皮肤是脊椎动物最大的器官,具有自我修护的能力,在抵御体外侵害过程中起着关键的作用[1-2]。创伤愈合是一个动态协调组织修复过程,包括止血、炎症、细胞增殖和重塑等一系列复杂的过程。在每个调控环节,干扰影响其创伤修复的主要因素包括机体免疫及巨噬细胞的活力、氧化应激产生过量过氧化物、血小板的激活、各种因子的释放等[3-4]。目前,常用的创伤修复药物主要有基因工程细胞因子、抗菌药物、酶清创制剂、中药制剂、抗氧化剂和皮质类固醇等[5]。然而,针对皮肤外伤的天然无瘢痕制剂及创伤患者专用型临床营养品却非常缺乏,急需开发有助于创伤愈合的天然活性物质。随着国内外对海洋来源活性肽功能的深入研究,已发现部分活性肽在皮肤组织创伤愈合方面具有较高的潜在应用价值,如海洋胶原蛋白肽[6]、鱼皮胶原蛋白肽[7]等,而贝类来源的活性肽物质目前尚未见在创伤愈合领域的报道。
马氏珠母贝Pinctada martensii又称合浦珠母贝,是中国南方沿海地区培育珍珠的主要贝种[8]。随着人工海水珍珠养殖面积的增多,马氏珠母贝产量日益递增,是南海主要的渔业资源之一。养殖珍珠贝主要用于珍珠的采集,珍珠贝肉作为珍珠副产品,其利用程度低,主要用作鲜食或简单加工成动物饲料,产值低且易对环境造成污染。因此,髙值化利用是提高马氏珍珠贝产业经济附加值的重要手段。珍珠贝外套膜作为实施人工“插核手术”的组织小片,具有较强的细胞增殖和组织修复能力,并最终形成珍珠袋,在珍珠形成和免疫抗炎中起着重要的作用[9]。研究表明,珍珠贝外套膜主要营养成分是蛋白质,主要为胶原蛋白[10]。胶原蛋白作为细胞外基质重要组成成分之一,对多种细胞的生理功能具有促进作用,并诱导多种生长因子的产生,有利于伤口愈合[11]。因此,本研究中采用酶法制备马氏珠母贝外套膜酶解产物(enzymatic hydrolysis from mantle of pearl oyster,EHM),并探讨了其促进小鼠皮肤软组织创伤愈合作用,以期为进一步利用马氏珠母贝外套膜开发皮肤组织创伤愈合功能的产品和深入研究其机制提供数据参考。
1 材料与方法
1.1 材料
试验用马氏珍珠贝肉于2018年6月采自广东省湛江市雷州市流沙养殖场,取其外套膜。
试验试剂:初元Ⅰ型产品(主要成分为小麦低聚肽、海洋鱼皮胶原低聚肽),购自江中集团股份有限公司;SPF 级KM小鼠体质量为(20±2) g,雄性,购于山东省济南朋悦实验动物繁育有限公司;中性蛋白酶(30 000 U/g) 购自广西南宁庞博生物工程有限公司;白介素-6(interleukin 6,IL-6)、白介素-10(interleukin 10,IL-10)、转化生长因子β(transforming growth factor-β,TGF-β)、碱性成纤维细胞生长因子(fibroblast growth factor 2,FGF-2)、表皮细胞生长因子(epidermal Growth Factor,EGF)、细胞生长周期素1(cyclin D1,CCND1)和羟脯氨酸测定试剂盒购自南京建成生物工程研究所。
试验仪器:Lynx 6000型高速冷冻离心机、多功能酶标仪购自Thermo公司;BSA224S-CW型万分之一电子天平购自赛多利斯科学仪器(北京)有限公司;FE28型pH计购自梅特勒-托利多仪器(上海)有限公司;DF-101T集热氏恒温加热磁力搅拌器购自上海精宏实验设备有限公司;FDU-1110型冷冻干燥机购自上海爱朗仪器有限公司;SW-CJ-2FD型双人超级操作台购自苏州净化设备有限公司。
1.2 方法
1.2.1 EHM制备工艺 参照前期团队的酶解工艺制备EHM[12]。采用凯氏定氮法[13]、甲醛滴定法[14]、双缩脲法[15]分别测定蛋白质含量、水解度和肽含量。
1.2.2 动物分组及创伤模型建立 将小鼠按体质量随机分为5组,每组20只,分别为阴性对照组(生理盐水,剂量为0.1 mL/10 g体质量)、初元Ⅰ型产品阳性对照组及EHM低(0.25 g/kg体质量)、中(0.5 g/kg体质量)、高(1 g/kg体质量)剂量给药组。将小鼠用10%水合氯醛腹腔麻醉后,背部剃毛、消毒,在小鼠背部剪去直径约0.8 cm的全层皮肤,造成全皮层创伤动物模型。小鼠均单独分笼饲养,每天灌胃给药,每两天对创伤口面观察、拍照,测量伤口大小,并记录结果。每组试验设3个平行。
1.2.3 愈合率及瘢痕缩小率 每隔两天用游标卡尺测量创面直径(cm)大小一次,计算创伤愈合率:
创伤愈合率=(第0天创面直径-第n天创
面直径)/第0天创面直径×100%。
第14天时测量瘢痕长度(cm),计算瘢痕缩小率:
瘢痕缩小率=(第0天创面直径-瘢痕长
度)/第0天创面直径×100%。
1.2.4 创面组织中生化指标测定 小鼠创面组织匀浆液制备参照赵秉江[16] 的方法,分装后保存于超低温冰箱(-80 ℃)中待测。IL-6、IL-10、TGF-β、FGF-2、EGF、CCND1和羟脯氨酸含量的检测均按照相应试剂盒说明书进行。
1.3 数据处理
试验数据采用平均值±标准差(mean±S.D.)表示,采用SPSS 20软件进行单因素方差分析,采用LSD法进行组间多重比较,显著性水平设为0.05,极显著性水平设为0.01。
2 结果与分析
2.1 EHM的基本性质
制备EHM时,选用中性蛋白酶酶解,加酶量为1000 U/g(原料)蛋白,温度为50 ℃,酶解时间为5 h,该条件下水解度为23.4%,制得的EHM冻干粉蛋白质含量为55.66 g/100 g,其中,肽含量占蛋白质含量的21.56%。
2.2 EHM对小鼠皮肤伤口愈合作用的影响
2.2.1 创面形态变化观察 从图1可见:造模后第2天,各试验组动物创面皆已结痂,伤口周围出现红肿,无液体渗出,伤口收缩均不明显;第4、6、8天时,各组创面结痂不断变硬,创伤周围表面不平整,创缘皮肤收缩明显,其中,各给药组结痂厚度优于对照组,创面完全封闭,呈现黑红色;第10天时,两对照组伤口结痂部分脱落,但瘢痕面积变化小,各给药组小鼠伤口明显缩小,并开始部分脱痂、缩痂明显;第12天时,各组皆已掉痂,愈合处开始长出毛发,各给药组进一步缩痂,中、高剂量组二次结痂;第14天时,阴性对照组多数伤口小于2 mm,阳性对照组和各剂量组伤口直径均小于1 mm,低剂量组呈现肉红色新生皮肤,新生肉色组织完整。总体来看,低、高剂量组较对照组愈合情况良好,无增生性瘢痕及瘢痕疙瘩生成。

图1 EHM对小鼠创面的影响
Fig.1 Effect of EHM on wound of mice
2.2.2 愈合率 从表1可见:造模后6 d,各EHM剂量组的伤口愈合率均在20%以上,高剂量组与阴性对照组相比,愈合率显著高出10%(P<0.05);造模后10 d,高剂量组伤口愈合率与阴性对照组有显著性差异(P<0.05);造模后14 d,低剂量组伤口愈合率较阴性对照组高出20%(P<0.05),愈合率达100%。
从图2可见:低、高剂量组瘢痕缩小率显著高于阴性对照组(P<0.05);各给药组在造模10 d内,创伤愈合速率均高于两个对照组,且高剂量组与阴性对照组有显著性差异(P<0.05);创伤愈合后期(14 d),各试验组创伤愈合速率逐渐趋于平衡,只有低剂量组效果突出。此外,除阴性对照外,其他组中多数小鼠均在造模后14 d左右达到愈合(伤口直径均小于1 mm),低剂量组、阳性对照组较其他组愈合率高;低、高剂量组和阳性对照组较阴性对照组和中剂量给药组瘢痕较小。
2.2.3 炎症因子测定 从图3可见:从第3天到第7天,除阳性对照组外,其余各组创伤皮肤组织中IL-6含量整体呈现逐渐减少的趋势,与阴性对照组相比,各给药组小鼠IL-6含量均无显著性差异(P>0.05)。这表明EHM对小鼠创伤皮肤组织中炎症因子IL-6的分泌无抑制效果。
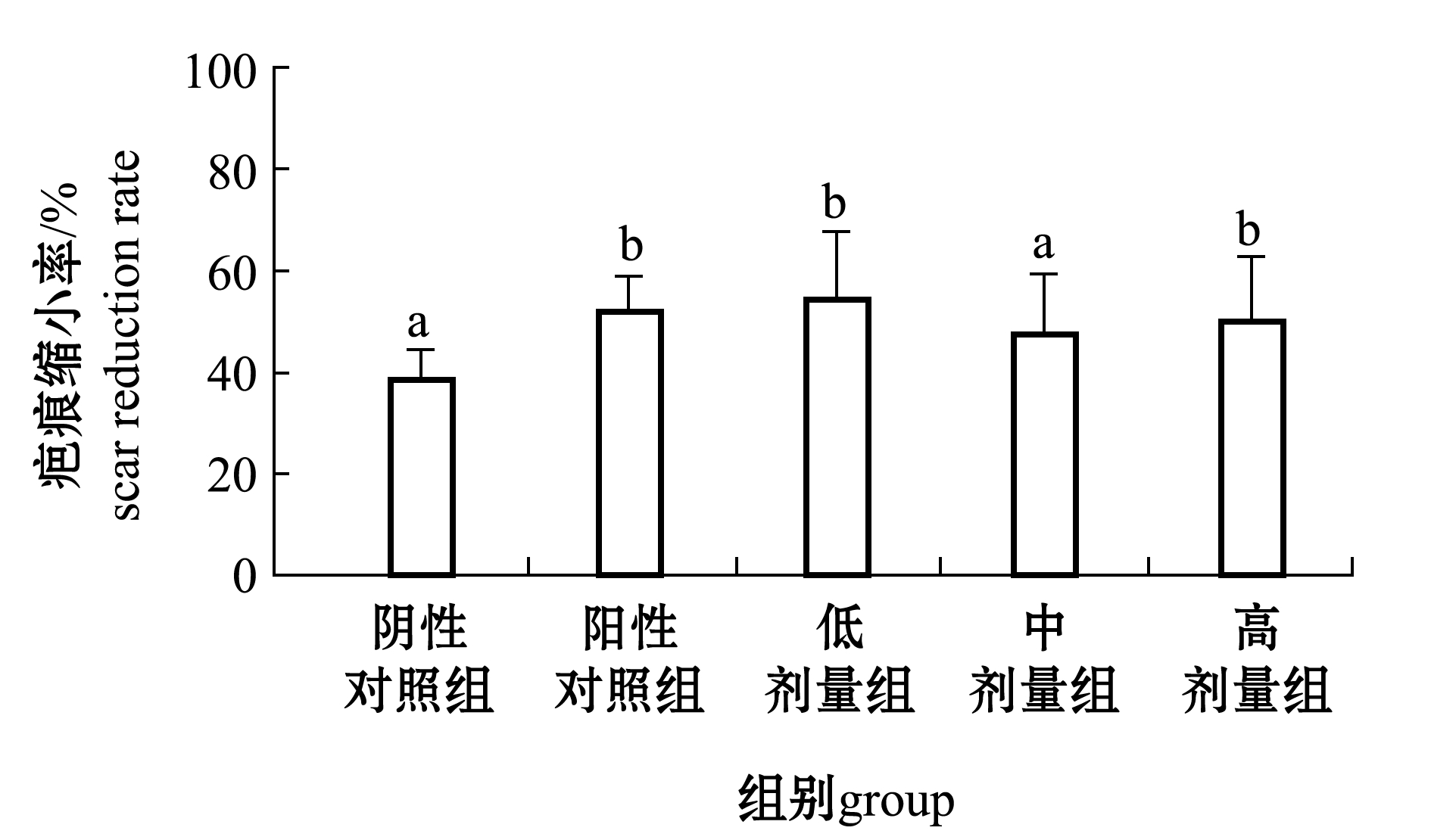
注:标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05)
Note: The means with different letters are significant differences at the 0.05 probability level, and the means with the same letters are not significant differences
图2 EHM对小鼠皮肤创伤瘢痕生成的影响
Fig.2 Effect of EHM on scar formation of skin wounds in mice
表1 EHM对小鼠皮肤创伤愈合的影响(愈合率)
Tab.1 Effect of EHM on skin wound healing in mice(healing rate) %

组别group0 d6 d10 d14 d 阴性对照negative control014.17±2.89b35.86 ±8.66b80.42±6.17c阳性对照positive control017.08±7.94ab32.50±4.33ab97.50±4.33ab低剂量crebanine-L024.58±12.01ab51.25±18.61ab100.00 ±0.00a中剂量crebanine-M021.25±3.31ab39.17±16.65ab85.00±7.60bc高剂量crebanine-H025.00±0.05a44.17±6.88a87.92±10.63abc
注:同列中标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异,下同(P>0.05)
Note:The means with different letters within the same column are significant differences at the 0.05 probability level, and the means with the same letters within the same column are not significant differences, et sequentia
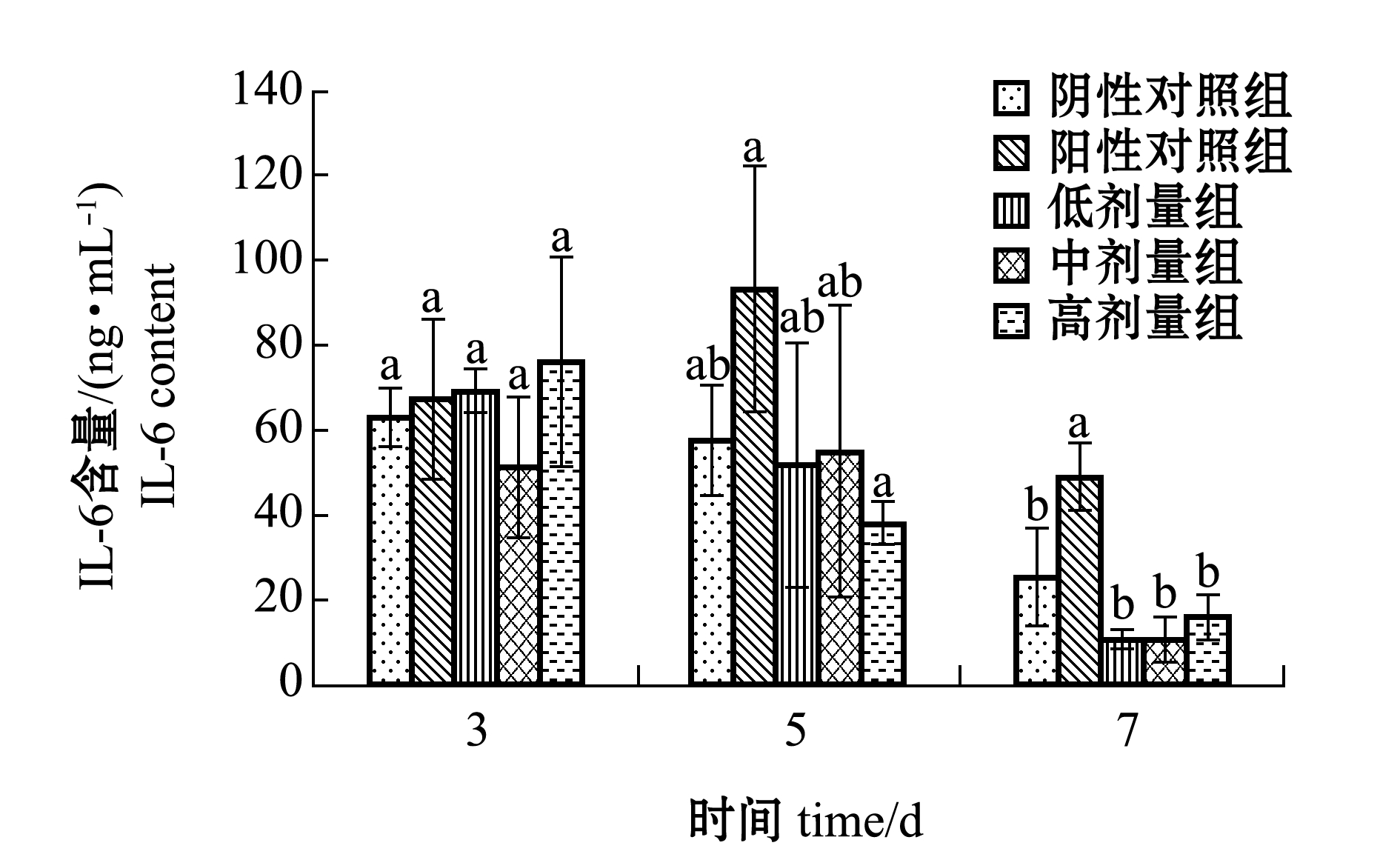
注:同一时间下,标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05)
Note: The means with different letters within the same time are significant differences at the 0.05 probability level, and the means with the same letters within the same time are not significant differences
图3 EHM对创伤皮肤组织中炎症因子IL-6的影响
Fig.3 Effect of EHM on inflammatory factor IL-6 in wound skin tissue
2.2.4 抗炎因子测定 从图4可见:各组小鼠创伤皮肤组织中IL-10含量随时间的延长而降低,最后趋于平衡;第3天时,阳性对照组和各给药组的IL-10含量极显著高于阴性对照组(P<0.01);第5天时,仅高剂量组IL-10含量极显著高于阴性对照组(P<0.01);第7天时,阳性对照组和中剂量组

注:** 表示与阴性对照组相比,有极显著性差异(P<0.01)
Note:** means very significantly different with the negative control group (P<0.01)
图4 EHM对创伤皮肤组织中抗炎因子IL-10的影响
Fig.4 Effect of EHM on anti-inflammatory factor IL-10 in wound skin tissue
能极显著地促进IL-10含量分泌(P<0.01)。从第3天起,给药组能够显著提高抗炎因子IL-10的含量,表明EHM具有抑制炎症的作用。
2.2.5 生长因子测定 从表2可见:低、中剂量组小鼠创伤皮肤组织中FGF-2含量均高于阴性对照组,但无显著性差异(P>0.05);与阴性对照组相比,各剂量的EHM均显著提高实验动物的TGF-β含量(P<0.05);中、高剂量组CCND1含量显著高于其他试验组(P<0.05);低、高剂量组EGF含量之间有显著性差异(P<0.05),两者均显著高于其他组(P<0.05)。
表2 EHM对创伤皮肤组织中生长因子的影响
Tab.2 Effect of EHM on growth factor in wound skin tissue ng/mL

组别 group 成纤维细胞生长因子2FGF-2转化生长因子βTGF-β细胞生长周期素CCND1表皮生长因子EGF阴性对照组negative control36.58 ±2.65ab0.44 ±0.04c1.67 ±0.50c131.37 ±59.51c阳性对照组positive control27.65 ±5.37b0.99 ±0.31ab1.85±0.28c180.70 ±50.41c低剂量组crebanine-L41.90 ±4.50a1.60 ±0.24ab4.36 ±2.26c3777.75 ±399.87a中剂量组crebanine-M41.28 ±6.80a1.91 ±0.04a6.30 ±2.37ab852.70 ±223.47c高剂量组crebanine-H35.27 ±4.15ab1.48 ±0.03ab8.21 ±0.41a1226.79 ±904.14b
2.2.6 羟脯氨酸含量测定 从表3可见:随着造模后时间的延长,各组小鼠创伤皮肤组织中胶原纤维均逐渐增多;造模后7 d,中、高剂量组羟脯氨酸含量显著高于阴性对照组(P<0.05);造模后14 d,各剂量组和阳性对照组羟脯氨酸均显著高于阴性对照组(P<0.05)。这表明,EHM具有促进胶原蛋白分泌、沉积及交联的作用。
表3 EHM对创伤皮肤组织中羟脯氨酸含量的影响
Tab.3 Effect of EHM on hydroxyproline content in wound skin tissueμg/mL
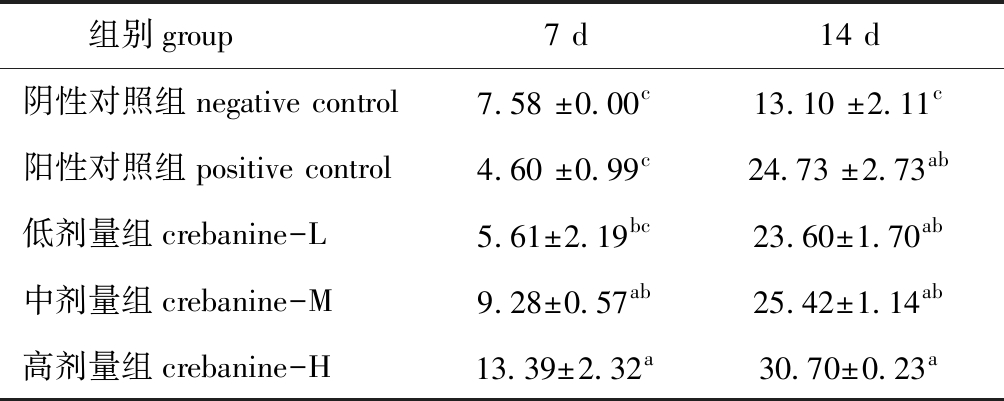
组别group7 d14 d阴性对照组negative control7.58 ±0.00c13.10 ±2.11c阳性对照组positive control4.60 ±0.99c24.73 ±2.73ab低剂量组crebanine-L5.61±2.19bc23.60±1.70ab中剂量组crebanine-M9.28±0.57ab25.42±1.14ab高剂量组crebanine-H13.39±2.32a30.70±0.23a
3 讨论
创伤愈合是一个动态协调组织修复过程,包括3个/4个重叠阶段:止血/炎症、细胞增殖和重塑。本研究中初步探讨了珍珠贝外套膜酶解产物对小鼠皮肤创伤愈合的影响,并以愈合阶段特征为切入点,测定各阶段试验动物皮肤组织相关生化指标,进一步探讨了其促进伤口愈合的可能作用机制,为开发术后临床营养支持和防治创伤愈合不良的产品提供重要科学依据。
3.1 EHM对炎症期的影响
Pastar等[17]研究表明,IL-6由M1型巨噬细胞分泌,属于促炎症因子;IL-10由M2型巨噬细胞分泌,属于抑制炎症因子。Du等[18]研究表明,第3、5天是炎症反应阶段,IL-6含量在损伤后1 d显著增加,在第3天时达到峰值,第7天时IL-6含量减低。本研究结果表明,不同剂量的EHM对创伤皮肤组织中IL-6含量的影响不显著;第3天时,各给药组创伤模型动物皮肤组织中IL-10含量极显著高于阴性对照组,同时,随时间延长含量降低,这与张慧等[19]报道的IL-10含量在第3天时达到高峰期,之后开始下降的研究结果一致。Du等[18]研究表明,通过减少促炎M1巨噬细胞极化和促进抗炎M2极化可减轻炎症。本研究中阳性对照组(初元Ⅰ型产品)配方中的海洋鱼皮胶原低聚肽[20]、酪蛋白磷酸肽[21]具有抑制炎症功效,与试验结果一致。同时,EHM有较高含量的蛋白及肽,这有利于EHM促进IL-10分泌,从而起到抑制炎症反应的作用。
3.2 EHM对细胞增殖期的影响
Gurtner等[22]研究表明,生长因子在创伤愈合和组织再生的复杂过程中,具有形成有利于皮肤伤口愈合过程理想环境的重要作用。Lu等[23]研究表明,FGF-2对内皮细胞、成纤维细胞、平滑肌细胞等多种细胞有促进 DNA 合成和促细胞分裂作用。Demidova-Rice等[24]研究表明,由血小板、巨噬细胞、成纤维细胞等分泌的TGF-β属于非活性状态下的TGF-β,在体内酸性环境下TGF-β因子可存在于骨折附近和正在愈合的伤口处,促进成纤维细胞等细胞的生长,促进胞外基质(ECM)如胶原蛋白、纤粘连蛋白的表达和抑制ECM的降解,对细胞的形态发生、增殖和分化过程起着重要作用,有利于胚胎发育和细胞修复。CCND1主要功能是促进细胞增殖[25]。Li等[26]研究表明,EGF促进创面愈合最主要的作用是促进创面组织的增殖和分化,增殖和分化形成的新细胞代替衰老和已经死亡的细胞。由此可推测,EHM促进创面愈合的过程中,通过加速细胞因子TGF-β、EGF的分泌增加胞外基质沉积,促进新血管形成和表皮细胞生长。同时,He等[27]研究表明,EHM也通过加速细胞周期调控蛋白CCND1的表达,促进细胞周期向分裂期转化,从而加速细胞的有丝分裂,以实现同愈合率结果一致的创伤愈合。本试验中,阳性对照组(初元Ⅰ型产品)配方中的海洋鱼皮胶原低聚肽、大豆低聚肽、酪蛋白磷酸肽均为低聚肽混合物,具有独特愈合功效,从愈合率结果看,阳性对照组在造模后10~14 d(组织重塑期)作用效果明显,而这时期胶原蛋白起主要作用[16],但EHM低、高剂量组在整个创伤愈合过程则更具优势。
3.3 EHM对重塑期的影响
Zhang等[28]研究表明,创伤愈合过程的最后阶段称为重塑,由于迁移和凋亡,观察到受伤区域的细胞含量减少。重塑是一个动态阶段,胶原蛋白与其他胶原蛋白和蛋白质分子形成紧密的交联,可通过测定羟脯氨酸含量来反映胶原蛋白含量的变化情况。本试验中,第7天时,EHM中、高剂量组小鼠创伤皮肤组织中羟脯氨酸含量显著高于其他组,第14天时,各给药组羟脯氨酸含量较阴性对照组显著提高,但羟脯氨酸含量与FGF-2含量的研究结果未能高度一致。除了与动物个体差异性、操作误差和试剂盒灵敏性等问题相关外,还有可能是其他途径促进了胶原蛋白的分泌、交联。庞广昌等[29]研究表明,在创伤愈合的炎症阶段结束时,巨噬细胞发展成抗炎、促纤维化的M2表型并分泌TGF-β、白细胞介素和肿瘤坏死因子,这些生长因子将刺激增生阶段的开始,其中,将发生纤维组织形成、基质沉积、血管生成和再上皮化过程。
综上所述,EHM具有促进生长因子分泌及胶原蛋白的沉积与交联,从而加快小鼠软组织开放性创伤愈合,对浅表瘢痕增生具有一定的抑制作用。本研究结果可为进一步研究EHM促进伤口愈合作用机制提供数据基础。
[1] Theoret C.Tissue engineering in wound repair:the three“R”s—Repair,replace,regenerate[J].Veterinary Surgery,2009,38(8):905-913.
[2] Hassan W U,Greiser U,Wang W.Role of adipose-derived stem cells in wound healing[J].Wound Repair and Regeneration,2014,22(3):313-325.
[3] Maxson S,Lopez E A,Yoo D,et al.Concise review:role of mesenchymal stem cells in wound repair[J].Stem Cells Translational Medicine,2012,1(2):142-149.
[4] Jee C H,Eom N Y,Jang H M,et al.Effect of autologous platelet-rich plasma application on cutaneous wound healing in dogs[J].Journal of Veterinary Science,2016,17(1):79-87.
[5] 李晓康,王舒,于杨,等.皮肤创伤修复研究进展[J].中国中西医结合皮肤性病学杂志,2016,15(1):62-65.
[6] 梁锐,张召锋,赵明,等.海洋胶原肽对剖宫产大鼠伤口愈合促进作用[J].中国公共卫生,2010,26(9):1144-1145.
[7] Hu Zhang,Yang Ping,Zhou Chunxia,et al.Marine collagen peptides from the skin of Nile tilapia (Oreochromis niloticus):characterization and wound healing evaluation[J].Marine Drugs,2017,15(4):102.
[8] 张磊,王锦旭,杨贤庆,等.合浦珠母贝糖胺聚糖泡腾片制备工艺优化及其质量分析[J].大连海洋大学学报,2018,33(5):644-650.
[9] 蒙钊美,李有宁,邢孔武.珍珠养殖理论与技术[M].北京:科学出版社,1996:49-53.
[10] 张雪莹.珍珠贝外套膜胶原蛋白肽的抗氧化作用及其对MCT3T-E1成骨细胞的保护作用研究[D].海口:海南大学,2015:21.
[11] 朱伟,张晓莉,刘洋,等.鱼鳞胶原蛋白对免疫低下小鼠皮肤伤口愈合的影响[J].哈尔滨医科大学学报,2014,48(3):177-181.
[12] 左光扬,章超桦,高加龙,等.企鹅珍珠贝肉酶解产物的制备及其醒酒作用的初步研究[J].食品工业科技,2012,33(15):145-148,152.
[13] 中华人民共和国卫生部.GB/T 5009.5-2010食品中蛋白质的测定[S].北京:中国标准出版社,2010:1-3.
[14] 孙瑞坤,章超桦,曾少葵,等.方格星虫酶解工艺优化及酶解物免疫活性[J].广东海洋大学学报,2018,38(3):54-61.
[15] 汪志华,王毅梅,蔡广霞,等.大米肽含量的快速测定方法[J].食品科学,2011,32(12):169-173.
[16] 赵秉江.黄芪多糖促进皮肤伤口愈合的作用及其相关机制的研究[D].兰州:兰州大学,2017:16.
[17] Pastar I,Stojadinovic O,Yin N C,et al.Epithelialization in wound healing:a comprehensive review[J].Advances in Wound Care,2014,3(7):445-464.
[18] Du Yu,Ren Peng,Wang Qi,et al.Cannabinoid 2 receptor attenuates inflammation during skin wound healing by inhibiting M1 macrophages rather than activating M2 macrophages[J].Journal of Inflammation,2018,15:25.
[19] 张慧,宋旭东,朱少华,等.小鼠皮肤切创IL-10和IL-4的表达及其与损伤时间关系[J].中国法医学杂志,2004,19(5):280-283.
[20] Matejuk A.Skin immunity[J].Archivum Immunologiaeet Therapiae Experimentalis,2018,66(1):45-54.
[21] 李承威,马淑霞,王春敏,等.胶原蛋白肽增强小鼠免疫力的实验研究[J].中国微生态学杂志,2013,25(4):387-389.
[22] Gurtner G C,Werner S,BarrandonY,et al.Wound repair and regeneration[J].Nature,2008,453(7193):314-321.
[23] Lu Lu,Wang Dongtao,Shi Ying,et al.Astragalus polysaccharide improves muscle atrophy from dexamethasone- and peroxide-induced injury in vitro[J].International Journal of Biological Macromolecules,2013,61:7-16.
[24] Demidova-Rice T N,Hamblin M R,HermanI M.Acute and impaired wound healing:pathophysiology and current methods for drug delivery,part 2:role of growth factors in normal and pathological woundhealing:therapeutic potential and methods of delivery[J].Advances in Skin & Wound Care,2012,25(8):349-370.
[25] Qin Qiaojing,Niu Jianying,Wang Zhaoxia,et al.Astragalus membranaceus inhibits inflammation via phospho-P38 Mitogen-Activated Protein Kinase (MAPK) and Nuclear Factor (NF)-κB pathways in advanced glycation end product-stimulated macrophages[J].International Journal of Molecular Sciences,2012,13(7):8379-8387.
[26] Li Lake,Hai Jie,Li Zhiqiang,et al.Resveratrol modulates autophagy and NF-κB activity in a murine model for treating non-alcoholic fatty liver disease[J].Food and Chemical Toxicology,2013,63:166-173.
[27] He Xiaojuan,Niu Xuyan,Li Jian,et al.Immunomodulatory activities of five clinically used Chinese herbal polysaccharides[J].Journal of Experimental and Integrative Medicine,2012,2(1):15-27.
[28] Zhang Yingwen,Wu Chaoyan,Cheng J T.Merit of Astragalus polysaccharide in the improvement of early diabetic nephropathy with an effect on mRNA expressions of NF-κB and IκB in renal cortex of streptozotoxin-induced diabetic rats[J].Journal of Ethnopharmacology,2007,114(3):387-392.
[29] 庞广昌,陈庆森,胡志和.乳在哺乳动物进化中的作用[J].食品科学,2002,23(10):146-152.