刺参 Apostichopus japonicus作为北方沿海重要的养殖物种之一,具有极高的营养价值和经济价值[1-3]。然而,随着养殖规模的扩大,其病害问题日益严重[4],但目前仍未见关于刺参详实的致病机制和预防治疗方案的研究报道。在刺参整个生长周期中,病原微生物能够直接进入刺参体腔,其体腔细胞和体壁组织在抵御病原体侵袭中发挥着重要的作用,因此,其免疫功能研究一直是海洋棘皮动物的研究热点。
流式细胞术(Flow cytometry,FCM)具有灵敏度高、特异性强、分析速度快等优点[5],可实现对目的细胞的分选提取[6-8]。随着对水产动物研究的深入,国外学者利用FCM将美洲牡蛎Crassostrea virginica的血细胞分为透明细胞、中间型细胞和颗粒细胞3类[9-10]。在国内,石芳芳等[11]采用FCM技术对栉孔扇贝Chlamys farreri和海湾扇贝Argopecten irradias血细胞吞噬活性进行了测定,并建立了相对完善的试验方法。同时,免疫细胞间相互识别的物质基础是细胞膜分子,而白细胞分化抗原(Leukocyte differentiation antigen)是一类重要的免疫细胞膜分子[12],在免疫应答过程中具有重要意义。目前,有关水产动物细胞分化簇(Cluster differentiation, CD)方面的研究较少,尤其是对无脊椎动物的相关研究方面,仅见Lin等[13]研究紫海胆Anthocidaris crassispina体腔细胞时,采用流式细胞仪测定海胆体腔细胞几种CD的表达情况。
本研究中,首次基于细胞流式技术和免疫组化方法,探究了刺参体腔细胞几种表面抗原的表达情况,为研究低等无脊椎水产动物免疫功能细胞的类型和具体功能提出了一条新的途径,也为探究刺参天然免疫应答机制提供了数据参考。
1 材料与方法
1.1 材料
试验用刺参购于大连棒棰岛海产企业集团有限公司,体质量为(160±10)g,体长为15 cm左右。全价配合饲料购于辽宁省海洋水产科学研究院。将刺参以15头/m2的密度暂养于水槽内,水温为(18±1)℃,每日定时换水一次,换水量为1/2水槽,每日投饵一次。
抗凝剂:30 mmol/L EDTA,30 g/L NaCl,50 mmol/L Tris-HCl,pH 7.6。
CD荧光标记抗体:均为抗人CD单克隆抗体,购自北京中杉金桥生物技术有限公司。PE激发光波长为488 nm,发射光峰值为575 nm,检测橙红荧光标记的CD7;PITC 激发光波长为488 nm,发射光峰值为525 nm,检测绿色荧光标记的CD3、CD4、CD8、CD11b、CD14、CD38。
免疫组化试剂:PBS(pH 7.4)、柠檬酸盐抗原修复液、胰酶消化液、内源性生物素阻断试剂(IHC.Biotin Block Kit)、胎牛血清封闭液、鼠抗人CD7和CD14单克隆抗体(一抗),以及快捷型酶标羊抗鼠IgG聚合物(二抗),试验使用所有免疫组化试剂均购自福州迈新生物技术开发有限公司。
1.2 方法
1.2.1 刺参体腔细胞的分离 用75%的乙醇擦拭刺参体表后,剪去体后端挤出体腔液,加入2倍体积4 ℃预冷的抗凝剂后,以60目无菌纱网过滤并除去其他组织。将微孔滤膜(5 μm, Whatman)装入聚碳酸酯滤器(25 mm,德国赛多利斯),光面向上。用注射器抽取刺参体腔液样品缓慢通过滤器,收集滤液,再重复过滤1次后收集流出液体,同时用无菌海水冲洗滤膜上的细胞并收集细胞,于显微镜下观察。
1.2.2 刺参体腔细胞CD的测定 用膜分离法可得到两类细胞,分别为直径大于或小于5 μm的刺参体腔细胞,调节细胞密度至1×106cells/mL。选择CD3、CD4、CD7、CD8、CD11b、CD14、CD38进行CD荧光抗体标记,流式细胞仪上样进行测定。若流式细胞仪显示荧光强度大于2,则判定该信号为阳性。
1.2.3 刺参体壁内层、体腔细胞CD7、CD14免疫组化试验 根据细胞流式仪测定两种大小的体腔细胞CD的阳性结果,选择其中表达差异明显的CD7和CD14进行免疫组织化学测定。步骤如下:
(1)样品固定。以上述相同方法清理刺参体表后剖开外壁,切下体壁内层,将组织修成约1 mm3的小块。通过膜分离法得到的两种刺参体腔细胞,以2000 r/min离心5 min,收集沉淀。将体壁组织和收集的细胞,放入固定液中固定24 h 以上。
(2)刺参体壁组织石蜡切片的制作。按照常规方法进行透明、脱水、浸蜡、包埋、切片,并贴于载玻片上于60 ℃下过夜。
(3)用PBS冲洗切片2次后,置于3% H2O2中温室孵育10 min,以消除内源性过氧化物酶活性。
(4)暴露抗原。将一组切片放入柠檬酸盐抗原修复液中,进行CD7标记;另一组切片上滴加胰酶消化液以暴露抗原,进行CD14标记。
(5)滴加阻断剂室温孵育10 min,阻断内源性生物素后,用PBS冲洗3次。以5%~6%羊血清封闭,室温下孵育10 min。
(6)滴加一抗工作液,于4 ℃下过夜,用PBS冲洗3次,2 min/次;再滴加快捷型酶标羊抗鼠IgG聚合物,室温下孵育15 min,用PBS再冲洗3次,2 min/次。
(7)滴加显色剂DAB,显微镜下观察,显色后用蒸馏水冲洗。
2 结果与分析
2.1 膜分离法分离刺参体腔细胞
采用5 μm微孔滤膜过滤体腔细胞,可分离到较纯的直径小于5 μm细胞和大于5 μm细胞两部分。滤液中的分离细胞纯度较高,为比较均一的直径小于5 μm细胞,而膜上沉淀中为直径大于滤膜孔径的细胞和未能通过滤膜的小细胞混合物。由此认为,滤膜分离法可较好地筛选出直径不同的细胞,但并不能完全将各类细胞相互分离。
经2次膜分离以后,收集滤液和膜上沉淀洗脱液并在镜下观察,滤出液中含较纯的直径小于5 μm的细胞,细胞纯度为96%;膜上的洗脱液含大小不等的体腔细胞(图1)。
2.2 流式细胞仪测定CD结果
由于试验中使用的是人类CD抗原抗体,目前人类CD与刺参CD是否同质性不得而知,本研究中以下称为“CD类似物”。两种直径大小的细胞分别通过流式细胞仪,检测结果显示:直径大于5 μm的体腔细胞CD7、CD14类似物为阳性,CD3、CD4、CD11b、CD38类似物均为阴性;直径小于5 μm的体腔细胞CD7、CD14类似物为阳性,CD3、CD4、CD11b、CD38类似物均为阴性。流式细胞仪测定荧光强度数据见表1。
2.3 刺参体壁结缔组织免疫组化染色
根据细胞流式仪测定两种大小的体腔细胞CD类似物的阳性结果,选择其中表达差异明显的CD7和CD14类似物进行免疫组织化学测定。从图2可见:刺参体壁结缔组织经CD7、CD14类似物免疫组化染色后,可见组织内有深褐色的细胞存在,分布在结缔组织细胞间隙中,从形态上看与体腔细胞基本相同;CD14类似物比CD7类似物颜色深,其中,图2-A和图2-C为同一视野不同放大倍数,可见结缔组织中有管腔样结构,且CD14免疫组化着色细胞位于该结构的下层;CD7免疫组化着色细胞散在分布于结缔组织中(图2-B);图2-D显示位于体腔内壁上皮细胞层外的分泌腺体。
表1 刺参体腔细胞CD类似物流式细胞仪荧光强度
Tab.1 Fluorescence intensity of CD analogs on coelomocytes of sea cucumber by flow cytometry(FCM)

细胞直径diameter/μmCD3CD4CD7CD8CD11bCD14CD38>50.30±0.101.60±0.312.65±0.141.49±1.010.44±0.253.30±0.141.19±0.15<50.25±0.150.23±0.176.10±1.161.80±1.570.09±0.0466.00±6.940.78±0.46
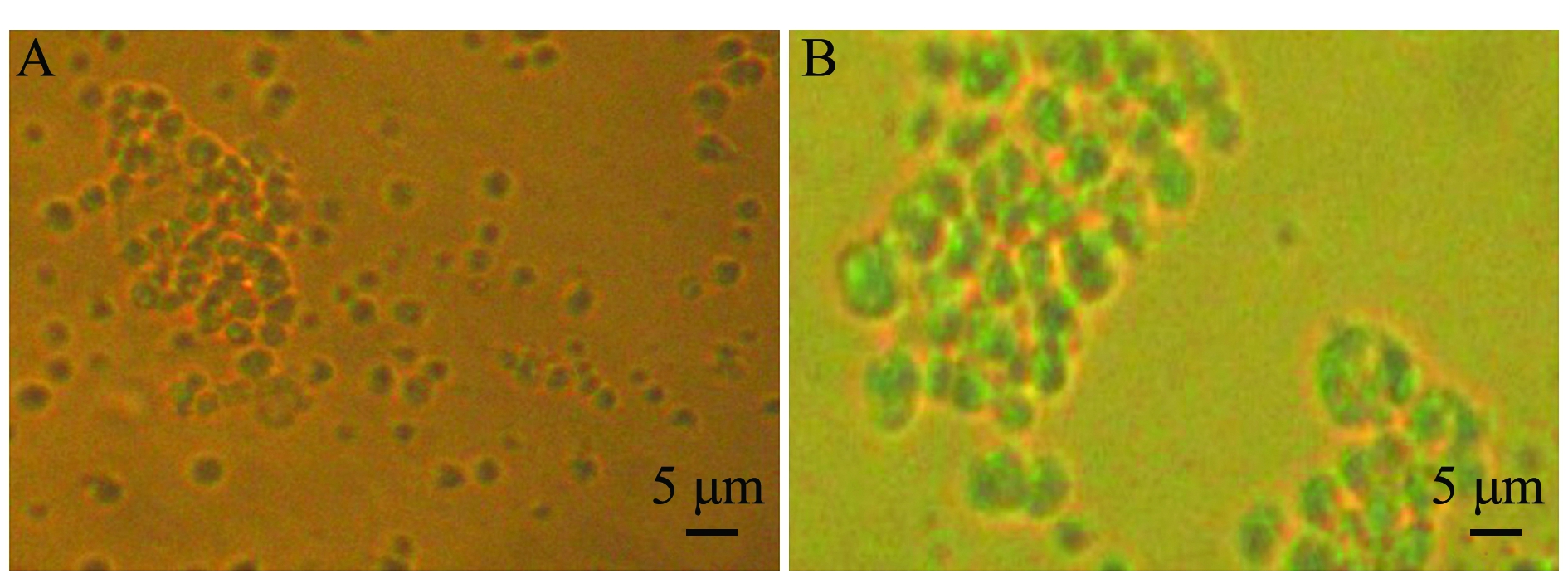
注:A为直径<5 μm的细胞; B为直径>5 μm的细胞
Note: A,cells less than 5 μm in diameter; B,cells larger than 5 μm in diameter
图1 膜分离刺参体腔细胞
Fig.1 Separated coelomocytes of sea cucumber by microporous membrane separation

注:A为体壁结缔组织CD14免疫组化染色; B为体壁结缔组织CD7免疫组化染色; C为结缔组织内管状结构,箭头示CD14类似物阳性细胞; D为体腔内壁腺体组织
Note:A, immunohistochemical staining of CD14 in body wall connective tissue; B, immunohistochemical staining of CD7 in body wall connective tissue; C,tubular structures within the connective tissue, the arrow showing CD14 positive cells; D,glandular tissues in the inner soma
图2 刺参体壁结缔组织免疫组化染色
Fig.2 Immunohistochemical assay of connective tissues in body walls of sea cucumber
2.4 刺参体腔细胞的免疫组化染色
鉴于流式细胞仪对几种CD的检测结果,为进一步证实在刺参体腔细胞上的CD类似物表达情况,以及组织中免疫细胞定位的情况,本研究中对刺参体腔细胞、体壁结缔组织进行了CD14及CD7类似物免疫组化研究,以期为进一步确定刺参免疫细胞的分类提供更多理论依据。经过滤膜分离得到大小两类细胞免疫组化染色后,直径小于5 μm细胞样品中,CD14(图3-A)和CD7(图3-C)组化染色标本可见有较多的细胞存在胞质染成深褐色的现象,CD14类似物染色标本中着色比CD7类似物深;直径大于5 μm细胞样品中,CD14类似物(图3-B)和CD7类似物(图3-D)均着色微弱。
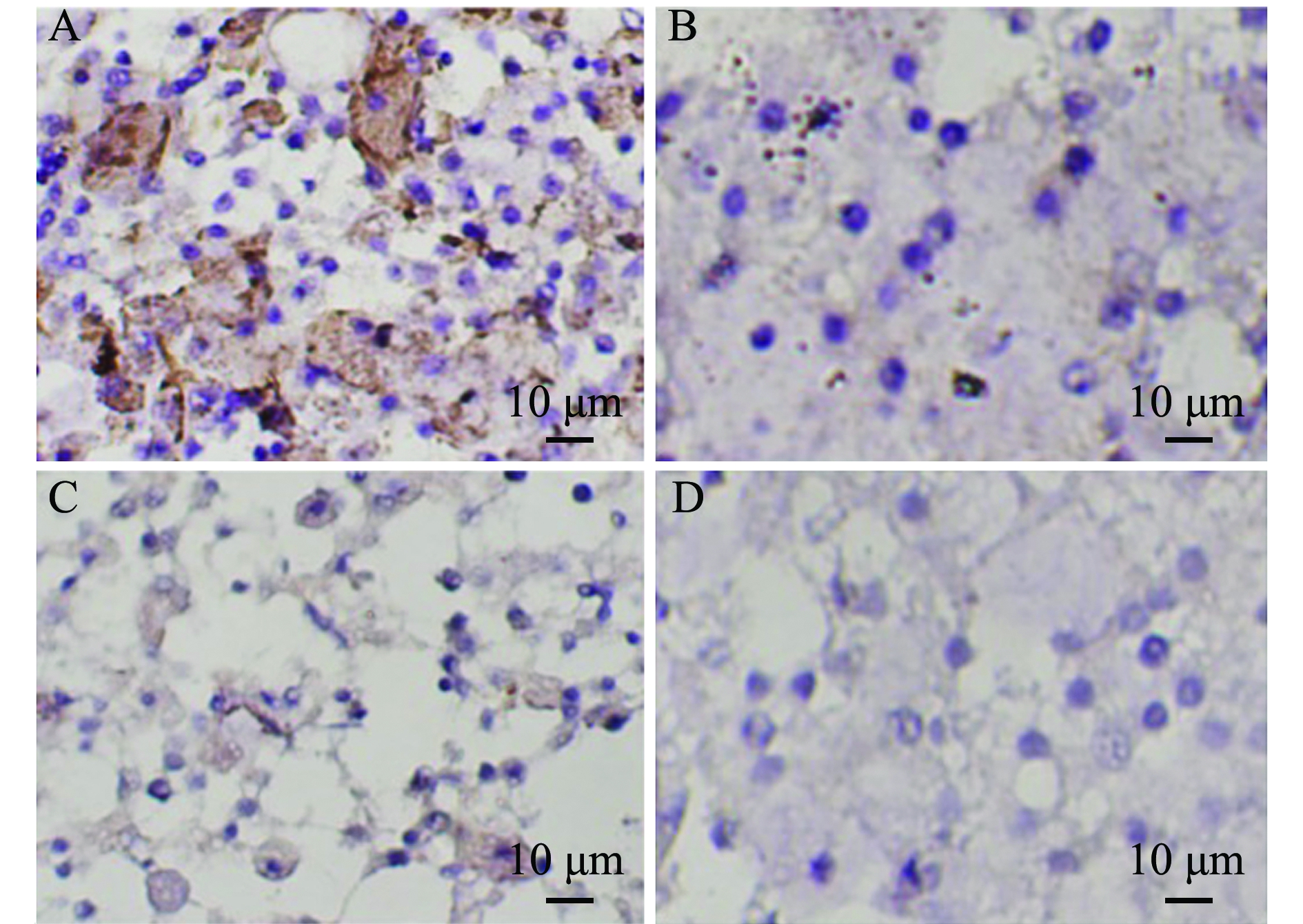
注:A为直径<5 μm体腔细胞CD14染色;B为直径>5 μm体腔细胞CD14染色;C为直径<5 μm体腔细胞CD7染色;D为直径>5 μm体腔细胞CD7染色
Note: A,staining of CD14 on coelomocytes with diameter of <5 μm; B,staining of CD14 on coelomocytes with diameter of >5 μm; C,staining of CD7 on coelomocytes with diameter of<5 μm; D, staining of CD7 on coelomocytes with diameter of >5 μm
图3 刺参体腔细胞免疫组化染色
Fig.3 Immunohistochemical assay of coelomocytes of sea cucumber
3 讨论
3.1 膜分离法分离体腔细胞
膜分离技术是一种常温下无相变的高效、节能的分离、提纯、浓缩新技术。其基本原理是利用天然或人工合成的具有选择透过性的薄膜,以外界能量或化学位差为推动力,对双组分或多组分体系进行分离、分级、提纯或富集。膜分离技术的特点包括:(1)膜分离过程不发生相变化,与有相变化的分离法和其他分离法相比,能耗要低;(2)膜分离过程是在常温下进行,因而特别适用于对热敏感的生物颗粒;(3)由于只是用压力作为膜分离的推动力,故分离装置简单、操作容易,易自控、维修[13]。本试验中采用5 μm微孔滤膜过滤体腔细胞,可分离到小于或大于5 μm细胞,滤液中直径小于5 μm细胞的纯度较高,而膜上沉淀中获得的为大直径细胞。由此认为,用滤膜分离法可较好地筛选出直径不同的细胞,今后还需进一步分析刺参体腔细胞的特点,以探索更完善的分离方法。
3.2 刺参体腔细胞的免疫功能
流式细胞术可根据细胞核物质和细胞质成分不同、表面标记不同等指标对细胞样品进行分类、分拣等研究[6-7, 9],在水产动物中的应用主要是通过DNA检测不同倍性的生殖细胞及血细胞类型[14]。已有学者采用流式细胞仪结合单克隆抗体(McAb)检测紫海胆的体腔细胞CD类型[13],但对于刺参体腔细胞CD类型的研究尚未见报道。本研究中参考已报道的方法,首次检测了刺参体腔细胞几种CD的表达情况,旨在通过CD的不同表达情况分析刺参体腔细胞的免疫学功能。
CD7主要表达于T细胞和NK细胞表面,与天然免疫细胞的活化密切相关[15-16]。本试验中分离的刺参体腔细胞中直径小于5 μm的体腔细胞CD7类似物表达阳性,高度提示小细胞中有类NK细胞存在,并很可能具有NK细胞的功能。CD14是LPS复合物受体,主要在粒细胞、巨噬细胞和树突状细胞表面表达,其表达细胞可与细菌脂多糖结合,行使细胞吞噬功能[17-18]。本研究中发现,CD14类似物同样主要表达于直径小于5 μm的体腔细胞表面,且这两种CD类似物在免疫组化中被证实在直径小于5 μm的体腔细胞表面有强阳性表达,因此,可以认为此种细胞是刺参体腔细胞中与革兰氏阴性细菌结合的主要类型,其行使重要免疫功能的特性。目前对无脊椎动物免疫细胞CD的研究较少,但已有文献指出,CD表达与机体和细胞的状态有关[19-21]。Lin等[13]研究认为,CD14+、CD56+、CD158+在紫海胆的红色桑椹细胞和阿米巴样吞噬细胞中有不同程度的表达,提示紫海胆体腔细胞的某些类型可能具有人类NK细胞相同的功能。当前有关无脊椎动物免疫细胞的分类还无详细的研究报道,对可能行使免疫功能的细胞称呼也主要以形态特征为主。就目前研究结果可初步认为,刺参行使免疫功能的细胞主要存在于体腔细胞中,免疫防御方式包括与NK细胞和巨噬细胞类似的功能,直径小于5 μm的体腔细胞可能更为突出。
细胞流式仪检测结果显示,小细胞样品CD7和CD14表达明显高于大细胞,结合免疫组化结果看,小细胞上的染色明显比大细胞深,与细胞流式仪检测结果相符。
3.3 刺参体壁组织细胞的类型及功能
本试验中刺参体壁结缔组织经过CD7、CD14免疫组化染色后,可见结缔组织细胞间隙的一些形态与体腔细胞相似的细胞周围显示为深褐色,提示体腔液中的这些细胞在体壁结缔组织存在。两种直径细胞经过免疫组化染色后,小细胞的CD7、CD14类似物免疫组化染色均比大细胞明显,且CD14类似物比CD7类似物染色更强烈,表示小细胞有脂多糖结合蛋白和NK细胞活化蛋白。Fyhn等[22]和常亚青等[23]在研究中描述刺参体腔细胞有淋巴细胞和吞噬细胞,大小为4~5 μm,无色桑椹细胞、纺锤细胞和血细胞,大小为6~20 μm。据此,本研究中选择以直径5 μm为分离界限,研究结果也显示,直径小于5 μm的体腔细胞更有可能是免疫功能细胞。
本试验中,观察到刺参体壁结缔组织中存在小管样结构,并在其周围富集CD染色的细胞。聂竹兰等[24]对刺参体壁组织的化学研究结果认为,碱性磷酸酶和酸性磷酸酶在结缔组织层管状结构的上皮基部和结缔组织层管状结构的立方上皮内。该部位与本研究中观察到的管状结构非常相似,而碱性磷酸酶和酸性磷酸酶是许多具有吞噬功能的细胞内溶酶体酶,由此可以认为,该部位可能是免疫功能细胞存在的部位。文献还指出,刺参体壁内的这两种酶主要存在于结缔组织层管状结构处,该结构与刺参水管系统相通,而水管系统通过石管与外界相通,即该管状结构与外界海水环境有直接的联系。组织化学结果显示的酸性磷酸酶存在于管状结构上皮细胞内,碱性磷酸酶存在于上皮细胞基部,说明该上皮细胞具有吸收和转运外来物质和代谢物的功能[24]。从另一角度来说,该部位与外界相通,免疫功能细胞的存在为抵御外来病原体的入侵提供了保护屏障。由于这种结构存在于刺参体壁结缔组织中,如确实是机体免疫防御的屏障,那么在免疫防御的过程中很有可能伴随不同程度地组织免疫损伤,这也可能与化皮症状的发生密切相关。
[1] 包鹏云,李璐瑶,陈炜,等.饲料中添加混合益生菌对幼参生长、消化酶活力和体壁营养组成的影响[J].大连海洋大学学报,2018,33(1):52-56.
[2] 武明欣,王雅平,李培玉,等.饲料中添加木聚糖酶对刺参幼参生长、消化和体腔液酶活力的影响[J].大连海洋大学学报,2018,33(3):329-335.
[3] 陈庭家,田景玉,丁月,等.刺参体腔细胞类型及其死亡率与温度的关系[J].大连工业大学学报,2016,35(6):407-410.
[4] 张峰,张莉,倪慧,等.仿刺参体腔细胞CD35的化学发光免疫检测[J].大连海洋大学学报,2011,26(2):176-179.
[5] Ashton-Alcox K A,Ford S E.Variability in molluscan hemocytes:a flow cytometric study[J].Tissue and Cell,1998,30(2):195-204.
[6] 尹洪滨,孙中武,孙大江,等.俄罗斯鲟的细胞遗传学分析[J].水产学报,2006,30(2):181-184.
[7] 张之晟,董成稳,赵俊,等.基于DNA含量的复合鲫倍性分析[J].华南师范大学学报:自然科学版,2006(1):99-103.
[8] 汪开毓,耿毅,黄小丽.用流式细胞术检测喹乙醇诱导的鲤肝细胞凋亡[J].中国水产科学,2005,12(5):648-651.
[9] Fisher W S.Flow cytometry:a tool for cell research in bivalve pathology[M]//Fisher W S.Disease Processes in Marine Bivalve Molluscs.Bethesda:American Fisheries Society,1988.
[10] Goedken M,De Guise S.Flow cytometry as a tool to quantify oyster defence mechanisms[J].Fish & Shellfish Immunology,2004,16(4):539-552.
[11] 石芳芳,李成华,宋林生,等.用流式细胞仪测定扇贝血细胞吞噬活性[J].生物技术通报,2006(S1):430-433.
[12] 崔巍,朱陵群,赵明镜,等.淋巴细胞免疫表型检测及其统计学分析[J].中国免疫学杂志,2001,17(10):538-540.
[13] Lin Wenyu,Zhang Haiyan,Beck G.Phylogeny of natural cytotoxicity:cytotoxic activity of coelomocytes of the purple sea urchin,Arbacia punctulata[J].Journal of Experimental Zoology,2001,290(7):741-750.
[14] 沙爱龙.流式细胞仪在贝类研究中的应用[J].南方水产科学,2007,3(6):71-74.
[15] 张东华,李登举,冉丹,等.外周血干细胞移植前后淋巴细胞免疫表型变化[J].中国现代医学杂志,2003,13(24):44-46.
[16] Milush J M,Long B R,Snyder-Cappione J E,et al.Functionally distinct subsets of human NK cells and monocyte/DC-like cells identified by coexpression of CD56,CD7,and CD4[J].Blood,2009,114(23):4823-4831.
[17] Zanoni I,Granucci F.Role of CD14 in host protection against infections and in metabolism regulation[J].Frontiers in Cellular and Infection Microbiology,2013,3:32.
[18] Kim D,Kim J Y.Anti-CD14 antibody reduces LPS responsiveness via TLR4 internalization in human monocytes[J].Molecular Immunology,2014,57(2):210-215.
[19] 童裳亮.海洋动物的细胞培养与应用[J].生物工程进展,1994,14(6):47-48.
[20] 顾立刚.医学免疫学与微生物学[M].北京:中国中医药出版社,2004.
[21] Huang Y S,Rousseau K,Le Belle N,et al.Opposite effects of insulin-like growth factors(IGFs) on gonadotropin(GtH-II) and growth hormone(GH) production by primary culture of European eel(Anguilla anguilla) pituitary cells[J].Aquaculture,1999,177(1-4):73-83.
[22] Fyhn U E H,Costlow J D.Tissue cultures of cirripeds[J].The Biological Bulletin,1975,149(2):316-330.
[23] 常亚青,丁君,宋坚,等.海参、海胆生物学研究与养殖[M].北京:海洋出版社,2004.
[24] 聂竹兰,李霞,辛涛.仿刺参体壁的组织学和组织化学[J].大连海洋大学学报,2007,22(3):184-187.