海洋无脊椎动物尤其是海洋贝类处于复杂的水体环境中,为避免氧化损伤引起机体的疾病及伤亡,进化出了更有效的抗氧化防御系统应对气候变化及病源菌的感染[1-3]。像高等动物一样,海洋贝类拥有一套抗氧化酶系统清除各种自由基,维持机体内环境平衡。在这些酶中,硫氧还蛋白过氧化物酶(Thioredoxin Peroxidase,TPX)通常也被称为过氧化物还原酶(Peroxiredoxins,PRX),是一种重要的硫醇特异性抗氧化蛋白[4-5]。TPX最早发现于酿酒酵母中[6],随后在细菌、植物和动物中相继被报道。哺乳动物TPX分为6类:TPX1和TPX2主要分布在细胞质中;TPX3位于线粒体;TPX4存在于细胞外;TPX5分布在线粒体和过氧化物酶体;TPX6同样分布在细胞质中[7-9]。所有TPX的N端都含有保守的半胱氨酸残基,基于半胱氨酸残基数量及TPX结构和功能的特性,又将其分为1-Cys TPX、典型2-Cys TPX和非典型2-Cys TPX[5],含有相同数量半胱氨酸残基TPX的同源性较高[4]。它们在调控细胞增殖与分化、细胞信号转导等众多生理生化反应中发挥重要作用[10-15]。TPX2在哺乳动物中又称为NKEF B、Calpromotin、Torin,通过去除正常细胞代谢产生的过氧化物来保护细胞组分,同时参与由细胞表面受体起始的H2O2信号调节[9]。
近年来,软体动物硫氧还蛋白过氧化物酶受到越来越多的关注[16-21],大多数研究涉及相关基因的克隆、基因结构分析及表达差异分布等,涉及蛋白水平功能的研究较少。皱纹盘鲍Haliotis discus hannai Ino因其具有较高的经济价值,目前已成为中国重要的海水养殖贝类之一。尽管日本盘鲍Haliotis discus discus的硫氧还蛋白过氧化物酶基因AbTPX2有被克隆[19],但尚未见通过真核表达载体对该蛋白进行体外重组表达的研究。本研究中,构建了皱纹盘鲍HdhTPX2基因真核表达载体pPIC9K-HdhTPX2,在毕赤酵母菌株GS115中诱导表达获得重组蛋白,通过亲和层析对获得的重组蛋白进行纯化,并对其纯化产物进行了抗氧化功能及细胞水平安全性的评价,旨在为开发HdhTPX2蛋白作为天然食品添加剂,以及在药物制备和化妆品领域的应用奠定理论基础。
1 材料与方法
1.1 材料
试验用毕赤酵母菌株GS115、表达载体pPIC9K购自Invitrogen公司;质粒克隆菌株E.coli DH5α感受态细胞购自TIANGEN公司;pPMD18-T质粒、高保真酶购自Transgen公司;限制性内切酶、D605A、DNA Ligation Kit均购自TaKaRa公司;人肝细胞L02购自中山大学;小鼠成纤维细胞L929由闽南师范大学惠赠;马血细胞购自北京索莱宝科技有限公司。
1.2 方法
1.2.1 pPIC9K-HdhTPX2载体的构建 皱纹盘鲍pPIC9K-HdhTPX2载体构建及表达的方法参考文献[22-23]。首先根据pPIC9K载体多克隆位点,设计皱纹盘鲍HdhTPX2基因的特异性引物。然后在上游引物F1的5′端加SnaBⅠ酶切位点:CATGTACGTAGCCCAAGTCGGAAACCTC,下游引物R1的5 ′端加NotⅠ酶切位点:ATGCGGCCGC
′端加NotⅠ酶切位点:ATGCGGCCGC![]() 终止密码子前为6×His标签(如方框部分)。
终止密码子前为6×His标签(如方框部分)。
皱纹盘鲍HdhTPX2基因由福建省海洋生物增养殖与高值化利用重点实验室前期构建的转录组文库获得(GenBank登录号:MK257743)。以皱纹盘鲍HdhTPX2重组PMD18-T阳性质粒(本实验室保存)为模板,分别以HdhTPX2 F1和HdhTPX2 R1为上、下游引物扩增目的基因片段,与pPMD18-T质粒连接,获得含有HdhTPX2目的基因的重组阳性质粒,再以该阳性质粒为扩增模板,通过TransStartFastPfu DNA Polymerase高保真酶,扩增目的基因片段。取20 μg上述回收的皱纹盘鲍HdhTPX2目的基因片段,分别使用SnaBⅠ和NotⅠ限制性内切酶两次单酶切,同时对pPIC9K载体质粒进行SnaBⅠ和NotⅠ二次酶切,用核酸共沉剂D605A回收酶切后的目的基因片段及载体。采用DNA Ligation Kit,于16 ℃下将具有SnaBⅠ和NotⅠ黏性末端的pPIC9K载体与具有相同黏性末端的HdhTPX2基因片段连接,转化至E.coli DH5α感受态细胞中,涂布于含有氨苄霉素的LB琼脂平板上培养。用PCR法鉴定阳性克隆菌,交由生工生物工程(上海)股份有限公司进行DNA序列测定。
1.2.2 pPIC9K-HdhTPX2载体的转化 将测序正确且含pPIC9K-HdhTPX2的菌株进行培养并提取质粒,通过SacⅠ限制性内切酶对其线性化。用核酸共沉剂对酶切产物进行纯化,并通过电击法将线性化的质粒转化至毕赤酵母GS115感受态细胞中。将转化液涂布MD平板,放入培养箱(28 ℃)中培养2~3 d。随机挑取MD平板上的单克隆菌落接种于YPD平板培养。
1.2.3 HdhTPX2重组蛋白的表达和纯化 从YPD平板上挑取单菌落于10 mL BMGY培养基中,并放入培养箱(28 ℃)中,以230 r/min摇菌至OD600 nm值为2~6时,再转入BMMY培养基诱导表达。比较不同浓度甲醇(0.5%、1.0%、2.0%、3.0%)、不同起始pH(4、5、6、7、8)和不同时间点(0、6、12、24、48、72、96 h)重组蛋白的表达量。利用SDS-PAGE对HdhTPX2重组蛋白的表达量进行分析。其余表达菌液的上清,经透析缓冲液透析3次,离心收集上清液并用0.45 μm膜过滤后待上柱纯化。
利用重组表达载体上的6×His标签对HdhTPX2重组蛋白进行亲和层析纯化。用MilliQ清洗镍柱,用含10 mmoL/L咪唑的磷酸盐缓冲液(pH 8.5)平衡镍柱,将过滤后的发酵上清液以2 mL/min的流速上样,用含10 mmoL/L咪唑的磷酸盐缓冲液(pH 8.5)清洗未结合的杂蛋白,用含1 moL/L咪唑的磷酸盐缓冲液(pH 8.5)洗脱目的蛋白。收集洗脱峰,进一步对其进行SDS-PAGE电泳分析。
1.2.4 重组表达蛋白抗氧化活性测定 使用南京建成生物工程研究所的试剂盒测定HdhTPX2蛋白清除羟自由基(·OH)的活性,具体方法见试剂盒说明书(货号A018)。维生素C(VC)是已知的羟自由基清除剂,试验同时测定VC对羟自由基的清除能力,并作为阳性对照。
采用MTS/PMS法测定重组蛋白HdhTPX2对L929及L02细胞活性的影响,具体方法参考文献[22]。首先在37 ℃下浓度为5%的CO2培养箱中培养人肝细胞L02与鼠成纤维细胞L929。然后选择不同浓度(0、6.25、12.5、25、50、100 μg/mL)的重组蛋白HdhTPX2对L929和L02细胞处理24 h,加入MTS/PMS细胞增殖工作液避光孵育0.75~2 h,用酶标仪测定490 nm波长下的吸光值。
细胞氧化损伤试验采用150 μmoL/L H2O2处理L02与L929细胞,加入不同浓度(0、6.25、12.5、25、50、100 μg/mL)重组蛋白HdhTPX2,用无H2O2和未添加蛋白的细胞作空白对照(记为CON),置于37 ℃下浓度为5%的CO2细胞培养箱培养3 h后,加入MTS/PMS细胞增殖工作液,避光孵育0.75~2 h,用酶标仪测定490 nm波长下的吸光值。
1.2.5 血细胞溶血试验 马血细胞溶血试验方法参考文献[23],首先配制4%马血细胞混悬液,取不同浓度的重组蛋白HdhTPX2各2 mL至灭菌管中,分别加入1 mL 4%的马血细胞,轻柔混匀,于37 ℃下浓度为5%的CO2细胞培养箱中培养2 h。再从各管中取出1 mL溶液放入新的离心管中,并置于离心机上以900 g离心5 min,吸取200 μL上清液至96孔酶标板中测定OD500 nm。试验中以等体积MiiliQ水作为阴性对照,1% TritonX-100作为阳性对照。
2 结果与分析
2.1 pPIC9K-HdhTPX2真核表达载体的构建与鉴定
试验用表达载体pPIC9K N端含有AOX1启动子,利用酵母信号肽α-factor因子引导HdhTPX2分泌表达,其C端加入6×His标签,可以通过亲和层析纯化目的蛋白,真核表达载体的构建过程如图1所示。
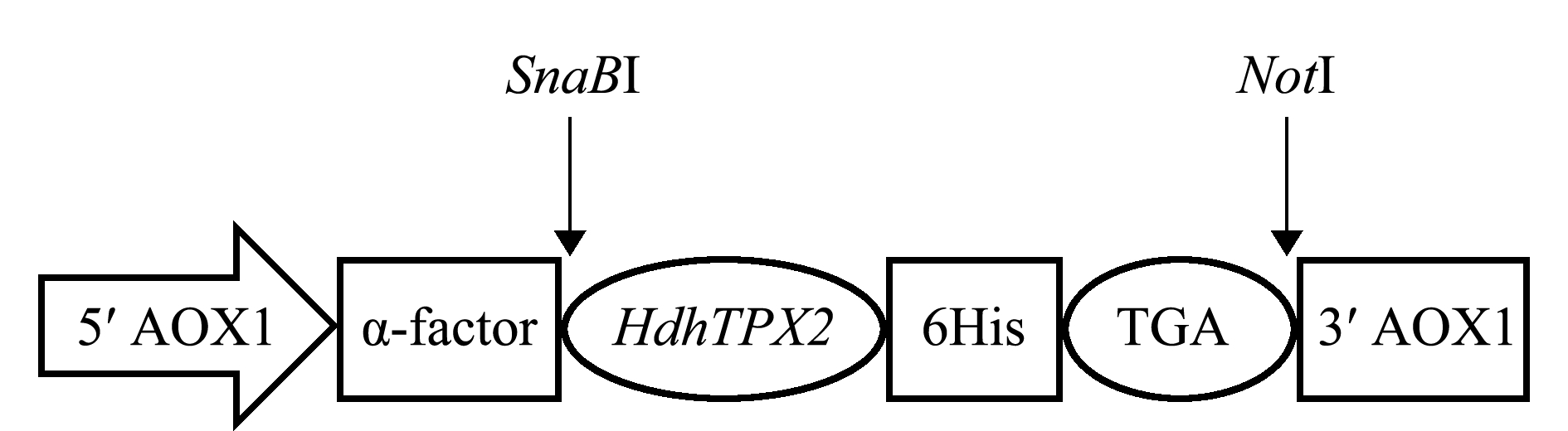
图1 PIC9K-HdhTPX2重组质粒载体的示意图
Fig.1 Schematic diagram of the expression vector of pPIC9K-HdhTPX2
经PCR扩增获得HdhTPX2 ORF框的编码序列,大小为594 bp,编码198个氨基酸(图2-A)。分别使用SnaBⅠ和NotⅠ对目的基因及pPIC9K载体进行酶切(图2-B),将酶切后的载体与目的基因连接,并转化至大肠杆菌DH5α中,随机挑取部分阳性克隆培养并送生工生物工程(上海)股份有限公司测序。结果表明,pPIC9K-HdhTPX2载体序列正确。
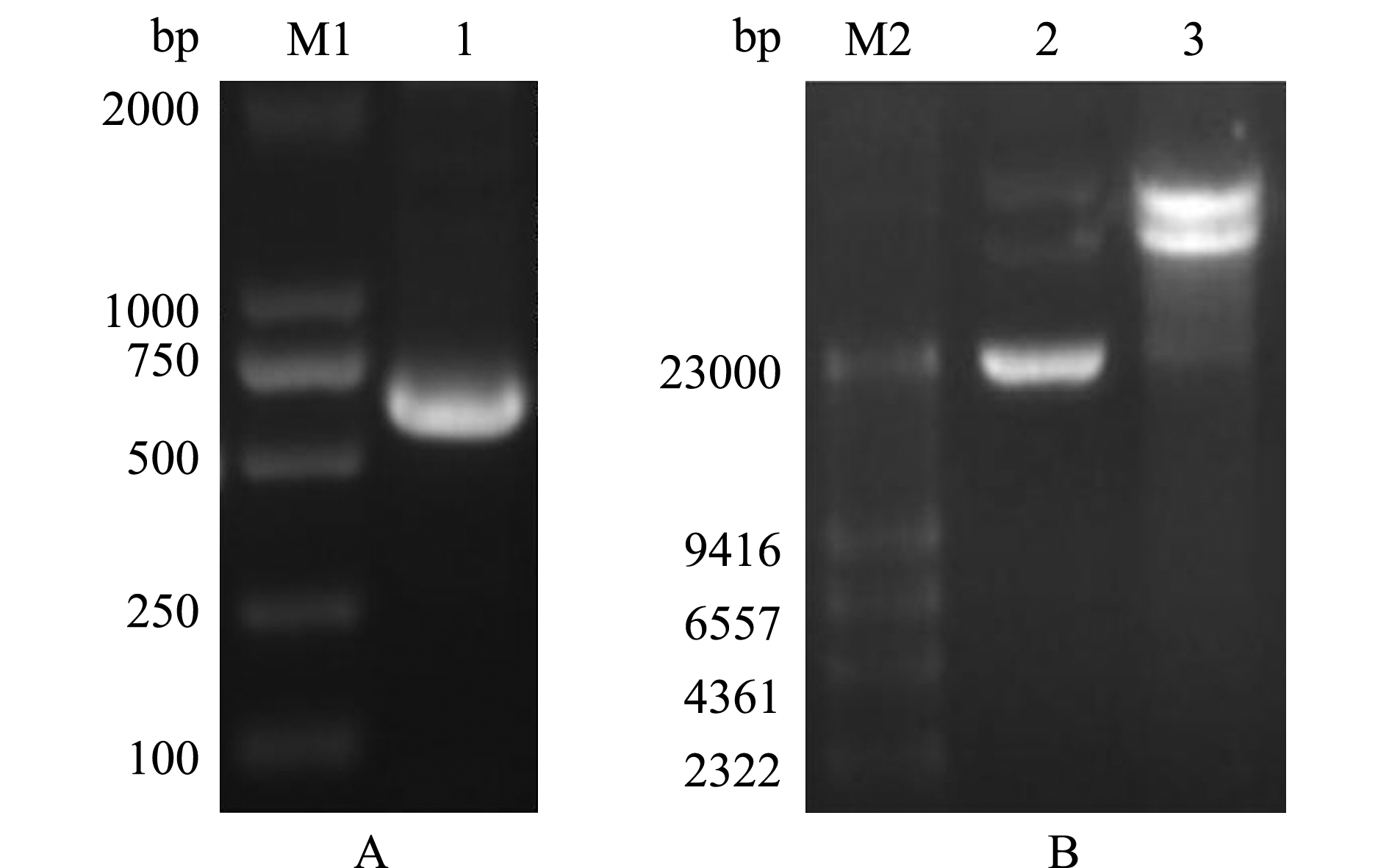
注:M1为DL2000 DNA Marker;M2为λHindⅢ DNA Marker;1为HdhTPX2的PCR产物;2为酶切前pPIC9K载体;3为pPIC9K载体经SnaBⅠ和NotⅠ酶切后产物
Note: M1,DL2000 DNA Marker; M2, λHindⅢ DNA Marker; 1, PCR amplification of HdhTPX2 gene; 2, plasmid pPIC9K; 3, plasmid pPIC9K digested with SnaBⅠ and NotⅠ
图2 HdhTPX2基因PCR产物及pPIC9K质粒酶切后的电泳图
Fig.2 Electrophoresis of expression pattern and digestion of plasmid pPIC9K vector of HdhTPX2 fragment
2.2 HdhTPX2蛋白诱导表达条件的优化
试验中比较了不同浓度甲醇(0.5%、1.0%、2.0%、3.0%)、培养基不同起始pH(4、5、6、7、8)和诱导后不同时间点(0、6、12、24、48、72、96 h)条件下,重组蛋白HdhTPX2的表达量。结果表明,pH为7的培养基中加入0.5%甲醇诱导后,在相对分子量约25 000的位置出现条带,且在72 h时表达量最高(图3)。
2.3 重组蛋白HdhTPX2的纯化及鉴定
重组蛋白HdhTPX2 C端带有6×His标签,可以与镍柱结合通过亲和层析将其纯化。将纯化得到的目的蛋白进行SDS-PAGE电泳,并将其切胶酶解,通过液相分离-基质辅助激光解析串联飞行时间质谱仪(LC-MALDI-TOF-TOF)鉴定,确认该蛋白为HdhTPX2(图4)。
2.4 HdhTPX2蛋白的抗氧化活性评价
2.4.1 HdhTPX2蛋白体外清除羟自由基的能力 如图5所示,重组蛋白HdhTPX2清除羟自由基的能力随蛋白浓度的增加而增强,其IC50为0.028 mg/mL。试验设置VC为阳性对照,测得VC的IC50为0.25 mg/mL。这表明,重组蛋白HdhTPX2具有较强的清除羟自由基能力。
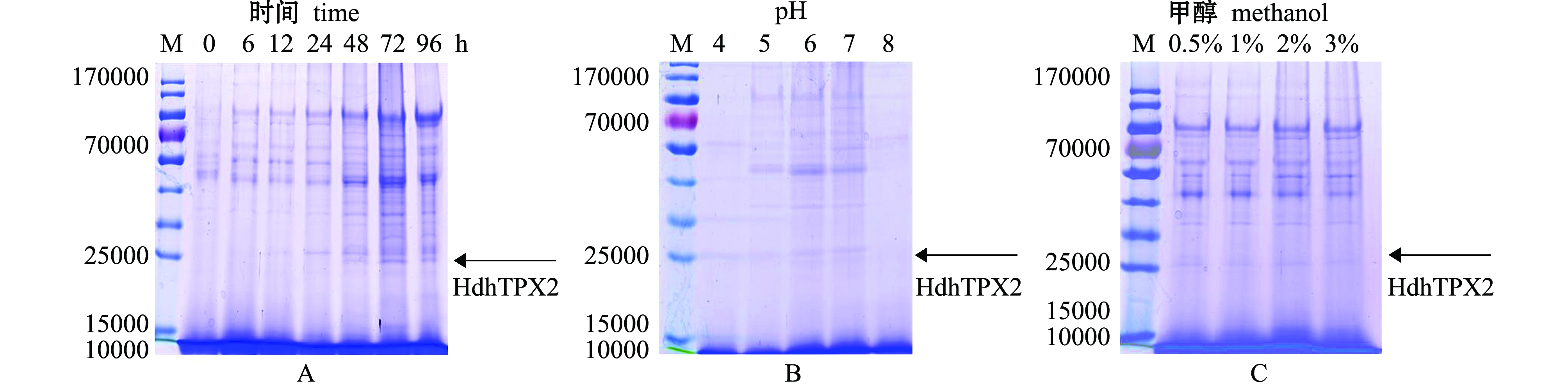
注:M为蛋白质Marker (26616,Thermo Scientific);A为不同诱导时间对重组蛋白HdhTPX2表达的影响;B为不同起始pH对重组蛋白HdhTPX2表达的影响;C为不同甲醇浓度对重组蛋白HdhTPX2表达的影响
Note:M, protein Marker (26616,Thermo Scientific);A, the effect of different induction time on the recombinant HdhTPX2 expression; B,the effect of initial pH on the expression of the recombinant HdhTPX2; C,the effect of methanol concentration on the expression of the recombinant HdhTPX2
图3 重组蛋白HdhTPX2在毕赤酵母中表达条件的优化
Fig.3 Optimization of conditions of recombinant HdhTPX2 expression in yeast Pichia pastoris

注:M为蛋白质Marker (26614,Thermo Scientific);1为HdhTPX2蛋白纯化前;2为HdhTPX2蛋白纯化后
Note: M,protein Marker (26614,Thermo Scientific); 1,TPX2 protein before purification; 2,TPX2 protein after purification
图4 HdhTPX2蛋白的纯化电泳及质谱鉴定图
Fig.4 SDS-PAGE electrophoresis and the MALDI-TOF MS spectrum of purified HdhTPX2 protein

图5 重组表达产物HdhTPX2及VC对羟自由基的清除能力
Fig.5 Effect of recombinant expression product of HdhTPX2 and VC on scavenging hydroxyl free radicals
2.4.2 HdhTPX2蛋白对L929和L02细胞活性的影响 将不同浓度的纯化后的HdhTPX2蛋白与L929和L02细胞培养24 h后,浓度低于或等于50 μg/mL的HdhTPX2蛋白对L929细胞活性均无显著性影响(P>0.05),浓度为100 μg/mL的HdhTPX2蛋白组L929细胞活性较浓度为0 μg/mL组显著下降(P<0.05);浓度低于或等于100 μg/mL的HdhTPX2蛋白对L02细胞活性均无显著性影响(P>0.05)(图6)。
2.4.3 HdhTPX2蛋白对H2O2引起的细胞损伤的保护作用 将不同浓度的HdhTPX2蛋白与H2O2共同孵育L929和L02细胞3 h,以未添加蛋白和H2O2的组作为空白对照(CON)。从图7可见:随着HdhTPX2蛋白浓度的增大,L929细胞活性不断升高,浓度为50 μg/mL的HdhTPX2蛋白组L929细胞活性显著高于蛋白浓度为0 μg/mL 的组(P<0.05);HdhTPX2蛋白同样对L02细胞也具抗氧化作用,浓度为50 μg/mL的HdhTPX2蛋白与H2O2共同孵育L02细胞能够显著提高细胞活性(P<0.05),该试验证实,HdhTPX2蛋白可以保护H2O2引起的L929及L02细胞过氧化损伤。
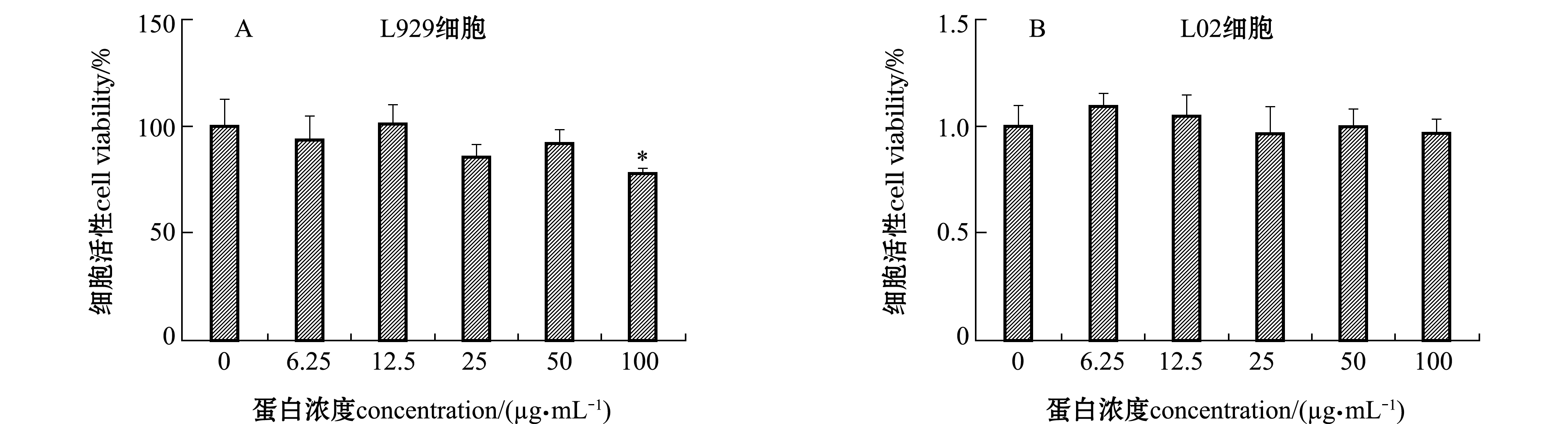
注:*表示与0 μg/mL蛋白浓度组有显著性差异(P<0.05),下同
Note: * means significant difference compared with 0 μg/mL protein concentration group(P<0.05),et sequentia
图6 重组表达产物HdhTPX2对L929及L02细胞活性的影响
Fig.6 Effects of recombinant expression product HdhTPX2 on L929 and L02 cell activity
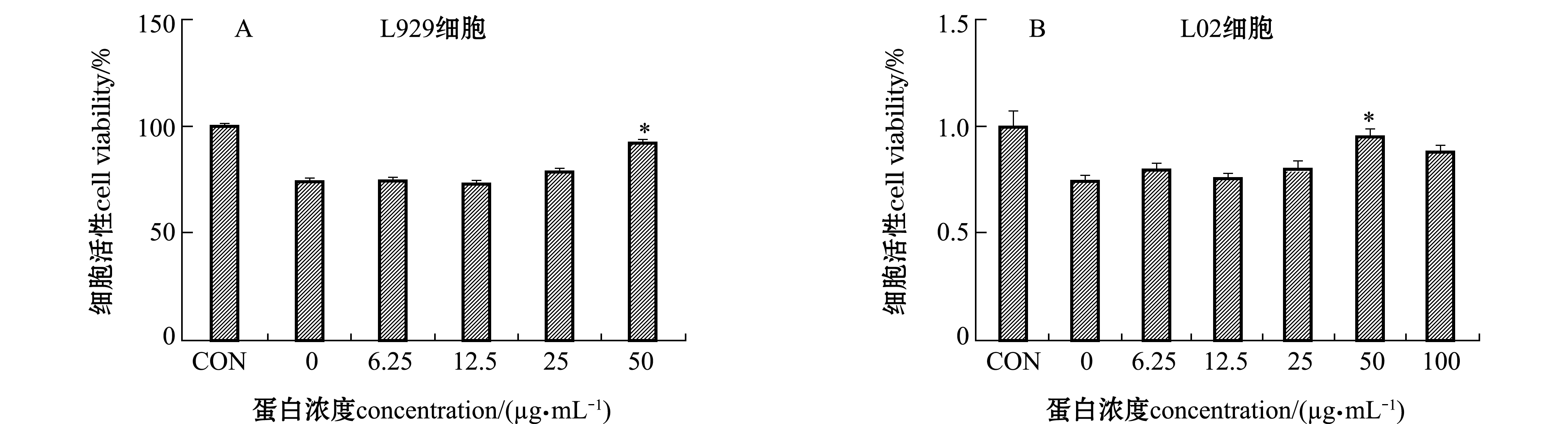
图7 重组表达产物HdhTPX2对H2O2诱导L929与L02细胞损伤的保护作用
Fig.7 Protection of L929 and L02 cells against H2O2 injury by recombinant expression product HdhTPX2
2.4.4 HdhTPX2对马血细胞溶血性作用评价 对重组表达产物的溶血试验结果表明,HdhTPX2对马血细胞溶血的影响非常小,在HdhTPX2蛋白最大浓度720 μg/mL时,溶血率均低于5%(表1)。
3 讨论
3.1 HdhTPX2重组蛋白表达
对于TPX蛋白功能的研究,多数学者采用原核表达的方式获取该蛋白。如廖剑[23]构建了青岛文昌鱼硫氧还蛋白过氧化物酶(TPX)的原核表达载体,重组的青岛文昌鱼TPX以同源二聚体和单体混合的形式存在。李永光[24]构建了猪带绦虫TPX的重组表达质粒p GEX-4T-Tm TPX,转化至大肠杆菌BL-21中,经IPTG诱导获得约43 000的
融合蛋白,用其纯化产物免疫家兔,具有较好的免疫原性。毕赤酵母是一个优良的异源表达宿主,能对翻译后的蛋白进行更好的修饰,因此,获得的表达产物具有更高的活性,常被用于生物制药及工业酶的生产中[25-28]。本研究中,采用毕赤酵母GS115真核表达系统对皱纹盘鲍HdhTPX2进行体外重组表达,经甲醇诱导,分别对诱导表达的时间、甲醇浓度、培养基pH等条件进行优化,最终获得了具有抗氧化活性的HdhTPX2真核表达菌株。HdhTPX2蛋白由198个氨基酸组成,在52位和173位各有一个高度保守的半胱氨酸残基,是抗氧化活性关键部位。皱纹盘鲍HdhTPX2蛋白属于典型2-Cys TPX,本研究中通过毕赤酵母表达系统获得相对分子质量约为25 000的蛋白,并通过肽指纹图谱鉴定为目标蛋白。
表1 重组表达产物HdhTPX2对马血细胞溶血作用的评价
Tab.1 Effect of recombinant expression product HdhTPX2 on hemolysis of horse blood cells
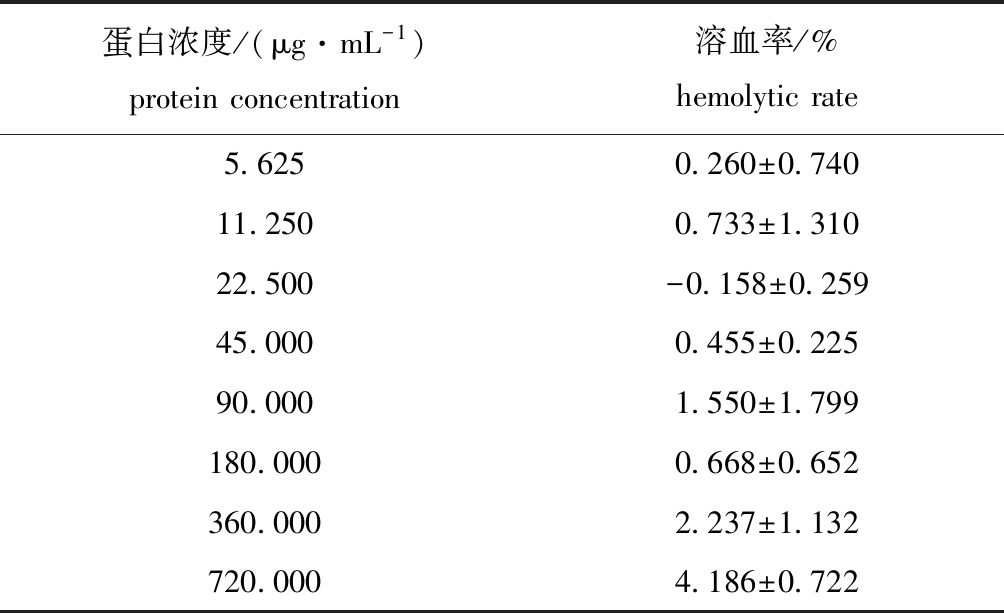
蛋白浓度/(μg·mL-1)protein concentration溶血率/%hemolytic rate5.6250.260±0.74011.2500.733±1.31022.500-0.158±0.25945.0000.455±0.22590.0001.550±1.799180.0000.668±0.652360.0002.237±1.132720.0004.186±0.722
3.2 HdhTPX2蛋白的活性评价
TPX家族蛋白不含金属辅基,通过分解过氧化物或超氧化物去除代谢中的羟自由基,从而减少氧化应激对机体的损伤[29]。本研究中通过测定对羟自由基的清除能力来评估皱纹盘鲍TPX2真核表达产物抗氧化活性高低。通过与VC比较50%清除率的浓度发现,纯化后得到的HdhTPX2蛋白具有清除羟自由基的能力,并且对H2O2引起的L929和L02细胞损伤具有一定的保护作用。Kim等[6]发现,酵母TPX具有清除过氧化氢和羟自由基的作用,在金属催化氧化系统中会产生羟自由基,从而引起DNA损伤。Pushpamali等[19]将AbTPX2构建至pMAL表达载体中,通过E.coli BL21原核表达系统对该蛋白进行融合表达,经纯化得到相对分子质量为64 500的AbTPX2融合蛋白。该蛋白可以催化H2O2与叔丁基过氧化氢的还原反应,AbTPX2可以保护超螺旋质粒不被切割。此外,一些研究还发现,硫氧还蛋白过氧化物酶除了可以抗氧化,还具有耐热、耐盐、抗旱和耐重金属等抗胁迫能力[30]。
本研究中对重组表达产物在细胞水平的安全性应用进行了评价,分别测定其对鼠成纤维细胞L929与人肝细胞L02细胞活性影响,并进行了马血细胞溶血检测,发现HdhTPX2蛋白浓度低于50 μg/mL时对两种细胞活性均无显著影响,也不会引起细胞溶血。本研究结果为进一步开发该重组产物作为天然抗氧化剂应用于医药食品及化妆品等领域提供了数据资料。
[1] Gao Xiaolong,Li Yong,Li Xian,et al.The response and osmotic pressure regulation mechanism of Haliotis discus hannai (Mollusca,Gastropoda) to sudden salinity changes[J].Hydrobiologia,2017,795(1):181-198.
[2] Kawagishi H,Finkel T.Unraveling the truth about antioxidants:ROS and disease:finding the right balance[J].Nature Medicine,2014,20(7):711-713.
[3] Zhang Hongkuan,Cheng Dewei,Liu Hongxing,et al.Differential responses of a thioredoxin-like protein gene to Vibrio parahaemolyticus challenge in the noble scallop Chlamys nobilis with different total carotenoids content[J].Fish & Shellfish Immunology,2018,72:377-382.
[4] Xia Xichao,Yu Ruixue,Li Mengbo,et al.Molecular cloning and characterization of two genes encoding peroxiredoxins from freshwater bivalve Anodonta woodiana:antioxidative effect and immune defense[J].Fish & Shellfish Immunology,2018,82:476-491.
[5] Wood Z A,Schröder E,Harris J R,et al.Structure,mechanism and regulation of peroxiredoxins[J].Trends in Biochemical Sciences,2003,28(1):32-40.
[6] Kim K,Kim I H,Lee K Y,et al.The isolation and purification of a specific “protector” protein which inhibits enzyme inactivation by a thiol/Fe(III)/O2 mixed-function oxidation system[J].The Journal of Biological Chemistry,1988,263(10):4704-4711.
[7] Wang Xiaobo,Hu Baoqing,Wen Chungen,et al.Molecular cloning,expression and antioxidative activity of 2-cys-peroxiredoxin from freshwater mussel Cristaria plicata[J].Fish & Shellfish Immunology,2017,66:254-263.
[8] Chen Jinwen,Dodia C,Feinstein S I,et al.1-Cys peroxiredoxin,a bifunctional enzyme with glutathione peroxidase and phospholipase A2 activities[J].The Journal of Biological Chemistry,2000,275(37):28421-28427.
[9] Rhee S G,Chae H Z,Kim K.Peroxiredoxins:a historical overview and speculative preview of novel mechanisms and emerging concepts in cell signaling[J].Free Radical Biology and Medicine,2005,38(12):1543-1552.
[10] Low F M,Hampton M B,Winterbourn C C.Peroxiredoxin 2 and peroxide metabolism in the erythrocyte[J].Antioxidants & Redox Signaling,2008,10(9):1621-1630.
[11] Fisher A B.Peroxiredoxin 6:a bifunctional enzyme with glutathione peroxidase and phospholipase A2 activities[J].Antioxidants & Redox Signaling,2011,15(3):831-844.
[12] Huh J Y,Kim Y,Jeong J,et al.Peroxiredoxin 3 is a key molecule regulating adipocyte oxidative stress,mitochondrial biogenesis,and adipokine expression[J].Antioxidants & Redox Signaling,2012,16(3):229-243.
[13] Bae S H,Sung S H,Lee H E,et al.Peroxiredoxin Ⅲ and sulfiredoxin together protect mice from pyrazole-induced oxidative liver injury[J].Antioxidants & Redox Signaling,2012,17(10):1351-1361.
[14] Perkins A,Poole L B,Karplus P A.Tuning of peroxiredoxin catalysis for various physiological roles[J].Biochemistry,2014,53(49):7693-7705.
[15] Winterbourn C C,Hampton M B.Redox biology:signaling via a peroxiredoxin sensor[J].Nature Chemical Biology,2015,11(1):5-6.
[16] Park H,Ahn I Y,Kim H,et al.Analysis of ESTs and expression of two peroxiredoxins in the thermally stressed Antarctic bivalve Laternula elliptica[J].Fish & Shellfish Immunology,2008,25(5):550-559.
[17] Cong Ming,Ni Duojiao,Song Linsheng,et al.Molecular cloning,characterization and mRNA expression of peroxiredoxin in Zhikong scallop Chlamys farreri[J].Molecular Biology Reports,2009,36(6):1451-1459.
[18] Li Juan,Li Li,Zhang Shoudu,et al.Cloning,genomic structure,and expression analysis of peroxiredoxin V from bay scallop Argopecten irradians[J].Fish & Shellfish Immunology,2011,30(1):309-316.
[19] Pushpamali W A,De Zoysa M,Kang H S,et al.Comparative study of two thioredoxin peroxidases from disk abalone (Haliotis discus discus):cloning,recombinant protein purification,characterization of antioxidant activities and expression analysis[J].Fish & Shellfish Immunology,2008,24(3):294-307.
[20] Green T J,Dixon T J,Devic E,et al.Differential expression of genes encoding anti-oxidant enzymes in Sydney rock oysters,Saccostrea glomerata (Gould) selected for disease resistance[J].Fish & Shellfish Immunology,2009,26(5):799-810.
[21] Nikapitiya C,De Zoysa M,Whang I,et al.Molecular cloning,characterization and expression analysis of peroxiredoxin 6 from disk abalone Haliotis discus discus and the antioxidant activity of its recombinant protein[J].Fish & Shellfish Immunology,2009,27(2):239-249.
[22] 方春华.皱纹盘鲍抗氧化蛋白的制备与活性评价[D].福州:福建农林大学,2017.
[23] 廖剑.中国青岛文昌鱼硫氧还蛋白过氧化物酶表达、纯化及活性特征[J].第二军医大学学报,2008,29(7):781-786.
[24] 李永光.多头带绦虫硫氧还蛋白过氧化物酶基因的克隆、表达及抗原性研究[D].兰州:甘肃农业大学,2009.
[25] Pan Nan.Studies on novel bioactive peptides and their precursors from the skin secretions of Australian Pelodryadinae frogs[D].Belfast:Queen’s University Belfast,2011.
[26] 彭会,刘杰,陈慧芸.拟穴青蟹抗菌肽SCY2在毕赤酵母中的表达及其抗菌活性[J].大连海洋大学学报,2018,33(2):151-157.
[27] Macauley-Patrick S,Fazenda M L,McNeil B,et al.Heterologous protein production using the Pichia pastoris expression system[J].Yeast,2005,22(4):249-270.
[28] Ahmad M,Hirz M,Pichler H,et al.Protein expression in Pichia pastoris:recent achievements and perspectives for heterologous protein production[J].Applied Microbiology and Biotechnology,2014,98(12):5301-5317.
[29] Netto L E S,Chae H Z,Kang S W,et al.Removal of hydrogen peroxide by thiol-specific antioxidant enzyme (TSA) is involved with its antioxidant properties TSA possesses thiol peroxidase activity[J].The Journal of Biological Chemistry,1996,271(26):15315-15321.
[30] 贺琳,蒋丽丽,王玉成.柽柳硫氧还蛋白过氧化物酶(ThPrx1)基因转入酵母的抗逆能力分析[J].东北林业大学学报,2011,39(4):101-104.