Akt(RAC-alpha serine/threonine-protein kinase)又称蛋白激酶B(Protein Kinase B,PKB),是一种相对分子质量约为60 000的丝氨酸(Ser)或苏氨酸(Thr)蛋白激酶。Akt最早发现于1991年,是一种与蛋白激酶A(Protein Kinase A,PKA)和蛋白激酶C(Protein Kinase C,PKC)相类似的新型蛋白激酶,与急性转化反转录病毒(Acutely transforming retrovirus,AKT8)的原癌基因(v-Akt)属同源序列 [1-2]。Akt蛋白能够通过磷酸化多种转录因子,参与调节蛋白合成、细胞生长和细胞存活等生理生化过程,进而调控脊椎动物的抗细胞凋亡、机体新陈代谢和免疫细胞的发育等[3-4]。
目前,在人Homo sapiens、小鼠Mus musculus和果蝇Drosophila melanogaster等生物中已发现了3种Akt异构体和50多种Akt的潜在底物,以及多条相关细胞信号转导通路[3]。截至2018年6月,美国国立生物技术信息中心(National Center for Biotechnology Information,NCBI,https://www.ncbi. nlm.nih.gov/)上登录的Akt基因和Akt蛋白序列信息共有1551条,其中完整序列349条,部分序列1202条,主要集中在灵长类(Primates)、啮齿类(Glires)、偶蹄类(Even-toed Ungulates)和硬骨鱼类(Pisces)等脊索动物中。
关于水产动物Akt基因的相关研究最早可以追溯到21世纪初[5],已有研究表明,Akt基因不仅参与了水产动物的胚胎发育过程[6],还可能参与介导水产动物机体的免疫防御。如中国明对虾Fenneropenaeus chinensis在经过溶壁微球菌Micrococcus lysodeikticus和鳗弧菌Vibrio anguillarum两种病原菌刺激后,体内Akt基因(FcAkt)的转录表达呈现相似的规律性波动[7];香港牡蛎Crassostrea hongkongensis在受到溶藻弧菌Vibrio alginolyticus、酿酒酵母Saccharomyces cerevisiae等病原菌感染后,其体内Akt1基因(ChAkt1)的相对表达量呈显著上调趋势[8]。这表明,Akt基因在水产动物免疫防御过程中可能发挥重要的调控作用。因此,为进一步丰富水产动物Akt基因研究数据,深入了解水产动物Akt基因的生物学功能,本研究中就近年来水产动物Akt基因的序列特征、进化特点及生物功能进行综述,旨在为研究Akt基因在水产动物生长发育、免疫防御过程中的作用提供数据资料。
1 Akt基因的分子结构及功能
Akt分子分为N端调节区、中间激酶活性区和C端调节区3个区域:N端调节区内含有一个AH结构域,通常在1~147位氨基酸(amino acid,aa)之间,AH结构域中的PH结构域(Pleckstrin Homologydomain,1aa~106aa),可介导蛋白质-蛋白质或蛋白质-脂质间的相互作用[9];中间激酶活性区含有一个激酶催化结构域(148aa~411aa),具有Akt活化所必需的Thr308位点,是催化丝氨酸/苏氨酸磷酸化活性的区域;C端调节区则含有一个疏水结构域(412aa~488aa),具有Akt完全活化所必需的第二个磷酸化位点——Ser473位点[10](图1)。目前已发现的Akt亚型共有3种,分别为Aktl(又称PKBα)、Akt2(又称PKBβ)和Akt3(又称PKBγ),这3种亚型蛋白的氨基酸序列具有的同源性高达85%,且具有相似的空间结构[11]。作为蛋白激酶家族的重要成员之一,Akt被证实是磷脂酰肌醇3激酶(Phosphoinositide 3-kinase,PI3K)信号通路下游主要的效应分子,可通过与细胞膜上磷酸肌醇对接位点的相互作用移动到膜上,被完全活化(图2)[12]。激活后的Akt可以通过磷酸化一系列细胞内靶标蛋白而介导细胞存活(cell survival)、细胞生长(cell growth)、细胞增殖(cell multiplication)、细胞代谢(cell metabolism)、细胞迁移(cell migration)和血管生成(angiogenesis)等下游反应[13-15]。
Akt在高等脊椎动物如人的上皮性卵巢癌[16]、心血管系统疾病[17]、恶性肿瘤[18]和糖尿病[19-20]等病理治疗中有着重要的作用及意义。张海燕等[16]研究发现,Akt在人的上皮性卵巢癌组织中的过表达程度与临床分期和组织分级密切相关,可作为潜在的靶标应用于人的上皮性卵巢癌的治疗过程。此外,Akt基因在动物细胞的生长发育、细胞增殖和代谢等方面可发挥重要的调控作用[21-22]。如Lai等[21]研究发现,当小家鼠的Akt基因过量表达时,可使其骨骼肌细胞大量增殖,导致小家鼠的全身性肌肉肥大和体力增加。
2 水产动物Akt基因研究进展
2.1 水产动物Akt基因的序列特征和结构特点
截至2018年6月,在NCBI数据库(https://www. ncbi.nlm.nih.gov/)中登录的Akt完整序列:鱼类有牙鲆Paralichthys olivaceus (KY763980.1)、鳜鱼Siniperca chuatsi (KY984992.1)、斑马鱼Danio rerio (JX307852.1)的完整序列,以及草鱼Ctenopharyngodon idella (XM_012851146.2)和底鳉Fundulus heteroclitus (KY763992.1)的部分序列;棘皮类动物(Echinoderm)有刺参Apostichopus japonicus (MG516906.1)和蓝海燕Asterina pectinifera (AB060291.1)的完整序列;甲壳类动物(Crustacean)有中华绒螯蟹Eriocheir sinensis (KY412800.1)、凡纳滨对虾Litopenaeus vannamei (KF163129.1)和中国明对虾Fenneropenaeus chinensis( JX853771.1)的完整序列,以及黑背地蟹Gecarcinus lateralis (HM989974.3)和普通滨蟹Carcinus maenas (JQ864249.1)的部分序列;软体动物(Mollusc)有香港牡蛎Crassostrea hongkongensis( KT362182.1)和九孔鲍Haliotis diversicolor( KX056492.1)的完整序列。通过比较发现,不同种类水产动物的Akt基因序列全长及其编码蛋白的长度(表1)不仅具有种内相似性,还具有种间特异性。
通过比较发现,在鱼类中,牙鲆Akt基因序列(PoAkt,KY763980.1)最长,全长为3340个碱基对(base pair,bp),其中,最大的开放阅读框为1449 bp,编码一个含有482个氨基酸的多肽,包含一个522 bp的5′非翻译区和一个1469 bp的3′非翻译区,与同属于辐鳍亚纲Actinopterygii的鳜鱼Akt基因(ScAkt, KY984992.1)具有相似的序列长度,且其开放阅读框的长度及其编码氨基酸的个数相同,编码蛋白的等电点和相对分子质量均相似,均无信号肽。与属于新鳍亚纲Neopterygii的序列全长为1425 bp的斑马鱼Akt基因(DrAkt,JX307852.1)差异较大。在棘皮动物中,刺参Akt基因(AjAkt,MG516906.1)序列的全长为1826 bp,其开放阅读框为1434 bp,编码一个含有477个氨基酸的多肽,无信号肽结构。蓝海燕Akt基因(ApAkt,AB060291.1)的序列全长为1662 bp,短于刺参的Akt序列,但其开放阅读框含1460个核苷酸,且编码486个氨基酸,均大于刺参,二者存在一定差异。这一结果与尚胜男等[23]对棘皮动物bindin基因序列特征的研究相类似。在甲壳动物中,通过比较中华绒螯蟹(EsAkt,KY412800.1)、凡纳滨对虾(LvAkt,KF163129.1)与中国明对虾(FcAkt,JX853771.1)的完整Akt基因序列,发现中华绒螯蟹的核苷酸序列最长(2220 bp),但三者的开放阅读框长度分别为1545、1536、1536 bp,且编码的蛋白分别含514、511及511个氨基酸,均无信号肽,较为相似。在贝类中,通过比较香港牡蛎(ChAkt,KT362182.1)和九孔鲍(HdAkt,KX056492.1)两个种类的完整Akt序列,发现二者的核苷酸序列和所编码的氨基酸序列相似程度较高,差异不大。
表1 部分已知全长的水产动物Akt基因及其编码蛋白序列特征
Tab.1 Sequence characteristics and encoding protein of Akt gene with known full length in some aquatic animals
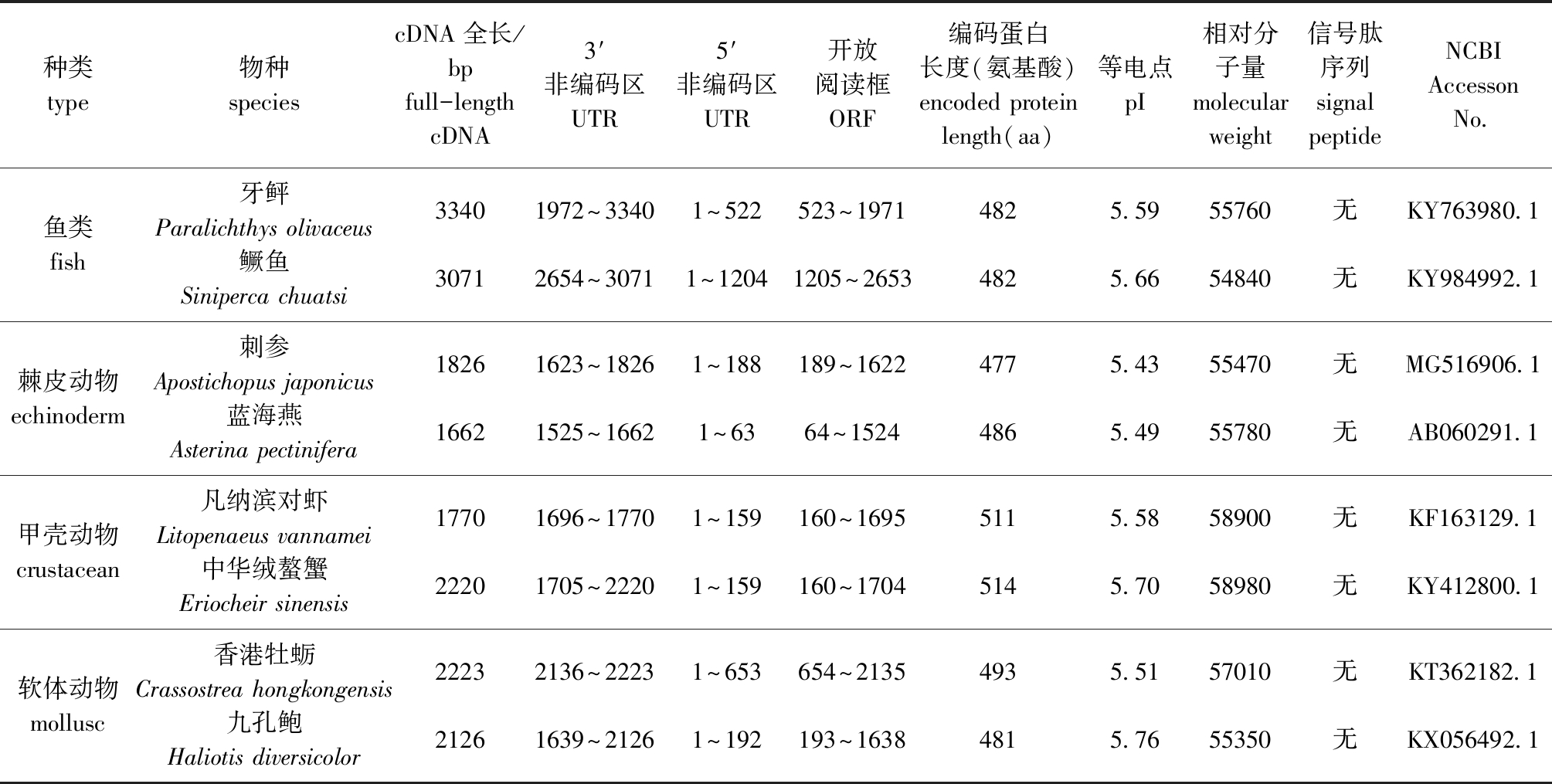
种类type物种speciescDNA全长/bpfull-length cDNA3′非编码区UTR5′非编码区UTR开放阅读框ORF编码蛋白长度(氨基酸)encoded proteinlength(aa)等电点pI相对分子量molecular weight信号肽序列signalpeptideNCBIAccesson No.鱼类fish牙鲆Paralichthys olivaceus鳜鱼Siniperca chuatsi334030711972~33402654~30711~5221~1204523~19711205~26534824825.595.665576054840无无KY763980.1KY984992.1棘皮动物echinoderm刺参Apostichopus japonicus蓝海燕Asterina pectinifera182616621623~18261525~16621~1881~63189~162264~15244774865.435.495547055780无无MG516906.1AB060291.1甲壳动物crustacean凡纳滨对虾Litopenaeus vannamei中华绒螯蟹Eriocheir sinensis177022201696~17701705~22201~1591~159160~1695160~17045115145.585.705890058980无无KF163129.1KY412800.1软体动物mollusc香港牡蛎Crassostrea hongkongensis九孔鲍Haliotis diversicolor222321262136~22231639~21261~6531~192654~2135193~16384934815.515.765701055350无无KT362182.1KX056492.1
2.2 水产动物Akt基因及其编码蛋白的进化特点
研究表明,Akt家族在真核生物(不包括酵母)中的进化极为保守[3]。多序列分析显示,鱼类Akt基因在同属于辐鳍亚纲的牙鲆和鳜鱼中存在较小的种内差异,而与属于新鳍亚纲的斑马鱼则存在一定程度的种间差异。在棘皮动物中,分属于海参纲和海星纲的刺参和蓝海燕Akt基因的核苷酸序列存在一定差异,这从一定程度上证实了棘皮动物Akt基因序列的种间变异性特征。而中华绒螯蟹、凡纳滨对虾和中国明对虾等甲壳动物Akt基因的序列相似性较高,呈现一定的保守性。在软体动物中,分属于瓣鳃纲和腹足纲的香港牡蛎和九孔鲍Akt基因的核苷酸序列差异并不显著,这是因为软体动物Akt基因虽具有较高保守性,但存在一定的种间差异。
值得注意的是,不同种类水产动物Akt蛋白氨基酸序列中均存在PH结构域、激酶催化结构域(S_TKc)和调节结构域(S_TK_X),且具有相同的排列顺序(图3),两个保守的关键磷酸化位点Thr308和Ser473也都分别位于激酶结构域和调节结构域[10]。多序列比对结果显示(图4),同为鱼类辐鳍亚纲的牙鲆和鳜鱼的Akt蛋白序列一致性为88.45%,同为棘皮动物但分属于海参纲和海星纲的刺参和蓝海燕的Akt蛋白序列一致性为60.52%,同为节肢动物甲壳纲的中华绒螯蟹和凡纳滨对虾的Akt蛋白序列一致性为85.66%,同为软体动物但分属于瓣鳃纲和腹足纲的香港牡蛎和九孔鲍的Akt蛋白序列一致性为72.44%,这一结果提示,水产动物Akt蛋白在种内的序列一致性较高,较为保守,而在种间则存在一定程度的差异性。
通过对牙鲆、刺参、凡纳滨对虾和九孔鲍的Akt蛋白二级结构(图5)进行比较发现,牙鲆的Akt蛋白二级结构中含有25个卷曲、14个折叠和10个螺旋,刺参的Akt蛋白二级结构中含有23个卷曲、14个折叠和8个螺旋,凡纳滨对虾的Akt蛋白二级结构中含有23个卷曲、13个折叠和9个螺旋,九孔鲍的Akt蛋白二级结构中含有24个卷曲、15个折叠和8个螺旋。它们的大部分折叠、卷曲、螺旋结构位点较为一致,但不同种间仍存在一定差异。
挖掘收集NCBI数据库中现有的部分水产动物已知的Akt基因序列信息,利用邻接法(Neighbor-Joining,NJ)构建基于Akt基因核苷酸序列的系统进化树(图6),经聚类分析发现,同属于辐鳍亚纲的牙鲆和鳜鱼聚为一支,底鳉和橙线雀Acanthochromis polyacanthus聚为一支,并与其他鱼类最终聚为一支。棘皮类中,海参纲的刺参和海星纲的蓝海燕最终也聚为一支。甲壳类中,凡纳滨对虾和中国明对虾聚为一支,黑背地蟹和中华绒螯蟹聚为一支,且所有节肢动物聚为一支。同属于软体动物的香港牡蛎和九孔鲍也聚为一支。这一结果表明,Akt基因在各种类水产动物种内的差异性不大,且在种间的分化也并不明显,表明其进化规律及具体的进化机制可能极为保守,这一结果在一定程度上也证实了Akt家族在真核生物(不包括酵母)中的进化极为保守这一假设[3]。

注:图中PH区域代表PH结构域;S_TKc区域代表激酶催化结构域;S_TK_X区域代表调节结构域
Note: The PH region represents the PH domain; the S_TKc region represents the kinase catalytic domain; the S_TK_X region represents the regulatory domain
图1 水产动物Akt基因及其编码蛋白的分子结构
Fig.1 Molecular structure and encoded protein of the Akt gene in aquatic animals
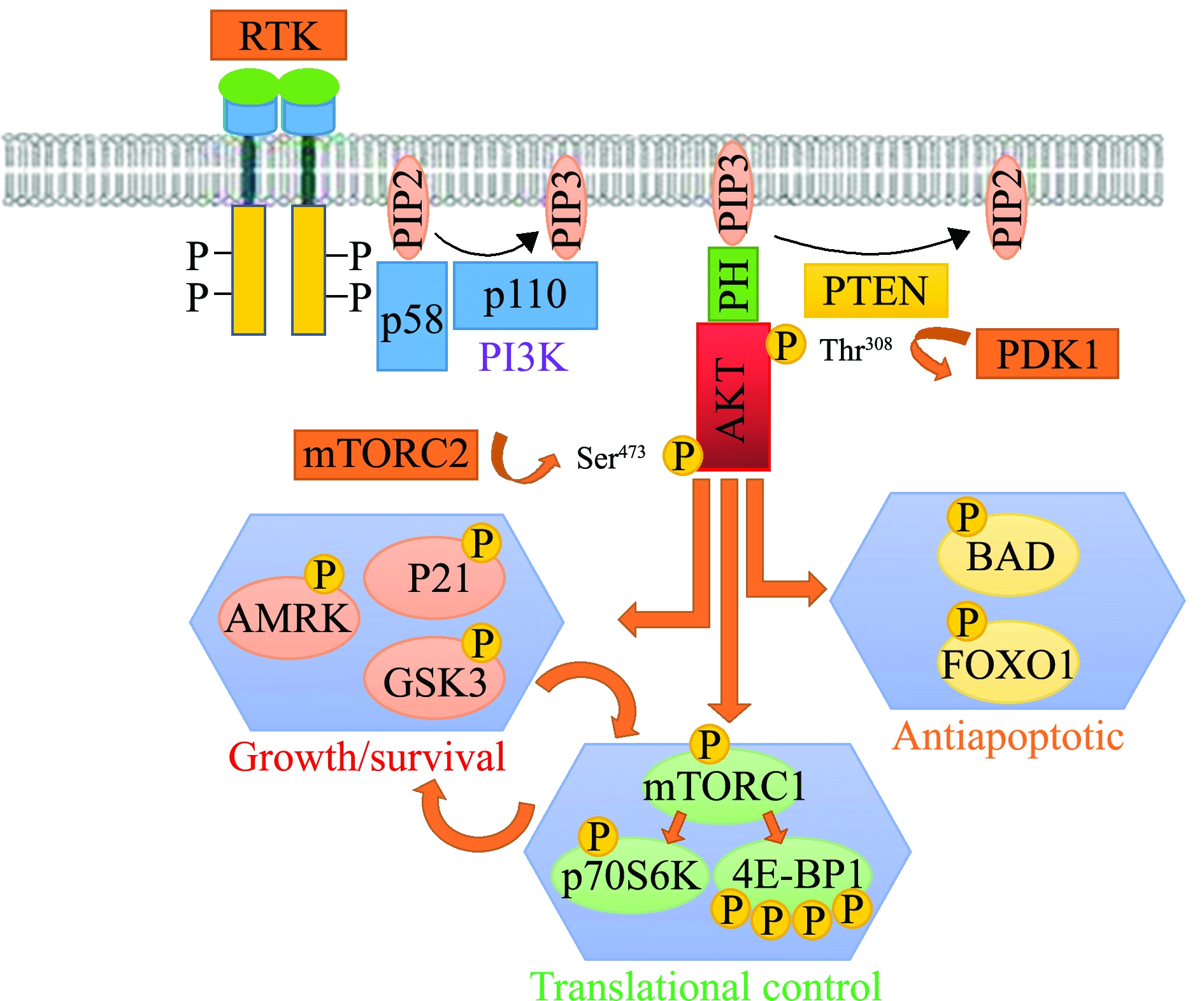
图2 Akt介导的经典信号通路(PI3K/Akt 通路,仿Dunn等[12] )
Fig.2 Akt-mediated classical signal pathway(PI3K/Akt pathway, from Dunn et al.[12])
2.3 水产动物Akt蛋白的生物学功能
研究证实,Akt蛋白可以通过磷酸化多种转录因子,参与机体的多种生命活动,在细胞代谢(cell metabolism)[20]、细胞增殖[24]、细胞凋亡(ap-optosis)[25]、细胞周期(cell cycle)[26]等多种生物学过程中发挥重要的调控作用。随着对水产动物Akt基因研究的不断深入,对于水产动物Akt蛋白生物功能的研究已逐渐成为人们关注的焦点。已有研究显示,水产动物Akt蛋白在鱼类的胚胎发育、甲壳类蜕壳和水产动物免疫防御等过程中均发挥重要调控作用。
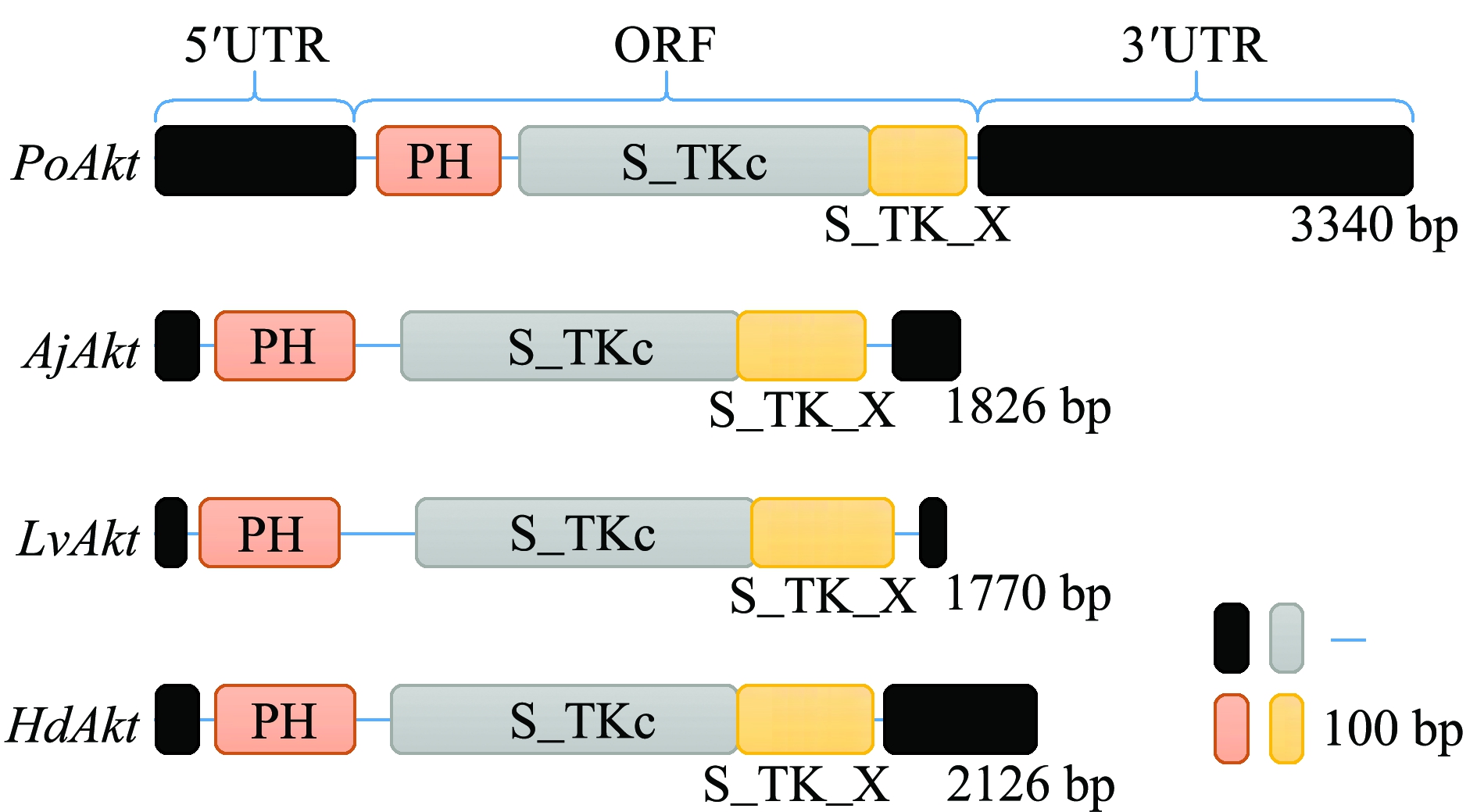
注:图中左侧PoAkt、AjAkt、LvAkt及HdAkt分别为牙鲆、刺参、凡纳滨对虾及九孔鲍的Akt基因结构。左侧黑色方框为5′非编码区,即5′UTR,右侧黑色方框为3′非编码区,即3′UTR,两个非编码区中间的序列为开放阅读框,即ORF。粉色方框为PH结构域,灰色方框为S_TKc结构域,黄色区域为S_TK_X结构域
Note: In the left side of the figure,PoAkt, AjAkt, LvAkt and HdAkt represent the Akt gene structure of Japanese flounder Paralichthys olivaceus,sea cucumber Apostichopus japonicus,Pacific white leg shrimp Litopenaeus vannamei and variously colored abalone Haliotis diversicolor, respectively. The black box on the left represents 5′UTR, and the black box on the right represents 3′UTR. The sequence between the two untranslated regions is the open reading frame, namely ORF. The pink box represents the PH domain, the gray box represents the S_TKc domain, and the yellow region represents the S_TK_X domain
图3 4种水产动物Akt基因结构的比较
Fig.3 Comparison of Akt gene structure in four species of aquatic animals
在调控水产动物胚胎发育方面,Chan等[5]利用化学遗传方法发现,可以通过增加Akt活性来防止药物诱导的内皮细胞凋亡,从而证实了Akt基因在斑马鱼胚胎血管生成过程中的生理作用。谌爽[6]研究发现,与对照组相比,注射过Akt1和Akt3的斑马鱼胚胎的脑部厚度和长度均明显增大,提示Akt基因的两种亚型——Akt1和Akt3可显著影响斑马鱼脑部的早期发育。此外,陈一飞[27]通过研究中国卤虫Artemia sinica胚胎滞育解除过程中Akt基因(AsAkt)的作用及表达模式发现,AsAkt在中国卤虫胚胎发育各时期的相对表达量不同,休眠卵解除滞育后AsAkt的表达量显著下调,而后逐渐上调,发育至拟成虫期后表达趋于稳定,这表明AsAkt在中国卤虫胚胎滞育解除过程中可能发挥重要作用。在调控水产动物耐低温应答方面,王金凤等[28]探讨了低温胁迫对斑马鱼、罗非鱼和草鱼3种鱼类PI3K/Akt/GSK-3β信号通路的影响,结果发现,3种鱼类的Akt蛋白在低温下呈现出不同的表达模式和规律,表明PI3K/Akt/GSK-3β信号通路在鱼类低温胁迫和适应中具有种间特异性。在调控水产动物蜕壳过程中的肌肉生长方面,田志环等[29]研究发现,Akt基因在中华绒螯蟹蜕壳过程中不同部位肌肉组织中的表达量变化与蜕壳周期密切相关,推测Akt基因可能参与调控中华绒螯蟹蜕壳所诱导的肌肉萎缩、生长和重建过程,同时发现PI3K/Akt/mTOR信号通路在肌肉生长或萎缩的分子机制中具有重要的调控作用,并揭示了Akt蛋白从一级序列到立体结构在中华绒螯蟹这类甲壳动物中同其在哺乳动物中一样都是高度保守的。在调控水产动物免疫防御方面,有研究发现,嗜水气单胞菌Aeromonas hydrophila 感染草鱼后,草鱼Akt1基因和Akt3基因在其肝脏中的相对表达量显著上升[30]。此外,刘荣雕[10]证实,凡纳滨对虾Akt基因不仅在对虾白斑综合症病毒(White Spot Syndrome Virus,WSSV)感染过程发挥重要的调控作用,其涉及的PI3K/Akt信号通路还是预防病毒感染的重要靶标,这对于对虾病毒疾病的分子预防和治疗具有重要意义。

注:图中动物由上至下依次为刺参(ATY93171.1)、凡纳滨对虾(AHY28871.1)、鳜鱼(ATA63306.1)、九孔鲍(AMY95372.1)、蓝海燕(BAB69974.1)、香港牡蛎(ALN96976.1)、牙鲆(AVA30830.1)、中华绒螯蟹(ARF20154.1)
Note: The species of animals from the top to the bottom are sea cucumber Apostichopus japonicus(ATY93171.1),Pacific white leg shrimp Litopenaeus vannamei(AHY28871.1), mandarin fish Siniperca chuatsi(ATA63306.1), variously colored abalone Haliotis diversicolor(AMY95372.1), starfish Asterina pectinifera(BAB69974.1), Hong Kong oyster Crassostrea hongkongensis(ALN96976.1), Japanese flounder Paralichthys olivaceus(AVA30830.1)and Chinese mitten handed crab Eriocheir sinensis(ARF20154.1)
图4 8种水产动物Akt蛋白的多序列比对结果
Fig.4 Multiple sequence alignment results of Akt protein of eight species of aquatic animals

注:图中黑线、黄色箭头和粉红色的圆柱体分别代表卷曲、折叠和螺旋。A为牙鲆Akt蛋白;B为刺参Akt蛋白;C为凡纳滨对虾Akt蛋白;D为九孔鲍Akt蛋白
Note: Black lines, yellow arrows and pink cylinders represent coils, strands and helices, respectively. A, Akt protein in Japanese flounder Paralichthys olivaceus; B, Akt protein in sea cucumber Apostichopus japonicus; C, Akt protein in Pacific white leg shrimp Litopenaeus vannamei; D, Akt protein in variously colored abalone Haliotis diversicolor
图5 4种水产动物Akt蛋白二级结构比较
Fig.5 Comparison of the secondary structure of Akt protein in four species of aquatic animals
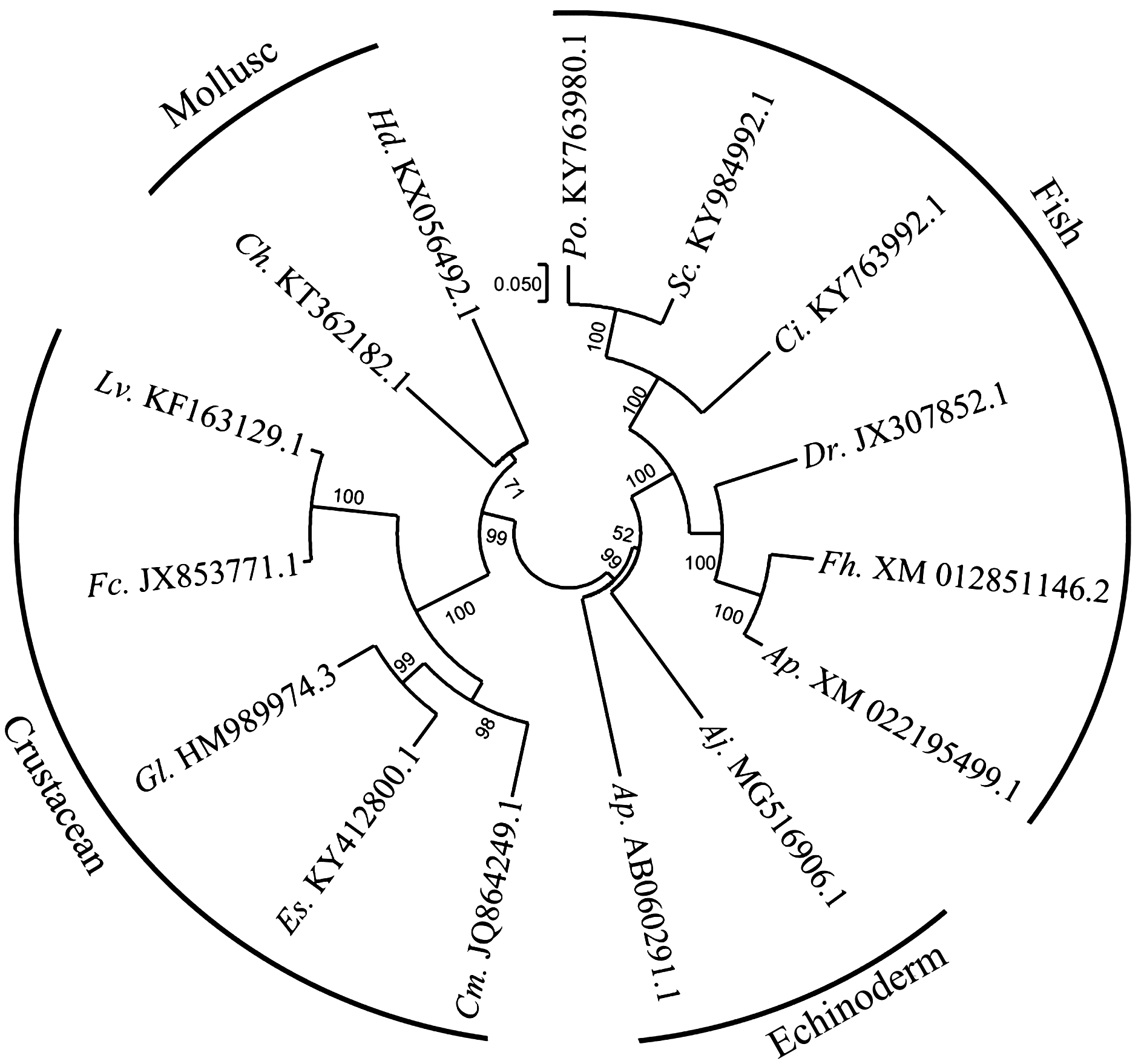
注:按照顺时针方向,Po.为牙鲆,Sc.为鳜鱼,Ci.为草鱼,Dr.为斑马鱼,Fh.为底鳉,Ap.为橙线雀,Aj.为刺参,Ap.为蓝海燕,Cm.为普通滨蟹,Es.为中华绒螯蟹,Gl.为黑背地蟹,Fc.为中国明对虾,Lv.为凡纳滨对虾,Ch.为香港牡蛎,Hd.为九孔鲍
Note: In clockwise order,Po.,Japanese flounder Paralichthys olivaceus; Sc.,mandarin fish Siniperca chuatsi; Ci.,grass carp Ctenopharyngodon idella;Dr.,zebrafish Danio rerio;Fh.,mummichog Fundulus heteroclitus;Ap.,spiny chromis damselfish Acanthochromis polyacanthus;Aj.,sea cucumber Apostichopus japonicus;Ap.,starfish Asterina pectinifera;Cm.,green crab Carcinus maenas;Es.,Chinese mitten handed crab Eriocheir sinensis;Gl.,blackback land crab Gecarcinus lateralis;Fc.Chinses shrimp Fenneropenaeus chinensis;Lv.,Pacific white leg shrimp Litopenaeus vannamei;Ch.,Hong Kong oyster Crassostrea hongkongensis; Hd.,variously colored abalone Haliotis diversicolor
图6 基于15种水产动物Akt基因核苷酸序列的系统进化分析
Fig.6 Phylogenetic analysis of nucleotide sequence of Akt gene in fifteen species of aquatic animals
3 展望
Akt是蛋白激酶家族的重要成员,作为主要的转录效应因子,Akt可在细胞增殖、细胞免疫应答、细胞代谢调控、细胞发育及存活等多种细胞过程中发挥重要作用。因此,进一步深入研究和理清水产动物Akt基因在水产动物生长发育、免疫防御等过程中所介导或参与的主要细胞通路及调控网络,不仅可为水产动物种质保护、分子辅助育种及病害防控提供一定的分子生物学基础数据,亦可进一步加深对水产动物蛋白激酶家族成员及其生物学功能的理解和认识。然而,目前对水产动物Akt基因及其生物学功能的相关研究仍处于起步阶段,已经公布Akt基因信息的水产动物种类仅占水产动物总数的0.3%左右,相当一部分水产动物,尤其是水产经济种类Akt基因的序列结构信息、时空表达特点、系统进化特征及生物学功能尚不清楚。此外,能够调控Akt基因表达的表观遗传调控因子(如非编码RNA等)信息仍然比较匮乏。因此,在今后的研究中,可以主要从以下三方面着手开展工作:第一,进一步利用同源克隆或基因组数据挖掘技术获得更多水产动物的Akt基因序列信息和结构信息,以便能够更为系统和全面地了解该基因在水产动物中的系统进化特点和规律;第二,深入探究不同生理、病理条件下,不同水产动物的Akt基因的时空表达规律,以及该基因与其下游靶基因的互作机制,进而了解和掌握不同水产动物中,该基因对不同生理、病理条件的响应规律;第三,进一步挖掘和筛选与水产动物Akt基因具有靶向调控作用的小RNA(microRNA,miRNA)、长链非编码RNA(long non-coding RNA,lncRNA)和环状RNA(circular RNA,circRNA)等表观遗传调控因子,探明这些表观调控因子与水产动物Akt基因间的相互作用方式及调控机制,为充分认识和利用水产动物的Akt 基因的生物学功能提供更为丰富的资料和线索。
[1] Bellacosa A,Testa J R,Staal S P,et al.A retroviral oncogene,Akt,encoding a serine-threonine kinase containing an SH2-like region[J].Science,1991,254(5029):274-277.
[2] Jones P F,Jakubowicz T,Pitossi F J,et al.Molecular cloning and identification of a serine/threonine protein kinase of the second-messenger subfamily[J].Proceedings of the National Academy of Sciences of the United States of America,1991,88(10):4171-4175.
[3] 周颖,王建,贺福初.蛋白激酶B(PKB/Akt)的结构、调控与功能[J].生命的化学,2006,26(3):226-228.
[4] 王维.P13K/Akt信号转导通路的研究进展[J].现代医药卫生,2010,26(7):1051-1052.
[5] Chan J,Bayliss P E,Wood J M,et al.Dissection of angiogenic signaling in zebrafish using a chemical genetic approach[J].Cancer Cell,2002,1(3):257-267.
[6] 谌爽.RKB/Akt在斑马鱼早期胚胎发育中的功能研究与分析[D].青岛:中国海洋大学,2010.
[7] 迟艳红,李诗豪,王冬冬,等.中国明对虾(Fenneropenaeus chinensis)Akt/PKB基因在病原刺激下的表达和功能分析[J].海洋与湖沼,2013,44(3):611-617.
[8] 王富轩.香港牡蛎(Crassostrea hongkongensis)Akt-FoxO信号通路相关基因的分子克隆与功能鉴定[D].北京:中国科学院大学,2016.
[9] Bottomley M J,Salim K,Panayotou G.Phospholipid-binding protein domains[J].Biochimica et Biophysica Acta,1998,1436(1-2):165-183.
[10] 刘荣雕.凡纳滨对虾免疫相关分子LVAKT与LVFLOT的初步研究[D].厦门:国家海洋局第三海洋研究所,2013.
[11] 徐丹丹,唐彦君,王桂华,等.Akt基因的研究进展[J].生物技术世界,2014(1):8.
[12] Dunn E F,Connor J H.HijAkt:the PI3K/Akt pathway in virus replication and pathogenesis[J].Progress in Molecular Biology and Translational Science,2012,106:223-250.
[13] Vasudevan K M,Garraway L A.AKT signaling in physiology and disease[M]//Rommel C,Vanhaesebroeck B,Vogt P K.Phosphoinositide 3-Kinase in Health and Disease.Berlin,Heidelberg:Springer,2010:105-133.
[14] Maehama T,Dixon J E.PTEN:a tumour suppressor that functions as a phospholipid phosphatase[J].Trends in Cell Biology,1999,9(4):125-128.
[15] Leslie N R,Downes C P.PTEN:the down side of PI 3-kinase signalling[J].Cellular Signalling,2002,14(4):285-295.
[16] 张海燕,孙红.Akt基因在上皮性卵巢癌组织中的表达及临床意义[J].现代妇产科进展,2014,23(12):964-967.
[17] 谢婧雯.Akt信号转导通路在心血管系统中作用的研究进展[J].重庆医学,2013,42(30):3692-3694.
[18] 晏淼,朱正秋.Akt/mTOR信号通路与恶性肿瘤[J].白求恩军医学院学报,2010,8(6):434-436.
[19] 杨运华.胰岛素抵抗对肝胰岛素PI3K/Akt/GSK-3信号传导通路的影响[J].黔南民族医专学报,2013,26(2):79-81,87.
[20] 迟毓婧,李晶,管又飞,等.PI3K-Akt信号传导通路对糖代谢的调控作用[J].中国生物化学与分子生物学报,2010,26(10):879-885.
[21] Lai K M V,Gonzalez M,Poueymirou W T,et al.Conditional activation of Akt in adult skeletal muscle induces rapid hypertrophy[J].Molecular and Cellular Biology,2004,24(21):9295-9304.
[22] 钟宇,王亚军,李娟.猪Akt1、Akt2基因克隆与组织表达图谱分析[J].四川大学学报:自然科学版,2014,51(2):365-370.
[23] 尚胜男,李开全,柳林,等.棘皮动物结合素研究进展[J].大连海洋大学学报,2018,33(1):113-122.
[24] Lawlor M A,Alessi D R.PKB/Akt:a key mediator of cell proliferation,survival and insulin responses?[J].Journal of Cell Science,2001,114:2903-2910.
[25] 胡明英,王晓莉,毕学辉,等.RNA干扰沉默AKT基因对卵巢癌SKOV3细胞增殖与凋亡影响研究[J].中华肿瘤防治杂志,2013,20(24):1869-1873.
[26] Liang Jiyong,Slingerland J M.Multiple roles of the PI3K/PKB (Akt) pathway in cell cycle progression[J].Cell Cycle,2003,2(4):339-345.
[27] 陈一飞.中国卤虫胚胎滞育解除过程中akt/pkb基因的作用及表达模式[D].大连:辽宁师范大学,2013.
[28] 王金凤,胡鹏,牛虹博,等.低温胁迫对鱼类PI3K/AKT/GSK-3β信号通路的影响[J].生物学杂志,2016,33(6):24-28.
[29] 田志环,焦传珍,成永旭,等.中华绒螯蟹Akt基因的cDNA克隆、序列分析及表达特征[J].水产学报,2018,42(4):485-494.
[30] 于鸿燕.草鱼三个PI3K/AKT通路相关基因的克隆和表达分析[D].上海:上海海洋大学,2015.