微藻具有丰富的生物多样性,是水生生态系统的重要组成部分[1],其不仅执行固碳和供给能量的功能,还具有净化水体的重要作用[2]。除此之外,微藻还是活性天然产物的重要来源生物,其所含有的活性物质种类繁多,包括多糖、蛋白、脂类、色素、甾醇等[3],目前,其商业化开发主要集中在脂类和色素两大方面[4],微藻中的多糖作为重要的天然产物尚未得以充分发掘利用。
已报道的微藻多糖生物活性包括抗肿瘤[5-7]、抗病毒[8-9]、调节免疫[10-11]、抗氧化[12-13]、抗菌[14-15]、抗炎[16]等诸多方面,对微藻多糖生物活性的深入研究将拓展海洋天然产物资源库,并推动相关的药物研发和功能食品开发。已有研究表明,微藻多糖的构成受许多条件影响,同一藻种以不同提取方法所得的多糖也会有所差别[5]。因此,对微藻多糖的提取和除蛋白处理方式进行考察,是探索其生物活性乃至确定其未来规模化制备工艺的必要前提。目前,关于金藻类的多糖研究主要集中在球等鞭金藻Isochrysis galbana和叉鞭金藻Dicrateriasp.[17-18],而对于湛江等鞭金藻Isochrysis zhanjianggensis这一经济藻种,仅有杨海波等[19]考察了添加甘油对该藻生长和多糖累积产量的影响,对于其多糖的组成和活性研究目前尚未见报道。本研究中,以湛江等鞭金藻为对象,考察了不同除蛋白方式所得多糖组分的差异,并以体外抗肿瘤活性为导向探索适宜的处理方法,旨在为微藻活性多糖的开发提供理论依据,同时推动微藻天然产物的综合加工与利用。
1 材料与方法
1.1 材料
试验用湛江等鞭金藻由中国科学院大连化学物理研究所海洋生物工程组提供。MCF-7(人乳腺癌)、HeLa(人宫颈癌)、SW480(人结肠癌)、HT29(人结肠癌)、HepG2(人肝癌)、A549(人肺癌)细胞株由中国科学院大连化学物理研究所提供。
主要试剂:McCoy’s 5A、MEM、DMEM高糖型、RPMI-1640培养基,小牛血清,3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT),二甲基亚砜(DMSO)均购于上海生工生物工程股份有限公司;Sephacryl S-100凝胶填料购于美国GE公司;蓝色葡聚糖(相对分子质量>2 000 000),相对分子质量为64 000~76 000、35 000~45 000、9000~11 000和1000的葡聚糖标准品,甘露糖、鼠李糖、半乳糖醛酸、葡萄糖醛酸、半乳糖、葡萄糖、木糖、阿拉伯糖、岩藻糖标准品均购于美国Sigma公司; KBr(光谱纯)购于国药集团化学试剂有限公司;色谱纯乙腈购于德国Meker公司;其余试剂为国产分析纯试剂。
主要仪器:iMark酶标仪(美国伯乐公司);BS224S电子天平(北京赛多利斯仪器系统有限公司);AC2-6S1生物安全柜(新加坡艺思高科技有限公司);LDZX-50KB型立式电热压力蒸汽灭菌器(上海申安医疗机械厂);Frontier傅立叶变换红外光谱仪(FT-IR) (美国珀金埃尔默股份有限公司);Agilent 1260高效液相色谱仪(美国安捷伦公司);GC-2014C气相色谱仪(日本岛津公司); KTA purifier UPC10全自动层析系统(美国通用公司); CO2细胞培养箱(美国热电公司)。
KTA purifier UPC10全自动层析系统(美国通用公司); CO2细胞培养箱(美国热电公司)。
1.2 方法
1.2.1 多糖提取及不同除蛋白方式的比较
(1)多糖提取。将冷冻的藻泥于室温下缓化,称取5 g于50 mL离心管中,加入20 mL 去离子水,以吸管吹吸抽提,于70 ℃下水浴20 min,再以10 000 r/min离心20 min,收集上清液。同样方法反复提取4次,在合并收集到的上清液(S)中加入5倍体积无水乙醇,4 ℃过夜。次日取出,以10 000 r/min 离心20 min,收集沉淀,得到多糖粗提物F。
(2)Sevag法除蛋白。取上述藻泥热水浸提后收集的上清液(S)各20 mL,加入5 mL Sevag试剂(氯仿与正丁醇的体积比为4∶1), 振荡15 min,4 ℃下以5000 r/min 离心10 min,收集上层清液;重复Sevag处理步骤,分别得到Sevag法处理1、2和3次的上清液,加入5倍体积乙醇,以10 000 r/min 离心20 min,收集沉淀,即为Sevag法处理1、2、3次的多糖样品,将各组沉淀定容至20 mL,用考马斯亮蓝法和硫酸苯酚法分别检测蛋白和总糖含量。[20]。
(3)TCA法除蛋白。取上述藻泥热水浸提后收集的上清液(S)各20 mL,加入100% TCA溶液使其终浓度分别为5%、10%和15%,45 ℃下水浴40 min,自然冷却后置4 ℃下过夜,以10 000 r/min离心20 min,取上清液与5倍体积的无水乙醇混合,再以10 000 r/min离心20 min,收集沉淀,分别得到5%、10%和15% TCA处理的多糖样品,各组沉淀分别定容至20 mL,用考马斯亮蓝法和硫酸苯酚法分别检测蛋白和总糖含量。
(4)多糖回收率和蛋白残留率的计算。根据硫酸苯酚法和考马斯亮蓝法的检测结果,分别计算两种除蛋白方式的多糖回收率和蛋白残留率。多糖回收率指样品除蛋白后的多糖总量与处理前多糖总量的比值,以处理前的总量为100%。蛋白残留率指除蛋白后的蛋白总量与处理前蛋白总量的比值,以去除前的总量为100%,蛋白残留率越高,表明清除效果越差。
1.2.2 3种多糖样品的基本成分测定 取Sevag法处理2次后的乙醇沉淀样品,加少量去离子水溶解后冷冻干燥,所得样品标记为FS。取10% TCA过夜处理后的乙醇沉淀样品,透析24 h后冷冻干燥,所得样品标记为FT。使用硫酸苯酚法检测FS、FT和多糖粗提物F中的总糖含量,使用氯化钡—明胶比浊法检测样品中的硫酸根含量[21]。
1.2.3 单糖组成检测 本试验中采用PMP-HPLC和气相色谱(GC)法相结合,分析计算样品中的各种单糖比例。
(1) PMP-HPLC法。甘露糖、鼠李糖、半乳糖醛酸、葡萄糖醛酸、半乳糖、葡萄糖和岩藻糖标准品的衍生和检测参见邢丽红等[22]的方法。样品前处理:3种多糖(F、FS和FT)于4 mol/L三氟乙酸中水解(100 ℃,6 h),之后于4 ℃下过夜。水解液使用NaOH调至中性,用PMP试剂衍生,氯仿抽提后取水相进行HPLC分析。液相色谱条件:色谱柱型号为Agilent ZORBAX Eclipse XDB C-18 (5 μm, 4.6 mm×250 mm);流动相A为含15%乙腈的0.05 mol/L KH2PO4(pH 6.9)溶液,流动相B为含40%乙腈的0.05 mol/L KH2PO4(pH 6.9)溶液;洗脱梯度为0 min, 100% A→10 min,85% A→55 min, 50% A;流速为1 mL/min,柱温30 ℃, 于250 nm波长下检测。根据标准品的摩尔吸光系数比值计算样品中各种单糖相对甘露糖的摩尔比。
(2) 气相色谱(TC)法。木糖、阿拉伯糖、甘露糖单糖组成采用糖醇乙酸酯衍生物气相色谱法,具体操作方法参见陈清花等[23]的报道。色谱柱使用OV-17毛细管柱(25 m×0.32 mm×25 μm),火焰离子化检测器 (FID),柱温为220 ℃。单糖标准品使用木糖、阿拉伯糖、甘露糖,计算3种多糖样品中木糖和阿拉伯糖相对于甘露糖的摩尔比。
1.2.4 FT-IR分析 称取F、FS和FT各1~2 mg,放入烘干箱( 85 ℃)干燥30 min,分别加入100 mg干燥KBr,混匀后放于玛瑙研钵中进行充分研磨,至颗粒度达200目左右时放入烘干箱中干燥2 h,用压片机压片,以空白KBr片为对照,在4000~400 cm-1波数范围扫描,得出各样品相应的谱图。
1.2.5 凝胶排阻层析 采用Sephacryl S-100凝胶填料,填充柱直径为1.0 cm,高度为35 cm;流动相为10 mmol/L Tris-HCl缓冲液(pH 8.0),流速为0.3 mL/min。将F、FS和FT各配制成2 mg/mL溶液,上样量为1 mL,使用 KTA purifier UPC10全自动层析洗脱。
KTA purifier UPC10全自动层析洗脱。
使用紫外检测器(UVD)于280 nm波长下检测;另使用RID-10A示差折光检测器(RID),通过流出液的折光系数变化反映洗脱情况。使用蓝色葡聚糖(相对分子质量>2 000 000)和相对分子质量区间分别位于64 000~76 000、35 000~45 000、9000~11 000和1000的葡聚糖作为标准品,按流出体积做标准曲线,依此计算F、FS和FT主要流出峰的相对分子质量范围。
1.2.6 体外抗肿瘤活性检测 选取6种肿瘤细胞株MCF-7、HeLa、SW480、HT29、HepG2和A549,其中HT29、HepG2和A549分别使用McCoy’s 5A、MEM和DMEM高糖培养基培养,其余细胞株使用RPMI-1640培养基培养,各种培养基中均加入10%小牛血清。取各细胞株对数期生长细胞,使用相应的培养基调整细胞浓度至2×105cells/mL,在96孔板上每孔接种100 μL。F、FS和FT3个样品使用相应培养基配制成3种浓度(2.00、0.40、0.08 mg/mL)的溶液,用0.22 μm无菌滤膜过滤,待96孔板中细胞接种约4 h贴壁后,各孔加入100 μL样品溶液,使得终浓度分别为1.00、0.20、0.04 mg/mL,每个浓度设5个平行孔,对照组添加等体积不含多糖的培养基,置于含5% CO2培养箱中,37 ℃下培养72 h;之后弃去各孔中培养基,加入150 μL含1 mg/mL MTT的PBS溶液,孵育4 h后弃上清,加入150 μL DMSO裂解,使用酶标仪双波长测定各孔吸光值,检测波长为570 nm,参比波长为630 nm。
以未添加多糖样品的对照组OD值为100%细胞活力,用多糖组样品OD值与对照组样品OD值的比值,计算各浓度下3种多糖样品组的细胞活力。
1.3 数据处理
试验数据用平均值±标准差(meas±S.D.)表示,采用SPSS 20.0 软件进行单因素方差分析(ANOVA)。抗肿瘤活性部分,与未加多糖的对照组比较采用独立样本t检验分析;采用Duncan法进行组间多重比较,显著性水平设为0.05。
2 结果与分析
2.1 不同除蛋白方式的效果比较
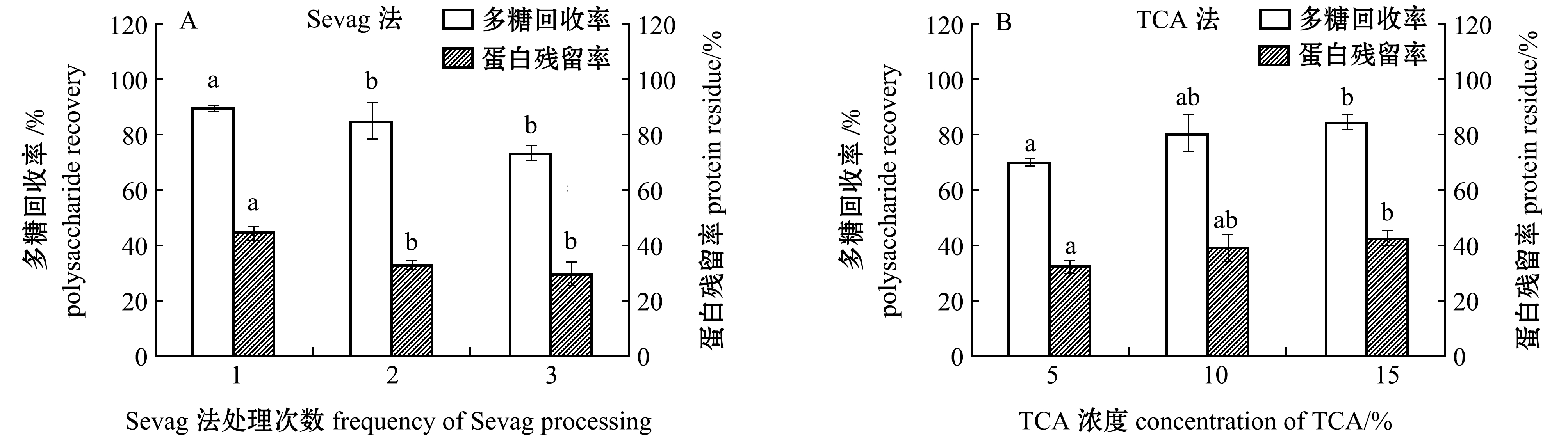
使用两种除蛋白方法,多糖的回收率和蛋白残留率如图1所示。用Sevag法处理后结果显示,随处理次数的增加多糖回收率和蛋白残留率逐渐降低,当处理1、2、3次时,多糖回收率分别为89.6%、84.9%和73.2%,蛋白残留率分别为44.5%、32.9%和29.5%(图1-A)。用TCA法处理后结果显示,随着TCA浓度的递增多糖回收率和蛋白残留率逐渐增加,当TCA浓度为 5%、10%、15%时,多糖回收率分别为69.8%、80.5%和84.3%,蛋白残留率分别为32.1%、38.9%和42.4%(图1-B)。综合考虑不同条件下两种方法的多糖回收率和蛋白残留率,选择Sevag法处理2次和10% TCA浓度两种条件进行后续的研究。
2.2 不同多糖组分的基本成分和单糖组成
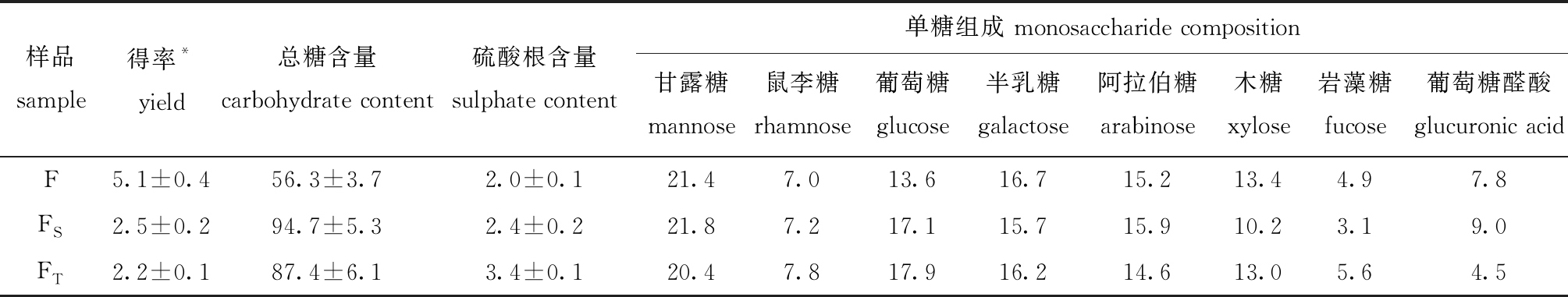
多糖粗提物F经过Sevag法和TCA法除蛋白后,得率均下降50%以上(表1),而FT由于经过了透析脱盐步骤,故得率较FS低。FT和FS中的总糖含量即碳水化合物含量比例的上升,反映了经除蛋白步骤后蛋白等杂质在样品中的相对含量下降,多糖相对含量增加。比较两种除蛋白方式,Sevag法的除蛋白效率略高于TCA法,FS中总糖含量较FT高,可达90%以上;而TCA法对硫酸根的保留效果较好。比较3个组分的单糖组成可知,经除蛋白步骤之后,FS和FT中的葡萄糖比例均明显上升,但比例下降的单糖各不相同。FS中比例下降≥1%的单糖种类为半乳糖、木糖和岩藻糖,而FT中比例下降的则为甘露糖和葡萄糖醛酸。单糖组成检测结果与硫酸根结果互相印证,由于多糖中的硫酸基团多集中于岩藻糖、鼠李糖和半乳糖,而在FS中岩藻糖和半乳糖的比例均下降,说明在Sevag法除蛋白的过程中损失了连接硫酸基团的两种单糖,因此,FS中硫酸根也未能较好保留。而TCA法去除蛋白过程中这几种单糖基本未损失,因此,硫酸根也得以充分保留。
注:同一指标下,标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同
Note:The means with different letters are significant differences in different groups at the 0.05 probability level, and the means with the same letters are not significant differences, et sequentia
图1 不同除蛋白方式的多糖回收率和蛋白残留率
Fig.1 Recovery rates of polysaccharide and the contents of protein residues using different deproteinizing methods
表1 F、FS和FT组分构成特征
Tab.1 Compositional characteristics of F, FSand FTfractions %
样品sample得率*yield 总糖含量carbohydrate content硫酸根含量sulphate content 单糖组成 monosaccharide composition甘露糖 mannose鼠李糖 rhamnose葡萄糖 glucose半乳糖 galactose阿拉伯糖 arabinose木糖 xylose岩藻糖 fucose葡萄糖醛酸 glucuronic acidF5.1±0.456.3±3.72.0±0.121.47.013.616.715.213.44.97.8FS2.5±0.294.7±5.32.4±0.221.87.217.115.715.910.23.19.0FT2.2±0.187.4±6.13.4±0.120.47.817.916.214.613.05.64.5
注:* 以藻干质量计
Note: *,relative to dry weight of alga
2.3 各组分的FT-IR分析
F、FS和FT的红外谱图如图2所示,各样品的主要峰位置相似。从图2可见:3300~3400 cm-1处的宽峰为多糖的O-H伸缩振动特征峰;2920~2930 cm-1处为C-H伸缩振动;1400~1430 cm-1处为甲基和亚甲基的C-H变角振动;1250 cm-1处为硫酸基团的吸收峰;1050~1070 cm-1处的强峰为C-O-H和C-O-C的伸缩振动。
3个样品相比较,FS和FT在1250 cm-1处吸收峰的相对强度较F均有增加,FT增加更为明显,反映了除蛋白后的样品中硫酸基团含量上升,这一结果与表1中硫酸根含量的检测结果相对应,是由于去除杂蛋白后硫酸多糖的相对含量上升的缘故。
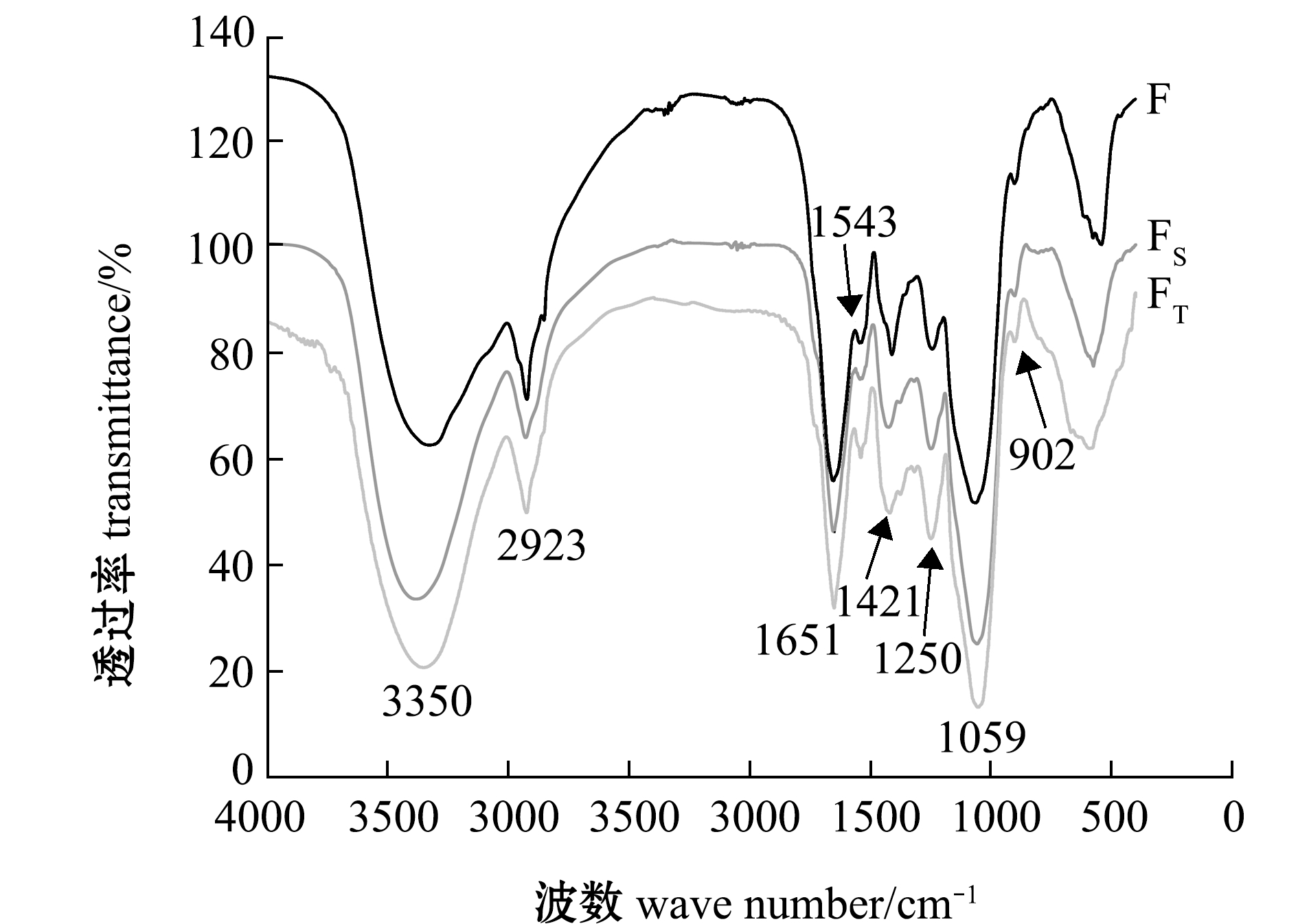
图2 F、FS和FT的FT-IR谱图
Fig.2 FT-IR spectra of F,FSand FT
2.4 各组分的凝胶排阻谱图分析
使用Sephacryl S-100凝胶柱对F、FS和FT进行层析,观察FT-IR谱图(图3)可知,示差折光检测器(RID)检测所得图谱与紫外检测器(UVD)在280 nm处检测所得谱图差别较大。示差折光检测器是通用型检测器,通过检测流出液折射率的变化反映洗脱情况;而使用紫外检测器在280 nm下检测,在分离生物大分子时可指示蛋白类和肽类。由于糖类物质难以使用紫外检测,因此,在等梯度洗脱时,示差折光检测器能更好地反映其组成。由RID和UVD谱图可知,F、FS和FT3个样品的洗脱谱图均可分为3个部分:一是出峰位置对应相对分子质量为70 000~90 000的部分,在RID和UVD谱图上均有出峰,但前者更明显,推测为较大相对分子质量蛋白和多糖组分混合出峰,或为蛋白多糖、凝集素组分;二是出峰位置对应相对分子质量为11 000~13 000的部分,在RID谱图上出峰不明显,但UVD紫外吸收较强,推测其含有蛋白或其他在紫外区有较强吸收的物质;三是相对分子质量在1400以下的部分,在UVD谱图上不明显,但RID检测有强吸收,其主要成分应为寡糖。比照F、FS和FT3个组分的谱图,可知不同除蛋白方式所去除的主要成分的差别:与F相比,FS主要表现为高相对分子质量(80 000~90 000)组分的损失,RID谱图中第一个流出峰峰高和相对比例减小,且出峰位置后移,相对分子质量降低,表明Sevag法去除的是以高相对分子质量为主的物质,可能包括混有的糖蛋白如凝集素等;而与F相比,FT主要表现为11 000~13 000(UVD谱图)成分的减少,以及小相对分子质量(<1400)寡糖成分的降低。FT中寡糖比例的降低主要是由透析造成的;而11 000~13000成分的降低应为TCA处理的结果,TCA除使蛋白沉淀外,其酸性环境会使多糖分子部分水解。此外,FT中80 000~90 000流出物与F相比出峰时间略有后移,表明10% TCA虽去除了部分相对分子质量较大的蛋白类化合物,但不及Sevag法去除的彻底;且由于FT中小相对分子质量物质的损失,使得70 000~90 000的组分在FT样品中所占的比例增加。
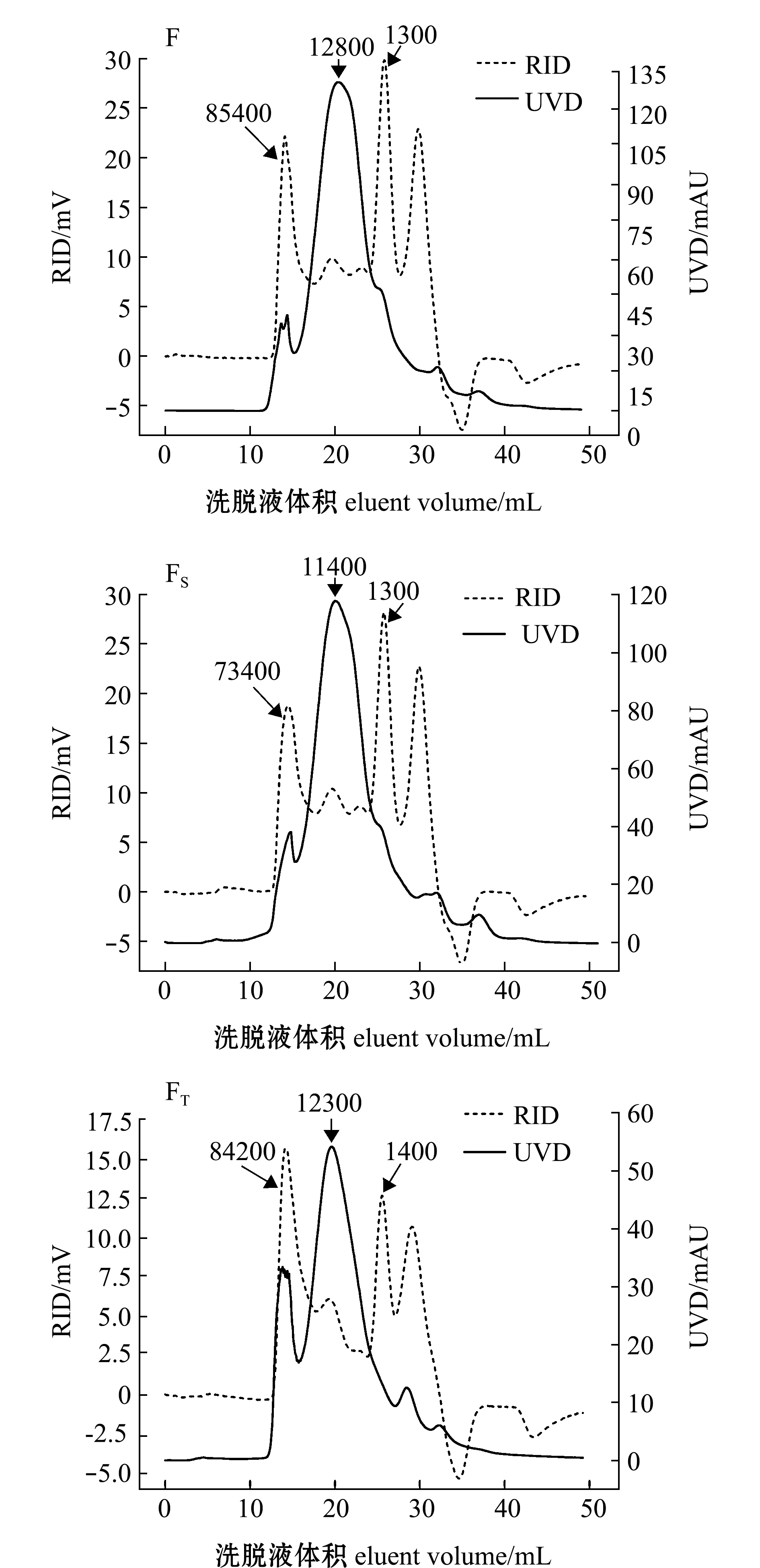
注:RID为示差折光检测器;UVD为紫外检测器(波长280 nm)
Note: RID, refractive index detector; UVD, UV detector analyzing at 280 nm
图3 F、FS和FT的Sephacryl S-100 层析谱图
Fig.3 Chromatograms of F,FSand FTby Sephacryl S-100
2.5 各组分的体外抗肿瘤活性比较
从图4可见,以未添加多糖的肿瘤细胞为对照组(所测得的平均吸光值为100%细胞活力),除Fs在0.04 mg/mL时HepG2细胞活力与对照组相比无显著性差异(P>0.05)之外,其余各样品在各浓度条件下对6种肿瘤细胞均具有显著抑制作用(P<0.05)。在6种肿瘤细胞中,湛江等鞭金藻多糖对MCF7、HeLa和HT29的抑制作用较好,3种多糖样品的高中低剂量组呈现出较好的剂量—效应关系,且效果最好的剂量组可使肿瘤细胞活力降至对照组的40%以下,1.00 mg/mL的FS可使MCF7和HT29细胞活性分别下降至对照组的30.4%和39.1%;1.00 mg/mL的FT可使MCF7、HeLa和HT29细胞活性分别下降至对照组的29.4%、39.6%和32.3%;而1.00 mg/mL的F也可使HT29活性下降至对照组的39.2%。
将相同浓度的F、FS和FT进行单因素方差分析,以表征不同除蛋白方法对肿瘤抑制活性的影响。统计结果表明:FT在1.00 mg/mL浓度下对6种肿瘤细胞的抑制作用均显著强于同浓度的F样品(P<0.05),在0.20 mg/mL浓度下对MCF7、HeLa、SW480、HT29和HepG2 5种细胞的抑制作用显著强于同浓度的F(P<0.05),在0.04 mg/mL浓度下对HeLa、HT29和A549 3种细胞的抑制作用显著强于同浓度的F样品(P<0.05),未发现FT在任一剂量下对任一细胞株的抑制作用弱于同浓度的F样品;而FS与同等剂量的F对比,只有4个剂量组的效果显著强于F,分别是1.00、0.20、0.04 mg/mL的FS对MCF7的作用(P<0.05),以及1.00 mg/mL的FS对A549的作用(P<0.05),FS另有7个剂量组虽与同浓度F有显著性差异(P<0.05),但抑制效果均弱于F(即细胞活力高于同浓度F,包括1.00、0.20 mg/mL浓度下对HeLa、SW480和HepG2 3种细胞,以及0.20 mg/mL浓度下对HT29的作用效果)。
综合上述结果可知,采用10% TCA除蛋白所得的样品FT体外对肿瘤细胞的抑制作用强于未除蛋白的F,而采用Sevag法除蛋白所得样品FS对肿瘤细胞的抑制作用整体来看弱于F。

注:*表示与对照组比较有显著性差异(P<0.05);同一浓度下,标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05)
Note:* indicates groups bearing a significant difference compared with control (P<0.05); the means with different letters are significant differences at the same concentration, at the 0.05 probability level, and the means with the same letters are not significant differences
图4 F、FS和FT不同浓度下体外对不同肿瘤细胞活力的抑制作用
Fig.4 In vitrocytotoxicity of F,FSand FTagainst tumor cells at different concentrations
3 讨论
3.1 不同除蛋白方法的作用效果比较
许多活性多糖和蛋白同属于水溶性大分子,在提取过程中易一同溶出,因此,多糖在提取之后需要经历除蛋白步骤。除蛋白的方法主要有3种:Sevag法、TCA法和酶法。3种方法各有局限性,Sevag法易导致较多的多糖损失,得率较低;TCA法易使多糖发生降解;酶法则在原体系中又加入了新的物质[24-25]。本研究中对Sevag和TCA两种除蛋白方式的考察结果和已有的报道规律相似,Sevag法除蛋白效率较高,TCA法导致部分成分水解。Sevag法处理后,半乳糖、木糖、岩藻糖的相对含量下降,硫酸根收率相对TCA法较低,且主要去除的是高相对分子质量(80 000~90 000)成分;而TCA法较多保留了高相对分子质量成分和硫酸根,但由于水解和透析损失了部分低相对分子质量组分,样品中甘露糖和葡萄糖醛酸相对含量下降。
3.2 抗肿瘤活性成分的来源分析
综合本研究中单糖组成、凝胶排阻层析和体外抗肿瘤的试验结果可知,Sevag与TCA两种处理方式由于去除的主要成分不同,导致产物的组成和活性不同。抗肿瘤活性整体表现为TCA组>未经处理粗提物>Sevag处理组。TCA法更多地保留了相对分子质量较大(80 000~90 000)的成分,而这一区间为Sevag法的主要清除对象。可以初步推测,湛江等鞭金藻中具有相对分子质量为80 000~90 000的含半乳糖、岩藻糖、木糖和硫酸根且与蛋白相关联的多糖;这种高相对分子质量成分在体外抗肿瘤活性中发挥了重要作用,在Sevag处理过程中被清除,但TCA法较好地保留了这一组分。另外,湛江等鞭金藻中具有相对分子质量较低的(<13 000)含甘露糖和葡萄糖醛酸的多糖,在TCA处理中由于水解和透析导致其损失,但此种多糖应与体外抗肿瘤活性无关。
关于微藻中高相对分子质量多糖具有抗肿瘤活性,在以往的研究中已有报道。Pugh等[26]从钝顶螺旋藻、水华束丝藻和蛋白核小球藻中分别分离出相对分子质量为100 000以上的多糖,3种多糖均水溶性良好、结构较复杂,主要单糖组成各不相同,但均具有激活巨噬细胞的作用,可使IL-1β和TNF-α表达上调,具有抗肿瘤治疗的巨大潜力。根据本试验结果初步推断,湛江等鞭金藻的抗肿瘤活性源于高相对分子质量组分,与上述文献报道相互印证,不同种属微藻的高相对分子质量多糖可能普遍具有抗肿瘤活性,应考虑作为有潜力的天然产物资源库加以开发。
4 结语
本研究中采用不同的除蛋白方式对湛江等鞭金藻多糖进行处理,发现所得的多糖样品在组成和活性上有所差异,但考虑到试验所用样品仍为粗多糖,不确定因素较多,需要进行更深入的分离纯化和抗肿瘤试验验证,以确定活性的来源。此外,Sevag法所使用的溶剂和振荡操作是否会导致多糖成分在水溶液中构象发生变化从而影响活性,也是值得探讨的方向。鉴于已有的试验结果,在未来多糖制备工艺的研究开发中,有必要以活性为导向加以实施,充分挖掘微藻多糖的活性价值,促进微藻综合利用技术的发展,推动实现商业化生产。
[1] 孔淮,王华,刘萱,等.两种微藻胞外分泌物与Fe(Ⅲ)、Cu(Ⅱ)对苯酚光解的影响[J].大连海洋大学学报,2015,30(4):386-390.
[2] 杨福利,李秀辰,白晓磊,等.小球藻脱氮除磷及其生物量增殖潜力的研究[J].大连海洋大学学报,2014,29(2):193-197.
[3] Raja R,Hemaiswarya S,Kumar N A,et al.A perspective on the biotechnological potential of microalgae[J].Critical Reviews in Microbiology,2008,34(2):77-88.
[4] 夏嵩,万凌琳,李爱芬,等.微藻生物质产品和生物活性物质的研究与开发[J].天然产物研究与开发,2014,26(3):463-469,453.
[5] 陈玮,刘启顺,李曙光,等.微藻多糖生物活性研究进展[J].中国海洋药物杂志,2012,31(3):55-60.
[6] Sun Liqin,Wang Ling,Zhou Yan.Immunomodulation and antitumor activities of different-molecular-weight polysaccharides fromPorphyridium cruentum[J].Carbohydrate Polymers,2012,87(2):1206-1210.
[7] Sun Liqin,Chu Jinling,Sun Zhongliang,et al.Physicochemical properties,immunomodulation and antitumor activities of polysaccharide fromPavlova viridis[J].Life Sciences,2016,144:156-161.
[8] Kim M,Yim J H,Kim S Y,et al.In vitroinhibition of influenza A virus infection by marine microalga-derived sulfated polysaccharide p-KG03[J].Antiviral Research,2012,93(2):253-259.
[9] Mustopa A Z,Lages A C,Ridwan M,et al.Purification and characterization of polysaccharide from microalgae btm 11 as inhibitor of hepatitis c virus rna helicase[J].Indonesian Journal of Pharmacy,2015,26(3):134-140.
[10] 周妍,王凌,孙利芹,等.5种海洋微藻多糖体外免疫调节活性的筛选[J].海洋通报,2010,29(2):194-198.
[11] Park J K,Kim Z H,Lee C G,et al.Characterization and immunostimulating activity of a water-soluble polysaccharide isolated fromHaematococcus lacustris[J].Biotechnology and Bioprocess Engineering,2011,16(6):1090-1098.
[12] 孙颖颖,王辉.球等鞭金藻胞外多糖的体外抗氧化活性和理化性质的初步分析[J].海洋科学,2013,37(5):45-49.
[13] 王凌,孙利芹,赵小惠.一种微藻多糖的理化性质及抗氧化和保湿活性[J].精细化工,2012,29(1):20-24,29.
[14] 陈晓清,郑怡,林雄平.二种微藻多糖与蛋白质提取物的抗菌活性[J].福建师范大学学报:自然科学版,2005,21(2):76-79.
[15] De Jesus Raposo M F,De Morais A M M B,De Morais R M S C.Influence of sulphate on the composition and antibacterial and antiviral properties of the exopolysaccharide fromPorphyridium cruentum[J].Life Sciences,2014,101(1-2):56-63.
[16] Wu Qinghua,Liu Lian,Miron A,et al.The antioxidant,immunomodulatory,and anti-inflammatory activities ofSpirulina:an overview[J].Archives of Toxicology,2016,90(8):1817-1840.
[17] 孙颖颖,周豹,徐深圳,等.球等鞭金藻胞内和胞外多糖的分离纯化及其抑菌活性[J].食品科学,2012,33(11):137-141.
[18] 周妍,王凌,孙利芹,等.叉鞭金藻多糖的分离纯化及体外抗氧化作用研究[J].烟台大学学报:自然科学与工程版,2010,23(4):289-293.
[19] 杨海波,王茜,曹旭鹏,等.甘油对湛江等鞭金藻生长及细胞内多糖累积的影响[J].水产科学,2015,34(8):485-490.
[20] DuBois M,Gilles K A,Hamilton J K,et al.Colorimetric method for determination of sugars and related substances[J].Analytical Chemistry,1956,28(3):350-356.
[21] 张惟杰.糖复合物生化研究技术[M].杭州:浙江大学出版社,1999.
[22] 邢丽红,祝纯静,孙伟红,等.柱前衍生-高效液相色谱法测定岩藻多糖的单糖及糖醛酸含量[J].中国渔业质量与标准,2011,1(1):64-69.
[23] 陈清花,李文权,张赛金,等.海洋微藻多糖组成的气相色谱分析[J].厦门大学学报:自然科学版,2003,42(4):495-498.
[24] 李洁琼,刘红全,袁莎.微藻多糖的研究进展[J].现代化工,2016,36(6):60-62.
[25] 汤梦瑶,王海波,祁艳霞,等.蛤类多糖的研究进展[J].大连海洋大学学报,2018,33(1):130-136.
[26] Pugh N,Ross S A,ElSohly H N,et al.Isolation of three high molecular weight polysaccharide preparations with potent immunostimulatory activity fromSpirulina platensis,Aphanizomenon flos-aquaeandChlorella pyrenoidosa[J].Planta Medica,2001,67(8):737-742.