亚硝酸态氮(NO2-N)是养殖水环境中常见的有毒污染物。目前,有关NO2-N对水生生物影响的研究多集中在鱼类[1-4]和虾蟹类[5-10],对海水贝类如方斑东风螺Babylonia areolata[11]、管角螺Hemifusus tuba[12]、皱纹盘鲍Haliotis discus hannaiIno[13]和日本海神蛤Panopea japonica[14]等也开展了相关研究。NO2-N在水中有HNO2和![]() 两种存在形式,不同形式的NO2-N毒性大小不同。当水温和盐度一定时,pH直接影响两者的分配比例,进而影响NO2-N的毒性[11,15-16]。
两种存在形式,不同形式的NO2-N毒性大小不同。当水温和盐度一定时,pH直接影响两者的分配比例,进而影响NO2-N的毒性[11,15-16]。
菲律宾蛤仔Ruditapes philippinarum(以下简称蛤仔),是中国单种产量最高的养殖贝类。贝类浮游幼虫较其他发育阶段对环境更敏感[17-18],幼贝养殖池塘中后期NO2-N容易积累,但有关NO2-N对蛤仔浮游幼虫和幼贝毒性的研究尚未见报道。为此,本研究中进行了NO2-N急性胁迫对蛤仔浮游幼虫存活和生长的影响,以及不同pH条件下NO2-N对蛤仔幼贝存活的影响试验,以期为完善蛤仔生态学理论及健康养殖技术提供数据参考。
1 材料与方法
1.1 材料
试验用蛤仔浮游幼虫壳长为(162.0±15.9)μm,壳高为(144.8±18.3)μm;试验用蛤仔幼贝壳长为9.4~10.3mm。
试验用水为大连市庄河近海(幼虫试验)和黑石礁近海(幼贝试验)经过沉淀和沙滤的海水。
1.2 方法
1.2.1 NO2-N对蛤仔浮游幼虫存活和生长的影响试验 试验期间各处理组水的pH为(8.00±0.20),盐度为23, 总铵态氮(包括![]() 和NH3-N,本研究中统一用TAN表示)为(0.274±0.026)mg/L,DO为(5.29±0.29)mg/L,水浴控温在(26.1±0.6)℃。
和NH3-N,本研究中统一用TAN表示)为(0.274±0.026)mg/L,DO为(5.29±0.29)mg/L,水浴控温在(26.1±0.6)℃。
试验在500 mL聚乙烯瓶中进行,装试验水300 mL。根据预试验,通过添加分析纯亚硝酸钠的方式设置7个NO2-N浓度组(以换水前后实测NO2-N浓度的平均值为真实值,下同),分别为(97.8±3.2)、(146.8±4.9)、(215.4±7.2)、(304.0±17.2)、(456.6±10.8)、(681.3±22.8)、(982.7±24.5)mg/L,另设一个不添加亚硝酸钠的对照组,实测NO2-N浓度为(0.084±0.060)mg/L。幼虫培育密度为3~4个/mL,试验期间不投饵,每天换水1次并测定幼虫密度,每两天在显微镜下测定1次壳长、壳高。存活率试验持续96 h,生长试验持续144 h。每个处理设2个重复。
1.2.2 不同pH条件下NO2-N对蛤仔幼贝的急性毒性试验 将幼贝于试验开始前暂养一周,暂养期间每天全量换水1次,水温为(21.0±1.1)℃,盐度为30,pH为7.97±0.07,TAN浓度为(0.027±0.003)mg/L。
试验设置7.2、7.6、8.0、8.4共4个pH组,每个pH下,在预试验基础上按等对数间距设5个NO2-N浓度组(表1),以不加NO2-N的天然海水为对照,试验设3个重复。试验在2 L玻璃烧杯中进行,装水1 L,每个烧杯放置30枚幼贝。试验持续96 h,期间不投饵,适当调整并维持pH稳定,每天全量换水1次,测定换水前后的NO2-N、DO、pH和水温等,并及时记录和剔除死亡个体。全部烧杯用A-0301型防爆潜水暖管(功率300 W)水浴控温在(19.9±0.3)℃。
表1 NO2-N对蛤仔幼贝毒性试验中的pH值和NO2-N浓度
Tab.1 pH values and NO2-N concentrations in toxicity test of nitrite nitrogen to larval Manila clamRuditapes philippinarum
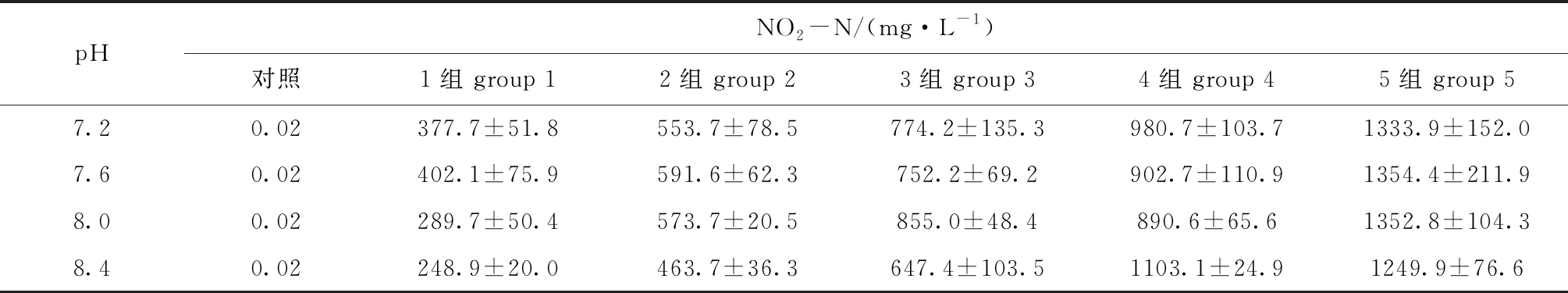
pHNO2-N/(mg·L-1)对照1组 group 12组 group 23组 group 34组 group 45组 group 57.20.02377.7±51.8553.7±78.5774.2±135.3980.7±103.71333.9±152.07.60.02402.1±75.9591.6±62.3752.2±69.2902.7±110.91354.4±211.98.00.02289.7±50.4573.7±20.5855.0±48.4890.6±65.61352.8±104.38.40.02248.9±20.0463.7±36.3647.4±103.51103.1±24.91249.9±76.6
1.2.3 水质指标的测定 按照《海洋监测规范》[19]进行测定。采用次溴酸盐氧化法、萘乙二胺分光光度法、光学折射盐度计、YSI550A型溶氧仪、PHS-3C型pH计和表层温度计分别测定TAN、NO2-N、盐度、溶氧、pH和水温。
1.2.4 半致死浓度、死亡率的测定与计算 采用概率单位法求半致死浓度(LC50),当线性关系不显著时,采用存活率50%附近且大于50%和小于50%的两个浓度按照概率单位法直线内插求LC50。安全浓度=96 h LC50×0.1。由于试验浮游幼虫为同一个批次,故采用各个时段的壳长和壳高作为生长指标。
校正死亡率=(试验组死亡率-对照组死亡率)/(1-对照组死亡率)×100%。
1.3 数据处理
试验结果用平均值±标准差(mean±S.D.)表示,采用SPSS 17.0软件进行单因素方差分析,采用Tukey法进行组间多重比较,显著性水平设为0.05。
2 结果与分析
2.1 NO2-N对蛤仔浮游期幼虫存活和生长的影响
从表2可见,胁迫96 h时,681.3、982.7 mg/L浓度组幼虫全部死亡。统计分析表明,各时段校正死亡率对应的概率单位(y)与NO2-N的浓度对数(x)呈直线正相关(P<0.05,图1),由此求得NO2-N对幼虫72、96 h LC50依次为598.0、160.5 mg/L,安全浓度为16.0 mg/L。
从表3可见:随着NO2-N浓度的增加,各时段浮游幼虫的壳长和壳高均呈下降趋势;胁迫48 h时,97.8、146.8 mg/L浓度组幼虫的壳长和壳高均与对照组无显著性差异(P>0.05),胁迫96 h和144 h时,各浓度组的壳长和壳高均显著低于对照组(P<0.05);97.8 mg/L浓度条件下胁迫96 h时,壳长和壳高分别较对照组显著下降10.0%和11.3%(P<0.05),胁迫144 h时壳长和壳高分别较对照组显著下降14.9%和14.7%(P<0.05)。这表明,随着胁迫时间的延长,NO2-N对幼虫生长的负面影响增大。
表2 不同NO2-N浓度下蛤仔浮游幼虫的死亡率
Tab.2 Mortality of planktonic larvae of Manila clamRuditapes philippinarumat different concentrations of NO2-N
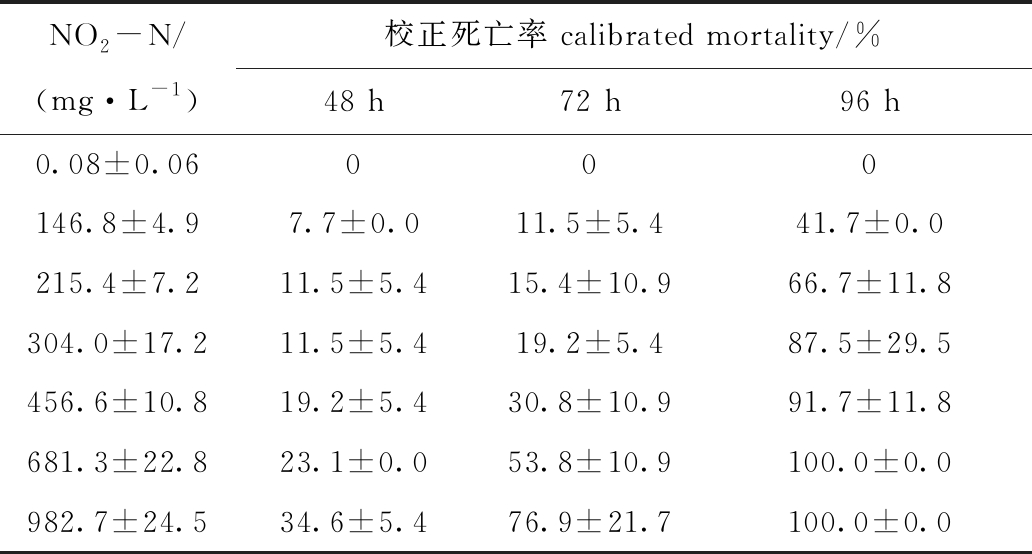
NO2-N/(mg·L-1)校正死亡率 calibrated mortality/%48 h72 h96 h0.08±0.06000146.8±4.97.7±0.011.5±5.441.7±0.0215.4±7.211.5±5.415.4±10.966.7±11.8304.0±17.211.5±5.419.2±5.487.5±29.5456.6±10.819.2±5.430.8±10.991.7±11.8681.3±22.823.1±0.053.8±10.9100.0±0.0982.7±24.534.6±5.476.9±21.7100.0±0.0
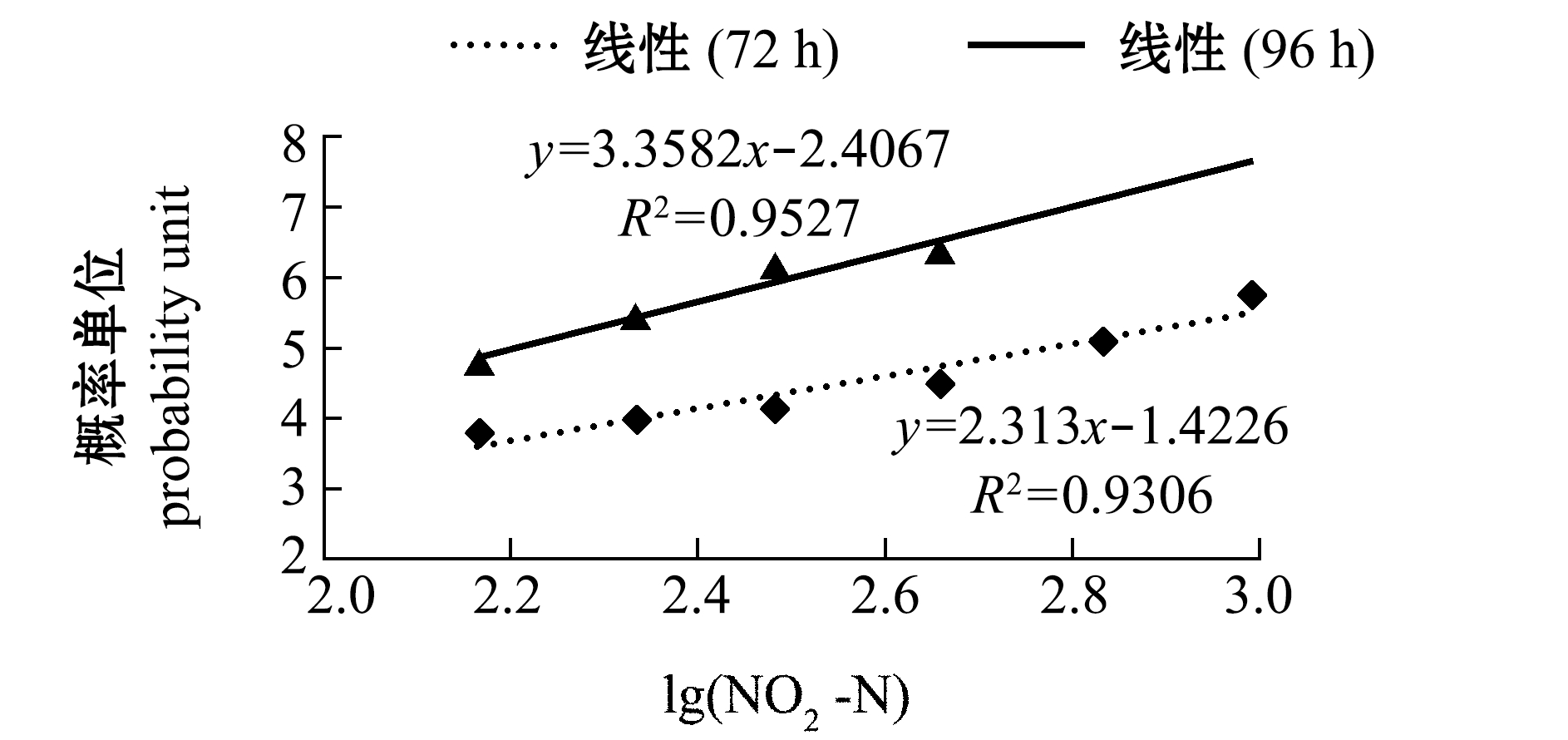
图1 NO2-N浓度对数与蛤仔浮游幼虫死亡概率单位的关系(72 h和96 h)
Fig.1 Relationship between the logarithm of NO2-N concentration and the probability unit of larval mortality in Manila clamRuditapes philippinarum(72 h and 96 h)
表3 不同NO2-N浓度下蛤仔浮游幼虫的壳长和壳高
Tab.3 Shell length and shell height of planktonic larvae of Manila clamRuditapes philippinarumat different concentrations of NO2-Nμm
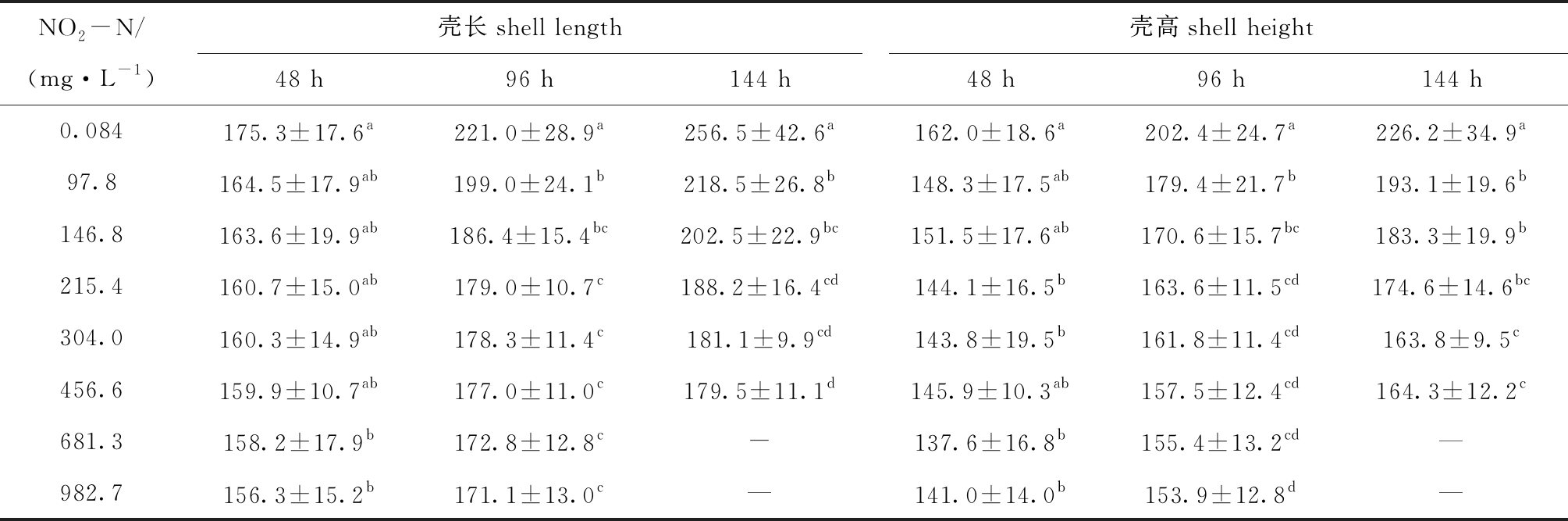
NO2-N/(mg·L-1)壳长shell length壳高shell height48 h96 h144 h48 h96 h144 h0.084175.3±17.6a221.0±28.9a256.5±42.6a162.0±18.6a202.4±24.7a226.2±34.9a97.8164.5±17.9ab199.0±24.1b218.5±26.8b148.3±17.5ab179.4±21.7b193.1±19.6b146.8163.6±19.9ab186.4±15.4bc202.5±22.9bc151.5±17.6ab170.6±15.7bc183.3±19.9b215.4160.7±15.0ab179.0±10.7c188.2±16.4cd144.1±16.5b163.6±11.5cd174.6±14.6bc304.0160.3±14.9 ab178.3±11.4c181.1±9.9cd143.8±19.5b161.8±11.4cd163.8±9.5c456.6159.9±10.7ab177.0±11.0c179.5±11.1d145.9±10.3ab157.5±12.4cd164.3±12.2c681.3158.2±17.9b172.8±12.8c-137.6±16.8b155.4±13.2cd—982.7156.3±15.2b171.1±13.0 c—141.0±14.0b153.9±12.8d—
注:同列中标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同
Note:The means with different letters within the same column are significant differences among the group at the 0.05 probability level, and the means with the same letters within the same column are not significant differences, et sequentia
2.2 不同pH条件下NO2-N对蛤仔幼贝的急性毒性
急性毒性试验期间,全部对照组幼贝均无死亡。
2.2.1 pH 7.2时NO2-N对蛤仔幼贝的毒性 从表4可见:当NO2-N浓度≥980.7 mg/L时,24 h内蛤仔幼贝全部死亡;浓度为 553.7、774.2 mg/L时,72 h时蛤仔幼贝全部死亡。将浓度取对数,死亡率换算成概率单位(下同),通过直线内插法求得pH为7.2时,NO2-N对蛤仔幼贝的24 h LC50为573.8 mg/L,48 h LC50为514.6 mg/L。
2.2.2 pH 7.6时NO2-N对蛤仔幼贝的毒性 从表5可见:NO2-N浓度为902.7 mg/L及以上时,幼贝24 h内全部死亡;浓度为 752.2 mg/L及以下时,幼贝96 h内均有存活。用概率单位法直线内插求出NO2-N对幼贝的24、48、72、96 h LC50依次为723.3、673.6、533.6、497.0 mg/L。
表4 pH为7.2时NO2-N对蛤仔幼贝的毒性
Tab.4 Toxicity of NO2-N to juvenile Manila clamRuditapes philippinarumat pH 7.2
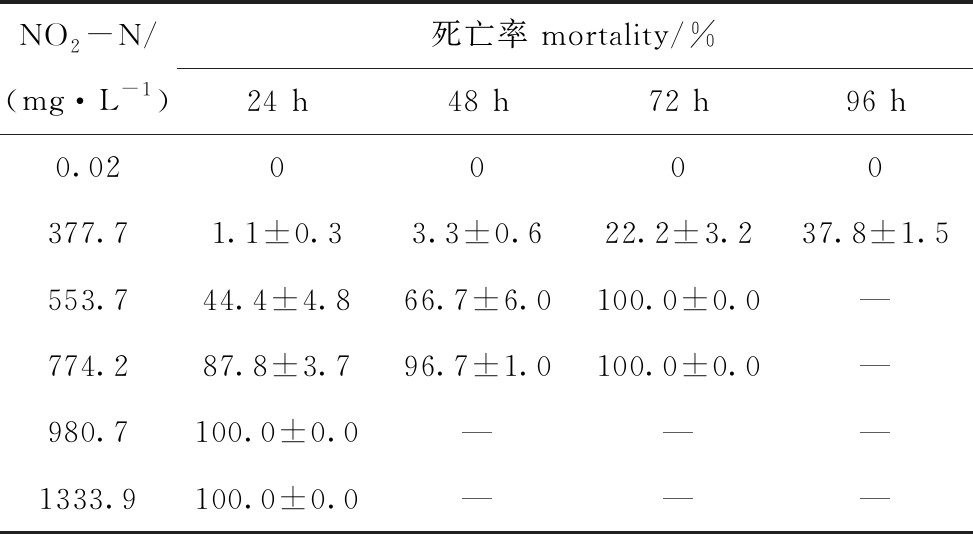
NO2-N/(mg·L-1)死亡率 mortality/%24 h48 h72 h96 h0.020000377.71.1±0.33.3±0.622.2±3.237.8±1.5553.744.4±4.866.7±6.0100.0±0.0—774.287.8±3.796.7±1.0100.0±0.0—980.7100.0±0.0———1333.9100.0±0.0———
2.2.3 pH 8.0时NO2-N对蛤仔幼贝的毒性 从表6可见:NO2-N浓度为289.7 mg/L时,蛤仔幼贝96 h内均存活;浓度为890.6 mg/L时,96 h时全部死亡;浓度为1352.7 mg/L时,72 h时全部死亡。根据浓度对数和死亡概率单位内插法求得NO2-N对蛤仔幼贝的24、48、72、96 h LC50依次为889.8、870.6、742.1、628.1 mg/L。
表5 pH为7.6时NO2-N对蛤仔幼贝的毒性
Tab.5 Toxicity of NO2-N to juvenile Manila clamRuditapes philippinarumat pH 7.6
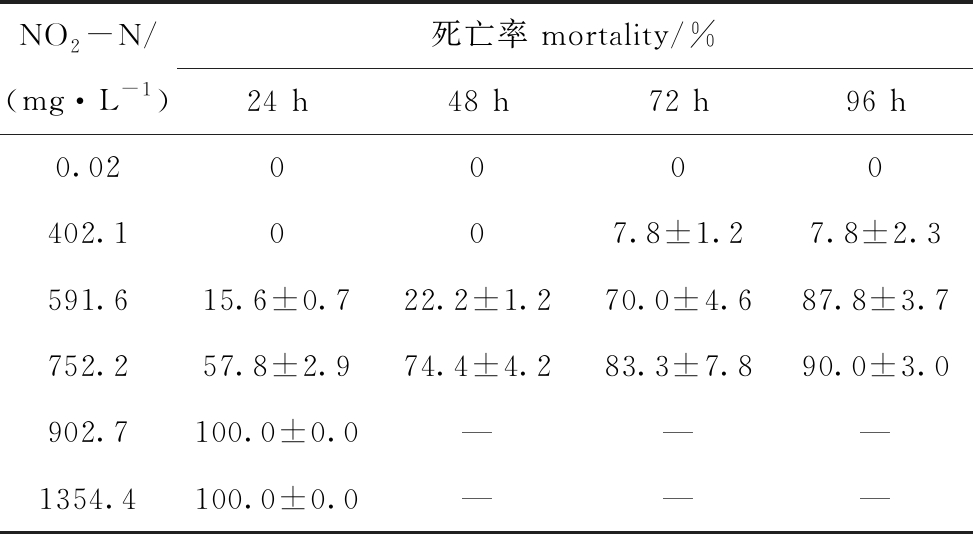
NO2-N/(mg·L-1)死亡率 mortality/%24 h48 h72 h96 h0.020000402.1007.8±1.27.8±2.3591.615.6±0.722.2±1.270.0±4.687.8±3.7752.257.8±2.974.4±4.283.3±7.890.0±3.0902.7100.0±0.0———1354.4100.0±0.0———
表6 pH为8.0时NO2-N对蛤仔幼贝的毒性
Tab.6 Toxicity of NO2-N to juvenile Manila clamRuditapes philippinarumat pH 8.0
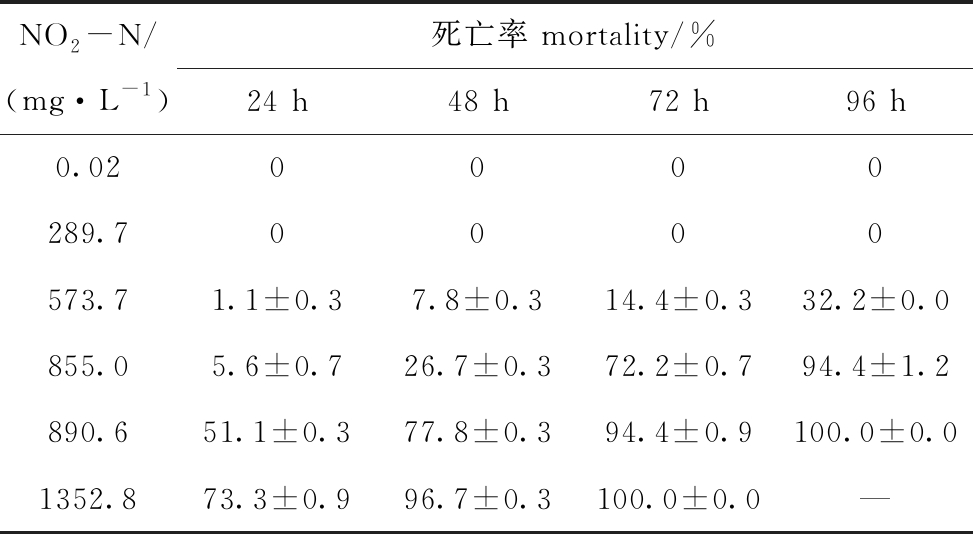
NO2-N/(mg·L-1)死亡率 mortality/%24 h48 h72 h96 h0.020000289.70000573.71.1±0.37.8±0.314.4±0.332.2±0.0855.05.6±0.726.7±0.372.2±0.794.4±1.2890.651.1±0.377.8±0.394.4±0.9100.0±0.01352.873.3±0.996.7±0.3100.0±0.0—
2.2.4 pH 8.4时NO2-N对蛤仔幼贝的毒性 从表7可见,受试96 h时,全部试验组均有幼贝存活。直线回归发现,96 h时浓度对数(x)和概率单位(y)直线正相关(P<0.01),线性方程为y=3.1892x-4.6509(R2=0.9462,n=5),由此求出NO2-N对蛤仔幼贝的96 h LC50为1062.0 mg/L。
表7 pH为8.4时NO2-N对蛤仔幼贝的毒性
Tab.7 Toxicity of NO2-N to juvenile Manila clamRuditapes philippinarumat pH 8.4
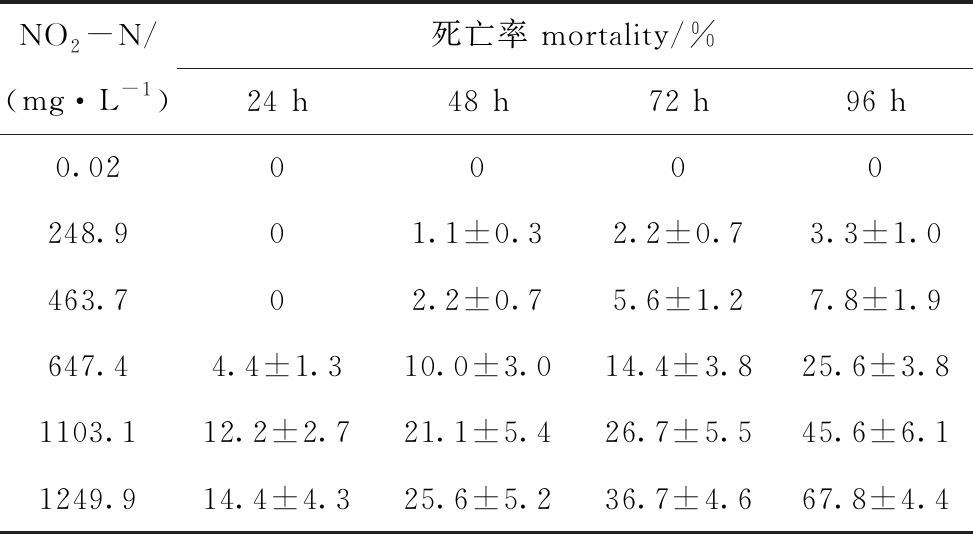
NO2-N/(mg·L-1)死亡率 mortality/%24 h48 h72 h96 h0.020000248.901.1±0.32.2±0.73.3±1.0463.702.2±0.75.6±1.27.8±1.9647.44.4±1.310.0±3.014.4±3.825.6±3.81103.112.2±2.721.1±5.426.7±5.545.6±6.11249.914.4±4.325.6±5.236.7±4.667.8±4.4
3 讨论
3.1 蛤仔浮游幼虫和幼贝对NO2-N的耐受能力
本试验表明,在pH 8.0条件下,NO2-N对壳长为(162.0±15.9)μm蛤仔浮游幼虫的96 h LC50为160.5 mg/L(表3,图1),推测安全浓度为16.0 mg/L;NO2-N对9.4~10.3 mm蛤仔幼贝的96 h LC50为628.1 mg/L(表6),推测安全浓度为62.8 mg/L,远大于蛤仔浮游幼虫。本研究中连续2年对海蜇-蛤仔-对虾混养池塘的水质监测结果表明,养殖期间NO2-N含量平均为(0.237±0.220)mg/L(2014年)和(0.317±0.235)mg/L(2015年),最大值均小于1 mg/L(未发表);李卓佳等[20]对凡纳滨对虾海水高位池养殖水体理化因子变化的研究发现,养殖后期NO2-N最高能达到1~2 mg/L,绝大多数时间小于0.5 mg/L;天然海水的NO2-N本底值更低。综合存活率和生长的试验结果可知,无论是在蛤仔幼体培育期间还是在海水养殖池塘中混养蛤仔,NO2-N均不会成为影响其生存的主要因子。研究表明,贝类孵化期和小规格浮游幼虫对TAN[14,17-18]和NO2-N[14]更敏感,本试验中所用蛤仔浮游幼虫为接近变态期的较大规格幼虫,NO2-N对受精卵孵化率及小规格浮游幼虫存活和生长的影响有待进一步研究。
3.2 蛤仔幼贝对NO2-N耐受能力与其他贝类的比较
受试验条件和发育阶段的影响,不同物种间的耐受能力较难相互比较。几种贝类相近试验条件下的96 h LC50见表8,其对NO2-N耐受能力依次为蛤仔幼贝(628.1 mg/L)>管角螺稚贝(254 mg/L)[12]>方斑东风螺幼贝(162 mg/L)[11]>日本海神蛤幼贝(112.8 mg/L)[14]。一般情况下,底栖的水质环境好于埋栖环境。管角螺和方斑东风螺营底栖生活,日本海神蛤营埋栖生活但双壳闭合时不能将肉体完全包裹。蛤仔营埋栖生活且双壳闭合紧密,对水质较差埋栖环境的长期适应及双壳紧闭的保护作用可能是其耐受能力较强的主要原因之一。
3.3 pH对NO2-N毒性的影响
不同pH条件下,NO2-N对蛤仔幼贝在24、48、72、96 h时的LC50均表现为pH 8.4>pH 8.0>pH 7.6>pH 7.2(表4~表7),pH 8.4时的96 h LC50(1062.0 mg/L)约为pH 8.0时(628.1 mg/L)的1.7倍。说明随着pH的升高,NO2-N对蛤仔幼贝的毒性逐渐下降。该结论与郭增华等[11]对方斑东风螺的研究,以及Russo等[16]对虹鳟的研究结果一致。原因可能是亚硝酸为弱酸,在水中存在如下电离平衡:
表8 NO2-N对几种贝类的96 h LC50
Tab.8 96 h LC50of NO2-N in several shellfishes

受试生物test species壳长shell length/cm温度temperature/℃pH96 h LC50/(mg·L-1)文献reference方斑东风螺Babylonia areolata0.529±18.1162.0郭增华等[11]管角螺Hemifusus tuba0.12228.5±0.58.0254.0罗杰等[12]日本海神蛤Panopea japonica1.019.88.03112.8王晔[14]蛤仔Ruditapes philippinarum(幼虫)0.0162±0.001626.1±0.68.0160.0本研究蛤仔Ruditapes philippinarum(幼贝)0.94~1.03 20.08.0628.1本研究
而不同形式的NO2-N毒性大小可能不同。HNO2较离子态的![]() 更容易穿过细胞膜,从而对生物毒性更强[21]。当pH升高时,HNO2占总NO2-N的比例减小,从而使总的NO2-N毒性下降。因此,在水产养殖过程中维持较高的pH对于降低NO2-N毒害作用有利。
更容易穿过细胞膜,从而对生物毒性更强[21]。当pH升高时,HNO2占总NO2-N的比例减小,从而使总的NO2-N毒性下降。因此,在水产养殖过程中维持较高的pH对于降低NO2-N毒害作用有利。
25 ℃时,HNO2的电离平衡常数为4.6×10-4,忽略盐度的影响,以96 h为例,用该电离平衡常数可以计算出不同pH下NO2-N的LC50所对应的![]() 和HNO2含量,结果如表9所示。
和HNO2含量,结果如表9所示。
表9 HNO2和![]() 对蛤仔幼贝的96 h LC50
对蛤仔幼贝的96 h LC50
Tab.9 96 h LC50of HNO2and![]() in juvenile Manila clamRuditapes philippinarum
in juvenile Manila clamRuditapes philippinarum

pH96 h LC50/(mol·L-1)NO2-NHNO2NO-27.63.55×10-21.93×10-63.55×10-28.04.49×10-20.98×10-64.49×10-28.47.59×10-20.66×10-67.59×10-2
为了方便计算和讨论,根据毒物联合毒性的基本原理[22],假设![]() 和HNO2对蛤仔幼贝均有毒性,且两者的联合毒性符合加和性原理。设HNO2单独存在时对蛤仔幼贝的LC50值为
和HNO2对蛤仔幼贝均有毒性,且两者的联合毒性符合加和性原理。设HNO2单独存在时对蛤仔幼贝的LC50值为![]() 单独存在时对蛤仔幼贝的LC50值为y,则在无其他毒物存在时得到如下方程:
单独存在时对蛤仔幼贝的LC50值为y,则在无其他毒物存在时得到如下方程:
其中,ρHNO2和![]() 分别为总NO2-N的LC50中HNO2和
分别为总NO2-N的LC50中HNO2和![]() 的含量(表9)。将上式变换可得如下方程:
的含量(表9)。将上式变换可得如下方程:
即ρHNO2和![]() 符合线性关系。室内试验表明,pH 从8.0突变至7.6时,蛤仔幼贝的存活率较突变至8.4时下降较多,考虑到pH为 7.6时可能对蛤仔幼贝有不利影响,故以pH 8.0和8.4两组数据来作图得到如下方程:
符合线性关系。室内试验表明,pH 从8.0突变至7.6时,蛤仔幼贝的存活率较突变至8.4时下降较多,考虑到pH为 7.6时可能对蛤仔幼贝有不利影响,故以pH 8.0和8.4两组数据来作图得到如下方程:
由此可求出,![]() 的96 h LC50约为HNO2的105倍,可见HNO2的毒性远大于
的96 h LC50约为HNO2的105倍,可见HNO2的毒性远大于![]()
[1] 徐勇,张修峰,曲克明,等.不同溶氧条件下亚硝酸盐和氨氮对半滑舌鳎的急性毒性效应[J].海洋水产研究,2006,27(5):28-33.
[2] 郑乐云.氨氮和亚硝酸盐对斜带石斑鱼苗的急性毒性效应[J].海洋科学,2012,36(5):81-86.
[3] Zhang L,Xiong D M,Li B,et al.Toxicity of ammonia and nitrite to yellow catfish(Pelteobagrus fulvidraco)[J].Journal of Applied Ichthyology,2012,28(1):82-86.
[4] Medeiros R S,Lopez B A,Sampaio L A,et al.Ammonia and nitrite toxicity to false clownfishAmphiprion ocellaris[J].Aquaculture International,2016,24(4):985-993.
[5] 臧维玲,江敏,张建达,等.亚硝酸盐和氨对罗氏沼虾幼体的毒性[J].上海水产大学学报,1996,5(1):15-22.
[6] 姚庆祯,臧维玲,戴习林,等.亚硝酸盐和氨对凡纳滨对虾和日本对虾幼体的毒性作用[J].上海水产大学学报,2002,11(1):21-25.
[7] 胡贤德,孙成波,王平,等.不同盐度条件下亚硝酸氮对斑节对虾的毒性影响[J].沈阳农业大学学报:自然科学版,2009,40(1):103-106.
[8] 彭自然,臧维玲,高杨,等.氨和亚硝酸盐对凡纳滨对虾幼虾的毒性影响[J].上海水产大学学报,2004,13(3):274-278.
[9] Seneriches-Abiera M L,Parado-Estepa F,Gonzales G A.Acute toxicity of nitrite to mud crabScylla serrata(Forsskål) larvae[J].Aquaculture Research,2007,38(14):1495-1499.
[10] Gomes R S Jr,de Lima J P V,Cavalli R O,et al.Acute toxicity of ammonia and nitrite to painted river prawn,Macrobrachium carcinus,larvae[J].Journal of the World Aquaculture Society,2016,47(2):239-247.
[11] 郭增华,王秋燕.亚硝酸盐氮对方斑东风螺毒性的研究[J].海洋水产研究,2006,27(6):88-92.
[12] 罗杰,陈加辉,刘楚吾.管角螺稚贝对亚硝酸盐耐受力研究[J].南方水产科学,2011,7(2):42-48.
[13] 谭烨辉,杨凤,雷衍之.总氨、亚硝酸氮及养鲍污水对皱纹盘鲍生长的影响[J].大连水产学院学报,2003,18(3):204-209.
[14] 王晔.pH、氨态氮和亚硝酸态氮对日本海神蛤Panopea japonica早期发育和生长的影响[D].大连:大连海洋大学,2016.
[15] Chen J C,Cheng S Y.Recovery ofPenaeus monodonfrom functional anaemia after exposure to sublethal concentration of nitrite at different pH levels[J].Aquatic Toxicology,2000,50(1-2):73-83.
[16] Russo R C,Thurston R V,Emerso K.Acute toxicity of nitrite to rainbow trout (Salmo gairdneri):effects of pH,nitrite species,and anion species[J].Canadian Journal of Fisheries and Aquatic Sciences,1981,38(4):387-393.
[17] 韩天坤,杨凤,贾甲,等.总氨态氮对菲律宾蛤仔早期生长发育的影响[J].大连海洋大学学报,2018,33(2):210-216.
[18] 袁洪梅,杨长奎,杨凤,等.总氨态氮对海湾扇贝幼体存活和生长的影响[J].大连海洋大学学报,2017,32(3):268-274.
[19] 国家海洋局.GB17378.4-2007 海洋监测规范第4部分:海水分析[S].北京:海洋出版社,2008.
[20] 李卓佳,李奕雯,曹煜成,等.凡纳滨对虾海水高位池养殖水体理化因子变化与营养状况分析[J].农业环境科学学报,2010,29(10):2025-2032.
[21] Colt J,Tchobanoglous G.Evaluation of the short-term toxicity of nitrogenous compounds to channel catfish,Ictalurus punctatus[J].Aquaculture,1976,8(3):209-224.
[22] 迈克尔C纽曼,迈克尔A昂格尔.生态毒理学原理[M].赵园,王太平,译.北京:化学工业出版社,2007.