表面活性剂是一种具有两亲结构,能够吸附在表(界)面上,在加入量较少时即能显著降低界面张力,从而产生一系列应用功能的物质[1]。表面活性剂根据化学性质可分为离子型和非离子型,作为一种新型添加剂,其广泛应用于纺织、制药、农药、化妆品、食品造船、土建、采矿和洗涤等领域。仅2017年国内生产的表面活性剂就高达276.9万t[2],而其中大部分在应用后未得到妥善处理就进入自然水体,成为威胁水域生态环境和水生生物安全的污染物质[3-4]。
十二烷基硫酸钠(Sodium dodecylsulfate,SDS)是一种常见的阴离子表面活性剂,作为液体洗涤剂及化学试剂生产的重要工业原料,用途十分广泛[5]。SDS对水生生物毒性较大,是美国试验材料协会(ASTM)推荐的生物毒性试验方法中常用标准毒物之一[6]。研究表明,SDS等阴离子表面活性剂对大型藻类[7]、浮游动物[8]、甲壳类[9]、贝类[10]和鱼类[11]均具有明显的生物毒性效应。壬基酚(Nonylphenol,NP)作为全球第二大类商用非离子表面活性剂,在使用过程中约有60%会经废水进入周围的水体环境,且因其毒性强不易降解而成为水环境中的持久性污染物。研究表明,NP对多种水生生物均具有毒性效应,可诱导细胞凋亡并抑制免疫系统的正常运行。此外,NP是公认的内分泌干扰物,具有雌激素效应,对生物的生殖系统具有明显负效应[12-15]。
刺参Apostichopus japonicus具有较高的营养和药用价值,是中国海水养殖单一产值最大的经济物种。近年来,随着刺参增养殖规模的不断扩大,沿海工业快速发展导致的海水污染对刺参养殖业带来较大影响[16],同时,由于刺参生活在污染物易于积聚的底栖环境中,加之行动能力迟缓,无法快速有效躲避污染物,使得刺参成为评价海洋污染物毒性效应和渔业水质生态风险的良好对象。表面活性剂作为海洋环境中一种新型的陆源流入污染物,引发的海洋生态环境和生物毒性效应已引起广泛关注,然而其对于刺参的相关毒性研究鲜有报道。为此,本研究中以刺参幼参为试验对象,选取广泛应用的两类典型表面活性剂代表十二烷基硫酸钠(SDS)和壬基酚(NP)作为染毒试剂,对刺参幼参开展急性毒性试验,计算半致死浓度和安全浓度,并分析比较幼参的附壁和死亡状态,以期丰富刺参生态毒性学研究资料,为近海水质标准制定及渔业环境污染防治提供基础数据。
1 材料与方法
1.1 材料
试验用刺参幼参购于烟台东方海洋科技股份有限公司,体质量为(0.15±0.05) g,采用湿运法运输,并在实验室中型塑料箱(200 L)内驯养一周,期间每日换水一次,隔日投喂饵料一次。试验开始前1 d停止投喂饵料,挑选健康幼参随机分组。
十二烷基硫酸钠(SDS)为化学纯(>97%),购于国药集团化学试剂有限公司。壬基酚(NP)为化学纯(>95%),购于上海阿拉丁生化科技股份有限公司,储存于棕色玻璃瓶中,并用丙酮配成一定浓度的母液备用,丙酮体积分数为0.1%。
试验用海水取自烟台市近海,pH为7.26,溶氧量为7.32 mg/L,盐度为31.56,经沙滤去除杂质、煮沸灭菌后置于消毒玻璃缸中待用。
1.2 方法
参照《水生生物检测手册》中静水毒性试验法[17],先根据预试验结果确定出SDS和NP的试验浓度范围,并依据等对数间距法计算并设置两种试剂的急性毒性试验浓度。SDS试验浓度设为0、5.00、6.47、8.38、10.81、14.00 mg/L,NP试验浓度设为0、500、594、708、841、1000 μg/L,每种药物浓度设置3个平行,并分别设置SDS空白对照组和NP空白对照组,其中NP空白对照组添加助溶剂丙酮(助溶剂添加量不超过2.5‰),SDS空白对照组不加任何药品试剂,其他试验条件与毒性处理组完全一致。
在室温下采取静水试验法,每个1 L烧杯中放入10头刺参,试验期间,不投喂不充气,保持水温为(16.5±1.5)℃,每隔24 h全量换水一次,并保持各组药物浓度为原始预设浓度。试验期间,每隔8 h(夜间除外)观察一次幼参状态,并记录挂壁个数和死亡个数,幼参死亡的判定以沉入烧杯底部、管足无吸附能力、对轻微刺激无反应、放入自然海水不能复活为准[18],及时清除死亡个体,保证水质免受污染。
1.3 数据处理
采用SPSS 18.0软件Probit工具进行回归分析,用概率单位法做出浓度对数-概率单位线性方程,并计算出两种表面活性剂药物对幼参的72、96 h半致死浓度(LC50)及95%置信区间。其中死亡率取3组平行试验的平均值进行计算,并按下式进行校正:
P=(P′-C)/(100-C)。
其中:P为经校正后试验组的死亡率(%);C为空白组死亡率(%);P′为试验组平行组的平均死亡率(%)。以附壁率(RA)来评价幼参附着能力和活动情况,其计算公式为
RA=NA/10×100%。
式中,NA为附着在烧杯壁上的幼参数。安全浓度(SC)计算公式[19]为
SC=96 h LC50×0.1。
2 结果与分析
2.1 SDS和NP对幼参的急性致死效应
SDS和NP两种类型表面活性剂对刺参幼参的急性致死效应如图1和图2所示,幼参的死亡率均随着两种药物浓度和暴露时间的延长而增加,但幼参对两种药物的毒性响应模式有明显差异。从图1可见:SDS对刺参幼参的毒性作用较为平缓持久,5.00 mg/L浓度SDS暴露下未有幼参死亡;6.47 mg/L浓度SDS暴露72 h时幼参出现死亡,死亡率为10%;8.38 mg/L以上浓度SDS暴露下刺参则出现大规模死亡现象。
从图1还可见,NP对幼参的急性毒性则更为迟缓,各浓度NP短时间暴露下(24 h和48 h)幼参均未见大规模死亡;而在暴露72 h后较高浓度处理组(841、1000 μg/L)开始出现死亡,且在短时间内死亡率急剧上升。另外,在试验过程中,SDS空白对照组及NP助溶剂对照组幼参均未出现死亡。
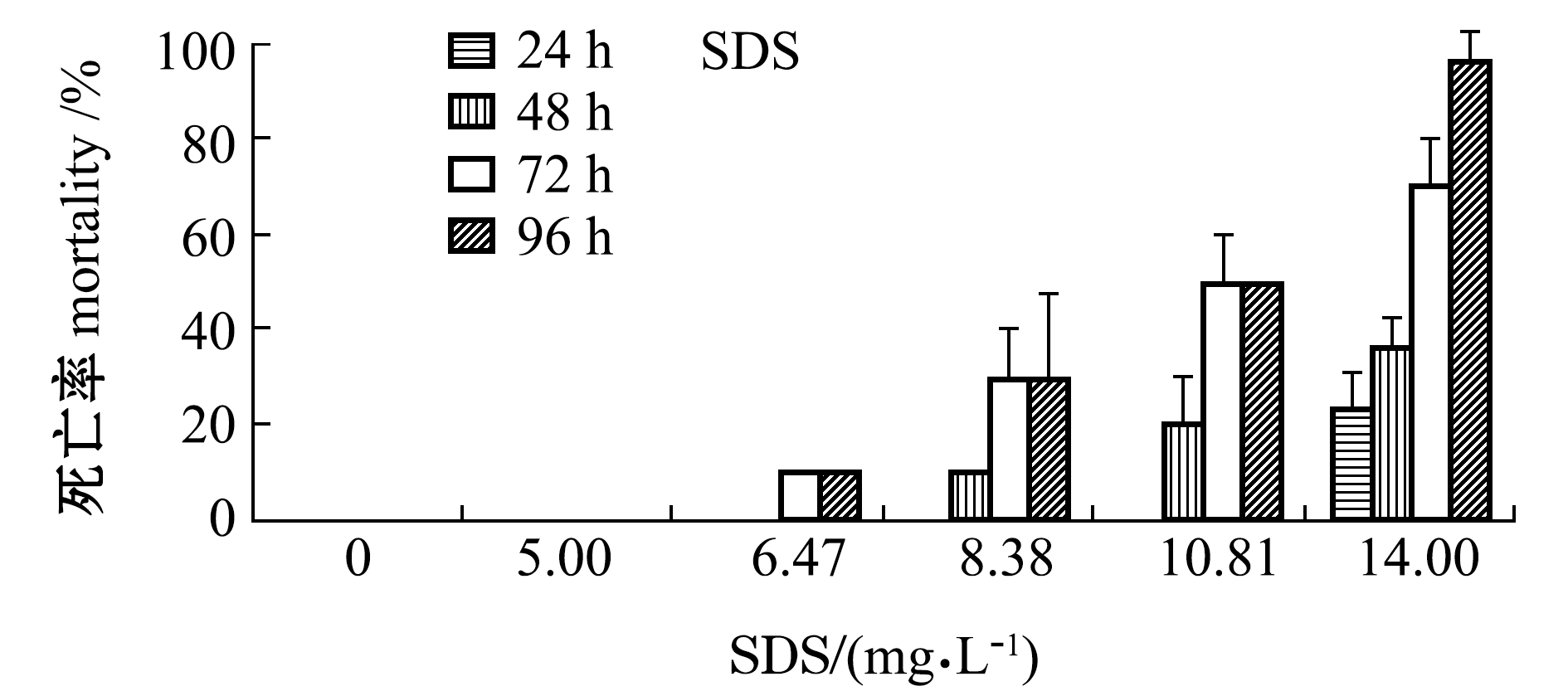
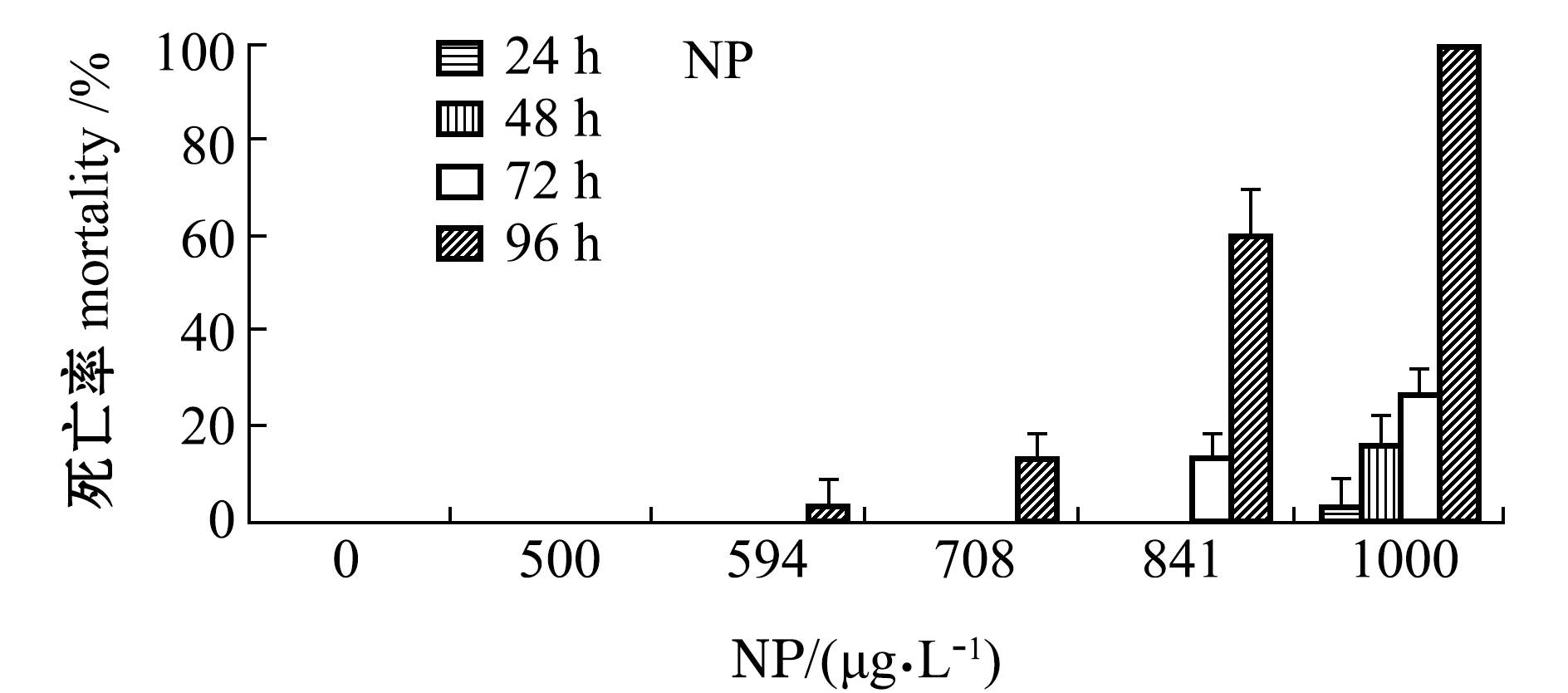
图1 不同浓度SDS和NP处理下刺参幼参的死亡率
Fig.1 Mortality of sea cucumberApostichopus japonicusjuveniles exposed to various concentrations of SDS and NP
进一步分析数据,可推出不同暴露时间段浓度对数(x)与概率单位(y)的回归方程,并计算出两种表面活性剂药物作用下刺参幼参的LC50及相应95%置信区间。从表1可见,在药物处理72 h后,SDS和NP对刺参幼参的72 h LC50分别为10.927、1.12 mg/L,在药物处理96 h后,SDS和NP对刺参幼参的96 h LC50分别为9.834、0.80 mg/L,表明这两种类型的表面活性剂药物对刺参的急性毒性存在较大差异,非离子型表面活性剂NP的毒性大于阴离子型表面活性剂SDS。此外,根据96 h LC50计算出两种表面活性剂药物对刺参幼参的安全浓度分别为0.983 mg/L(SDS)和0.08 mg/L(NP)。
表1 SDS和NP两种表面活性剂对刺参幼参急性毒性作用及安全浓度分析
Tab.1 Acute toxicity and safety concentrations of SDS and NP to sea cucumberApostichopus japonicusjuveniles
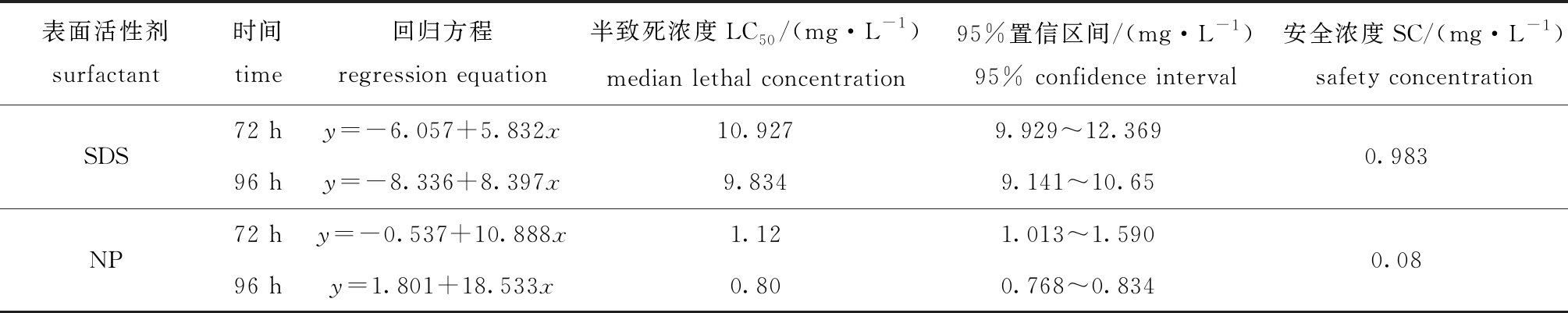
表面活性剂surfactant时间time回归方程regression equation半致死浓度LC50/(mg·L-1)median lethal concentration95%置信区间/(mg·L-1)95% confidence interval安全浓度SC/(mg·L-1)safety concentrationSDS72 hy=-6.057+5.832x10.9279.929~12.36996 hy=-8.336+8.397x9.8349.141~10.650.983NP72 hy=-0.537+10.888x1.121.013~1.59096 hy=1.801+18.533x0.800.768~0.8340.08
2.2 SDS和NP对幼参附壁率的影响
附壁率是评价幼参附着力的指标,在一定程度上反映了幼参的存活状态和活动能力。与死亡率相似,两种表面活性剂药物暴露下,刺参幼参的附壁率随药物处理时间和药物浓度的增加而降低(图2)。试验期间,两个对照组刺参附壁率保持在80%~100%,而两种不同类型表面活性剂药物处理下的附壁率则呈现明显差异。从图2可见:在中低浓度(0~5.00 mg/L)SDS处理下,幼参附壁率随药物浓度和处理时间的延长出现缓慢下降,而在中高浓度(6.47~14.00 mg/L)SDS处理下,幼参附壁率出现急剧下降,活力大大减弱。
从图2还可见,在NP暴露试验中,24 h处理后各浓度NP处理组中的幼参附壁率均较高,在48 h处理后各浓度处理组幼参虽未见大规模死亡,但附壁率却几乎降低为0,这表明NP的毒性较迟缓,虽未导致幼参大规模死亡却极大抑制了刺参活力。
2.3 SDS和NP暴露下幼参死亡状态的差异
试验过程中发现,两种类型表面活性剂SDS和NP暴露下刺参幼参的死亡状态有较大差异,SDS的毒性效应主要体现在刺激幼参排脏吐肠,而对体壁未见明显影响(图3-A);而NP的毒性效应则主要体现在引起体壁的严重化皮,NP暴露一段时间后大部分幼参出现了体表大面积化皮并最终死亡(图3-B)。
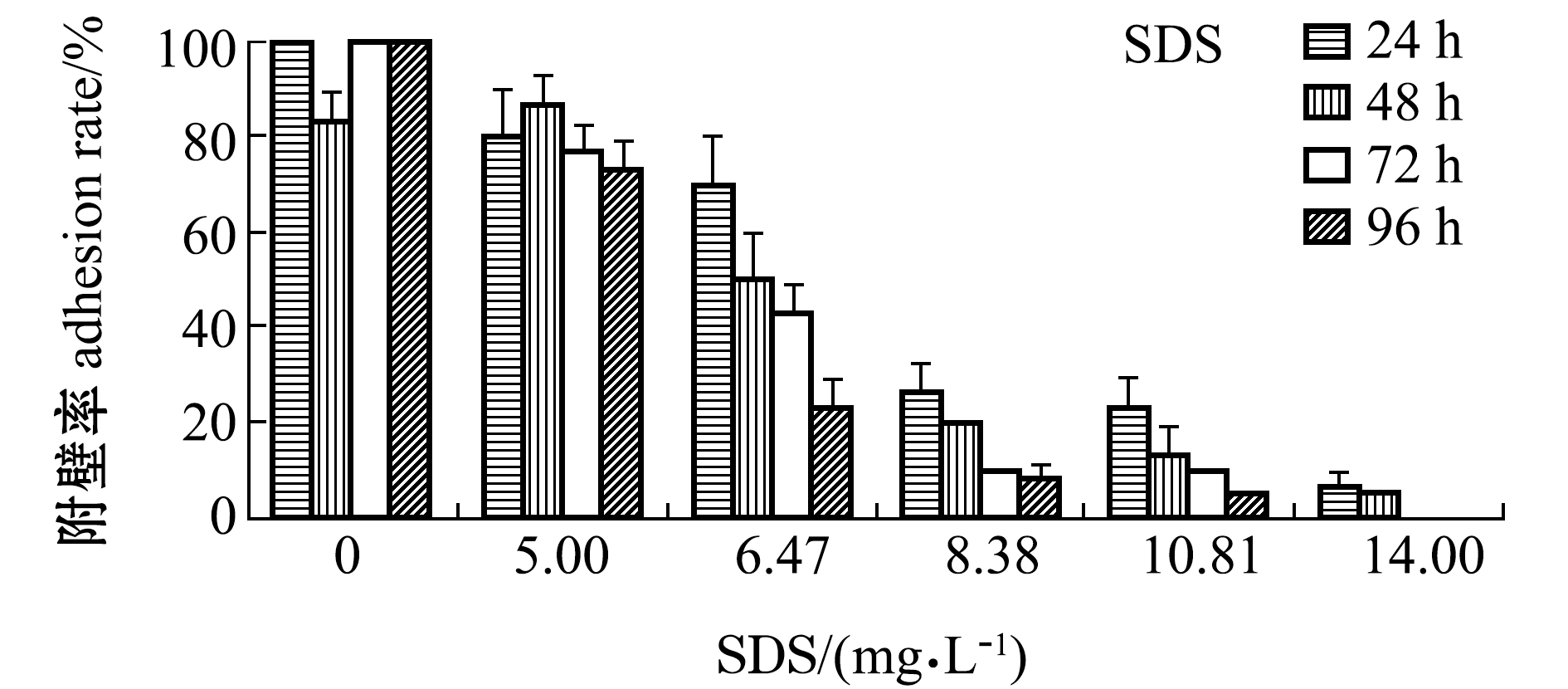
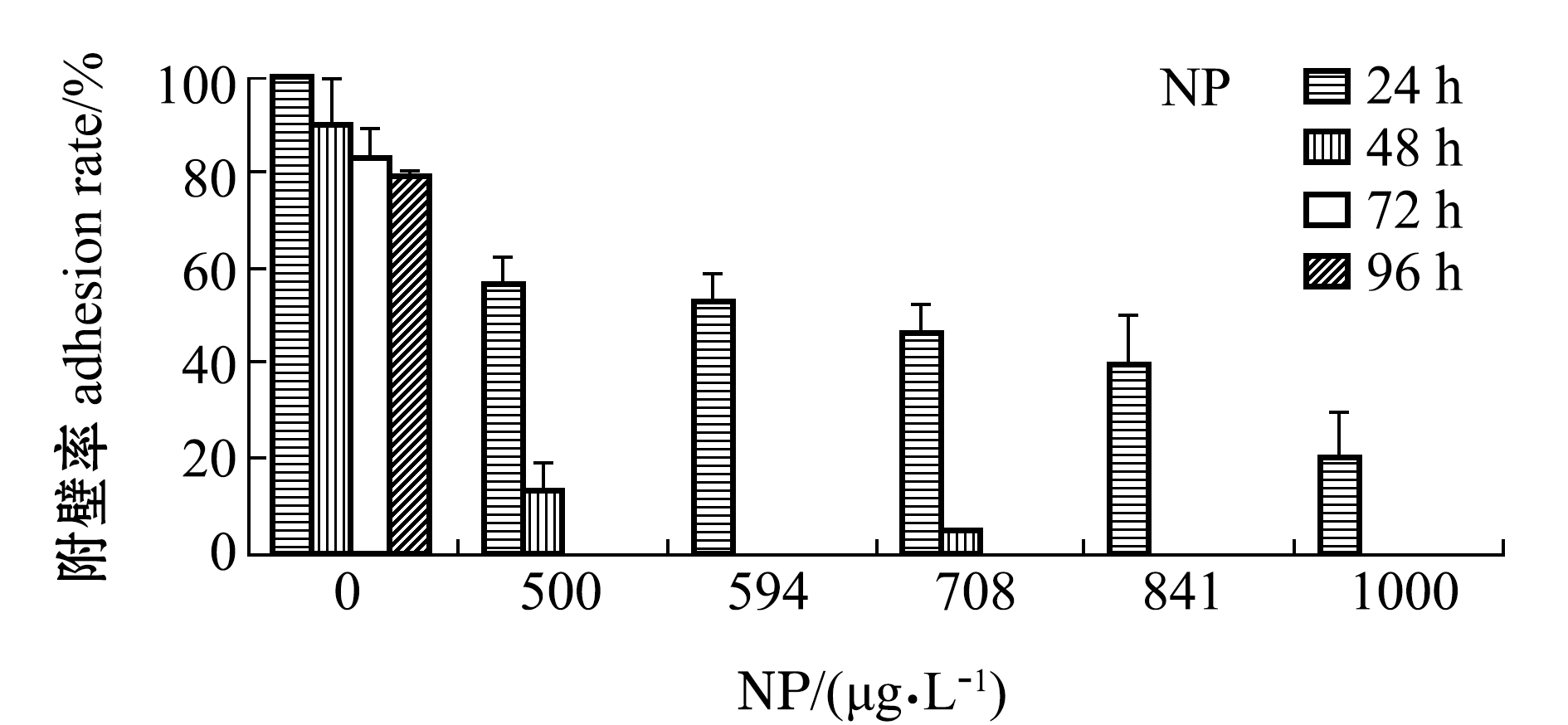
图2 不同浓度SDS和NP处理下刺参幼参的附壁率
Fig.2 Adhesion rate of sea cucumberApostichopus japonicusjuveniles exposed to different concentrations of SDS and NP
3 讨论
3.1 表面活性剂污染对海洋底栖生物可能构成生态威胁
表面活性剂广泛应用于各个工业领域,素有“工业味精”美称。近年来,由于国内工业化的快速发展及人们环保意识的缺乏,大量表面活性剂随工业生活污水流入天然水体,造成河流、湖泊、甚至海洋水环境污染。本研究中选取了两种典型表面活性剂(SDS和NP)作为受试药物,以海洋大型底栖动物的代表经济物种刺参作为受试动物开展急性毒性研究。由于生物早期发育阶段一般作为对药物胁迫最为敏感的阶段,故本试验中选取了刺参幼参作为受试对象。静水急性毒性试验结果表明,两种常用表面活性剂对刺参幼参均存在毒性,且毒性差异较大,非离子类表面活性剂NP的毒性强于离子型表面活性剂SDS。
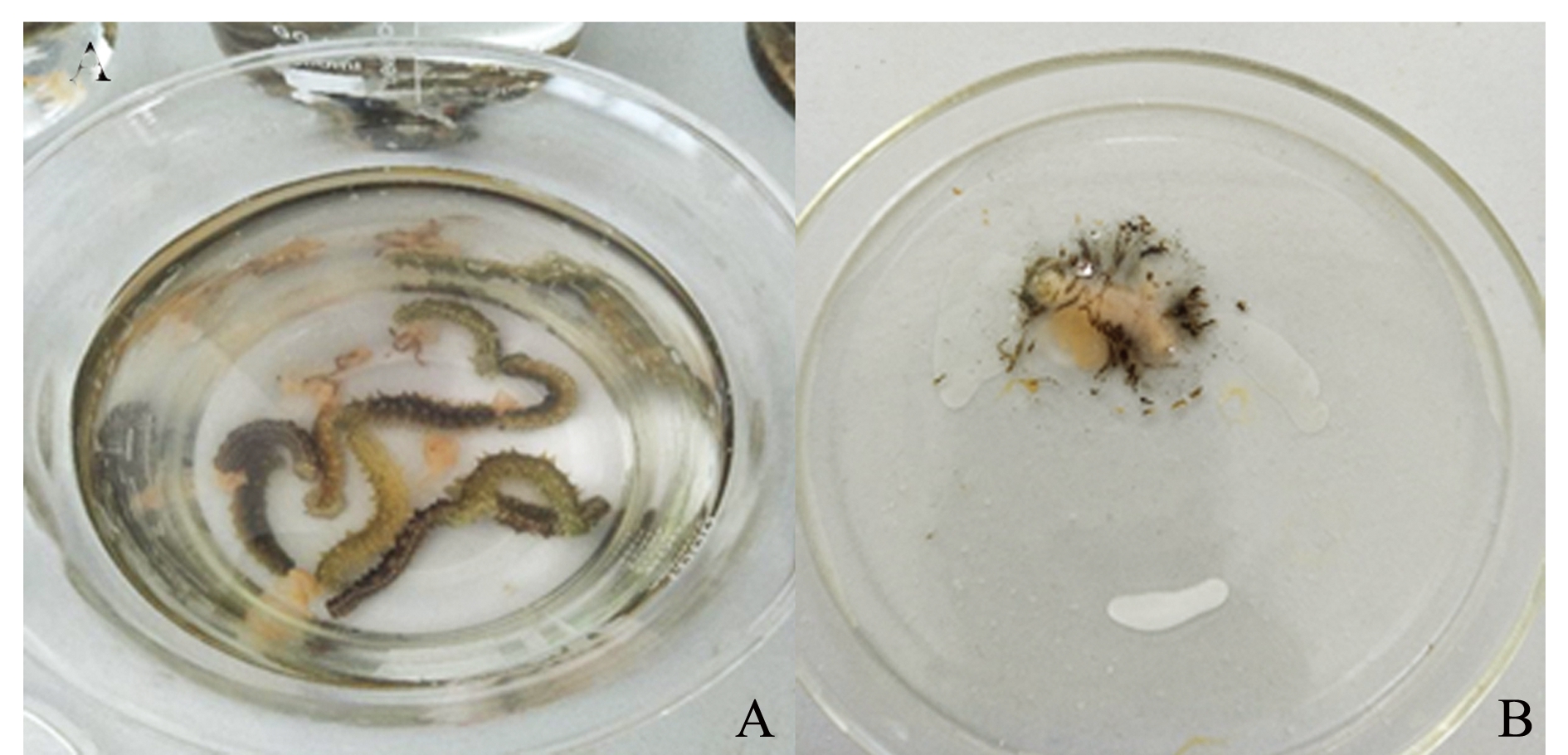
注: A为SDS处理下幼参出现排脏;B为NP处理下幼参严重化皮
Note: A, evisceration of the sea cucumber exposed to SDS; B,severe autolysis symptom of the sea cucumber exposed to NP
图3 刺参对两种表面活性剂所表现出的毒性反应
Fig.3 Toxic reactions of sea cucumberApostichopus japonicusexposed to two surfactants
壬基酚(NP)作为典型的非离子表面活性剂,在国内生产和使用量较大,对环境调查表明,其在中国海洋水体和沉积物中均广泛分布,部分站位污染严重。刘文萍等[20]发现,北黄海辽宁近岸水体中NP浓度为15.1~762.0 ng/L。沈钢等[21]研究表明,海河和渤海表层水中溶解态的NP浓度分别为160~429 ng/L和33~132 ng/L。邵亮等[22]发现,渤海海域沉积物中NP的浓度为3.16~13.6 ng/g (干质量)。而李正炎等[23]研究发现,胶州湾水体中NP浓度达20.2~268.7 ng/L,而其表层沉积物中壬基酚的最大浓度达到28 656 ng/g,表明该海域已为NP严重污染区域。由于NP具有分子稳定、水溶解度差且极易在沉积物中积聚的特征,且上述NP严重污染的海域与刺参人工增养殖区域多有重合,因此,很可能对刺参构成较大生态威胁。SDS是一种典型的阴离子表面活性剂,近年来随着排放量的越来越多,而较低浓度的SDS即可在水体表面产生丰富的泡沫,干扰水体氧交换,导致溶氧下降[11],因此,对于行动能力较弱的底栖动物刺参影响可能尤为严重。
3.2 SDS和NP两种表面活性剂对不同水生生物的急性毒性差异
将已有报道的SDS和NP对其他水生生物的LC50值同本研究相比,结果如表2所示。SDS对菲律宾蛤仔Ruditapes philippinarum的96 h LC50最小,为1.466 mg/L,而对克氏原螯虾Procambarus clarkii的96 h LC50最大,为1120.43 mg/L。相比而言,海洋生物对SDS更为敏感,如菲律宾蛤仔[10]和凡纳滨对虾Litopenaeus vannamei仔虾[24],而淡水生物对SDS的耐受力更强,如卤虫Artemia parthenogenetica[25]、中华大蟾蜍Bufo gargarizans蝌蚪[26]和克氏原螯虾[27]。在这几种水生动物中,刺参对SDS的敏感性处于中等位置,96 h LC50为9.834 mg/L。NP对水生生物毒性研究中,黑褐新糠虾Neomysis awatschens[29]对NP最为敏感,96 h LC50为0.066 53 mg/L,而NP对三角帆蚌Hyriopsis cumingi[33]的96 h LC50最大,为16.226 mg/L。同SDS相类似,海水及半咸水水生生物对NP更敏感,淡水生物则表现出对NP耐受性更高。刺参对NP的敏感性处于中等位置,96 h LC50为0.80 mg/L(表2)。值得注意的是,刺参作为大型海洋底栖动物,虽然对两种表面活性剂的急性毒性耐受性较强,但因其活动能力较弱,无法短时间有效回避污染物质,且长期生活在污染物易积聚的底栖环境中,因而在中长期胁迫下相比其他水生动物更易受到污染物的影响。
表2 SDS和NP对几种水生生物的毒性比较
Tab.2 Comparison of acute toxicities of SDS and NP among several aquatic organisms
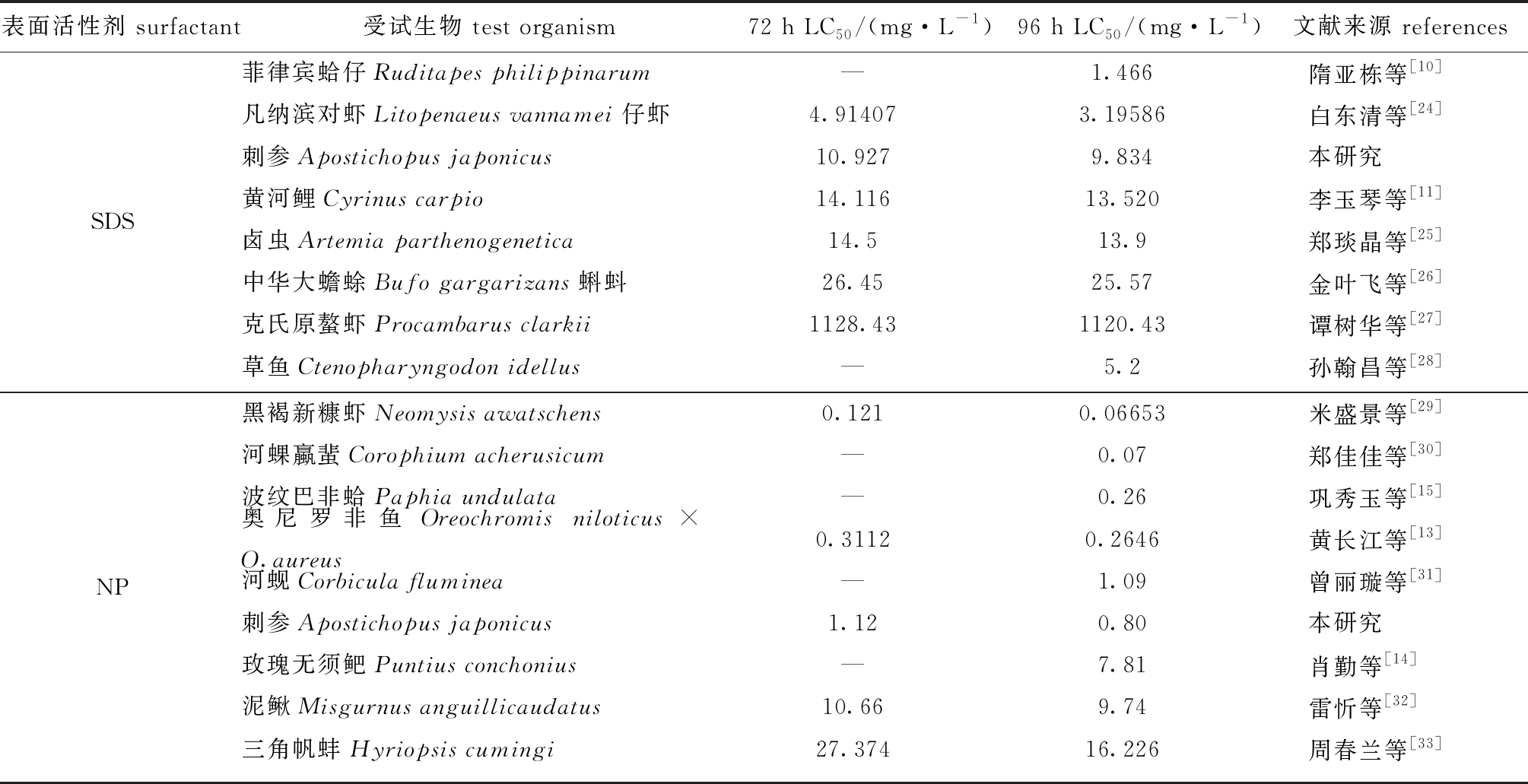
表面活性剂 surfactant受试生物 test organism72 h LC50 /(mg·L-1)96 h LC50 /(mg·L-1)文献来源 referencesSDS菲律宾蛤仔Ruditapes philippinarum—1.466隋亚栋等[10]凡纳滨对虾Litopenaeus vannamei仔虾4.914073.19586白东清等[24]刺参Apostichopus japonicus10.9279.834本研究黄河鲤Cyrinus carpio14.11613.520李玉琴等[11]卤虫Artemia parthenogenetica14.513.9郑琰晶等[25]中华大蟾蜍Bufo gargarizans蝌蚪26.4525.57金叶飞等[26]克氏原螯虾Procambarus clarkii1128.431120.43谭树华等[27]草鱼Ctenopharyngodon idellus—5.2孙翰昌等[28]NP黑褐新糠虾Neomysis awatschens0.1210.06653米盛景等[29]河蜾蠃蜚Corophium acherusicum—0.07郑佳佳等[30]波纹巴非蛤Paphia undulata—0.26巩秀玉等[15]奥尼罗非鱼Oreochromis niloticus×O.aureus0.31120.2646黄长江等[13]河蚬Corbicula fluminea—1.09曾丽璇等[31]刺参Apostichopus japonicus1.120.80本研究玫瑰无须鲃Puntius conchonius—7.81肖勤等[14]泥鳅Misgurnus anguillicaudatus10.669.74雷忻等[32]三角帆蚌Hyriopsis cumingi27.37416.226周春兰等[33]
3.3 SDS和NP两种类型表面活性剂急性致毒机制探讨
本研究中,两种表面活性剂暴露导致的刺参死亡状态差异较大,很可能与不同类型表面活性剂的致毒作用机制不同有关。目前,SDS对水生生物的致毒机理尚未完全明确,但已有研究显示,SDS具有两亲化合物结构,极易引发体内关键代谢酶和蛋白质的变性,破坏机体的免疫防御体系,干扰机体正常代谢功能;同时它也能作用于生物的脂质细胞膜,使细胞膜裂解最终致细胞死亡。如隋亚栋等[10]研究发现,高浓度的SDS可显著抑制菲律宾蛤仔抗氧化防御酶(SOD、 POD和CAT)的活性,使得机体更易受到氧化侵害。再如李安娜等[34]研究表明,SDS暴露胁迫可显著抑制斑马鱼肌肉组织两种ATPase(Na+/K+-ATPase和Ca+/Mg+-ATPase)的活性,抑制机体的正常生长。本研究中,刺参在SDS急性暴露下出现附着力下降并出现排脏,表明短时间的SDS处理已诱发刺参的应激反应,暗示着SDS对刺参的毒性较强。
非离子型表面活性剂NP易在生物体内积累并可对机体健康构成严重的威胁。巩秀玉等[15]有关NP对水生生物的慢性毒性研究表明,NP暴露会对波纹巴非蛤Paphia undulata内脏团的抗氧化酶系统造成明显损伤[15],同时诱发太平洋牡蛎Crassostrea gigas血淋巴细胞的DNA突变,暗示NP对太平洋牡蛎血淋巴细胞的毒性具有遗传性[35],此外,NP还可导致奥尼罗非鱼Oreochromis niloticus×O.aureus多种器官组织发生明显病变[13]。本试验中观察到NP胁迫早期并不会造成刺参大量死亡,而是药物处理几天后诱发刺参发生大规模化皮并出现死亡。大量的病原病理学研究证实,刺参“化皮病”主要是以细菌感染为主[36],因此,推测NP暴露很可能损伤了刺参的防御体系和免疫功能,诱发细菌感染,进而出现化皮死亡。值得一提的是,本研究中所采用的急性毒性试验只能反映药物对于受试动物死亡情况,无法全面反映药物的其他毒性特征,因此,进一步开展表面活性剂对刺参的致毒机制研究十分必要。在自然海水环境中,其他环境因素(如重金属、营养盐)的存在均可能影响表面活性剂药物的生物毒性,各成分之间可能存在拮抗、叠加或协同作用,因此,表面活性剂与其他环境污染物的联合毒性有待进一步研究探索。
4 结论
两种典型表面活性剂对刺参幼参均产生一定的毒性效应,并存在一定的剂量-效应关系,随着试验毒性处理时间延长,幼参刺参死亡率明显上升,附壁率明显下降。根据急性毒性试验计算出两种类型表面活性剂SDS和NP对刺参幼参的72 h LC50分别为10.927、1.12 mg/L,对刺参幼参的96 h LC50分别为9.834、0.80 mg/L,安全浓度分别为0.983 mg/L(SDS)和0.08 mg/L(NP),本研究数据可为表面活性剂对刺参幼参的生态毒性预测和养殖水质风险评估提供参考依据。
[1] 纪卿,云喜玲.表面活性剂的分类、性能及其应用原理[J].集宁师专学报,2003,25(4):58-59.
[2] 裴鸿,张利国.2017年中国表面活性剂原料及产品产销统计分析[J].日用化学品科学,2018,41(4):1-6.
[3] 陈荣圻.表面活性剂的生态安全性[J].印染助剂,2009,26(11):1-9.
[4] 李玉,俞志明,宋秀贤,等.胶州湾海水中阴离子表面活性剂的含量及分布[J].海洋与湖沼,2005,36(3):284-288.
[5] Sirisattha S,Momose Y,Kitagawa E,et al.Toxicity of anionic detergents determined bySaccharomyces cerevisiaemicroarray analysis[J].Water Research,2004,38(1):61-70.
[6] ASTM.Annual Book of ASTM Standards[M].Philadelpia PA:American Society for Testing and Materials,1988.
[7] 张荣.SDS与重金属Cr6+单独及联合对南四湖沉水植物的生态毒理学效应[D].曲阜:曲阜师范大学,2016.
[8] 李秀环,李华,陈澄宇,等.不同种类农药表面活性剂对大型溞的急性毒性[J].应用生态学报,2013,24(8):2319-2324.
[9] 郑琰晶,魏社林,吴进孝,等.Cu2+、Zn2+、SDS、DBS对脊尾白虾的毒性试验[J].热带海洋学报,2006,25(5):87-90.
[10] 隋亚栋,李美琴,王悠,等.阴离子表面活性剂SDS对菲律宾蛤仔(Ruditapes philippinarum)的急性毒性效应及抗氧化酶活性的影响[J].海洋环境科学,2012,31(2):163-166,172.
[11] 李玉琴,盛东峰.两种阴离子表面活性剂对黄河鲤的急性毒性研究[J].科学养鱼,2013(3):56-58.
[12] 郭匿春,谢平.双酚A和壬基酚对隆线溞和微型裸腹溞的毒性[J].水生生物学报,2009,33(3):492-497.
[13] 黄长江,董巧香,马茹飞.壬基酚对奥尼罗非鱼(Oreochromis niloticus×O.aureus)的急性毒性研究[J].海洋与湖沼,2006,37(4):309-315.
[14] 肖勤,张士璀,赵博生.壬基酚对成体玫瑰无须鲃性腺的毒性效应[J].环境科学,2007(11):2580-2585.
[15] 巩秀玉,陈海刚,张喆,等.壬基酚对波纹巴非蛤(Paphia undulata)内脏团毒性效应[J].生态学杂志,2012,31(6):1473-1479.
[16] 罗耀明,李多慧,田甲申,等.异戊二烯对刺参急性毒性及其抗氧化酶和免疫酶活性的影响[J].大连海洋大学学报,2017,32(6):682-687.
[17] 国家环境保护局《水生生物监测手册》编委会.水生生物监测手册[M].南京:东南大学出版社,1993.
[18] 吕豪,周伯文.四种药物对刺参幼参毒性的初步研究[J].水产科学,2005,24(6):28-31.
[19] 周永欣,章宗涉.水生生物毒性试验方法[M].北京:农业出版社,1989:75-156.
[20] 刘文萍,石晓勇,王晓波,等.北黄海辽宁近岸水环境中壬基酚污染状况调查及生态风险评估[J].海洋环境科学,2009,28(6):664-667.
[21] 沈钢,张祖麟,余刚,等.夏季海河与渤海湾中壬基酚和辛基酚污染的状况[J].中国环境科学,2005,25(6):733-736.
[22] 邵亮,边海燕,李正炎.夏季渤海表层沉积物中壬基酚和双酚A的分布特征与潜在生态风险[J].海洋环境科学,2011,30(2):158-161.
[23] 李正炎,傅明珠,卫东.胶州湾及其邻近河流中壬基酚等有机污染物的分布特征[J].海洋与湖沼,2008,39(6):599-603.
[24] 白东清,郭永军,董少杰,等.Cu2+、Zn2+、SDS、DBS对凡纳滨对虾仔虾的毒性试验[J].安徽农业科学,2009,37(30):15074-15076.
[25] 孙翰昌,黄丽英,丁诗华,等.表面活性剂SDS对草鱼急性毒性效应的研究[J].中国农学通报,2005,21(11):406-408.
[26] 郑琰晶,陈琳,陈燕平,等.十二烷基硫酸钠对水生生物的急性毒性影响[J].农业环境科学学报,2006(S2):496-498.
[27] 金叶飞,祝尧荣,韩丽.SDS、Cu2+污染对蟾蜍蝌蚪的急性毒性及肝脏Na+-K+-ATPase活性的影响[J].浙江农业学报,2010,22(1):81-86.
[28] 谭树华,袁志栋,谢婧,等.镉和十二烷基硫酸钠对克氏原螯虾的单一和联合毒性[J].生态学杂志,2012,31(8):2098-2102.
[29] 米盛景,王立俊,王秀利.菲、芘、壬基酚对黑褐新糠虾的急性毒性[J].河北渔业,2011(8):5-8.
[30] 郑佳佳,王睿睿,林志浩,等.壬基酚、五氯酚及硝基苯对端足类河蜾蠃蜚(Corophium acherusicum)的毒性效应[J].生态毒理学报,2014,9(6):1104-1111.
[31] 曾丽璇,张悦君,康园,等.双酚A和壬基酚对河蚬呼吸代谢和抗氧化酶活性的影响[J].生态环境学报,2014,23(1):122-128.
[32] 雷忻,田鹏飞,唐丁丁,等.壬基酚胁迫对泥鳅的急性毒性效应[J].江苏农业科学,2014,42(5):306-307.
[33] 周春兰,简少卿,胡宝庆,等.壬基酚对三角帆蚌的毒性效应[J].南昌大学学报:理科版,2016,40(1):93-96,102.
[34] 李安娜.阴离子表面活性剂十二烷基硫酸钠对斑马鱼的毒性效应研究[D].兰州:兰州大学,2008.
[35] 李正炎,卫东.壬基酚对牡蛎血淋巴细胞的DNA损伤[J].癌变·畸变·突变,2006,18(6):469-471.
[36] Deng Huan,He Chongbo,Zhou Zunchun,et al.Isolation and pathogenicity of pathogens from skin ulceration disease and viscera ejection syndrome of the sea cucumberApostichopus japonicus[J].Aquaculture,2009,287(1-2):18-27.