菲律宾蛤仔Ruditapes philippinarum(以下简称蛤仔)分布在北美西海岸、欧洲及亚洲沿海[1],是世界性养殖贝类,也是中国单种产量最高的养殖贝类[2]。目前,关于蛤仔的性别分化机制在之前的一些研究中已有报道。Chung等[4]早在1994年就研究发现,蛤仔是雌雄异体。2006年,Drummond等[5]在爱尔兰两个不同海湾的自然种群中发现了雌雄同体的蛤仔,但其所占比例非常低(约为千分之一)。Ghiselli等[6]发现了两个有性比偏离的蛤仔家系,一个家系主要产出雌性个体,而另一个家系主要产出雄性个体,在分析这两个家系的转录组后,他提出蛤仔的性别决定与双单亲遗传有关。蛤仔性别还与体型有关,如Lee等[7]研究发现,蛤仔的雌性比例随着贝壳的增大而增加,证明了性别比例与体型大小的相关性。
贝类性别分化由遗传因素和环境因素共同决定[8]。阐明贝类性别的调控机制,也能够为无脊椎动物性别决定机制、性染色体的起源与进化等研究奠定基础。
遗传因素方面主要是通过基因影响性别分化,与性别相关的基因主要有Dmrt、Sox、VTG等。其中Dmrt基因家族存在于脊椎动物和无脊椎动物中,近年来对Dmrt基因的研究较为深入,主要集中在脊椎动物当中,而在无脊椎动物尤其在贝类中的研究较少。脊椎动物Dmrt基因家族是编码含DM保守域转录因子的基因,它们共享一个高度保守的DNA结合域,即具有锌指连接DNA特殊结构的DM域,Dmrt基因在性别决定和性别分化方面起着重要作用[9-11]。Traylor-Knowles等[12]研究表明:所有的11种与性别发育相关的Dmrt基因均在星形海葵Nematostella vectensis中表达,其中9个基因的表达量在发育时期存在显著性差异,通常在成体阶段表达量达到最高;比较Dmrt基因在雌性和雄性中的表达量时还发现,7个Dmrt基因的表达量存在显著性差异,其中6个基因在雄性中的表达量高于雌性。Johnsen等[13]对大西洋鳕Gadus morhua的Dmrt1、Dmrt2a、Dmrt3、Dmrt4和Dmrt5定量PCR结果揭示了其在胚胎和幼虫中的不同表达模式,推测这5个Dmrt基因参与了性别分化过程。Kondo 等[14]研究表明,OlaDmrt4在成体青鳉Oryzias latipes大脑、眼睛、鳃、肾脏、睾丸和卵巢中均发生表达,试验中还比较了新月鱼和青鳉Dmrt4基因的区别,结果显示,Dmrt4可能在不同物种中扮演着不同角色。于非非等[8]在对马氏珠母贝Pinctada martensi的Dmrt5进行克隆和分析中发现,Dmrt5基因在性腺发育中起重要作用。冯政夫等[15]发现,扇贝Chlamys(Azumapecten)farreri Cf-Dmrt4-like基因参与了扇贝早期发育,在雌雄成熟个体中起着不同作用。Dmrt1基因是小鼠睾丸发育过程中不可或缺的基因[16]。Dmrt基因在尼罗罗非鱼Oreochromis niloticus的性别决定、睾丸维持和性别逆转中发挥重要作用[17]。
环境因素如温度、盐度、季节变化、食物丰度、外源性类固醇激素的刺激都可以使贝类发生性逆转。雌雄激素是环境中最主要的性类固醇激素。在水产动物中,雌二醇是由一类具有生物活性的化合物胆固醇代谢产生的。早前对于雌二醇影响水产养殖生物的相关研究大多是针对脊椎动物,而对双壳类动物的研究较少。Mori等[18]最早提出了雌二醇可影响双壳类动物的性别分化,通过研究雌二醇对长牡蛎Crassostrea gigas季节性性逆转的影响,发现在长牡蛎季节性性成熟早期对其注射雌二醇可以诱导雄性向雌性性逆转。雌二醇的注射刺激了成年扇贝的卵子形成和精子发生,导致性腺质量和卵母细胞直径增加[19]。
本研究中,鉴定了蛤仔3个Dmrt基因,通过对蛤仔不同发育时期,以及成体性腺未发育蛤仔经雌二醇长期和短期浸泡处理后Dmrt基因表达量变化的分析,研究了Dmrt基因家族在蛤仔性别决定、性腺发育过程中的作用,旨在为未来蛤仔单性养殖提供数据支撑,也为蛤仔性别分化机制研究提供理论参考。
1 材料与方法
1.1 材料
试验试剂:雌二醇激素粉末(索莱宝公司)和Prime ScriptTMRT Master Mix试剂盒(TaKaRa)。
试验仪器:移液枪、手持离心机、LightCycler 480实时PCR系统(Roche Diagnostics, Mannheim, Germany)和NanoDrop ND-2000C分光光度计(Thermo,美国)。
1.2 方法
1.2.1 Dmrt基因的鉴定 利用蛤仔的基因组数据库 (未发表)和一些可用的无脊椎动物和脊椎动物的Dmrt氨基酸序列,包括人类Homo sapiems、非洲爪蟾Xenopus laevis、小鼠肌肉Mus musculus、青鳉、鲐鱼Scomber japonicus、黄鳝Monopterus albus、马氏珠母贝、香鱼Plecoglossus altivelis、虾夷扇贝Mizuhopecten yessoensis、巨牡蛎Ostreagigas thunb、海豆芽Lingula,制作Dmrt系统进化树。利用ORF(open reading frame) finder对氨基酸序列进行预测,使用SMART工具确定保守结构域,用expasy工具计算理论等电点和分子量,用SWISS-MODEL预测蛋白质的三级结构。
1.2.2 不同发育时期的样品采集 蛤仔亲本为大连獐子岛野生群体,在獐子岛良种场人工授精繁殖,温度为(22±1)℃,盐度为31±1,pH为8.1±0.1。如出现超过80%的胚胎和幼虫即确定为该胚胎或者幼虫时期。取不同发育时期的蛤仔样品,每个时期取3管样品,每管不少于500粒胚胎或幼虫, 用手持式离心机轻轻离心,除去海水上层的水分,在液氮中迅速冷冻后,保存于超低温冰箱(-80 ℃)中备用。
1.2.3 雌二醇刺激蛤仔试验 试验用蛤仔为成体性腺未发育的大连獐子岛野生群体,采样区海水温度低于7 ℃。试验设置空白组和试验组,每组设3个平行。试验组中将0.5 g雌二醇粉末溶于500 mL的二甲基亚砜中配成1 g/L的雌二醇原液,试验用聚乙烯塑料水槽体积为28 L,用移液枪加入280 μL的原液使得槽中雌二醇浓度达到10 μg/L,再对蛤仔进行浸泡,在浸泡的0、3、6、9、12、24、48、72 h时分别从各组取3只蛤仔进行解剖,取其性腺作为短期处理样品,同时分别在0、72 h时从各组取3只蛤仔,取其水管、鳃、性腺、内脏团、足和外套膜等组织样本,所有组织样本均于-80 ℃下保存并提取RNA。浸泡试验每天换水一次,试验组换水后加入雌二醇激素,每天投喂两次(足够的螺旋藻粉和浓缩饵料),空白组不加激素,浸泡试验持续2个月。2个月后,从空白组及试验组中分别取3只雌、雄蛤仔,同时经过雌二醇处理后试验组中出现了雌雄同体个体,从试验组中再取3只雌雄同体个体,所有样品均取其性腺于-80 ℃下保存,作为长期处理样品。
1.2.4 RNA提取及反转录 用Trizol从30 mg的组织样本中提取总RNA。采用美国Thermo公司的NanoDrop ND-2000C分光光度计测定RNA浓度和纯度。用琼脂糖凝胶电泳检测RNA的完整性。使用Prime ScriptTMRT Master Mix试剂盒(TaKaRa)进行反转录。在作为荧光定量PCR模板前,所有的cDNA稀释到90 ng/μL,使用前再稀释。
1.2.5 实时荧光定量PCR 使用Sso Fast Eva Green Supermix在LightCycler 480 PCR系统(Roche Diagnostics, Mannheim, Germany)上进行实时PCR。循环程序为:94 ℃下预变性5 min;94 ℃下变性30 s,55 ℃下退火30 s,72 ℃下延伸1 min,共进行34个循环;最后在94 ℃下变性30 s,72 ℃下延伸1 min。以18S rRNA基因作为内参基因,实时定量PCR所用引物均采用Primer Premier 5.0软件进行设计(表1)。数据实时PCR分析使用ΔΔCT(ΔΔCT =ΔCT未知-ΔCT校准器)方法。
表1 实时定量PCR引物信息
Tab.1 Primers for Real-time PCR
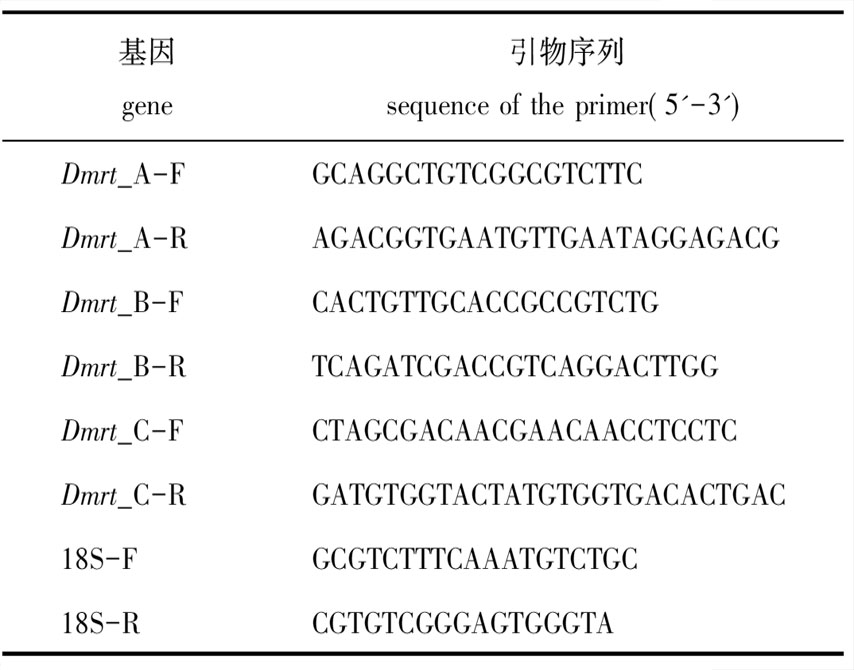
基因gene引物序列sequence of the primer(5'-3')Dmrt_A-FGCAGGCTGTCG-GCGTCTTCDmrt_A-RAGACGGTGAAT-GTTGAATAG-GAGACGDmrt_B-FCACTGTTGCAC-CGCCGTCTGDmrt_B-RTCAGATCGAC-CGTCAGGACTT-GGDmrt_C-FCTAGCGA-CAACGAACAAC-CTCCTCDmrt_C-RGATGTGGTAC-TATGTGGTGA-CACTGAC18S-FGCGTCTTTCAAAT-GTCTGC18S-RCGTGTCGG-GAGTGGGTA
1.3 数据处理
采用SPSS 17.0软件对试验数据进行方差分析,用Duncan法进行多重比较。
2 结果与分析
2.1 蛤仔Dmrt基因家族特征
本试验中,在蛤仔基因组数据库中运用BLASTe比对确定了蛤仔的3个Dmrt基因,运用MEGA、expasy、SMART等软件进行基因结构和进化分析。基于Dmrt氨基酸序列构建的系统发育树(图1)显示,每个Dmrt被分到自己的分支中,这为蛤仔Dmrt基因的身份提供了确切的系统发育证据,因此,将蛤仔的3个Dmrt基因分别命名为Dmrt3-like、Dmrt4-like-1、Dmrt4-like-2。
从图1还可见:蛤仔Dmrt3-like氨基酸序列和海豆芽、虾夷扇贝Patinopecten yessoensisJay、太平洋牡蛎Crassostrea gigas、青鳉、人Homo、鼠、日本鲭Scomber japonicus的Dmrt3氨基酸序列归为一类;蛤仔Dmrt4-like-1和Dmrt4-like-2氨基酸序列与马氏珠母贝、鼠、黄鳝的Dmrt4氨基酸序列,以及日本鲭、香鱼、家鼠Dmrt5氨基酸序列归为一类,但蛤仔Dmrt4-like-1、Dmrt-like-2氨基酸序列与马氏珠母贝的Dmrt4氨基酸序列亲缘关系最近。
蛤仔Dmrt3-like、Dmrt4-like-1、Dmrt-like-2基因的开放阅读框分别为1146、1170、1098 bp,分别编码381、389、365个氨基酸(表2)。在NCBI数据库(http://www.ncbi.nlm.nih.gov/)中用protein blast搜索Dmrt同源氨基酸序列,发现蛤仔Dmrt4-like-1氨基酸序列与合浦珠母贝、太平洋牡蛎的一致性最高,达99%,与非洲爪蟾一致性为85%;蛤仔Dmrt4-like-2氨基酸序列与太平洋牡蛎、合浦珠母贝的一致性分别为93%、90%;蛤仔Dmrt3-like氨基酸序列与太平洋牡蛎、巨牡蛎的一致性均为93

图1 基于Dmrt氨基酸序列构建的系统进化树
Fig.1 Phylogenetic tree based on amino acid sequences of Dmrt gene
每个蛤仔Dmrt基因包含两个外显子(图2),经过与图3中结构域DM所在序列位置相比较,每个基因的第一段外显子上都包含DM结构域。Dmrt家族有许多的结构和功能,但是他们都包含一个DM结构域,这一区域首先在黑腹果蝇Drosophila melanogaster的doublesex蛋白中被发现,也见于秀丽隐杆线虫Caenorhabditis elegans的蛋白中。
表2 菲律宾蛤仔Dmrt基因特征
Tab.2 Parameters ofDmrtgene in Manila clamRuditapes philippinarum
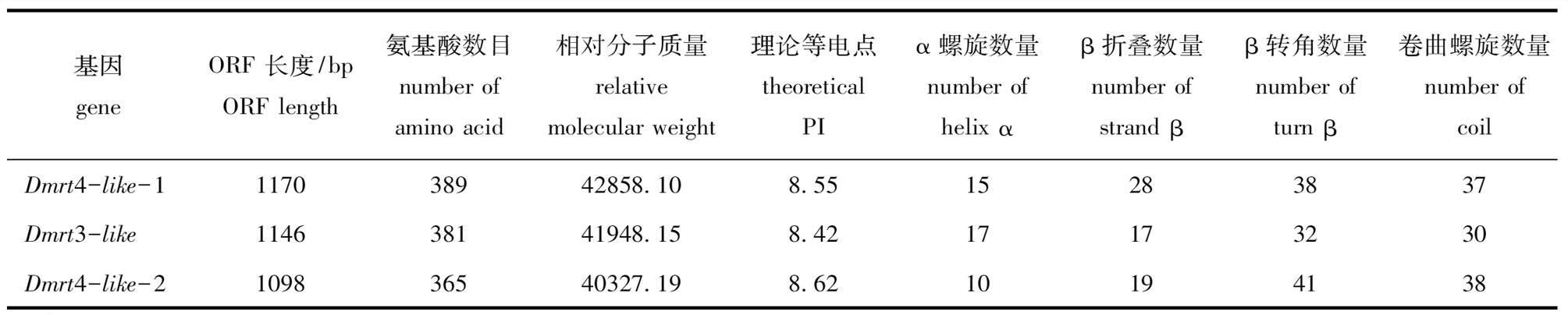
基因geneORF 长度/bpORF length氨基酸数目number of amino acid相对分子质量relative molecular weight理论等电点theoretical PIα螺旋数量number of helix αβ折叠数量number of strand ββ转角数量number of turn β卷曲螺旋数量number of coilDmrt4-like-1117038942858.108.5515283837Dmrt3-like114638141948.158.4217173230Dmrt4-like-2109836540327.198.6210194138
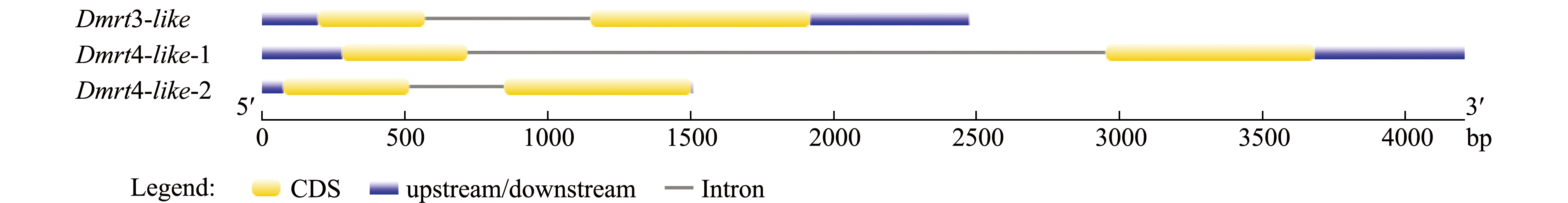
图2 菲律宾蛤仔Dmrt基因结构
Fig.2 Structure ofDmrtgene in Manila clamRuditapes philippinarum
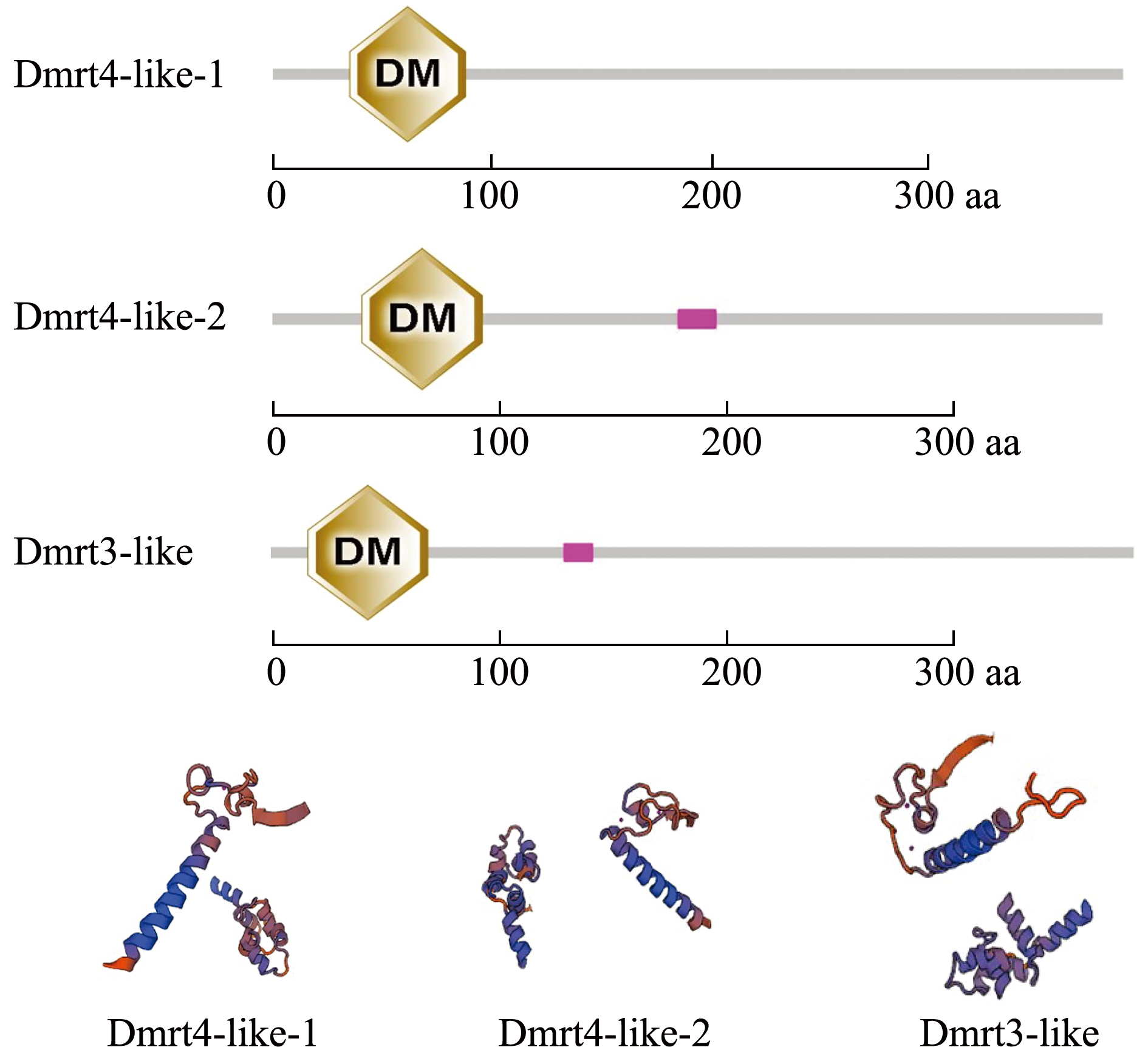
图3 Dmrt基因编码的蛋白结构域及三维结构
Fig.3 Protein structure domain and three-dimensional structure ofDmrtgene
2.2 Dmrt基因的实时荧光定量PCR
从图4可见:蛤仔Dmrt4-like-1基因在受精卵、多细胞期、原肠胚均未有表达,在担轮幼虫时期开始表达,Dmrt4-like-1在壳顶幼虫时期的表达量比担轮幼虫时期高约833.44倍,从壳顶幼虫到稚贝,表达量呈波动变化;Dmrt3-like基因从原肠胚开始表达;Dmrt4-like-2基因在整个发育时期均有表达,但在受精卵、多细胞期、原肠胚和担轮幼虫时期表达量较低。
从图5、图6可见:相较于0 h,72 h的雌二醇激素刺激后,蛤仔Dmrt4-like-1在性腺中的表达量基本不变,在足中的表达量上升,但在其他组织中的表达量下降;Dmrt3-like在水管中不表达,但在其他组织中的表达量上升;Dmrt4-like-2在足中的表达量上升,但在其他组织中表达量均下降。
从图7可见:蛤仔性腺中Dmrt4-like-1在0~24 h时表达量呈上升趋势,在24 h时表达量达到最高,之后表达量显著下降(P<0.05);Dmrt3-like和Dmrt4-like-2的表达量也在24 h时达到最高。
从图8可见:雌二醇刺激2个月后,无论在空白组还是试验组中,雄性蛤仔性腺中Dmrt4-like-1、Dmrt4-like-2基因表达量均显著高于雌性性腺(P<0.05),而雌、雄性腺中Dmrt3-like表达量则相近(P>0.05);空白组中雌、雄性腺中Dmrt4-like-1和Dmrt3-like表达量分别高于试验组中对应的雌、雄性腺表达量;试验组雌雄同体性腺中,Dmrt4-like-1和Dmrt4-like-2表达量略高于试验组雌性性腺(P>0.05),但显著低于试验组雄性性腺(P<0.05),而Dmrt3-like基因的表达量则略低于试验组雌、雄性腺(P>0.05)。
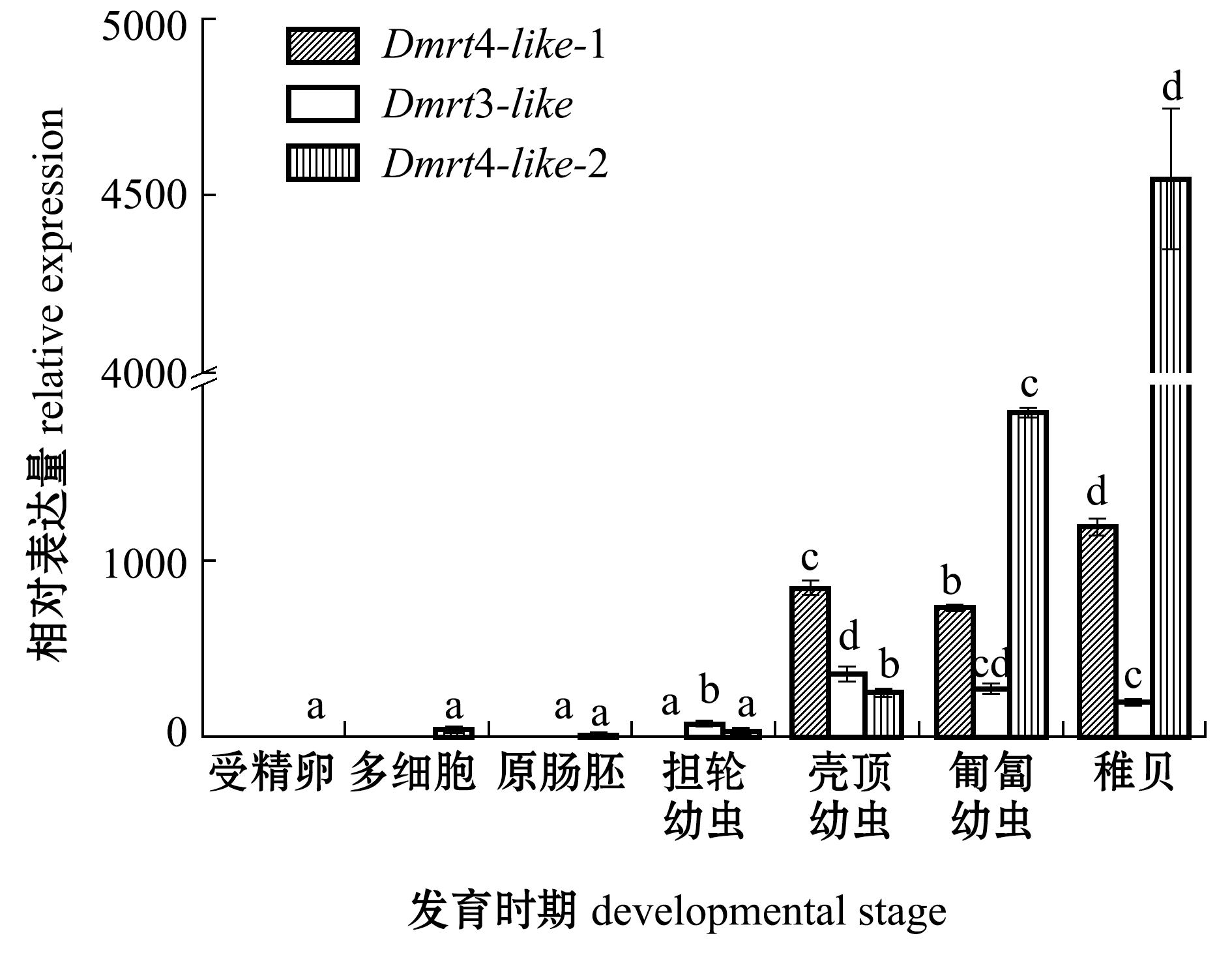
注:使用18 S作为内参基因;标有不同字母者表示同一基因不同发育时期比较有显著性差异(P<0.05),标有相同字母者表示无显著性差异(P>0.05)
Note: 18 S is used as the internal control.Different letters represent significant differences between different stages in the same gene (P<0.05);The means with the same letters are not significant differences(P>0.05)
图4 不同发育时期菲律宾蛤仔性腺组织Dmrt的表达量
Fig.4 Relative expression levels ofDmrtgene in different embryonic and larval stages in Manila clamRuditapes philippinarum
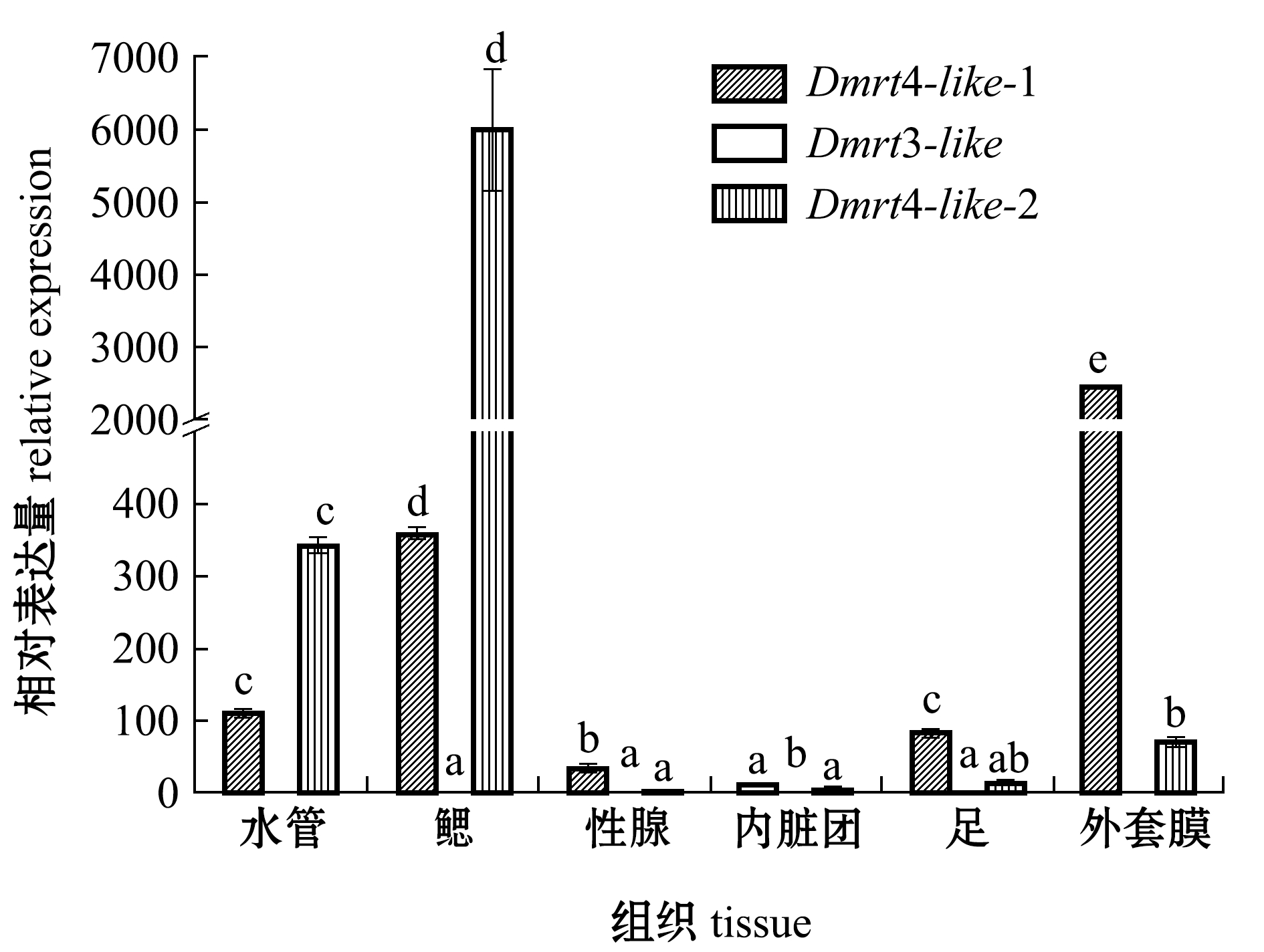
注:使用18 S作为内参基因;标有不同字母者表示同一基因不同组织间比较有显著性差异(P<0.05),标有相同字母者表示无显著性差异(P>0.05),下同
Note: 18 S is used as the internal control. Different letters at the same gene represent significant differences between tissues (P<0.05);The means with the same letters are not significant differences(P>0.05), et sequentia
图5 暴露于雌二醇0 h时菲律宾蛤仔不同组织Dmrt的表达量
Fig.5 Expression levels ofDmrtgene in different tissues in Manila clamRuditapes philippinarumexposed to estradiol for 0 h
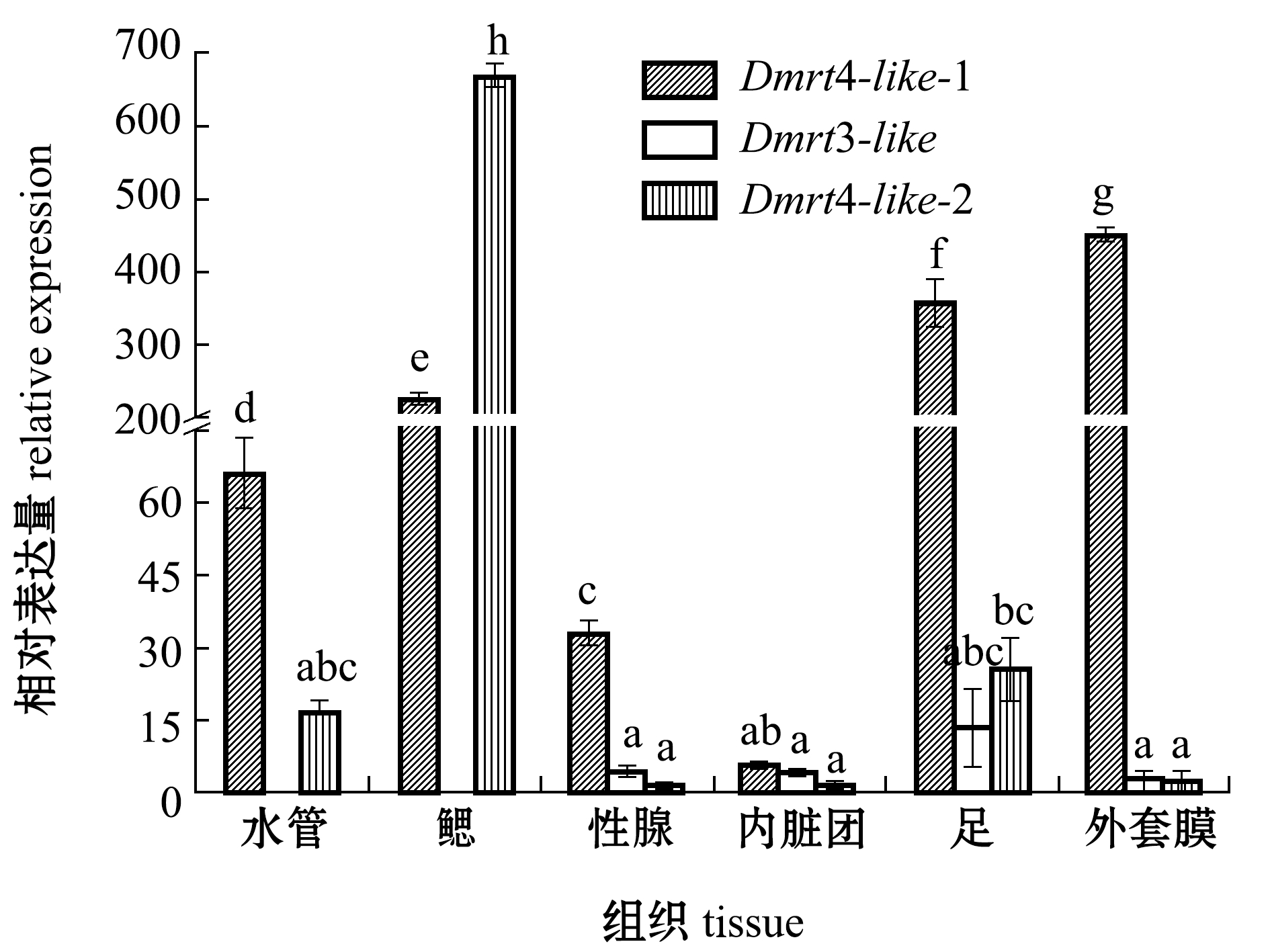
图6 暴露于雌二醇72 h时菲律宾蛤仔不同组织Dmrt的表达量
Fig.6 Expression levels ofDmrtgene in different tissues in Manila clamRuditapes philippinarumexposed to estradiol for 72 h
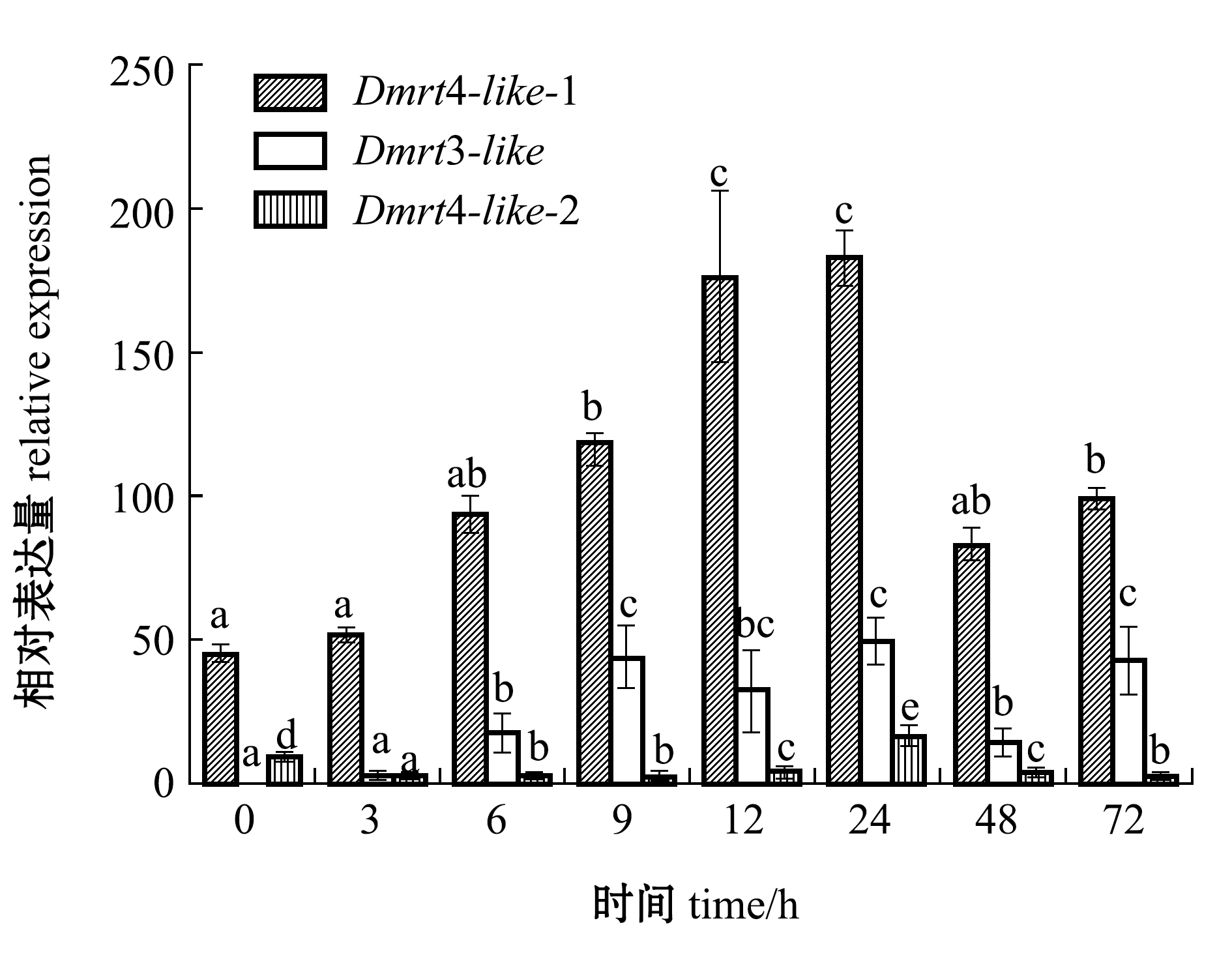
注:使用18 S作为内参基因;标有不同小写字母表示同一基因不同时间点比较有显著性差异(P<0.05),标有相同字母者表示无显著性差异(P>0.05)
Note: 18 S is used as the internal control. Different letters represent significant differences in the same gene at various periods(P<0.05);The means with the same letters are not significant differences(P>0.05)
图7 雌二醇短期刺激后不同时间点菲律宾蛤仔性腺中Dmrt表达量的变化
Fig.7 Expression levels ofDmrtgene in gonad of Manila clamRuditapes philippinarumunder hormone treatment for various periods
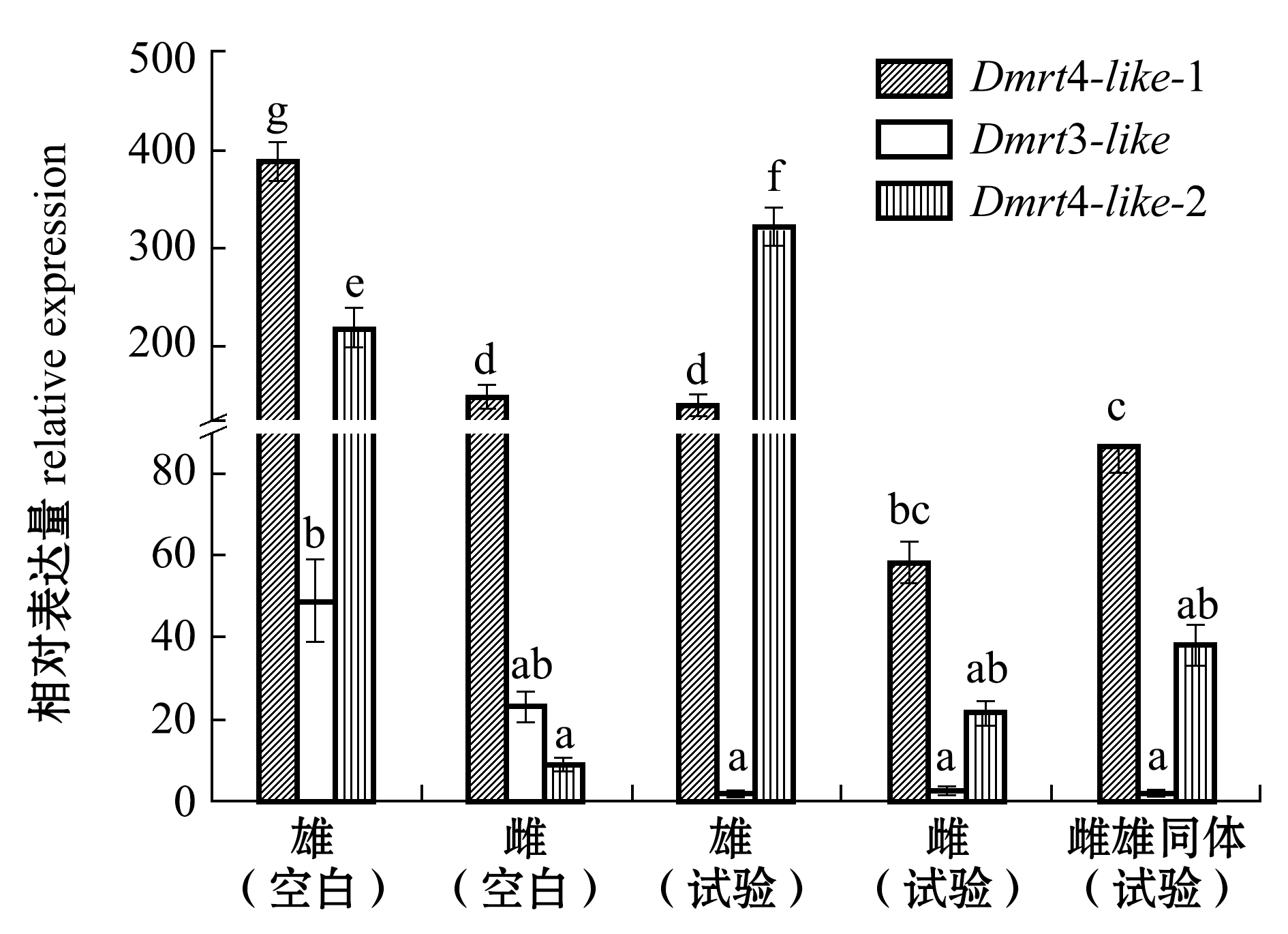
注:使用18 S作为内参基因;标有不同字母者表示同一基因不同组别雌雄及雌雄同体间比较有显著性差异(P<0.05),标有相同字母者表示无显著性差异(P>0.05)
Note: 18 S is used as the internal control. Different letters represent significant differences between different groups in the same gene (P<0.05);The means with the same letters are not significant differences(P>0.05)
图8 雌二醇刺激60 d时空白组及试验组菲律宾蛤仔性腺中Dmrt表达量的变化
Fig.8 Relative expression levels ofDmrtgene in the gonads of Manila clamRuditapes philippinarumin blank group and the experimental groups for 60 days
3 讨论
对于所有的Dmrt基因都具有高度保守的DM结构域,可以与特定的DNA序列结合,并调控下游基因的表达,从而控制性别的分化及早期发育[20-22]。该基因家族DM结构域的碱基序列在进化上具有高度的保守性,但功能上存在物种的差异性[23-25]。不同物种Dmrt基因DM结构域核苷酸序列和氨基酸序列的同源性与变异性可反映出它们进化地位的差异[9]。不同物种的Dmrt基因DM结构域均有一定的保守区域,又有其自身的特异性位点或变异位点,这些位点有可能对雌雄同体的产生起决定性的作用[26]。
3.1 蛤仔不同发育时期性腺Dmrt表达的变化
脊椎动物的Dmrt1、Dmrt2、Dmrt4、Dmrt5在性腺发育及维持成年性腺功能过程中起到了重要作用[20]。本试验中也有相似结果,蛤仔性腺Dmrt3-like、Dmrt4-like-1、Dmrt4-like-2表达量从担轮幼虫到壳顶幼虫均呈爆发式增长,分别增加了5.37、833.44和16.05倍。推测性腺从担轮幼虫时期开始发育,Dmrt基因可能还参与其胚胎发育。
3.2 雌二醇短期处理后蛤仔性腺Dmrt表达的变化
在用雌二醇浸泡蛤仔72 h的短期处理组中,0 h时蛤仔Dmrt4-like-1、Dmrt4-like-2在水管、鳃、外套膜中表达量高于性腺。推测Dmrt4-llike-1、Dmrt4-like-2在神经系统、免疫系统和呼吸器官中发挥了重要作用。在刺激24 h时,蛤仔Dmrt3-like、Dmrt4-like-1、Dmrt4-like-2表达量均达到最高,之后随时间的延长表达量下降。陈家长等[27]研究发现,17β-雌二醇具有较强的雌激素效应,能显著提高罗非鱼Oreochromis mossambicus血清中雌二醇和卵黄蛋白原的含量。此外,雌激素浸泡也可以诱导太平洋牡蛎、虾夷扇贝体内卵黄蛋白原基因的表达和蛋白合成[28-29],由此推测,蛤仔中的性激素会维持一定的比例来维持正常性腺功能。当雌二醇刺激蛤仔时,会打破性激素的平衡进而使机体迅速做出反应,Dmrt3-like、Dmrt4-like-1、Dmrt4-like-2的表达量增加以维持内环境的平衡,推测Dmrt3-like、Dmrt4-like-1、Dmrt4-like-2基因参与了成体蛤仔性腺的发育和维持功能。
3.3 雌二醇长期处理后蛤仔性腺Dmrt表达的变化
在用雌二醇浸泡蛤仔2月的长期处理组中,未经雌二醇浸泡的空白组成熟雄性性腺中Dmrt3-like、Dmrt4-like-1、Dmrt4-like-2的表达量高于成熟雌性性腺的表达量,前者分别为后者的2.13、2.61、23.92倍。对栉孔扇贝Cf-Dmrt4-like的研究结果与对蛤仔Dmrt4-like-1、Dmrt3-like、Dmrt4-like-2的研究相似,Cf-Dmrt4-like在成熟雄性性腺的表达量比成熟雌性性腺多约20倍[15]。对青鳉和红鳍东方鲀Takifugu rubripes的Dmrt4及太平洋牡蛎的DMI研究结果与对蛤仔的Dmrt3-like、Dmrt4-like-1、Dmrt4-like-2的研究也相似,蛤仔成体雄性性腺的基因表达量大于成体雌性性腺,Dmrt4基因具有维护成体性腺的功能[28,30-31]。试验组性腺与空白组性腺相比较,发现Dmrt4-like-1、Dmrt3-like表达减少,Dmrt4-like-2表达增加,表明雌二醇(10 μg/L)抑制Dmrt4-like-1、Dmrt3-like表达。推测Dmrt4-like-1、Dmrt3-like基因参与成体蛤仔性腺的发育和维持功能,甚至参与了雌二醇激素的合成过程。试验组雄性性腺Dmrt4-like-1、Dmrt4-like-2的表达量显著高于试验组雌雄同体的表达量,而试验组雌性性腺的Dmrt4-like-1、Dmrt4-like-2基因表达量则低于试验组雌雄同体,表明蛤仔的Dmrt基因参与了性别决定、性别分化和性逆转过程。
4 结语
目前,对软体动物中Dmrt基因的研究较少,本试验中通过对蛤仔不同发育时期的基因表达量分析,推测蛤仔从担轮幼虫时期性腺开始分化。对蛤仔进行短期和长期的雌二醇浸泡处理后的Dmrt表达量分析,发现Dmrt参与了蛤仔的性分化、性别决定和性逆转过程。
通过对蛤仔的性别分化机制研究,可以更好地了解贝类的性别转化机制,也将为控制性腺发育和未来单性养殖技术提供数据参考。
[1] 张国范,闫喜武.蛤仔养殖学[M].北京:科学出版社,2010.
[2] 韩天坤,杨凤,贾甲,等.总氨态氮对菲律宾蛤仔早期生长发育的影响[J].大连海洋大学学报,2018,33(2):210-216.
[3] 郑怀平,张国范,刘晓,等.海湾扇贝杂交家系与自交家系生长和存活的比较[J].水产学报,2004,28(3):267-272.
[4] Chung E Y,Ryou D K,Lee J H.Gonadal development,age and growth of the short necked clam,Ruditapes philippinarum(Pelecypoda:Veneridae),on the coast of Kimje,Korea[J].Korean Journal of Malacology,1994,10:38-54.
[5] Drummond L,Mulcahy M,Culloty S.The reproductive biology of the Manila clam,Ruditapes philippinarum,from the North-West of Ireland[J].Aquaculture,2006,254(1-4):326-340.
[6] Ghiselli F,Milani L,Chang P L,et al.Denovo assembly of the Manila clamRuditapes philippinarumtranscriptome provides new insights into expression bias,mitochondrial doubly uniparental inheritance and sex determination[J].Molecular Biology and Evolution,2012,29(2):771-786.
[7] Lee J S,Park J S,Shin Y K,et al.Sequential hermaphroditism in Manila clamRuditapes philippinarum(Bivalvia:Veneridae)[J].Invertebrate Reproduction & Development,2013,57(3):185-188.
[8] 于非非,桂建芳,周莉,等.马氏珠母贝Dmrt5基因的克隆及时序表达模式分析[J].水生生物学报,2009,33(5):844-850.
[9] 张月圆,王昌留.DMRT基因家族研究进展[J].中国细胞生物学学报,2013,35(11):1660-1665.
[10] Ottolenghi C,Fellous M,Barbieri M,et al.Novelparalogy relations among human chromosomes support alink between the phylogeny of double sex-related genes and the evolution of sex determination[J].Genomics,2002,79(3):333-343.
[11] Kim S,Kettlewell J R,Anderson R C,et al.Sexually dimorphic expression of multiple double sex-related genes in the embryonic mouse gonad[J].Gene Expression Patterns,2003,3(1):77-82.
[12] Traylor-Knowles N G,Kane E G,Sombatsaphay V,et al.Sex-specific and developmental expression ofDmrtgenes in the starlet sea anemone,Nematostella vectensis[J].Evo Devo,2015,6:13.
[13] Johnsen H,Andersen Ø.Sex dimorphic expression of fivedmrtgenes identified in the Atlantic cod genome.The fish-specificdmrt2bdiverged fromdmrt2abefore the fish whole-genome duplication[J].Gene,2012,505(2):221-232.
[14] Kondo M,Froschauer A,Kitano A,et al.Molecular cloning and characterization ofDMRTgenes from the medakaOryzias latipesand the platyfishXiphophorus maculatus[J].Gene,2002,295(2):213-222.
[15] 冯政夫,邵明瑜,孙大鹏,等.栉孔扇贝Cf-Dmrt4-like基因的克隆、序列特征及表达分析[J].中国水产科学,2010,17(5):930-940.
[16] Raymond C S,Murphy M W,O’Sullivan M G,et al.Dmrt1,a gene related to worm and fly sexual regulators,is required for mammalian testis differentiation[J].Genes & Development,2000,14(20):2587-2595.
[17] 王婷茹.尼罗罗非鱼Dmrt1、Amh和Cyp11b2抗体制备及其在正常发育和性逆转性腺中的表达研究[D].重庆:西南大学,2013.
[18] Mori K,Tamate H,Imai T.Histochemical study on the change of 17h-hydroxysteroid dehydrogenase activity in the oyster during the stages of sexual maturation and spawning[J].Tohoku J Agric Res,1966,17:179-187.
[19] Varaksin A A,Varaksina G S,Reunova O V,et al.Effect of serotonin,some fatty acids and their metabolites on reinitiation of meiotic maturation in oocytes of bivalveSpisula sachalinensis(Schrenk)[J].Comparative Biochemistry and Physiology Part C:Comparative Pharmacology,1992,101(3):627-630.
[20] Hong C S,Park B Y,Saint-Jeannet J P.The function ofDmrtgenes in vertebrate development:it is not just about sex[J].Developmental Biology,2007,310(1):1-9.
[21] Naimi A,Martinez A S,Specq M L,et al.Identification and expression of a factor of the DM family in the oysterCrassostrea gigas[J].Comparative Biochemistry and Physiology Part A:Molecular & Integrative Physiology,2009,152(2):189-196.
[22] 杨岐生.分子生物学基础[M].杭州:浙江大学出版社,1994:92-93.
[23] 彭巧玲,蒲友光,程子华,等.罗氏沼虾3个Dmrt基因的序列分析[J].中国水产科学,2005,12(1):5-9.
[24] 文爱韵,尤锋,孙鹏,等.牙鲆Dmrt1基因的克隆及其与P450arom基因的组织表达分析[J].海洋科学,2010,34(11):97-102.
[25] 葛永斌,曹承和,聂刘旺.饰纹姬蛙7个Dmrt基因DM结构域的克隆及序列分析[J].生命科学研究,2008,12(2):110-114.
[26] 周丽青,杨爱国,王清印,等.虾夷扇贝不同性别类型2个Dmrt基因DM结构域分析[J].海洋科学,2015,39(3):19-25.
[27] 陈家长,王泽镕,瞿建宏,等.17β-雌二醇与1-萘酚对雄性罗非鱼(GIFTOreochromis niloticus)雌激素效应的比较[J].生态环境学报,2012,21(4):754-759.
[28] Li Qi,Osada M,Suzuki T,et al.Changes in vitellin during oogenesis and effect of estradiol-17β on vitellogenesis in the Pacific oysterCrassostrea gigas[J].Invertebrate Reproduction & Development,1998,33(1):87-93.
[29] Osada M,Takamura T,Sato H,et al.Vitellogenin synthesis in the ovary of scallop,Patinopecten yessoensis:control by estradiol-17β and the central nervous system[J].Journal of Experimental Zoology Part A:Comparative Experimental Biology,2003,299A(2):172-179.
[30] Yamaguchi A,Lee K H,Fujimoto H,et al.Expression of theDMRTgene and its roles in early gonadal development of the Japanese pufferfishTakifugu rubripes[J].Comparative Biochemistry and Physiology Part D:Genomics and Proteomics,2006,1(1):59-68.
[31] Winkler C,Hornung U,Kondo M,et al.Developmentally regulated and non-sex-specific expression of autosomalDmrtgenes in embryos of the Medaka fish (Oryziasl atipes)[J].Mechanisms of Development,2004,121(7-8):997-1005.