刺参Apostichopus japonicus池塘养殖是中国海水养殖的主导产业之一[1-5],2016年中国刺参增养殖总产量约为20万t,全国刺参实现直接产品出塘销售产值约230多亿元[6]。随着刺参养殖产业的迅猛扩增,疾病频发等问题始终困扰着该产业的可持续发展,而刺参疾病的发生主要归因于参池水质不佳[7-10],因此,提高池塘水质已成为刺参养殖者和研究者关注的热点问题。目前,刺参池塘水质物理调控方式主要有自然纳潮和微孔曝气两种。自然纳潮水质调控方式成本低,但无法有效减少沉积物中有害物质的积累,极端天气时底部缺氧,刺参容易出现各种问题;微孔曝气调水方式较自然纳潮参池能增加池塘水体溶氧量,但费用较高,管道易堵塞,且管道更换不易进行。因此,大连海洋大学研究团队针对刺参生活特点和池塘中出现的问题,自主研发新型水质调控设备——养水机,作用是将表层水经过生物包后再冲入底层水,从而使表、底层水持续交换,达到净化水质的目的。
微生物在养殖生态系统的物质循环和能量流动中发挥重要作用,某些细菌是养殖对象的病原菌或条件致病原[11],许多有益菌也是刺参的重要饵料成分,其在刺参肠道中产生的各种代谢物在刺参的生长发育过程中发挥了重要作用。春季是池塘环境易变季节,因此,研究春季养殖环境中微生物群落结构组成具有重要意义。
细菌群落结构多样性评价由最初的培养方法,逐渐转化为不依赖于传统培养方法的16S rDNA的PGGE技术和构建16S rDNA文库技术[12]。关晓燕等[13]采用16S rDNA的PCR—DGGE 基因指纹技术研究了不同盐度刺参养殖水环境中菌群的多样性。张文姬等[14]利用16S rDNA—RFLP法分析了大连地区刺参肠道可培养微生物的多样性。然而,利用16S rDNA高通量测序技术测定刺参养殖环境和肠道中细菌群落的报道较少[15],目前,该技术是研究细菌群落的前沿技术,其测定精度和覆盖率也最为有效[16]。为此,本研究中利用16S rDNA高通量测序技术研究了3种水质调控方式下参池水样、沉积物、刺参肠道中的细菌群落结构,以期为养水机调控刺参池塘水质提供理论支持。
1 材料与方法
1.1 材料
本试验在大连宝发海珍品有限公司刺参养殖池塘进行。池塘长为600 m,宽为85 m,水深为1.2~2.0 m。
养水机池塘,在池塘最深处(南端)放置一台功率为750 W的养水机,每日21:00~次日9:00工作,共12 h;微孔曝气池塘,在池塘底部铺设1套微孔曝气系统,由空压机(0.1 kW/667 m2)、总供气管和微孔曝气盘组成,池塘缺氧时,开始工作;自然纳潮池塘,无任何养殖装置。试验期间,各池塘放养的刺参规格、密度相同,不投饵、不投药,统一管理。水温为-2.1~27.5 ℃,溶氧为4.2~13.9 mg/L,盐度为29.9~36.3,pH为7.3~8.6。
1.2 方法
1.2.1 养水机结构及原理 养水机是本研究团队针对刺参养殖池塘水体温、盐跃层问题,自主研发的新型水质调控设备(图1)。该设备巧妙结合了物理水质调控技术和生物水质调控技术,产品经过七代不断改进完善,在实际生产中表现出肥水、抑草、活水、节能等多方面优点。养水机主要分为进水组件、生物包、水循环动力装置和生物水质输出喷头4个部分。养水机在工作时,通过水循环动力装置系统抽取表层溶氧丰富的水体进入进水口,再流入提前接种过不同种类有益菌的生物包进行过滤,最后由水体底部朝向池塘对角线方向的生物水质喷头喷射出去,实现垂直方向水体快速交换,打破温、盐跃层,起到调节净化水质的作用。
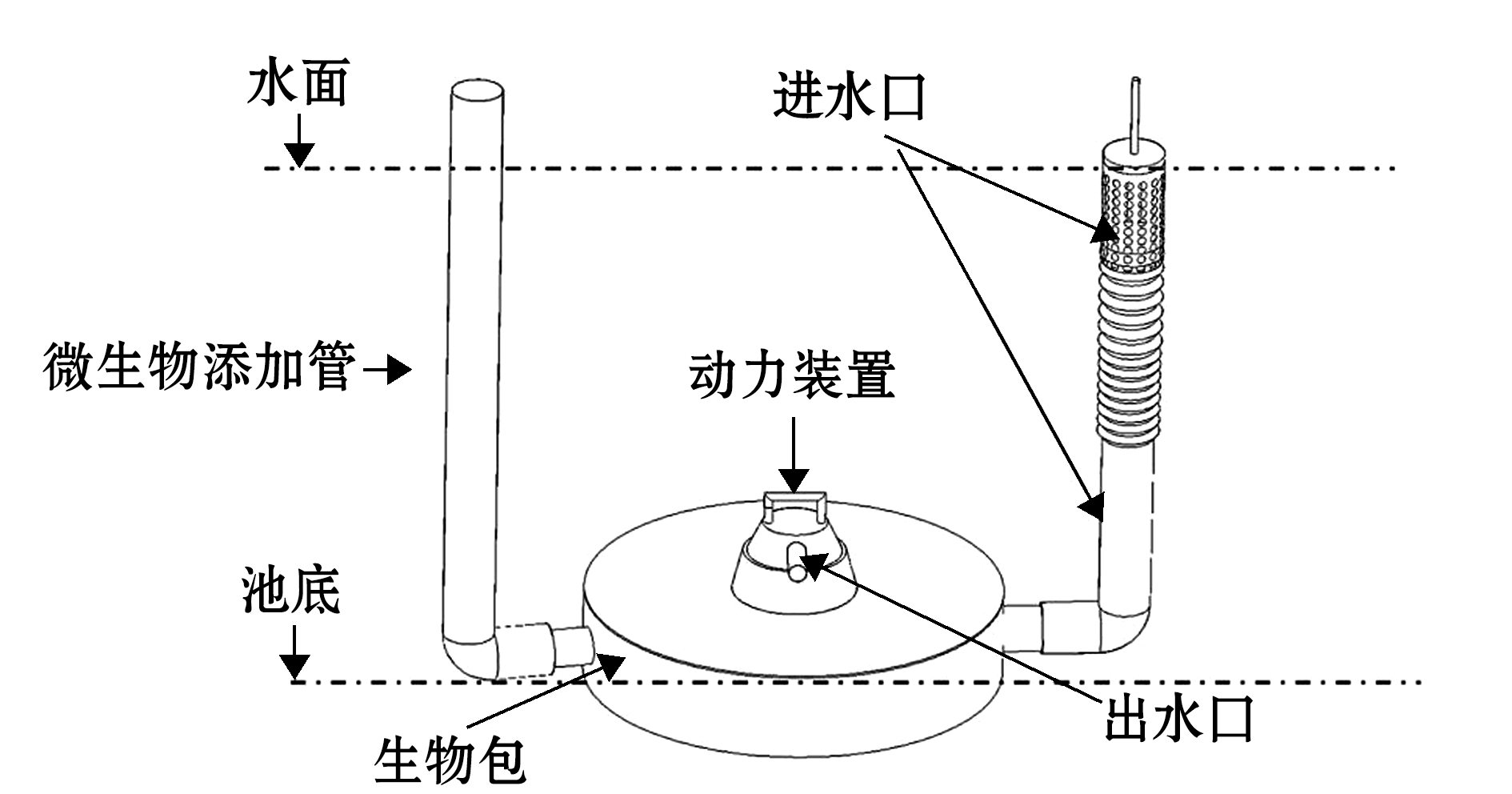
图1 养水机实图
Fig.1 Physical diagram of a water quality regulator
1.2.2 样品采集
(1)池塘水样采集。于2017年3月大潮前3 d进行水样采集。选择3种调控方式的池塘各3口,在参池进水口、出水口、中间3个位置采集水样,水样采集参照《国家海洋调查规范》海洋生物调查标准中规定的方法采集,使用5 L颠倒采水器采集水体表层(距离水体表面5 cm)、中层(根据当前水位取中间位置)和底层(距离沉积物表层10 cm)的水样,装入无菌塑料采样瓶中,并立即带回实验室将同种池塘所有水样等量混合成1 L,用0.22 μm无菌醋酸纤维滤膜过滤,装入无菌自封袋中,养水机、自然纳潮、微孔曝气3个参池水样分别标记为DWY、DWZ、DWD,然后立即放入-80 ℃液氮中冷冻后,再用干冰冷冻运送到北京诺禾致源科技股份有限公司进行测定。
(2)泥样采集。参照《国家海洋调查规范》海洋生物调查标准中规定的方法采集,在采集水样相同位点使用圆柱形采泥器(横截面直径5 cm)采集表层0~10 cm的样品,将同种池塘的泥样混匀后装入无菌自封袋中,养水机、自然纳潮、微孔曝气3个参池泥样分别标记为DMY、DMZ、DMD,保存和运送方法同水样采集方法。
(3)刺参肠道样品采集。于不同池塘分别采集刺参8头,放入15 ℃无菌纯海水瓶中,遮光且避免振动运回无菌操作台,用无菌海水冲洗刺参后解剖,取同种池塘的刺参肠道放入无菌自封袋中,养水机、自然纳潮、微孔曝气3个参池刺参肠道样品分别标记为DSY、DSZ、DSD,保存和运送方法同水样采集方法。
1.2.3 微生物测序 本试验中样品测序均由北京诺禾致源生物信息科技有限公司完成。
(1) 基因组DNA的提取。采用CTAB方法对样本的基因组DNA进行提取,使用琼脂糖凝胶电泳检测DNA的纯度和浓度,取适量样品于离心管中,使用无菌水稀释至1 ng/μL。
(2) PCR扩增。以稀释后的基因组DNA为模板;使用Barcode的特异引物选择测序区域;使用Phusion©High-Fidelity PCR Master Mix GC Buffer试剂盒(New England Biolabs公司)和高效高保真的酶进行PCR扩增,确保扩增效率和准确性。
(3) PCR产物的混养和纯化。使用20 g/L的琼脂糖凝胶电泳检测PCR产物;根据PCR产物浓度进行等浓度混样,充分混匀后使用20 g/L琼脂糖凝胶电泳检测PCR产物,使用GeneJET胶回收试剂盒(Thermo Sceintific公司)回收产物。
(4) 文库构建和上机测序。使用NEB Next©UltraTM DNA Library Prep Kit for lllumina建库试剂盒(New England Biolabs公司)进行文库的构建,构建好的文库经过Qubit定量和文库检测,合格后使用Miseq进行上机测序。
1.2.4 生物信息分析 对原始数据进行拼接、过滤,得到有效数据,然后基于有效数据进行OTUs聚类和物种分类分析,并将OTU和物种注释结合,从而得到每个样品的OTUs和分类谱系的基本分析结果,再对OTUs进行丰度、多样性指数等分析。
1.2.5 多样性指数的计算 Chao1、Shannon、Simpson和ACE指数的计算公式为
Chao1=Sobs+n1(n1-1)/[2(n2+1)],
其中:Chao1为估计的OTU数目;Sobs为实际观测到的OTU数目;n1为只有一条序列的OTU数目;n2为只有两条序列的OTU数目;ni为含有i条序列的OTU数目;N为所有的序列数;Scommon为样本中出现超过10次的物种数目;Srare为出现不多于10次的物种数目;Cace为所有低丰度(出现≤10次)的物种中非单个物种的比例;![]() 为变异系数。Chao1指数值越大,说明物种总数越多;Shannon指数值越大,说明群落多样性越高;Simpson指数值越大,说明群落多样性越低;ACE指数越大,说明群落多样性越高[17]。
为变异系数。Chao1指数值越大,说明物种总数越多;Shannon指数值越大,说明群落多样性越高;Simpson指数值越大,说明群落多样性越低;ACE指数越大,说明群落多样性越高[17]。
2 结果与分析
2.1 3种水质调控方式下参池细菌群落多样性分析
9个克隆文库中的克隆序列经载体去除和嵌合体检测后,共得到10 406条有效克隆序列(表1),9个样品的文库覆盖率均大于0.99,说明本试验数据准确且有说服力。根据OTU丰度,采用SPADE软件计算得到9个克隆文库的Chao1、Shannon、Simpson和ACE指数。
从表1可见:养水机参池环境中Chao1、Shannon和ACE指数均为最高,Simpson优势度指数最低;微孔曝气参池环境中Chao1、Shannon和ACE指数均为最低,Simpson指数最高;刺参肠道中Chao1指数为自然纳潮参池最高,Shannon指数和ACE指数均为养水机参池最高。
表1 9个样品细菌的多样性
Tab.1 Bacterial diversity of nine samples
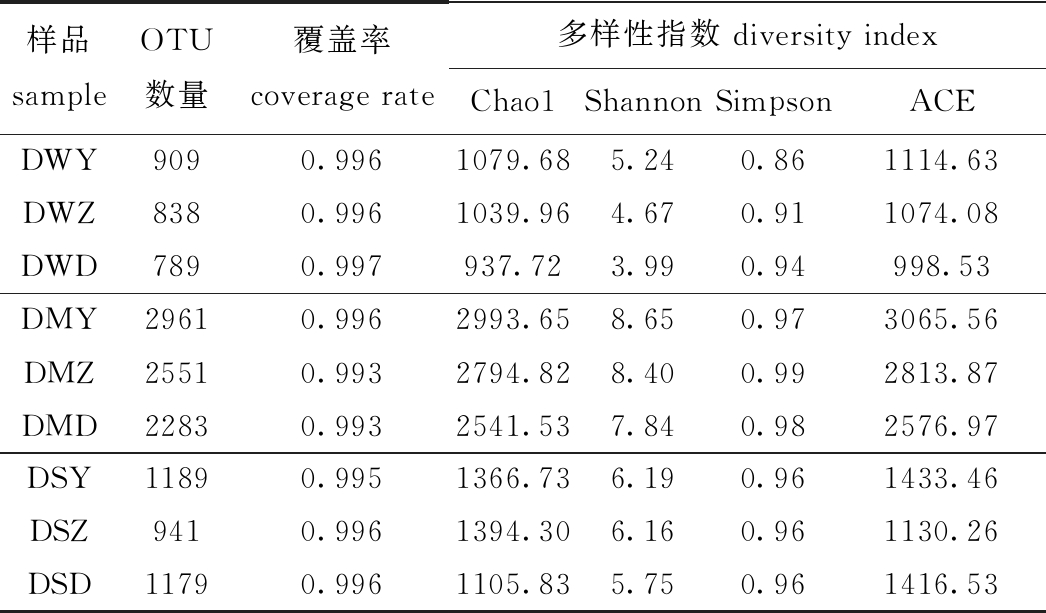
样品sampleOTU数量覆盖率coverage rate多样性指数 diversity indexChao1ShannonSimpsonACEDWY9090.9961079.685.240.861114.63DWZ8380.9961039.964.670.911074.08DWD7890.997937.723.990.94998.53DMY29610.9962993.658.650.973065.56DMZ25510.9932794.828.400.992813.87DMD22830.9932541.537.840.982576.97DSY11890.9951366.736.190.961433.46DSZ9410.9961394.306.160.961130.26DSD11790.9961105.835.750.961416.53
注:DW为水样,DM为沉积物,DS为刺参肠道样品;Y为养水机参池,Z为自然纳潮参池,D为微孔曝气参池,下同
Note: DW, water sample;DM, sediment sample;DS, intestinal sample of sea cucumber; Y, sea cucumber pond with water quality regulator; Z, natural tidal pond; D, microporous aerated pond,et sequentia
2.2 3种水质调控方式下参池细菌群落结构分析
所测定的9个样品中包含的优势菌门类如表2所示,主要为变形菌门Proteobacteria、拟杆菌门Bacteroidetes、疣微菌门Verrucomicrobia、放线菌门Actinocteria、厚壁菌门Firmicutes、浮霉菌门Planctomycetes、酸杆菌门Acidobacteria、绿弯菌门Chloroflexi、蓝细菌门Cyanobacteria、芽单胞菌门Gemmatimonadetes。另外,41个门类菌在9个样品中含量均不足1%。
3种水质调控方式下,养水机参池、自然纳潮参池、微孔曝气参池水样中分别出现27、25、23种菌门。养水机参池和自然纳潮参池水样优势菌门均为变形菌门,分别占55.9%、71.9%,次优势菌均为拟杆菌门,分别占42.2%、22.7%,而微孔曝气参池优势菌门为拟杆菌门,占61.9%,次优势菌为变形菌门,占36.4%。变形菌门中均以α-变形菌纲Alphaproteobacteria或γ-变形菌纲Gammaproteobacteria为主;拟杆菌门中以Flavobacteriia纲为主,分别占22.3%~60.6%。值得注意的是,自然纳潮参池水中蓝细菌较高,为3.5%(表2)。
3种水质调控方式下,养水机参池、自然纳潮参池、微孔曝气参池沉积物中分别出现49、43、43种菌门,优势菌门均为变形菌门,分别占68.3%、73.2%、74.6%,养水机参池和微孔曝气参池沉积物次优势菌均为拟杆菌门,分别占9.9%、6.2%,而自然纳潮参池中次优势菌为厚壁菌门,占7.5%。变形菌门中以γ-变形菌纲和δ-变形菌纲为主。值得注意的是,自然纳潮参池沉积物中厚壁菌门的相对丰度(7.5%)是其他两参池的2倍以上;绿弯菌门的相对丰度(1.4%)仅为其他两参池的一半;养水机参池沉积物浮霉状菌门是其他两参池的2倍;微孔曝气参池沉积物放线菌门的相对丰度(3.7%)远高于其他两参池(表2)。
3种水质调控方式下,养水机参池、自然纳潮参池、微孔曝气参池刺参肠道分别出现28、28、33种菌门,优势菌门均为变形菌门,分别占67.9%、64.8%、73.7%,且均以α-变形菌纲为第一优势菌,γ-变形菌纲为第二优势菌。养水机和自然纳潮参池刺参肠道中次优势菌均为疣微菌门,分别占13.5%、14.9%,而微孔曝气参池次优势菌门为拟杆菌门,占9.6%。自然纳潮池塘刺参肠道浮霉状菌的相对丰度(1.4%)远低于其他两参池。
表2 样品中优势门的相对丰度
Tab.2 Relative abundance of superiority phylum in the samples %
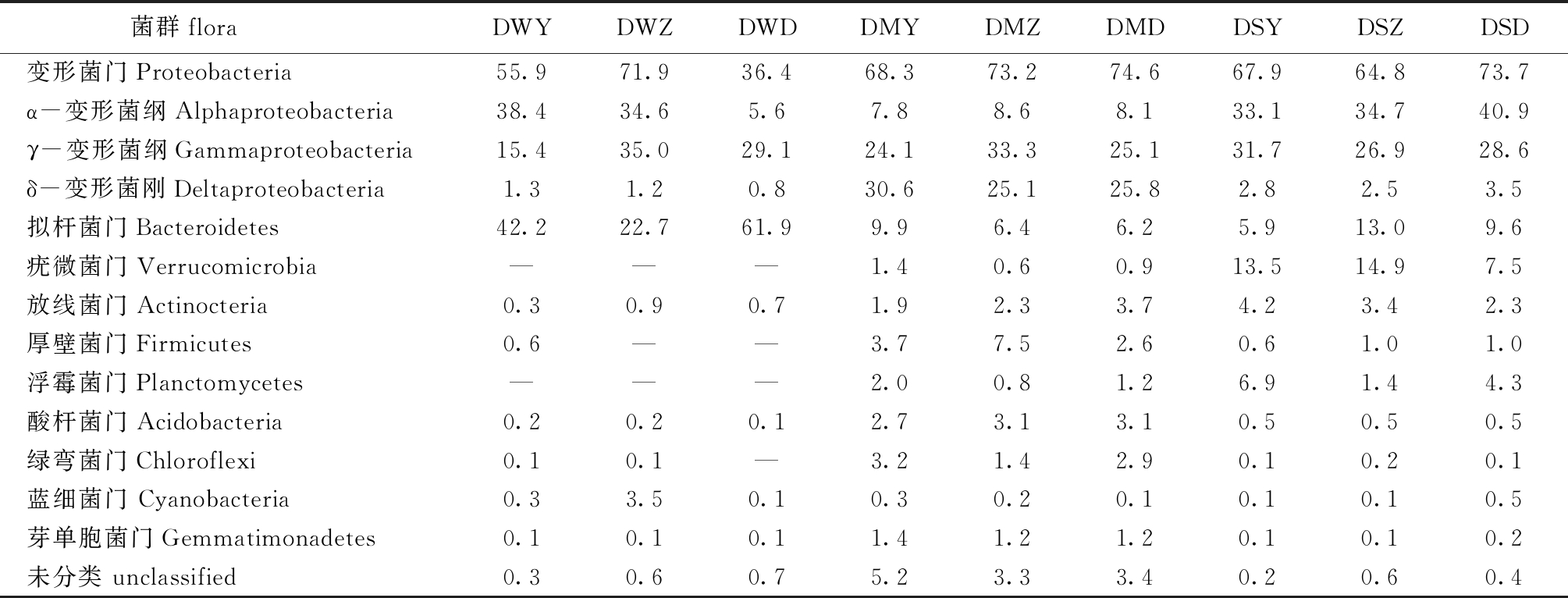
菌群floraDWYDWZDWDDMYDMZDMDDSYDSZDSD变形菌门Proteobacteria55.971.936.468.373.274.667.964.873.7α-变形菌纲Alphaproteobacteria38.434.65.67.88.68.133.134.740.9γ-变形菌纲Gammaproteobacteria15.435.029.124.133.325.131.726.928.6δ-变形菌刚Deltaproteobacteria1.31.20.830.625.125.82.82.53.5拟杆菌门Bacteroidetes42.222.761.99.96.46.25.913.09.6疣微菌门Verrucomicrobia———1.40.60.913.514.97.5放线菌门Actinocteria0.30.90.71.92.33.74.23.42.3厚壁菌门Firmicutes0.6——3.77.52.60.61.01.0浮霉菌门Planctomycetes———2.00.81.26.91.44.3酸杆菌门Acidobacteria0.20.20.12.73.13.10.50.50.5绿弯菌门Chloroflexi0.10.1—3.21.42.90.10.20.1蓝细菌门 Cyanobacteria0.33.50.10.30.20.10.10.10.5芽单胞菌门Gemmatimonadetes0.10.10.11.41.21.20.10.10.2未分类 unclassified0.30.60.75.23.33.40.20.60.4
9个测序样品中,主要优势属为NS3a_marine_group、Sulfitobacter、Haliea、Sulfurovum、Polaribacter、Nonlabens、Halioglobus、Haloferula、Acinetobacter、Rhodopirellula(表3)。
3种水质调控方式下,养水机和微孔曝气参池水样中第一优势菌属均为NS3a_marine_group,分别占15.02%、17.09%,远高于自然纳潮池塘,但自然纳潮参池第一优势菌属为Nonlabens,占9.65%。值得注意的是,Polaribacter和NS3a_marine_group两种属在养水机和微孔曝气池塘水样中相对丰度分别是自然纳潮池塘的10~15倍(表3)。
3种水质调控方式下,参池沉积物中超过1%的优势群类与池塘水样中不同,分别为Haliea、Sulfitobacter、Sulfurovum、Halioglobus、Acinetobacter,养水机参池沉积物中第一优势菌属为Haliea,占2.59%,自然纳潮参池沉积物中第一优势菌属为Acinetobacter,占4.51%,微孔曝气参池沉积物中第一优势菌属为Sulfurovum,占12.63%。值得注意的是,Sulfitobacte相对丰度在养水机池塘沉积物中最低,在自然纳潮池塘中最高,但差异不明显,而Sulfurovum相对丰度在养水机池塘最低,略低于自然纳潮池塘,但远低于微孔曝气池塘,其影响原因值得进一步探讨。Acinetobacter相对丰度在自然纳潮参池中是其他两参池的2倍以上(表3)。
表3 样品中优势属的相对丰度
Tab.3 Relative abundance of superiority genus in the samples %
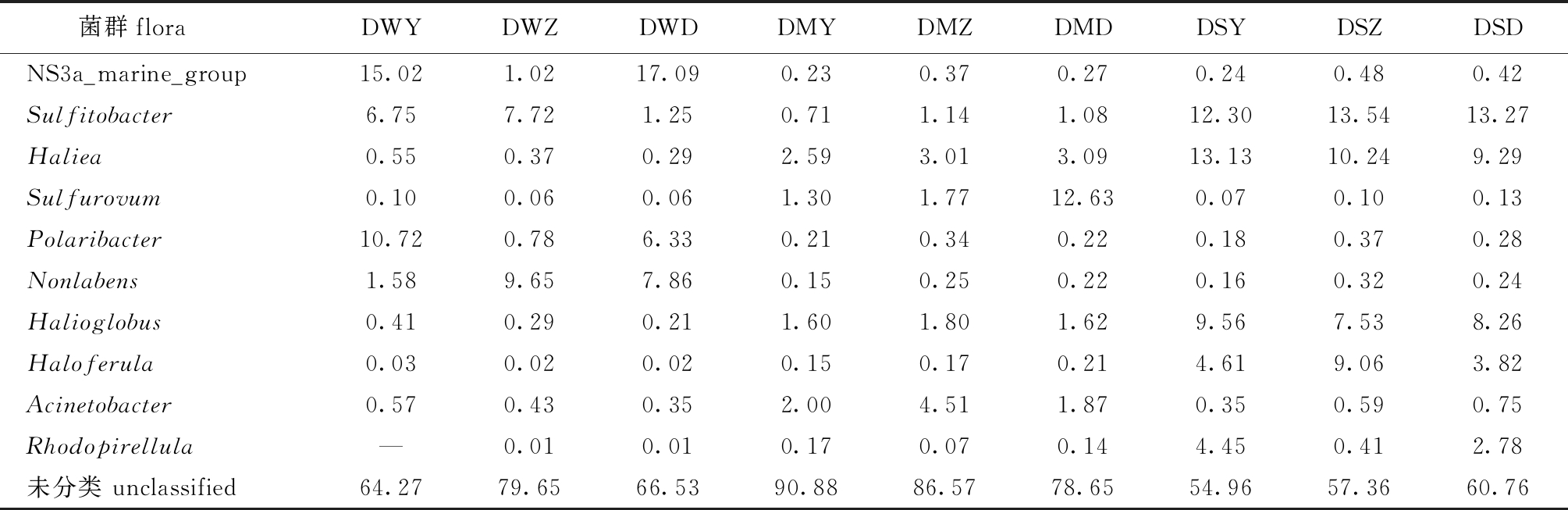
菌群floraDWYDWZDWDDMYDMZDMDDSYDSZDSDNS3a_marine_group15.021.0217.090.230.370.270.240.480.42Sulfitobacter6.757.721.250.711.141.0812.3013.5413.27Haliea0.550.370.292.593.013.0913.1310.249.29Sulfurovum0.100.060.061.301.7712.630.070.100.13Polaribacter10.720.786.330.210.340.220.180.370.28Nonlabens1.589.657.860.150.250.220.160.320.24Halioglobus0.410.290.211.601.801.629.567.538.26Haloferula0.030.020.020.150.170.214.619.063.82Acinetobacter0.570.430.352.004.511.870.350.590.75Rhodopirellula—0.010.010.170.070.144.450.412.78未分类 unclassified64.2779.6566.5390.8886.5778.6554.9657.3660.76
3种水质调控方式下,养水机池塘刺参肠道中第一优势菌属为Haliea,次优势属为Sulfitobacter,而自然纳潮和微孔曝气池塘刺参肠道中第一优势菌属为Sulfitobacter,次优势属为Haliea,这两个优势菌属在3个池塘的相对丰度差异不大。Haloferula属在自然纳潮池塘刺参肠道中相对丰度(9.06%)是其他两参池刺参肠道中的2倍以上;Rhodopirellula属在养水机池塘刺参肠道中相对丰度最高(4.45%),在自然纳潮池塘刺参肠道中最低(0.41%),仅占养水机池塘刺参肠道的十分之一(表3)。
2.3 3种调控方式下参池细菌群落结构相似度分析
从图2可见:通过对9种样品的细菌群落PCA分析发现,3种参池沉积物细菌的PCA坐标相距较远,说明其群落结构差异性较大;而3种参池水样和刺参肠道细菌的PCA坐标距离相距较近,表明其群落结构差异性不大。
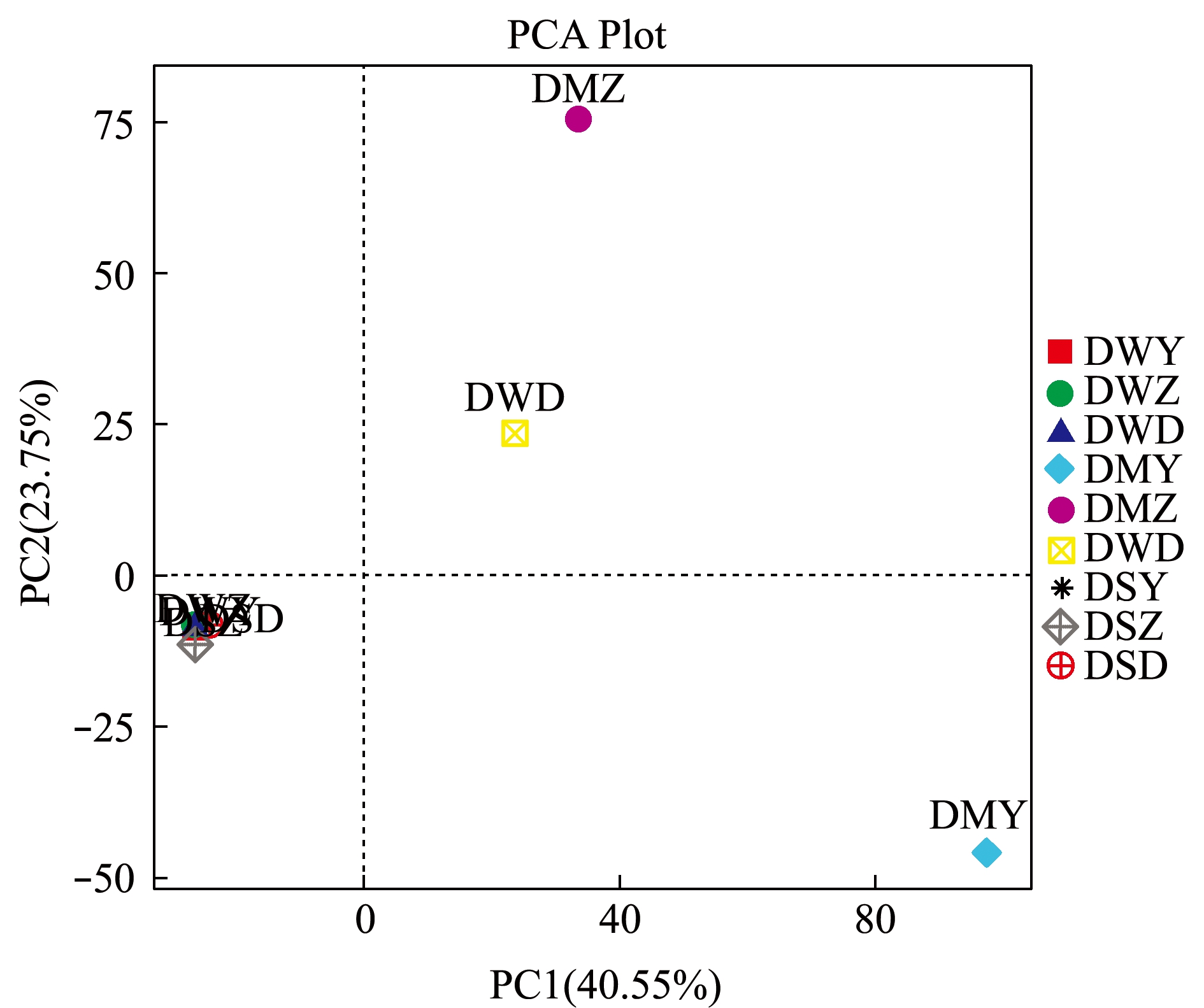
图2 样品主成分PCA分析图
Fig.2 Principal component analysis (PCA) graphics of samples
3 讨论
3.1 不同水质调控方式参池微生物菌群组成差异
窦妍等[16]研究表明,黄、渤海环境中细菌群落主要是由变形菌门、蓝细菌门、拟杆菌门、放线菌门组成,两地区优势菌门基本相同,第一优势类群均为变形菌门,相对丰度为48.1%~92.1%,黄海海域水体均以α-Proteobacteria为主。任利华等[12]、阳刚[17]研究表明,东营和蓬莱两地区刺参池塘水中的细菌群落由4~5种优势菌门组成,且两地区的优势菌门相同,拟杆菌门最多,占44.0%~44.4%,其次为变形菌门,占33.9%~36.9%(以α-Proteobacteria为主),厚壁菌门占3.6%~13.7%。闫法军[18]发现,山东省青岛市胶南的刺参池塘细菌以变形菌门、拟杆菌门、蓝细菌门为优势菌门,其中,变形菌纲细菌为春季水体中的绝对优势菌群,其相对丰度为49.3%~72.1%,其中以α-Proteobacteria量最高。本试验结果与上述文献结果相似,养水机参池和自然纳潮参池水样以变形菌门为第一优势菌,分别占55.9%、71.9%,而微孔曝气参池水样以拟杆菌门为第一优势菌,占61.9%,这两类细菌是海洋中主要的细菌类群[19],由于刺参池塘基本上不投饵,受养殖投饵影响较小,因此,水体与海洋中的第一优势菌群相同,但其占比不同。次优势菌群与其他学者的研究结果略有差异,这些差异可能与测定区域、海域生物和非生物的不同有关。本研究结果显示,3种水质调控方式也影响了池塘水体微生物群落组成,这可能是造成水质差异的原因。
李彬等[20]研究表明,刺参池塘沉积物中细菌群落多样性显著高于水体中细菌群落多样性,以变形菌菌门和拟杆菌门为主,变形菌门中多数情况下以γ-变形菌纲菌为最优势菌群,仅有少部分以δ-变形菌纲为优势菌群,且通常存在变形菌门中的其他变形菌纲,这与水体不同。本试验中测定显示,3种池塘沉积物中均以γ-变形菌纲和δ-变形菌纲为主要优势菌群,这与文献资料相似。
细菌是刺参肠道的重要组成成分[21],参与刺参饵料的消化、吸收[22],因此,了解刺参肠道菌群的正常组成情况,可为日后开发快速诊断刺参疾病免疫学方法奠定基础,也为分离刺参健康生长的益生菌提供菌种资源[23]。通过PCR-DGGE技术,王娇娇等[15]测得刺参肠道内含物菌群主要由变形菌门(γ-变形菌纲、α-变形菌纲、δ-变形菌纲)、绿弯菌门、疣微菌门和蓝藻门4大门类组成,其中变形菌门为优势菌门。高菲等[24]报道:刺参肠道内含物细菌群落也是由变形菌门中的3个(γ、α、δ)变形菌纲及拟杆菌门中的拟杆菌纲Bacteroidetes和柔膜菌门中的柔膜菌纲Mollicutes组成,但优势菌群仍为γ -Proteobacteria;此外,采用16S rDNA高通量技术测得刺参肠道中的细菌群落多样性显著高于采用PCR-DGGE技术测得的肠道菌群多样性。综上所述,无论是PCR-DGGE技术还是高通量测序技术,测得的刺参肠道第一优势菌群均为变形菌门中的γ-Proteobacteria,但不同区域其含量有所差异,利用PCR-DGGE技术测定的黄、渤海刺参肠道中的其他次优势菌门相差较大,但利用高通量测序技术(16S rDNA)测得的刺参肠道细菌组成相似,可能是高通量测序技术能够捕捉到更多基因的缘故,其数据更加可靠。本研究中通过高通量测序技术(16S rDNA)测得的刺参肠道细菌群落组成与其相似,也是由变形菌门为主。这与张文姬等[14]、王姣姣[15]等所报道的3种调控方式下刺参肠道内的菌群主要以α-变形菌纲为主一致,各池刺参肠道的优势菌门与沉积物不同,但与池塘沉积物中优势菌结构相似,与水中的优势属差距较大,这与刺参摄食底栖物质有关。
3.2 不同水质调控方式参池微生物群落多样性差异
群落生物多样性可以衡量区域内生物资源的丰富程度,评价群落的结构特征、稳定度等[25]。Yachi等[26]提出保险假说(Insurance hypothesis):当外界环境不断变化时,较高的生物多样性更能保证生态系统的功能冗余,使生态系统维持稳定。有研究表明,α多样性反映群落稳定性,维持群落α多样性在一定程度上可降低养殖生物发病的风险[27]。
窦妍等[28]研究表明,水和刺参肠道中的细菌多样性高于沉积物[30],本研究中测定结果与文献报道不同,沉积物中细菌多样性最高,其次是刺参肠道,水中细菌多样性最低,这可能与检测方法不同有关。测定16S rDNA序列一般采用PGGE或16S rRNA文库技术,PGGE仅能测定样品中含量超过1%的细菌群体,而16S rRNA文库技术需要将样品中的16S rRNA连接到载体后转接到活细胞中,这一过程可能丢失样本中的一些16S rRNA序列。本研究中使用的是16S rDNA 高通量测序技术,更能准确地反映池塘环境和肠道内容物的细菌群落。
3种水质调控方式下,养水机参池水环境中细菌的多样性最高,均匀度最好,这说明养水机参池在水质稳定上优于自然纳潮参池和微孔曝气参池,实测该池塘的水质指标与该结果是一致的[29]。微生物群落多样性高可稳定环境中的微生物,对防止某一微生物的大量繁殖有一定作用,同时也可抑制病原菌的大量繁殖。
3.3 不同水质调控方式池塘和肠道菌群结构差异
3种调控方式下水中细菌差异较小,可能与水环境中的水质差异较小有关。但3种调控方式下沉积物中菌群差异较大,这可能与3种调控方式对沉积物有机质含量、溶氧等造成的环境差异较大有关。
目前有关刺参肠道与沉积物细菌群落结构的关系有两种不同的观点,一种是刺参肠道菌群结构与沉积物中的菌群结构相似[30-31],另一种是刺参肠道菌群结构与沉积物中差异较大[32],认为刺参具有选择摄食性[33]。刺参肠道中的细菌菌群有可能来自育苗前期养殖水体的菌群,也有可能来自养殖环境中的菌群,这两类菌群都可能在刺参肠道内定居而形成肠道菌群。虽然本研究中测定的3种水质调控方式下刺参池塘沉积物中细菌群落结构相似度差异较大,但刺参肠道中细菌群落结构相似度差异较小,这表明沉积物中细菌群落结构对肠道的细菌群落结构影响较小,这与王轶南等[33]的研究结果一致,因此本文结果支持第二种观点。但究竟是刺参具有选择摄食性还是沉积物中细菌定居具有选择性还有待进一步研究。
[1] 农业部渔业渔政管理局.2015中国渔业统计年鉴[M].北京:中国农业出版社,2015.
[2] 农业部渔业渔政管理局.2016中国渔业统计年鉴[M].北京:中国农业出版社,2016.
[3] 刘园园,张劲松,石峰,等.池塘和网箱养殖海参效果的对比试验[J].河北渔业,2013(11):46-47.
[4] 常亚青,隋锡林,李俊.刺参增养殖业现状、存在问题与展望[J].水产科学,2006,25(4):198-201.
[5] 郭超,陈济丰,魏亚南,等.仿刺参养殖池塘三氮一磷及硫化物周年变化特征分析[J].现代农业科技,2018(4):213-215,221.
[6] 农业部渔业渔政管理局.2017中国渔业统计年鉴[M].北京:中国农业出版社,2017.
[7] 袁玉宝,金妮妮.浅谈我省刺参虾池养殖存在的问题及对策[J].齐鲁渔业,2004,21(8):16-17.
[8] 鲁伟,王秋玲.我国刺参养殖现状及存在问题[J].科学养鱼,2005(6):13-14.
[9] 王立超,孙德华.刺参的病害与防治[J].齐鲁渔业,2004,21(9):25.
[10] 宋春华,王祖杰.刺参的人工养殖[J].生物学通报,2005,40(2):26-27.
[11] 张建城.溶藻弧菌噬菌体特性及其防控刺参感染的研究[D].大连:大连理工大学,2017.
[12] 任利华,李斌,孙国华,等.16S rDNA克隆文库解析仿刺参(Apostichopus japonicus)苗种培育池中生物絮团的细菌群落结构[J].海洋与湖沼,2015,46(1):197-205.
[13] 关晓燕,周遵春,姜冰,等.DGGE分析不同盐度仿刺参养殖环境中菌群多样性[J].水产科学,2011,30(5):276-280.
[14] 张文姬,侯红漫,张公亮,等.仿刺参肠道可培养微生物多样性研究[J].食品工业科技,2011,32(9):149-151,155.
[15] 王姣姣,李丹,王轶南,等.不同养殖时期刺参肠道内菌群结构的分析[J].大连海洋大学学报,2015,30(4):345-350.
[16] 窦妍,丁君,曲凌云,等.秋、冬季刺参养殖池塘菌群的多样性分析[J].大连海洋大学学报,2015,30(2):143-148.
[17] 阳钢.几种微生态制剂对刺参(Apostichopus japonicus)养殖水体及刺参肠道菌群结构的影响[D].青岛:中国海洋大学,2012.
[18] 闫法军.刺参(Apostichopus japonicasSelenka)养殖池塘生态系统微生物结构与功能研究[D].青岛:中国海洋大学,2013.
[19] 韦静静.西太平洋微型生物群落结构及其影响因子的初步研究[D].厦门:厦门大学,2013.
[20] 李彬,廖梅杰,荣小军,等.池塘养殖仿刺参(Apostichopus japonicus)肠含物、附着基和底泥中的菌群结构及其相关性[J].渔业科学进展,2016,37(5):127-132.
[21] 常亚青,丁君,宋坚,等.海参、海胆生物学研究与养殖[M].北京:海洋出版社,2004:113-192.
[22] 张春云,王印庚,荣小军.养殖刺参腐皮综合征病原菌的分离与鉴定[J].水产学报,2006,30(1):118-123.
[23] 李凤辉.刺参消化道微生物组成及其产酶功能研究[D].上海:上海海洋大学,2014.
[24] 高菲,孙慧玲,许强,等.刺参消化道内含物细菌群落组成的PCR-DGGE分析[J].中国水产科学,2010,17(4):671-680.
[25] 裘钱玲琳,徐如卫,朱建林,等.凡纳滨对虾土塘养殖与循环养殖系统细菌群落结构比较研究[J].生物学杂志,2015,32(6):45-49.
[26] Yachi S,Loreau M.Biodiversity and ecosystem productivity in a fluctuating environment:the insurance hypothesis[J].Proceedings of the National Academy of Sciences of the United States of America,1999,96(4):1463-1468.
[27] Loreau M,Naeem S,Inchausti P,et al.Biodiversity and ecosystem functioning:current knowledge and future challenges[J].Science,2001,294(5543):804-808.
[28] 窦妍,丁君,王轶南,等.黄、渤海春季刺参肠道及养殖池塘细菌菌群的多样性[J].大连海洋大学学报,2014,29(6):572-576.
[29] 党子乔,杨申,鲁晓倩,等.富硒饲料对仿刺参成参的饲喂效果研究[J].河北渔业,2016(11):1-5.
[30] Sugita H,Hirose Y,Matsuo N,et al.Production of the antibacterial substance byBacillussp.strain NM12,an intestinal bacterium of Japanese coastal fish[J].Aquaculture,1998,165(3-4):269-280.
[31] Perdigon G,Naderde Macias M E,Alvarez S,et al.Prevention of gastrointestinal infection using immunobiological methods with milk fermented withLactobacillus caseiandLactobacillus acidophilus[J].Journal of Dairy Research,1990,57(2):255-264.
[32] Becker P,Gillan D,Lanterbecq D,et al.The skin ulceration disease in cultivated juveniles ofHolothuria scabra(Holothuroidea,Echinodermata)[J].Aquaculture,2004,242(1-4):13-30.
[33] 王轶南,朱世伟,常亚青.刺参肠道及养殖池塘菌群组成的PCR-DGGE指纹图谱分析[J].渔业科学进展,2010,31(3):119-122.