斜带石斑鱼Epinephelus coioides作为名贵的水产鱼类,是中国南方沿海地区特别是广东和福建网箱养殖的重要经济鱼类之一,因此,保护其生长环境显得尤为重要[1]。
近年来,随着社会经济发展,海上航运、石油与天然气的勘测与开发、海上工程建设等都会造成海洋环境噪声的增加[2-3],其中,船舶噪声是最为常见的水下噪声[4],海上船舶的种类繁多,大小不一,其声学特性也不尽相同。但船舶产生的水下噪声中,噪声频率通常为100~1000 Hz[5],根据鱼类的听阈特性可知,大部分鱼类的敏感频率也属于此范围[6]。已有研究表明,船舶的噪声污染对鱼类的行为和生理方面均会产生不利的影响[7-9],受到不利因素刺激时,鱼类会表现出生理生化参数的变化。Wysocki等[10]研究表明,水下船舶噪声可以引起不同鱼类皮质醇水平的增加,但噪声对生物的影响取决于噪声强度和频率的差异及与噪声源的距离[11]。鉴于此,本试验中在船舶的常见频率范围内,选用一个频率为600 Hz、声压级为130 dB(re 1 μPa)的正弦波纯音进行室内试验,通过测定斜带石斑鱼血清几种酶活力、肝脏热休克蛋白70(HSP70)表达量和肝组织病理变化,探讨了声刺激时间与石斑鱼生理生化指标变化间的关系,以评估声刺激对鱼类造成的影响,旨在为改善水产养殖动物的水声环境,以及海洋鱼类声学保护提供参考依据。
1 材料与方法
1.1 材料
试验用鱼采自广东省阳江市水产养殖区,斜带石斑鱼体质量为(42.54±6.03)g,体长为(13.26±0.78)cm,共160尾。
试验主要仪器:信号发射器(TFG6960A,SUin公司);功率放大器与升压变换器(HEA-1500G,南京佛能科技实业有限公司);低频大功率弯张换能器(FM700,中国科学院声学研究所),主要工作频率范围为300~1000 Hz;水听器(HTI-96-MIN,High Tech公司,美国),无前置放大器时灵敏度为-201 dB re 1 V/μPa,带宽为2000~30 000 Hz;正置光学显微镜(Nikon Eclipse CI,日本);成像系统(Nikon DS-U3,日本)。
1.2 方法
1.2.1 声刺激试验 声刺激试验于600 L PVC圆桶形水箱(直径为113 cm,高为82 cm)中进行,弯张换能器置于水箱中心位置。信号发射器产生信号,经功率放大器和升压变换器将信号放大后,由弯张换能器转换为声信号输出。试验组声信号为正弦波纯音,发射频率为600 Hz,声压级为130 dB(re 1 μPa);对照组为无人为额外添加声信号(环境背景噪声)。将试验鱼随机分为8组,每组20尾,分别暂养于8个相同的600 L PVC圆桶形水箱中,取样时间点为声刺激的0(对照)、2、6、12、24、48、72、120 h,从对应的8组中取3尾鱼。试验期间,水体盐度为 36.40±0.81,温度为 (25.61±0.39)℃,每日换水1次,换水量为1/2,每次取样前停止摄食24 h。
1.2.2 样品采集与血清酶活力测定 鱼体用100 mg/L的MS-222快速麻醉后,用一次性注射器(1 mL)从尾部静脉采血,注入离心管中,于低温下凝固2~3 h,4 ℃下以4000 r/min离心取其上层血清,置于-20 ℃下保存备用。
采用南京建成生物公司的试剂盒测定血清中酸性磷酸酶(ACP)、碱性磷酸酶(AKP)、谷草转氨酶(GOT)、谷丙转氨酶(GPT)活力,指标检测原理与方法参照说明书。
1.2.3 Western Blot法检测鱼肝脏组织HSP70蛋白表达量 将采血后的鱼快速解剖,取其肝脏组织,用预冷的PBS清洗2~3次,去除血污后于超低温冰箱(-80 ℃)中保存备用。将肝脏组织剪成小块置于匀浆管中,加入1~2个2 mm的小磁珠和10倍组织体积的PBS(添加蛋白酶抑制剂),匀浆1 min后冰浴30 min,再以12 000 r/min离心10 min,取其上清,用BCA法测定蛋白浓度后,将蛋白溶液按照4∶1的比例加入5倍蛋白上样缓冲液,沸水浴变性15 min,置于冰箱(-20 ℃)中保存备用。
用300 mA恒流湿转膜1 h后将PVDF膜于室温下脱色,再用5%的脱脂牛奶(0.5% TBST配)封闭1 h。在 4 ℃下将膜与Anti-HSP70(mouse monoclonal,Sigma公司, 以5%的脱脂牛奶按1∶3000稀释)一起孵育过夜,在TBST中脱色3次(5 min/次),结合HRP-conjugated Goat Anti-Mouse IgG(BBI Life Sciences, 1∶1000稀释)于室温下孵育30 min,在TBST中脱色3次后置于化学发光系统上显影,用Alpha软件分析目标带的光密度。
1.2.4 肝脏切片病理组织学检测 取斜带石斑鱼肝脏组织固定于4%多聚甲醛中,修块和再固定,用梯度乙醇脱水、石蜡包埋、制片(厚4 μm)、H.E染色,在光学显微镜下观察并拍照。
1.3 数据处理
试验结果均以平均值±标准差(mean±S.D.)的形式表示,使用SPSS 23软件进行单因素方差分析(One-way ANOVA),并使用Tukey HSD法进行组间多重比较,显著性水平设为0.05。
2 结果与分析
2.1 斜带石斑鱼血清酶活力随声刺激时间的变化
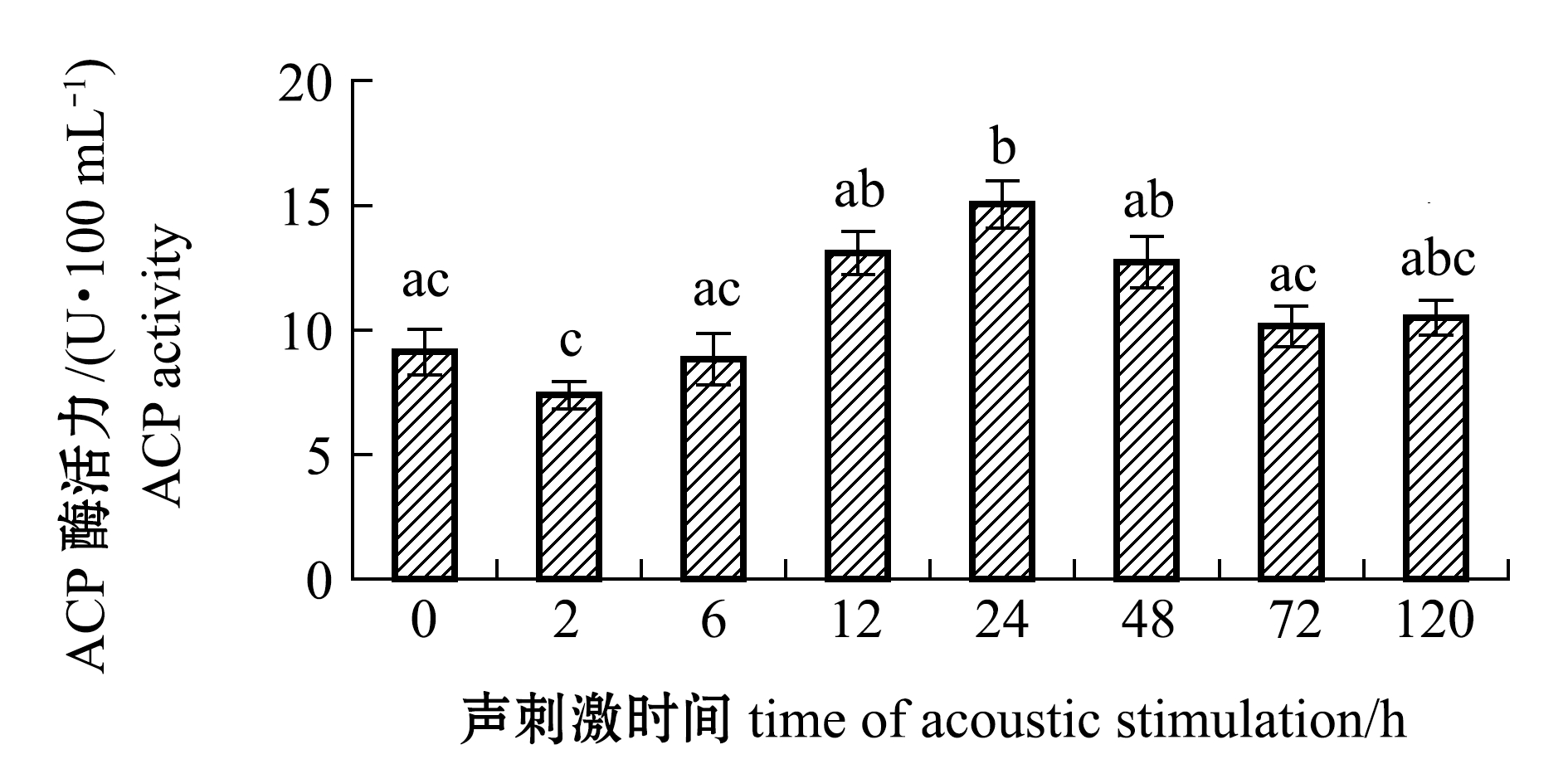
2.1.1 ACP酶活力的变化 从图1可见:在试验周期内,斜带石斑鱼血清ACP酶活力呈现先下降后升高最后逐渐恢复至初始水平的变化趋势;与初始(0 h)相比,声刺激2 h时ACP酶活力有所下降,但无显著性差异(P>0.05);声刺激12 h时ACP酶活力显著高于2 h时(P<0.05);声刺激24 h时ACP酶活力水平最高,为15.04 U/100 mL,且显著高于初始水平(P<0.05);声刺激72、120 h时ACP酶活力恢复至初始水平(P>0.05)。
2.1.2 AKP酶活力的变化 从图2可见:在试验周期内,斜带石斑鱼血清AKP酶活力总体呈现先下降后升高最后恢复至初始水平的变化趋势,除声刺激12 h时酶活力略有升高(P>0.05)外,其余时间点酶活力均低于初始水平;与初始相比,声刺激24、48 h时AKP酶活力水平下降幅度较大,且显著低于其余时间点(P<0.05),其中,声刺激48 h时酶活力最低,仅为6.22 U/100 mL;声刺激72、120 h时酶活力水平又恢复至初始水平(P>0.05)。
注:标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同
Note: The means with different letters are significant differences at the 0.05 probability level, and the means with the same letters are not significant differences, et sequentia
图1 斜带石斑鱼血清ACP酶活力随声刺激时间的变化
Fig.1 Changes in ACP activities in serum of grouperEpinephelus coioideswith the time of acoustic stimulation
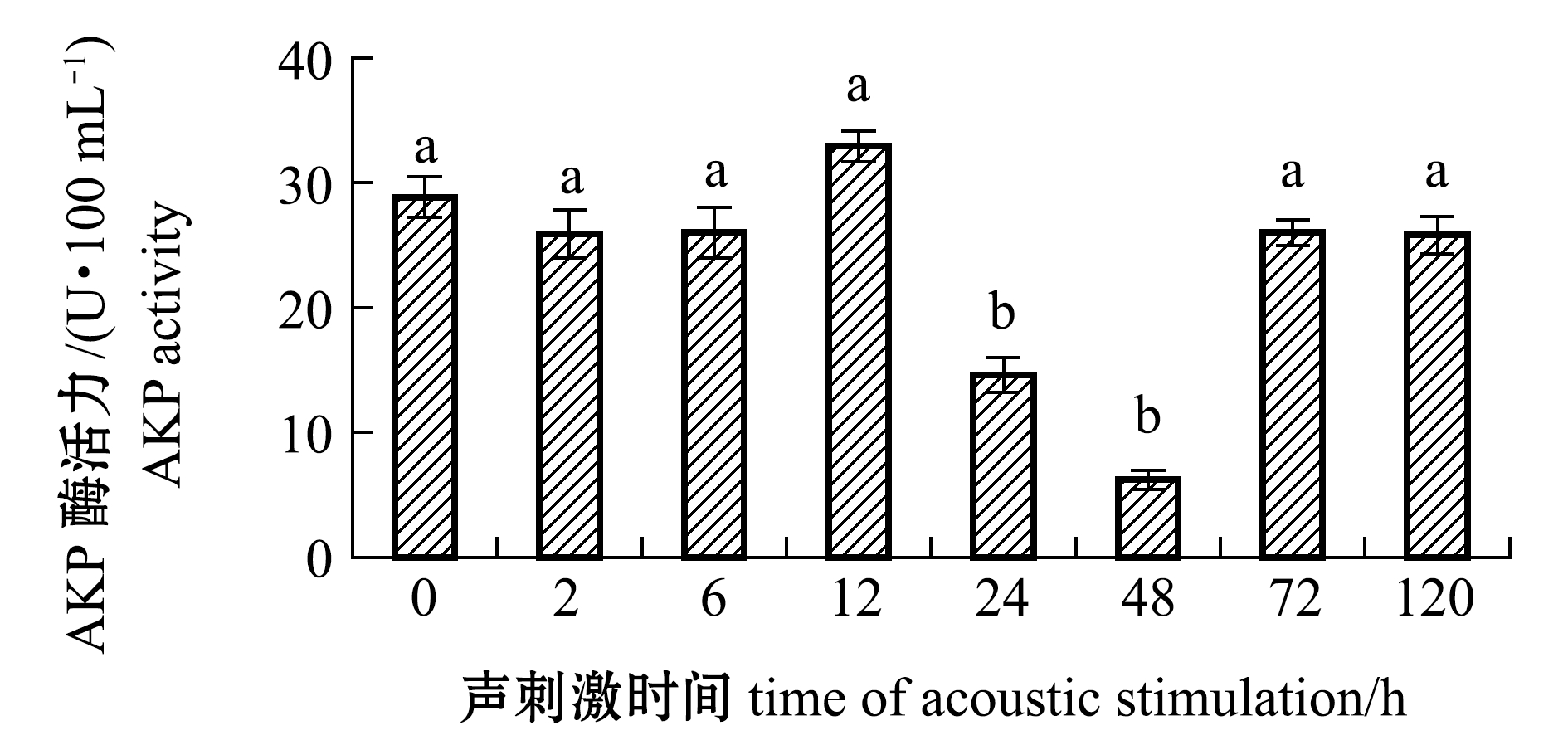
图2 斜带石斑鱼血清AKP酶活力随声刺激时间的变化
Fig.2 Changes in AKP activities in serum of grouperEpinephelus coioideswith the time of acoustic stimulation
2.1.3 GOT酶活力的变化 从图3可见:在试验周期内,斜带石斑鱼血清GOT酶活力呈先上升后下降最后恢复至初始水平的变化趋势;声刺激2 h时酶活力略高于对照组(P>0.05);声刺激6 h时GOT酶活力水平最高,且显著高于初始水平(P<0.05);声刺激12 h时GOT酶活力开始下降,声刺激48 h后恢复至初始水平(P>0.05)。
2.1.4 GPT酶活力的变化 从图4可见:在试验周期内,斜带石斑鱼血清GPT酶活力呈先上升后下降最后恢复至初始水平的变化趋势;声刺激12 h时GPT酶活力达到最大值,为29.26 U/L,声刺激12、24 h时GPT酶活力显著高于初始水平(P<0.05);声刺激48 h后GPT酶活力又恢复至初始水平(P>0.05)。
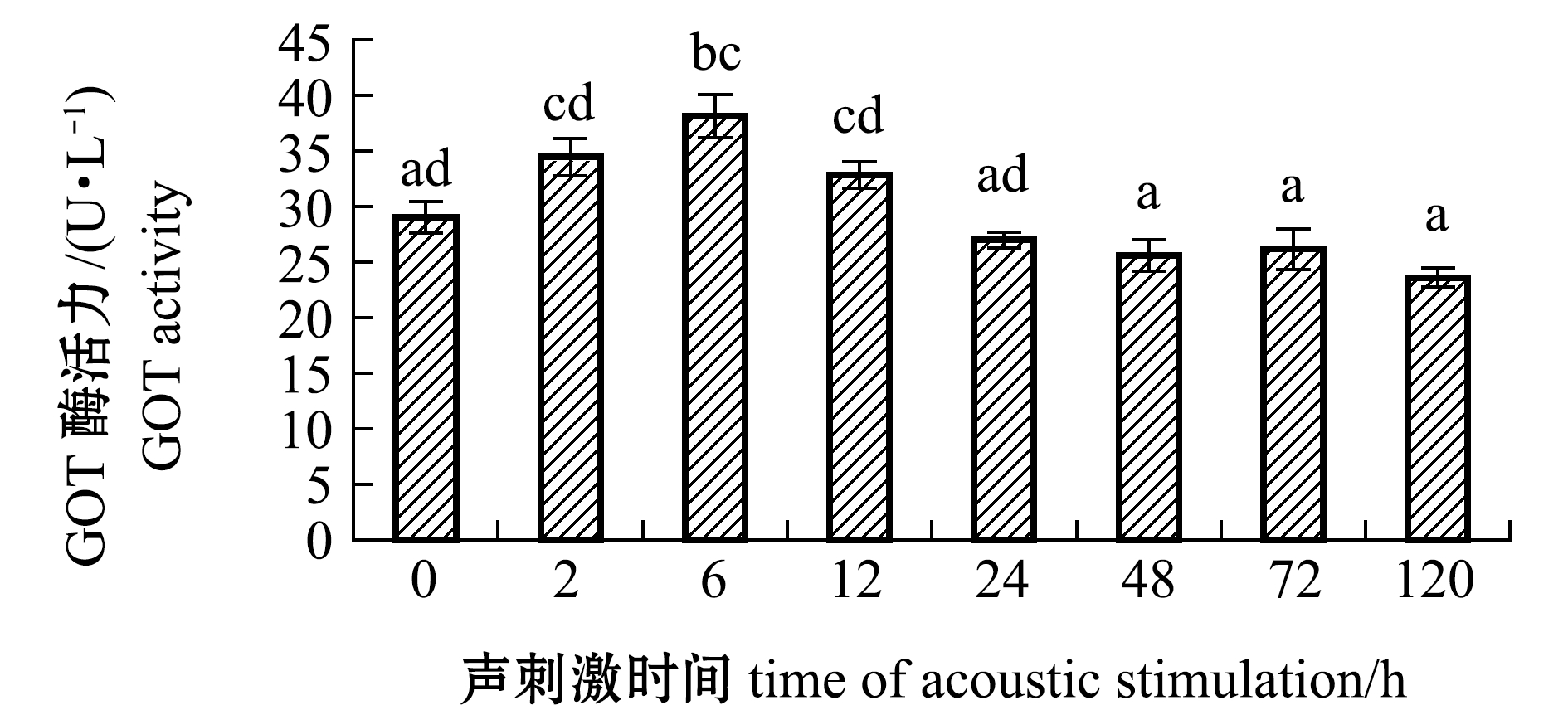
图3 斜带石斑鱼血清GOT酶活力随声刺激时间的变化
Fig.3 Changes in GOT activities in serum of grouperEpinephelus coioideswith the time of acoustic stimulation
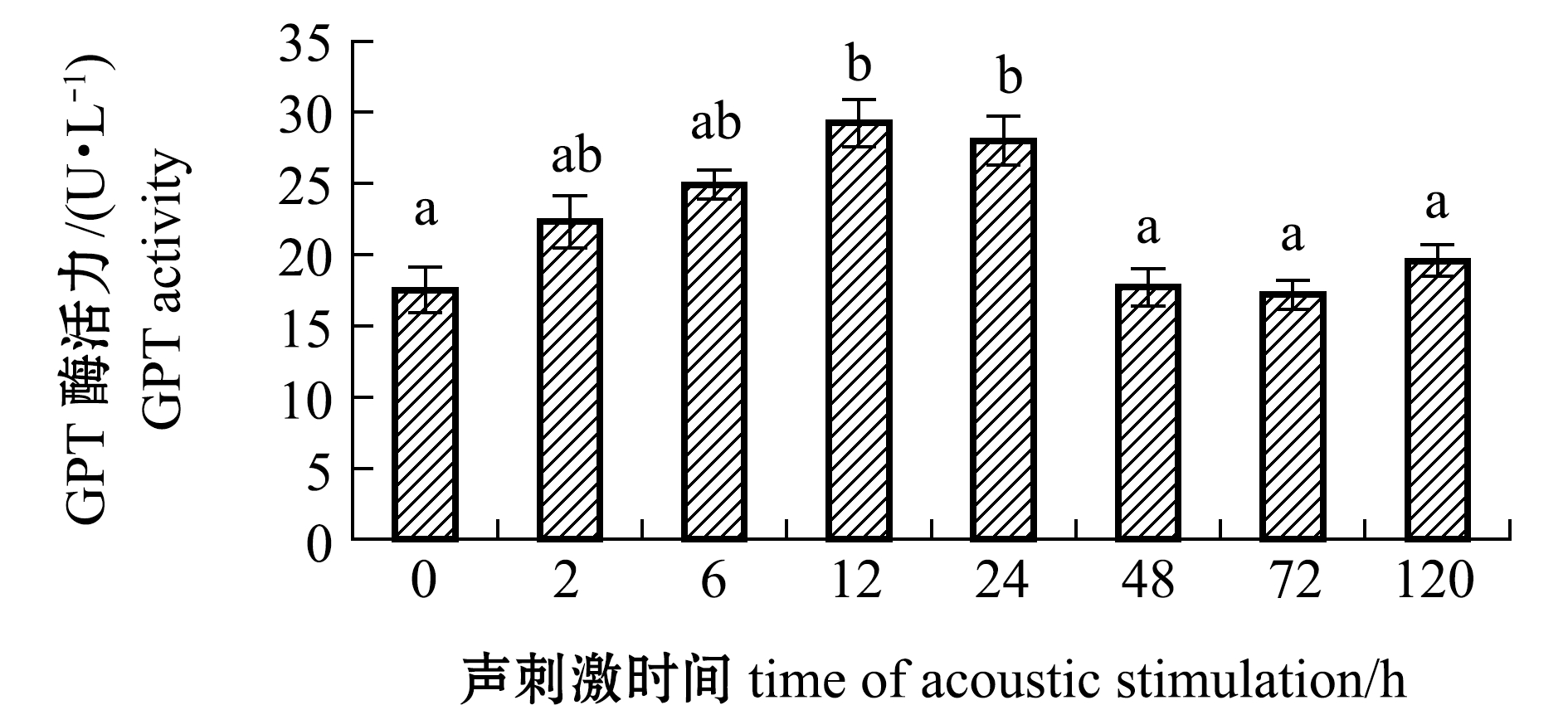
图4 斜带石斑鱼血清GPT酶活力随声刺激时间的变化
Fig.4 Changes in GPT activities in serum of grouperEpinephelus coioideswith the time of acoustic stimulation
2.2 斜带石斑鱼肝脏HSP70表达量随声刺激时间的变化
从图5可见:经Western Blot检测,随声刺激后时间的延长,石斑鱼肝脏HSP70表达量总体呈现升高的趋势;声刺激2、6 h时,HSP70表达量略有升高(P>0.05);声刺激12 h时,HSP70表达水平最高,且显著高于初始水平(P<0.05);声刺激24~72 h时,HSP70表达量较12 h时HSP70表达量有所降低(P>0.05);声刺激120 h时又有所升高且显著高于初始水平(P<0.05)。
2.3 肝脏切片病理组织学检测
斜带石斑鱼肝脏组织切片观察结果(图6)显示:未经声刺激的石斑鱼肝细胞呈多面体形紧密排列,细胞核大而圆,多为单核,居细胞中央,且着色较深;肝窦沿中央静脉呈放射状相间排列,结构清晰;中央静脉位于肝小叶中部,周围有较多肝窦开口,肝板清晰,表现为正常形态。经2~24 h声刺激后,斜带石斑鱼肝细胞受到轻微损伤,胞质内脂质含量较高,肝细胞胞质稀疏,胞核偏移至一侧,部分区域肝细胞排列散乱,肝窦间隙增大;声刺激48 h后,肝细胞受到较大的损伤,整体主要表现为肝板消失,肝细胞体积增大,失去固有形态,细胞排列较为疏松,大部分细胞核因变性出现固缩和溶解状,着色较浅;在声刺激12、48、72 h时静脉腔内有血细胞聚集。这表明,声刺激对试验鱼体肝脏有一定程度损伤,但在试验周期内,肝脏组织未见明显的坏死、炎症和纤维化等病理改变。
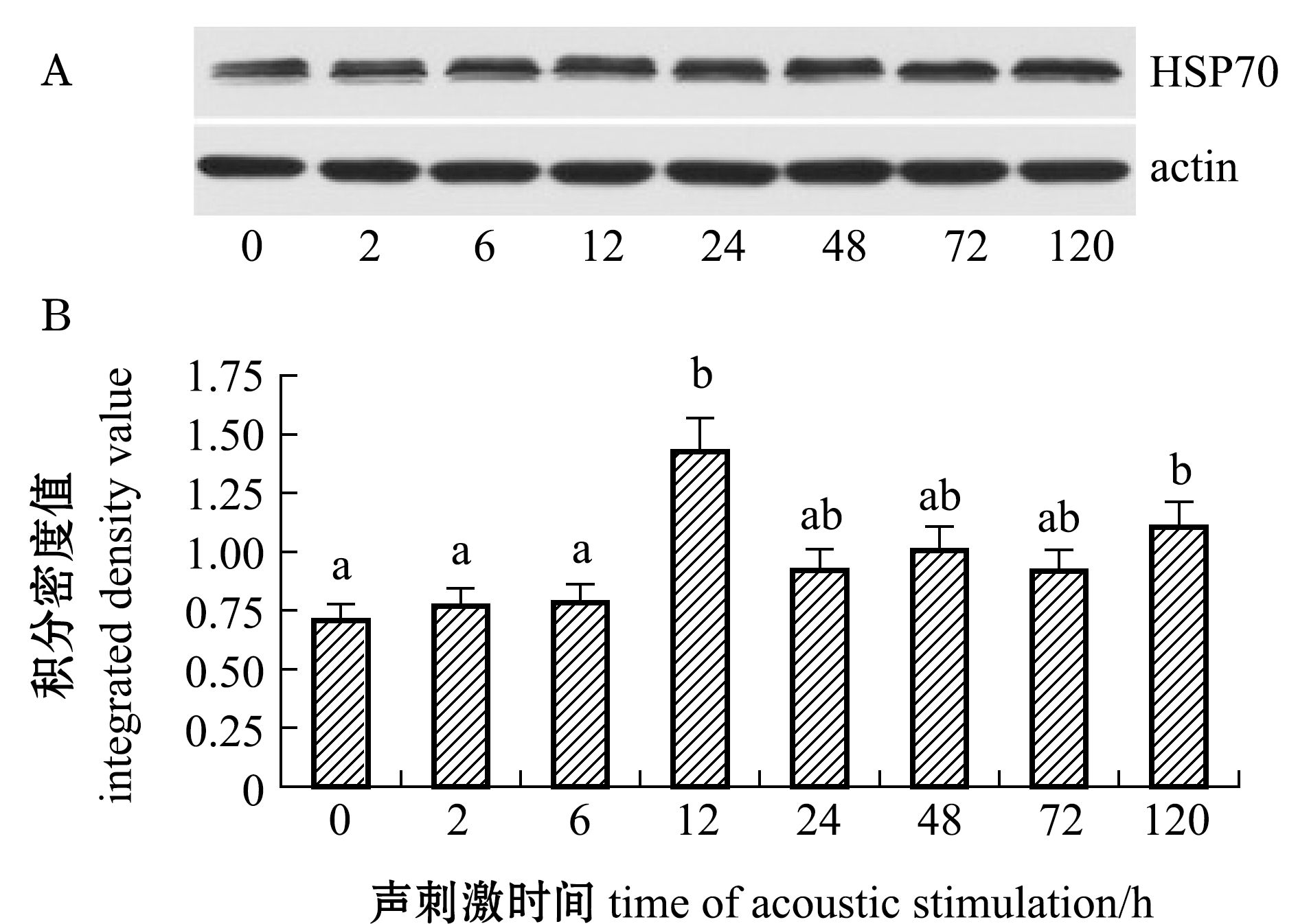
注:A为蛋白印迹法检测斜带石斑鱼肝脏中HSP70蛋白表达条带;B为HSP70的积分密度值
Note: A, HSP70 expression bands in the liver of grouperEpinephelus coioidesdetected by Western Blot; B,integrated density value of the HSP70
图5 声刺激对斜带石斑鱼肝脏HSP70表达量的影响
Fig.5 Effect of the acoustic stimulation on the expression levels of the protein HSP70 in liver of grouperEpinephelus coioides
3 讨论
人为噪声被认为是21世纪的主要污染物之一,而海洋动物,特别是海洋鱼类和海洋哺乳动物,大部分具有声信号感知能力,对声音非常敏感[12],会因为人为噪声引起原生存环境的变化而导致机体内生理生化指标的变化。

注:CV为中央静脉;BV为血管;BC为血细胞;HC为肝细胞;HN为肝细胞核;HS为肝窦;HP为肝板
Note: CV,central vein; BV, blood vessel; BC, blood cell; HC, hepatic cell; HN, heptocyte nucleus; HS, hepatic sinusoid; HP, hepatic plate图6 声刺激后斜带石斑鱼肝脏组织的病理变化(H.E染色,200×)
Fig.6 Pathological changes in liver of grouperEpinephelus coioidesexposed to acoustic stimulation (H.E staining,200×)
3.1 声刺激对斜带石斑鱼血清酶活力的影响
ACP和AKP是水解酶体系中重要的两种酶,在磷化物等营养物质的消化、吸收、转运中起重要作用[13]。ACP和AKP酶的活性高低对机体代谢和免疫有重要影响,在适宜范围内活性升高表明代谢功能加强[14]。本研究结果表明,声刺激会引起斜带石斑鱼的应激反应,其酶活力在试验周期内会有明显的变化。声刺激2 h内ACP酶活力水平稍有下降,可能由于机体来不及对声刺激做出适应性反应;声刺激6 h时ACP酶活力持续上升,24 h时达到最大,这可能是鱼在应激后通过调节ACP酶活性水平以抵御机体损伤[15];声刺激120 h时ACP酶活力随着机体的调节逐渐趋于声胁迫前水平,此结果与尤宏争等[16]研究结果相似,表明短期的声刺激对鱼体造成的损伤可能会随着机体的自身调节而逐渐得到恢复。韩振兴等[17]研究了不同电磁场对鲫鱼生理影响,结果表明,电磁场胁迫24、48 h时AKP酶活性明显低于对照水平。郑榕辉等[18]在褐菖鮋腹腔内注射不同浓度的三丁基锡(TBT),发现随着TBT浓度的增大,AKP酶活性呈先上升后下降的变化趋势,表明TBT影响褐菖鮋的正常代谢。本试验结果显示:声刺激12 h时,AKP酶活力水平略有上升的趋势,表明鱼体受到应激,体内新陈代谢速率加快,ATP合成增加,磷基团转移增多,导致AKP酶活力上升;声刺激24、48 h时,AKP酶活力下降幅度较大,表现为抑制作用,可能是由于声信号持续刺激对免疫系统有损伤,导致参与免疫的巨噬细胞发生变化,从而降低了鱼体免疫反应水平[19];之后随着声信号持续刺激受试鱼适应了环境,噪声污染效应减缓,在试验后期(72~120 h)酶活力水平逐渐恢复至声刺激前水平,表现出鱼对环境的适应性与耐受性。
GPT和GOT是氨基酸代谢、蛋白质合成与分解过程中的关键酶,主要分布于肝脏组织中,是肝脏损伤重要指示酶[20]。在正常情况下,只有少量转氨酶被释放至血液中,当组织产生病变时,血清中GPT和GOT酶活力就会显著增高[21]。王涛等[22]研究发现,大黄鱼Pseudosciaena crocea经突降盐度胁迫后血清中GPT和GOT酶活力水平显著上升,与本试验结果一致。本试验结果表明:石斑鱼对声刺激产生了应激反应,声信号引起的振动会导致机体组织损伤,增加了细胞膜的通透性,GPT和GOT酶渗入血液,导致血清中GPT和GOT酶活力在12 h内上升;随着声刺激时间的延长,GPT和GOT酶活力均在48 h后逐渐恢复至胁迫前水平,表明声刺激对于鱼体的损伤可随着时间的延长而自行调节恢复。
3.2 声刺激对斜带石斑鱼肝脏中HSP70表达量的影响
鱼类能对噪声胁迫压力做出应激反应,目前最常研究的应激蛋白家族是热休克蛋白(HSPs)中的HSP70,HSP70家族是最为保守的,且在大多数生物中也是含量最多的一种蛋白,最能代表机体组织细胞抵御环境压力的能力[23]。
本试验结果显示,斜带石斑鱼肝脏HSP70蛋白表达水平在声刺激0~6 h期间上升不明显,但声刺激12 h时HSP70表达水平显著升高,推测鱼受到声刺激后对机体肝脏产生了一定的损伤,其自身可以通过调节HSP70以维持细胞的稳定性,保护其组织免受损伤[24-26]。HSP70与其他异常蛋白结合可减少产生不溶性聚集物的危险性,从而增强对细胞的保护,提高机体对环境的适应能力,是鱼机体自主适应性的生理表现。相关研究表明,HSP70的表达只能在一定程度内保护细胞不被损伤,若应激超过一定强度或进一步延长暴露时间,可能引起胞膜结构和蛋白质组成的异常,从而抑制HSP70的表达。本研究中,HSP70表达量在声刺激12 h时达到最高水平,之后表达水平虽有所下降,但仍比声刺激前要高,这可能是受试鱼在经过声刺激后建立了新的生理平衡。
3.3 声刺激对斜带石斑鱼肝脏组织病理学变化的影响
肝细胞内含有多种内含物,主要有糖原、脂质和色素等,且其含量与机体的生理状态密切相关。当肝脏处于超负荷运作状态,就会造成肝脏组织的病理损伤,肝脏组织细胞的正常形态结构遭到破坏,进而影响肝脏的正常生理功能。声波振动的强度足以传播到机体内,引起机体内部器官损伤[27-28]。Oliveira等[29]研究长期暴露于宽带工业噪声的大鼠肝脏组织的变化时,发现噪声胁迫后其肝脏组织中出现大面积的结缔组织,表明噪声可以导致肝脏形成纤维组织。虽然在本试验中,声刺激后斜带石斑鱼肝细胞未出现纤维化情况,但肝细胞的静脉腔内有不同程度的红细胞聚集。区又君等[30]研究表明,急性低温胁迫会导致四指马鲅Eleutheronema tetradactylum幼鱼能量代谢及耗氧量增加,此时机体自身会通过肝血窦间隙增大与血流加快以满足对氧的需求,从而导致红细胞聚集,该结果与本试验结果吻合。本试验结果表明,在6 h时肝细胞未见明显变化,表明受到短暂的声刺激时,机体的能量供给主要来自葡萄糖等小分子物质的分解,对肝脏组织不会造成明显的损伤。彭士明等[31]对银鲳Pampus argenteus幼鱼的研究表明,在应激胁迫下,银鲳机体的能量供给主要来自肝脏糖原的分解。而在本试验中,声刺激48~120 h时肝细胞出现较多空泡,可能是持续的声刺激使斜带石斑鱼耗氧量增加, 导致肝糖原或脂质被分解,从而使肝细胞出现空泡化现象。在试验后期,肝脏的自我调节能力逐渐下降, 肝细胞损伤增加, 部分肝细胞表现为细胞核固缩或消失。
4 结论
声刺激对鱼类的行为、生理均会造成不同程度的影响,当受到外界刺激时,鱼类行为是最直观的反映,而血液生化指标则从生理学上对刺激的程度进行量化。本研究表明,声刺激72 h内,斜带石斑鱼血清中ACP、AKP、GPT和GOT酶活力随时间的延长而呈波动式变化,声刺激72 h后均恢复至初始水平;石斑鱼肝脏组织中HSP70蛋白表达水平在声刺激后均有所提高,其肝细胞受到的病理损伤在试验周期内未出现明显的恢复趋势。肝细胞的损伤是否会影响石斑鱼肝脏的正常生理功能,尚需进一步通过延长声刺激时间进行研究。由于鱼类种群间差异较大,不同生长阶段的个体也可能表现出其敏感性上的差异,因此,在以后的工作中仍需对斜带石斑鱼的听阈特性进行深入的研究。
[1] 周韦峥嵘.声刺激对两种海洋甲壳动物运动行为和HSP70表达的影响研究[D].厦门:厦门大学,2016.
[2] Hawkins A,Popper A.Effects of noise on fish,fisheries,and invertebrates in the U.S.Atlantic and Arctic from energy industry sound-generating activities[R].Bedford N H:Bureau of Ocean Energy Management,2012.
[3] Ren Huiying,Halvorsen M B,Deng Z D,et al.Aquatic acoustic metrics interface utility for underwater sound monitoring and analysis[J].Sensors,2012,12(6):7438-7450.
[4] Vasconcelos R O,Amorim M C P,Ladich F.Effects of ship noise on the detectability of communication signals in the Lusitanian toadfish[J].Journal of Experimental Biology,2007,210(12):2104-2112.
[5] McDonald J I,Wilkens S L,Stanley J A,et al.Vessel generator noise as a settlement cue for marine biofouling species[J].Biofouling:The Journal of Bioadhesion and Biofilm Research,2014,30(6):741-749.
[6] Popper A N,Fay R R,Platt C,et al.Sound detection mechanisms and capabilities of teleost fishes[M]//Collin S P,Marshall N J.Sensory Processing in Aquatic Environments.New York:Springer,2003:3-38.
[7] Voellmy I K,Purser J,Flynn D,et al.Acoustic noise reduces foraging success in two sympatric fish species via different mechanisms[J].Animal Behaviour,2014,89:191-198.
[8] Voellmy I K,Purser J,Simpson S D,et al.Increased noise levels have different impacts on the anti-predator behaviour of two sympatric fish species[J].PLoS One,2014,9(7):e102946.
[9] Holles S,Simpson S D,Radford A N,et al.Boat noise disrupts orientation behaviour in a coral reef fish[J].Marine Ecology Progress Series,2013,485:295-300.
[10] Wysocki L E,Dittami J P,Ladich F.Ship noise and cortisol secretion in European freshwater fishes[J].Biological Conservation,2006,128(4):501-508.
[11] Slabbekoorn H,Bouton N,van Opzeeland I,et al.A noisy spring:the impact of globally rising underwater sound levels on fish[J].Trends in Ecology & Evolution,2010,25(7):419-427.
[12] Hoelzel A R.Marine Mammal Biology:An Evolutionary Approach[M].Oxford:Wiley-Blackwell,2002.
[13] 何海琪,孙凤.中国对虾酸性和碱性磷酸酶的特性研究[J].海洋与湖沼,1992,23(5):555-560.
[14] 虞顺年,魏小岚,韦芳三,等.不同运动强度对黑鲷生长、血清和肝脏抗氧化指标的影响[J].水生生物学报,2018,42(4):255-263.
[15] 谭树华,李玉峰,刘文海,等.十二烷基硫酸钠(SDS)对克氏原螯虾抗氧化功能和酸性磷酸酶活性的影响[J].生态与农村环境学报,2014,30(3):392-397.
[16] 尤宏争,石洪玥,贾磊,等.短途运输胁迫对珍珠龙胆石斑鱼血清酶活力及葡萄糖含量的影响[J].经济动物学报,2018,22(2):72-77,84.
[17] 韩振兴,王韫沛,张硕,等.电磁场对鲫血清4种生化指标的影响研究[J].大连海洋大学学报,2018,33(3):359-364.
[18] 郑榕辉,王重刚,李岩,等.三丁基锡暴露对褐菖鲉碱性磷酸酶活性的影响[J].厦门大学学报:自然科学版,2005,44(S1):203-206.
[19] 崔前进,陈冰,邱丽华,等.低盐胁迫对钝吻黄盖鲽幼鱼鳃Na+/K+-ATP酶、肝脏抗氧化酶和非特异免疫酶的影响[J].广东海洋大学学报,2017,37(6):26-32.
[20] 高权新,谢明媚,彭士明,等.急性温度胁迫对银鲳幼鱼代谢酶、离子酶活性及血清离子浓度的影响[J].南方水产科学,2016,12(2):59-66.
[21] 陈玉春,顾雪飞,刘敏.5种中草药对鲤血清谷丙转氨酶、谷草转氨酶及红细胞过氧化氢酶活性的影响[J].淡水渔业,2007,37(5):11-13.
[22] 王涛,苗亮,李明云,等.突降盐度胁迫对大黄鱼(Pseudosciaena crocea)血清生理生化及鳃丝Na+/K+-ATP酶活性的影响[J].海洋与湖沼,2013,44(2):421-426.
[23] Heredia-Middleton P,Brunelli J,Drew R E,et al.Heat shock protein (HSP70) RNA expression differs among rainbow trout (Oncorhynchus mykiss) clonal lines[J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,2008,149(4):552-556.
[24] O’Connor W A,Lawler N F.Salinity and temperature tolerance of embryos and juveniles of the pearl oyster,Pinctada imbricataRöding[J].Aquaculture,2004,229(1-4):493-506.
[25] Ruscoe I M,Shelley C C,Williams G R.The combined effects of temperature and salinity on growth and survival of juvenile mud crabs (Scylla serrataForskål)[J].Aquaculture,2004,238(1-4):239-247.
[26] Soria G,Merino G,von Brand E.Effect of increasing salinity on physiological response in juvenile scallopsArgopecten purpuratusat two rearing temperatures[J].Aquaculture,2007,270(1-4):451-463.
[27] Castelo Branco N A,Rodriguez E,Alves-Pereira M,et al.Vibroacoustic disease:some forensic aspects[J].Aviation,Space,and Environmental Medicine,1999,70(3):A145-A151.
[28] Alves-Pereira M,Castelo Branco N A A.Vibroacoustic disease:biological effects of infrasound and low-frequency noise explained by mechanotransduction cellular signalling[J].Progress in Biophysics and Molecular Biology,2007,93(1-3):256-279.
[29] Oliveira M J R,Freitas D,Carvalho A P O,et al.Exposure to industrial wide band noise increases connective tissue in the rat liver[J].Noise & Health,2012,14(60):227-229.
[30] 区又君,刘奇奇,温久福,等.急性低温胁迫对四指马鲅幼鱼肝脏、肌肉以及鳃组织结构的影响[J].生态科学,2018,37(05):53-59.
[31] 彭士明,施兆鸿,李杰,等.运输胁迫对银鲳血清皮质醇、血糖、组织中糖元及乳酸含量的影响[J].水产学报,2011,35(6):831-837.