岩扇贝Crassadoma gigantean隶属于软体动物门Mollusca、瓣鳃纲Lamellibranchia、珍珠贝目Pterioida、扇贝科Pectinidae、岩扇贝属Crassadoma,原产于北美洲太平洋沿岸,是一种大型海水双壳贝类。近年来,随着人们生活水平的不断提高,国内对海产品的需求也不断上升,扇贝的规模化养殖快速发展,为了满足市场需求,相关部门和研究者对岩扇贝进行了引进培养[1]。岩扇贝作为一个新品种被引入中国,但国内子一代岩扇贝与加拿大进口岩扇贝在外观上存在明显区别(图1)。
目前,国外对于岩扇贝的研究报道主要集中在能量变化、毒性检测、扇贝病理、养殖、行为学和分子生物学分类等[2-8]方面,国内则集中在外部特征、育种、代谢和营养成分分析等[9-14]方面,而对于岩扇贝组织共附生微生物的研究则鲜见报道。由于双壳贝类滤食性的特点,对环境中的各种物质具有富集作用。双壳贝类的内脏团结构复杂,各种滤食后的食物在其内部消化成为粪便,并经肠道排出。双壳贝类的内脏团是重金属、贝毒的主要富集部位,其中的细菌等微生物对岩扇贝的消化和代谢有较大影响。双壳贝类内脏团中的微生物群落不仅与消化息息相关,而且也与免疫机能有关,目前,国内研究者对岩扇贝处于育种试验阶段,研究岩扇贝的内脏团和消化道细菌组成及群落多样性对了解其生长和代谢特性具有重要意义。为此,本研究中对岩扇贝内脏团和肠道微生物的多样性进行分析,比较岩扇贝原产地和异地育种后子代体内附生细菌的变化情况,旨在为岩扇贝的大规模推广养殖、疾病预防提供微生物方面的重要信息,以及对岩扇贝的养殖环境及食用安全评估供参考依据。

图1 加拿大岩扇贝(左)和国内子一代岩扇贝(右)
Fig.1 Canadian rock scallop(left) and the first generation of scallop in China(right)
1 材料与方法
1.1 材料
试验用加拿大原种岩扇贝2.5龄,为加拿大温哥华附近海域自然生长的个体。试验用中国育种子一代岩扇贝1.5龄,是以加拿大岩扇贝作为亲本在国内繁育获得的子一代个体,并在大连龙王塘海域进行养殖,试验样品规格如表1所示。试验于2017年11月在辽宁省海洋生物资源恢复与生境修复重点实验室进行。
表1 试验样品规格
Tab.1 Specifications for experimental samples
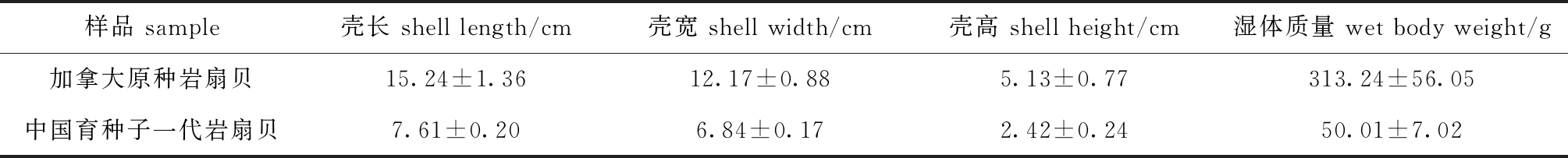
样品 sample壳长 shell length/cm壳宽 shell width/cm壳高 shell height/cm湿体质量 wet body weight/g加拿大原种岩扇贝15.24±1.3612.17±0.885.13±0.77313.24±56.05中国育种子一代岩扇贝7.61±0.206.84±0.172.42±0.2450.01±7.02
1.2 方法
1.2.1 样品处理 加拿大岩扇贝采集后,在2 ℃低温状态下运输,24 h内送达实验室,并从中随机取出20只,先用灭菌海水冲洗,然后用解剖针和解剖刀迅速解剖取出肠道和内脏团样品,置于装有灭菌陈海水的培养皿中备用。国内子一代岩扇贝采样后立即送回同一实验室,同法处理20只个体。共取样品4种,每种为20只个体混合样,编号为JC(加拿大贝肠道)、JN(加拿大贝内脏团)、YC(国内子一代贝肠道)和YN(国内子一代贝内脏团),取剥离的组织样品分别置于玻璃十字柄匀浆器进行研磨,得到组织匀浆样品,分别用于可培养细菌分离和总DNA提取。
1.2.2 可培养细菌分离纯化 利用稀释涂布平板法,将组织匀浆液JC、JN、YC和YN先进行稀释,用灭菌海水分别稀释(10-1、10-2、10-3、10-4、10-5),取0.1 mL 10-3、10-4和10-5稀释度样品涂布于2216E培养基上,每个稀释度设3个重复平板,分别倒置于25 ℃培养箱培养48 h。根据培养基中菌落形态特征,将分离出的单菌落在2216E固体培养基上进行划线,然后置于25 ℃培养箱培养48 h。选取平板上的单菌落继续划线,同法纯化三代,获得的纯化菌株接种到2216E斜面培养基,于25 ℃培养箱培养48 h后,4 ℃下保存备用。
1.2.3 分离菌株形态观察及鉴定 取纯化得到的菌株划线至2216E固体培养基上,于25 ℃培养箱培养48 h后,取单菌落进行革兰氏染色,油镜下观察其形态。将纯化的菌株送至北京诺禾致源生物信息科技有限公司测定其16S rRNA基因,并将测序结果输入到美国国立生物技术信息中心(NCBI)(http://www.ncbi.nlm.nih.gov/)中,用BLAST工具对序列进行同源性比对分析。
1.2.4 样品总DNA提取及高通量测序 将4个样品分别用TIANamp Bacteria DNA Kit进行总DNA提取。采用16S rRNA基因 V4区通用引物806R(5′GGACTACHVGGGTWTCTAAT 3′)和515F(5′GTGCCAGCMGCCGCGG 3′)进行PCR扩增。PCR扩增条件为:95 ℃下预变性3 min;95 ℃下变性30 s,55 ℃下退火30 s,72 ℃下延伸45 s,共进行27个循环;最后在72 ℃下延伸10 min。PCR扩增产物样品送北京诺禾致源生物信息科技有限公司进行高通量测序,首先对PCR产物进行纯化与定量,使用Thermofisher公司的Ion Plus Fragment Library Kit 48 rxns建库试剂盒进行文库的构建,构建好的文库经过Qubit定量和文库检测合格后,使用Thermofisher的Ion S5TMXL进行上机测序。基于IonS5TMXL测序平台,利用单端测序(Single-End)方法,构建小片段文库进行单端测序。使用Cutadapt软件过滤和按barcode拆分样本后,进行OTUs聚类和物种分类分析。
2 结果与分析
2.1 岩扇贝肠道和内脏团可培养微生物多样性
分别将4种样品涂布于2216E固体培养基上进行可培养细菌的分离和纯化,共得到83株细菌。其中,从样品JC、JN、YC、YN中分别分离到 21、35、11、16株菌株,根据所有分离菌株菌落形态和显微镜下的形态选出代表菌31株进行鉴定。16S rRNA基因序列比结果表明,31株分离菌分别属于嗜冷杆菌属Psychrobacter(8/31)、动性球菌属Planococcus(4/31)、弧菌属Vibrio(8/31)、假单胞菌属Pseudomonas(4/31)、假交替单胞菌属Pseudoalteromonas(2/31)、芽孢杆菌属Bacillus(3/31)、库克菌属Kocuria(1/31)、副球菌属Paracoccus(1/31)(表2)。这说明,岩扇贝的肠道和内脏团可培养细菌具有丰富的多样性。
2.2 岩扇贝肠道和内脏团总DNA中细菌基因测序结果
一般来说,在97%以上的序列一致性下聚类成为一个OTU的序列被认为可能是源自同一个种的序列。因此,对不同样品在97%一致性阈值下的Alpha分析指数(Shannon、Simpson、Chao1、ACE)进行统计,以97%的一致性将序列聚类成为OTUs。
从表3可见:JN样品的Shannon指数和Simpson指数最大,其次是YN样品,说明JN和YN样品具有较高的多样性;4种样品的Chao1指数和ACE 指数依次为YC>JN>YN>JC,说明YC样品的细菌群落丰度最大,JC样品的细菌丰度最小;JN、JC、YN、YC 4种样品的覆盖率分别为99.9%、99.8%、99.9%和99.9%,有效序列能够代表样品菌群整体情况。
从图2可见:4种样品的稀释曲线逐渐趋向平坦,说明测序数据量渐进合理,更多的数据量只会产生少量新的物种(OTUs);从曲线高度可以间接发现,物种丰富度由大至小依次为YC>JN>YN>JC。
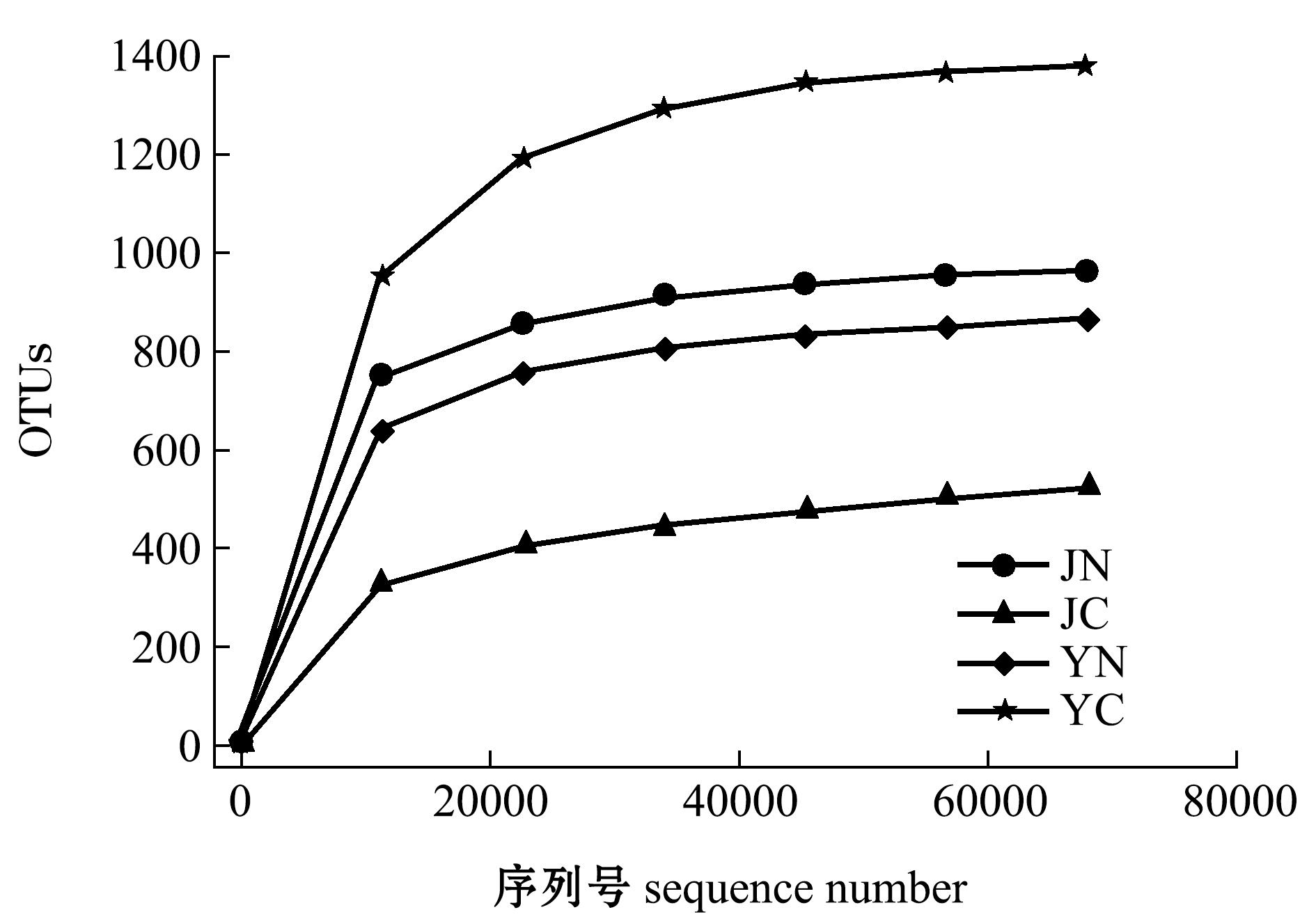
图2 样品稀释曲线
Fig.2 Rarefaction curves of different samples
2.3 岩扇贝肠道和内脏团细菌类群分析
根据OTUs聚类分析结果和研究需求,分析不同样品之间共有、特有的OTUs,绘制成韦恩图(图3)。其中,JN样品中共得到966个OUTs,YN样品中共得到827个OUTs,YC样品中共得到1383个OUTs,JC样品中共得到524个OUTs。4种样品中共有的OTUs为244个,JN特有OTUs为327个,YN特有OTUs为204个,JC特有OTUs为66个,YC特有OTUs为570个。
2.4 门、属水平细菌的相对丰度
根据物种注释结果,选取每个样品在门(图4)和属(图5)水平上最大丰度排名前10的物种,生成物种相对丰度柱形累加图,以便直观查看各样品在不同分类水平上,相对丰度较高的物种及其比例。从图4可见: JC样品中的优势菌门为变形菌门,占80%,次优势门为拟杆菌门,占15%;JN样品中的优势菌门为变形菌门,占52%,次优势菌门为拟杆菌门,占18%;YC样品中的优势菌门为变形菌门,占61%,次优势菌门为拟杆菌门,占26%;YN样品中的优势菌门为变形菌门,占73%,次优势菌门为拟杆菌门,占17%。4种样品中的优势菌门和次优势菌门均是相同的,但其比例有明显的区别,JC样品中的变形菌门比例高于JN,而YC样品中的变形菌门比例却低于YN。
从图5可见:4种样品共检测到的细菌类群包括黄杆菌属Tenacibacutes、弧菌属Vibrio、冰川菌属Glaciecola、拟杆菌属Bacterides、栖热菌属Thermus、红细菌属Lentibacter、假交替单胞菌属Pseudoalteromonas、速生杆菌属Celeribacter、叶杆菌属Phyllobacterium、不动杆菌属Acinetobacter和未确定分类位置的其他类群共11个;JN样品除其他占比超过50%外,各组成菌群比例差距不大,红细菌属为优势属,占6%,其次优势菌属是假交替单胞菌属、叶杆菌属和速生杆菌属,各占5%;JC样品菌群组成变化不大,但各组分的丰度有所不同,其中,速生杆菌属为优势属,占11%,次优势属是假交替单胞菌属和红细菌属,各占10%;YN和YC两种样品菌群组成与JN和JC样品相似,但组成比例有较大不同,YN样品速生杆菌属、假交替单胞菌属和红细菌属各占8%;但YC样品中不动杆菌属和叶杆菌属丰度较高,其中,不动杆菌属为优势菌属,占22%,次优势菌属为叶杆菌属,占19%;另外,4种样品中其他属均高于50%。
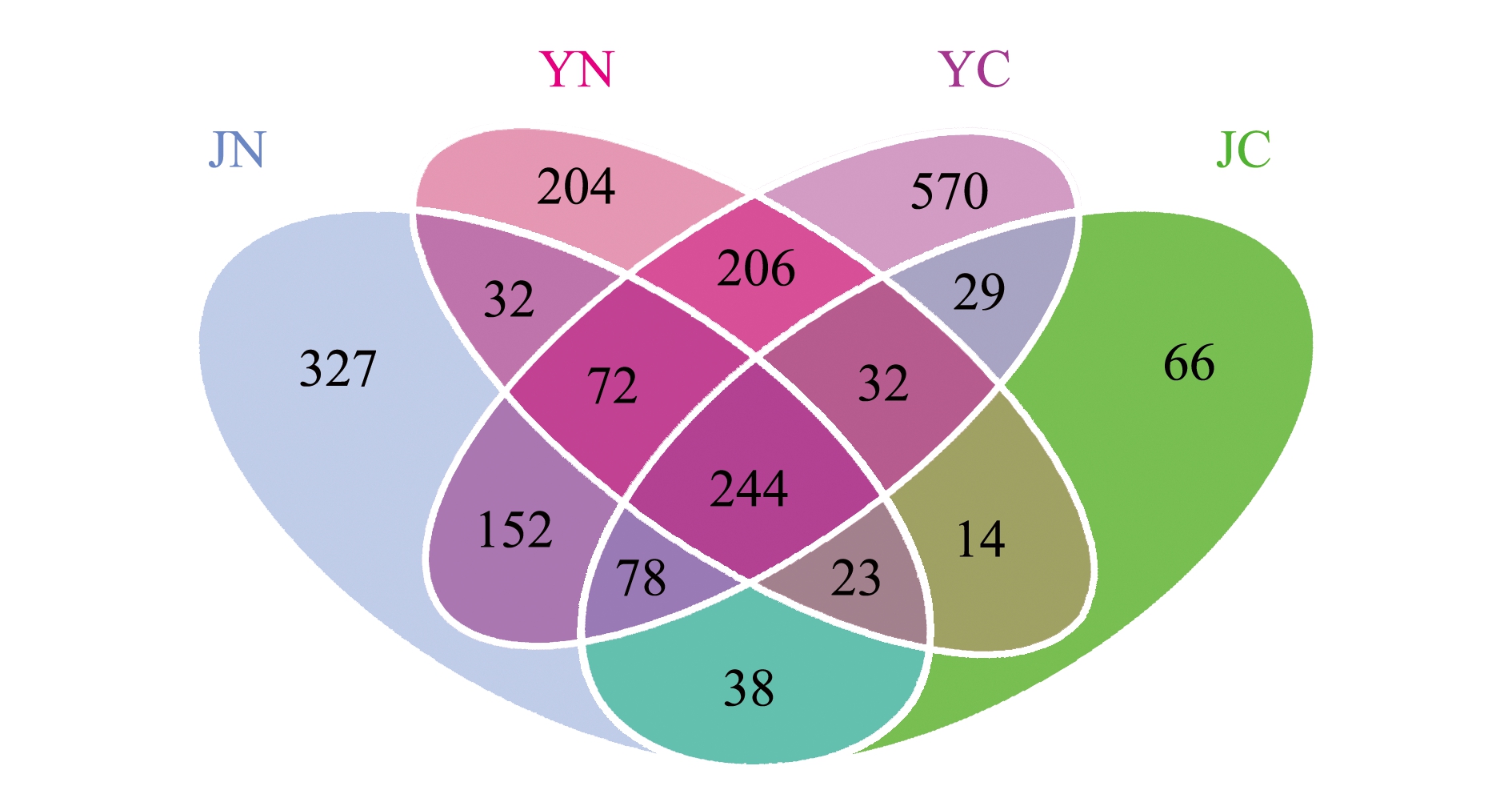
图3 岩扇贝肠道和内脏团细菌OUTs分布韦恩图
Fig.3 OUTs distribution Wayne diagram of intestine and viscera of rock scallopCrassadoma gigantea
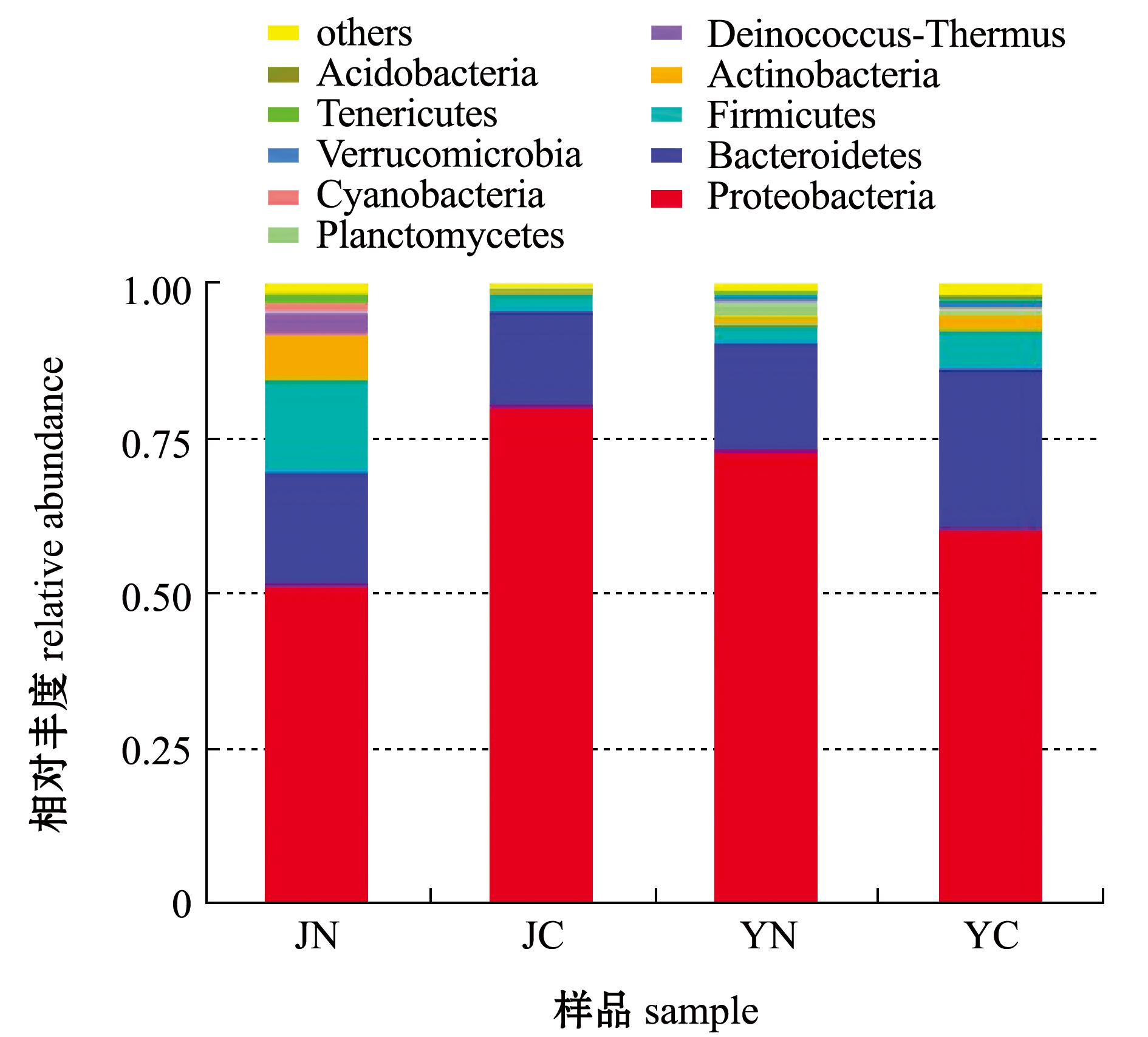
图4 门水平上细菌的相对丰度
Fig.4 Bacterial relative abundance at phylum level
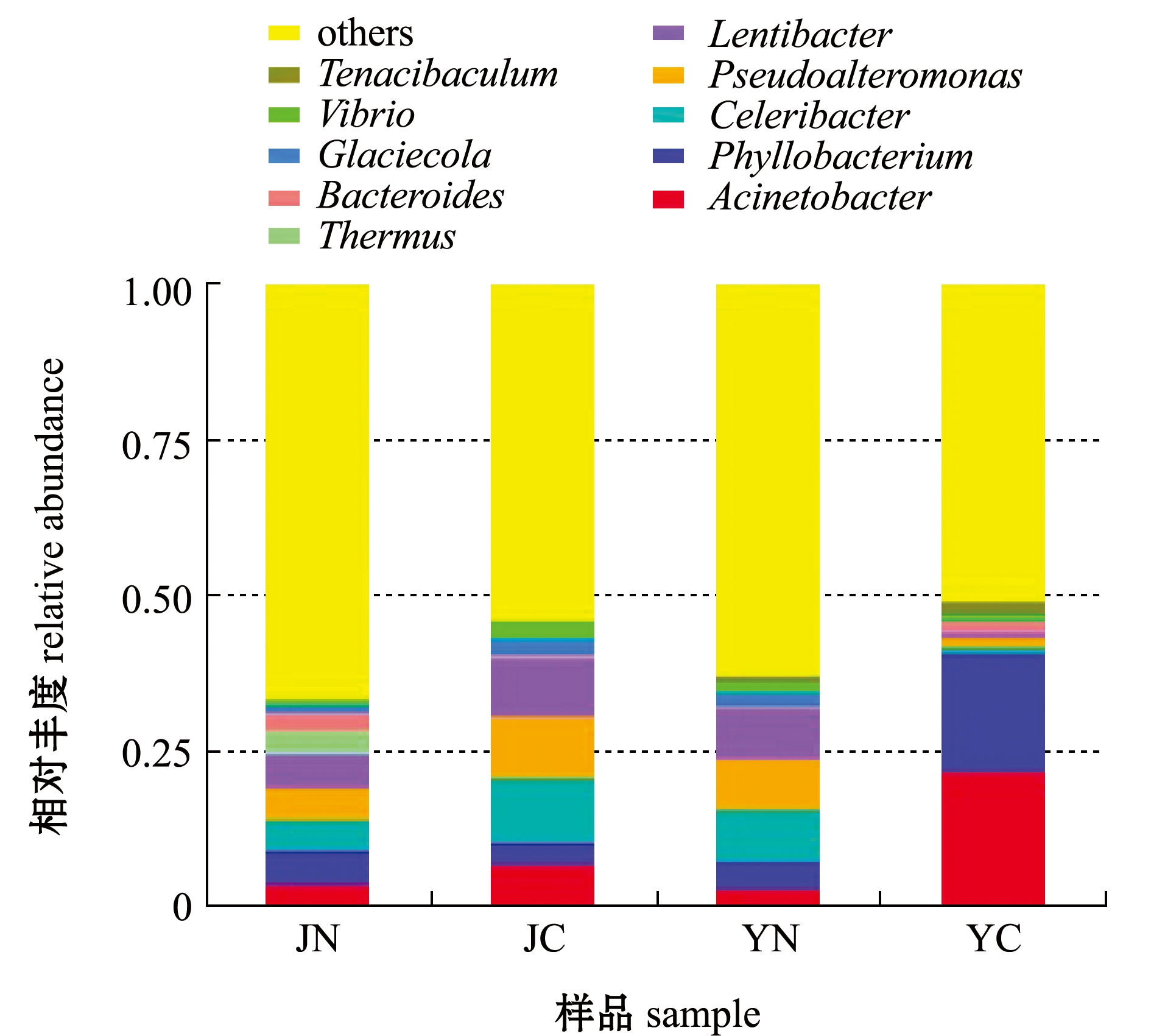
图5 属水平上细菌的相对丰度
Fig.5 Bacterial relative abundance at genus level
2.5 属水平系统发育进化树
为了进一步研究属水平物种的系统进化关系,通过多序列比对得到top100属的代表序列的系统发生关系并进行展示,这些属的系统进化关系如图6所示,4种样品的优势属主要集中在变形菌门Proteobacteria,前5种优势属分别是不动杆菌属Acinetobacter、叶杆菌属Phyllobacterium、假交替单胞菌属Pseudoalteromonas、红细菌属Lentibacter和速生杆菌属Celeribacter。
3 讨论
3.1 传统方法和高通量测序技术同时用于岩扇贝细菌的多样性分析
近年来,高通量测序技术的应用,极大地扩展了人们对生态环境中微生物物种多样性的认知,但对微生物生理功能和生态作用的解析还有赖于传统的分离和培养技术。迄今为止, 由于分离培养技术的局限, 自然界可培养的微生物大约只占总数的1%,99%的微生物尚不能培养[15]。据统计, 应用传统培养技术在不同生境中可培养的微生物比率是:海水中为0.001%~0.1%, 淡水中约为0.25%, 土壤中约为0.3%, 活性污泥中为1%~15%[16-17]。海洋生态环境中不可培养微生物数量更大,高通量测序技术的应用为了解海洋微生物资源及海洋动物微生态环境群落组成提供了重要帮助。目前,对海洋动物消化道微生物群落多样性研究主要集中在养殖鱼类等个体的报道[18-20],有关贝类消化道菌群的系统研究较少。陈瑜等[21]检测了3种代表性双壳贝类缢蛏、文蛤和泥蚶中的大肠埃希氏菌和菌落总数,从而推断双壳贝类的微生物富集能力和水体环境因子的关系。王瑞旋等[22]研究了企鹅珍珠贝肠道微生物对抗生素类药物敏感性,发现细菌的耐药性在不断增强,细菌耐药性可通过质粒等可移动遗传因子进行传递, 甚至传递至人类病原细菌,给人类健康带来安全隐患。
3.2 岩扇贝原种和国内育种子一代可培养和未可培养细菌群落结构差异
通过测定原种岩扇贝和引种后繁育的子一代岩扇贝内脏团和肠道细菌群落的情况,可以掌握菌群结构的变化情况,并结合其生长状况分析细菌群落对岩扇贝消化功能的影响。比较原种贝和子一代贝消化道JC和YC两种样品,JC样品中可培养微生物有5个属,分别是嗜冷杆菌属Psychrobacter、铜绿假单胞菌属Pseudomonas、副球菌属Paracoccus、动性球菌属Planococcus和库克菌属Kocuria,而YC样品中可培养微生物只有3个属,分别是芽孢杆菌属Bacillus、嗜冷杆菌属Psychrobacter和弧菌属Vibrio,从可培养微生物多样性来看,JC样品高于YC样品,原种贝和子一代贝共有的种群仅为嗜冷杆菌属Psychrobacter。原种贝和子一代贝内脏团JN和YN两种样品对比,JN样品中可培养微生物有6个属,分别是动性球菌属Planococcus、弧菌属Vibrio、嗜冷杆菌属Psychrobacter、假交替单胞菌属Pseudoalteromonas、芽孢杆菌属Bacillus和铜绿假单胞菌属Pseudomonas,而YN样品中可培养微生物有3个属,分别是弧菌属Vibrio、嗜冷杆菌属Psychrobacter和芽孢杆菌属Bacillus,JN样品多样性高于YN样品,与肠道菌群情况相同。
表2 分离代表菌株显微镜下形态及16S rRNA基因鉴定结果
Tab.2 Microscopic morphology and 16S rRNA identification of isolated bacterial strains

菌株strain菌落特征colony characteristics细胞形态cell shape革兰氏染色gram stain相近菌株similar strain模式菌登录号accession No.一致性/%identityJC-1乳白色,球状凸起,边缘光滑,水浸状,菌落较小杆状-嗜冷杆菌PsychrobacterHM58448099JC-2奶酪色,圆形,表面光滑半透明,边缘整齐,有同心环棒杆状-铜绿假单胞菌PseudomonasMG708168100JC-3乳白色,不透明的圆形凸起,表面光滑,湿润,边缘整齐球状-副球菌ParacoccusKX98944899JC-5黄橙色,球状凸起,边缘光滑球状+动性球菌PlanococcusKC250890100JC-6黄橙色,球状凸起,边缘光滑球状+动性球菌PlanococcusKT424984100JC-7乳白色,边缘整齐,表面光滑,隆起球状+库克菌KocuriaKX108882100JC-9乳白色,球状凸起,边缘光滑,水浸状,菌落较小杆状-嗜冷杆菌PsychrobacterHM584480100JC-10乳白色,球状凸起,边缘光滑,水浸状,菌落较小杆状-嗜冷杆菌PsychrobacterKY405931100JN-1黄橙色,球状凸起,边缘光滑球状-动性球菌PlanococcusKJ191056100JN-3黄橙色,球状凸起,边缘光滑球状-动性球菌PlanococcusMF754141100JN-4乳白色,球状凸起,边缘光滑直或弯杆状-弧菌VibrioKX453196100JN-5乳白色,球状凸起,边缘光滑直或弯杆状-弧菌VibrioKX453196100JN-6乳白色,球状凸起,边缘光滑,水浸状,菌落较小杆状-嗜冷杆菌PsychrobacterKY38282799JN-7乳白色,球状凸起,边缘光滑,水浸状,菌落较小杆状-嗜冷杆菌PsychrobacterMG263478100JN-8乳白色,球状凸起,边缘光滑短杆状-假交替单胞菌属PseudoalteromonasJQ406678100JN-9黄橙色,球状凸起,边缘光滑短杆状+芽孢杆菌BacillusMF445214100JN-10奶酪色,圆形,表面光滑半透明,边缘整齐,有同心环棒杆状-铜绿假单胞菌PseudomonasAJ55111099JN-11奶酪色,圆形,表面光滑半透明,边缘整齐,有同心环棒杆状-铜绿假单胞菌PseudomonasCP01707399JN-12乳白色,球状凸起,边缘光滑,水浸状,菌落较小杆状-嗜冷杆菌PsychrobacterKF186667100JN-13奶酪色,圆形,表面光滑半透明,边缘整齐,有同心环棒杆状-铜绿假单胞菌PseudomonasKF186667100YN-14乳白色,水浸状凸起,边缘光滑短杆状-假交替单胞菌属PseudoalteromonasFJ195979100YC1-1黄橙色,球状凸起,边缘光滑短杆状+芽孢杆菌BacillusKR270143100YC2-3-1乳白色,球状凸起,边缘光滑,水浸状,菌落较小杆状-嗜冷杆菌PsychrobacterMF537174100YC3-4乳白色,球状凸起,边缘光滑直或弯杆状-弧菌VibrioKU647922100YC5-7乳白色,球状凸起,边缘光滑直或弯杆状-弧菌VibrioKX001858100YN1-1黄橙色,球状凸起,边缘光滑短杆状+芽孢杆菌BacillusKY744419100YN2-7乳白色,球状凸起,边缘光滑直或弯杆状-弧菌VibrioDQ481607100YN2-8乳白色,球状凸起,边缘光滑,水浸状,菌落较小杆状-嗜冷杆菌PsychrobacterHM584290100YN3-10乳白色,球状凸起,边缘光滑杆状-弧菌VibrioAB85996799YN3-12乳白色,球状凸起,边缘光滑直或弯杆状-弧菌VibrioKU647922100YN3-14乳白色,球状凸起,边缘光滑直或弯杆状-弧菌VibrioDQ146970100
注:+为阳性;-为阴性
Note:+,positive; -,negative
表3 岩扇贝肠道和内脏团细菌测序数据统计
Tab.3 Statistics of sequencing data in intestine and viscera of rock scallopCrassadoma gigantea
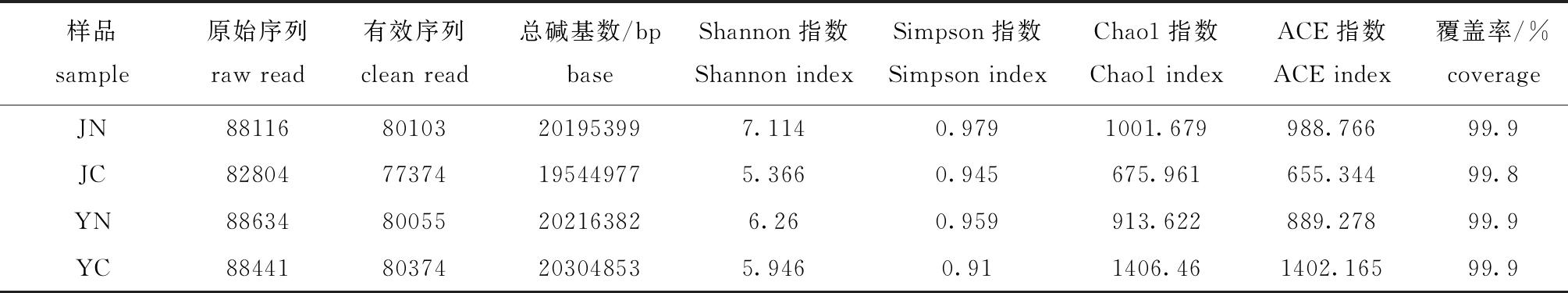
样品sample原始序列raw read有效序列clean read总碱基数/bpbaseShannon指数Shannon indexSimpson指数Simpson indexChao1指数Chao1 indexACE指数ACE index覆盖率/%coverageJN8811680103201953997.1140.9791001.679988.76699.9JC8280477374195449775.3660.945675.961655.34499.8YN8863480055202163826.260.959913.622889.27899.9YC8844180374203048535.9460.911406.461402.16599.9

图6 属水平系统发育树
Fig.6 Phylogenetic tree at genus level
利用Ion S5TMXL高通量测序平台,从加拿大进口岩扇贝及国内育种得到的子一代岩扇贝肠道和内脏团JC、JN、YC、YN样品中分别获得了77 374、80 103、80 374和80 055条有效序列,从4种样品的细菌群落多样性分析,岩扇贝内脏团样品中的细菌群落多样性优于肠道样品,后者某些种类丰度较高。国内育种样品菌群组成与原种样品相比变化不大,但各类群比例变化较大,尤其肠道样品中不动杆菌属和叶杆菌属丰度有较大提高。另外,测序菌群组成和可培养菌群组成差异较大,两种方法均检出的种类仅为假交替单胞菌属和弧菌属两类。高通量测序结果中的细菌类群在属水平上包含可培养细菌类群,但其中丰度较高的红细菌属、速生杆菌属、叶杆菌属和不动杆菌属均未在可培养细菌中发现。据报道,红细菌属和速生杆菌属在国内海域被分离到[23-24],但未见在水生动物体内检测的报道,在本研究样品的可培养细菌中未分离到。可能由于培养条件所限,高通量测序中检出的类群在可培养细菌中未检出,即可能与可培养细菌种类丰度较低有关。对于动物组织微生物组成的研究需要根据可培养检测结果和宏基因测序结果综合分析,不能仅依据单独一项检测方法评价其微生态环境的微生物多样性。孙雪莹[25]以虾夷扇贝为研究对象,在门水平上变形菌门同样也是优势门,在属水平上优势属是假单胞菌属,该菌属在岩扇贝样品中的相对丰度也较高,与虾夷扇贝具有一定的相似性。鉴于本研究中可培养细菌和高通量测序均检出该菌,且高通量测序显示存在于4种样品中,其丰度均较高,因此,认为假细胞菌属细菌在岩扇贝的生长过程中可能起到一定的作用,具体种类和作用有待于采用更适合的分离手段分离并进一步深入研究。
3.3 细菌群落变化对岩扇贝消化功能的影响
原种贝和子一代贝肠道和内脏细菌群落组成不同,子一代岩扇贝2种组织样品的可培养细菌群落明显减少,高通量测序结果中菌群丰度亦有较大差异,分析原因可能与养殖环境改变有较大关系,在子一代贝中仍然存在的与原种贝相同的菌群种类,其属于组织中定植的类群,而其他类群可能是随环境的变化和饵料的改变带入,并随粪便排出。故子一代样品中不能再分离到原种所携带的某些细菌类群,并出现其他的一些过路种类。内脏团中的细菌基本来自消化道,因此,呈现相同的变化趋势。张皓[26]报道,养殖环境中微生物群落的动态变化及与水环境的互作可影响南美白对虾、鲤和鲢肠道微生物多样性和菌群结构及其动态变化,影响因素包括养殖水体和底泥的微生物群落,环境改变可以对水生动物的肠道微生物群落的组成结构造成影响,从而也影响水生动物的健康。肠道与内脏团中菌群的变化可能影响了岩扇贝的消化功能,从而影响了岩扇贝生长,造成国内子一代岩扇贝生长缓慢。本研究中所采集的样本仅限于贝组织,主要目的是分析原代与引种后繁育的后代细菌组成的差异,从而为其生长状况的变化提供微生态方面可能的影响因素,今后还需对环境和饵料中的细菌组成状况进行调查,从而深入分析组织中细菌变化的根本原因。另外,岩扇贝内脏团和肠道样品中分离的可培养细菌中均分离到芽孢杆菌属的菌株,芽孢杆菌具有产胞外蛋白酶和淀粉酶的能力。游龙等[27]报道了芽孢杆菌对凡纳滨对虾的作用,指出其可作为益生菌提高个体对饵料的利用率。芽孢杆菌在组织中尤其肠道中的存在对于岩扇贝的食物消化可能起到一定作用,可以作为益生菌的目标菌株进行深入研究。
4 结语
本研究中首次对原种贝加拿大进口岩扇贝和国内育种岩扇贝的肠道和内脏团微生物群落丰富度和多样性进行了初步研究,通过分析岩扇贝在不同养殖环境中体内菌群多样性的变化,为了解岩扇贝肠道和内脏团的微生物群落组成提供了试验数据,为深入研究岩扇贝的生活习性提供参考。此外,通过对可培养微生物进行研究,为选择功能细菌提供了试验材料,给未来岩扇贝在国内人工养殖过程中益生菌剂的开发提供了研究思路,其中,可培养细菌菌株的生物学特性及产酶情况有待今后深入研究。
[1] 王紫竹.大连获准引进岩扇贝促进扇贝养殖业健康发展[N].中国海洋报,2017-08-10(02).
[2] Whyte J N C,Bourne N,Ginther N G.Biochemical and energy changes during embryogenesis in the rock scallopCrassadoma gigantea[J].Marine Biology,1990,106(2):239-244.
[3] Beitler M K.Toxicity of adductor muscles from the purple hinge rock scallop (Crassadoma gigantea) along the Pacific coast of North America[J].Toxicon,1991,29(7):889-894.
[4] Bendell L I.Survey of levels of cadmium in oysters,mussels,clams and scallops from the Pacific Northwest coast of Canada[J].Food Additives & Contaminants Part B: Surveillance,2009,2(2):131-139.
[5] Meyers T R,Burton T,Evans W,et al.Detection of viruses and virus-like particles in four species of wild and farmed bivalve molluscs in Alaska,USA,from 1987 to 2009[J].Diseases of Aquatic Organisms,2009,88(1):1-12.
[6] Culver C S,Richards J B,Page H M.Plasticity of attachment in the purple-hinge rock scallop,Crassadoma gigantea:implications for commercial culture[J].Aquaculture,2006,254(1-4):361-369.
[7] Tremblay I,Guderley H E,Himmelman J H.Swimming away or clamming up:the use of phasic and tonic adductor muscles during escape responses varies with shell morphology in scallops[J].Journal of Experimental Biology,2012,215(23):4131-4143.
[8] Canapa A,Barucca M,Marinelli A,et al.A molecular approach to the systematics of the Antarctic scallopAdamussium colbecki[J].Italian Journal of Zoology,1999,66(4):379-382.
[9] 王潇,曹善茂,印明昊,等.不同贝龄岩扇贝数量性征的相关性及通径分析[J].河北渔业,2018(2):23-28,38.
[10] 曹善茂,汪健,王谦,等.岩扇贝人工育苗的初步研究[J].大连海洋大学学报,2017,32(1):1-6.
[11] 曹善茂,梁伟锋,刘钢,等.不同生态因子对岩扇贝幼贝耗氧率和排氨率的影响[J].大连海洋大学学报,2017,32(3):280-286.
[12] 曹善茂,梁伟锋,汪健,等.岩扇贝幼贝滤食率的基础研究[J].大连海洋大学学报,2016,31(6):612-617.
[13] 曹善茂,王昊,陈炜,等.岩扇贝闭壳肌营养成分的分析及与中国3种扇贝的比较[J].大连海洋大学学报,2016,31(5):544-550.
[14] 王昊.岩扇贝与深海扇贝营养成分分析及与三种养殖扇贝的比较[D].大连:大连海洋大学,2016.
[15] 梅承,范硕,杨红.昆虫肠道微生物分离培养策略及研究进展[J].微生物学报,2018,58(6):985-994.
[16] Rappé M S,Giovannoni S J.The uncultured microbial majority[J].Annual Review of Microbiology,2003,57:369-394.
[17] 王保军,刘双江.环境微生物培养新技术的研究进展[J].微生物学通报,2013,40(1):6-17.
[18] 刘增新,柳学周,史宝,等.牙鲆(Paralichthys olivaceus)仔稚幼鱼肠道菌群结构比较分析[J].渔业科学进展,2017,38(1):111-119.
[19] 史秀清,张正,王印庚,等.大菱鲆(Scophthalmus maximus)仔稚鱼发育期消化道可培养细菌的菌群特征分析[J].渔业科学进展,2015,36(4):73-82.
[20] 张正,李彬,王印庚,等.基于高通量测序的池塘养殖半滑舌鳎消化道菌群的结构特征分析[J].水生生物学报,2015,39(1):38-45.
[21] 陈瑜,金雷,朱敬萍,等.双壳贝类微生物富集能力及环境水体对其影响分析[J].山东化工,2016,45(17):13-14,17.
[22] 王瑞旋,林韵锶,郭志勋,等.海南陵水企鹅珍珠贝肠道及其养殖水体中异养细菌耐药性研究[J].热带海洋学报,2013,32(6):96-100.
[23] 李佩佩,陈雪昌,张玉荣,等.海洋红细菌Lentibacter algarum胞外多糖的分离纯化及结构解析[J].生物工程学报,2014,30(3):455-463.
[24] 简书令,吴月红,买热帕提阿依,等.来源于中国南海的微生物新种乙醇速生杆菌(Celeribacter ethanolicus)多相分类研究(英文)[J].微生物学通报,2016,43(5):907-916.
[25] 孙雪莹.虾夷扇贝幼体及育苗池水体细菌群落动态及潜在益生菌筛选[D].大连:大连海洋大学,2016.
[26] 张皓.养殖环境微生物群落的动态变化及与水环境的互作[D].苏州:苏州大学,2015.
[27] 游龙,韩茵,张凯,等.芽孢杆菌产胞外酶的活性分析及其对凡纳滨对虾的作用[J].中国海洋大学学报:自然科学版,2018,48(3):80-87.