刺参Apostichopus japonicus隶属于棘皮动物门、海参纲,为后口动物,是无脊椎动物中与脊索动物最为相似的类群。同时,刺参也是中国重要的海珍品,具有极高的经济价值,是中国海水养殖中产值最高的品种之一[1]。刺参体腔中充满了体腔液,其中悬浮着不同种类的体腔细胞,由于外物能直接进入体腔而与刺参体接触,所以体腔细胞在抵御外来异物的侵入等免疫反应中显得尤为重要,充当了关键的角色。刺参体腔细胞种类多样,众多学者借助细胞染色、扫描电镜、透射电镜等技术,对体腔细胞类型进行了研究,但由于研究技术的局限性,刺参体腔细胞的分类一直未得到统一[2-6]。刺参体腔液中含有一些参与免疫反应的重要因子、免疫酶等,在免疫防御中也具有重要作用。其中,碱性磷酸酶(AKP)、酸性磷酸酶(ACP)、超氧化物歧化酶(SOD)和过氧化氢酶(CAT)等为刺参体液免疫中重要的几种免疫酶类,其活性高低可反映刺参的免疫力[7]。
近年来,中国刺参养殖业发展迅速,但养殖技术却比较粗糙,在刺参养殖规模不断扩大的同时,其种质、病害、环境和产品品质等问题日趋凸显,刺参养殖中同一批出塘的刺参规格因差异显著可直接影响养殖效益。造成这种差异的外界因素主要有密度、社会等级、物理接触等[8],同时刺参自身免疫力方面也存在一定的差异[9-10],但关于免疫力与刺参生长方面的关系目前尚无明确定论。为此,本试验中对不同规格野生和养殖刺参的免疫力进行了研究,通过比较体腔细胞密度、数量及免疫酶活性等方面的差异,系统地分析体质量、生活环境与刺参免疫力的关系,旨在为进一步明确刺参免疫机制,以及建立刺参免疫指标提供基础试验依据。
1 材料与方法
1.1 材料
健康养殖刺参购于大连庄河宝发海珍品有限公司,野生刺参采自大连旅顺海域。
1.2 方法
1.2.1 试验设计 依据体质量大小,养殖刺参分别设置体质量为(30.00±9.83)、(70.00±7.83)、(110.00 ±10.68)g的3组,记为30 g、70 g、100 g组;野生刺参分别设置体质量为(70.00±8.13)、(110.00±7.53)、(150.00±10.64)g的3组,记为70 g、110 g、150 g组。每组20头刺参,在实验室暂养一周后进行试验,暂养期间水温为17~19 ℃,不间断充氧。
1.2.2 刺参体腔液的采集 分别随机捞取5只暂养的野生和养殖刺参置于干净解剖盘中,阴干20 min后,称取刺参体质量,并以此时称取的刺参体质量为依据进行分组。用无菌手术剪沿刺参腹部纵向解剖,并用50 mL离心管收集体腔液,记录体积后,取100 μL体腔液与等体积的抗凝剂(葡萄糖20.8 g/L、柠檬酸钠8 g/L、EDTA 3.36 g/L、氯化钠22.5 g/L,pH 7.5)混合均匀,用于体腔细胞计数。剩余体腔液于4 ℃下以3000 r/min离心10 min,取上清液分装,于-80 ℃下保存,用于测定免疫酶活力。
1.2.3 刺参体腔细胞分类 将处理获得的体腔液做成细胞涂片,在100倍光学显微镜下观察体腔细胞并依据体腔细胞的形态、大小及核质比进行分类。
1.2.4 刺参体腔细胞密度和数量的测定 取采集获得的体腔液滴于血球计数板上,并在光学显微镜镜下进行总体腔细胞密度 (TCD)和不同类型体腔细胞密度 (DCD)的计数,为了保证数据的准确性,统计25个方格中的体腔细胞。总体腔细胞数量 (TCC)和不同类型体腔细胞数量 (DCC)的计数通过体腔液容积进行,其计算公式为
TCD=A×B×104,
DCD=C×B×104,
TCC=A×B×104×D,
DCC=C×B×104×D。
其中:A为25个中方格中的总体腔细胞密度(cells/mL);B为稀释倍数;C为25个中方格中各类型体腔细胞的密度(cells/mL);D为体腔液容积(mL)。
1.2.5 刺参体腔上清液免疫酶活力的测定 采用南京建成生物工程研究所的试剂盒,测定免疫指标SOD、CAT、AKP、ACP的酶活力,同时测定体腔液上清总蛋白含量并计算免疫酶比活力。
1.3 数据处理
试验数据均以平均值±标准误差 (mean±S.E.) 表示,采用SPSS 24.0软件进行单因素方差(One-way ANOVA),显著性水平设为0.05,极显著性水平设为0.01。
2 结果与分析
2.1 刺参体腔细胞分类
本试验中,根据体腔细胞的活体形态,将体腔细胞分为桑椹细胞、球形细胞、变形细胞、淋巴细胞、纺锤细胞、透明细胞、结晶细胞7类。通过光学显微镜观察大量活体细胞,结果发现,养殖和野生刺参体腔细胞在形态上无明显差异,各类型细胞形态及特征描述如表1和图1所示。
表1 刺参体腔细胞分类
Tab.1 Types of coelomocytes in sea cucumberApostichopus japonicus
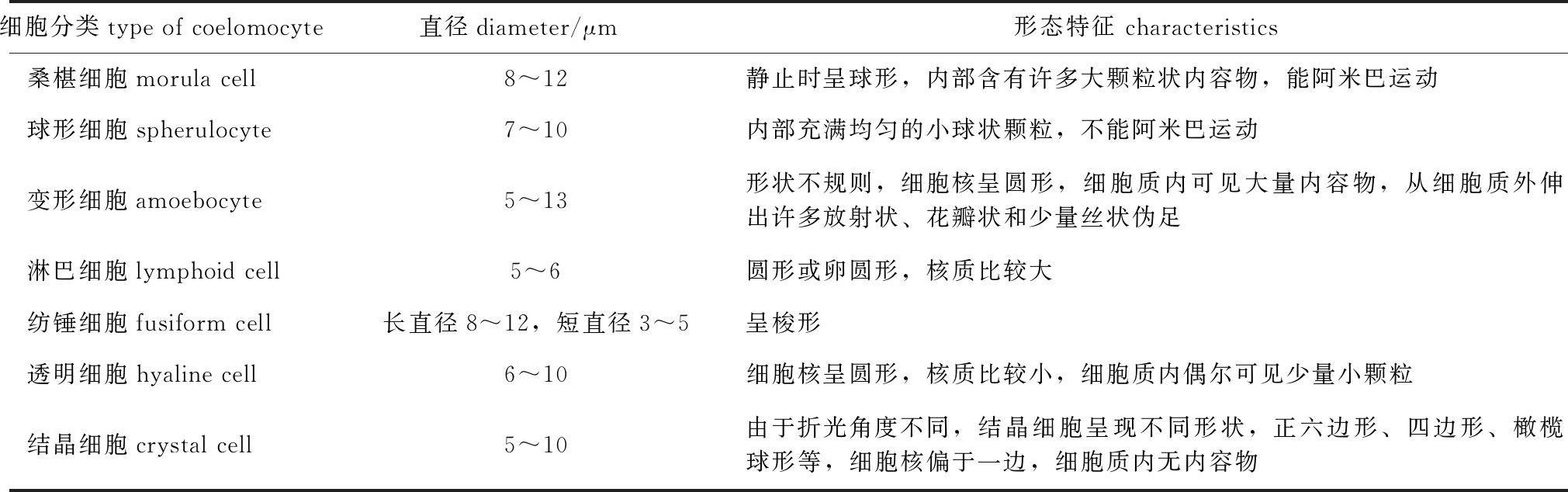
细胞分类type of coelomocyte直径diameter/μm形态特征 characteristics桑椹细胞morula cell8~12 静止时呈球形,内部含有许多大颗粒状内容物,能阿米巴运动球形细胞spherulocyte7~10 内部充满均匀的小球状颗粒,不能阿米巴运动变形细胞amoebocyte5~13 形状不规则,细胞核呈圆形,细胞质内可见大量内容物,从细胞质外伸出许多放射状、花瓣状和少量丝状伪足淋巴细胞lymphoid cell5~6 圆形或卵圆形,核质比较大纺锤细胞fusiform cell长直径8~12,短直径3~5呈梭形透明细胞hyaline cell6~10细胞核呈圆形,核质比较小,细胞质内偶尔可见少量小颗粒结晶细胞crystal cell5~10 由于折光角度不同,结晶细胞呈现不同形状,正六边形、四边形、橄榄球形等,细胞核偏于一边,细胞质内无内容物

注:A为桑椹细胞;B为球形细胞;C为变形细胞;D为淋巴细胞;E为纺锤细胞;F为透明细胞;G、H均为结晶细胞
Note:A,morula cell; B,spherulocyte; C,amoebocyte;D,lymphoid cell; E,fusiform cell; F,hyaline cell; G,H,crystal cell
图1 刺参不同类型体腔细胞形态
Fig.1 Morphology of differential types of coelomocytes of sea cucumberApostichopus japonicus
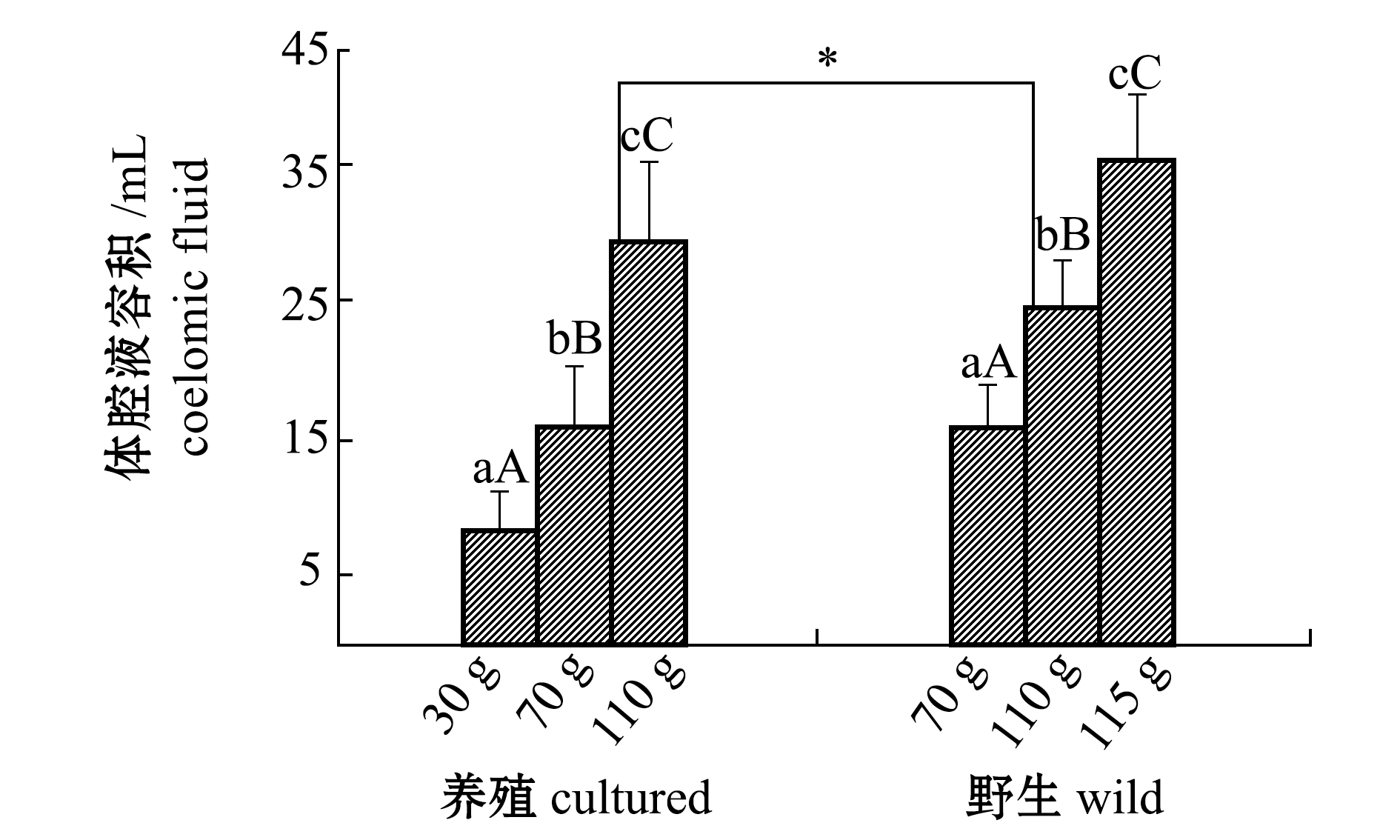
2.2 刺参体腔液容积
从图2可见:通过对养殖与野生刺参体腔液容积的比较,发现养殖与野生刺参体腔液容积均随体质量的增加而增加,不同规格刺参的体腔液容积有极显著性差异(P<0.01);70 g组的养殖和野生刺参无显著性差异(P>0.05),而110 g组的养殖刺参体腔液容积显著高于同规格的野生刺参(P<0.05)。
2.3 刺参体腔细胞密度
从图3、图4可见:不同规格的刺参体腔细胞总密度无显著性差异(P>0.05);养殖刺参不同类型体腔细胞密度不同规格组间无显著性差异(P>0.05),野生刺参150 g体质量组球形细胞密度显著高于70 g组和110 g组(P<0.05);相同规格的养殖刺参与野生刺参的总体腔细胞密度无显著性差异(P>0.05),但110 g体质量组养殖刺参和野生刺参球形细胞和淋巴细胞密度有显著性差异(P<0.05);不同规格的养殖刺参和野生刺参,变形细胞和淋巴细胞所占密度数量均是最大。
2.4 刺参体腔细胞数量
从图5、图6可见:不同规格刺参体腔细胞总数有显著性差异(P<0.05),无论野生刺参还是养殖刺参总体腔细胞数量均随体质量的增加而增加;养殖刺参的桑椹细胞、球形细胞、变形细胞、淋巴细胞数量均为70 g、110 g组显著高于30 g组(P<0.05),而透明细胞、结晶细胞数量均为110 g组体质量显著高于30 g组(P<0.05);野生刺参的桑椹细胞、球形细胞、变形细胞、淋巴细胞和结晶细胞数量均为110 g组显著高于30 g组(P<0.05);相同规格的养殖、野生刺参体腔细胞总数无显著性差异(P>0.05),110 g体质量组的养殖刺参球形细胞数量显著高于野生刺参(P<0.05)。
注:标有不同大写字母者表示同一群体不同体质量组间有极显著性差异(P<0.01);标有不同小写字母者表示同一群体不同体质量组间有显著性差异(P<0.05);标有相同小写字母者表示组间无显著性差异(P>0.05);*表示相同规格不同群体之间有显著性差异(P<0.05),下同
Note:The means with different capital letters in same population are very significantly different among the body weight groups at the 0.01 probability level,the means with different letters show significant differences between body weight groups of different sizes in the same population at the 0.05 probability level,and the means with the same letters show no significant difference between groups;* indicating significant differences between different groups within the same size at the 0.05 probability level,et sequentia
图2 不同规格养殖和野生刺参体腔液容积
Fig.2 Coelomic fluid volume in cultured and wild sea cucumberApostichopus japonicuswith different body weight

图3 不同规格养殖和野生刺参总体腔细胞密度
Fig.3 TCD in cultured and wild sea cucumberApostichopus japonicuswith different body weight
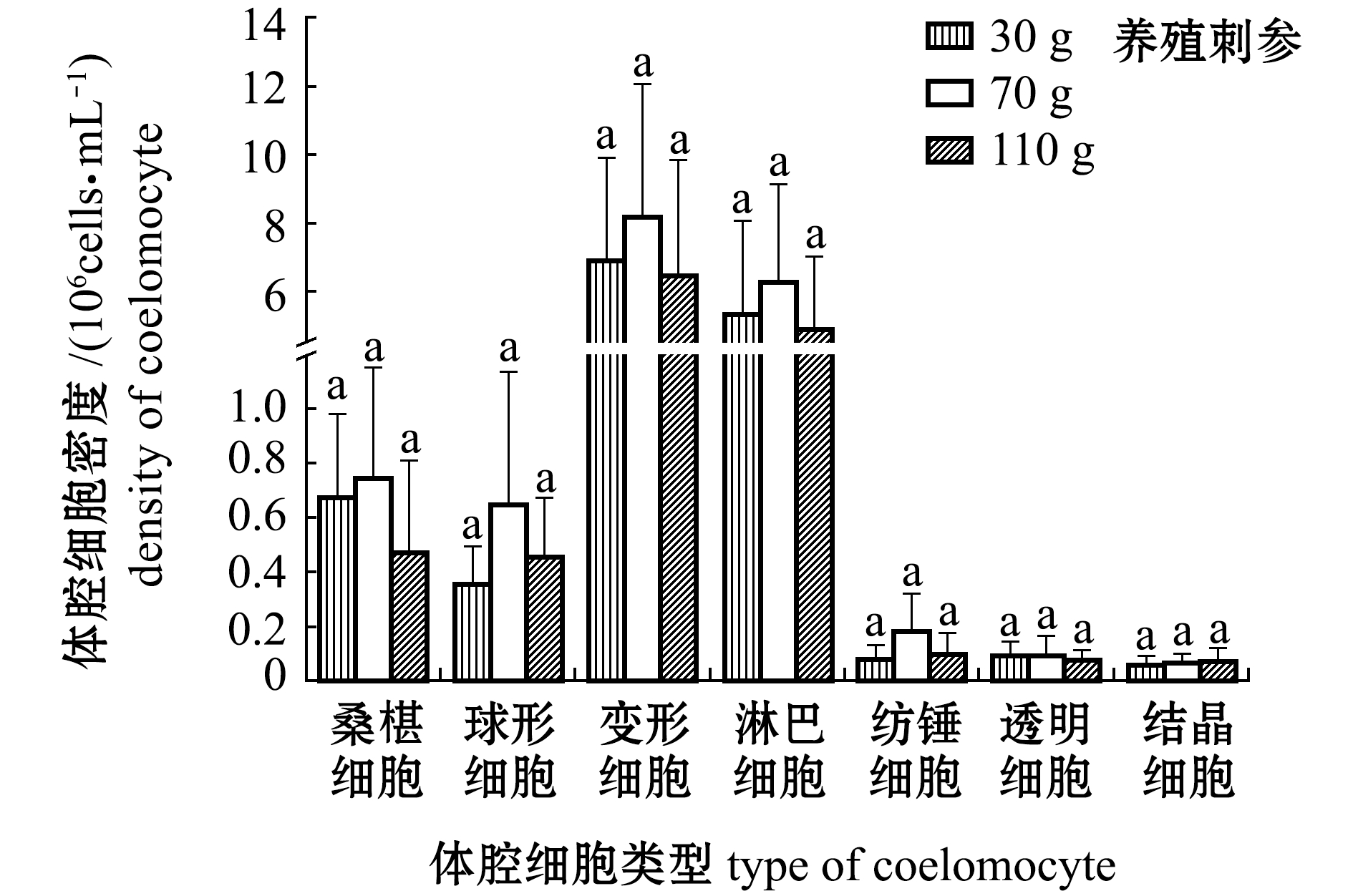
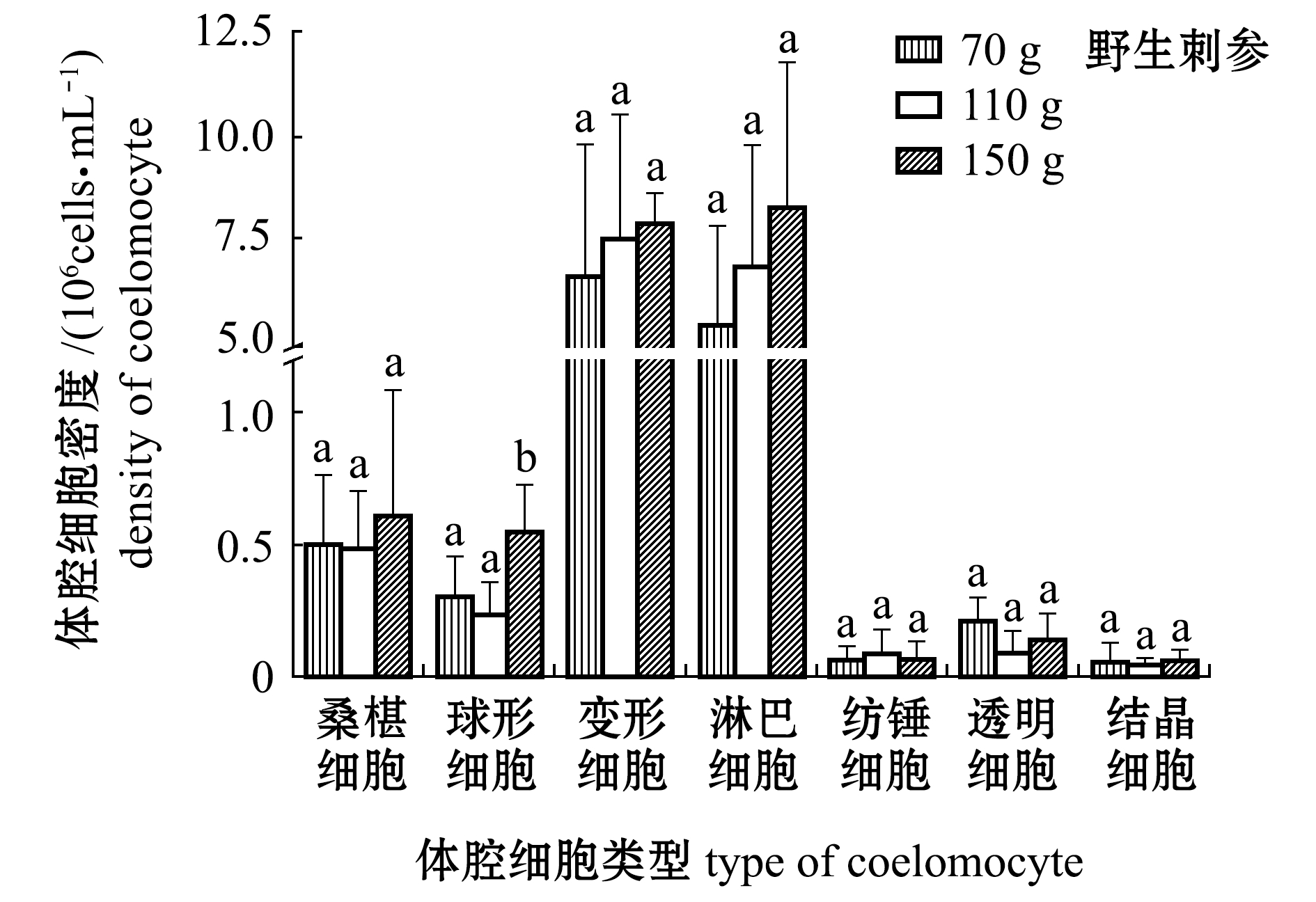
注:标有不同字母者表示同一种细胞不同体质量组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同
Note: The means with different letters in same cell are significantly different among the body weight groups at the 0.05 probability level, and the means with the same letters are not significant differences,et sequentia
图4 不同规格养殖和野生刺参各类体腔细胞密度
Fig.4 DCD in cultured and wild sea cucumberApostichopus japonicuswith different body weight
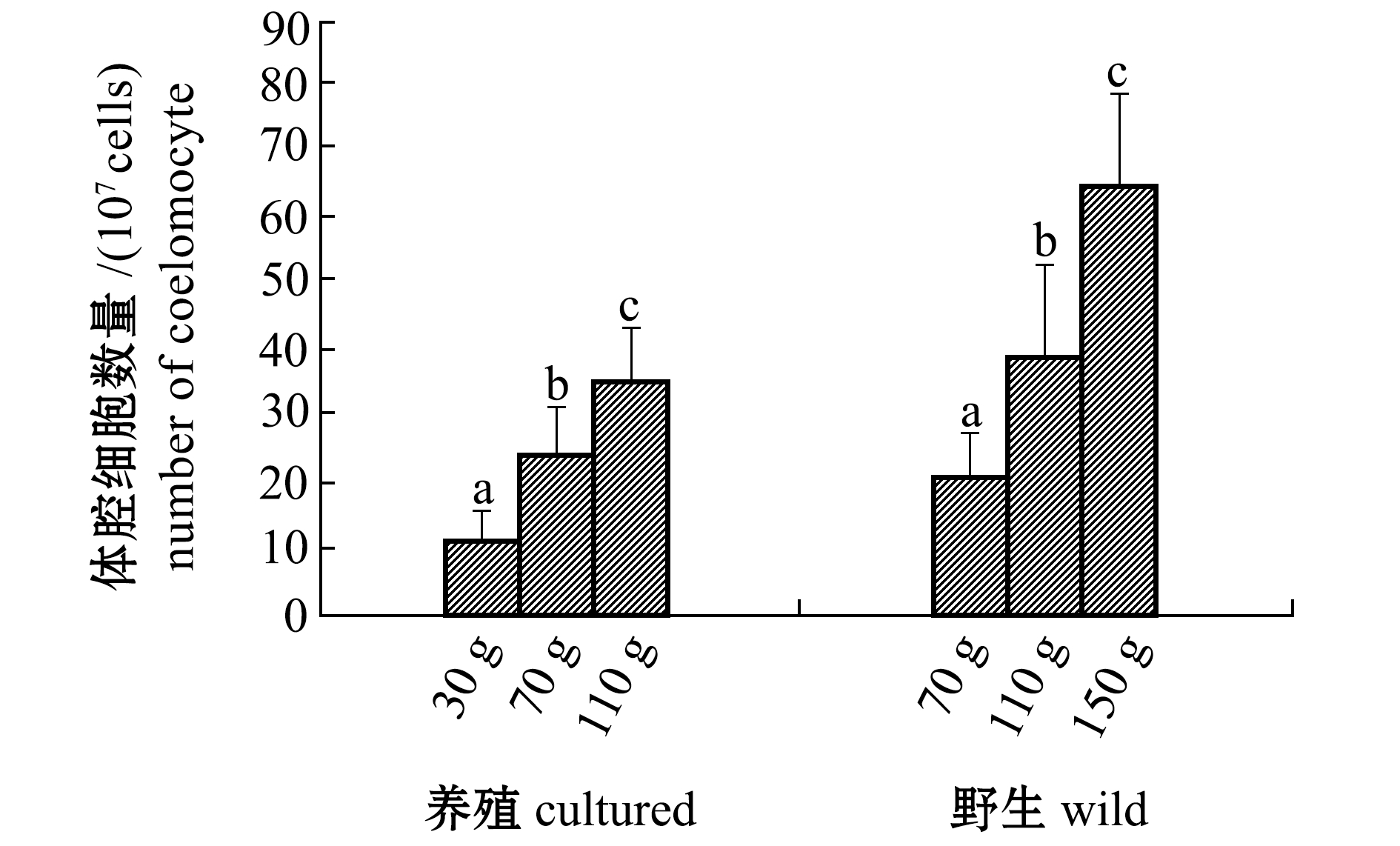
图5 不同规格养殖和野生刺参总体腔细胞数量
Fig.5 TCC in cultured and wild sea cucumberApostichopus japonicuswith different body weight
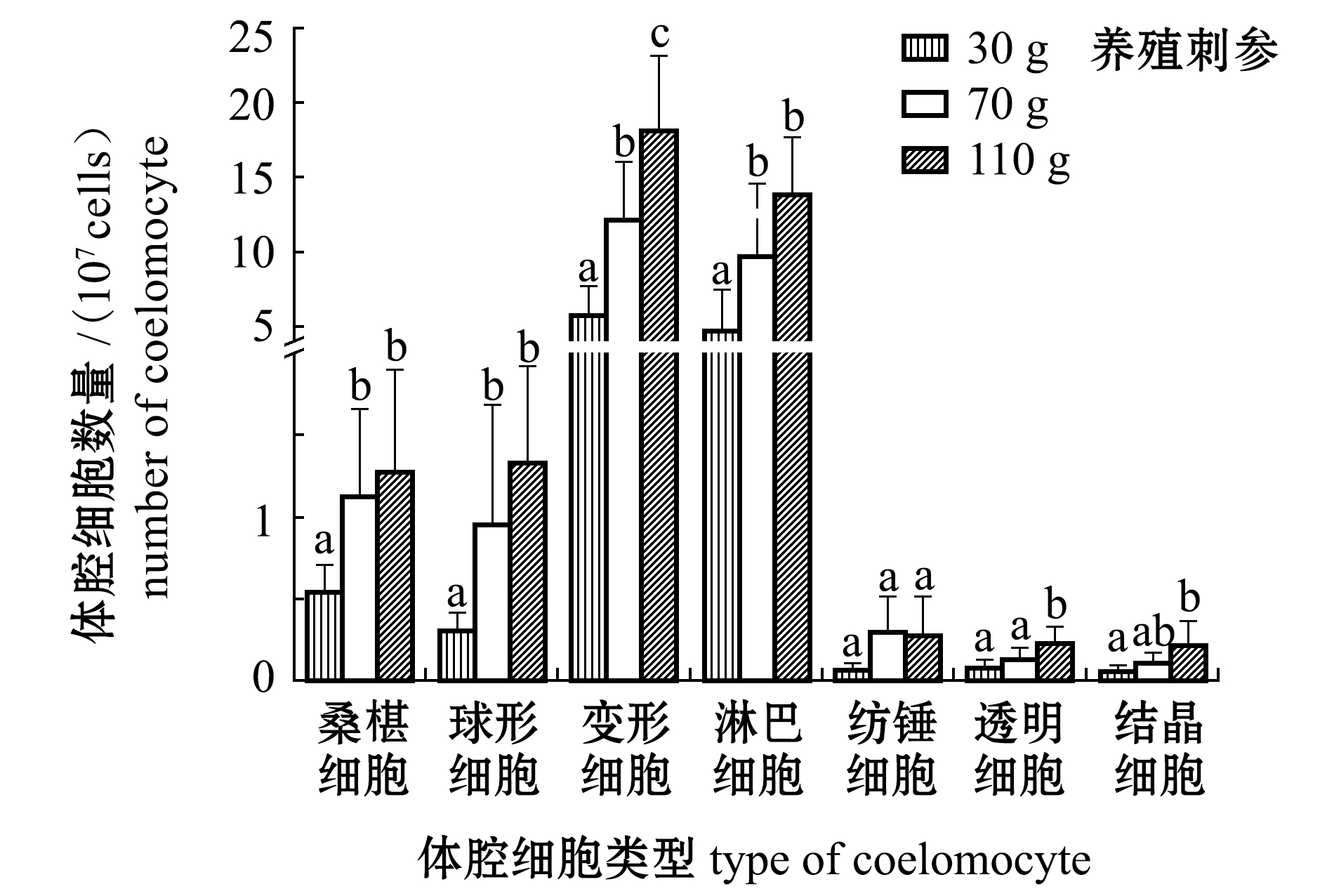
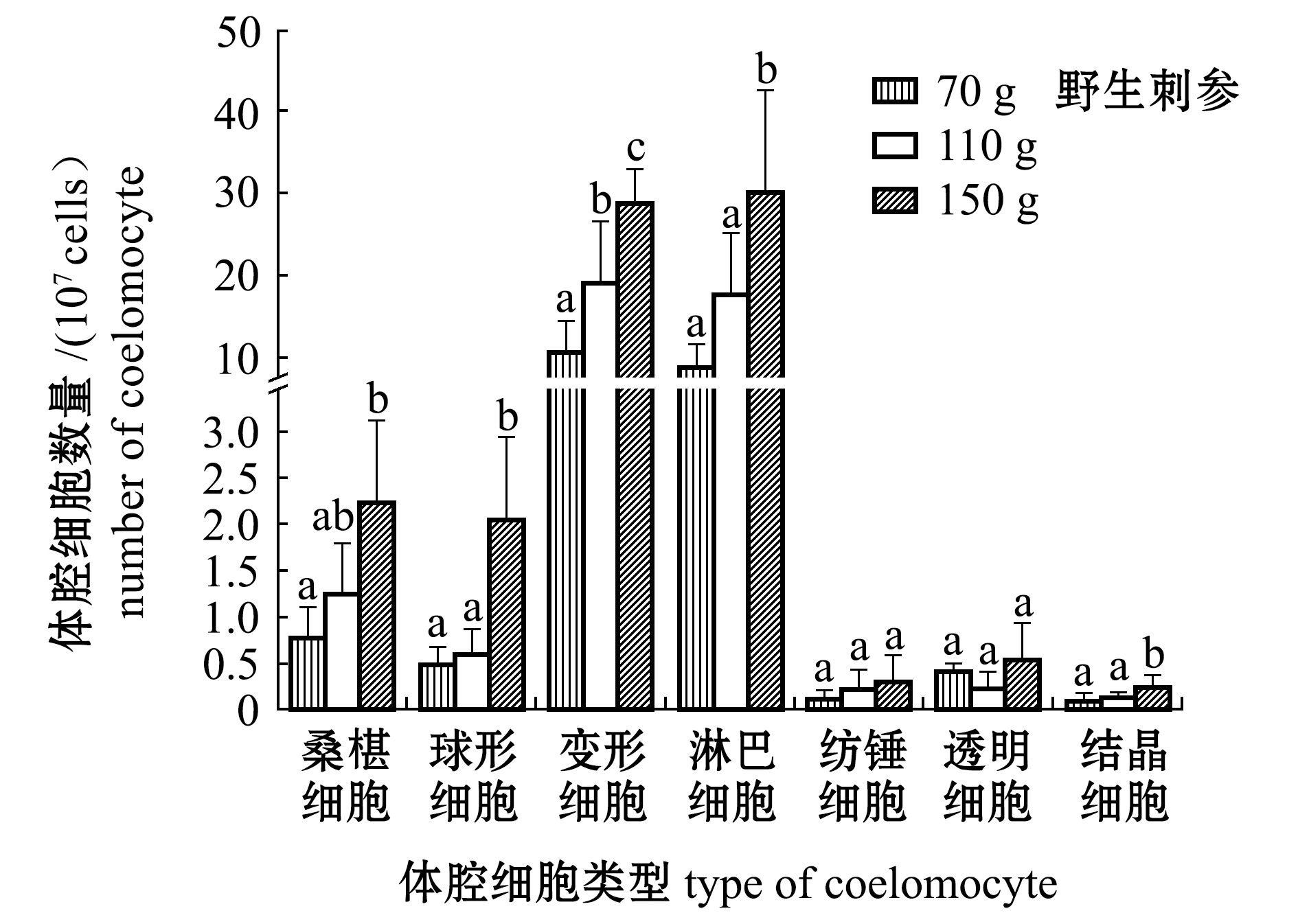
图6 不同规格养殖和野生刺参各类体腔细胞数量
Fig.6 DCC in cultured and wild sea cucumberApostichopus japonicuswith different body weight
2.5 刺参体腔液上清免疫酶活力
从7可见:养殖刺参体腔液上清ACP活力,110 g体质量组显著高于其他两组(P<0.05),而野生刺参各体质量组间无显著性差异(P>0.05);养殖刺参体腔液上清AKP活力,各体质量组间无显著性差异(P>0.05),而野生刺参110 g体质量组显著高于其他两组(P<0.05);养殖刺参体腔液上清CAT活力,110 g体质量组显著高于其他两组(P<0.05),而野生刺参各体质量组间无显著性差异(P>0.05);养殖刺参体腔液上清SOD活力,30 g体质量组显著高于其他两组(P<0.05),而野生刺参各体质量组间无显著性差异(P>0.05);相同规格的养殖与野生刺参4种免疫酶活力均无显著性差异(P>0.05)。
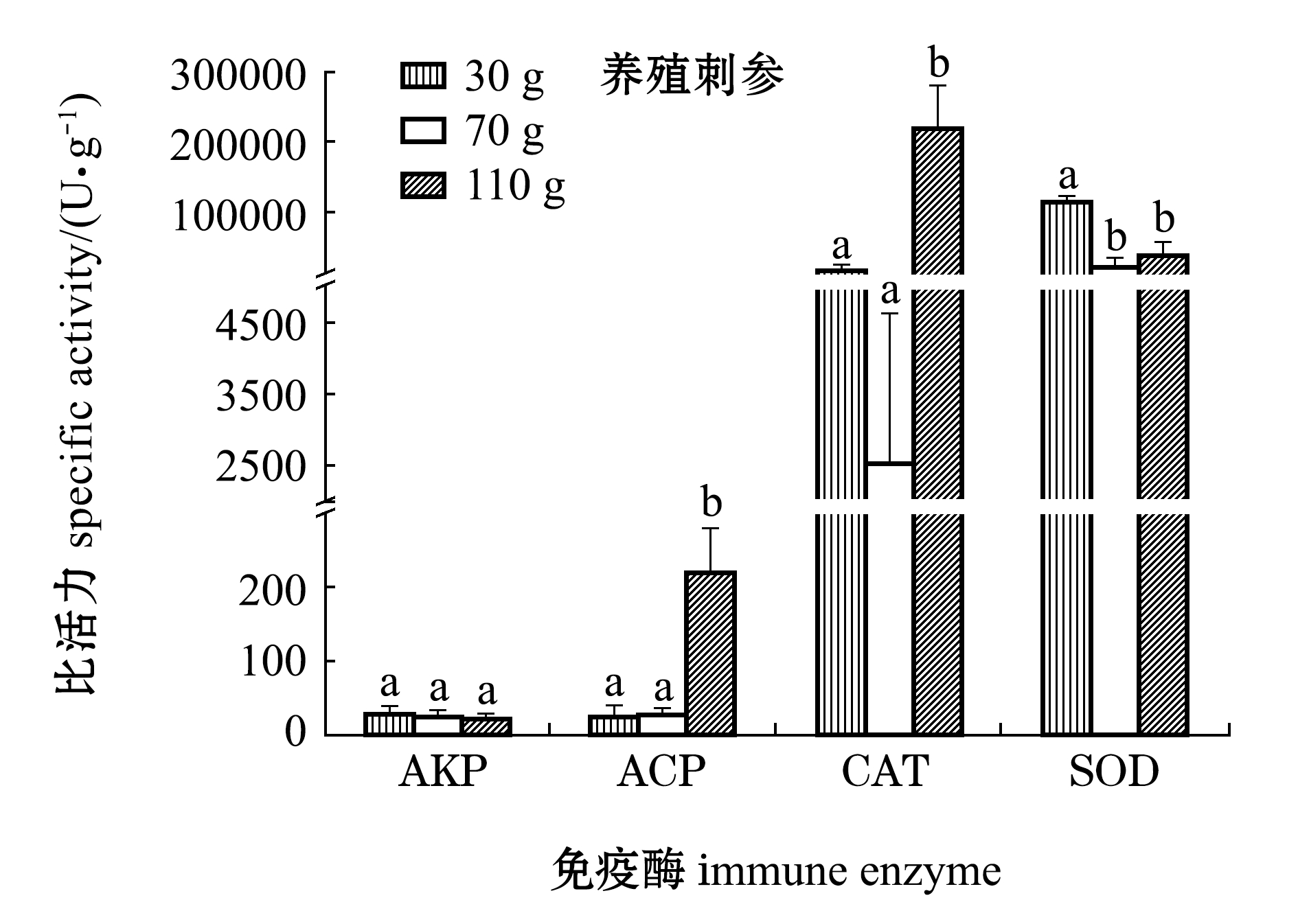
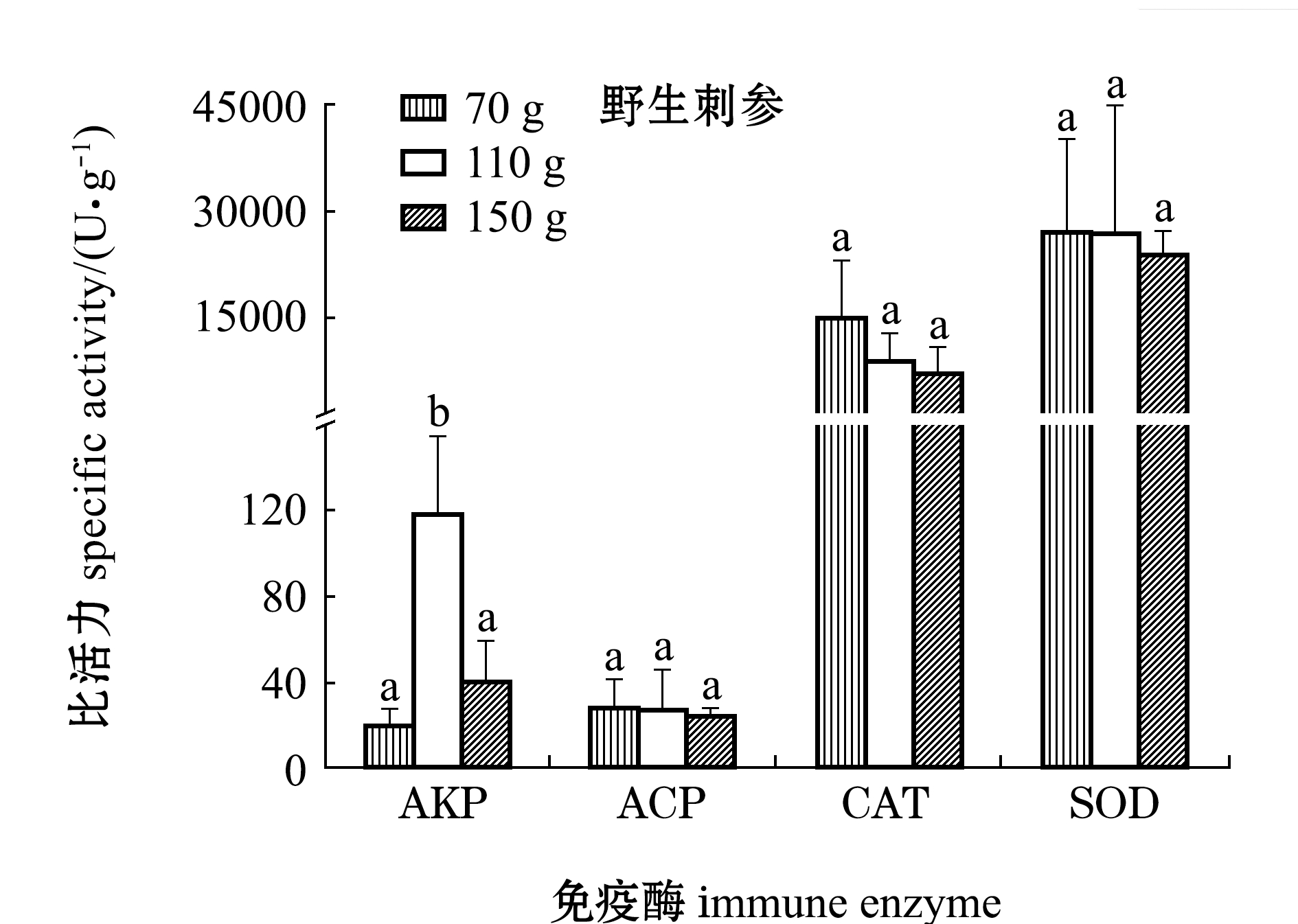
注:标有不同字母者表示同一种免疫酶不同体质量组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05)
Note: The means with different letters in same immune enzyme are significantly different among the body weight groups at the 0.05 probability level, and the means with the same letters are not significant differences
图7 不同规格养殖和野生刺参体腔液上清免疫酶活力
Fig.7 Immune enzyme activities in coelomic fluid of cultured and wild sea cucumberApostichopus japonicaswith different body weight
3 讨论
3.1 刺参体腔细胞的分类与数量
棘皮动物的体腔中有类似于淋巴的体腔液,在体腔液中有参与免疫反应的细胞,相当于白细胞。体腔细胞是棘皮动物的免疫核心成分,它既是细胞免疫的承担者,又是体腔液免疫因子的提供者[11]。有研究指出,体腔细胞的数量在一定程度上反映了棘皮动物机体的免疫应激能力或健康状况[6]。本研究中发现,通过穿刺抽取体腔液并测定体腔细胞密度,对于同一头刺参多次取样结果差异很大,分析原因可能是体腔细胞在体腔内分布不均匀所致。因此,为了保证数据的准确性,本研究中借鉴Li等[1]的取样方式,通过解剖获取所有体腔液,测定体腔细胞密度和体腔液容积,进而计算体腔细胞数量,结果发现,不论养殖刺参还是野生刺参,同种类型不同规格刺参体腔细胞密度并无显著性差异,其与朱江艳等[9]的研究结果不一致,分析原因可能与刺参的选取规格有关。朱江艳的研究中选取的刺参最大规格为50 g,最小规格为3 g,认为差异的原因是随着个体的增大,免疫系统在逐步完善,体腔细胞的密度也在逐步增加。但本试验中选取的养殖刺参最小规格为30 g,最大规格为110 g,野生刺参最小规格为70 g,最大规格为150 g,同种类型不同规格刺参之间不存在差异的原因,笔者认为是刺参在体质量为30 g时免疫系统已发育成熟,体腔细胞的密度已经达到正常水平,随着体质量的增加密度不再发生大的变化。其研究结果与田丹等[10]报道的50 g与100 g养殖刺参体腔细胞密度无显著差异的结果是一致的。另外,本研究中也发现,大规格养殖和野生刺参间体腔细胞密度也无显著性差异,说明不同的生存环境并不会影响刺参体腔细胞的密度。本研究中通过对养殖与野生刺参体腔液容积的比较,发现不同规格刺参的体腔液容积有极显著性差异,养殖与野生刺参体腔液容积都随体质量的增加而增加,体腔细胞的数量也随着体质量的增加而增加,这说明30 g左右的刺参免疫系统已发育成熟,但随着体质量的增加所需体腔液和体腔细胞也越来越多,但体腔细胞密度会始终维持在一个恒定水平。
目前,对于刺参体腔细胞的分类还未有统一的标准,本研究中主要借鉴Li等[1]的研究报道,将体腔细胞分为淋巴样细胞、变形细胞、球形细胞、桑椹细胞、透明细胞、纺锤细胞和结晶细胞7类,各类型体腔细胞的密度统计结果表明,不同规格的养殖刺参和野生刺参,变形细胞和淋巴细胞所占比重均比较大。此结果与Eliseikina等[2]和李华等[6]的研究结果一致,刺参属棘皮动物门,包含非特异性免疫,体液中的免疫因子和免疫细胞是其抵御外界病原入侵的主要手段,刺参体腔内分布的大量变形细胞和淋巴细胞很可能是刺参的主要免疫细胞。养殖刺参各类型体腔细胞在不同规格刺参间无显著性差异,但野生刺参150 g体质量组的球形细胞密度显著高于70 g和110 g组。田丹等[10]研究发现,养殖刺参在体质量为150 g左右时,体腔细胞各类型的比例与体质量为50 g和100 g相比发生明显变化,颗粒细胞(球形细胞)和变形细胞总比例上升到50%,认为这两类细胞比例的上升表明了刺参吞噬活性的增强、免疫能力的提高。本试验中并未测定150 g左右的养殖刺参,所以并未得出上述结论,但野生刺参的研究结果与其是一致的。另外,通过比较同种规格下养殖刺参和野生刺参发现,110 g体质量组养殖刺参与野生刺参的球形细胞和淋巴细胞密度有显著性差异,但具体原因目前尚不清楚。
3.2 不同规格刺参体腔液免疫活性差异
体腔液免疫是刺参防御病害入侵的主要免疫反应,体腔液作为刺参最重要的免疫组织之一,其含有大量的免疫因子,包括凝集素、溶血素、活性酶、类补体物质等[11-12]。研究表明,水产动物血细胞及体腔液中含有大量与免疫防御功能相关的酶类(如溶菌酶、磷酸酶、过氧化物酶、脂酶、蛋白酶、葡萄糖苷酶等),外来病原体在刺参体内的消除降解过程即视为酶解过程,通过内外调节手段改变动物体内酶水平可间接影响机体免疫能力[12]。ACP和AKP酶是刺参体内两种重要的水解酶类,ACP酶在刺参的免疫系统中起着调理素的作用,它可以诱导刺参体腔细胞中的阿米巴细胞对外来的物质进行吞噬作用,ACP活性可以代表刺参体内体腔细胞清除异物的能力[13]。本研究中发现,养殖刺参110 g体质量组ACP活性显著高于30 g和70 g两组,野生刺参体质量组间则无显著性差异,而朱江艳等[9]研究发现,不同规格的养殖刺参ACP活性无显著性差异,研究结果不一致的原因作者认为与刺参的选取规格有关,还可能与朱江艳等[9]检测的是体腔细胞沉淀物中的ACP活性,而本研究中检测的是体腔液上清中的ACP活力有关。对于AKP的检测结果恰恰相反,养殖刺参各体质量组间无显著性差异,而野生刺参110 g体质量组显著高于70 g和150 g两组,具体原因目前不清楚。
SOD与CAT酶均属于抗氧化酶,其能够及时清除吞噬细胞呼吸爆发产生的活性氧自由基,从而使机体免受损伤[14]。本试验中,养殖刺参和野生刺参中均表现出较高的CAT和SOD酶活性,说明CAT和SOD酶在刺参免疫过程中扮演了重要的防御作用。本研究中发现,养殖刺参体腔液SOD活性,30 g体质量组显著高于70 g和110 g两组;养殖刺参体腔液CAT活性,110 g体质量组显著高于30 g和70 g两组。田丹等[10]研究发现,POD活性随体质量增加呈下降趋势,150 g左右的刺参POD活性最低,而SOD活性却最高,该作者分析认为是随着刺参免疫系统的发育,抗氧系统发生了较明显的变化,在发育早期POD发挥了重要作用,而随着刺参的生长,SOD逐渐成为主要的抗氧化酶。本研究结果与其恰恰相反,具体原因可能与酶测量单位有关,本研究中测定单位是比活力,而田丹等[10]的测定单位是酶活力。另外,本研究中发现,相同规格养殖与野生刺参4种免疫酶活性均无显著性差异,说明不同的生存环境并不会影响体腔液免疫酶活性。
4 结论
无论养殖刺参还是野生刺参,同种类型不同规格刺参体腔细胞密度无显著性差异,但野生刺参150 g体质量组的球形细胞密度显著高于70 g和110 g组;同种规格下养殖刺参和野生刺参体腔细胞密度无显著性差异,但110 g组养殖刺参球形细胞和淋巴细胞密度与野生刺参存在显著性差异。对于体腔液指标,同种类型不同规格刺参免疫酶差异并不一致,无一定的规律性,同种规格下,养殖刺参和野生刺参无显著性差异。今后,将从基因表达层面进一步对不同规格养殖和野生刺参进行比较研究,以期为解析刺参免疫机制及免疫指标的建立提供基础试验数据。
[1] Li Qiang,Ren Yuan,Liang Chunlei,et al.Regeneration of coelomocytes after evisceration in the sea cucumber,Apostichopus japonicus[J].Fish & Shellfish Immunology,2018,76:266-271.
[2] Eliseikina M G,Magarlamov T Y.Coelomocyte morphology in the holothuriansApostichopus japonicus(Aspidochirota:Stichopodidae) andCucumaria japonica(Dendrochirota:Cucumariidae)[J].Russian Journal of Marine Biology,2002,28(3):197-202.
[3] 刘晓云,谭金山,包振民,等.刺参体腔细胞的超微结构观察[J].电子显微学报,2005,24(6):613-615.
[4] Xing Kun,Yang Hongsheng,Chen Muyan.Morphological and ultrastructural characterization of the coelomocytes inApostichopus japonicus[J].Aquatic Biology,2008,2(1):85-92.
[5] Taguchi M,Tsutsui S,Nakamura O.Differential count and time-course analysis of the cellular composition of coelomocyte aggregate of the Japanese sea cucumberApostichopus japonicus[J].Fish & Shellfish Immunology,2016,58:203-209.
[6] 李华,陈静,陆佳,等.仿刺参体腔细胞和血细胞类型及体腔细胞数量研究[J].水生生物学报,2009,33(2):207-213.
[7] 张宇鹏,田燚,商艳鹏,等.复合免疫增强剂对刺参生长和非特异性免疫酶活性的影响[J].大连海洋大学学报,2017,32(2):178-183.
[8] Dong Shuanglin,Liang Miao,Gao Qinfeng,et al.Intra-specific effects of sea cucumber (Apostichopus japonicus)with reference to stocking density and body size[J].Aquaculture Research,2010,41(8):1170-1178.
[9] 朱江艳,张洪彩,陈政强,等.不同规格刺参的非特异性免疫活性研究[J].集美大学学报:自然科学版,2013,18(6):408-412.
[10] 田丹,姜国良,刘云.不同体质量仿刺参免疫活性的研究[J].海洋科学,2013,37(10):47-52.
[11] 孟繁伊,麦康森,马洪明,等.棘皮动物免疫学研究进展[J].生物化学与生物物理进展,2009,36(7):803-809.
[12] 叶海斌,樊英,李天保,等.刺参免疫防御机制研究进展[J].安徽农业科学,2018,46(16):27-29.
[13] 张琴,麦康森,张文兵,等.饲料中添加硒酵母和维生素E对刺参生长、免疫力及抗病力的影响[J].动物营养学报,2011,23(10):1745-1755.
[14] 常杰,牛化欣,张文兵,等.刺参免疫系统及其免疫增强剂评价指标的研究进展[J].中国饲料,2011(6):8-12.