研究鱼类的胚胎及胚后发育过程,对人工繁殖和苗种生产有着重要的指导意义[1]。欧洲舌齿鲈Dicentrarchus labrax隶属于鲈形目、狼鲈科、舌齿鲈属[2],国内又称欧鲈。欧鲈在地中海地区的海水养殖种类中占有重要地位,是欧洲地区商业化养殖的第一个非鲑科海水鱼类[3]。欧鲈具有的广温广盐、生长迅速、病害较少的特点,适合循环水、池塘和网箱养殖。为促进中国水产养殖业的可持续发展,中国在2010年引进欧鲈,并开展了养殖、繁育和生长营养需求等相关研究[4-7],而有关欧鲈胚胎及仔鱼发育方面的研究目前尚未见报道。
本研究中,在人工培育条件下观察了欧鲈的胚胎及胚后发育过程,对仔鱼在不同时期的形态变化和生长特性进行了分析,旨在积累欧鲈早期生活史资料,为国内开展欧鲈的人工苗种繁育工作提供理论参考。
1 材料与方法
1.1 材料
欧洲舌齿鲈受精卵由大连海洋大学与大连富谷食品有限公司的科技人员联合繁育,选取性成熟雄鱼及雌鱼各8尾,其中,雄鱼体质量为(3.25±0.74)kg,雌鱼体质量为(3.44±0.82)kg。人工催产过程参考郑纪盟等[4]的方法。
1.2 方法
1.2.1 受精卵的孵化 欧鲈的受精卵为浮性卵,用120目筛绢细网小心将受精卵分离后,倒入60 L PP材质的孵化桶内,在溶解氧≥5.5 mg/L、盐度32、水温(13±0.5) ℃条件下进行孵化。
1.2.2 胚后培育 仔鱼孵出后转移至直径为140 cm的PP材质圆形培育缸内进行培育。培育密度为5000 ind./m3。培育条件与孵化桶内条件保持一致。仔鱼破膜后第3天向培育缸中添加小球藻Chlorellasp.,育苗前6 d内根据水色随时进行新鲜海水和小球藻的补充。6 d后开始逐渐加大换水量和充气量,保证充足的溶解氧。仔鱼开口摄食后投喂褶皱臂尾轮虫Brachionus plicatilis,摄食2 d后交叉投喂卤虫Artemiasp.无节幼体。
1.2.3 取样和观察测量 胚胎发育观察材料取自人工催产获得的同批正常发育的受精卵。每次用120目筛绢细网取30枚受精卵进行观察和测量,同时用甲醛固定30枚受精卵样品备用。取样和观察的时间间隔为胚盘期到囊胚期,每10 min进行一次;原肠胚期到出膜期每30 min进行一次。用Motic K-700L体视显微镜(目镜6.25×,物镜连续变倍1.0~5.2)观察欧鲈的胚胎发育全过程,记录各个时间点的形态发育特征,并进行拍照。
破膜孵化后的仔鱼发育阶段,每天直接从培育缸内取出30尾鱼苗进行样品的固定。前期采用吸管吸取鱼苗,后期为避免对鱼体造成损伤,采用捞网捞出。固定后的样品用OLYMPPUS SZ51解剖镜及其配套的图像采集系统进行拍照和测量。
胚胎及仔鱼各发育阶段划分参照刘筠[8]的方法,若镜检中有一半以上样本的胚胎发育至某一时期,则确定为胚胎发育至该时期。仔鱼的测量数据包括全长、肛前长、头长、眼径、体高和卵黄囊长。
2 结果与分析
2.1 受精卵及胚胎发育
刚产出的欧鲈卵(图1-A)为正圆球形,直径为(1.287±0.025) mm(n=30),为浮性卵,卵子透明,收纳聚集时呈淡绿色,卵内有1~4个油球,油球直径为(0.1132±0.007)mm(n=30)。产后自由漂浮在海水中,植物极朝下,动物极朝上,卵无黏性,卵粒分离。受精卵在盐度为32、水温为(13.0±0.5)℃的海水中,历时72 h完成胚胎发育全部过程(半数以上仔鱼孵化出膜)。胚胎发育各时期变化和主要特征见表1。
2.1.1 卵裂期 在温度为(13.0±0.5)℃的条件下,受精卵在1.5 h开始第1次卵裂,第1次卵裂为径裂,将胚盘分成大小相等的两个分裂球,分裂的细胞聚集在一端,油球位于另一端(图1-B);受精后2.0 h,在两个分裂球的垂直线上分化出纵沟,等分为两个分裂球,第2次卵裂完成,受精卵进入4细胞期(图1-C);受精后2.5 h,受精卵开始第3次卵裂,两个分裂面的方向与第1次分裂面平行,分裂出8个细胞,外侧细胞较大,内侧细胞较小(图1-D);受精后4.0 h,分裂面的方向及分裂后的细胞排列无规律,细胞直径变小,细胞间的界限逐渐模糊,此时胚胎进入多细胞期(图1-E);受精后4.5 h,细胞更为细小,难以统计数目,细胞团呈现如桑椹状的圆球形,此时胚胎进入囊胚期(图1-F)。
表1 欧洲舌齿鲈鱼胚胎发育各时期特征
Tab.1 Developmental characteristics of various embryonic stages in sea bassDicentrarchus labrax

发育时期embryonic development stage发育时间/htime after fertilization各发育阶段主要特征developmental characteristics图示plate受精卵fertilized egg0透明球形,有1~4个油球图1-A2细胞期2-cell stage1.5受精卵一端分裂出2个细胞图1-B4细胞期4-cell stage2.0受精卵一端分裂出4个细胞图1-C8胚叶期8-cell stage2.5受精卵一端形成胚叶图1-D多细胞期multi-cell stage4.0持续分裂,细胞变小,数量增多图1-E桑椹胚期morula stage4.5细胞分层堆积,形成桑椹状的细胞团图1-F高囊胚期high blastula stage9.0细胞团以高帽状聚集在动物极图1-G低囊胚期low blastula stage15.5囊胚变低,细胞逐渐向植物极包裹图1-H原肠早期early gastrula stage22胚胎背侧形成胚环,胚胎向下包裹至1/4卵黄处图1-I原肠中期mid-gastrula stage28胚胎下包到卵黄的1/2处图1-J胚胎轴出现期embryo body axis stage37胚胎伸长变成线状图1-K肌节和视囊出现期myomere and optic capsule stage48胚体中部出现肌节,可观察到视囊图1-L脑泡形成期brain vesicle stage56胚体出现明显头部,可观察到脑泡图1-M心脏形成期heart stage62心跳出现同时,胚胎开始有了微弱活动图1-N尾芽期tail-bud stage68胚体尾部与卵黄分离,可见片状鳍褶,眼囊变圆图1-O心脏跳动期heart-beating stage70心跳跳动加强,血流清晰可见图1-P孵出期hatching stage71卵绒膜被溶解,头部首先露出,胚胎剧烈摆动图1-Q初孵仔鱼newly hatched larva72胚体整体孵化出膜图1-R1、R2
2.1.2 囊胚期 受精后9.0 h左右,细胞数目继续增加,细胞层次进一步明晰,囊胚腔开始形成于卵黄与胎盘之间,囊胚中部隆起呈高帽状,此时受精卵进入高囊胚期(图1-G);受精后9.0~15.5 h期间,囊胚细胞逐渐向下包裹,边缘变薄,胚胎进入低囊胚期(图1-H)。
2.1.3 原肠胚期 受精后22 h左右,囊胚层细胞下包形成原肠胚(图1-I);受精后28 h,胚胎细胞层下包至卵黄的中间,受精卵进入原肠胚中期(图1-J);随着胚胎的继续发育,胚盾逐渐变长,胚胎发育至原肠末期。
2.1.4 神经胚期 受精后37 h,囊胚层细胞不断增多,逐渐将卵黄完全包裹。在显微镜光照下,可以观察到胚胎中线部位出现圆柱状脊索,胚体已有明显雏形,此时胚胎进入器官形成期(图1-K)。
2.1.5 器官形成期 受精后48 h,胚体肌节出现,可观察到轮廓清晰的视囊(图1-L);受精后56 h,体节数量明显增加,两个视囊间观察到了已经分室的椭圆形脑泡,此时胚体为脑泡形成期(图1-M);受精后62 h,可见心脏的微弱跳动,脊索中分布神经管,胚胎进入心脏形成期(图1-N);受精后68 h,胚体腹背分别可见初生鳍褶,胚体尾部继续分化,直至逐渐与卵黄囊分离,胚胎进入尾芽期(图1-O);受精后70 h,心脏开始有力跳动,并逐渐稳定在70~85次/min,血流清晰可见,胚体进入心脏跳动期(图1-P);受精后71 h,胚体扭动频繁且有力,胚体头部卵膜溶解,部分胚胎头部露出,尾部仍在膜内继续摆动,此时胚体即将出膜(图1-Q);受精后72 h,超过一半的仔鱼破膜而出,仔鱼腹部卵黄囊呈椭圆形,卵黄囊内部后端含有油球,胚胎发育过程完成(图1-R1、图1-R2);水体中残余有透明卵膜(图1-S)。
2.2 仔鱼发育
胚胎发育72 h后,胚体头部首先出膜,然后整个鱼体进行摆动,随之全部破膜而出,胚体进入仔鱼发育阶段。本试验中,对破膜后的仔鱼继续观察19 d,直到即将进入稚鱼期为止。第9天仔鱼开口摄食,1~8 d为早期仔鱼,9~19 d为晚期仔鱼。
2.2.1 早期仔鱼 初孵仔鱼全长为(3.98±0.02)mm,椭圆形卵黄囊整体与仔鱼头部相连,与仔鱼尾部分离;卵黄囊连接心脏,表面布满血管;心脏内部可观察到无色血液流动;肛门原基已经形成,尾椎骨向斜后方翘(图2-A)。初孵仔鱼活动能力较差,鱼体透明,腹部朝下悬浮于水体中上层,可摆动身体进行缓慢游动;孵化后1 d的仔鱼,全长为(4.16±0.14)mm,卵黄囊变小,头部区域与躯干的分离度增加,躯干变得平直,血液流动明显(图2-B);孵化后2 d的仔鱼,全长为(4.35±0.18)mm,卵黄囊继续变小,头部与躯干的分离度进一步增加,眼内黑色素开始沉积,血液流动明显(图2-C);孵化后3 d的仔鱼,全长为(4.55±0.25)mm,眼中的黑色素增加,血液开始显现红色(图2-D);孵化后5 d的仔鱼,全长为(4.97±0.08)mm,躯体部与卵黄囊相连处沉积大量黑色素,卵黄囊直径明显变小,眼囊与晶体颜色进一步加深(图2-E);孵化后7 d的仔鱼,全长为(5.42±0.14)mm,头部分化程度高,口裂明显,胸鳍鳍条形成,肠道明显但可见未完全消失的卵黄囊,此时仔鱼仍不能从外界摄食,需靠卵黄囊内油球提供营养,肛门附近有辐射状的色素细胞,躯体腹侧黑色素分布增多,少数仔鱼开始平游(图2-F)。
2.2.2 晚期仔鱼 孵化后9 d的仔鱼,全长为(5.87±0.15)mm,口裂和鳃盖能够开合,吻端突出,消化管增厚并弯曲,游泳能力增强至可在水中平游,卵黄囊减小至几乎消失,在肠道内观察到食物,说明仔鱼开始进入混合营养期,此时的仔鱼在水中游动时肉眼可观察到明显的胸鳍和尾鳍摆动(图2-G);孵化后11 d的仔鱼,全长为(6.51±0.19)mm,卵黄囊已经消失,吻端进一步分化,上颌短、下颌长,肠道蠕动频繁,黑色素进一步增多(图2-H);孵化后13 d的仔鱼,全长为(6.93±0.41)mm,仔鱼游动能力及捕食能力增强,肠道内充满食物(图2-I);孵化后15 d的仔鱼,全长为(7.60±0.26)mm,仔鱼游动速度加快,活力变强,仔鱼摄食后腹部饱满、膨胀,胃部蠕动有力(图2-J);孵化后17 d的仔鱼,全长为(8.11±0.55)mm,鱼体生长加快,头部鳃盖骨分离明显,尾鳍进一步发育,尾椎骨逐渐向上弯曲,仔鱼个体开始出现明显的大小差异(图2-K);孵化后19 d的仔鱼,全长为(8.64±0.21)mm,黑色素继续增多并逐渐遍布鱼体,体表颜色变暗,尾椎骨向上弯曲明显,各鳍基本形成,继续发育将进入稚鱼期(图2-L)。
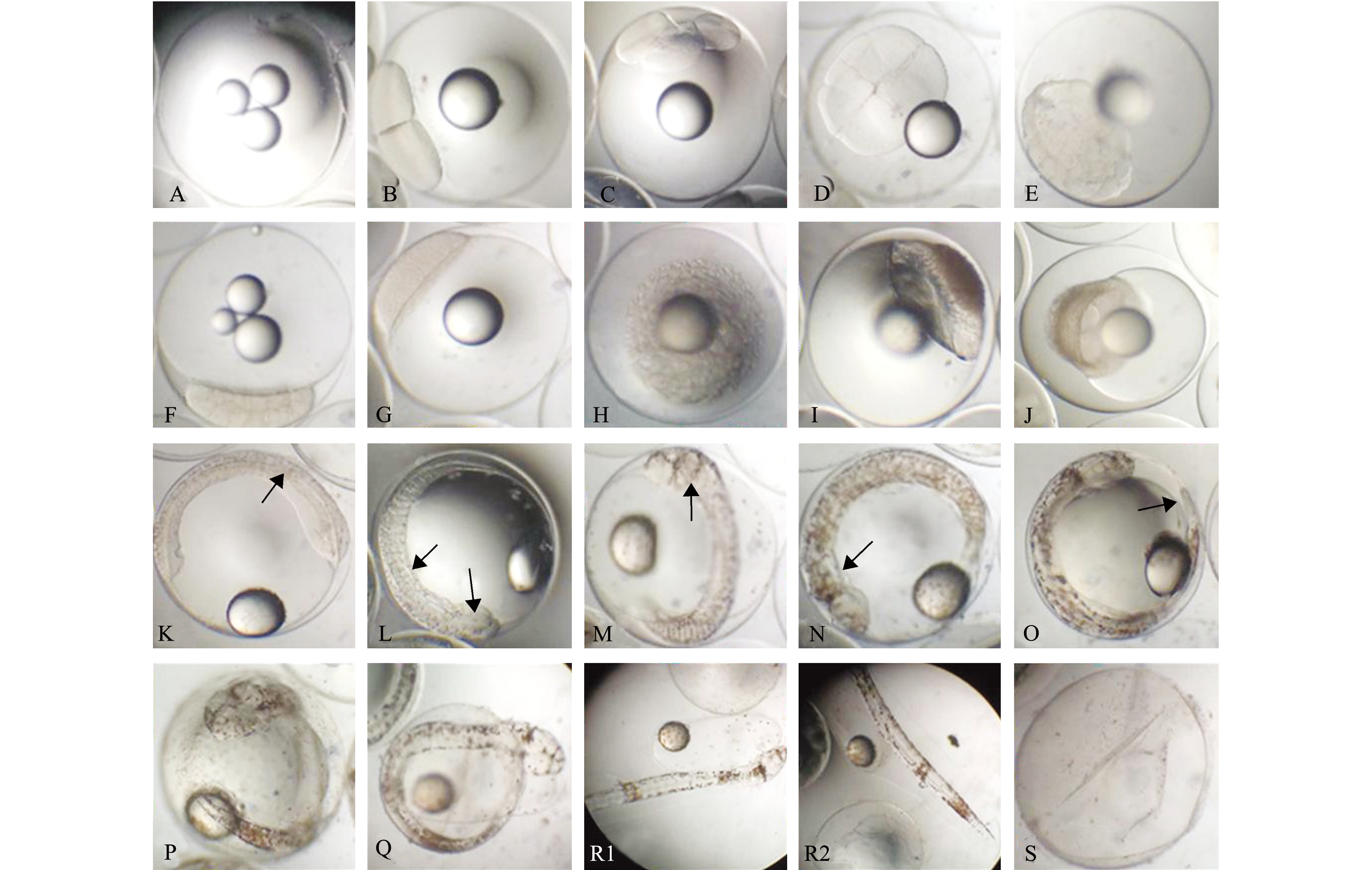
注:A为受精卵(0 h);B为2细胞期(1.5 h);C为4细胞期(2.0 h);D为8胚叶期(2.5 h);E为多细胞期(4.0 h);F为桑椹胚期(4.5 h);G为高囊胚期(9.0 h);H为低囊胚期(15.5 h);I为原肠早期(22 h);J为原肠中期(28 h);K为胚胎轴出现期(37 h),箭头示胚胎轴;L为肌节和视囊出现期(48 h),箭头示肌节和视囊;M 为脑泡形成期(56 h),箭头示脑泡;N为心脏形成期(62 h),箭头示心脏;O尾牙期(68 h);P心脏跳动期(70 h);Q为孵出期(71 h); R1为刚出膜的仔鱼头部(72 h);R2为刚出膜的仔鱼尾部(72 h);S为孵化后的卵膜
Note:A, fertilized egg(0 h);B, 2-cell stage(1.5 h);C, 4-cell stage(2.0 h);D, 8-cell stage(2.5 h);E, multi-cell stage(4.0 h);F, morula stage(4.5 h);G, high blastula stage(9.0 h);H, low blastula stage(15.5 h);I, early gastrula stage(22 h);J, mid-gastrula stage(28 h);K, embryo body axis(arrow) stage(37 h);L, myomere and optic capsule stage(48 h);M, brain vesicle(arrow) stage(56 h);N, heart(arrow) stage(62 h);O, tail-bud stage(68 h);P, heart-beating stage(70 h);Q, hatching stage(71 h);R1, head of newly hatched larva(72 h);R2, tail of newly hatched larva(72 h);S, egg membrane after hatching图1 欧洲舌齿鲈胚胎的发育
Fig.1 Embryonic development of sea bassDicentrarchus labrax
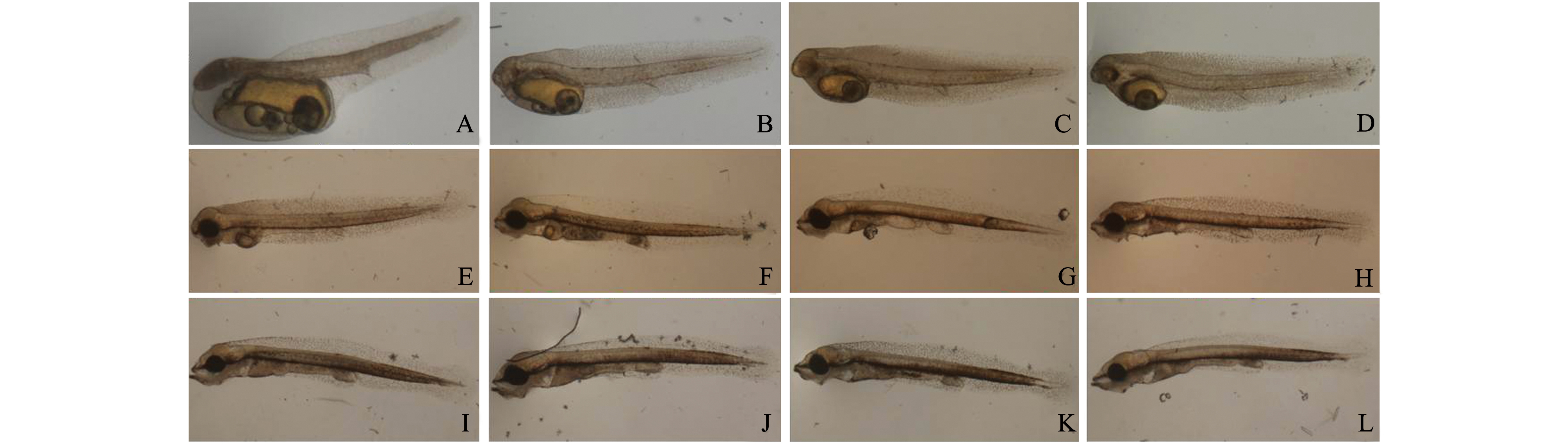
注:A为初孵仔鱼;B为1日龄仔鱼;C为2日龄仔鱼;D 为3日龄仔鱼;E为5日龄仔鱼;F为7日龄仔鱼;G为9日龄仔鱼;H为11日龄仔鱼;I为13日龄仔鱼;J为15日龄仔鱼;K为17日龄仔鱼;L为19日龄仔鱼
Note: A, newly hatched larva; B, 1 d after hatching; C, 2 d after hatching; D, 3 d after hatching; E, 5 d after hatching; F, 7 d after hatching; G, 9 d after hatching; H, 11 d after hatching; I, 13 d after hatching; J, 15 d after hatching; K, 17 d after hatching; L, 19 d after hatching
图2 欧洲舌齿鲈仔鱼的发育
Tab.2 Larval development of sea bassDicentrarchus labrax
2.3 仔鱼生长特性
经回归分析(图3),欧鲈仔鱼的全长生长方程为
y=0.00408x2+0.17773x+3.97911,R2=0.99825。
其中:y为欧鲈仔鱼全长(mm);x为孵化后时间(d)。仔鱼孵化后0~6 d全长及肛前距的生长速度较为平缓;孵化后6 d的仔鱼全长及肛前距的生长速度加快;孵化后0~9 d的仔鱼头长生长较快,孵化后9~13 d的仔鱼头长生长减慢,而13 d以后的头长生长又加快;孵化后0~5 d仔鱼眼径增长较快,孵化后5~19 d的仔鱼眼径增长较慢;孵化后0~9 d仔鱼的体高生长较慢,孵化后9~19 d仔鱼的体高增长较快(表2)。
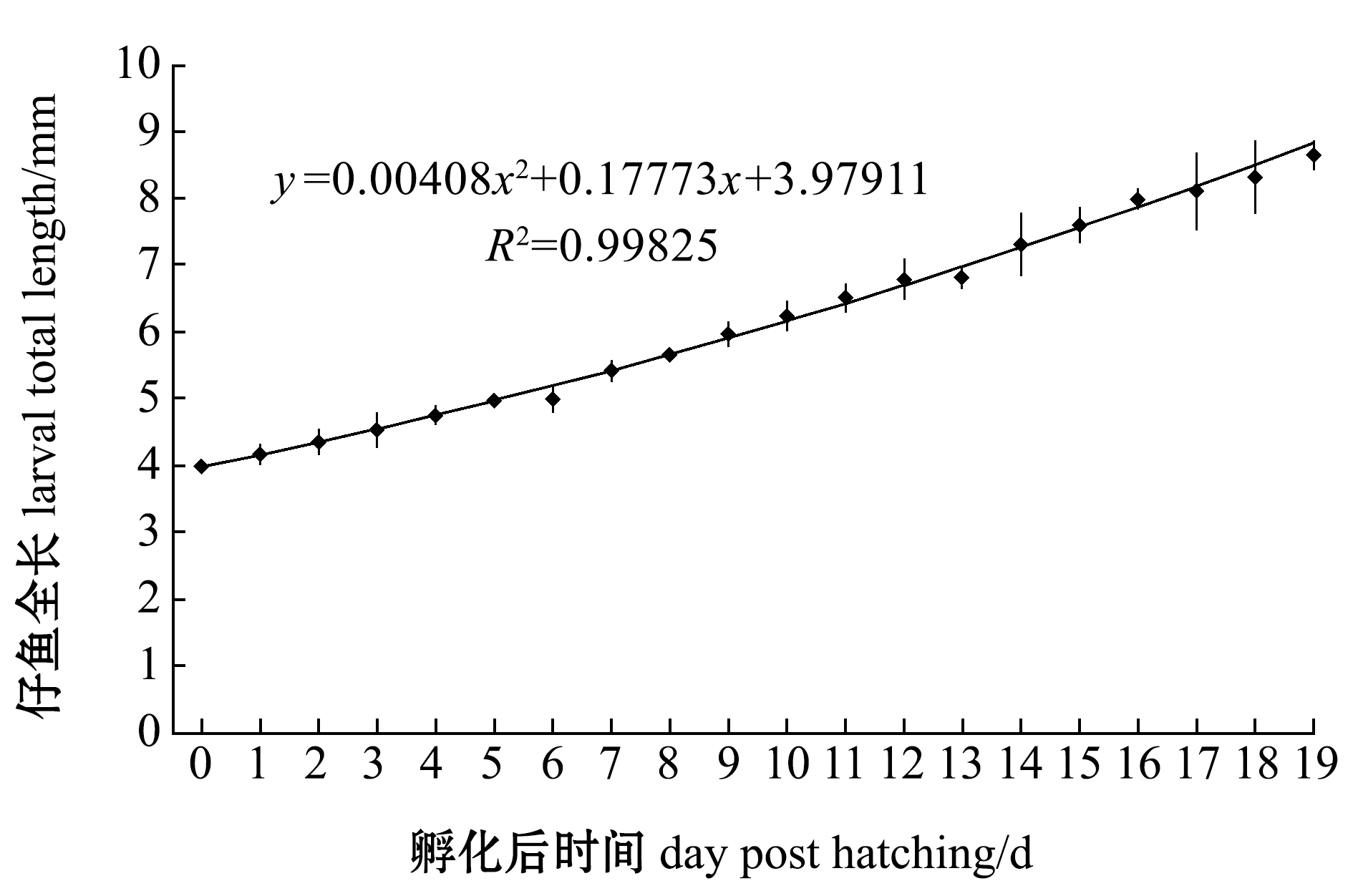
图3 欧鲈仔鱼的生长
Fig.3 Growth of larval sea bassDicentrarchus labrax
表2 欧洲舌齿鲈仔鱼发育过程的形态学测量
Tab.2 Morphological measurement of larval development of sea bassDicentrarchus labrax
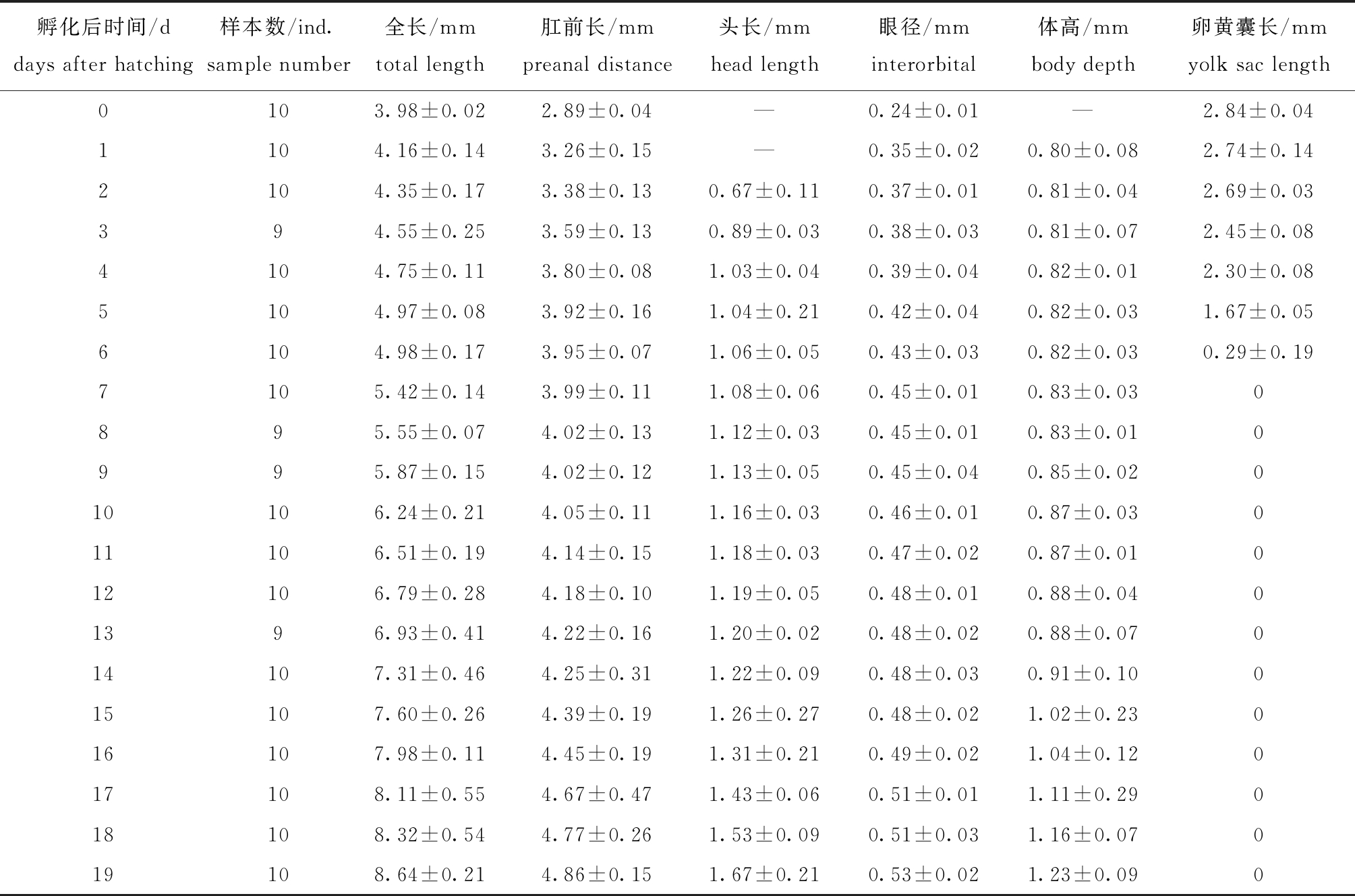
孵化后时间/ddays after hatching样本数/ind.sample number全长/mmtotal length肛前长/mmpreanal distance头长/mmhead length眼径/mminterorbital体高/mmbody depth卵黄囊长/mmyolk sac length0103.98±0.022.89±0.04—0.24±0.01—2.84±0.041104.16±0.143.26±0.15—0.35±0.020.80±0.082.74±0.142104.35±0.173.38±0.130.67±0.110.37±0.010.81±0.042.69±0.03394.55±0.253.59±0.130.89±0.030.38±0.030.81±0.072.45±0.084104.75±0.113.80±0.081.03±0.040.39±0.040.82±0.012.30±0.085104.97±0.083.92±0.161.04±0.210.42±0.040.82±0.031.67±0.056104.98±0.173.95±0.071.06±0.050.43±0.030.82±0.030.29±0.197105.42±0.143.99±0.111.08±0.060.45±0.010.83±0.030895.55±0.074.02±0.131.12±0.030.45±0.010.83±0.010995.87±0.154.02±0.121.13±0.050.45±0.040.85±0.02010106.24±0.214.05±0.111.16±0.030.46±0.010.87±0.03011106.51±0.194.14±0.151.18±0.030.47±0.020.87±0.01012106.79±0.284.18±0.101.19±0.050.48±0.010.88±0.0401396.93±0.414.22±0.161.20±0.020.48±0.020.88±0.07014107.31±0.464.25±0.311.22±0.090.48±0.030.91±0.10015107.60±0.264.39±0.191.26±0.270.48±0.021.02±0.23016107.98±0.114.45±0.191.31±0.210.49±0.021.04±0.12017108.11±0.554.67±0.471.43±0.060.51±0.011.11±0.29018108.32±0.544.77±0.261.53±0.090.51±0.031.16±0.07019108.64±0.214.86±0.151.67±0.210.53±0.021.23±0.090
3 讨论
3.1 欧洲舌齿鲈受精卵及胚胎发育
鱼类胚胎发育过程与卵子的成熟度、直径有着紧密联系。欧鲈的排卵量较大,2.5 kg左右的雌鱼排卵量可达30万粒左右。鱼类卵子的大小因物种、环境及产卵时间的不同也有差异[9]。欧鲈的受精卵为浮性卵,卵径为(1.287±0.025)mm,比河鲈Perca fluviatilis受精卵(卵径为1.4~1.7 mm)[10]、银鲈Bidyanus bidyanus受精卵(卵径为1.8~2.2 mm)[11]、松江鲈Trachidermus fasciatus受精卵(卵径为1.50~1.78 mm)[12-13]、花鲈Lateolabrax japonicus受精卵(卵径为1.38~1.51 mm)[14]小,比梭鲈Lucioperca lucioperca受精卵(卵径为0.96 mm)[15-16]、豹纹鳃棘鲈Plectropomus leopardus受精卵(卵径为0.816 mm±0.015 mm)[17]、驼背鲈Chromileptes altivelis受精卵(卵径为0.914 mm±0.019 mm)[18-19]、七星鲈Lateolaberx japonicus受精卵(卵径为1.25 mm)[20]、加州鲈Micropterus salmoides受精卵(卵径为1.1~1.3 mm)[21]、黑莓鲈Pomoxis nigromaculatus受精卵(卵径为0.89 mm±0.06 mm)[22]大。卵的大小还受雌鱼营养水平的影响[23],经过营养强化的亲鱼繁殖的受精卵尺寸更大。鱼卵的大小对其早期存活具有重要生态意义,仔鱼卵黄囊耗尽及开口时间与受精卵卵径的大小呈正相关[24]。欧鲈的卵径较大,虽然这可能降低了初孵仔鱼的活动能力,但也延长了从内源性营养转向外源性营养的过程,卵黄囊提供营养的时间较长,有利于仔鱼建立初次摄食,提高存活率。一般在较低温度条件下,孵化期长、代谢率低,对大卵有利[25],所以欧鲈鱼卵的孵化过程不宜采用较高的孵化温度。
欧鲈受精卵的卵裂方式为盘状卵裂,多次卵裂形成囊胚后通过外包法形成原肠胚,原肠胚的不同胚层继续发育逐渐形成器官。在本研究中,欧鲈的受精卵在水温为(13.0±0.5)℃的条件下,历时72 h(50%的仔鱼孵化出膜)完成胚胎发育的全部过程,比Cucchi等[26]研究中报道的孵化时间(15 ℃条件下68 h)相对较长,这主要是由于本研究中的海水温度较低。发育早期的胚胎对环境条件非常敏感,除温度外,盐度[27]、光照[28]、酸碱度[25]、溶解氧[29]和无机物[30]等均对胚胎发育有较大影响。有关环境因子对欧鲈胚胎发育的影响还有待进一步探讨。
3.2 欧洲舌齿鲈仔鱼形态变化和观察分析
欧洲舌齿鲈仔鱼的发育可分为早期仔鱼阶段和晚期仔鱼阶段。早期仔鱼又称卵黄囊期仔鱼,仔鱼口裂未完全发育,游动能力较差,无法摄食外界营养物质,依靠卵黄囊提供营养,直至卵黄囊逐步吸收消失。欧鲈的早期仔鱼有着较大的卵黄囊,仔鱼前期时间较长,而口裂发育完全后,卵黄囊消失的速度很快,这说明欧鲈仔鱼发育过程中的混合营养期很短,在养殖中要确保仔鱼在发育过程中能够及时地提供适口的外源性营养物质以保证其生长发育。目前,已有研究对后期仔鱼结束的判断没有统一标准。张海发等[31]认为,鱼鳍的完全形成、鳞片的出现为后期仔鱼结束的标志;刘东娥等[32]认为,覆盖仔鱼各鳍的鳍膜彻底消失后则进入稚鱼期;陈国华等[33]认为,尾鳍、胸鳍的基本形成,体色出现即可认为仔鱼进入了稚鱼期。本研究中欧鲈后期仔鱼的发育过程较长,有关该时期过渡到稚鱼期的形态变化特点还有待研究。
欧鲈仔鱼的生长速度有阶段性差异,早期仔鱼依靠内源性物质提供营养,生长较快;在第8天开口后转向外源性物质提供营养,但由于游动能力仍然较差,捕食效率低,生长较慢;而进入仔鱼后期以后,随着仔鱼游动能力加强,已适应了从外界摄取营养,生长又加快。同时,欧鲈为凶猛性捕食鱼类,在养殖中应控制好孵化温度及亲鱼的产卵批次和营养条件,以免因鱼苗个体发育差异过大,导致互相残食。
[1] 科舍列夫.鱼类发育生态形态和生态生理学研究[M].张亢西,译.北京:科学出版社,1985.
[2] Nelson J S.Fishes of the world[J].The Quarterly Review of Biology,1995,70(2):232-233.
[3] FAO.Review of the state of world aquaculture[R].Roma:FAO,1997.
[4] 郑纪盟,张磊,夏苏东,等.欧洲舌齿鲈人工繁育技术[J].科学养鱼,2015,31(4):43-44.
[5] 张磊,郑纪盟,夏苏东,等.盐度和温度对欧洲舌齿鲈(Dicentrarchus labrax)幼鱼活动与存活的影响[J].安徽农业科学,2014,42(34):12121-12122.
[6] 高露.大连海洋大学工厂化繁育欧洲舌齿鲈苗种获得突破[J].水产科技情报,2017,44(5):284.
[7] 张静,李勇,赵宁宁,等.欧洲舌齿鲈和花鲈生长期营养需求特点综述[J].渔业现代化,2016,43(5):12-17.
[8] 刘筠.中国养殖鱼类繁殖生理学[M].北京:农业出版社,1993.
[9] Bobe J,Labbé C.Egg and sperm quality in fish[J].General and Comparative Endocrinology,2010,165(3):535-548.
[10] 乔德亮,凌去非,殷建国,等.河鲈胚胎及卵黄囊期仔鱼发育[J].生物学杂志,2006,23(1):34-38.
[11] 李恒颂,邬国民,范阳,等.银鲈胚胎和仔鱼的发育[J].中国水产科学,2000,7(2):5-9.
[12] 王金秋,潘连德,梁天红,等.松江鲈鱼(Trachidermus fasciatus)胚胎发育的初步观察[J].复旦大学学报:自然科学版,2004,43(2):250-254.
[13] 赵一杰,张美昭,温海深.松江鲈鱼胚胎及仔稚鱼形态观察[J].现代农业科技,2012(19):256-259.
[14] 胡先成,曹双俊,周忠良,等.花鲈胚胎发育的研究[J].重庆师范学院学报:自然科学版,1997,14(2):51-56.
[15] 丁海,李荣庆.梭鲈胚胎发育及仔鱼前期发育的初步观察[J].淡水渔业,1999,29(1):7-10.
[16] 黄金善,郭家祥,刘奕,等.梭鲈胚胎及仔鱼发育观察[J].东北农业大学学报,2009,40(2):65-69.
[17] 王永波,陈国华,林彬,等.豹纹鳃棘鲈胚胎发育的初步观察[J].海洋科学,2009,33(3):21-26.
[18] 区又君.驼背鲈的胚胎发育[J].海洋科学,2006,30(8):17-19.
[19] 张梦淇,陈超,李炎璐,等.驼背鲈(Chromileptes altivelis)的胚胎发育及仔、稚、幼鱼形态观察[J].渔业科学进展,2014,35(5):145-153.
[20] 陈瑞芳,童万平.七星鲈胚胎发育与水温关系的研究试验[J].广西科学院学报,2011,27(1):22-24.
[21] 刘文生,林焯坤,彭锐民.加州鲈鱼胚胎及幼鱼发育的研究[J].华南农业大学学报,1995,16(2):5-11.
[22] 钟全福.黑莓鲈胚胎发育观察及温度对胚胎发育的影响[J].福建水产,2014,36(5):333-343.
[23] Hsiao S,Greeley M S Jr,Wallace R A.Reproductive cycling in femaleFundulus heteroclitus[J].The Biological Bulletin,1994,186(3):271-284.
[24] Knutsen G M,Tilseth S.Growth,development,and feeding success of Atlantic cod larvaeGadus morhuarelated to egg size[J].Transactions of the American Fisheries Society,1985,114(4):507-511.
[25] 李霞.水产动物组织胚胎学[M].北京:中国农业出版社,2006.
[26] Cucchi P,Sucré E,Santos R,et al.Embryonic development of the sea bassDicentrarchus labrax[J].Helgoland Marine Research,2012,66(2):199-209.
[27] 姜志强,赵祥东,王国祖.不同盐度下牙鲆幼鱼存活、生长和摄食的研究[J].大连水产学院学报,2002,17(2):79-83.
[28] 谢刚,陈焜慈,胡隐昌,等.倒刺鲃胚胎发育与水温和盐度的关系[J].大连水产学院学报,2003,18(2):95-98.
[29] 谢刚,祁宝崙,余德光,等.鳗鲡胚胎和早期仔鱼的耗氧量[J].大连水产学院学报,2000,15(4):250-253.
[30] Humphrey C,Weber M,Lott C,et al.Effects of suspended sediments,dissolved inorganic nutrients and salinity on fertilisation and embryo development in the coralAcropora millepora(Ehrenberg,1834)[J].Coral Reefs,2008,27(4):837-850.
[31] 张海发,刘晓春,刘付永忠,等.斜带石斑鱼胚胎及仔稚幼鱼形态发育[J].中国水产科学,2006,13(5):689-699.
[32] 刘冬娥,张雅芝,方琼珊,等.斜带石斑鱼仔、稚、幼鱼的形态发育研究[J].台湾海峡,2008,27(2):180-189.
[33] 陈国华,张本.点带石斑鱼仔、稚、幼鱼的形态观察[J].海南大学学报:自然科学版,2001,19(2):151-156.