褐藻胶是一类广泛存在于褐藻植物细胞壁中的水溶性酸性多糖物质,主要是由1,4-β-D甘露糖醛酸(M)和1,4-α-L古罗糖醛酸(G)两种糖醛酸单体以1-4糖苷键连接而成的酸性多糖组成[1],并存在聚甘露糖醛酸(poly M)、聚古罗糖醛酸(poly G)和M、G两种单体交替的嵌段3种方式,具有较高的应用价值。由于褐藻胶的分子质量较大(50~100 000 ku),故其应用方面受到限制,通常将大分子的褐藻胶降解为低聚糖或寡糖片段。研究发现,褐藻胶寡糖具有抗肿瘤[2]、抗凝血[3]、保护神经[4]、促进植物生长[5-6]等多重生理活性。传统制备褐藻胶寡糖的方法主要有物理降解法、化学降解法和生物酶解法[7]等。物理降解法主要包括超声波法或者物理辐射,一般需要配合其他降解方法一起使用,对所用的设备具有较高的要求,难以应用;化学降解法主要包括酸降解、碱降解和氧化降解等,其缺点是反应时间较长,生成的副产物较多,难以去除;生物酶解法尤其是微生物产酶降解褐藻胶,反应条件温和、易控制,目标产物得率高,因此,研究应用较为广泛。
在自然界中广泛存在产褐藻胶裂解酶的生物体,主要包括动物内脏和微生物。动物内脏主要集中在海洋棘皮动物[8]、软体动物[9]等,如主要以海藻为食的海胆、海兔等,在其内脏、肠道和消化器官中可分离得到褐藻胶裂解酶。微生物源主要有指从褐藻、巨藻、海带中筛选出产褐藻胶裂解酶菌株,还有直接分离获得的海洋细菌[10]、真菌[11]等。微生物来源主要包括芽孢杆菌[12]、弧菌[13]、盐单胞菌[14]等。
海星Asteroidea sp.作为海洋无脊椎动物,隶属于棘皮动物门,主要食用海参、牡蛎等以海藻等作为主要食物的海洋动物,其体内可以存在与消化酶共同参与褐藻胶消化及吸收的微生物菌群。目前,从海星内脏中筛选得到产褐藻胶裂解酶的菌株鲜有报道。本研究中,主要以褐藻胶作为唯一碳源,在海星内脏中筛选出一株产褐藻胶裂解酶菌株,通过对菌株形态、生理生化鉴定及16S rRNA基因鉴定,并优化其产酶条件,进行发酵罐中试发酵,利用菌株产粗酶液制备褐藻胶低聚糖或寡糖,并对降解的低聚糖或寡糖进行结构分析,以期找到高效产褐藻胶裂解酶的微生物菌株,为后续褐藻胶寡糖的分离纯化和生理活性研究提供数据资料。
1 材料与方法
1.1 材料
1.1.1 样品及药品 试验用海星采自大连旅顺柏岚子养殖场。
褐藻胶(产品批号:YPSQJT1701031-1)购于青岛明月海藻集团有限公司;褐藻胶底物标准品购于Sigma公司;细菌基因组DNA提取试剂盒购于天根生物技术有限公司;其他试剂均为国产分析纯。
1.1.2 仪器与设备 试验用仪器主要有LDZM-60KCS立式蒸汽灭菌器(上海申安医疗器械厂)、HWS24型电热恒温水浴锅(上海一恒科学仪器有限公司)、酶标仪(美国伯腾仪器有限公司)、微量台式小型离心机(Thermo Fisher)、聚合酶链式反应(PCR)仪(德国Eppendorf公司)、恒温培养箱(天津欧诺仪器有限公司)、生物显微镜(德国Leica公司)、水浴恒温振荡器(上海龙跃仪器设备有限公司)和BIOTECH-10BGZG-7K发酵罐(上海保兴生物设备工程有限公司)。
1.1.3 培养基
富集培养基(1 L):褐藻胶12 g、(NH4)2SO4 5 g、NaCl 20 g、KH2PO4 1 g、MgSO4·7H2O 0.5 g、FeSO4·7H2O 0.01 g,pH 7.0。
初筛培养基(1 L):在富集培养基的基础上添加20 g琼脂。
初筛发酵培养基:同富集培养基一致。
1.2 方法
1.2.1 菌株筛选 将海星内脏取出均质后,取5 g加到装有50 mL富集培养基的250 mL三角瓶中,在26 ℃下以150 r/min发酵培养48 h,取培养液,用无菌生理盐水进行10-3~10-7梯度稀释,取100 μL涂布于初筛培养基平板中,25 ℃下恒温培养72 h,将生长出的菌落重新接种到新的初筛培养基平板中,进行菌株纯化,纯化三代后,将分离纯化的菌株接种到初筛发酵培养基中,26 ℃下以150 r/min发酵培养48 h,取发酵液在4 ℃下以10 000 r/min离心10 min,取上清液进行酶活力测定。
1.2.2 菌株鉴定
初始培养条件:挑取一株新鲜斜面培养的菌株接种到装有15 mL初筛发酵培养基的50 mL大试管中,在26 ℃下以150 r/min培养24 h,再按照体积分数2%的接种量接种到装有50 mL初筛发酵培养基的250 mL三角瓶中,在26 ℃下以150 r/min培养,取发酵液用于指标测定。
形态学鉴定及生理生化试验:取培养24 h的发酵液,用无菌生理盐水稀释到适当浓度,取100 μL涂布于初筛培养基平板中,25 ℃下倒置培养72 h,观察菌株形态,生理生化试验参照《常见细菌系统鉴定手册》[15]。
16S rRNA基因鉴定:采用细菌基因组试剂盒提取该菌株DNA,利用16S rRNA通用引物27F(5′GAGTTTGATCCTGGCTCAG 3′)、1492R(5′GGTTACCTTGTTACGACTT 3′)进行PCR扩增,将获得的扩增片段进行测序。将测序结果的基因序列输入美国国立生物技术信息中心(National Center for Biotechnology Information,NCBI)核苷酸数据库进行BLAST分析,选取同源性较高的16S rRNA序列,采用邻接法(Neighbor-Joining)构建菌株系统发育树[16]。
1.2.3 菌株产酶活力、生物量的测定
褐藻胶裂解酶酶活力测定:采用3,5-二硝基水杨酸法(DNS)测定褐藻胶裂解酶酶活力。取5 μL发酵液上清液,加入95 μL Na2HPO4-NaH2PO4缓冲液,与100 μL 5 g/L褐藻酸钠溶液混合,在35 ℃条件下反应1 h,迅速加入100 μL DNS试剂,沸水浴10 min;空白对照为发酵液上清液在沸水浴中加热15 min。然后在570 nm波长下测定吸光度OD570 nm,主要根据产生还原糖(以葡萄糖计)的大小判断酶活力。
酶活力单位(U/mL)定义为:在35 ℃条件下,每分钟催化底物产生1 μg还原糖(以葡萄糖计)需要的酶量为一个酶活力单位。
相对酶活力测定:将试验组的最高酶活力定义为100%,将其他条件下的酶活力与最高酶活力的比值定义为相对酶活力。
菌株生物量测定:取100 μL不同发酵菌液,将其用1倍体积的无菌生理盐水进行稀释,同时以未接菌摇瓶发酵培养基的发酵菌液作为空白对照,利用比浊法,在600 nm波长下测定发酵液中的生物量(OD600 nm)。
1.2.4 菌株培养条件优化 根据初始培养条件进行菌株培养,取发酵液测定其酶活力和生物量,每个试验设3个平行。后续每一步在初筛发酵培养基和初始培养条件的基础上进行优化。
分别进行碳源质量浓度(4~16 g/L)、氮源质量浓度(2~7 g/L)、NaCl质量浓度(0~60 g/L)、pH(5.5~8.5)、培养温度(22~35 ℃)、转速(100~200 r/min)、接种量(1%~5%)、装液量(25~100 mL/250 mL)对菌株产酶发酵的单因素影响试验。
根据单因素结果,综合考虑碳源浓度、初始pH、氮源浓度、NaCl浓度、接种量、温度、装液量7个因素对菌株生物量和酶活力的综合影响,根据7因素3水平设计L18(37)正交试验。
1.2.5 10 L发酵罐产酶试验 基于正交优化试验条件,进行10 L发酵罐扩大发酵产酶试验。根据发酵罐使用要求,按照最优培养基成分配制培养基6 L,装罐灭菌,将培养24 h的种子液按照比例接入发酵罐中。设置发酵温度为22 ℃,搅拌速度为150 r/min,每隔12 h进行无菌取样,检测其生物量、酶活力、pH值。
1.2.6 降解低聚糖与寡糖的HPLC分析
降解产物的制备:利用丙酮沉淀法制备粗酶液。将发酵粗酶液在搅拌条件下添加一定体积的预冷丙酮(-20 ℃)进行沉淀,在4 ℃条件下静置1 h,以10 000 r/min冷冻离心20 min,沉淀即为粗酶,并测定其酶活力。将粗酶与褐藻胶按照比例混合,在22 ℃下以150 r/min培养24 h,将混合物以10 000 r/min冷冻离心10 min,收集上清液,冷冻干燥,制得降解产物。
HPLC分析:色谱条件为Thermo BioBasic SEC-120色谱柱,柱温为35 ℃,以Na2SO4溶液作为流动相;使用示差检测器(RID)进行检测。
2 结果与分析
2.1 菌株的筛选与鉴定
经过富集、初筛、纯化、培养,在以褐藻胶作为唯一碳源的发酵培养基中进行初筛,获得初筛菌株10株。将筛选出的10株菌进行发酵培养,测定其酶活力和生物量,发现编号AlgX2的菌株其酶活力最高,进行产酶方式的判断为胞外酶,经5代遗传性稳定试验表明,该菌株产酶能力稳定。
由图1可知,菌株AlgX2在初筛培养基中,25 ℃条件下培养72 h,菌落呈圆形、淡黄色,表面光滑。通过部分生理生化试验结果显示,该菌株在甘露醇、淀粉和蔗糖中均可生长(表1)。
表1 AlgX2菌株的生理生化特征
Tab.1 Physiological and biochemical characteristics of strain AlgX2

试验项目 item结果 result接触酶 H2O2+氧化酶 oxidase-硝酸盐 nitrate-VP-明胶液化 gelatin liquefaction-氧化发酵 oxidation and fermentation发酵型甘露醇 mannitol+蔗糖 sucrose+乳糖 lactose-淀粉 starch+
注:+示反应呈阳性;-示反应呈阴性
Note: +,positive reaction; -,negative reaction
菌株AlgX2基因序列测序分析表明,其16S rRNA大小为1426 bp,经比对,发现其16S rRNA的基因序列与Cobetia属多种菌株的序列一致性达到99%。系统发育树(图2)显示,该菌株与Cobetia amphilecti聚为一支,亲缘关系最近。根据其形态特征和生理生化特征及系统发育树所示,将该菌株鉴定为盐单胞菌属Cobetia,并命名为Cobetia AlgX2。
2.2 产酶培养基优化
2.2.1 培养基成分优化 不同培养基成分中褐藻胶浓度、硫酸铵浓度、NaCl浓度、初始pH对菌株产酶和生长影响的试验结果如图3所示。
随着褐藻胶质量浓度的增加,菌株的酶活力和生物量均呈先升高后降低的趋势,当浓度达到12 g/L时,菌株的产酶和生长均达到最大值,分析原因可能是高浓度的褐藻胶影响培养基中的溶氧量,不利于菌株的产酶和生长(图3-A)。
当硫酸铵质量浓度达到4 g/L时,菌株的产酶和生长均达到最大值,之后随着浓度的继续增加,酶活力先骤降后达到平稳状态,但其生物量随之不断降低,其原因有待进一步探究(图3-B)。
海洋来源的菌株生长和产酶需要一定的盐度,在液体发酵培养基中,添加不同浓度的NaCl对于菌株产酶存在较大的差异,该菌株产酶的最佳NaCl浓度为30 g/L,分析原因可能是该菌株分离于海洋生物中,与菌株的原始生长环境相关(图3-C)。
培养基的不同初始pH对于菌株产酶和生长影响较大,当初始pH达到6.5时,菌株的生长和产酶均达到最大值,随着pH的继续增加,菌株的生长和产酶随之降低(图3-D)。
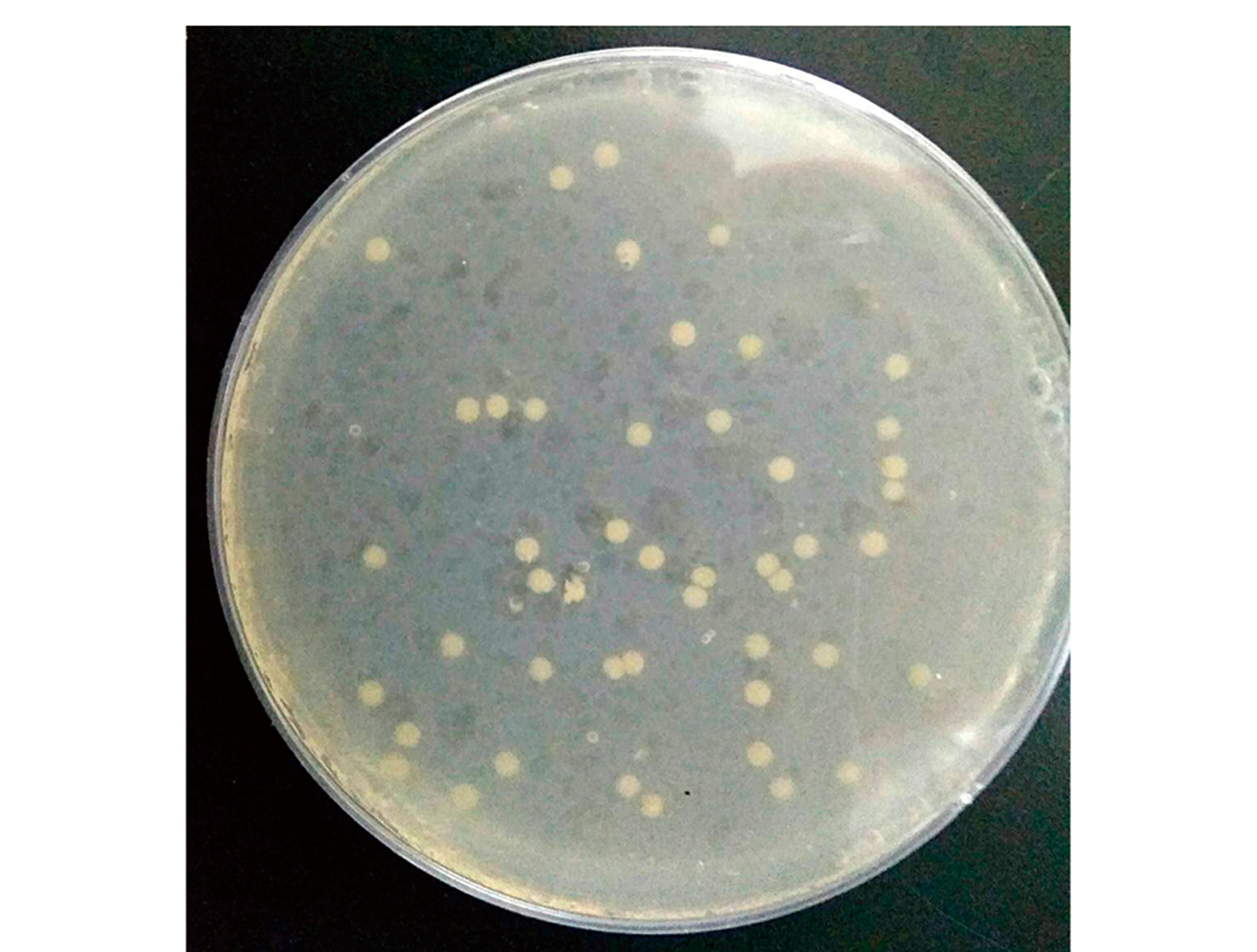
图1 菌株AlgX2的形态特征
Fig.1 Morphological characteristics of strain AlgX2
2.2.2 培养条件优化 不同培养条件下,温度、转速、接种量和装液量对菌株产酶和生长影响的试验结果如图4所示。
温度对菌株的生物量影响较大,当温度为22 ℃时,菌株的生物量和酶活力均较低,在26 ℃时,其生物量和酶活力均达到最大值,当温度高于26 ℃之后,温度对菌株的生物量影响不大,但菌株的产酶活力下降(图4-A)。
不同转速对菌株的生物量和酶活力影响不大(图4-B)。
当接种量大于2%时,随着接种量的增加其生物量和酶活均随之下降(图4-C),分析原因可能是随着接种量的增加,其菌体生长延滞期缩短,从而影响菌体的生物量和酶活力。
菌株的生物量和酶活力受发酵过程中溶氧量的影响,而装液量的多少直接影响其溶氧量,当装液量为50 mL/250 mL时其菌株的产酶达到最大值;而随着装液量的增加,菌株的生物量随之增加(图4-D),说明该菌株可能是厌氧菌,溶氧量不会影响其菌株的生长。

图2 基于16S rRNA基因序列构建的菌株AlgX2系统发育树
Fig.2 Phylogenetic tree of strain AlgX2 based on 16S rRNA gene sequence
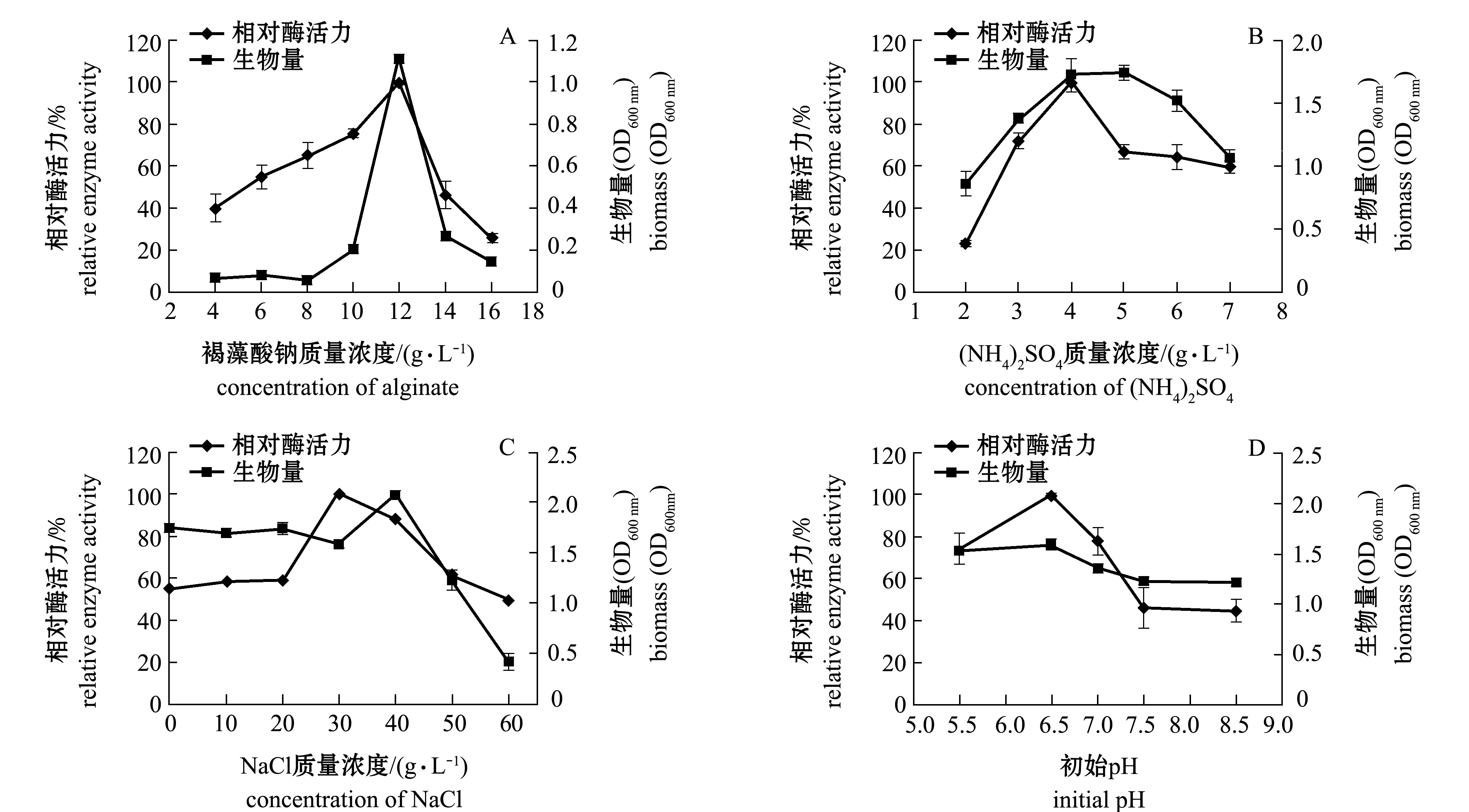
图3 不同培养基成分对菌株产酶和生长的影响
Fig.3 Effect of medium composition on enzyme production and growth of strain AlgX2

图4 不同培养条件对菌株产酶和生长的影响
Fig.4 Effect of culture condition on enzyme production and growth of strain AlgX2
2.3 正交试验设计及结果
根据单因素试验结果,设计7因素3水平的L18(37)正交试验(表2),试验结果如表3所示。由于培养基中的各个成分间可能存在交互作用,由表3可知,产褐藻胶裂解酶菌株生长的最佳培养基成分和培养条件组合为A3B1C2D2E1F2G2,即褐藻胶质量浓度为14 g/L,初始pH为6.0、硫酸铵质量浓度为4 g/L、NaCl质量浓度为30 g/L、接种量为2%、温度为22 ℃、装液量为50 mL/250 mL。
根据极差结果分析显示,对菌株生长、产酶各因素影响的大小为B>E>G>C>A>F>D,可知B因素是决定菌株生长和产酶的重要因素,即初始pH对菌株的生长和产酶影响力最大,而氮源浓度对菌株的生长产酶影响极低,分析原因可能是由于该菌株是盐单胞菌,具有极强的耐盐性。通过验证试验,最优组合的酶活力达到0.240 U/mL,OD600 nm值达到1.707,与正交试验表中试验组13(酶活力达到0.247 U/mL)相比,其酶活力相差不大,但生物量远远高于试验组13,因此,选择最优组合作为菌株培养的最佳培养基成分和最佳条件。
2.4 10 L发酵罐产酶结果分析
根据正交试验结果,进行10 L发酵罐产酶试验,分别测定酶活力、生物量和pH的变化,试验结果如图5、图6所示。
表2 菌株AlgX2产酶优化正交试验因素水平表
Tab.2 Factors and levels of the orthogonal test for enzyme production by strain AlgX2
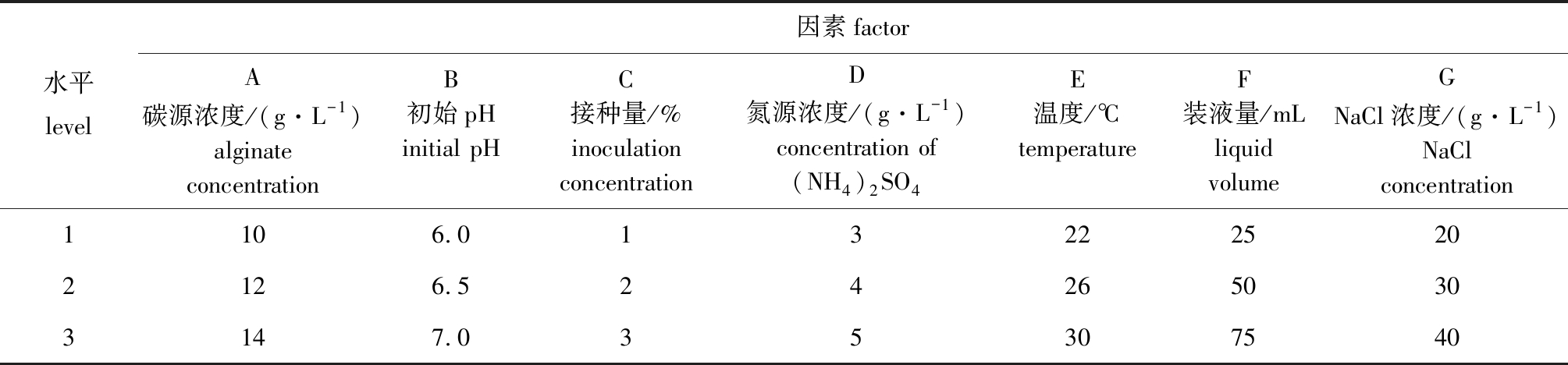
水平level因素factorA碳源浓度/(g·L-1)alginate concentrationB初始pHinitial pHC接种量/%inoculation concentrationD氮源浓度/(g·L-1)concentration of(NH4)2SO4E温度/℃temperatureF装液量/mLliquid volumeGNaCl浓度/(g·L-1)NaCl concentration1231012146.06.57.0123345222630255075203040
表3 菌株AlgX2产酶优化L18(37)正交试验设计及试验结果
Tab.3 Design and results of orthogonal test on enzyme producing optimization by strain AlgX2
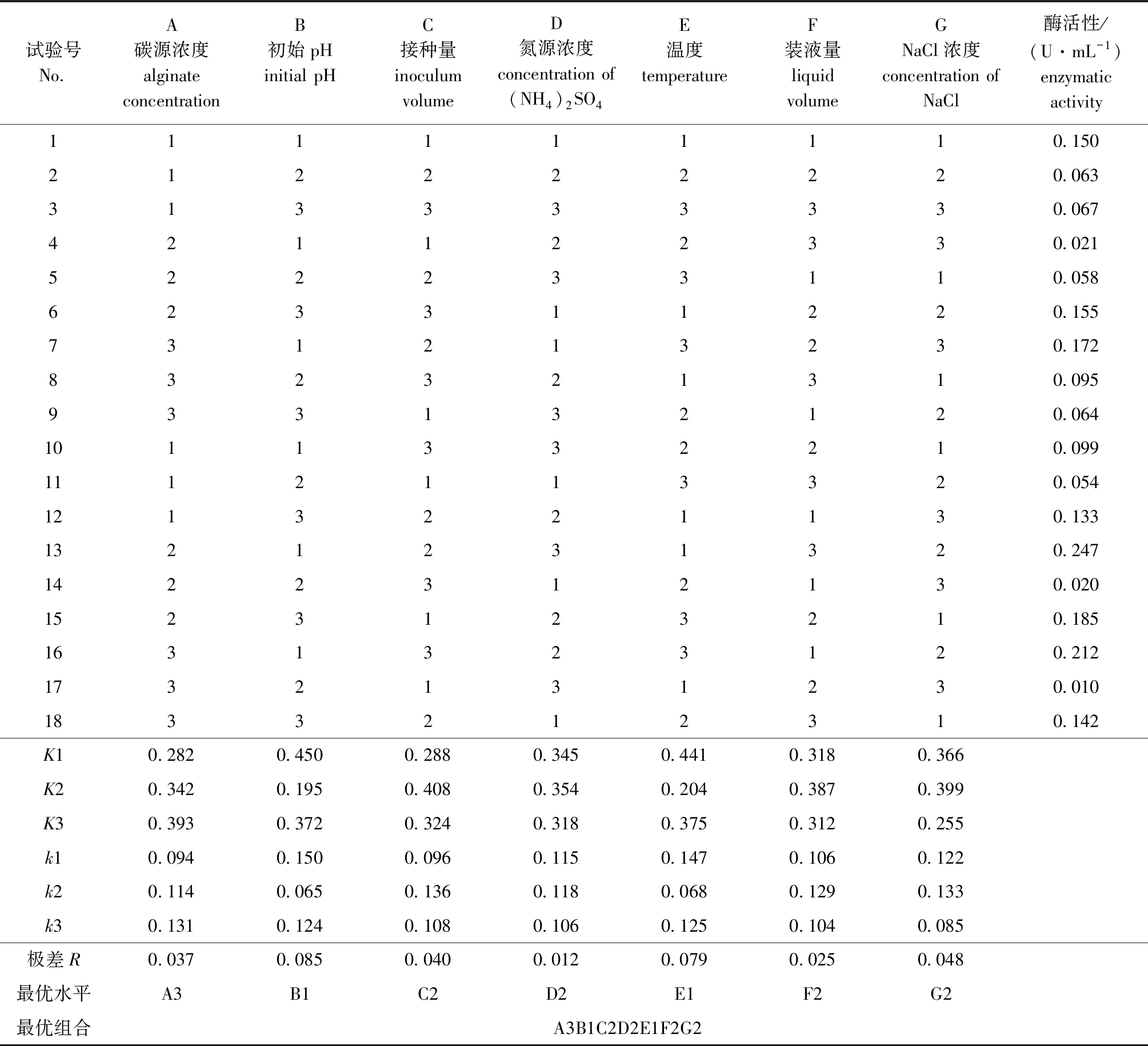
试验号No.A碳源浓度alginate concentrationB初始pHinitial pHC接种量inoculum volume D氮源浓度concentration of (NH4)2SO4E温度temperatureF装液量liquid volumeGNaCl浓度concentration of NaCl 酶活性/(U·mL-1)enzymatic activity111111110.150212222220.063313333330.067421122330.021522233110.058623311220.155731213230.172832321310.095933132120.0641011332210.0991112113320.0541213221130.1331321231320.2471422312130.0201523123210.1851631323120.2121732131230.0101833212310.142K10.2820.4500.2880.3450.4410.3180.366K20.3420.1950.4080.3540.2040.3870.399K30.3930.3720.3240.3180.3750.3120.255k10.0940.1500.0960.1150.1470.1060.122k20.1140.0650.1360.1180.0680.1290.133k30.1310.1240.1080.1060.1250.1040.085极差R0.0370.0850.0400.0120.0790.0250.048最优水平A3B1C2D2E1F2G2最优组合A3B1C2D2E1F2G2
从图5可见,菌株在发酵24 h内处于延滞期,酶活力和生物量变化不大,24 h后菌株生长处于对数期,褐藻胶裂解酶大量积累,当48 h时酶活力达到最大值,为0.176 U/mL,是摇瓶发酵菌株酶活的83.7%。这可能是由于发酵罐中使用机械搅拌与传统的摇瓶培养不同,机械搅拌产生的剪切力可能改变菌株的生长形态,增加发酵环境中的溶氧量,引起菌株生长环境的改变,从而影响菌株的产酶。
从图6可见,随着发酵时间的延长,发酵液pH呈现上升趋势,在发酵过程中菌株大量利用海藻酸,影响发酵液的pH变化。根据摇瓶正交试验结果,pH是决定菌株生长产酶的重要因素,在发酵过程中发酵液pH的变化导致其生长、产酶时间和产酶能力发生变化。
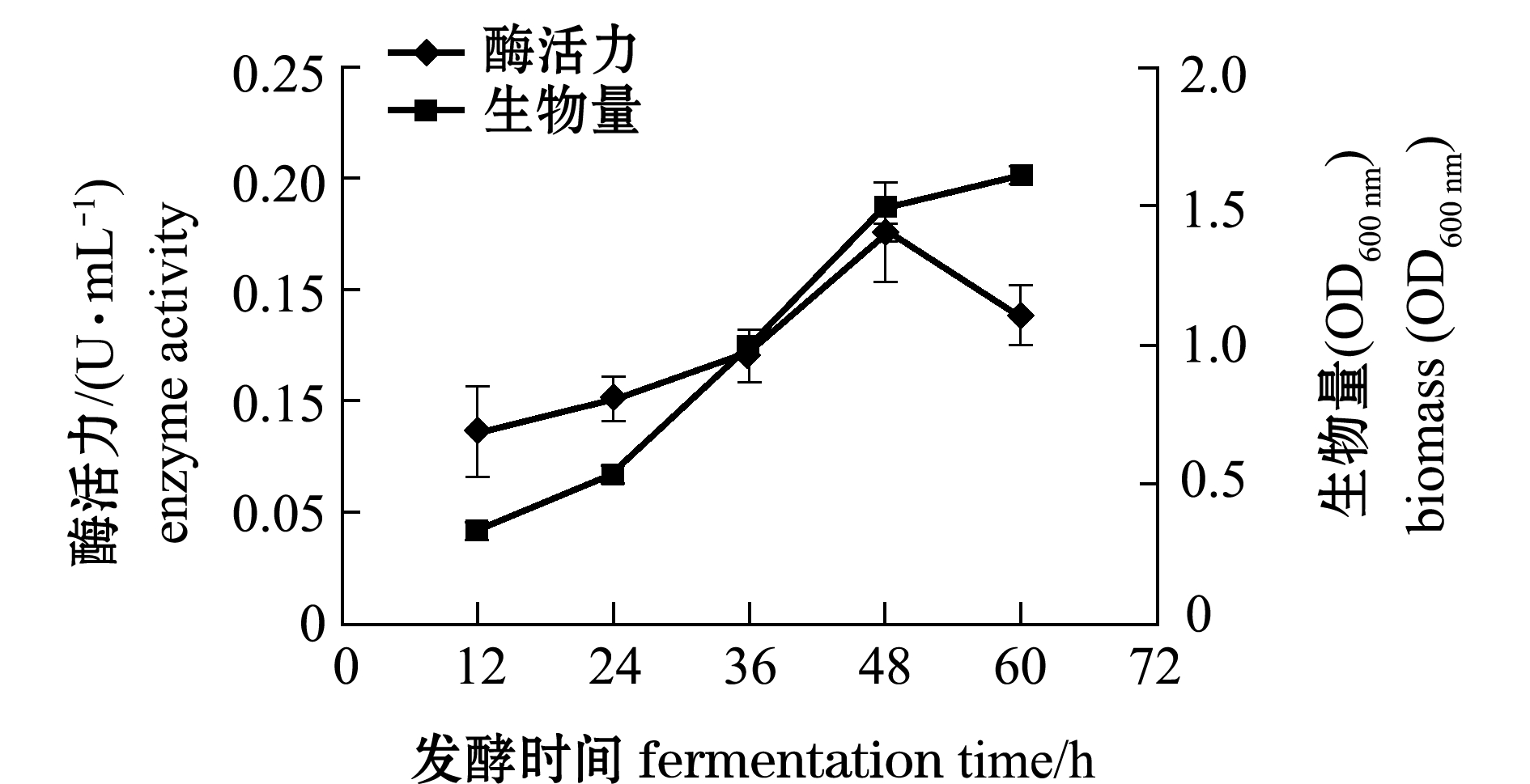
图5 10 L发酵罐AlgX2菌株发酵产褐藻胶裂解酶曲线
Fig.5 Fermentation curve of AlgX2 production alginate lyase in a 10 L bioreactor
2.5 降解寡糖分析
根据丙酮沉淀法制备粗酶液,体外进行酶解反应制备褐藻胶寡糖,对寡糖样品进行聚合度检测,降解寡糖的HPLC色谱如图7显示,根据标准品和出峰时间进行比对,样品的聚合度为dp2~dp5,其中dp2和dp3的含量较高,在11.5 min左右处出现包峰,其可能是较高聚合度的组分,在19 min左右出现的峰可能是单糖或Na2SO4峰。
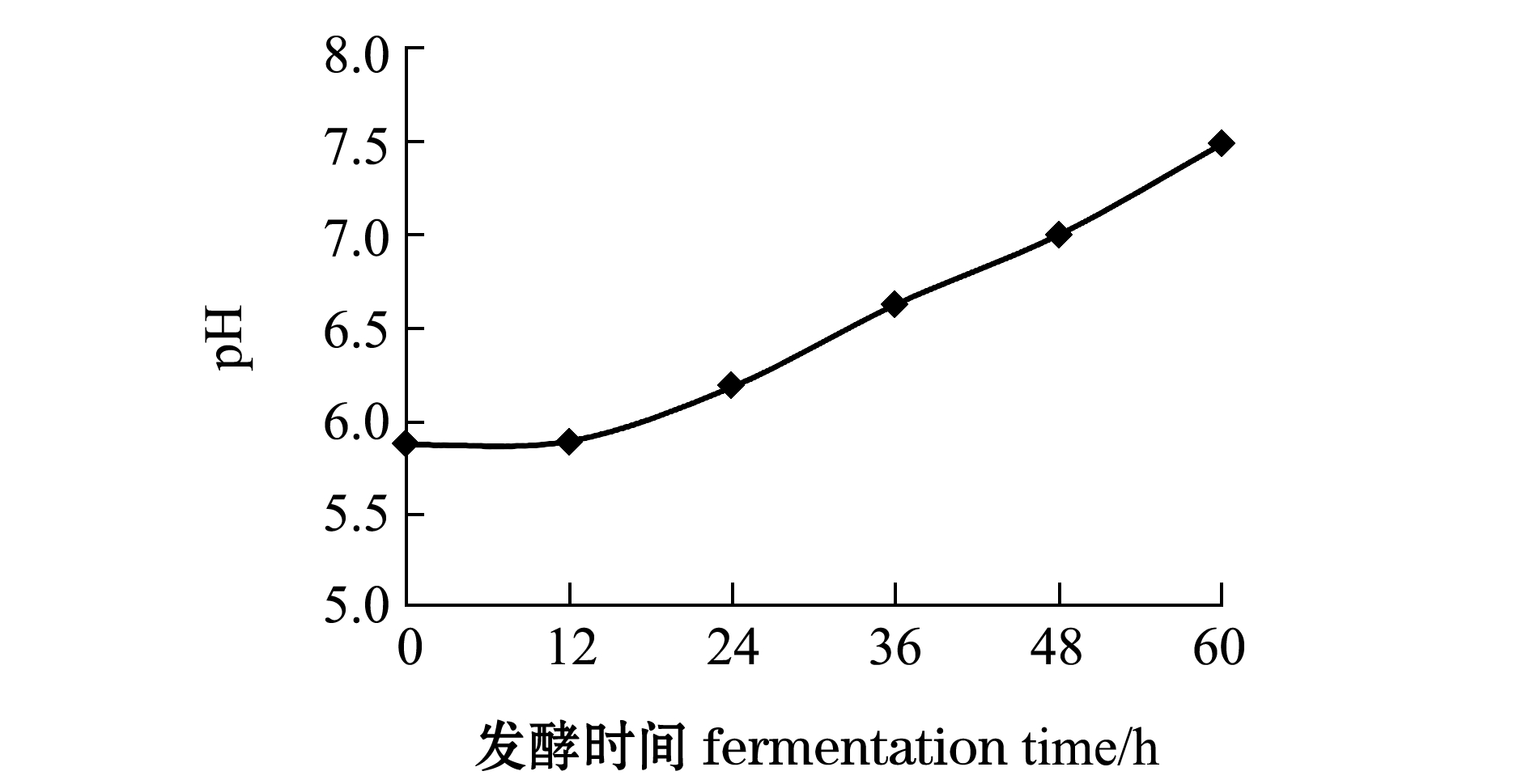
图6 10 L发酵罐AlgX2菌株发酵过程中pH的变化
Fig.6 Changes in pH during fermentation in a 10 L bioreactor

图7 HPLC聚合度检测图
Fig.7 HPLC degree of polymerization test
3 讨论
3.1 产酶菌株的筛选及10 L发酵罐中试生产
本研究中产酶菌株是从养殖场的海星内脏中筛选出一株产褐藻胶裂解酶菌株AlgX2。根据菌株形态、生理生化特征和16S rRNA基因序列分析,鉴定为盐单胞菌属Cobetia,命名为Cobetia AlgX2。目前,产褐藻胶裂解酶菌属主要有Vibrio[17-18]、Pseudoalteromonas tetraodoni[8]、Flavobacterium[19]等,用盐单胞菌属产褐藻胶裂解酶的应用较广泛,但其菌株主要初始来源为腐烂海带或者海水,而在海星内脏中较少筛选得到,刘旭梅等[20]以褐藻酸钠为唯一碳源,在腐烂的海带中筛选出一株产褐藻胶裂解酶菌株,经鉴定为Cobetia属,与本研究中筛选菌株的原始来源不同。陈艳红等[21]在褐藻胶裂解酶发酵中进行中试放大试验,当进行20 L发酵罐中试生产时,其酶活力只有小试生产的39.6%,而本研究中根据正交试验结果,在10 L发酵罐中进行中试放大产酶试验,使用的菌株通过实际发酵生产,其酶活力是摇瓶发酵菌株酶活的83.7%,与之相比,该菌株在实际发酵生产中酶活力稳定,表现出较高的发酵中试潜力,后续应优化工业参数,将该菌株应用于工业发酵生产。
3.2 降解寡糖结构分析
褐藻胶是来源于海带、马尾藻等褐藻细胞壁的填充物质,但因其分子量大、溶解度低、黏度高而使其应用受到限制。酶解法反应温和、专一性强,已成为制备褐藻胶寡糖的主要方法,而寻找高效降解效果的裂解酶已成为研究的热点。目前,关于产褐藻胶裂解酶菌株方面的研究主要集中在菌株筛选、鉴定和产酶条件优化等方面,而对由微生物产裂解酶制备的褐藻胶寡糖结构的报道较少,其中涉及的微生物菌属主要有弧菌属Vibrio[18]、Halomonas[14]等,而用Cobetia菌属制备褐藻胶寡糖并对其结构进行研究则是首次报道。本研究中主要利用10 L发酵罐生产发酵液,根据丙酮沉淀法制备粗酶液,体外进行酶解反应制备褐藻胶寡糖,经过TLC初步分析降解产物主要是由低聚合物组成(该数据本研究中未列出),用HPLC进行结构分析显示,酶解反应产物的聚合度为dp2~dp5,其中,dp2和dp3的含量较高(图7),与Sim等[22]制备的褐藻胶寡糖相比聚合度更低。
综上所述,与传统使用工业化酶制备褐藻胶寡糖相比,使用微生物法制备褐藻胶寡糖成本较低、方法简单,且可广泛应用于大批量生产,后续还可进行寡糖与粗酶的分离纯化、褐藻胶寡糖生理活性等方面的研究。由此可见,该菌株在制备褐藻胶低聚糖方面具有潜在的应用价值。
[1] Haug A,Larsen B,Smidsrød O.A study of the constitution of alginic acid by partial acid hydrolysis[J].Acta Chemica Scandinavica,1966,20:183-190.
[2] 韩伟,林娟,谢勇,等.褐藻胶裂解酶基因的克隆表达及重组酶酶学性质[J].微生物学通报,2017,44(5):1074-1080.
[3] 张玉娟,罗福文,姚子昂,等.海藻酸钠寡糖生物活性的研究进展[J].中国酿造,2014,33(1):5-8.
[4] Yamamoto Y,Kurachi M,Yamaguchi K,et al.Induction of multiple cytokine secretion from RAW264.7 cells by alginate oligosaccharides[J].Bioscience,Biotechnology,and Biochemistry,2007,71(1):238-241.
[5] Iwasaki K I,Matsubara Y.Purification of alginate oligosaccharides with root growth-promoting activity toward lettuce[J].Bioscience,Biotechnology,and Biochemistry,2000,64(5):1067-1070.
[6] 刘瑞志.褐藻寡糖促进植物生长与抗逆效应机理研究[D].青岛:中国海洋大学,2009.
[7] 邰宏博,唐丽薇,陈带娣,等.褐藻胶寡糖制备的研究进展[J].生命科学研究,2015,19(1):75-79.
[8] 汤海青,欧昌荣,郑晓冬.1株产褐藻胶裂解酶海洋细菌的分离鉴定及其酶学性质[J].浙江大学学报:农业与生命科学版,2013,39(4):387-395.
[9] Rahman M M,Wang Ling,Inoue A,et al.cDNA cloning and bacterial expression of a PL-14 alginate lyase from a herbivorous marine snail Littorina brevicula[J].Carbohydrate Research,2012,360:69-77.
[10] Huang Lishuxin,Zhou Jungang,Li Xiao,et al.Characterization of a new alginate lyase from newly isolated Flavobacterium sp. S20[J].Journal of Industrial Microbiology & Biotechnology,2013,40(1):113-122.
[11] Gacesa P,Wusteman F S.Plate assay for simultaneous detection of alginate lyases and determination of substrate specificity[J].Applied & Environmental Microbiology,1990,56(7):2265-2267.
[12] 陈朋,朱玥明,韩文佳,等.产褐藻胶裂解酶菌种的筛选、鉴定及发酵条件优化[J].食品科学,2015,36(15):105-111.
[13] Zhou Jiushun,Cai Menghao,Jiang Tao,et al.Mixed carbon source control strategy for enhancing alginate lyase production by marine Vibrio sp. QY102[J].Bioprocess and Biosystems Engineering,2014,37(3):575-584.
[14] 李恒,朱思婷,刘旭梅,等.褐藻胶裂解酶产生菌的分离鉴定及产酶发酵优化[J].中国生物工程杂志,2014,34(9):94-101.
[15] 东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[16] Li Changqing,Liu Wenchao,Zhu Ping,et al.Phylogenetic diversity of bacteria associated with the marine sponge Gelliodes carnosa collected from the Hainan island coastal waters of the South China Sea[J].Microbial Ecology,2011,62(4):800-812.
[17] 李云涛,汪立平,张孟,等.鲍鱼来源褐藻胶裂解酶菌株的筛选及发酵条件优化[J].大连海洋大学学报,2017,32(5):574-583.
[18] 张真庆.褐藻胶酶解寡糖的制备、分离和结构鉴定[D].青岛:中国海洋大学,2003.
[19] 黄李淑馨,刘钢,岳敏,等.产褐藻胶裂解酶菌株的分离与鉴定[J].食品工业科技,2013,34(23):147-151.
[20] 刘旭梅,李恒,蒋敏,等.产褐藻胶裂解酶菌株Cobetia sp. WG-007的筛选及发酵优化[J].食品与生物技术学报,2014,33(9):903-909.
[21] 陈艳红,杨帆,肖安风,等. 大[J].集美大学学报:自然科学版,2016,21(3):184-190.
[22] Sim S J,Baik K S,Park S C,et al.Characterization of alginate lyase gene using a metagenomic library constructed from the gut microflora of abalone[J].Journal of Industrial Microbiology & Biotechnology,2012,39(4):585-593.