海洋藻类资源丰富,主要分为红藻、绿藻、褐藻及微藻。由于微藻种类多、数量大、分布范围广,在整个海洋生态系统中发挥着积极作用[1]。对微藻药用活性研究发现,从微藻中提取的多糖具有抗氧化[2]、抗癌[3]、抑菌[4]、降血脂[5]、抗肿瘤等生物学活性。微藻因富含多不饱和脂肪酸、优质蛋白质、多糖、无机盐等组分,已被广泛应用于医药保健、化妆品及农业等诸多领域[6]。
裂殖壶菌Schizochytrium sp.又名裂壶藻,隶属于破囊壶菌科,含有丰富的二十二碳六烯酸(DHA)是一种单细胞、球形的海洋真菌[7]。从裂殖壶菌中提取的多糖具有抗氧化、抑菌、降血脂、抗肿瘤等生物学活性,裂殖壶菌在异养方式下培养,生长速度快。朱婧瑶等[8]研究发现,裂殖壶菌含有大量的脂质,约占细胞干质量的55%,且多为不饱和脂肪酸。除此之外,裂殖壶菌中含有的DHA作为一种人体所必需的多不饱和脂肪酸,具有较大的开发潜力。裂殖壶菌因生长不受季节的影响,具有对环境无污染、营养成分稳定等诸多优点,已成为发酵生产DHA的理想菌种。但是,利用裂殖壶菌发酵生产DHA油脂过程中,存在培养基盐离子浓度高、DHA含量偏低、生产成本过高等问题,从而影响该产业的发展。目前,对裂殖壶菌的研究主要集中在DHA的提取分离及提取的多糖活性探索方面,对裂殖壶菌其他营养成分的分析及应用鲜有报道。为此,本研究中分析了裂殖壶菌的脂质组成、元素组成、单糖组成及多糖初级结构,旨在为裂殖壶菌的开发利用提供参考。
1 材料与方法
1.1 材料
试验菌:裂殖壶菌藻粉购自山东滨州无棣绿奇生物工程有限公司。
试验试剂:单糖标准品(Man、Rha、Glu-UA、Gal-UA、Glu、Gal、Xyl、Fuc)购于美国Sigma公司;金属离子标准品(Ca、Fe、Na、Cu、Mn、Mg、K、Zn、Al、Se、Cr、As、Hg、Pb)购于美国Sigma公司;正己烷、异辛烷、三氟化硼-乙醚均为色谱纯;盐酸、浓硫酸、氯仿、氢氧化钠、硝酸、高氯酸、苯酚、三氟乙酸、山梨醇、氯化钡、溴化钾均为分析纯。
试验仪器:721型分光光度计(上海分析仪器总厂);TL5R型立式低速冷冻离心机(湖南赫西仪器设备有限公司);GC-2014C气相色谱仪(GC)(日本岛津公司);PerkinElmer Optima 8000等离子体发射光谱仪(ICP)(上海珀金埃尓企业管理有限公司);1260型高效液相色谱仪(HPLC)(美国Agilent公司);Nicolet-470型红外光谱仪(FTIR)(美国Nicolet公司)。
1.2 方法
1.2.1 裂壶藻基本成分的测定 取适量干燥的裂殖壶菌藻粉,于105 ℃下常压干燥,分别采用重量法、灼烧法、凯氏定氮法和氯仿-甲醇法测定水分、灰分、蛋白质和粗脂肪含量(上述试验均设3组平行样)。
1.2.2 金属元素含量的测定 参考王晓晴等[9]的试验方法,略做修改。取干燥藻粉0.25 g(设3组平行)于石英锥形瓶中,在通风橱中每管各加入8 mL浓硝酸和2 mL高氯酸,摇匀。置于电热炉(加石棉网)上缓慢加热至无色透明,冷却至室温后加10 mL超纯水,继续加热蒸发至干后用5%硝酸定容至50 mL。经硝化后,使用等离子体发射光谱仪(ICP)测定其原子吸收吸光度值, 以浓度值C (μg/mL)为横坐标,吸光度值A为纵坐标绘制校准曲线。
1.2.3 脂质脂肪酸组成分析 脂肪酸甲酯化参考国标GB/T 17377—2008[10]与朱路英等[11]的试验方法。分析条件:OV-17毛细管柱(30 m×0.32 mm×0.25 μm),FID-2014氢焰离子化检测器,载气为氢气,流速为2 mL/min。程序方法:起始柱温为 50 ℃,以8 ℃/min的速度升至120 ℃保留1 min,然后以 6 ℃/min的速度升至180 ℃,保留1 min后以3 ℃/min升至250 ℃,保留25 min。进样口温度为 300 ℃,检测器温度为 300 ℃,进样量为1 μL(不分流进样)。根据归一化法进行脂肪酸组成分析。
1.2.4 总糖含量的测定 参考曹欢[12]的试验方法,并加以改进。取脱脂后的藻粉(设3组平行)用20倍体积蒸馏水溶解、搅拌,超声振荡30 min,于70 ℃水浴锅中搅拌提取3 h、3次,以4000 r/min离心15 min。合并上清液,旋蒸浓缩、95%乙醇醇沉(体积比为1∶3),以4000 r/min离心15 min,得粗多糖。采用苯酚硫酸法测定多糖含量[13]。称取25 mg D-半乳糖标准品,用去离子水定容至500 mL,分别吸取0、0.4、0.6、0.8、1.0、1.2、1.4、1.6、1.8、2.0 mL于25 mL比色管中,用去离子水补至2 mL,分别加入1 mL 6%苯酚溶液、5 mL浓硫酸,摇匀后静置30 min,在490 nm处测定吸光度。以标准糖浓度(μg/mL)为横坐标,吸光度为纵坐标,用去离子水组校零,绘制标准曲线。称取10 mg粗多糖定容至100 mL,吸取1 mL于比色管,按上述步骤,测定吸光度并计算多糖含量。
1.2.5 单糖组成分析 参考姜龙等[14]试验方法。分别取10 mg干燥恒重的8种单糖标准品,用去离子水定容至10 mL。取多糖粗品20 mg溶于1.5 mL超纯水中,溶胀过夜,加入1.5 mL 8 mol /L三氟乙酸(TFA) 溶液,摇匀放置于105 ℃下的烘箱中水解6 h,取出冷却至室温,用4 mol/L NaOH 溶液调至中性,离心取上清液备用,避光保存。单糖衍生化后,加入三氯甲烷震荡混匀,静置后去除有机相,反复萃取3次,通过0.45 μm水系膜后进行高效液相色谱分析(HPLC)。色谱柱为Agilent ZORBAX Eclipse XDB C-18 (5 μm,4.6 mm×250 mm),柱温为30 ℃,流动相A为15%乙腈+ 50 mmol/L的KH2PO4-NaOH缓冲液(pH 6.0),流动相B为40%乙腈+50 mmol/L 的KH2PO4-NaOH缓冲液(pH 6.0)。洗脱程序:0 min 100%A→9 min 92%A→35 min 80%A→45 min 75%A→55 min 100%A,流速为1 mL /min,检测波长为250 nm,进样体积为20 μL。
1.2.6 硫酸根含量的测定 用明胶-氯化钡法测定硫酸根含量[15]。称取0.1 g粗多糖(设3组平行)放入25 mL比色管中,加入2 mol/L HCl 10 mL,溶胀过夜,封管后放入105 ℃烘箱中5 h,取出冷却至室温,用2 g活性炭脱色,再用滤纸过滤水洗,将滤液和洗涤液合并,用5 mol/L NH4OH调节pH至7,定容至50 mL,待用。分别吸取0、0.1、0.3、0.5、0.7、0.9 mL 0.05% K2SO4溶液及0.5 mL样品稀释液于25 mL比色管中,分别用去离子水补至4 mL,再依次加入0.8 mL 6 mol/L HCl、4 mL 70%山梨醇和4 mL 20% BaCl2溶液,混匀,静置10 min,于470 nm处测定其吸光度,以硫酸根含量(μg/mL)为横坐标,吸光度A为纵坐标,用去离子水组校零,绘制标准曲线。
1.2.7 傅里叶红外光谱(FTIR)分析 参考Yu等[16]的试验方法。取2 mg干燥至恒重的粗多糖样品(设3组平行),加入适量的恒重溴化钾粉末并研磨均匀,压制成均匀透明的薄片,在4000~400 cm-1范围内扫描吸收光谱。
1.3 数据处理
所有数据均以平均值±标准差(mean±S.D.)表示,采用Excel 2013软件处理数据。
2 结果与分析
2.1 裂殖壶菌基本成分
经测定,裂殖壶菌样品水分含量为1.49%±0.08%,其他基本成分含量按干基计算,灰分含量为9.79%±0.65%,蛋白质含量为15.49%±0.32%,脂质含量为43.97%±3.24%。
2.2 裂殖壶菌金属离子元素含量
本研究中测定了裂殖壶菌样品中14种金属离子的含量,结果如表1所示。裂殖壶菌含有丰富的Mg、Ca、Na、Fe等元素,并含有少量的Cu、Mn、K、Zn、Al,但不含有稀有元素Se,也不含有Cd、As、Hg,但含有微量的Pb。
表1 裂殖壶菌元素含量分析
Tab.1 Analysis of elemental contents in the fungus Schizochytrium sp.
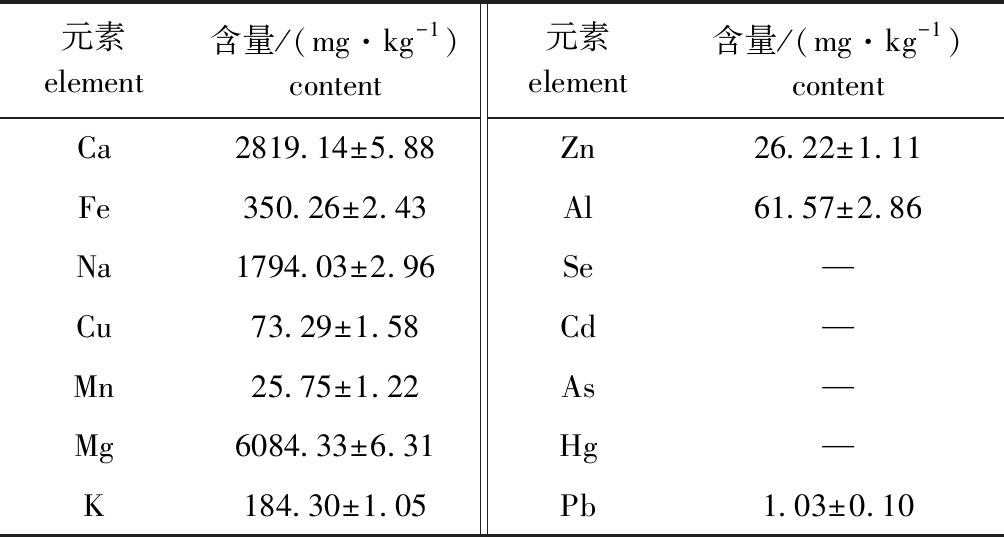
元素element含量/(mg·kg-1)content元素element含量/(mg·kg-1)contentCa2819.14±5.88Zn26.22±1.11Fe350.26±2.43Al61.57±2.86Na1794.03±2.96Se—Cu73.29±1.58Cd—Mn25.75±1.22As—Mg6084.33±6.31Hg—K184.30±1.05Pb1.03±0.10
2.3 脂质的脂肪酸组成
采用氯仿-甲醇法提取裂殖壶菌的脂质,提取率为43.97%±3.24%。裂殖壶菌脂肪中的脂肪酸GC分析图谱如图1所示,裂殖壶菌中含有丰富的C22:6n-3、C16:0、C22:5n-6。
从表2可见, DHA的保留时间为33.52 min,这与国标推荐出峰时间吻合,表明分析确实可信。通过面积归一法得到的DHA含量在总脂肪中的百分比最高,为49.84%。
2.4 多糖的提取分离及总糖含量
采用D-半乳糖作为标准物质绘制标准曲线,这是因为对裂殖壶菌单糖组分分析中发现,这种藻含有的单糖主要为半乳糖,另含有少量的木糖和岩藻糖,葡萄糖和鼠李糖含量过低可忽略不计[12]。裂殖壶菌的多糖提取率为2.13%±0.32%,通过标准曲线Y=0.0044 X-0.0032(r=0.9996)计算可知,总糖含量为49.81%±0.12%(表3)。
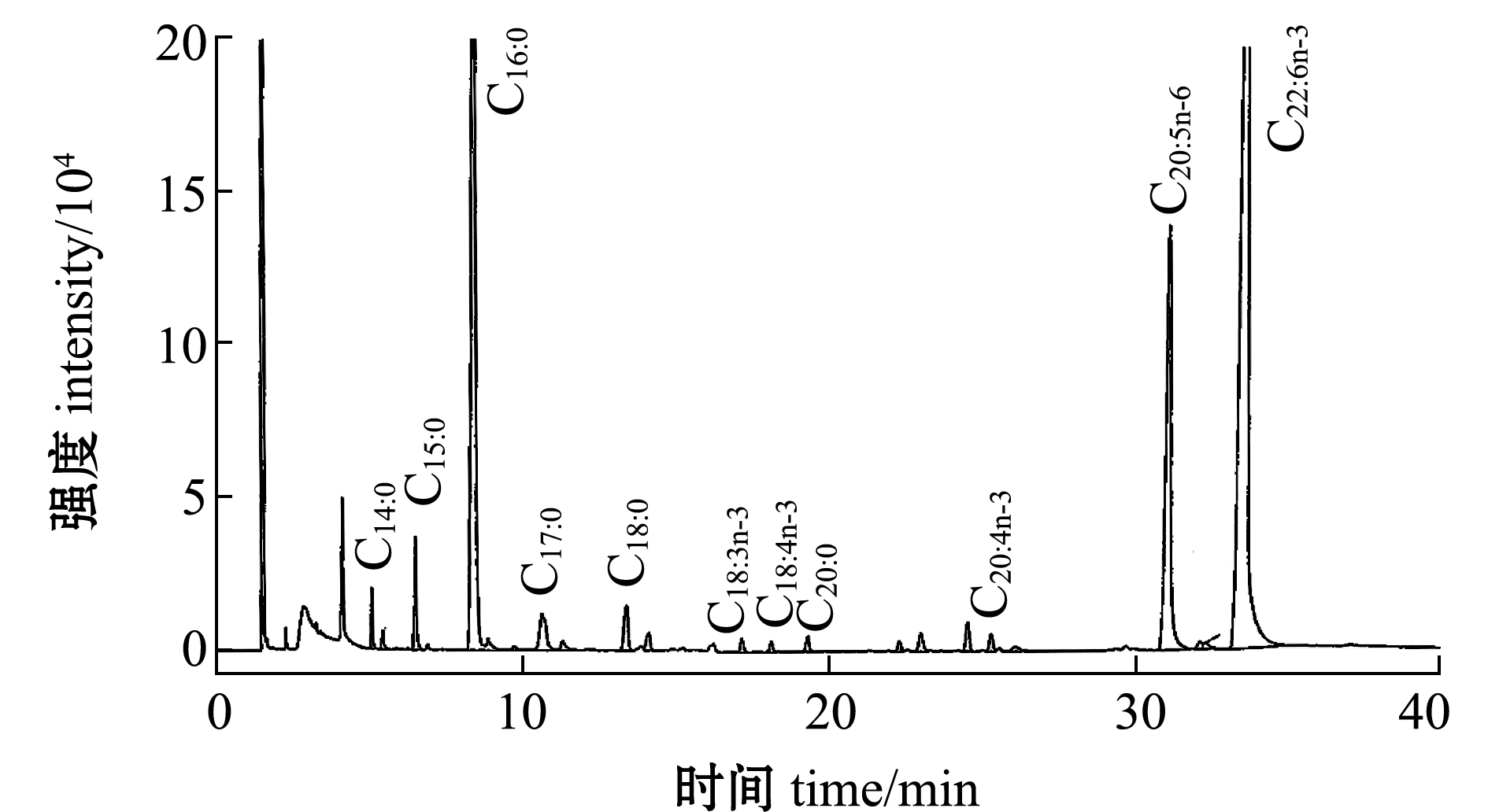
图1 脂肪酸组成分析气相色谱图
Fig.1 Gas chromatogram analysis of fatty acid composition
表2 裂殖壶菌的脂肪酸组成
Tab.2 Fatty acid composition of the fungus Schizochytrium sp.
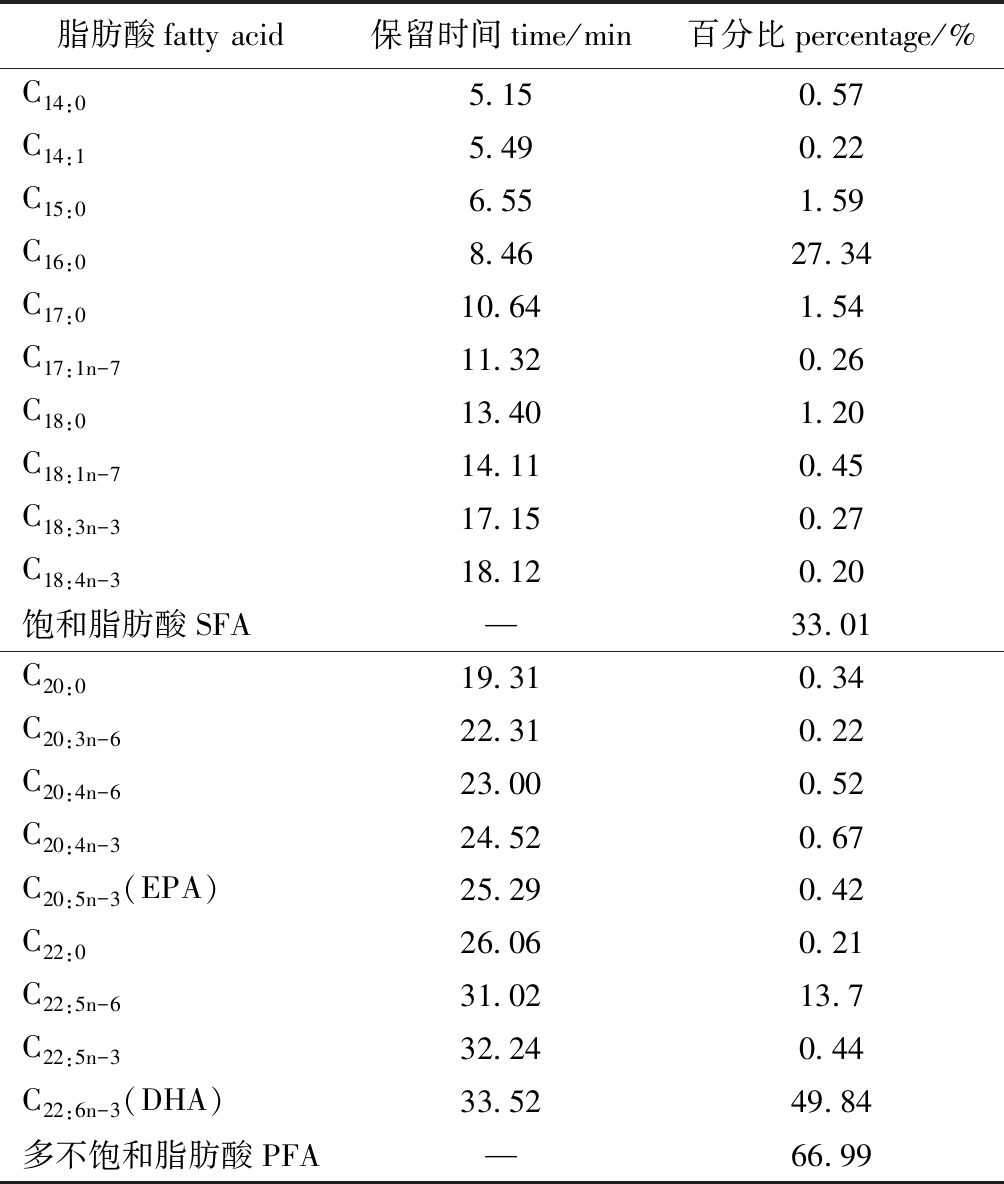
脂肪酸fatty acid保留时间time/min百分比percentage/%C14:05.150.57C14:15.490.22C15:06.551.59C16:08.4627.34C17:010.641.54C17:1n-711.320.26C18:013.401.20C18:1n-714.110.45C18:3n-317.150.27C18:4n-318.120.20饱和脂肪酸SFA—33.01C20:019.310.34C20:3n-622.310.22C20:4n-623.000.52C20:4n-324.520.67C20:5n-3(EPA)25.290.42C22:026.060.21C22:5n-631.0213.7C22:5n-332.240.44C22:6n-3(DHA)33.5249.84多不饱和脂肪酸PFA—66.99
2.5 单糖组成及硫酸基分析
单糖组成的高效液相色谱分析结果见表3和图2,通过比对各单糖标准品的出峰时间和峰面积,确定裂殖壶菌可溶性多糖的单糖构成及其相对含量。其中,含量最高的为半乳糖(56.84%),其次是甘露糖和鼠李糖及少量的葡萄糖、木糖。用明胶-硫酸钡法测得硫酸基含量为4.76%±1.39%。
表3 单糖含量及理化性质分析
Tab.3 Analysis of content and physicochemical properties of monosaccharide %

单糖组成及含量monosaccharide composition and contentManRhaGluGalXyl得率yield总糖含量carbohydrate content硫酸根含量sulphate content18.5812.796.0156.845.782.13±0.3249.81±0.124.76±1.39
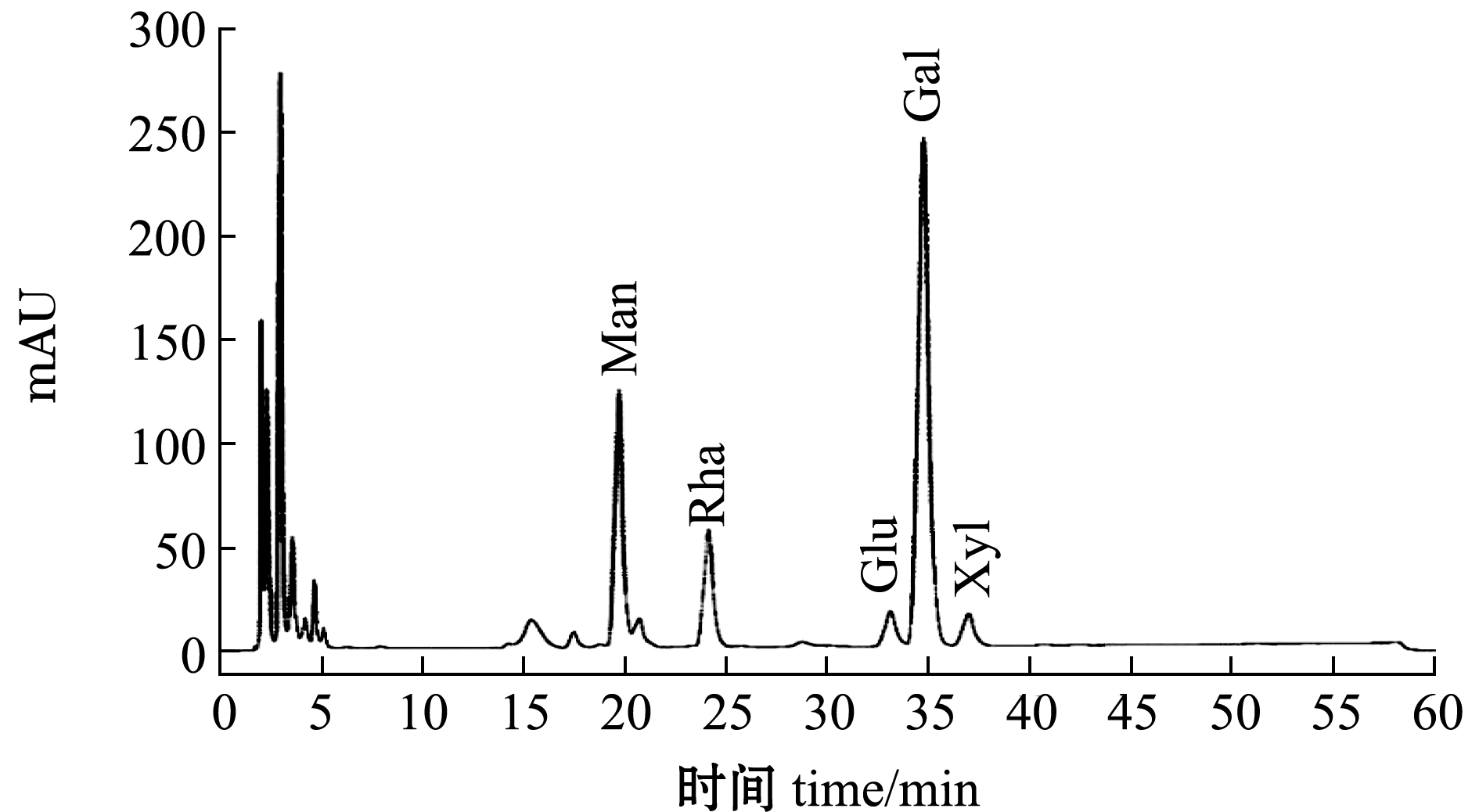
图2 多糖的高效液相色谱图
Fig.2 The HPLC of polysaccharide
2.6 红外光谱(IR)分析
在4000~400 cm-1红外波数范围内扫描裂殖壶菌多糖。从图3可见:在3380 cm-1左右出现强吸收峰,这是多糖结构中共有的O-H键伸缩振动,2933 cm-1左右为糖环中C-H伸缩振动吸收峰,1649 cm-1处出现糖环中酰胺基N-H变角振动吸收峰;此外,在1404 cm-1处出现较强的C-H 变角振动吸收峰,在1244 cm-1附近有含硫酸基的S=O伸缩振动峰,在780 cm-1附近为半乳糖的C6位C-O-S伸缩振动吸收峰。而在1700 cm-1左右未出现特征吸收峰,表明其不含有糖醛酸,该结果与图2及硫酸基含量测定结果一致。
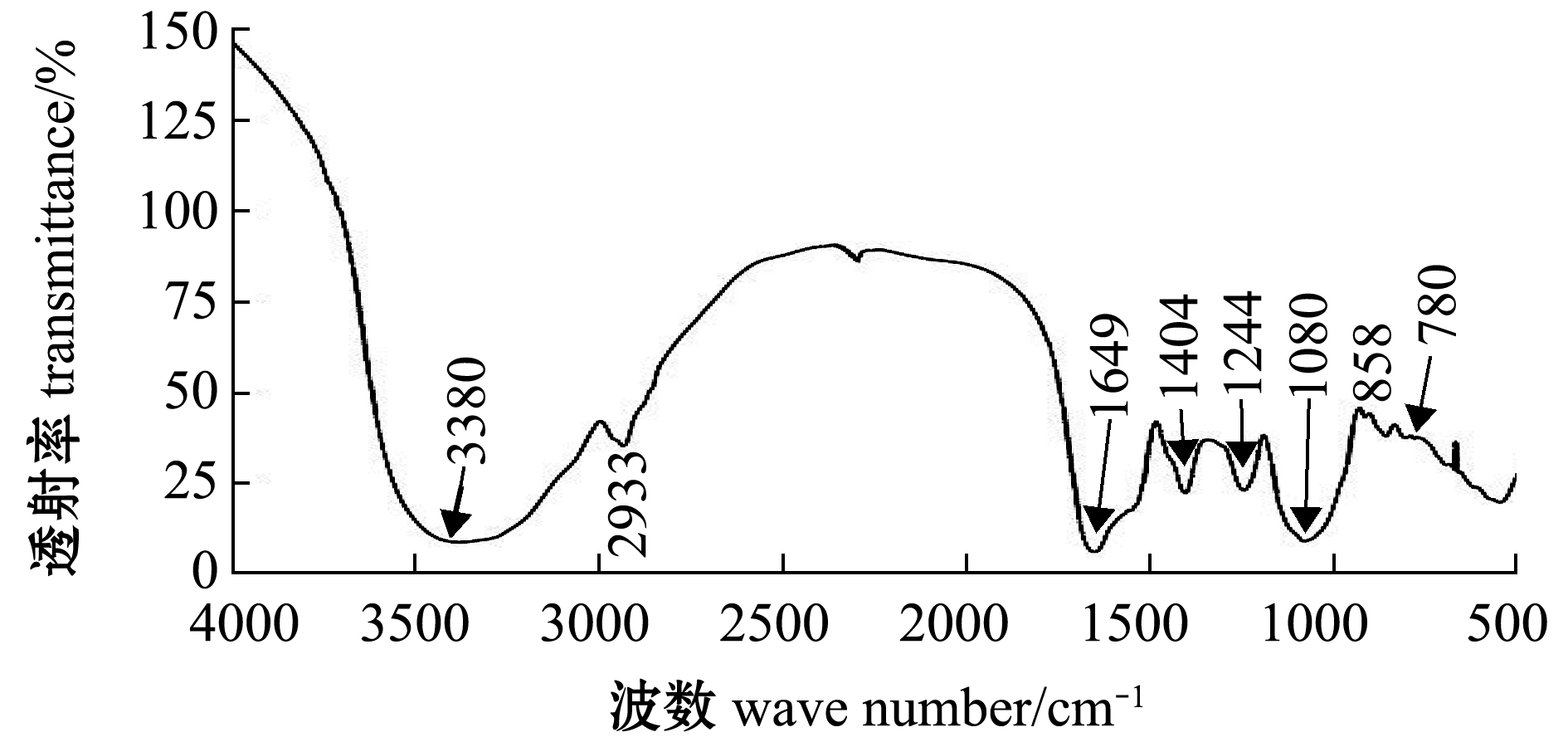
图3 多糖的红外光谱图
Fig.3 IR spectra of polysaccharide
3 讨论
3.1 裂殖壶菌的基本成分
朱路英等[11]的研究指出,裂殖壶菌中灰分含量为4.85%,蛋白质为9.35%,脂质为42.83%,与此相比,本研究中测得的裂殖壶菌脂质含量(43.97%)相近,而灰分(9.79%)与蛋白质含量(15.49%)的测定结果有差异,这可能是因为不同试验所用的裂殖壶菌藻粉产地与培育环境不同,也可能是裂殖壶菌藻粉的收获季节不同。Moroney等[17]研究表明,海洋藻类的营养组分含量及活性会随着季节的变化而不同,并且差异明显。关于水分含量的测定少有报道,这可能是因为干制的裂殖壶菌藻粉易于吸湿受潮,且水分监测对后续的研究并无显著影响。
3.2 脂质的脂肪酸组分分析
本研究中,采取氯仿-甲醇法提取裂殖壶菌的脂质提取率为43.97%±3.24%。朱路英等[11]研究表明,在以氮源为豆粕水解物的条件下培养的裂殖壶菌,其细胞内主要成分为脂类,其含量达42.83%,与本研究结果类似。本研究中用GC法分析裂殖壶菌脂肪中的脂肪酸,得出DHA含量为49.84%,与付杰等[18]的研究结果相似。付杰等[18]研究表明,提取的裂殖壶菌油脂中DHA含量最高,且出峰时间会随着脂肪酸的碳链长度及脂肪酸的极性发生规律性变化。
3.3 裂殖壶菌多糖结构的红外光谱分析
曹欢等[19]通过红外光谱分析了裂殖壶菌多糖的结构,在3400 cm-1处出现多糖特征吸收峰,在2900 cm-1处出现糖环中C-H伸缩振动吸收峰,在1650 cm-1处出现糖环中O-H的弯曲振动及残余蛋白酰胺键(CO-NH)中羧基吸收峰,在1234 cm-1处出现硫酸基S=O伸缩振动峰,在806 cm-1处出现半乳糖C6位C-O-S伸缩振动吸收峰。本研究中,红外光谱测定结果与曹欢等的研究结果类似。
综上所述,裂殖壶菌中含有的DHA作为一种人体所必需的多不饱和脂肪酸,具有较大的开发潜力。此外,国外根据混合油脂中脂肪酸沸点的不同,直接分离提取DHA的技术已经走在研发前列;国内如何在分离提取技术上取得创新,如何提升设备的自动化、一体化程度等方面需要取得突破。至于企业及生产者,应当适当关注利用裂殖壶菌中优质DHA研发出提供给特殊人群的功能性食品及保健品,以进一步挖掘新资源食品的发展潜力。
[1] 李斯.海洋微藻的分类方法学研究[D].青岛:中国海洋大学,2012.
[2] 杨贤庆,吕军伟,林婉玲,等.DHA功能特性以及抗氧化性研究进展[C]//2013年环北部湾高校研究生海洋论坛论文集.湛江:广东海洋大学,海南大学,广西大学,2013.
[3] Habermann N,Schön A,Lund E K,et al.Fish fatty acids alter markers of apoptosis in colorectal adenoma and adenocarcinoma cell lines but fish consumption has no impact on apoptosis-induction ex vivo[J].Apoptosis,2010,15(5):621-630.
[4] Kang S M,Kim K N,Lee S H,et al.Anti-inflammatory activity of polysaccharide purified from AMG-assistant extract of Ecklonia cava in LPS-stimulated RAW 264.7 macrophages[J].Carbohydrate Polymers,2011,85(1):80-85.
[5] Jung H A,Jung H J,Jeong H Y,et al.Phlorotannins isolated from the edible brown alga Ecklonia stolonifera exert anti-adipogenic activity on 3T3-L1 adipocytes by downregulating C/EBPα and PPARγ[J].Fitoterapia,2014,92:260-269.
[6] 曾娟,刘海燕,顾继锐,等.裂殖壶藻在水产养殖中的应用[J].中国饲料,2015(13):27-28,37.
[7] Yaguchi T,Tanaka S,Yokochi T,et al.Production of high yields of docosahexaenoic acid by Schizochytrium sp. strain SR21[J].Journal of the American Oil Chemists’ Society,1997,74(11):1431-1434.
[8] 朱婧瑶,张红漫,胡耀池,等.面向工业化的裂殖壶菌DHA油脂提取方法研究[J].食品科技,2011,36(9):32-35.
[9] 王晓晴,王榆元,秦珠,等.8种海藻中7种金属元素含量的测定[J].光谱实验室,2011,28(4):1759-1762.
[10] 国家粮食局.GB/T 17377-2008 动植物油脂脂肪酸甲酯的气相色谱分析[S].北京:中国标准出版社,2009.
[11] 朱路英,张学成,王淑芳,等.一种海洋真菌—裂殖壶菌的营养成分分析[J].食品科学,2009,30(24):272-275.
[12] 曹欢.一种裂壶藻(S.limacinum)和两种硅藻多糖的提取分离、结构表征及抗凝活性研究[D].青岛:中国海洋大学,2012.
[13] 郭峰君,胡靖,赵雪.海带岩藻聚糖硫酸酯降解及基本结构分析[J].食品工业科技,2014,35(18):93-97.
[14] 姜龙,宋悦凡,罗宣,等.树皮藻岩藻聚糖硫酸酯的纯化及其化学结构研究[J].大连海洋大学学报,2017,32(1):73-78.
[15] 彭雍博,宋悦凡,武龙,等.厚叶海带岩藻聚糖硫酸酯分离纯化及其体外肿瘤抑制活性研究[J].食品工业科技,2017,38(17):283-287.
[16] Yu Guangli,Yang Bo,Ren Weina,et al.A comparative analysis of four kinds of polysaccharides purified from Furcellaria lumbricalis[J].Journal of Ocean University of China,2007,6(1):16-20.
[17] Moroney N C O,Grady M N O,Doherty J V,et al.Effect of a brown seaweed (Laminaria digitata) extract containing laminarin and fucoidan on the quality and shelf-life of fresh and cooked minced pork patties[J].Meat Science,2013,94(3):304-311.
[18] 付杰,柳梦,田华,等.裂壶藻产DHA藻油中脂肪酸的不同甲酯化方法与GC-MS分析[C]//中国粮油学会油脂分会学术年会暨产品展示会,2016.
[19] 曹欢,王培培,吴建东,等.裂壶藻(Schizochytrium limacinum)多糖的提取分离及其结构特性[J].中国海洋药物,2011(6):1-5.