水生植被是湖泊生态系统的重要组成部分[1],作为主要初级生产者之一,水生植物不仅为鱼类、鸟类、无脊椎动物等提供饵料、活动场所和繁殖场所,更在维持健康湖泊生态系统中起着关键作用,对维护生态系统的结构和功能、改善水环境等具有重要作用[2-4]。菹草Potamogeton crispus是全世界分布最广、最为常见的沉水植物,也是少数在冬季保持较高生物量的反季节沉水植物之一[5],对于维持冬季水生生态系统的健康稳定具有重要作用。
在沉水植物茎叶表面通常存在一个由藻类、有机质、泥沙和细菌等组成的附着物层[6],这些附着物不仅与宿主间存在营养物质交流[7-8],还可通过遮光效应抑制宿主光合作用[9-11],在水体营养盐浓度足够高时,过量生长的附着物层甚至能导致水生植物死亡[11-12]。目前,已有研究均是在水温较高的季节进行的,对于低温情况下水生植物的生理生态研究较少[13],尤其对于附着物在低温条件下的沉水植物生长过程中的作用方面研究非常缺乏。
鉴于冬季生长的水生植物对维持良好水生生态系统具有重要意义[14-15],本研究中基于野外原位试验探索了在低温环境下附着物的去除对菹草叶片光合效率的影响,用以补充对低温环境下水生植物生理状态方面研究的空缺,旨在为湖泊水生植被管理提供理论依据。
1 材料与方法
1.1 试验地点
试验时间为2016年1月14日—19日,天气状况如表1所示。试验地点位于中国水产科学研究院淡水渔业研究中心附近的一个静水池塘里(31°25′36.03″N、120°16′48.93″E),该水塘毗邻太湖的贡湖湾北岸,与长广溪相连,面积约为2300 m2,平均水深为1.5 m,冬季仅生长菹草一种水生植物,盖度超过90%。测量时间为1月14日,测得的水体理化因子:透明度为85 cm,浊度为0.41 NTU,pH为6.97,DO为9.06 mg/L,TN为1.52 mg/L,TP为0.04 mg/L。TN和TP通过常规方法测量[16],其他参数通过便携式仪器现场测量。测得的菹草生物量为1.83 kg/m2,附着物生物量为0.048 g/g(鲜质量),0.251 g/g(干质量)。
1.2 方法
试验设置单次试验和连续多日试验,分别调查附着物去除后植物的光合能力变化和连续5 d的恢复情况。
表1 试验期间天气情况
Tab.1 Weather conditions during the experiment
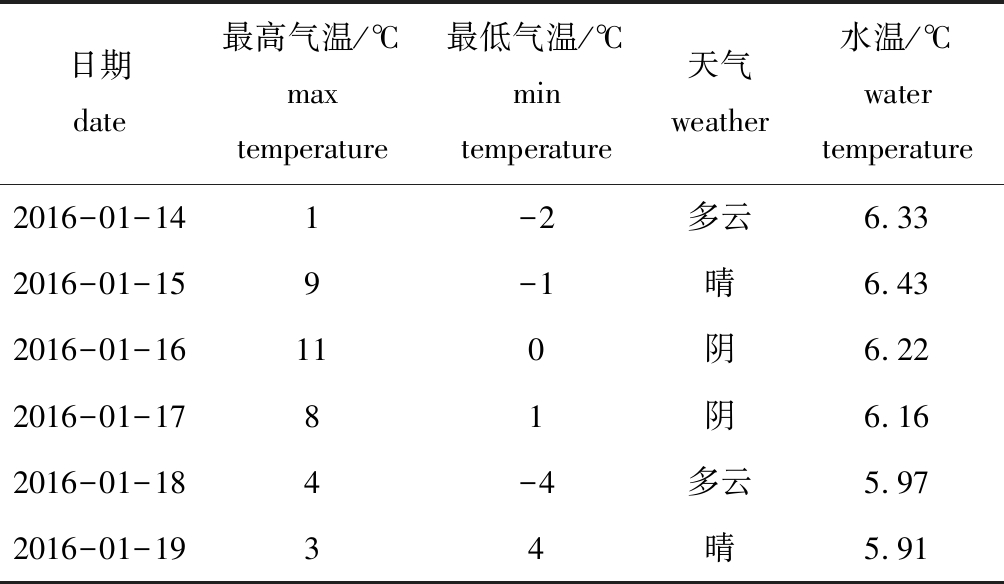
日期 date最高气温/℃ max temperature最低气温/℃min temperature天气 weather水温/℃ water temperature2016-01-14 1-2多云6.332016-01-159-1晴6.432016-01-16110阴6.222016-01-1781阴6.162016-01-184-4多云5.972016-01-1934晴5.91
1.2.1 单次试验 设置不同植株和同一植株两个单次试验,试验处理时间为2016年1月14日的上午9:00—10:00,参数测量时间为13:00—15:00。不同植株处理的操作为:在水体中随机选择15株健康菹草,用软毛刷去除所有叶片的附着物,测量水下5 cm处经处理后植株(一般为第3~5枚叶片,下同)的叶绿素荧光参数,同时,选择未刷去附着物的15株健康植株,测量水下5 cm处健康叶片的叶绿素荧光参数作为对照。同一植株处理操作为:在水体中选择15株健康菹草,小心刷洗掉水下5 cm处一枚叶片表面的附着物并做好标记,其他部分的附着物保留,测量该叶片的叶绿素荧光参数,无附着物为处理组,有附着物为对照组。
1.2.2 连续多日试验 试验处理时间为2016年1月15—19日,参数测量时间为每日的13:00—15:00。选择15株健康菹草,测量水下5 cm处一枚叶片的叶绿素荧光参数并做好标记,轻轻刷洗掉该叶片表面的附着物,整个过程尽量不对叶片造成伤害。1 h后测量处理叶片的叶绿素荧光指标,记为第1天,此后连续5 d测量各叶片相同位置的叶绿素荧光参数,每天另随机选择未作处理的15株健康菹草,测量水下5 cm处叶片的叶绿素荧光参数作为对照。
1.2.3 参数测量 植株的叶绿素荧光参数选择水下饱和脉冲荧光仪DIVING-PAM(德国WALZ公司)测量,测量指标包括最大光量子产量(Fv/Fm)和叶片快速光响应曲线,测量方法及换算参考文献[13,17]。由于未有足够的暗适应叶夹进行暗处理,本试验中在测量Fv/Fm值前,用不透光的黑色塑料膜在被测植株上层水面覆盖20 min,以模拟暗处理环境。测量快速光响应曲线时的光合有效辐射强度(PAR)分别为0、5、19、38、60、90、122、180、242 μmol/(m2·s),时间间隔为10 s,用多次测量所得的数据平均值绘制快速光响应曲线。
1.3 数据处理
试验结果用平均值±标准差(mean±S.D.,n=15)表示,采用SPSS 19.0软件对试验结果进行单因素方差分析(One-way ANOVA),显著性水平设为0.05,极显著性水平设为0.01。
2 结果与分析
2.1 附着物去除对菹草叶绿素荧光活性的影响
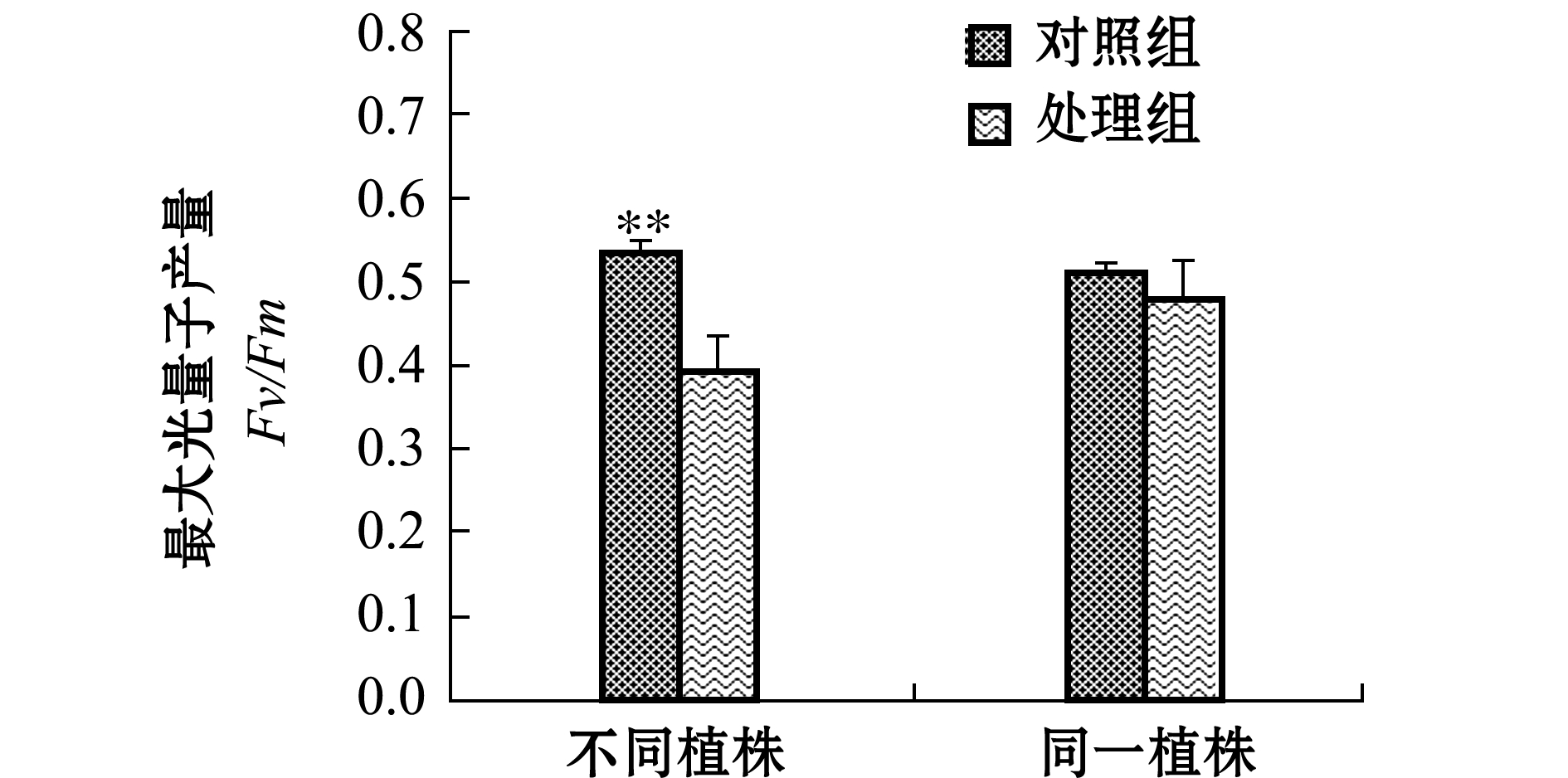
单次试验结果表明:不同植株对照组和处理组最大光量子产量(Fv/Fm)值分别为0.547±0.020和0.414±0.015;同一植株对照组和处理组Fv/Fm值分别为0.514±0.028和0.481±0.026(图1)。
方差分析结果显示,不同植株处理下的处理组和对照组间Fv/Fm值有极显著性差异(F=28.797,P<0.01),同一植株处理下的处理组平均值低于对照组,但无显著性差异(F=0.740, P>0.05)。
注:*表示与对照组有显著性差异(P<0.05);**表示与对照组有极显著性差异(P<0.01),下同
Note: *means significant difference compared with the control (P<0.05);**means very significant difference compared with the control(P<0.01), et sequentia
图1 附着物去除前后菹草叶片最大光量子产量变化
Fig.1 Variation in Fv/Fm on leaves of crisp pondweed Potamogeton crispus exposed to periphyton and after the periphyton removal
快速光响应曲线测量结果显示,相同的辐射光强下,同一植株和不同植株的处理组相对电子传递速率(rETR)总是低于对照组(图2)。
2.2 附着物去除后菹草叶绿素荧光活性变化
将菹草植株叶片的附着物去除后,连续5 d测量叶绿素荧光活性变化情况,结果如图3所示。最大光量子产量结果表明:附着物去除之前Fv/Fm的初始值为0.567±0.029,附着物去除的处理组在试验第1天稍有下降,为初始值的93.65%,从第2天开始锐减至初始值的 72.42%,此后一直维持在较低水平,第3~5天Fv/Fm值分别为初始值的72.87%、73.34%和79.68%。
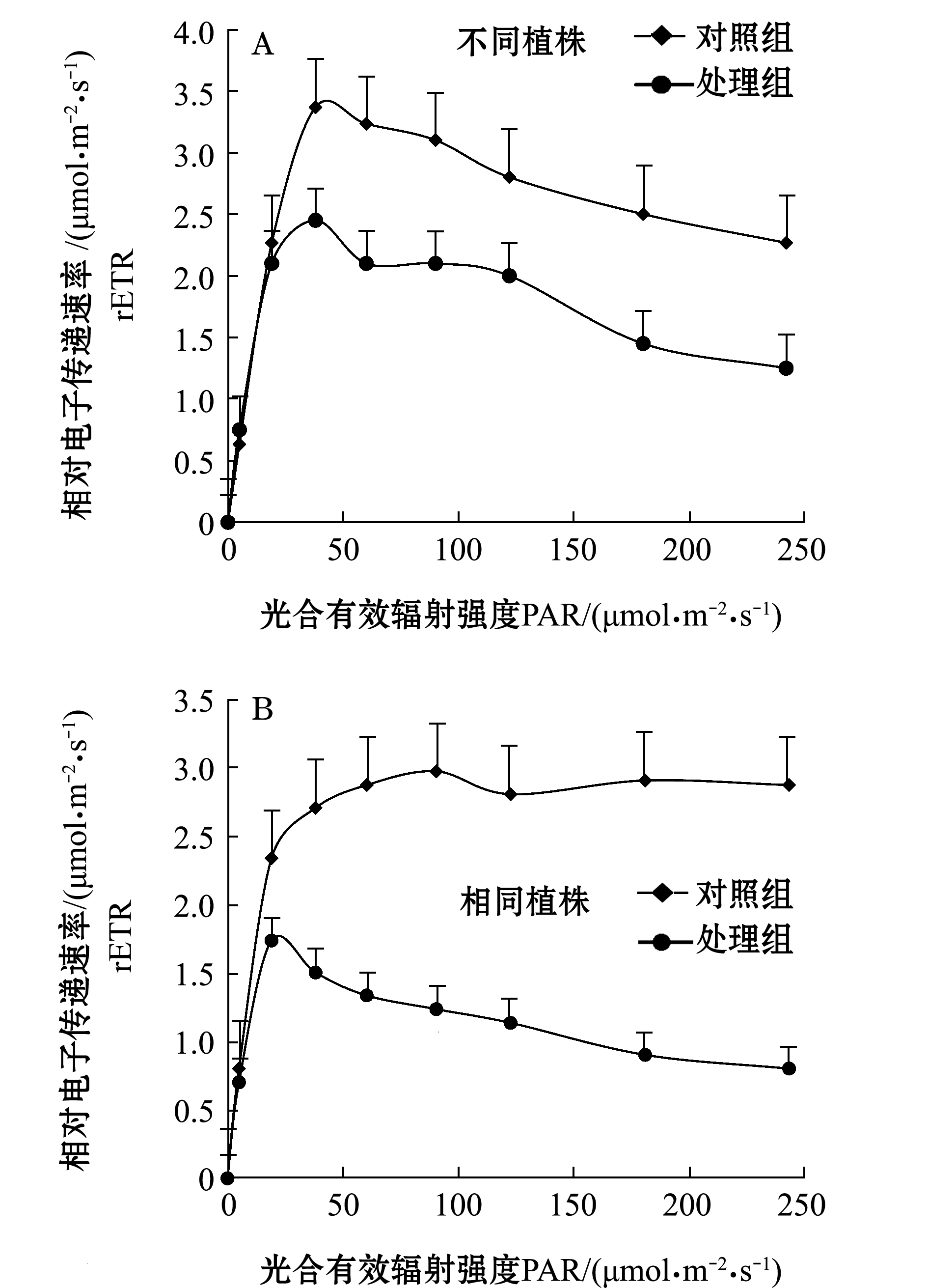
图2 附着物去除前后菹草叶片快速光响应曲线变化
Fig.2 Variation in RLC on leaves of crisp pondweed Potamogeton crispus exposed to periphyton and after the periphyton removal
对比处理组和对照组,从试验的第1天开始,对照组Fv/Fm值为0.531±0.017,处理组Fv/Fm值为0.514±0.032,处理组Fv/Fm值略低于对照组,但无显著性差异(P>0.05);在之后的几天试验中,处理组Fv/Fm值占对照组的比例分别为75.72%、84.09%、82.83%和78.54%,第3天和第4天处理组与对照组呈显著性差异(P<0.05),第2天和第5天处理组与对照组呈极显著性差异(P<0.01)(图3)。
运用单因素方差分析对不同时间点的rETR值进行显著差异分析。快速光响应曲线结果表明:在去除附着物后的第1天,快速光响应曲线呈现明显下降趋势,且在相同PAR下测得的rETR值总是显著低于对照组(P<0.05);在去除附着物后的第2天,在相同PAR下测得的rETR值已逐渐恢复至对照组水平(P>0.05);相较于第2天的rETR值,在第3天~第5天时植株的rETR值均有所下降,且低于对照组(P>0.05)(图4)。
对照组最大相对电子传递速率rETRmax为(2.97±0.33)μmol/(m2·s-1),去除附着物之后的第1天锐减至(1.73±0.15)μmol/(m2·s-1),第2天~第5天分别为(2.96±0.47)、(2.50±0.33)、(2.67±0.28)、(2.44±0.19)μmol/(m2·s)。
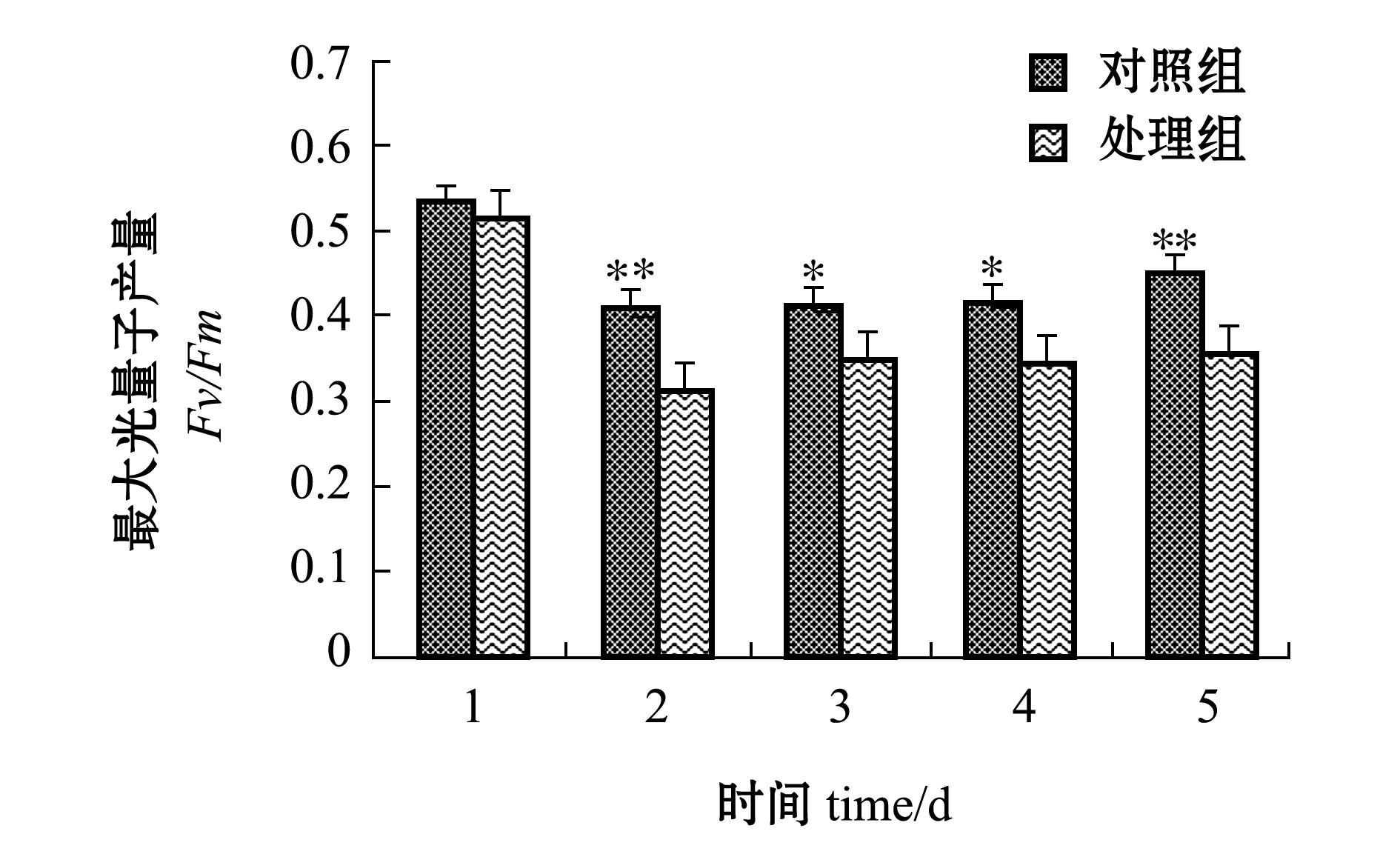
图3 附着物去除前后菹草叶片最大光量子产量连续5 d变化情况
Fig.3 Variation in Fv/Fm on leaves of crisp pondweed Potamogeton crispus exposed to periphyton and after the periphytonr emoval in successive five days
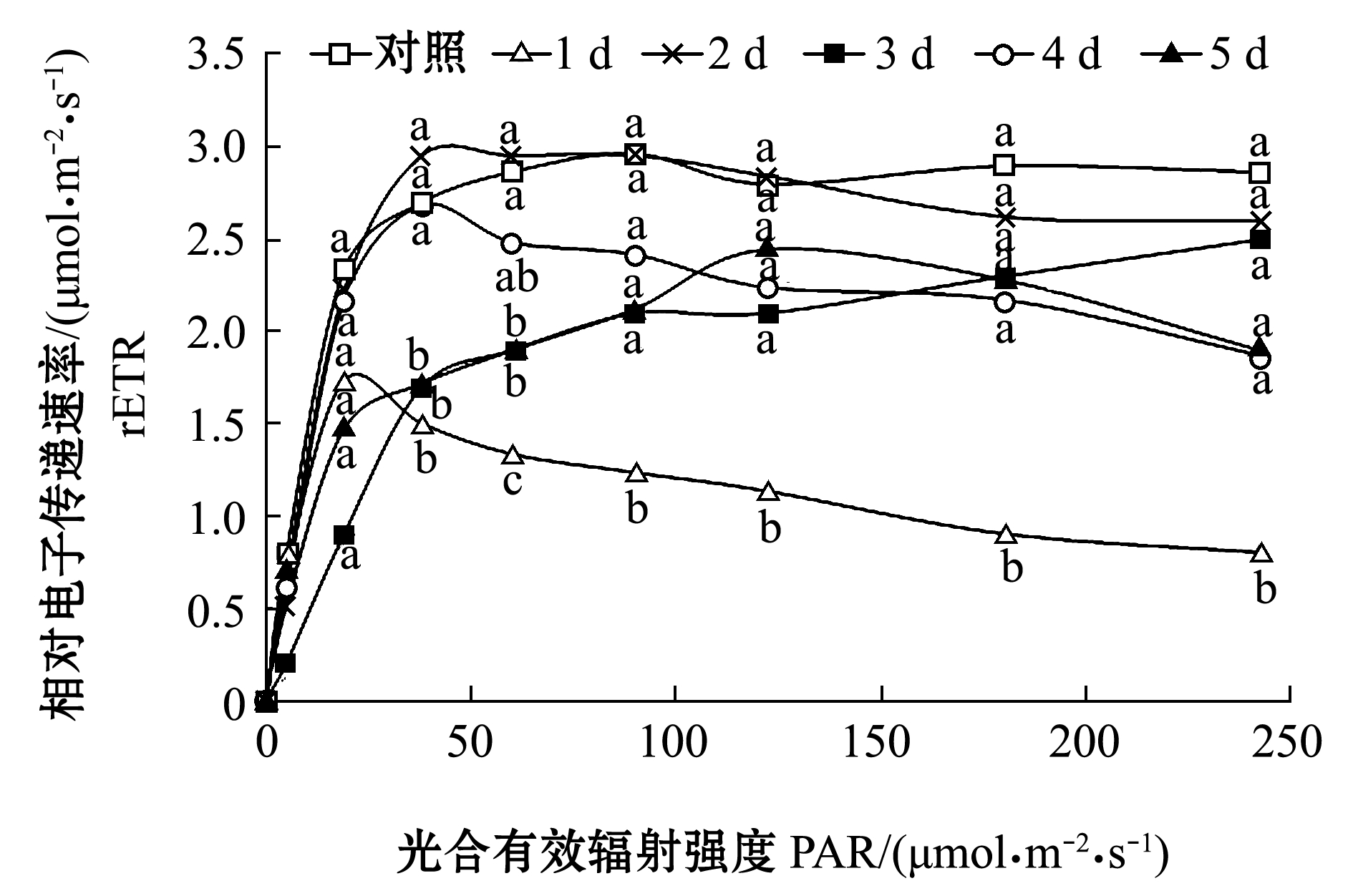
注:标有不同小写字母者表示同一辐射强度下不同时间组间有显著性差异(P<0.05),标有相同小写字母者表示组间无显著性差异(P>0.05)
Note:The means with different letters within the same radiation intensity are significant differences among the groups at the 0.05 probability level, and the means with the same letters are not significant differences among the groups
图4 附着物去除前后菹草叶片快速光响应曲线连续5 d变化情况
Fig.4 Variation in RLC on leaves of crisp pondweed Potamogeton crispus in continuously five days before and after the periphyton removal
3 讨论
3.1 低温环境和附着物对植物光合能力的影响
植物的光合能力是反映其生长状况的最佳指标之一,叶绿素荧光技术作为研究植物与环境关系的内在探针,具有测量快速、简便且对植株无损伤等特点[18],因而得到了广泛应用。本研究中选择植株在胁迫状况下的两个指标进行观察和研究,探索附着物在冬季菹草生长中的生理作用。Fv/Fm值是反映光系统Ⅱ(PSⅡ)原初光能转化效率或潜在光能转化效率的指标,一般不受物种影响,非胁迫条件下Fv/Fm值约为0.83,在胁迫条件下显著降低[19]。本研究结果表明,对照组Fv/Fm值为0.42~0.67,显著低于0.83,说明冬季低温条件对菹草的生长具有显著的胁迫作用。李强等[13]研究表明,菹草正常光合作用的临界温度可能为9~10 ℃,在夏季由于强光照与高温条件,菹草更易出现衰败和死亡,本研究中的水温条件为6 ℃左右,与已有研究结果一致。在附着物去除以后,Fv/Fm值进一步下降到0.33~0.54。本研究中,单次试验不同植株中的处理组和连续观察试验中处理组的Fv/Fm值均显著低于对照组,在低温环境中,附着物的去除加剧了低温对于菹草的影响。但同一植株处理组Fv/Fm值虽然低于对照组,但无显著性差异。不同植株处理组菹草茎叶表面所有的附着物全部被清除,植株几乎是完全暴露在低温环境中,而同一植株处理组中仅有一片叶片表面的附着物被清除。据此推测,附着物去除对菹草的胁迫作用可能不仅对叶片有影响,还对整个植株有影响。
3.2 水生植物对低温及附着物去除的适应性
快速光响应曲线测量的是叶片的电子传递速率对光合有效辐射的响应,反映的是植株对光照环境变化的适应能力,rETRmax可作为判断叶片适应能力的指标,即rETRmax值越大,植物叶片的适应能力越强[19]。本研究结果表明,在附着物去除后的第1天,叶片的rETRmax下降显著,但第2天后就迅速恢复了,这说明菹草叶片对附着物去除的适应能力强。对比Fv/Fm值结果来看,从第2天开始,处理组的Fv/Fm值一直显著低于对照组。即叶片恢复适应能力后,胁迫仍然存在。已有研究表明,低温能加剧植物的光抑制作用[20-21],在水温低于7 ℃时,菹草叶片PSⅡ结构受损,易发生光抑制现象[13]。本试验中的参数测量是在13:00以后进行的,这是一天中光照条件最好的时间,且所有测量叶片均位于水面附近。据此推测,附着物去除对植物的胁迫作用非常短暂,附着物去除后对叶片的遮光作用消失,水面附近光照条件良好时易发的光抑制作用才是今后应测得的胁迫作用的真实原因。
通常认为,沉水植物相对于其他植物而言,最大的不同在于其水下弱光环境[22]和无机碳的缺乏[23],水生植物被迫表现出阴生植物的特性[24-25],并降低光补偿点和光饱和点[26-27]。此外,沉水植物茎叶表面普遍存在的附着物也是其他植物不具备的环境特点,此类研究目前还较缺乏。已有研究表明,附着物在富营养化水体中,能通过遮光作用导致水生植物死亡[11-12],在植物衰亡期也能起到加剧植物衰亡的作用[28]。本研究表明,在冬季低温环境下,附着物的遮光作用对低温条件下菹草易发的光抑制现象是一种保护。这反映出附着物与沉水植物间的关系可能是复杂且有条件的,今后应进一步开展相关探究。
[1] Bornette G,Puijalon S.Response of aquatic plants to abiotic factors:a review[J].Aquatic Sciences,2011,73(1):1-14.
[2] Batzer D P,Palik B J.Variable response by aquatic invertebrates to experimental manipulations of leaf litter input into seasonal woodland ponds[J].Fundamental and Applied Limnology,2007,168(2):155-162.
[3] Kolada A.The use of aquatic vegetation in lake assessment:testing the sensitivity of macrophyte metrics to anthropogenic pressures and water quality[J].Hydrobiologia,2010,656(1):133-147.
[4] Kreiling R M,Richardson W B,Cavanaugh J C,et al.Summer nitrate uptake and denitrification in an upper Mississippi River backwater lake:the role of rooted aquatic vegetation[J].Biogeochemistry,2011,104(1-3):309-324.
[5] Pip E.The ecology of Potamogeton species in central North America[J].Hydrobiologia,1987,153(3):203-216.
[6] Vis C,Hudon C,Carignan R.Influence of the vertical structure of macrophyte stands on epiphyte community metabolism[J].Canadian Journal of Fisheries and Aquatic Sciences,2006,63(5):1014-1026.
[7] Neely R K,Wetzel R G.Simultaneous use of 14C and 3H to determine autotrophic production and bacterial protein production in periphyton[J].Microbial Ecology,1995,30(3):227-237.
[8] Sims A,Zhang Yanyan,Gajaraj S,et al.Toward the development of microbial indicators for wetland assessment[J].Water Research,2013,47(5):1711-1725.
[9] Aloi J E.A critical review of recent freshwater periphyton field methods[J].Canadian Journal of Fisheries and Aquatic Sciences,1990,47(3):656-670.
[10] Köhler J,Hacho J,Hilt S.Regulation of submersed macrophyte biomass in a temperate lowland river:interactions between shading by bank vegetation,epiphyton and water turbidity[J].Aquatic Botany,2010,92(2):129-136.
J,Hilt S.Regulation of submersed macrophyte biomass in a temperate lowland river:interactions between shading by bank vegetation,epiphyton and water turbidity[J].Aquatic Botany,2010,92(2):129-136.
[11] Phillips G L,Eminson D,Moss B.A mechanism to account for macrophyte decline in progressively eutrophicated freshwaters[J].Aquatic Botany,1978,4:103-126.
[12] Qin Baoqiang,Yang Liuyan,Chen Feizhou,et al.Mechanism and control of lake eutrophication[J].Chinese Science Bulletin,2006,51(19):2401-2412.
[13] 李强,王国祥.冬季降温对菹草叶片光合荧光特性的影响[J].生态环境,2008,17(5):1754-1758.
[14] 李文朝.富营养水体中常绿水生植被组建及净化效果研究[J].中国环境科学,1997,17(1):53-57.
[15] 李英杰,许秋瑾,金相灿,等.湖泊水生植被恢复物种选择及群落配置分析[J].环境污染治理技术与设备,2004,5(8):23-26.
[16] 国家环境保护总局.水和废水监测分析方法[M].4版.北京:中国环境科学出版社,2002:670-671.
[17] 吴晓东,王国祥,李振国,等.干旱胁迫对香蒲生长和叶绿素荧光参数的影响[J].生态与农村环境学报,2012,28(1):103-107.
[18] Küster A,Altenburger R.Development and validation of a new fluorescence-based bioassay for aquatic macrophyte species[J].Chemosphere,2007,67(1):194-201.
[19] 韩博平,韩志国,付翔.藻类光合作用机理与模型[M].北京:科学出版社,2003.
[20] Greer D H,Berry J A,Björkman O.Photoinhibition of photosynthesis in intact bean leaves:role of light and temperature,and requirement for chloroplast-protein synthesis during recovery[J].Planta,1986,168(2):253-260.
[21] Greer D H,Ottander C,Öqust G.Photoinhibition and recovery of photosynthesis in intact barley leaves at 5 and 20 ℃[J].Plant Physiology,1991,81(2):203-210.
[22] Küster A,Schaible R,Schubert H.Light acclimation of photosynthesis in three charophyte species[J].Aquatic Botany,2004,79(2):111-124.
[23] Madsen T V.Growth and photosynthetic acclimation by Ranunculus aquatilis L.in response to inorganic carbon availability[J].New Phytologist,1993,125(4):707-715.
[24] Bowes G,Salvucci M E.Plasticity in the photosynthetic carbon metabolism of submersed aquatic macrophytes[J].Aquatic Botany,1989,34(1-3):233-266.
[25] Van T K,Haller W T,Bowes G.Comparison of the photosynthetic characteristics of three submersed aquatic plants[J].Plant Physiology,1976,58(6):761-768.
[26] Lucas W J,Berry J A.Inorganic carbon transport in aquatic photosynthetic organisms[J].Physiologia Plantarum,1985,65(4):539-543.
[27] Duarte C M.Seagrass depth limits[J].Aquatic Botany,1991,40(4):363-377.
[28] 魏宏农,潘建林,赵凯,等.菹草附着物对营养盐浓度的响应及其与菹草衰亡的关系[J].生态学报,2013,33(24):7661-7666.