随着工厂化养殖的迅速发展,高密度养殖过程中的残饵、残骸和养殖生物产生的大量排泄物,经过氨化作用分解出铵态氮(包括![]() 和NH3-N,本文中统一用TAN表示),进而经亚硝化作用产生亚硝酸态氮(包括HNO2和
和NH3-N,本文中统一用TAN表示),进而经亚硝化作用产生亚硝酸态氮(包括HNO2和![]() 本文中统一用NO2-N表示),当NO2-N向硝酸态氮
本文中统一用NO2-N表示),当NO2-N向硝酸态氮![]() 的转化受阻时,NO2-N便会逐渐积累,对养殖生物产生毒害作用[1]。NO2-N已成为对海水养殖生物产生毒害作用的常见因子之一[2]。
的转化受阻时,NO2-N便会逐渐积累,对养殖生物产生毒害作用[1]。NO2-N已成为对海水养殖生物产生毒害作用的常见因子之一[2]。
目前,国内外关于NO2-N对水生动物毒性效应方面的研究多见于鱼[3-7]、虾[8-10]和蟹[11]等。有关NO2-N对贝类的毒性研究有日本海神蛤 Panopea japonica[12]、方斑东风螺Babylonia areolata[13]、管角螺Hemifusus tuba[14]和皱纹盘鲍Haliotis discus hannai等[15],关于NO2-N对虾夷扇贝Patinopecten yessoensis毒性的研究尚未见报道。生物早期发育阶段是对外环境最敏感的时期,此阶段对毒物的耐受能力对于确定其整个生活史的安全浓度具有重要的参考价值[2]。虾夷扇贝隶属于软体动物门、瓣鳃纲、异柱目、扇贝科、扇贝属,是一种冷水性贝类,其味道鲜美、营养丰富,是中国北方重要的海水养殖贝类之一。本研究中,选择从受精卵至变态成稚贝的虾夷扇贝生活史早期阶段,在实验室条件下,研究了不同NO2-N含量对虾夷扇贝早期发育和生长的影响,以期为完善虾夷扇贝生态学及育苗期间的水质调控提供参考。
1 材料与方法
1.1 材料
受试生物为虾夷扇贝人工繁育所得受精卵、两种规格浮游期幼虫(壳长129.4 μm ±14.8 μm和145.4 μm±7.4 μm)和变态前眼点幼虫(壳长238.0 μm±47.7 μm)。试验用水为大连市黑石礁海区经沉淀和沙滤的新鲜海水,盐度为32,pH为8.19±0.03,TAN为(0.085±0.032)mg/L,NO2-N为(0.006±0.037)mg/L,溶解氧>5.0 mg/L。
试验中使用的亚硝酸钠等药品均为分析纯。采用奈氏法、重氮偶氮法、pHS-2C型精密酸度计、YSI85型溶氧仪、wyy-1光学折射盐度计分别测定TAN、NO2-N、pH、DO、盐度。
1.2 方法
1.2.1 试验设计 全部试验在2 L聚乙烯桶中进行,内装试验海水1.5 L,用温控加热棒水浴控温。按照水生生物毒性试验方法[1],在预试验基础上等对数间距设置NO2-N浓度。以不添加NO2-N的正常海水为对照,试验期间不充气。孵化期间不换水,浮游至变态期间每天换水1次,根据镜检发育情况和摄食状况,各试验组每天酌情等量投喂不同比例的叉鞭金藻Dicrateria inornata和新月菱形藻Nitzschia closterium 2~3次,并测定换水前后的pH、DO、水温、盐度、TAN和NO2-N。NO2-N浓度和幼虫培育密度以试验期间实测的平均值为准。全部试验均设3个重复,各个试验阶段的NO2-N的实测浓度如表1所示。
表1 虾夷扇贝毒性试验的NO2-N浓度
Tab.1 NO2-N concentrations in toxicity test of yesso scallopmg/L
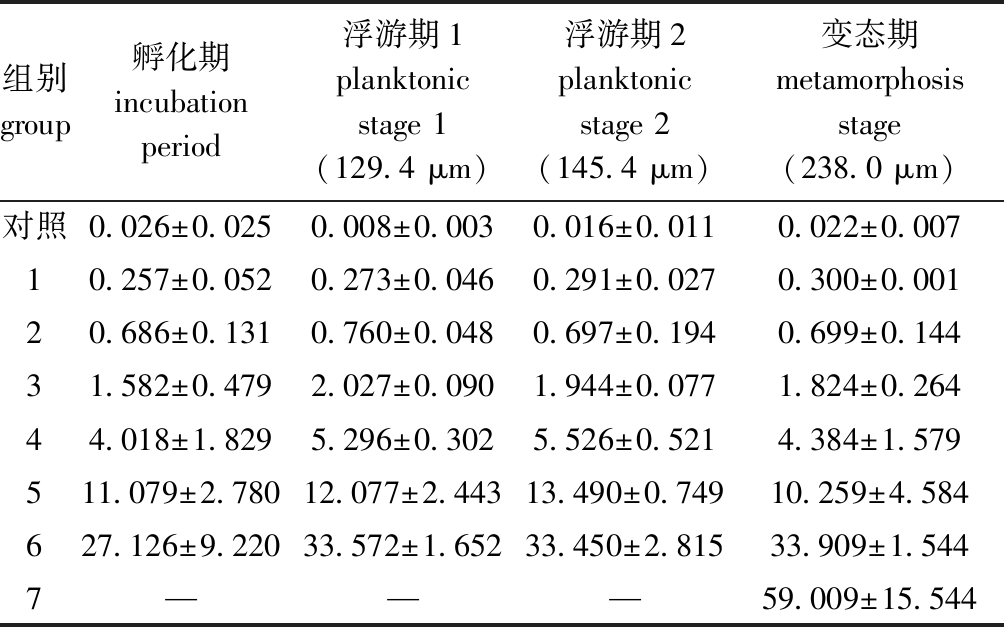
组别 group孵化期incubation period浮游期1planktonic stage 1(129.4 μm)浮游期2planktonic stage 2(145.4 μm)变态期metamorphosis stage(238.0 μm)对照0.026±0.0250.008±0.0030.016±0.0110.022±0.00710.257±0.0520.273±0.0460.291±0.0270.300±0.00120.686±0.1310.760±0.0480.697±0.1940.699±0.14431.582±0.4792.027±0.0901.944±0.0771.824±0.26444.018±1.8295.296±0.3025.526±0.5214.384±1.579511.079±2.78012.077±2.44313.490±0.74910.259±4.584627.126±9.22033.572±1.65233.450±2.81533.909±1.5447———59.009±15.544
1.2.2 NO2-N对孵化率的影响试验 受精卵密度为10 ind./mL,试验从受精卵开始至孵化出D形幼虫结束,持续72 h。期间每隔2~4 h搅水1次,以防卵下沉而缺氧死亡,水浴控温为15~16 ℃。
孵化率=孵化出的D型幼虫密度/初始受精卵密度×100%。
1.2.3 NO2-N对浮游期幼虫的影响试验 壳长为(129.4 ±14.8) μm的幼虫培育密度为6 ind./mL,壳长为(145.4 ±7.4)μm的幼虫培育密度为9 ind./mL,水浴控温为17~18 ℃,试验持续96 h。试验结束时,从每个试验桶中随机取30个幼虫,在显微镜下用目微尺测定壳长;将水样浓缩后,随机取样3次,每次取2 mL计数活苗的数量,再换算为密度(ind./mL)。
壳长相对生长率=(结束时壳长-初始壳长)/初始壳长×100%,
校正死亡率=(试验组死亡率-对照组死亡率)/(100-对照组死亡率)×100%。
1.2.4 NO2-N对变态期幼虫的影响试验 壳长为(238.0±47.7)μm的眼点幼虫密度设为3 ind./mL,投放聚乙烯附着基,水浴控温为15~16 ℃。每天观察苗的附着情况,直至水中没有浮游苗时结束试验,试验持续216 h。试验结束时,测定各个试验组已变态稚贝的壳长和密度,相对生长率和死亡率计算同浮游幼虫。
1.2.5 LC50、EC50、EC5和MATC的计算 用概率单位法求半致死浓度(LC50)或半数有效浓度(EC50,使孵化率、相对生长、变态率等观测指标下降50%的浓度)[1]。假设使观测指标下降5%的浓度为无影响浓度,根据观测指标与浓度的关系曲线,求使观测指标下降5%的有效浓度(EC5)。根据多重比较结果,将与对照组差异不显著的最高浓度(C1)和与对照组差异显著的最低浓度(C2)界定为最大允许毒物浓度(MATC)[1],即MATC=C1~C2。
1.3 数据处理
试验结果均以平均值±标准差(mean±S.D.)表示,采用SPSS 20.0软件进行方差分析,采用Tukey法进行多重比较,显著性水平设为0.05,极显著性水平设为0.01。
2 结果与分析
2.1 NO2-N对虾夷扇贝受精卵孵化率的影响
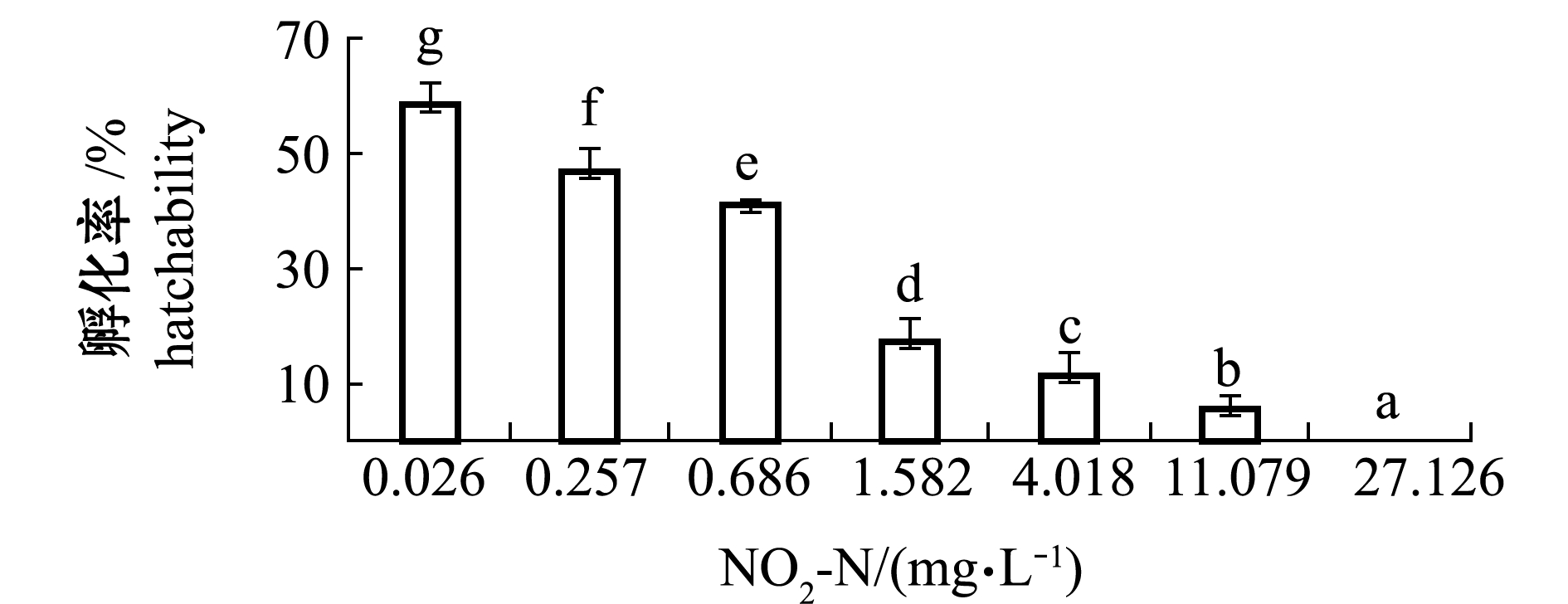
从图1可见:随着NO2-N浓度的升高,虾夷扇贝受精卵的孵化率显著下降(P<0.05);11.079 mg/L浓度组的孵化率为5.5%,27.126 mg/L组的孵化率为0;各浓度组间孵化率均有显著性差异(P<0.05),且均显著低于对照组(0.026 mg/L)(P<0.05)。NO2-N对受精卵孵化率的MATC为0.026~0.257 mg/L。根据概率单位法的基本原理,建立NO2-N浓度对数(x)与受精卵死亡率对应概率单位(y)的直线方程,得到回归方程为y=1.3815x+4.9541(R2=0.949,P<0.01,图2)。由方程求得NO2-N对孵化率的72 h EC50为1.07 mg/L,72 h EC5为0.07 mg/L。
2.2 NO2-N对虾夷扇贝浮游期幼虫的影响
2.2.1 浮游期幼虫的死亡率 不同NO2-N浓度下浮游期小规格(129.4 μm)和大规格(145.4 μm)幼虫的校正死亡率情况如图3所示。从图3可见:受试96 h时,小规格幼虫在NO2-N≥5.296 mg/L时全部死亡, 在NO2-N≤2.027 mg/L时各组均有存活,大规格幼虫在NO2-N≤33.450 mg/L时均有存活,说明浮游期小规格幼虫的耐受能力差;各浓度处理组的死亡率均显著高于对照组(0.008~0.016 mg/L)。NO2-N对浮游期小规格幼虫死亡率的MATC为0.008~0.273 mg/L,对大规格幼虫死亡率的MATC为0.016~0.291 mg/L。 在有存活幼虫的试验组,NO2-N的浓度对数(x)与小规格和大规格幼虫死亡率对应的概率单位(y)直线相关均显著(P<0.05,图4),回归方程分别为y=0.6111x+5.0579(R2=0.9976)和y=0.4084x+4.7913(R2=0.8324)。由方程求得 NO2-N对浮游期小规格和大规格幼虫的96 h LC50分别为0.306、3.24 mg/L。
注:标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同
Note:The means with different letters are significantly different among the groups at the 0.05 probability level, and the means with the same letters are not significant differences, et sequentia
图1 不同NO2-N浓度下虾夷扇贝受精卵的孵化率(72 h)
Fig.1 Hatching rates of fertilized eggs of yesso scallop under different NO2-N concentrations(72 h)
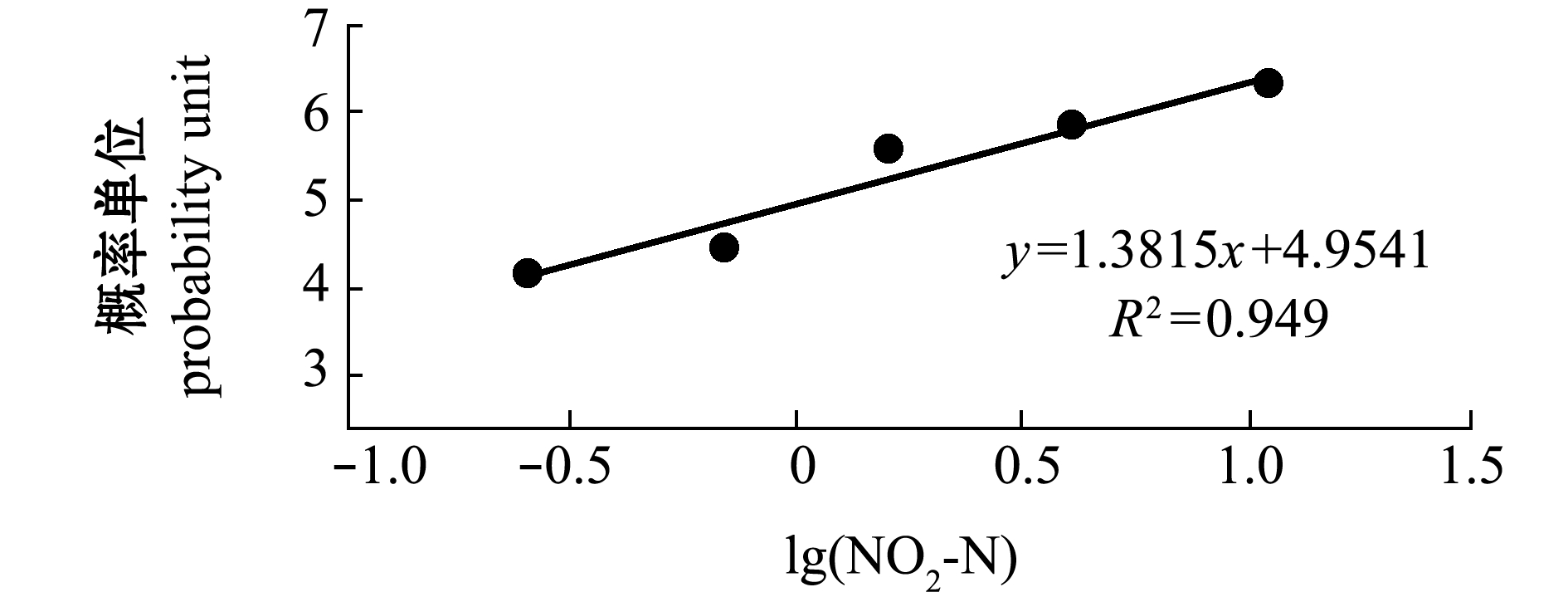
图2 NO2-N浓度对数与虾夷扇贝受精卵孵化期死亡率概率单位的关系
Fig.2 Relationship between logarithm of NO2-N concentration and hatching rate of fertilized eggs of yesso scallop
2.2.2 浮游期幼虫壳长相对生长 从图5可见:各浓度组幼虫壳长的相对生长率均低于对照组,并且在一定范围内(小规格组NO2-N≤0.760 mg/L,大规格组NO2-N≤5.526 mg/L),随着NO2-N浓度的增加,幼虫相对生长率呈下降趋势。统计分析表明,NO2-N对两种规格幼虫相对生长的96 h MATC分别与相应死亡率的96 h MATC相同。但是浓度较高时(小规格组NO2-N≥2.027 mg/L,大规格组NO2-N≥13.490 mg/L),幼虫的相对生长率较低浓度组异常升高。原因可能是高浓度组死亡率高,导致密度下降,空间压力减小,使零星存活的耐受力特强的个体生长加快,或者较大个体耐受力增强得以存活。将相对生长异常升高的高浓度组剔除,以浓度对数(x)与幼虫相对生长率(y)线性回归,发现两者显著直线负相关(P<0.05,图6)。将对照组的相对生长率设为100%,由直线方程可求得使小规格和大规格幼虫相对生长率下降5%的96 h EC5依次为0.026、0.076 mg/L。
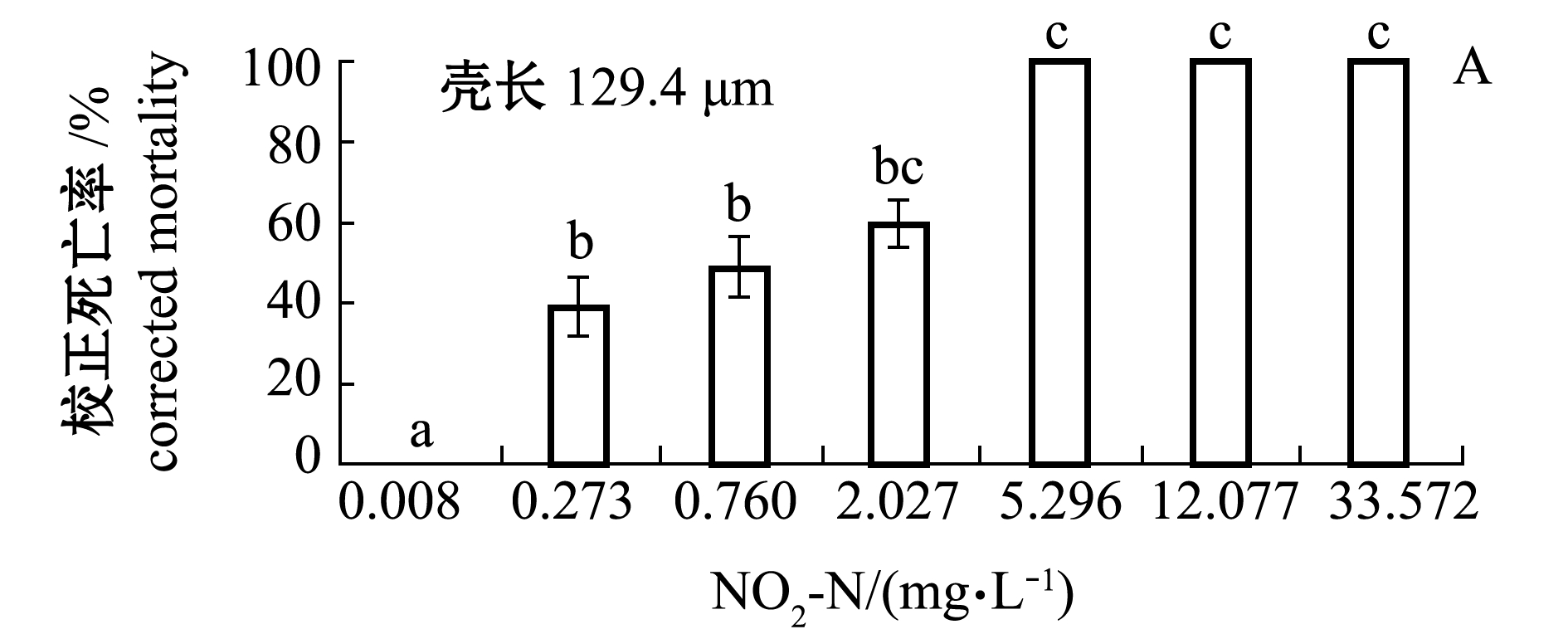

图3 不同NO2-N浓度条件下虾夷扇贝浮游期幼虫的死亡率(96 h)
Fig.3 Mortalities of planktonic larvae of yesso scallop under different NO2-N concentrations(96 h)
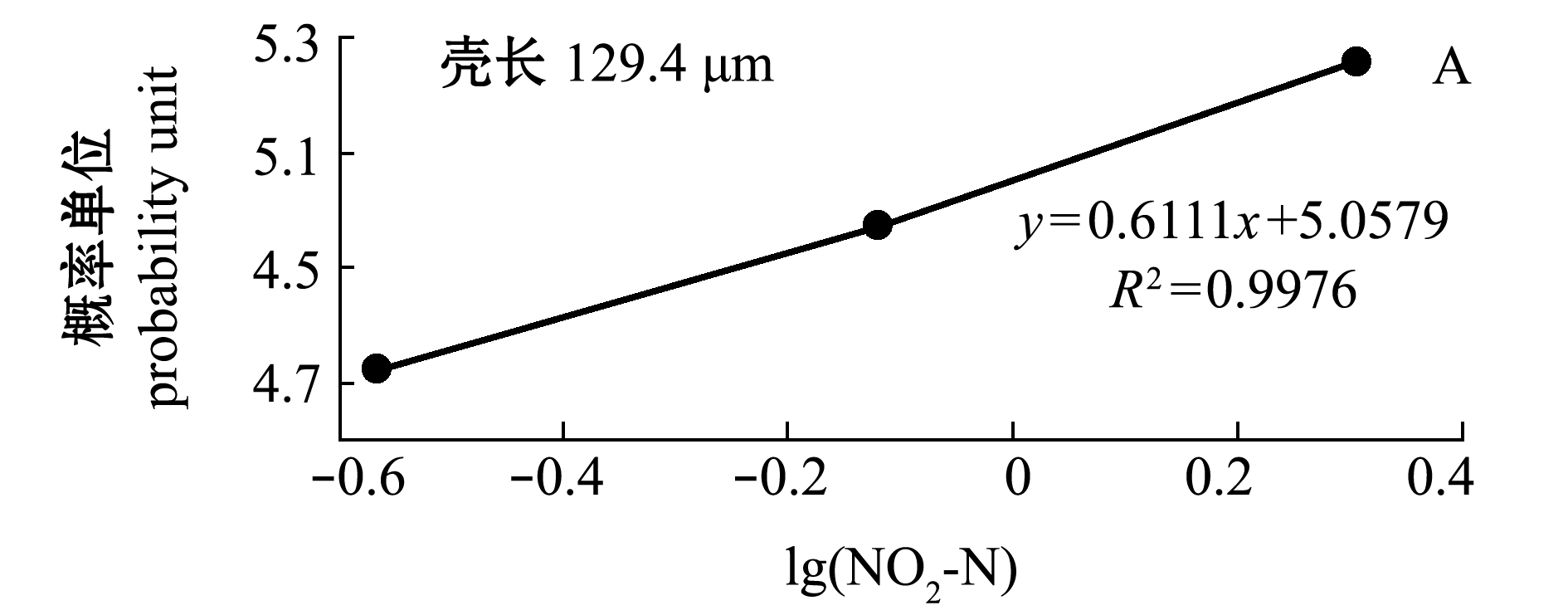
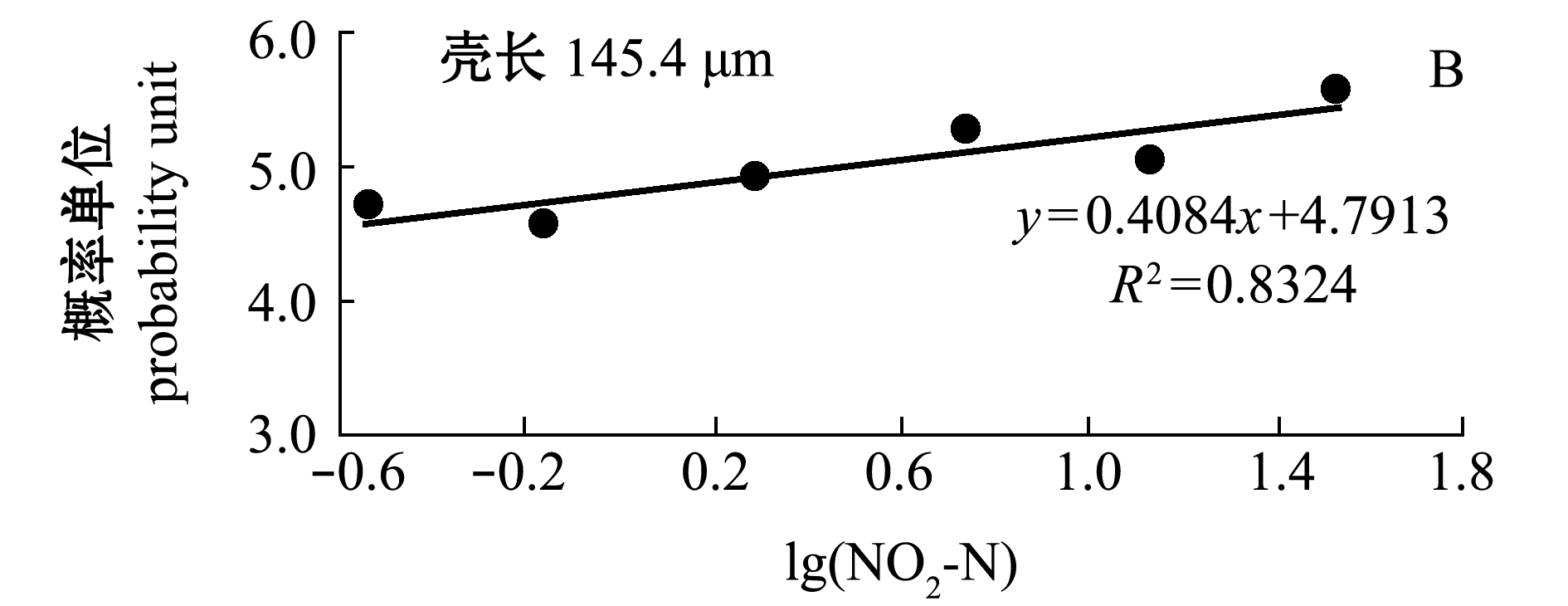
图4 NO2-N浓度对数与虾夷扇贝浮游期幼虫死亡率概率单位的关系
Fig.4 Relationship between NO2-N concentration logarithm and probability unit in larval mortality of yesso scallop
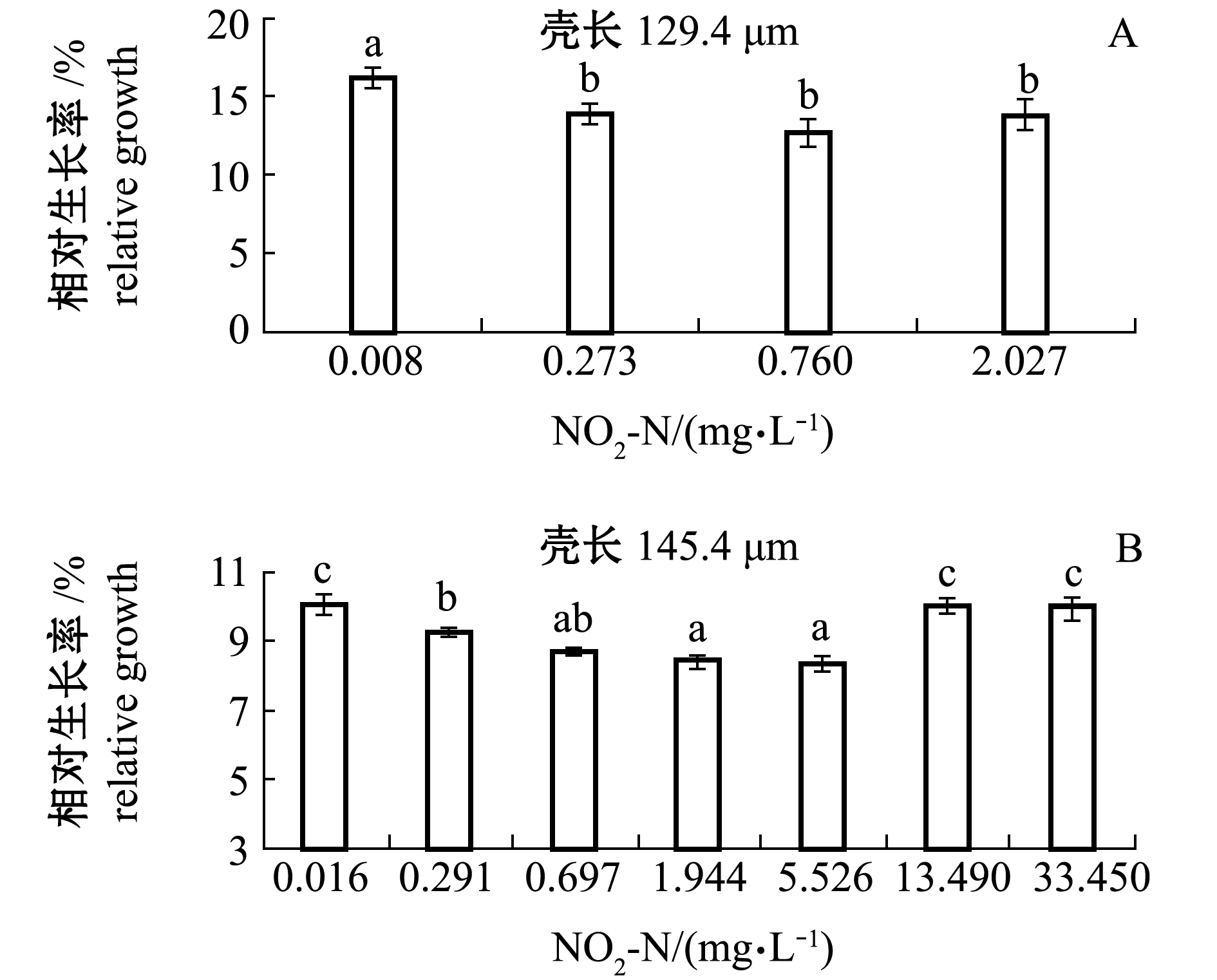
图5 不同NO2-N浓度下虾夷扇贝浮游期幼虫的壳长相对生长(96 h)
Fig.5 Relative growth rate of planktonic larvae in yesso scallop under different NO2-N concentrations(96 h)
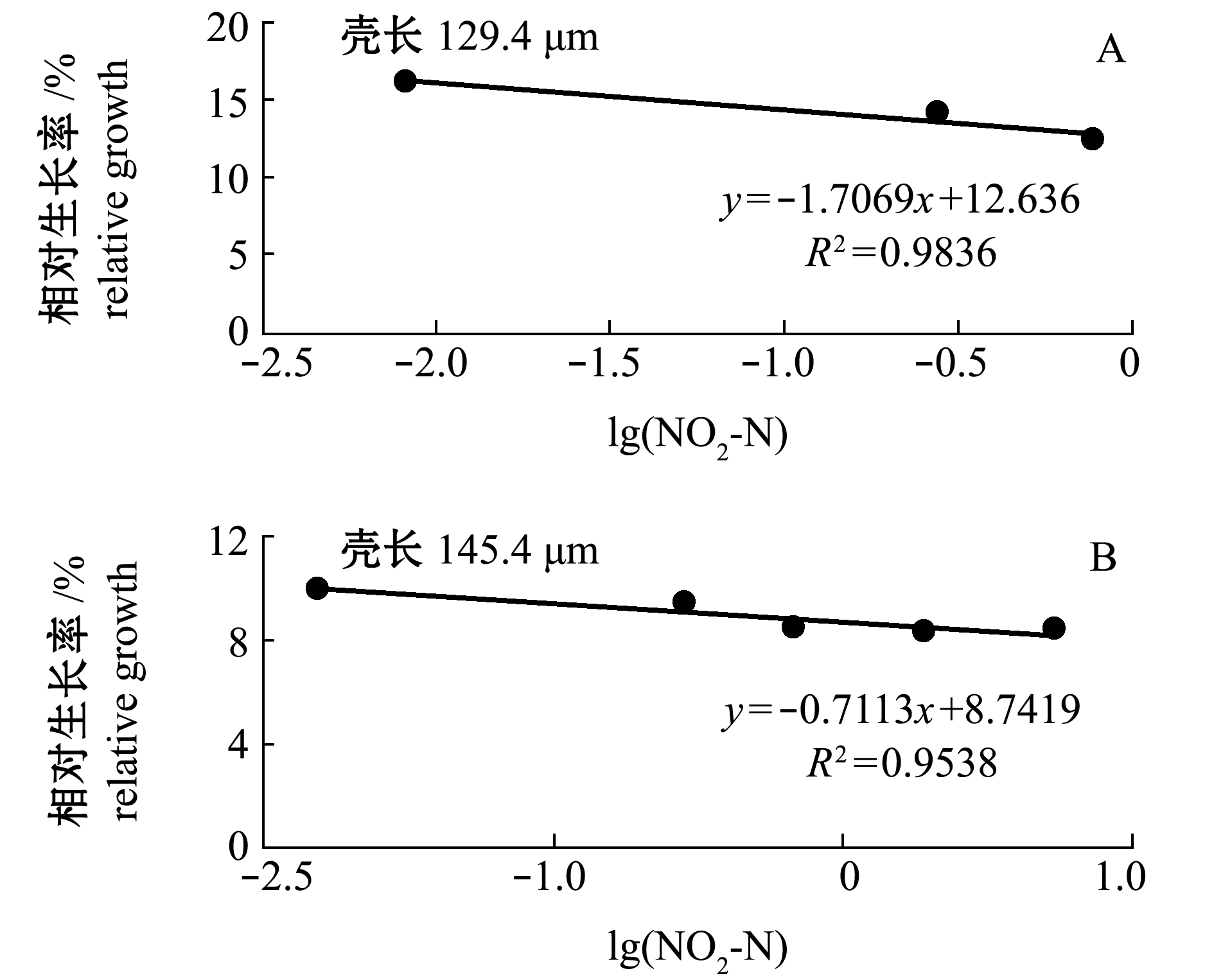
图6 NO2-N浓度对数与虾夷扇贝浮游期壳长相对生长的关系(96 h)
Fig.6 Relationship between logarithm of NO2-N concentration and relative growth of planktonic larvae in yesso scallop(96 h)
2.3 NO2-N对虾夷扇贝变态阶段的影响
2.3.1 幼虫变态率 从图7可见:从眼点幼虫(壳长238.0 μm)开始,至完全变态成稚贝(胁迫216 h),虾夷扇贝变态率随着NO2-N浓度的升高而降低;0.300、0.699 mg/L浓度组的变态率与对照组(0.022 mg/L)无显著性差异(P>0.05),其他浓度组的变态率显著低于对照组(P<0.05)。NO2-N对变态率的216 h MATC为0.699~1.824 mg/L。将变态期死亡率换算成概率单位(y),与NO2-N浓度对数(x)回归,两者极显著直线相关(P<0.01,图8),回归方程为y=0.8323x+4.357(R2=0.9662,n=7)。由方程求得幼虫变态率的216 h EC50为5.92 mg/L,216 h EC5为0.063 mg/L。
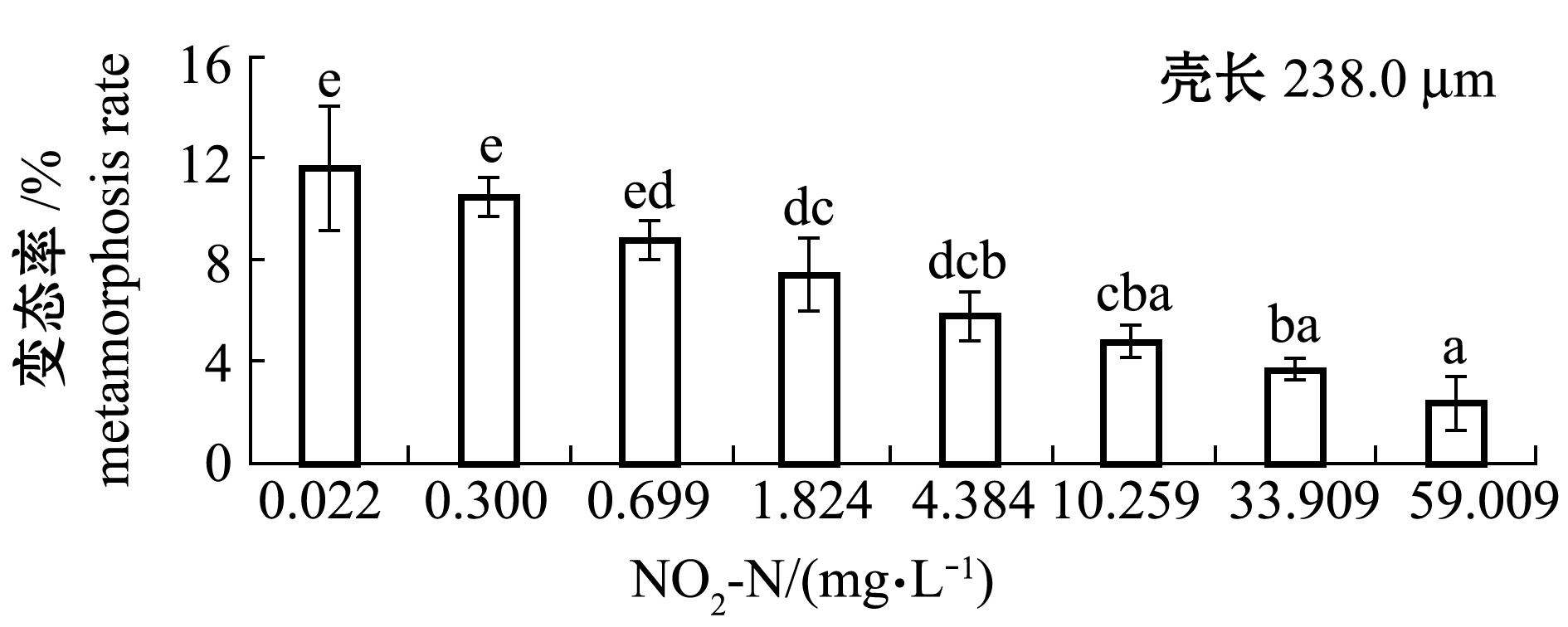
图7 不同NO2-N浓度下虾夷扇贝的变态率(216 h)
Fig.7 Metamorphosis rate of yesso scallop larvae under different NO2-N concentrations(216 h)
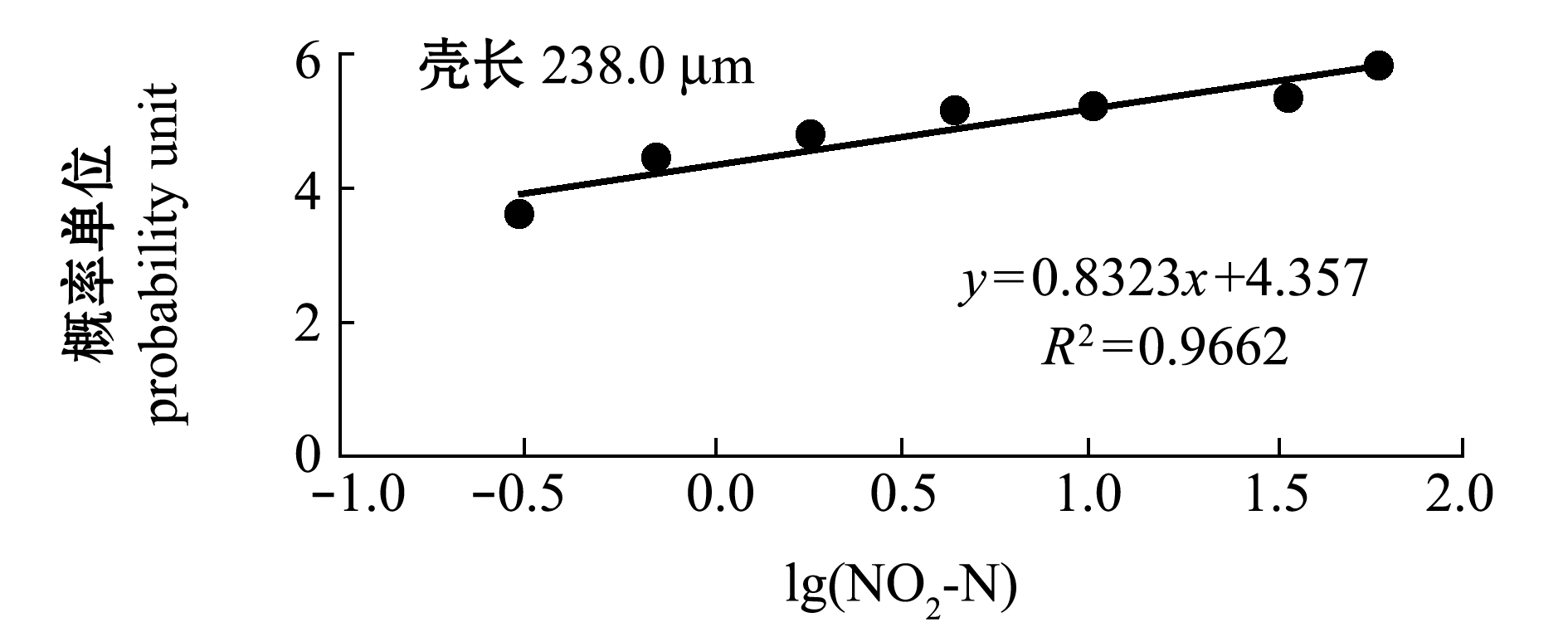
图8 NO2-N浓度对数与虾夷扇贝变态期死亡率概率单位的关系
Fig.8 Relationship between the logarithm of NO2-N concentration and the probability unit of mortality in metamorphosis stage in yesso scallop
2.3.2 变态期幼虫壳长的相对生长 从图9可见:低浓度组(0.300、 0.699 mg/L)幼虫的相对生长率与对照组(0.022 mg/L)相比无显著性差异(P>0.05),5个高浓度组(1.824、4.384、10.259、33.909、59.009 mg/L)变态期相对生长率均显著低于对照组(P<0.05)。NO2-N对变态期相对生长的216 h MATC为0.699~1.824 mg/L。幼虫的相对生长率(y)与NO2-N浓度对数(x)呈极显著直线负相关(P<0.01,图10),回归方程为y=-5.5486x+62.751(R2=0.9451)。将对照组相对生长率记为100%,由回归方程可求得变态期相对生长率的216 h EC5为0.078 mg/L。
3 讨论
3.1 虾夷扇贝早期不同发育阶段对NO2-N的耐受能力比较
本试验表明,NO2-N对受精卵孵化率的72 h MATC为0.026~0.257 mg/L(图1),对小规格浮游期浮游幼虫死亡率和相对生长率的96 h MATC为0.008~0.273 mg/L,对大规格幼虫死亡率和相对生长率的96 h MATC为0.016~0.291 mg/L(图3和图5),对变态期变态率和相对生长率的216 h MATC为0.699~1.824 mg/L(图7和图9),以变态期的MATC最高;各发育阶段 LC50或EC50的大小为129.4 μm浮游幼虫96 h LC50(0.306 mg/L)<孵化率72 h EC50(1.07 mg/L)<145.4 μm浮游幼虫96 h LC50(3.24 mg/L)<变态期幼虫216 h LC50(5.92 mg/L),以小规格浮游幼虫的96 h LC50最低;小规格幼虫相对生长的96 h EC5(0.026 mg/L)也小于大规格幼虫96 h EC5(0.076 mg/L)。
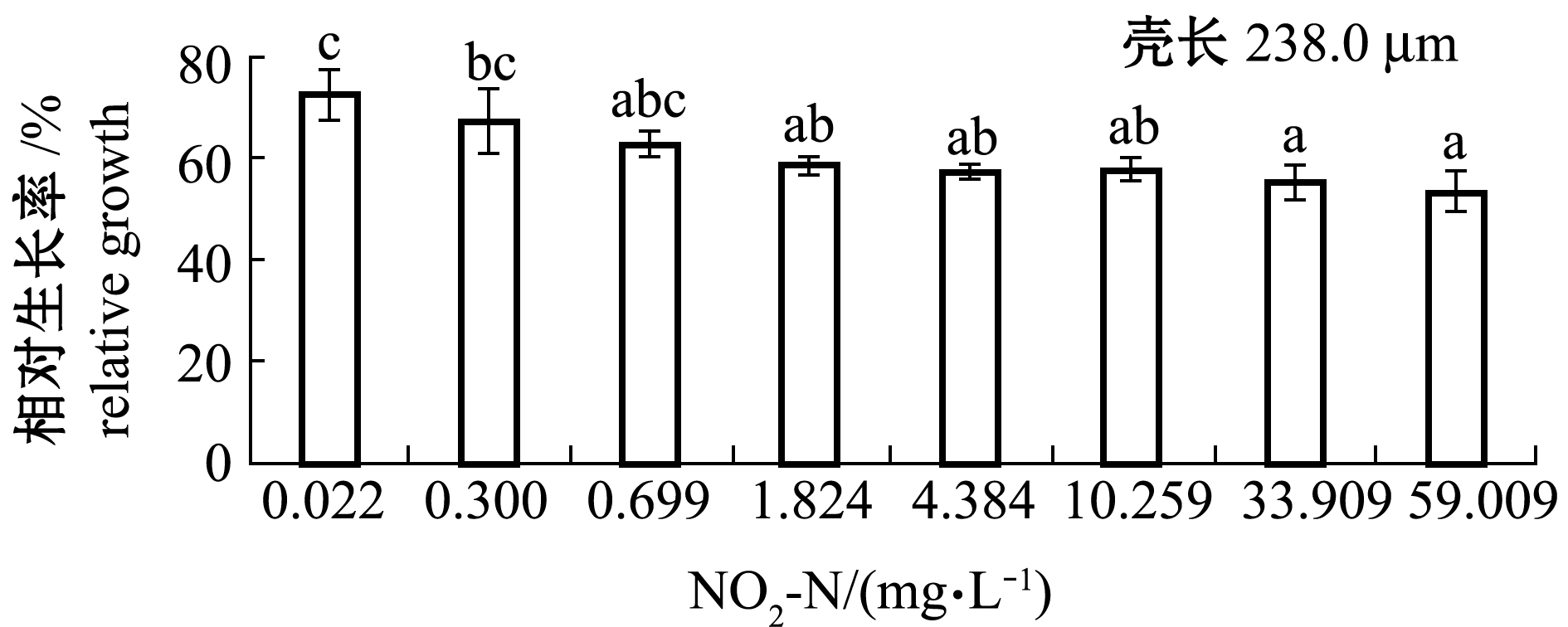
图9 不同NO2-N浓度下虾夷扇贝变态期的壳长相对生长(216 h)
Fig.9 Relative shell growth of yesso scallop during metamorphosis at different NO2-N concentrations(216 h)
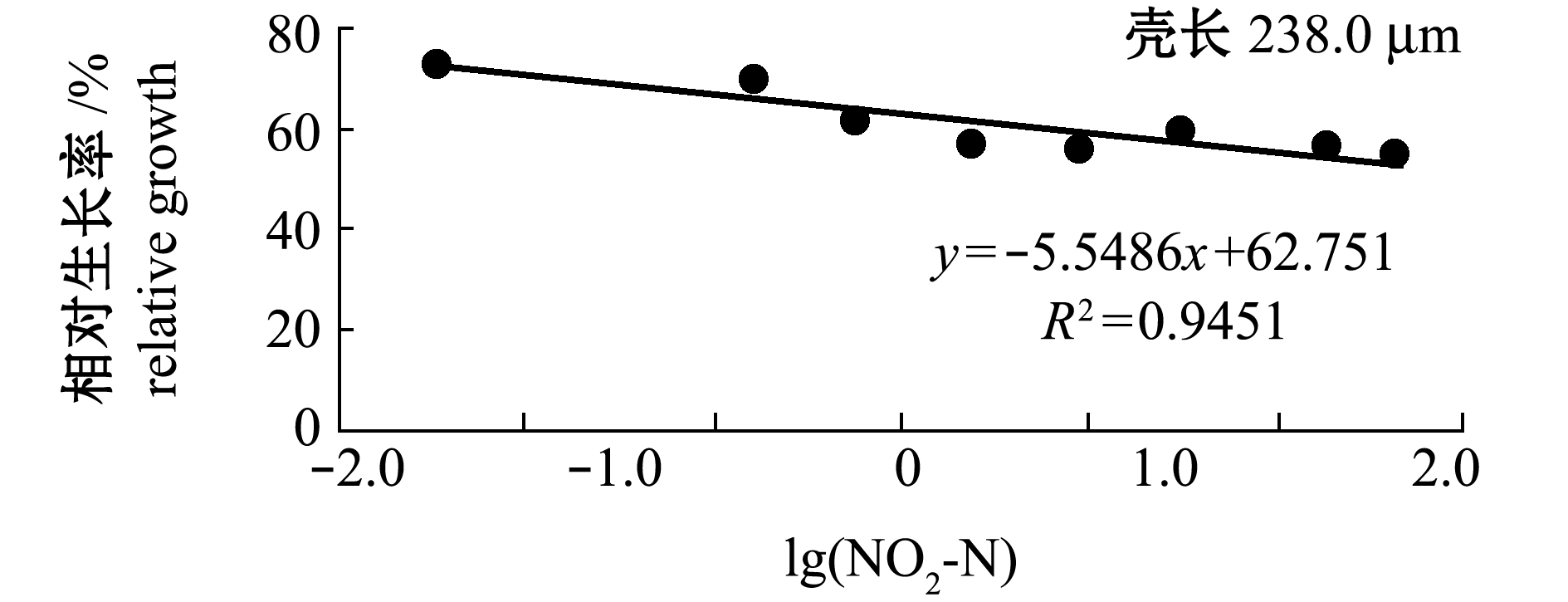
图10 NO2-N浓度对数与虾夷扇贝变态期相对生长率的关系
Fig.10 Relationship between the logarithm of NO2-N concentration and the relative shell growth rate of yesso scallop in metamorphosis stage
综上所述,虾夷扇贝早期发育阶段中,以浮游期小规格幼虫对NO2-N更敏感,孵化期的72 h LC50也较低。说明在虾夷扇贝育苗期间,除了要关注早期浮游幼虫阶段水体中NO2-N含量外,孵化期间NO2-N含量也不能忽视。目前有关NO2-N对贝类早期发育各阶段影响的研究不多。王晔[12]研究了NO2-N对日本海神蛤早期生长发育的影响,结果表明,小规格浮游幼虫较大规格对NO2-N更敏感,与本试验结果一致。
3.2 虾夷扇贝与其他海水贝类对NO2-N耐受能力的比较
研究发现,NO2-N毒性随盐度[3,14]、pH[6]、溶解氧[5]等升高而降低,在饥饿状态下比饱食状态下毒性增强,但差异不显著[11]。因此,不同试验条件下得出的试验结果较难相互比较。表2汇总了NO2-N对几种海水养殖贝类的毒性试验结果。相近pH、盐度和发育阶段条件下比较,虾夷扇贝(壳长129.4~145.4 μm,96 h LC50<3.24 mg/L)对NO2-N的耐受能力低于日本海神蛤浮游幼虫(116 μm,96 h LC50>18 mg/L)[12]。这可能与日本海神蛤营埋栖生活,栖息底质以泥沙为主[12]有关,由于底质环境中NO2-N含量较高,日本海神蛤长期适应,导致其对NO2-N的耐受能力更强。而虾夷扇贝喜生活在底质坚硬、淤沙少、水质良好的海水中,其中NO2-N含量较低[1],故对NO2-N耐受能力较差。由营埋栖生活的方斑东风螺幼贝(壳长5 mm)[13]和管角螺稚贝(壳长1.22 mm)[14]的96 h LC50推算得到安全浓度依次为27.0、29.6 mg/L,远大于喜附着生活的皱纹盘鲍幼贝(壳长6.18 mm)[15]的0.8 mg/L,这也是对上述分析的佐证。
3.3 虾夷扇贝育苗用水中NO2-N的安全浓度
采用96 h LC50×0.1计算[1],NO2-N对规格为129.4、145.4 μm幼虫的安全浓度分别为0.031、0.324 mg/L。可见,采用不同规格的受试生物推算所得安全浓度不同。从严控制水质,综合129 μm幼虫相对生长EC5的结果(0.026 mg/L),建议虾夷扇贝苗种人工繁育期间NO2-N控制在0.030 mg/L以下。根据变态期稚贝相对生长的EC5(0.078 mg/L),建议中间育成阶段NO2-N控制在0.08 mg/L以下。
表2 几种贝类对NO2-N的耐受能力比较
Tab.2 Comparison of tolerance of several shellfish to nitrite nitrogen
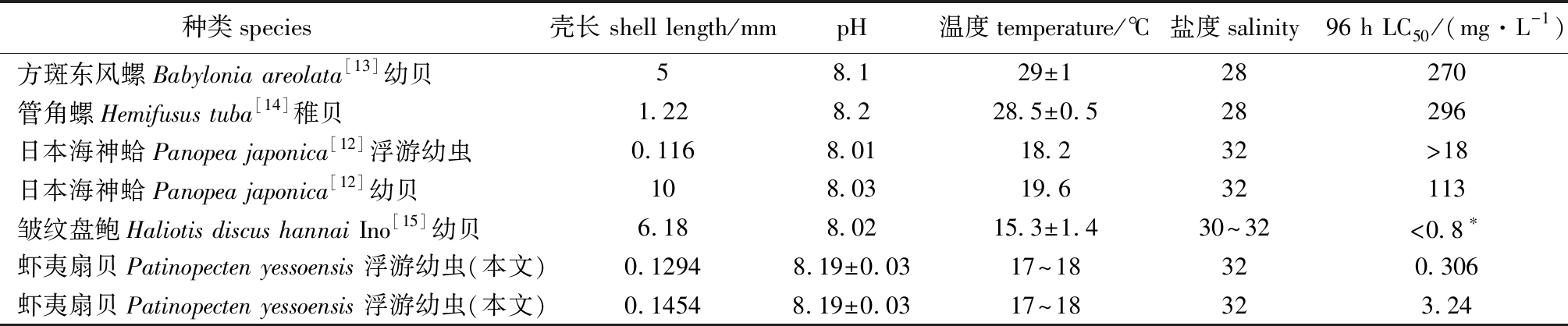
种类species 壳长 shell length/mmpH温度temperature/℃盐度salinity96 h LC50/(mg·L-1)方斑东风螺Babylonia areolata[13]幼贝58.129±128270管角螺Hemifusus tuba[14]稚贝1.228.228.5±0.528296日本海神蛤Panopea japonica[12]浮游幼虫0.116 8.0118.232>18日本海神蛤Panopea japonica[12]幼贝108.0319.632113皱纹盘鲍Haliotis discus hannai Ino[15]幼贝6.188.0215.3±1.430~32<0.8∗虾夷扇贝Patinopecten yessoensis 浮游幼虫(本文)0.12948.19±0.0317~18320.306虾夷扇贝Patinopecten yessoensis 浮游幼虫(本文)0.14548.19±0.0317~18323.24
注:*为皱纹盘鲍受试31 d推测而得的安全浓度
Note:*, the safe concentration deduced from the 31 d test in disk abalone Haliotis discus hannai
[1] 雷衍之.养殖水环境化学[M].北京:中国农业出版社,2004.
[2] 董玉波,戴媛媛.亚硝酸盐氮对水产经济动物毒性影响的研究概况[J].水产养殖,2011,32(4):28-32.
[3] 韩枫,黄杰斯,温海深,等.不同盐度条件下亚硝酸态氮与非离子氨对花鲈幼鱼的毒性实验[J].海洋科学,2016,40(10):8-15.
[4] 郑乐云.氨氮和亚硝酸盐对斜带石斑鱼苗的急性毒性效应[J].海洋科学,2012,36(5):81-86.
[5] 徐勇,张修峰,曲克明,等.不同溶氧条件下亚硝酸盐和氨氮对半滑舌鳎的急性毒性效应[J].海洋水产研究,2006,27(5):28-33.
[6] Wedemeyer G A,Yasutake W T.Prevention and treatment of nitrite toxicity in juvenile steelhead trout (Salmo gairdneri)[J].Journal of the Fisheries Research Board of Canada,1978,35(6):822-827.
[7] Zhang L,Xiong D M,Li B,et al.Toxicity of ammonia and nitrite to yellow catfish (Pelteobagrus fulvidraco)[J].Journal of Applied Ichthyology,2012,28(1):82-86.
[8] 包杰,姜宏波,程慧,等.亚硝酸氮对中华小长臂虾的急性毒性及非特异性免疫指标的影响[J].生态学杂志,2017,36(9):2549-2555.
[9] 胡贤德,孙成波,王平,等.不同盐度条件下亚硝酸氮对斑节对虾的毒性影响[J].沈阳农业大学学报,2009,40(1):103-106.
[10] Cheng S Y,Chen J C.Hemocyanin oxygen affinity,and the fractionation of oxyhemocyanin and deoxyhemocyanin for Penaeus monodon exposed to elevated nitrite[J].Aquatic Toxicology,1999,45(1):35-46.
[11] 吕敢堂,王志铮,王海平,等.亚硝酸钠对三疣梭子蟹幼体的急性毒性[J].浙江海洋学院学报:自然科学版,2006,25(3):244-248.
[12] 王晔.pH、氨态氮和亚硝酸态氮对日本海神蛤Panopea japonica早期发育和生长的影响[D].大连:大连海洋大学,2016.
[13] 郭增华,王秋燕.亚硝酸盐氮对方斑东风螺毒性的研究[J].海洋水产研究,2006,27(6):88-92.
[14] 罗杰,陈加辉,刘楚吾.管角螺稚贝对亚硝酸盐耐受力研究[J].南方水产科学,2011,7(2):42-48.
[15] 谭烨辉,杨凤,雷衍之.总氨、亚硝酸氮及养鲍污水对皱纹盘鲍生长的影响[J].大连水产学院学报,2003,18(3):204-209.
[16] Rocha-Olivares A,Calderon-Aguilera L E,Aragón-Noriega E A,et al.Genetic and morphological variation of northeast Pacific Panopea clams:evolutionary implications[J].Journal of Shellfish Research,2010,29(2):327-335.