海洋环境中细菌多样性最为丰富[1],其中包含着大量病原细菌。近年来,随着沿海城市人口的增加,生活污水排海量呈上升趋势,海洋环境中的病原细菌亦随之增加,加之降雨带来的地表径流、潮汐、人类扰动等影响,导致海滩(干砂、湿砂)及沉积物中的病原细菌被带入或重悬进入上覆海水,成为近岸海水的非点源污染源[2-3]。此外,越来越多的研究发现,病原细菌在沙滩或沉积物中生存和增殖能力较强,导致海水浴场潜在的健康风险升高[4-5]。流行病学研究表明,沙滩暴露与胃肠道疾病风险升高存在显著相关性[6]。目前,国内有关海水浴场病原细菌分布及其风险评估的研究只涉及海水,李江宇等[7]采用PCR-DGGE技术对大连星海浴场细菌群落结构进行了鉴定,并鉴定出几种潜在病原细菌,郭建丽[8]采用PCR和基因芯片技术对该浴场15种病原细菌在海水中的分布进行了研究,但尚无针对不同介质病原细菌分布特征的研究,故不能客观、全面地给予公众健康指导。
国际标准化组织(ISO)及美国(EPA)、加拿大等国家和组织[9-10]通常采用粪大肠菌群(fecal coliforms,FC)和肠球菌(Enterococcus,ENT)等粪便指示细菌(fecal indicator bacteria,FIB)来评价浴场海水受粪便病原细菌污染的程度,中国自20世纪90年代起采用粪大肠菌群来评价浴场水质[11-13],2010年中国《滨海旅游度假区环境评价指南》中将肠球菌纳为评价指标来反映水质受粪便污染状况[14]。然而,粪便污染指示细菌对非粪便来源病原细菌的指示作用越来越受到质疑[15],如海滩上游客携带的金黄色葡萄球菌Staphylococcus aureus是干砂中该菌来源的主要贡献者[16],沙滩中金黄色葡萄球菌是娱乐用水人群主要的潜在健康风险[17-20],特别是儿童和免疫力低下的娱乐用水人群,病原细菌的浓度与其感染疾病的相关性极强[21-22]。此外,弧菌属Vibrio作为海洋中的土著菌是人体潜在的病原细菌,其分布与粪便污染关系不大[23]。虽然金黄色葡萄球菌和弧菌属作为非肠道疾病指标的价值尚不清楚,但鉴于其潜在致病性,掌握其在休闲海滩中的分布有助于评估疾病传播的可能性。
大连金石滩浴场和傅家庄浴场属于典型的北方海水浴场,金石滩浴场远离市中心,是国内唯一一处3S(阳光、海水、沙滩)国家级滨海旅游度假海滩,傅家庄位于南部海滨风景区中部,是大连市内最大的海水浴场之一。金石滩浴场和傅家庄浴场每年接收众多国内外泳客,旺季时,平均每天客流量达3万到10万人次,是大连海水浴场娱乐用水人群主要集中的地点。为此,本研究中选取金石滩浴场和傅家庄浴场为研究区域,筛选其海水、干砂、湿砂、沉积物等不同介质中的病原细菌,并对其粪便污染指示菌(粪大肠菌群和肠球菌)及重要的非粪便来源病原细菌(弧菌和金黄色葡萄球菌)进行空间分布特征分析,旨在为娱乐海水浴场健康指导提供重要的参考数据。
1 材料与方法
1.1 站位布设和样品采集
按照平均布设站位原则(图1),在海岸线为4500 m的金石滩海水浴场设置11个采样点,除靠近养殖区域的两侧站位(东1和西5)外,将相邻两个点样品混合,并在东5排污口处单独布设站位,共计7个样品。在海岸线为450 m的傅家庄海水浴场设置3个站位(图2),同样在浴场东侧排污口单独设置1个站位,并在垂直岸边200 m处设立1个远海点站位,共计5个样品。在同一垂直断面沿岸分别垂直采集干砂和湿砂,在水面分别垂直采集水样和水下沉积物。采集水样时,在距水面30 cm左右采集,砂样在距表面2~3 cm处采集,低温保存4~6 h送实验室处理。
1.2 方法
1.2.1 可培养细菌 称取沉积物、砂样各20 g,放入180 mL灭菌陈海水中,稀释度为10-1,充分混匀后再进行10-2~10-3梯度稀释。将处理好的样品进行如下检测:

图1 金石滩空间分布试验方案站位布设
Fig.1 Layout of spatial stations in Jinshitan during the experiment
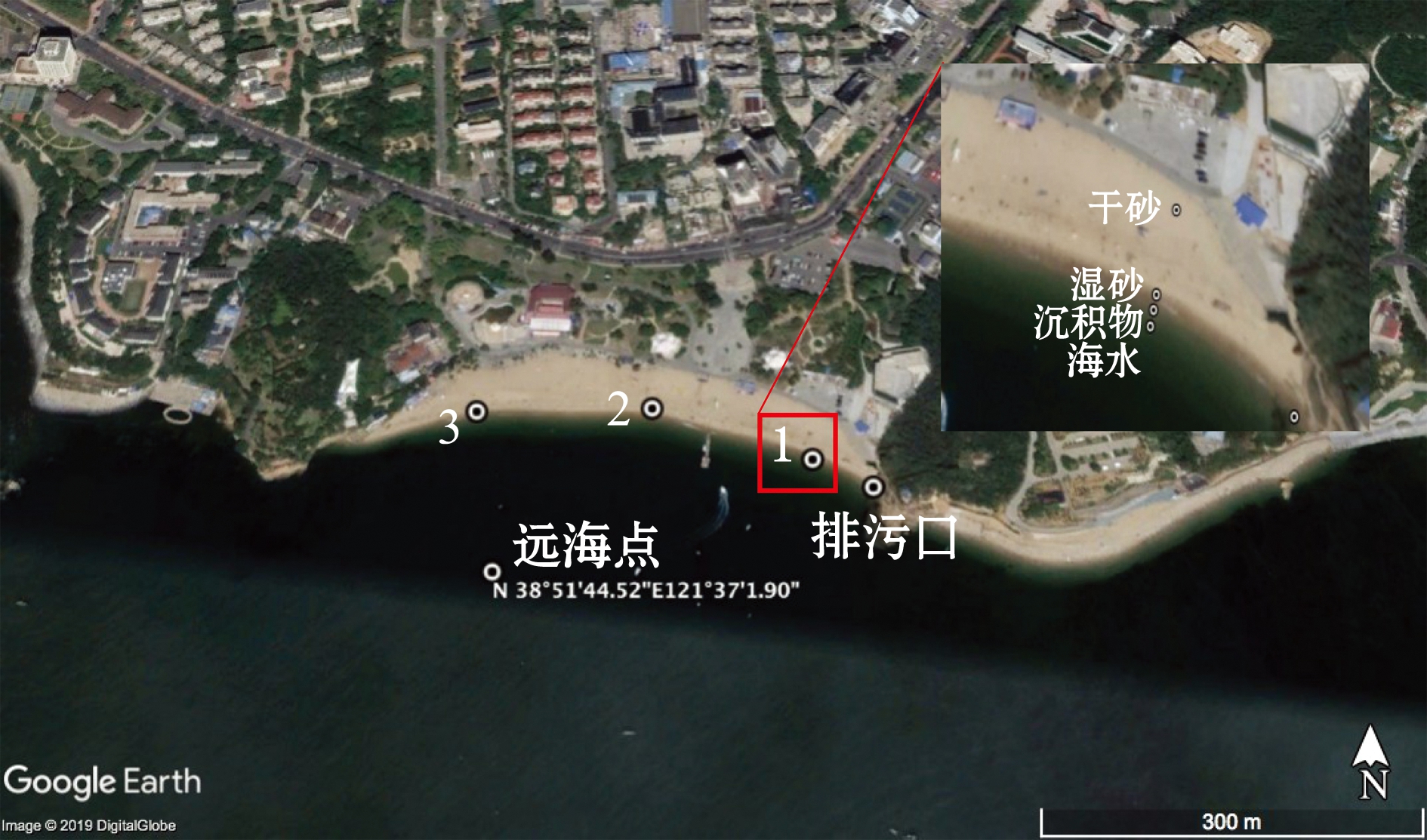
图2 傅家庄空间分布试验方案站位布设
Fig.2 Layout of spatial stations in Fujiazhuang during the experiment
肠球菌:参照国际标准ISO 7899-2:2000,即取适当梯度水样各100 mL,分别用孔径为0.45 μm的混合纤维素滤膜过滤,将滤膜置于SB培养基中37 ℃下培养44 h。培养后,典型的菌落中心或整个菌落均应呈红色或栗色或粉红色。当有典型菌落出现时,用消毒镊子将滤膜小心转移到已预热至44 ℃含胆盐七叶苷-叠氮化物的培养基中,并于44 ℃下培养2 h后显色,每个样品设3个平行。
金黄色葡萄球菌:参照《美国标准3M纸片法》,吸取适当梯度样品1 mL分别滴加于3M试纸片上,迅速按压,静置2~3 min,然后置于37 ℃培养箱中培养24 h后计数,每个样品设3个平行。
粪大肠菌群:参照国家标准《海洋监测技术规程第五部分海洋生物》(HY-T-47.5—2013)粪大肠菌群测试纸片法,吸取适当梯度样品5 mL滴加于纸片后,静置2~3 min,44 ℃下培养24 h,每个样品设3个平行。
弧菌总数:参照《海洋监测规范第7部分:近海污染生态调查和生物监测》(GB17378.7—2007),取适当稀释水样200 μL均匀涂于TCBS培养基中,置于37 ℃恒温培养箱培养18~24 h后计数,每个样品设3个平行。
异养细菌总数:参照《海洋监测规范第7部分:近海污染生态调查和生物监测》(GB17378.7—2007),取适当稀释水样100 μL均匀涂于2216E培养基中,置于25 ℃恒温黑暗倒置培养,培养3~7 d后计数,每个样品设3个平行。
1.2.2 高通量测序 无菌条件下刮取可培养的异养细菌,每个样品选取两个平行进行高通量测序。首先使用天根公司细菌基因组DNA提取试剂盒提取可培养异养细菌总DNA,利用10 g/L琼脂糖凝胶电泳检测抽提的基因组DNA,然后选择V3-V4区进行测序。构建Illumina PE250配对末端文库,所有样品在Illumina PE250 平台测序,统计每轮收集到的荧光信号结果,获知模板DNA片段的序列。
1.2.3 基因芯片技术 采用基因芯片方法筛选病原细菌,首先使用水煮裂解法提取可培养异养细菌(样品同高通量测序)总DNA,然后采用特异性引物对样品进行PCR扩增,将PCR产物混合后,进行探针杂交,并用激光扫描仪扫描。基因芯片病原细菌库包含18种:溶藻弧菌、粪肠球菌、气单胞菌、志贺氏菌、哈维弧菌、副溶血弧菌、大肠杆菌、鳗弧菌、河流弧菌、霍乱弧菌O1、迟缓爱德华菌、沙门氏菌、单增李斯特菌、金黄色葡萄球菌、大肠杆菌O157:H7、嗜水气单胞菌、腐败西瓦氏菌和铜绿假单胞菌。
1.2.4 粒度分析 粒度分析主要是对沉积物、湿砂和干砂样品分别进行中值粒径、平均粒径、分选系数、偏态、峰态等物理参数进行标准化检测,使用美国贝克曼库尔特公司(Beckman Coulter)生产的LS13320型激光衍射粒度分析仪,进行Aqueous Liquid Module模块测试,一般常规检测范围为0.4~2000 μm,粒度分析采用尤登-温德华氏等比制φ值粒级标准。
2 结果与分析
2.1 可培养细菌空间分布特征
2.1.1 金石滩海水浴场可培养细菌 金石滩海水浴场异养细菌分布如图3所示,海水中异养细菌浓度为6.50×104 ~2.78×106 CFU/100 mL,沉积物中其浓度为2.50×105~1.65×106 CFU/100 g,湿砂中其浓度为5.00×105~9.40×106 CFU/100 g,干砂中其浓度为4.00×106~5.60×107 CFU/100 g。异养细菌在不同介质空间分布为干砂>湿砂>沉积物>海水,其中,东1干砂中异样细菌浓度最高。

图3 金石滩浴场异养细菌分布特征
Fig.3 Distribution characteristics of heterotrophic bacteria in Jinshitan bathing beach
金石滩海水浴场弧菌分布如图4所示,海水中其浓度为3.50×102~1.98×104 CFU/100 mL,沉积物中其浓度为1.00×102~1.67×104 CFU/100 g,湿砂中其浓度为5.00×101~1.00×103 CFU/100 g,干砂中其浓度为5.00×101~1.15×103 CFU/100 g。弧菌在不同介质空间分布为海水>沉积物>湿砂>干砂,其中,西1&2及排污口海水中弧菌浓度最高。

图4 金石滩浴场弧菌分布特征
Fig.4 Distribution characteristics of Vibrio in Jinshitan bathing beach
金石滩海水浴场粪大肠菌群分布如图5所示,海水中其浓度为2.00×101~4.96×103 CFU/100 mL,沉积物中其浓度为2.00×102 CFU/100 g~6.00×102 CFU/100 g,湿砂中其浓度为5.00×101 ~4.50×102 CFU/100 g,干砂中其浓度为5.00×101~3.50×102 CFU/100 g。粪大肠菌群在不同介质空间分布为海水>干砂>沉积物>湿砂,其中,排污口海水中粪大肠菌群浓度最高,但整体状况良好。
金石滩海水浴场肠球菌分布如图6所示,海水中其浓度为2.00×102~3.70×104 CFU/100 mL,沉积物中其浓度为5.00×101~1.65×105 CFU/100 g,湿砂中其浓度为2.30×103~4.95×103 CFU/100 g,干砂中其浓度为2.00×102~4.00×104 CFU/100 g。肠球菌在不同介质空间分布为海水>干砂>沉积物>湿砂,其中,排污口沉积物中肠球菌浓度最高,其次是排污口海水和西1&2干砂。
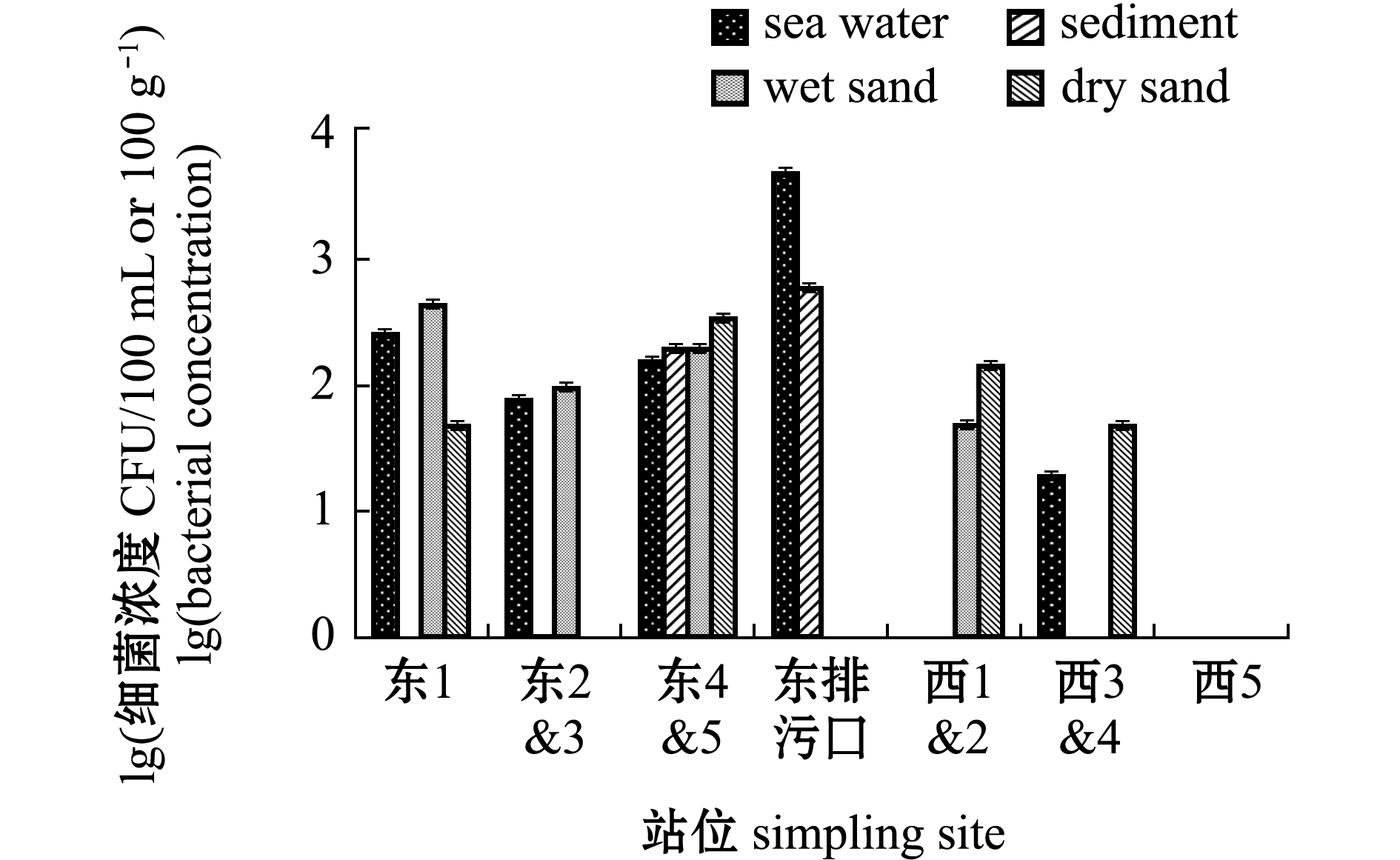
图5 金石滩浴场粪大肠菌群分布特征
Fig.5 Distribution characteristics of fecal coliforms in Jinshitan bathing beach
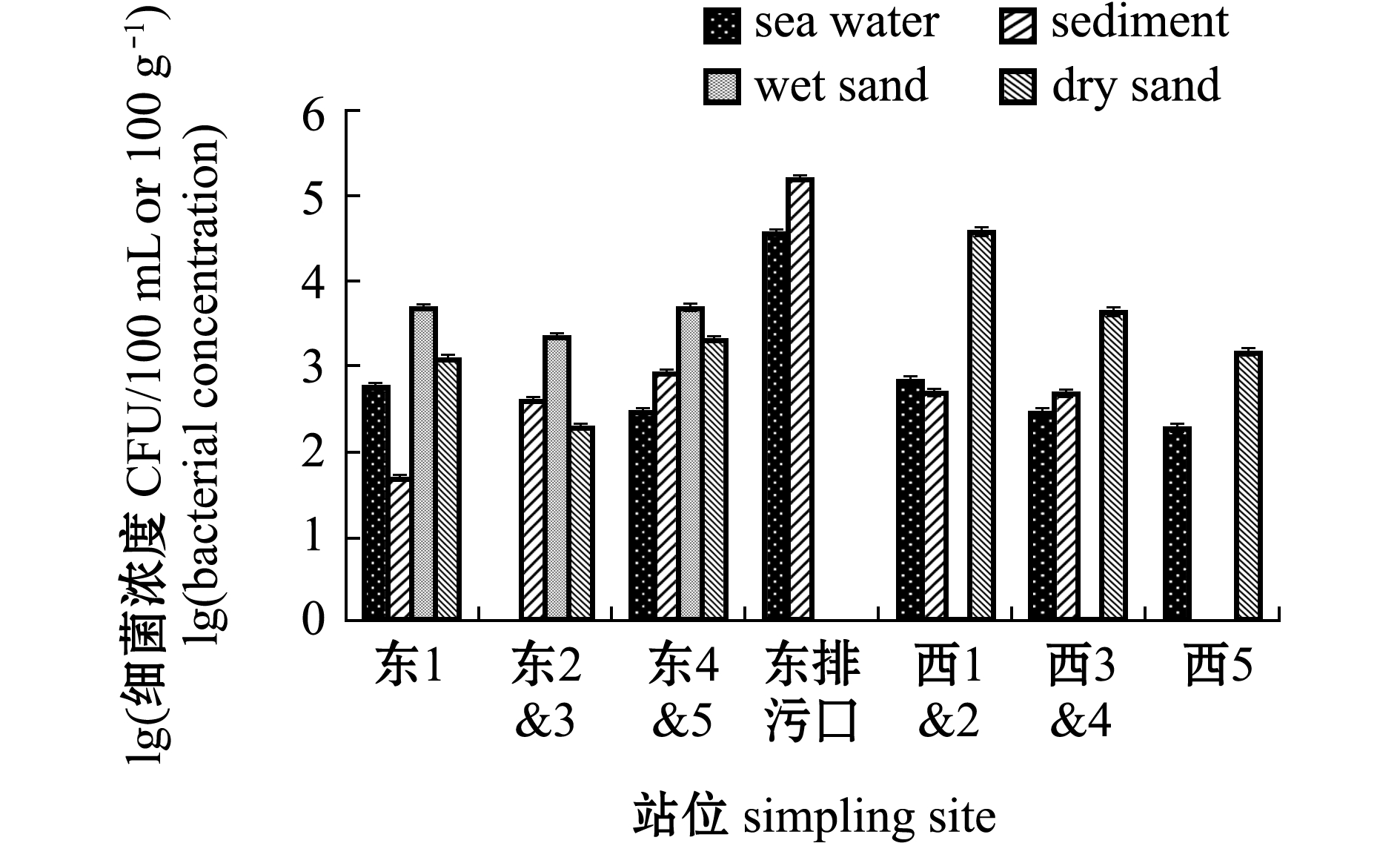
图6 金石滩浴场肠球菌分布特征
Fig.6 Distribution characteristics of Enterococcus in Jinshitan bathing beach
金石滩海水浴场金黄色葡萄球菌分布如图7所示,海水中其浓度为9.00×103~3.72×105 CFU/100 mL,沉积物中其浓度为5.00×102~4.60×103 CFU/100 g,湿砂中其浓度为4.50×102~1.10×104 CFU/100 g,干砂中其浓度为2.03×104~1.65×105 CFU/100 g。金黄色葡萄球菌在不同介质空间分布为海水>干砂>湿砂>沉积物,其中,干砂中金黄色葡萄球菌浓度接近海水中的浓度。
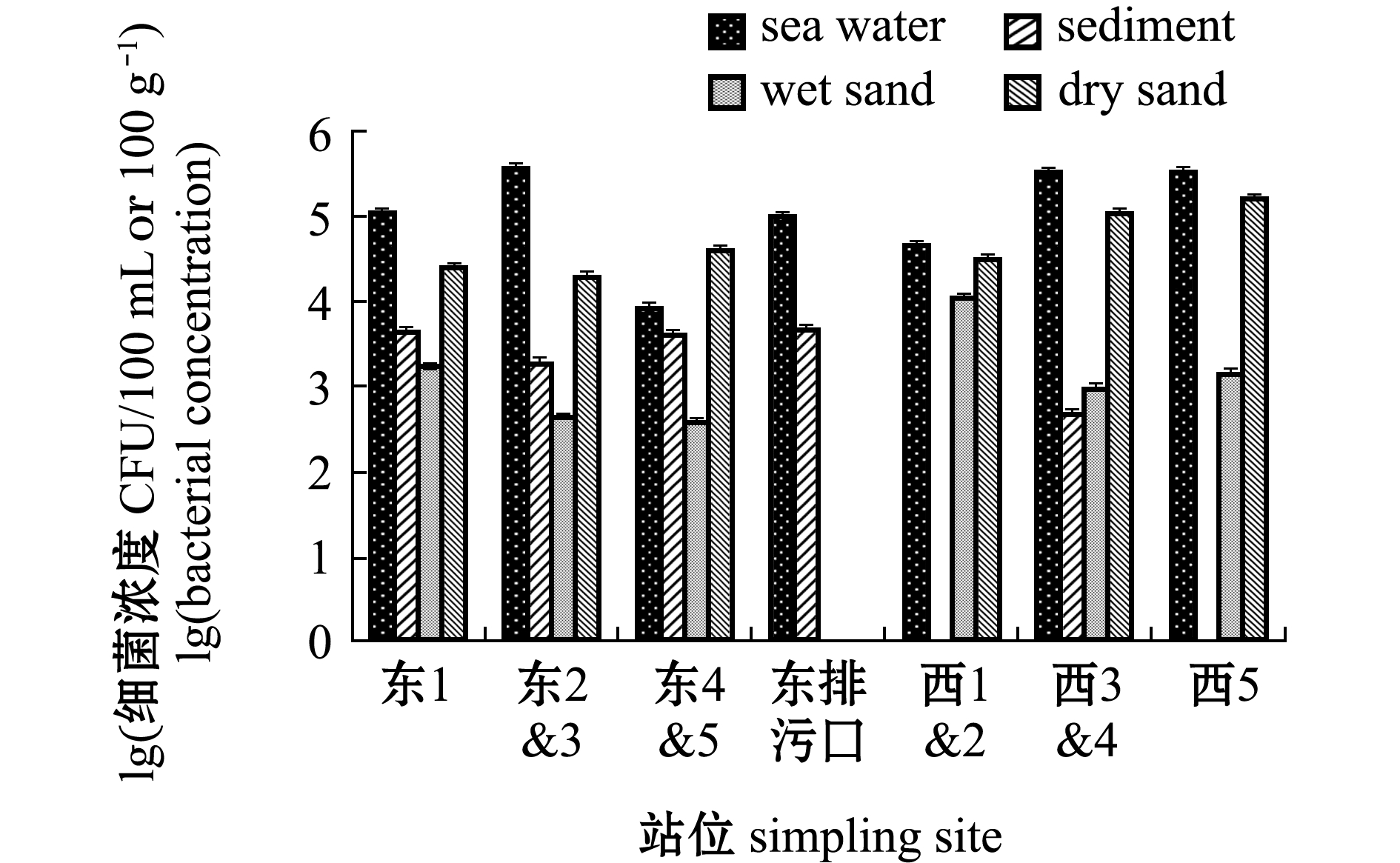
图7 金石滩浴场金黄色葡萄球菌分布特征
Fig.7 Distribution characteristics of Staphylococcus aureus in Jinshitan bathing beach
2.1.2 傅家庄海水浴场可培养细菌 傅家庄海水浴场异养细菌总数分布如图8所示,海水中其浓度为1.12×105~6.48×105 CFU/100 mL,沉积物中其浓度为1.20×103~3.92×104 CFU/100 g,湿砂中其浓度为5.00×103 ~1.24×104 CFU/100 g,干砂中其浓度为3.14×104~ 9.32×104 CFU/100 g。异养细菌在不同介质空间分布为海水>干砂>沉积物>湿砂,其中,排污口海水中异养细菌浓度最高。
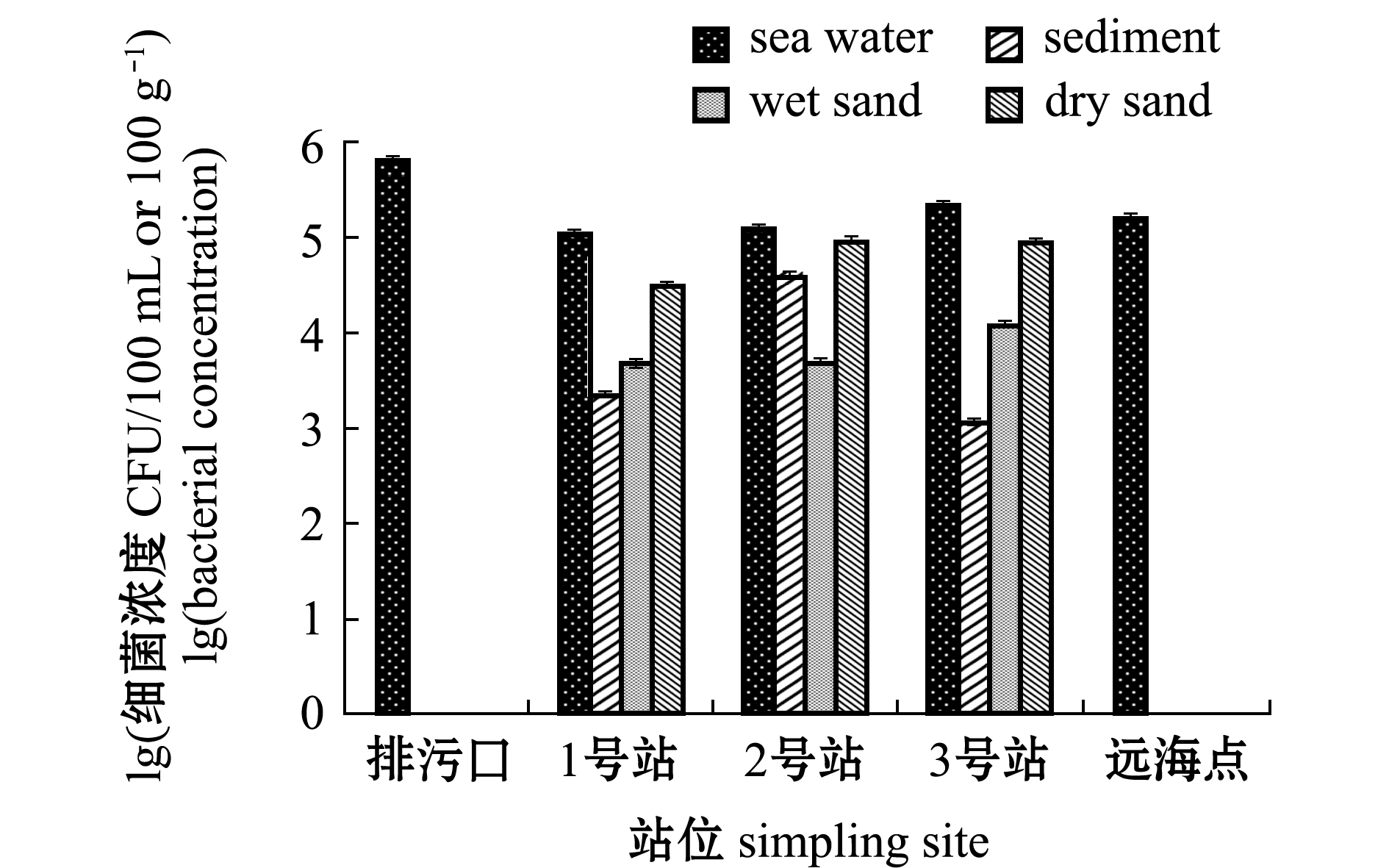
图8 傅家庄浴场异养细菌分布特征
Fig.8 Distribution characteristics of heterotrophic bacteria in Fujiazhuang bathing beach
傅家庄海水浴场弧菌分布如图9所示,海水中其浓度为1.00×103~ 7.80×105 CFU/100 mL,沉积物中其浓度为1.00×102~2.00×102 CFU/100 g,湿砂中其浓度为1.00×102 CFU/100 g,干砂中其浓度为5.0×101 CFU/100 g。可培养弧菌在不同介质空间分布为海水>沉积物>湿砂>干砂,其中,远海点海水中可培养弧菌浓度最高。

图9 傅家庄浴场弧菌分布特征
Fig.9 Distribution characteristics of Vibrio in Fujiazhuang bathing beach
傅家庄海水浴场粪大肠菌群分布如图10所示,海水中其浓度为1.20×102~1.04×105 CFU/100 mL,湿砂中其浓度为5.00×101~2.50×102 CFU/100 g,干砂中其浓度为2.00×102~6.00×102 CFU/100 g。粪大肠菌群在不同介质空间分布为海水>干砂>沉积物>湿砂,其中,排污口海水中粪大肠菌群浓度最高,海水介质中从排污口到远距离站位粪大肠菌群浓度依次递减。
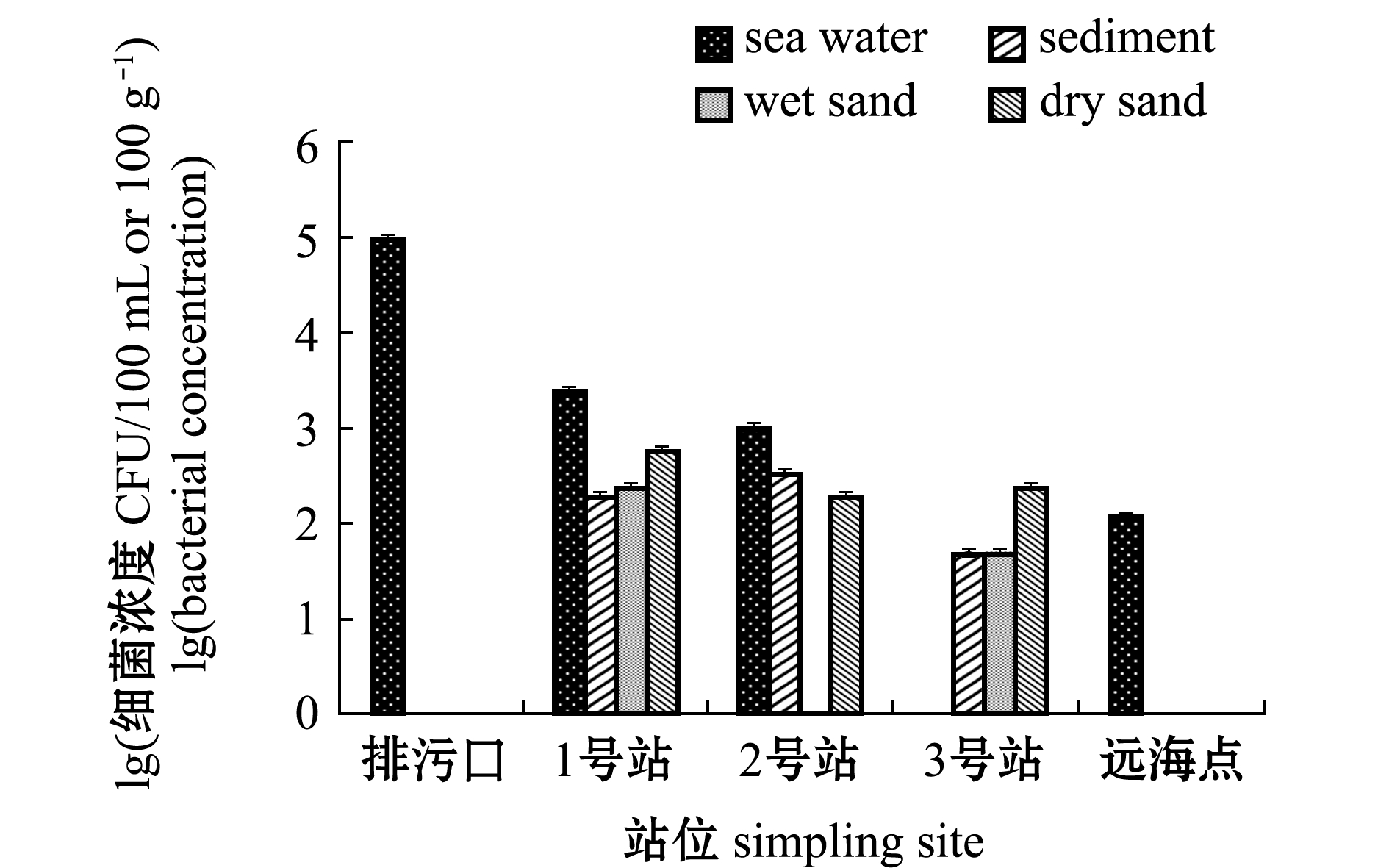
图10 傅家庄浴场粪大肠菌群分布特征
Fig.10 Distribution characteristics of fecal coliforms in Fujiazhuang bathing beach
傅家庄海水浴场肠球菌分布如图11所示,海水中其浓度为5.70×103~5.20×104 CFU/100 mL,沉积物中其浓度为2.00×103~7.50×103 CFU/100 g,湿砂中其浓度为1.00×103~2.00×103 CFU/100 g,干砂中其浓度为5.90×104~6.90×104 CFU/100 g。肠球菌在不同介质空间分布为海水>干砂>沉积物>湿砂,这与粪大肠菌的空间分布规律相似,其中,肠球菌在干砂和海水中均呈现高浓度分布。
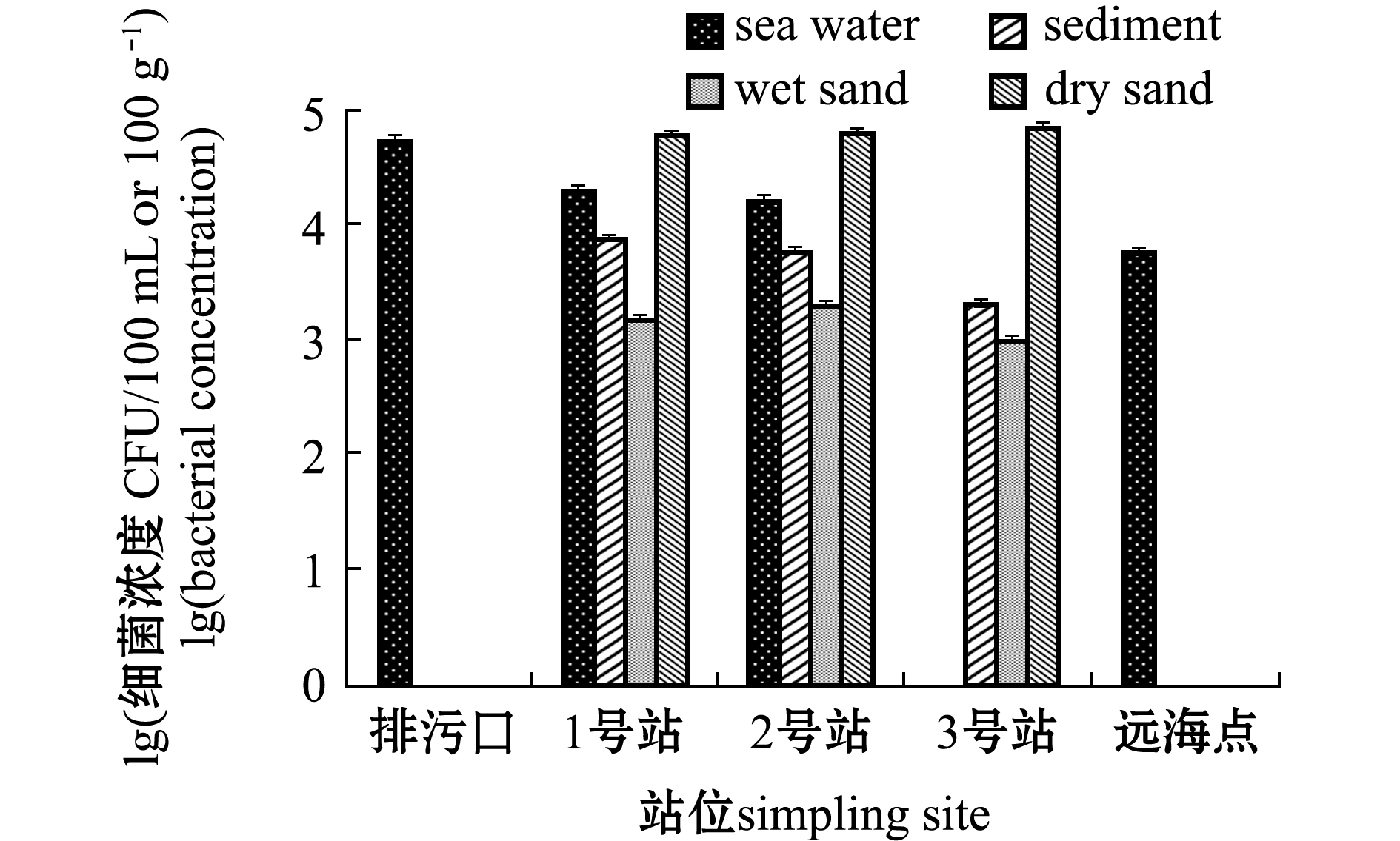
图11 傅家庄浴场肠球菌分布特征
Fig.11 Distribution characteristics of Enterococcus in Fujiazhuang bathing beach
傅家庄海水浴场金黄色葡萄球菌分布如图12所示,海水中其浓度为2.90×105~9.80×105 CFU/100 mL,沉积物中其浓度为2.50×103~5.00×103 CFU/100 g,湿砂中其浓度为9.50×103~2.95×104 CFU/100 g,干砂中其浓度为9.00×103~9.65×104 CFU/100 g。金黄色葡萄球菌在不同介质空间分布为海水>干砂>湿砂>沉积物,其中,金黄色葡萄球菌在海水和干砂中均呈现高浓度分布。
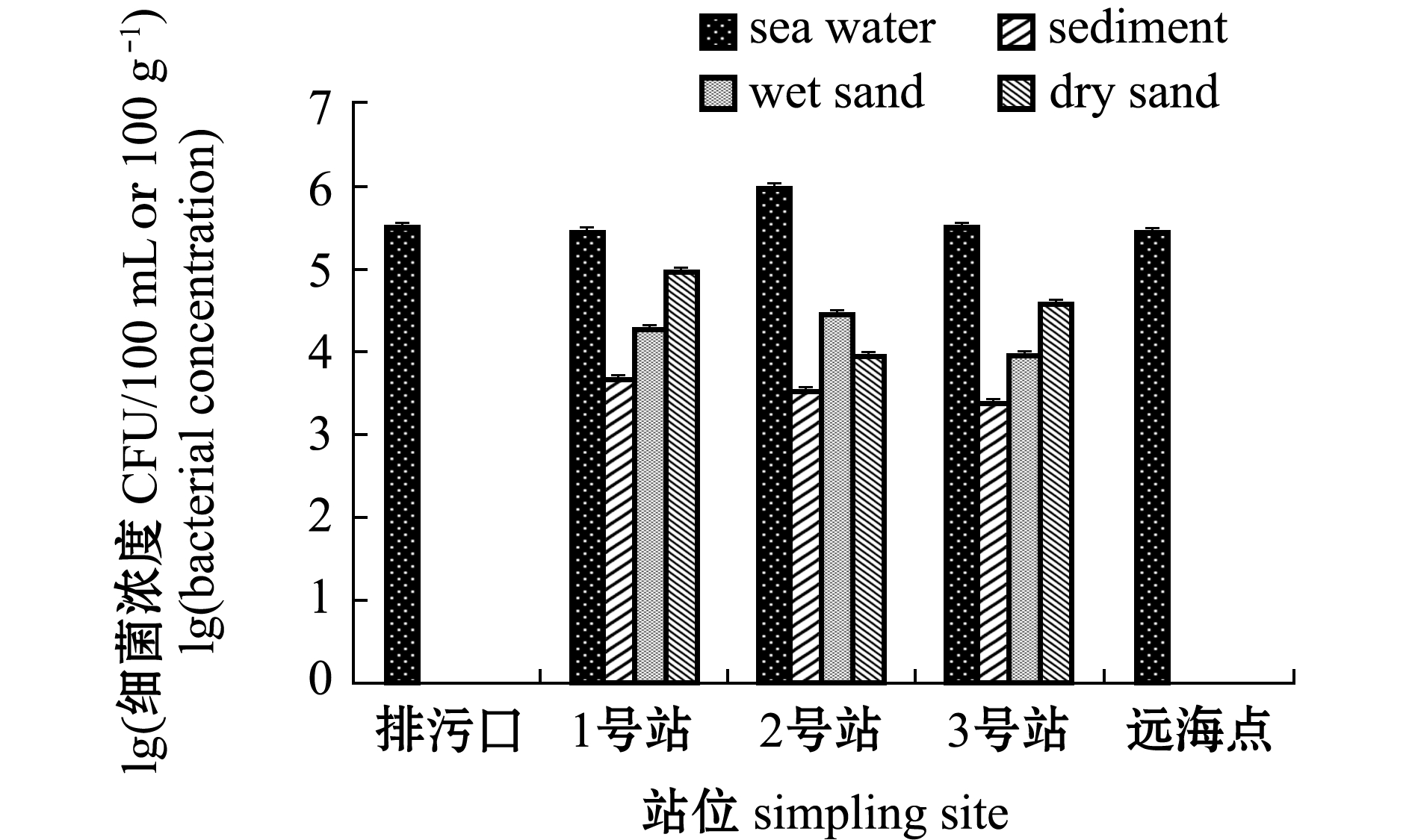
图12 傅家庄浴场金黄色葡萄球菌分布特征
Fig.12 Distribution characteristics of Staphylococcus aureus in Fujiazhuang bathing beach
2.2 可培养细菌高通量测序结果
门水平高通量测序结果显示:金石滩和傅家庄浴场主要可培养优势菌为变形菌门Proteobacteria、拟杆菌门Bacteroidetes、厚壁菌门Firmicutes、放线菌门Actinobacteria,不论金石滩海水浴场还是傅家庄浴场,变形菌门在海水、沉积物、湿砂和干砂中的丰度均较高,尤其在海水、沉积物、湿砂中占绝对优势;拟杆菌门在金石滩浴场沉积物介质中丰度最高;厚壁菌门和放线菌门在金石滩海水浴场干砂中分布具有优势(图13)。
属水平高通量测序结果显示:金石滩和傅家庄浴场干砂中可培养细菌多样性最为丰富,其次是海水;主要菌属包括弧菌属、假单胞菌属、芽孢杆菌属、克雷伯氏菌属、大肠杆菌属、志贺氏菌属等,其中,优势属为弧菌属、芽孢杆菌属、假单胞菌属等,可能的病原菌属为弧菌属、假单胞菌属、克雷伯氏菌属、大肠杆菌属、志贺氏菌属等(图14)。
2.3 病原细菌的筛选
采用基因芯片方法对两个浴场18种常见病原细菌进行了筛选,金石滩东1站位海水中的病原细菌有溶藻弧菌、粪肠球菌、气单胞菌、志贺氏菌;金石滩东1站位湿砂中检测出病原细菌为哈维弧菌;傅家庄远海点海水中检测出病原细菌有副溶血弧和大肠杆菌,代表性图片如图15所示。
2.4 粒度检测结果
金石滩浴场和傅家庄浴场海滩砂质粒度分析结果如图16所示,对主要优势菌属与砂粒度进行相关性分析显示:砂质类型对不同菌属影响不同,如弧菌属、希瓦氏菌属、假单胞菌属的主要影响因素为砾石;肠球菌属、芽孢杆菌属、Curtobacterium属、aaa34a10_norank菌属的主要影响因素为粉砂;黄杆菌科Aquibacter属、布鲁氏菌科苍白杆菌属和南极海冰细菌科尔韦尔氏菌Colwellia属的主要影响因素为砂。其中,优势病原菌菌属有弧菌属、肠球菌属、芽孢杆菌属、放线菌属等。首先,最具有优势的弧菌属主要分布在海水浴场3个湿砂站位(金石滩浴场东2&3、金石滩浴场西3&4和金石滩浴场西1&2)、2个干砂站位(金石滩浴场西5和金石滩浴场西3&4)和1个沉积物站位(金石滩浴场西1&2),这些站位的样品经检测粒度均划分为砾石等级,结果表明,弧菌与粒度为砾石的砂质相关性最强;其次,肠球菌属、芽孢杆菌属和Curtobalterium属主要分布在两大海水浴场中其余4个干砂站位(傅家庄浴场1号站、傅家庄浴场3号站、金石滩浴场东2&3和金石滩浴场西1&2)、1个湿砂站位(金石滩浴场西5)和1个沉积物站位(傅家庄浴场3号站位),这些站位的样品粒度分析结果属于粉砂级别,这表明,肠球菌属、芽孢杆菌属和Curtobalterium属与粒度为粉砂的砂质相关性最强;最后,黄杆菌科Aquibactor属主要分布在1个沉积物站位(傅家庄浴场1号)和1个湿砂站位(金石滩浴场东1),这些站位的样品经检测粒度均划分为砂等级,这表明,黄杆菌科Aquibactor属与粒度为砂的砂质相关性最强。
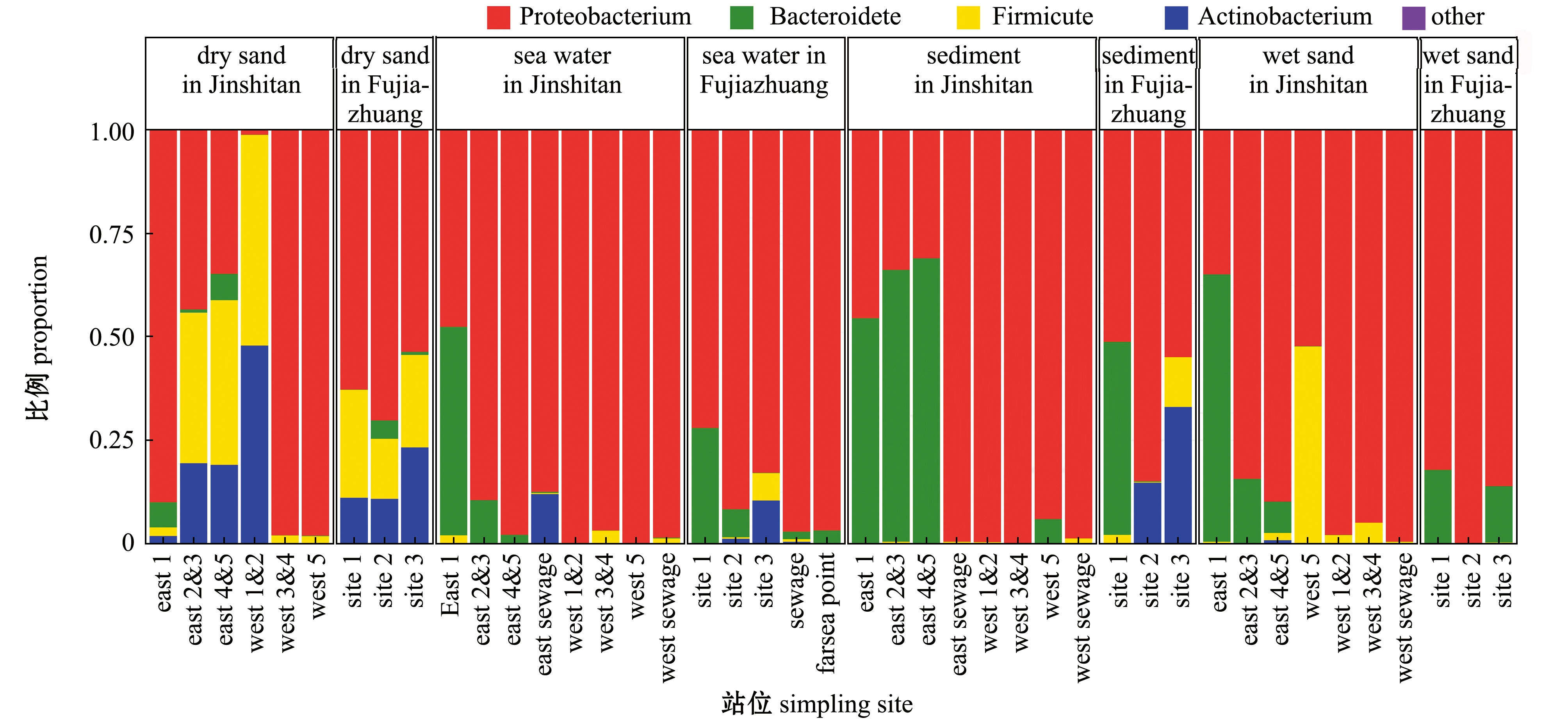
图13 门分类水平的细菌类群丰度分析
Fig.13 Abundance analysis of bacterial groups under phylum level
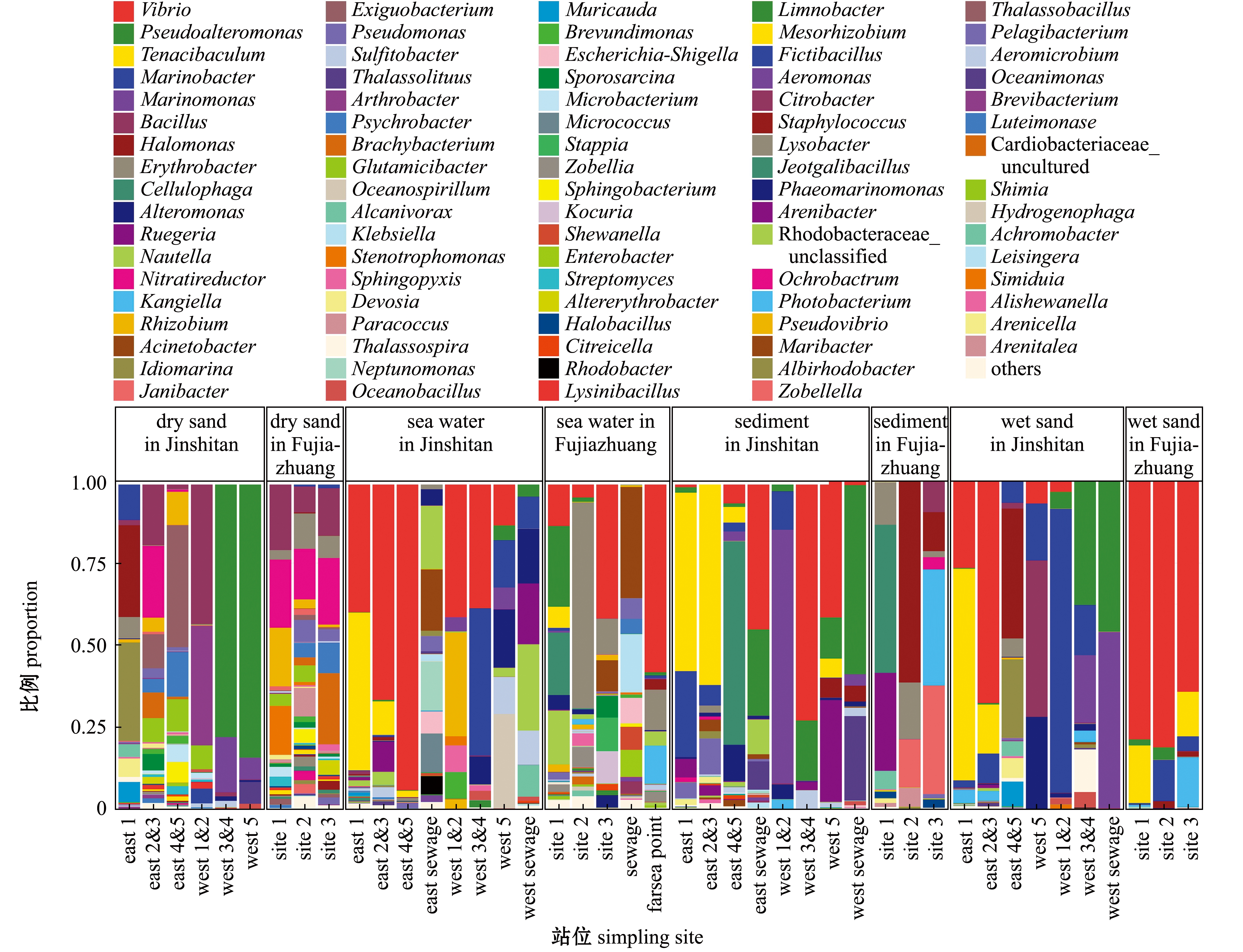
图14 属分类水平的细菌类群丰度分析
Fig.14 Abundance analysis of bacterial groups under genus level

注:左侧绿色荧光1~4依次为溶藻弧菌、粪肠球菌、气单胞菌、志贺氏菌;右侧绿色荧光5~7依次为副溶血弧菌、鳗弧菌、志贺氏菌
Note:Vibrio alginolyticus,Enterococcus faecalis, Aeromonas,and Shigella are shown in 1-4 on the green fluorescence on the left side; Vibrio parahaemolyticus, Vibrio anguillarum,and Shigella are shown in 5-7 on the green fluorescence on the right side
图15 海水浴场基因芯片检测结果
Fig.15 Result of gene chip method in the bathing water
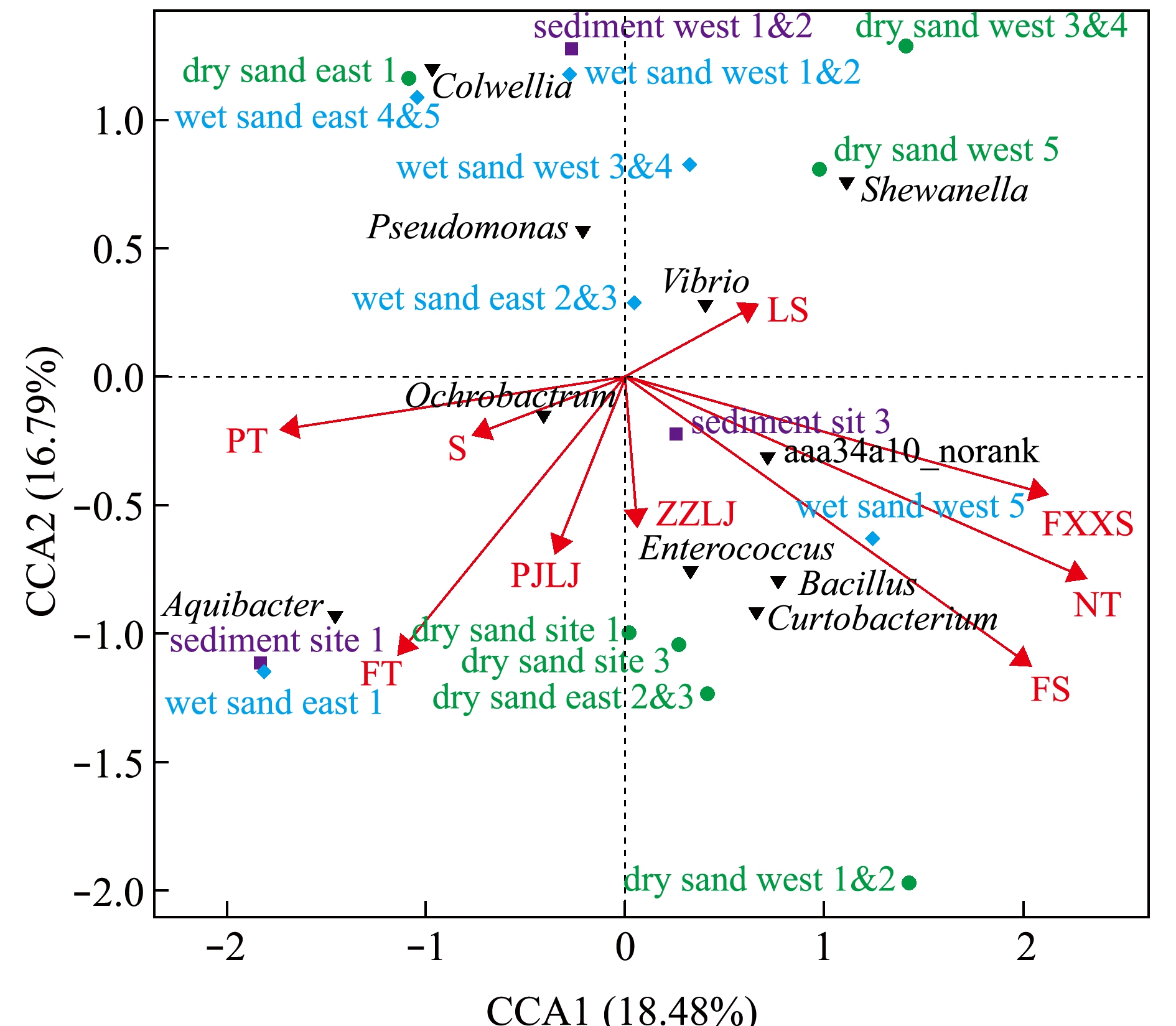
注:LS为砾石,S为砂,FS为粉砂,NT为黏土,ZZLJ为中值粒径,PJLJ为平均粒径,FXXS为分选系数,PT为偏态,FT为峰态;绿色代表干砂,蓝色代表湿砂,紫色代表沉积物;两大浴场不同站位沉积物、湿砂和干砂与粒度指标的夹角呈现锐角代表相关性为正相关
Note:LS,gravel; S,sand; FS,silt; NT,clay; ZZLJ,median diameter; PJLJ,average particle size; FXXS,sorting coefficient;PT, skewed; FT,kurtosis.The dry sand in the two large bathing beach are marked by green color,wet sand by blue, and sediment by purple.The angles between the sediments, wet sand and dry sand at different stations of the two major bathing beach and the grain size shows an acute angle indicating a positive correlation
图16 CCA粒度分析
Fig.16 CCA granularity analysis
3 讨论
3.1 海水浴场不同介质中粪便污染指示细菌的分布特征异同及其原因
金石滩浴场和傅家庄浴场4种介质中粪便污染指示菌肠球菌和粪大肠菌群具有相似的分布特征,近年来,越来越多的标准将肠球菌和粪大肠菌群作为水质等级划分的重要微生物指标[24]。2006年,欧盟委员会通过了一项新指令,将肠球菌作为欧盟海水浴场的污染指示菌[25],2012年,美国EPA修订了休闲水质标准,将肠球菌作为海水污染的唯一指示菌[26]。研究表明,沙滩中的肠球菌会影响水质监测和公共卫生[6,27],肠球菌可以暂时在海滩中生长[28-33],因此,有必要充分了解海滩中肠球菌的污染分布[34-35]。研究表明,游泳人群密度与海滩病原细菌分布密切相关[36-37],大连金石滩浴场和傅家庄浴场每天承接大量的游客,尤其是金石滩浴场,最高纪录泳季高峰期每日客流量可达10万人次,而游客的大部分时间集中在海滩上,可能带来大量的病原细菌,并随着潮汐扰动进入浴场海水。另一方面,降雨等带来的地表径流将生活污水中的病原细菌携带入海水浴场[38]。
金石滩浴场和傅家庄浴场不同站位中粪便污染指示菌肠球菌和粪大肠菌群分布特征相同点在于:两种粪便污染指示菌都在排污口浓度最高,随着海水稀释作用,向附近的站位扩散,距离排污口越远,浓度相对越低,其中傅家庄海水浴场显示,排污口浓度远高于远海点,进一步说明海水浴场受到排污口污水排放的严重影响,与金石滩海水浴场相比,傅家庄浴场粪便污染指示菌分布浓度更高,尤其是肠球菌污染更严重,分析原因可能是付家庄海水浴场坐落在大连市内,其排污口污水排放类型受人类活动影响更大。金石滩浴场和傅家庄浴场不同介质中粪便污染指示菌肠球菌和粪大肠菌群不同介质分布特征相同点在于:二者在海水和干砂中浓度均较高,推测排污口的污水排放是海水浴场重要的点源污染[39],肠球菌可能黏附在干砂、湿砂和沉积物各个介质表面[18,40-41],有利于生物膜的形成,且本研究中大部分干砂属于粉砂粒度级别,与肠球菌的分布相关性最强,推测肠球菌可以在干砂中生长繁殖[42]。本研究表明,整体来看两大浴场干砂中粪便污染指示菌浓度较高,对游客健康存在潜在威胁,为更好地反映娱乐水域公共卫生安全状况,建议在监测娱乐浴场海水中指示菌的同时,增加海滩干砂这一重要介质的监测。
3.2 海水浴场不同介质中重要病原细菌金黄色葡萄球菌和弧菌的分布特征
本研究表明,金石滩浴场和傅家庄浴场金黄色葡萄球菌在海水介质中浓度最高,干砂中次之。Ghinsberg等[38]研究发现,金黄色葡萄球菌随着地表径流被携带入海水,致使美国好莱坞海水浴场金黄色葡萄球菌在干砂中的数量高于海水。大连海水浴场中该菌则是海水中普遍更高,分析原因可能是大连海水浴场主要受排污口影响,而美国好莱坞海水浴场没有排污口这一点源污染来源,进一步说明,排污口是金石滩、傅家庄浴场主要的点源污染来源,其次,也不排除海滩尤其是干砂是近海娱乐水域病原细菌重要的非点源污染来源。
金石滩浴场和傅家庄浴场弧菌在海水介质中分布浓度最高,随着潮汐、海浪等作用因素将其携带到沉积物、湿砂中。粒度分析表明,弧菌在砾石中的分布最占优势,这可能与沉积物最靠近海水有关,且砾石中值粒径大,推测其有利于弧菌附着;弧菌在海水介质中高浓度分布,这个占比结果和高通量测序结果一致,从海水到沉积物到湿砂再到干砂,整体上呈浓度递减的趋势。尽管弧菌为海洋环境中土著菌,与陆源粪便污染无关[43],但本研究中数据显示,弧菌在排污口(除远海点外的其他海水站位)呈现高浓度分布趋势,推测排污口是影响近岸弧菌在娱乐海水浴场分布的污染来源之一,但是相关性分析表明,其浓度与粪便污染指示菌的时空分布并不相关。在娱乐海水浴场日常监测时,由于粪便污染指示菌不能指示弧菌的污染,而弧菌是人体健康重要的病原菌,因此,为更好地反映公共卫生安全状况,在监测粪便污染指示菌时,建议增加弧菌这一重要指标。
3.3 病原细菌的污染及其危害
用基因芯片筛选出的病原细菌主要存在于近海岸的海水和沉积物中,大部分是引起食源性疾病的主要病原菌[44],该结果是对可培养病原细菌和高通量测序结果的重要补充,本研究中检测出的病原细菌有溶藻弧菌、副溶血弧菌、哈维弧菌、鳗弧菌、粪肠球菌、气单胞菌、志贺氏菌和大肠杆菌,其中,副溶血弧菌是革兰阴性嗜盐性细菌,隶属弧菌科中的弧菌属,是一种人畜共患病原菌,可致患者出现腹泻、肠痉挛、恶心、呕吐和发烧等典型胃肠炎反应[45];嗜水气单胞菌在自然界广泛分布,是一种典型的人-畜-鱼共患病原菌,人类可因致病性嗜水气单胞菌感染而发生腹泻、食物中毒、继发感染[46];志贺氏菌属会引起痢疾,是一种在全世界范围内流行的传染病。这些病原细菌的存在,会潜在威胁娱乐用水人群的健康[47-49]。因此,建议海滩管理者在泳季高峰期定期监测海滩病原细菌的污染情况,尤其是排污口周围病原细菌的分布。在这两个浴场中,只有部分站位检出了病原细菌,分析原因可能是一方面这些区域未被所分析的病原细菌污染,另一方面也有可能是样品病原细菌荧光信号值低于基因表达值下限或者高于其上限[50]。
4 结论
(1) 傅家庄浴场、金石滩浴场变形菌门、厚壁菌门等为优势菌,不同浴场常见病原细菌组成相近,病原细菌的浓度在不同空间(傅家庄、金石滩浴场)分布有所差异。金石滩浴场可培养细菌浓度高于傅家庄浴场,但粪便污染指示菌整体呈现傅家庄浴场更高的趋势。
(2) 不同浴场海水中肠球菌和粪大肠菌群的空间分布相似,其在傅家庄和金石滩浴场都在排污口附近海水和干砂中高浓度分布,推测排污口是主要的点源污染来源,建议在监测娱乐浴场海水中指示菌的同时,为更好地反映娱乐海滩公共卫生安全状况,增加海滩干砂这一重要介质的监测。
(3) 由于粪便污染指示菌不能指示弧菌的污染,而弧菌是人体健康重要的病原菌,因此,建议在监测粪便污染指示菌的同时,增加弧菌这一重要指标。
[1] 张振冬,王秀娟,朱琳.海洋环境中病原微生物不同检测方法的比较研究[J].海洋环境科学,2011,30(2):292-295.
[2] Esiobu N,Mohammed R,Echeverry A,et al.The application of peptide nucleic acid probes for rapid detection and enumeration of eubacteria,Staphylococcus aureus and Pseudomonas aeruginosa in recreational beaches of S.Florida[J].J Microbiol Meth,2004,57(2):157-162.
[3] Bonilla T D,Nowosielski K,Esiobu N,et al.Species assemblages of Enterococcus indicate potential sources of fecal bacteria at a South Florida recreational beach[J].Mar Pollut Bull,2006,52(7):807-810.
[4] Hartz A,Cuvelier M,Nowosielski K,et al.Survival potential of Escherichia coli and enterococci in subtropical beach sand:implications for water quality managers[J].J Environ Qual,2008,37(3):898-905.
[5] Yamahara K M,Walters S P,Boehm A B.Growth of enterococci in unaltered,unseeded beach sands subjected to tidal wetting[J].Appl Environ Microbiol,2009,75(6):1517-1524.
[6] Heaney C D,Sams E,Wing S,et al.Contact with beach sand among beachgoers and risk of illness[J].Am J Epidemiol,2009,170(2):164-172.
[7] 李江宇,樊景凤,穆贵强,等.利用PCR-DGGE分析海水浴场细菌多样性[J]. 海洋环境科学,2013,32(4):523-528.
[8] 郭建丽.海水浴场常见致病菌PCR方法和基因芯片检测方法的建立及应用[D].大连:大连海洋大学,2014.
[9] ISO.ISO 7899-2-2000 Water quality-detection and enumeration of intestinal enterococci-Part 2:membrane filtration method[S].Geneva,Switzerland:ISO,2000.
[10] United States Environmental Protection Agency.EPA 440/5-84-002 ambient water quality criteria for bacteria[S].Washington,DC:Office of Water Regulations and Standards Criteria and Standards Division,1986.
[11] 国家环境保护局,国家海洋局.GB 3097-1997海水水质标准[S].北京:环境科学出版社,2004.
[12] 国家海洋局.GB/T 12763.9-2007海洋调查规范 第9部分:海洋生态调查指南[S].北京:中国标准出版社,2008.
[13] 国家海洋环境监测中心.GB17378.4-2007海洋监测规范第4部分:海水分析[S].北京:中国标准出版社,2008.
[14] 国家海洋局.HY/T 127-2010滨海旅游度假区环境评价指南[S].北京:中国标准出版社,2010.
[15] Enns A A,Vogel L J,Abdelzaher A M,et al.Spatial and temporal variation in indicator microbe sampling is influential in beach management decisions[J].Water Res,2012,46(7):2237-2246.
[16] Alm E W,Burke J,Hagan E.Persistence and potential growth of the fecal indicator bacteria,Escherichia coli,in shoreline sand at Lake Huron[J].J Great Lakes Res,2006,32(2):401-405.
[17] Boehm A B,Ashbolt N J,Colford Jr J M,et al.A sea change ahead for recreational water quality criteria[J].J Water Health,2009,7(1):9-20.
[18] Charoenca N,Fujioka R S.Association of staphylococcal skin infections and swimming[J].Water Sci Technol,1995,31(5-6):11-17.
[19] Elmir S M,Wright M E,Abdelzaher A,et al.Quantitative evaluation of bacteria released by bathers in a marine water[J].Water Res,2007,41(1):3-10.
[20] Plano L R W,Garza A C,Shibata T,et al.Shedding of Staphylococcusaureus and methicillin-resistant Staphylococcus aureus from adult and pediatric bathers in marine waters[J].BMC Microbiol,2011,11:5.
[21] Abdelzaher A M,Wright M E,Ortega C,et al.Daily measures of microbes and human health at a non-point source marine beach[J].Journal of Water and Health,2011,9(3):443-457.
[22] Halliday E,Griffith J F,Gast R J.Use of an exogenous plasmid standard and quantitative PCR to monitor spatial and temporal distribution of Enterococcus spp.in beach sands[J].Limnol Oceanogr:Methods,2010,8(4):146-154.
[23] Scholthof K B G.The disease triangle:pathogens,the environment and society[J].Nat Rev Microbiol,2007,5(2):152-156.
[24] Bonilla T D,Nowosielski K,Cuvelier M,et al.Prevalence and distribution of fecal indicator organisms in South Florida beach sand and preliminary assessment of health effects associated with beach sand exposure[J].Mar Pollut Bull,2007,54(9):1472-1482.
[25] Cui Henglin,Yang Kun,Pagaling E,et al.Spatial and temporal variation in enterococcal abundance and its relationship to the microbial community in Hawaii Beach Sand and water[J].Appl Environ Microbiol,2013,79(12):3601-3609.
[26] USEPA.Recreational water quality criteria[R].Washington,DC:USEPA,2012.
[27] Heaney C D,Sams E,Dufour A P,et al.Fecal indicators in sand,sandcontact,and risk of enteric illness among beachgoers[J].Epidemiology,2012,23(1):95-106.
[28] Ishii S,Hansen D L,Hicks R E,et al.Beach sand and sediments are temporal sinks and sources of Escherichia coli in Lake Superior[J].Environ Sci Technol,2007,41(7):2203-2209.
[29] Clark A,Turner T,Dorothy K P,et al.Health hazards due to pollution of waters along the coast of Visakhapatnam,east coast of India[J].Ecotoxicol Environ Saf,2003,56(3):390-397.
[30] Esiobu N,Green M,Echeverry A,et al.High numbers of Staphylococcus aureus at three bathing beaches in South Florida[J].Int J Environ Health Res,2013,23(1):46-57.
[31] Abreu R,Figueira C,Romão D,et al.Sediment characteristics and microbiological contamination of beach sand—A case-study in the archipelago of Madeira[J].Sci Total Environ,2016,573:627-638.
[32] Fan Jingfeng,Ming Hongxia,Li Lili,et al.Evaluating spatial-temporal variations and correlation between fecal indicator bacteria (FIB) in marine bathing beaches[J].J Water Health,2015,13(4):1029-1038.
[33] Feng Zhixuan,Reniers A,Haus B K,et al.A predictive model for microbial counts on beaches where intertidal sand is the primary source[J].Mar Pollut Bull,2015,94(1-2):37-47.
[34] Oshiro R,Fujioka R.Sand,soil,and pigeon droppings:sources of indicator bacteria in the waters of Hanauma Bay,Oahu,Hawaii[J].Water Sci Technol,1995,31(5-6):251-254.
[35] Yan Tao,Goto D K,Feng Fan.Concentration Dynamics of Fecal Indicators in Hawaii’s Coastal and Inland Sand,Soil,and Water during Rainfall Events[M].Alexandria,VA,USA.Publishing,2011.
[36] Baty III A M,Eastburn C C,Techkarnjanaruk S,et al.Spatial and temporal variations in chitinolytic gene expression and bacterial biomass production during chitin degradation[J].Appl Environ Microbiol,2000,66(8):3574-3585.
[37] Obiri-Danso K,Jones K.Intertidal sediments as reservoirs for hippurate negative campylobacters,salmonellae and faecal indicators in three EU recognised bathing waters in North West England[J].Water Res,2000,34(2):519-527.
[38] Ghinsberg R C,Bar Dov L,Rogol M,et al.Monitoring of selected bacteria and fungi in sand and sea water along the Tel Aviv coast[J].Microbios,1994,77(310):29-40.
[39] 黄宝华,陈庆森,庞广昌.志贺氏菌研究及其快速检测技术发展现状[J].食品科学,2004,25(11):333-336.
[40] Ferguson D M,Moore D F,GetrichM A,et al.Enumeration and speciation of enterococci found in marine and intertidal sediments and coastal water in southern California[J].J Appl Microbiol,2005,99(3):598-608.
[41] Burton Jr G A,Gunnison D,Lanza G R.Survival of pathogenic bacteria in various freshwater sediments[J].Appl Environ Microbiol,1987,53(4):633-638.
[42] Byappanahalli M N,Nevers M B,Korajkic A,et al.Enterococci in the environment[J].Microbiol Mol Biol Rev,2012,76(4):685-706.
[43] 郭建丽,王玥,李江宇,等.大连重要海水增养殖区粪便污染指示菌和弧菌的时空分布[J].海洋环境科学,2017,36(6):813-819.
[44] 宁喜斌,刘代新,张继伦.副溶血性弧菌的致病性及其快速检测[J].微生物与感染,2008,3(1):53-56.
[45] 刘雪飞.副溶血性弧菌拮抗菌的分离及其抑菌机理研究[D].沈阳:沈阳农业大学,2016.
[46] 杨守明,王民生.嗜水气单胞菌及其对人的致病性[J].疾病控制杂志,2006,10(5):511-514.
[47] Halliday E,Gast R J.Bacteria in beach sands:an emerging challenge in protecting coastal water quality and bather health[J].Environ Sci Technol,2011,45(2):370-379.
[48] Abbott S L,Janda J M,Johnson J A,et al.Vibrio and related organisms[M]//Murray P R,Baron E J,Jorgensen J H,et al.Manual of Clinical Microbiology.9th ed.Washington:American Society for Microbiology,2007:723-733.
[49] Sobrinho P D S C,Destro M T,Franco B D G M,et al.Occurrence and distribution of Vibrio parahaemolyticus in retail oysters in Sao Paulo State,Brazil[J].Food Microbiol,2011,28(1):137-140.
[50] Li Cheng,Wong W H.Model-based analysis of oligonucleotide arrays:expression index computation and outlier detection[J].ProcNatl Acad Sci USA,2001,98(1):31-36.