益生菌制剂是一种无毒副作用、无耐药性,并在一定浓度范围内促进养殖动物生长的微生物制剂,对其合理应用可以减少或替代抗生素类等药物的使用,可成为未来水产养殖领域病害防治的一种主要手段[1-4]。目前,中国已批准部分益生菌制剂品种在养殖业和饲料业中应用,主要包括芽孢杆菌类、乳酸菌类和光合细菌类。益生菌的作用对养殖动物及养殖环境均具有针对性,且功能性益生菌在水产养殖业逐渐被认可,其多样化不仅可提高饲料的转化率,还可提高养殖动物自身内源酶的活性,从机体免疫系统、肠道系统等方面增强抵抗外界病害的能力[1,5-8]。
虹鳟Oncorhynchus mykiss是中国北方水产养殖的优良品种之一,是重要的经济型、冷水型鱼类,在生态习性、生长特点、养殖方法等方面独具特色,是网箱养殖、工厂化养殖及渔业增殖放流等的理想品种。随着虹鳟养殖规模的不断扩大,配合饲料、生物饲料的需求日益增多,而市场供给比较单一,且供不应求。目前,关于益生菌制剂对虹鳟机体的影响及在虹鳟养殖过程中的应用研究较少,本研究中通过在虹鳟基础饲料中添加丁酸梭菌Clostridium butyricum和凝结芽孢杆菌Bacillus coagulans,探讨了其对虹鳟生长性能、肝功能及肠道菌群的影响,以期为益生菌制剂在虹鳟养殖中的应用提供理论参考,也为新型饲料添加剂开发提供数据资料。
1 材料与方法
1.1 材料
试验用虹鳟购自日照市万泽丰渔业有限公司,初始体质量为(73.0 ±2.0)g。
丁酸梭菌、凝结芽孢杆菌购自中国普通微生物菌种保藏管理中心(CGMCC),通过PYG培养基(多胨5.0 g、胰胨5.0 g、酵母提取物10.0 g、葡萄糖10.0 g、盐溶液40.0 mL、蒸馏水960.0 mL、琼脂15.0 g,pH 7.2,其中盐溶液包含CaCl2 0.2 g、MgSO4·7H2O 0.4 g、K2HPO4 1.0 g、KH2PO41.0 g、NaHCO3 10.0 g、NaCl 2.0 g、蒸馏水1.0 L)和营养肉汁培养基(蛋白胨10.0 g、牛肉浸取物3.0 g、NaCl 5.0 g、蒸馏水1.0 L,pH 7.0)活化,于-80 ℃下保存备用。
基础饲料购自北京汉业科技有限公司,其营养水平如表1所示。
保存菌株通过大豆蛋白胨肉汤培养基(TSB) 于30 ℃条件下过夜培养,然后将活化的菌液均匀喷洒到基础饲料中,再取适量的蛋清液均匀地包裹制备好的试验饲料,于阴凉处晾干、备用。丁酸梭菌和凝结芽孢杆菌饲料中菌浓度分别为7.35×109、2.4×109 CFU/kg。
表1 基础日粮组成及主要营养成分(干物质基础)
Tab.1 Ingredients and approximate compositions of the basal diet
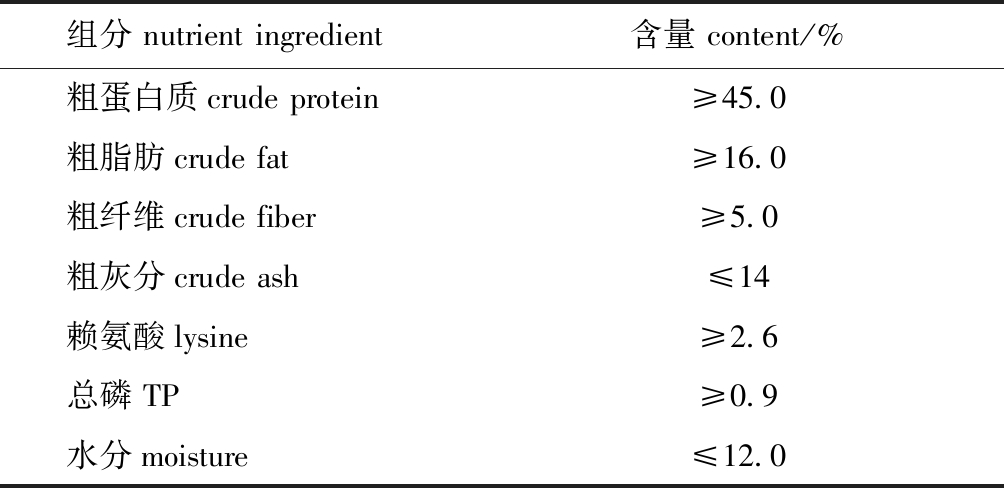
组分 nutrient ingredient含量 content/%粗蛋白质crude protein≥45.0粗脂肪crude fat≥16.0粗纤维crude fiber≥5.0粗灰分crude ash≤14赖氨酸lysine≥2.6总磷 TP≥0.9水分moisture≤12.0
1.2 方法
1.2.1 试验设计 试验在山东省海洋生物研究院养殖实验室进行,时间为2017年11月7日—12月17日,周期为40 d。选取初始体质量为(73.0 ±2.0)g 的虹鳟,随机分成4组,每组设3个重复,每个重复放20尾鱼,饲养于水族箱(80 cm×50 cm×60 cm)中,试验前用基础饲料喂养1周,适应环境后开始试验。对照组(T0)饲喂基础饲料;试验处理组1(T1)饲喂添加丁酸梭菌(7.35×109 CFU/kg)的饲料;试验处理组2(T2)饲喂添加凝结芽孢杆菌(2.4×109 CFU/kg)的饲料;试验处理组3(T3)饲喂添加丁酸梭菌(7.35×109 CFU/kg)和凝结芽孢杆菌(2.4×109 CFU/kg)混合菌的饲料。
1.2.2 饲养管理 试验过程中每天排污,换水量为总水量的1/2;每天10:00、18:00 投喂,日投喂量为试验鱼体质量的2%,并根据摄食情况适当调整投喂量,达到饱食投喂,无残饵剩余。试验期间水温为(11.5±1.0)℃,溶氧为(7.0±0.5) mg/L,pH 为7.2±0.3。
1.2.3 样品采集 饲养试验结束后,随机从每个重复中抽取3尾虹鳟,从尾静脉处采血,将血液迅速置入离心管后于4 ℃下放置6 h,以5000 r/min离心15 min,取血清备用。
从每个重复中随机抽取3尾虹鳟,在无菌条件下,冰上解剖取其前中肠样品,用无菌预冷生理盐水冲洗、无菌棉球擦拭干燥后,于-80 ℃下保存备用;分别取其背部白肌150 g左右,剪碎成均匀的混合物以测定试验虹鳟肌肉中水分、粗蛋白质、粗脂肪和粗灰分含量;分别取其肝脏样品,置于无菌离心管内待测肝指数。
1.2.4 指标的测定与计算
(1)生长性能。40 d的养殖试验结束后,停食1 d,对每个重复中的虹鳟进行称重(终末体质量),计算特定生长率(SGR,%/d)和饲料系数(FCR),其计算公式为
SGR=100%×(lnWt-lnW0)/t,
(1)
FCR=F/(Wt-W0)。
(2)
其中: W0和Wt分别为试验虹鳟初始和终末体质量(g);F为饲料摄入量(g);t为试验时间(d)。
(2)体成分。采用105 ℃恒重法( GB/T 6435-86)、凯氏定氮法(GB/T 5009.5—2016)、氯仿-甲醇抽提法(GB/T 5009.6—2016)、550 ℃灰化法(GB/T 5009.4—2016)分别测定虹鳟肌肉中水分、粗蛋白质、粗脂肪和粗灰分含量。
(3)肝功能。使用南京建成生物工程研究所试剂盒微板法测定血清谷草转氨酶(GOT)、腺苷脱氨酶(ADA)活性、γ-谷氨酰转肽酶(γ-GT)活性、胆碱酯酶(CHE)活性和总胆红素(TBiL)浓度,均按照试剂盒说明书操作。采集肝脏后,立即称取湿质量,计算肝指数,计算公式为
肝指数=肝质量(g)/体质量(g)。
(4)肠道微生物。利用QUAGEN 试剂盒提取肠道样品内容物基因组DNA,扩增高可变区(引物319F、806R);通过杭州联川生物技术股份有限公司IlluminaMiSeq 2×300 bp paired-end测序平台进行分析,包括数据优化及序列统计、OTU(Operational Taxonomy Unit)分析、丰度及Alpha多样性分析(Shannon、Simpson、Chao1指数),并在门水平上对不同菌群分布的均匀度进行统计。
1.3 数据处理
试验数据均用平均值±标准误差(mean±S.E.)表示,采用SPSS 17.0软件进行单因素方差分析(One-way ANOVA),采用Duncan法进行组间多重比较,显著性水平设为0.05。
2 结果与分析
2.1 丁酸梭菌、凝结芽孢杆菌对虹鳟机体生长性能的影响
从表2可见:益生菌组终末体质量和特定生长率均显著高于对照组(P<0.05),饲料系数均显著低于对照组(P<0.05),且T1、T3组效果较好。
表2 丁酸梭菌、凝结芽孢杆菌对虹鳟生长性能的影响
Tab.2 Effect of Clostridium butyricum and Bacillus coagulans on growth performance of rainbow trout Oncorhynchus mykiss
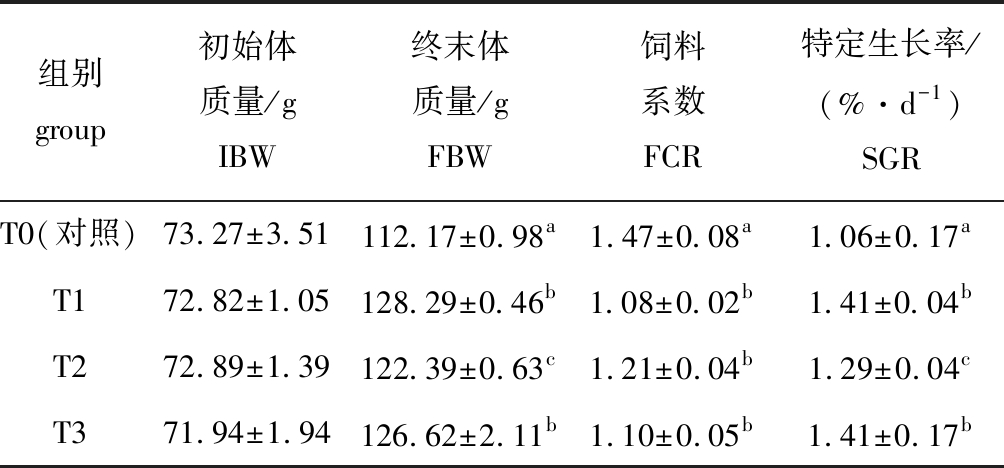
组别 group初始体质量/gIBW终末体质量/gFBW饲料系数FCR特定生长率/(%·d-1)SGRT0(对照)73.27±3.51112.17±0.98a1.47±0.08 a1.06±0.17 aT172.82±1.05128.29±0.46b1.08±0.02 b1.41±0.04 bT272.89±1.39122.39±0.63c1.21±0.04b1.29±0.04cT371.94±1.94126.62±2.11b1.10±0.05b1.41±0.17b
注:同列中标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同
Note:The means with different letters within the same column are significantly different among the groups at the 0.05 probability level, and the means with the same letters within the same column are not significant differences, et sequentia
2.2 丁酸梭菌、凝结芽孢杆菌对虹鳟体成分的影响
从表3可见:T3组中虹鳟肌肉粗蛋白质、粗脂肪含量较对照组有显著性提高(P<0.05);不同处理组中灰分和水分含量均无显著性差异(P>0.05)。
表3 丁酸梭菌、凝结芽孢杆菌对虹鳟体成分的影响
Tab.3 Effect of Clostridium butyricum Bacillus coagulans on body composition of rainbow trout Oncorhynchus mykissw/%
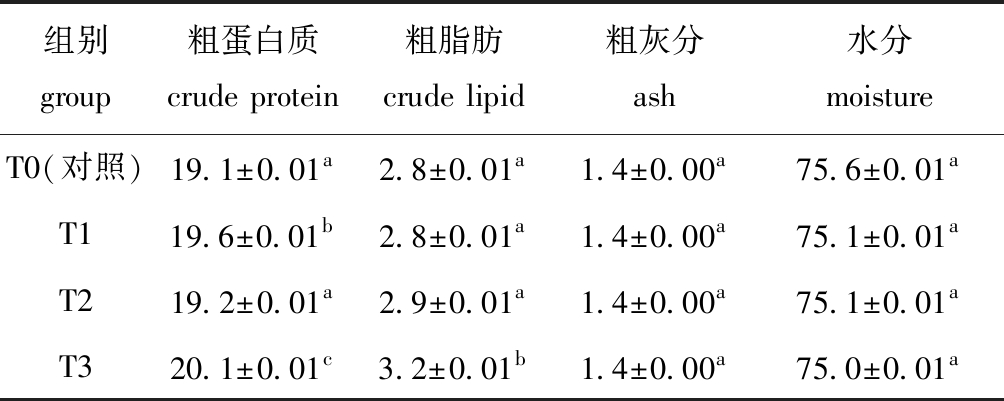
组别group粗蛋白质crude protein粗脂肪crude lipid粗灰分ash水分moistureT0(对照)19.1±0.01a2.8±0.01 a1.4±0.00 a75.6±0.01aT119.6±0.01b2.8±0.01 a1.4±0.00 a75.1±0.01 aT219.2±0.01a2.9±0.01 a1.4±0.00 a75.1±0.01 aT320.1±0.01c3.2±0.01b1.4±0.00 a75.0±0.01 a
2.3 丁酸梭菌、凝结芽孢杆菌对虹鳟肝功能的影响
从表4中可见:益生菌组GOT活性均较对照组显著降低(P<0.05),其中,T3组降低了近50%;T1、T3组ADA活性较对照组显著降低(P<0.05),T2组与对照组无显著性差异(P>0.05);益生菌组γ-GT活性均较对照组显著降低(P<0.05),T3组最低;益生菌组CHE活性总体呈现升高趋势,其中,T2组最高,T3组次之,均显著高于对照组(P<0.05);益生菌组总胆红素含量均显著低于对照组(P<0.05),T3组最低;各益生菌组间肝指数及与对照组间均有显著性差异(P<0.05)。
2.4 丁酸梭菌、凝结芽孢杆菌对虹鳟肠道微生物的影响
从表5可见:相似性大于97%的OTU数量由于丁酸梭菌、凝结芽孢杆菌的应用发生了变化,序列间相似度提高,对照组OTU数量最多,为4900,T3组OTU数量较少,为2601;Chao1指数代表群落丰富度,T3组为166.14,明显高于对照组和T2组;Shannon、Simpson指数与群落多样性指数呈正比,T3组指数值均为最高,分别为4.69、0.84。
表4 丁酸梭菌、凝结芽孢杆菌对虹鳟肝功能的影响
Tab.4 Effect of Clostridium butyricum and Bacillus coagulans on hepatic function of rainbow trout Oncorhynchus mykiss
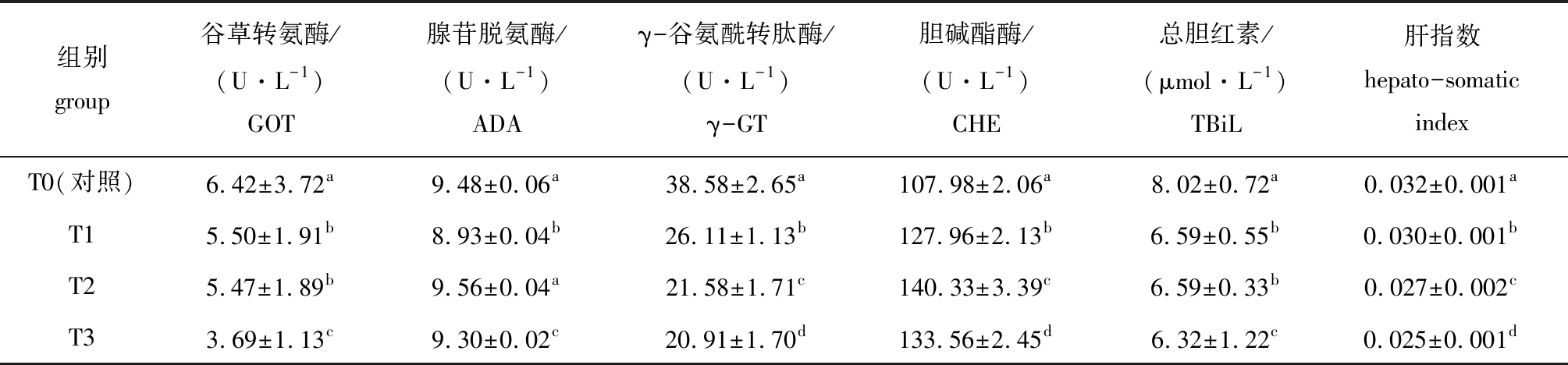
组别group谷草转氨酶/(U·L-1)GOT腺苷脱氨酶/(U·L-1)ADAγ-谷氨酰转肽酶/(U·L-1)γ-GT胆碱酯酶/(U·L-1)CHE总胆红素/(μmol·L-1)TBiL肝指数hepato-somaticindexT0(对照)6.42±3.72a9.48±0.06a38.58±2.65a107.98±2.06a8.02±0.72a0.032±0.001aT15.50±1.91b8.93±0.04b26.11±1.13b127.96±2.13b6.59±0.55b0.030±0.001bT25.47±1.89b9.56±0.04a21.58±1.71c140.33±3.39c6.59±0.33b0.027±0.002cT33.69±1.13c9.30±0.02c20.91±1.70d133.56±2.45d6.32±1.22c0.025±0.001d
对不同处理组虹鳟肠道内容物样品中细菌门类统计显示:优势菌门类包括蓝菌门Cyanobacteria、变形菌门Proteobacteria、厚壁菌门Firmicutes、拟杆菌门Bacteroidetes、放线菌门Actinobacteria、疣微菌门Verrucomicrobia和梭杆菌门Fusobacteria,各组比例最高的为蓝菌门;T2和T3组变形菌门比例明显降低,而厚壁菌门、拟杆菌门比例明显提高;T1和T3组梭杆菌门比例明显提高(表6)。
表5 不同处理组肠道样品的多样性统计
Tab.5 Diversity indices of gut microflora in different treatments
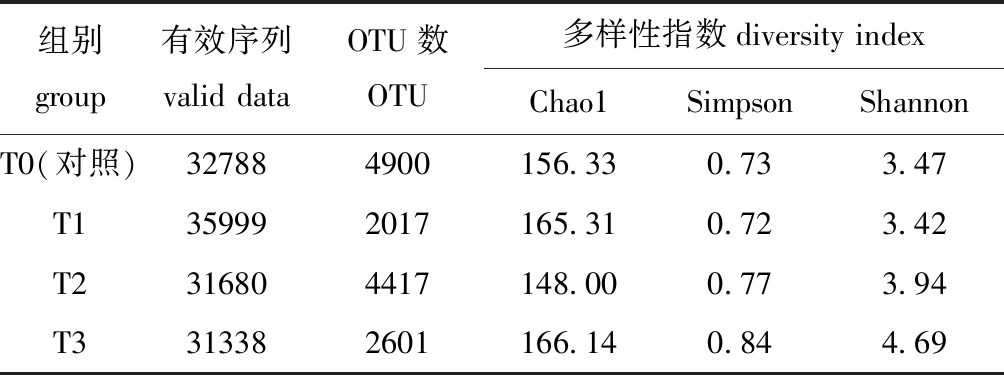
组别group有效序列valid dataOTU数 OTU多样性指数diversity index Chao1SimpsonShannonT0(对照)327884900156.330.733.47T1359992017165.310.723.42T2316804417148.000.773.94T3313382601166.140.844.69
表6 不同处理组肠道样品细菌门水平及其相对丰度百分比
Tab.6 Percent aboundance of microbial communities in phylum level from different treatments %
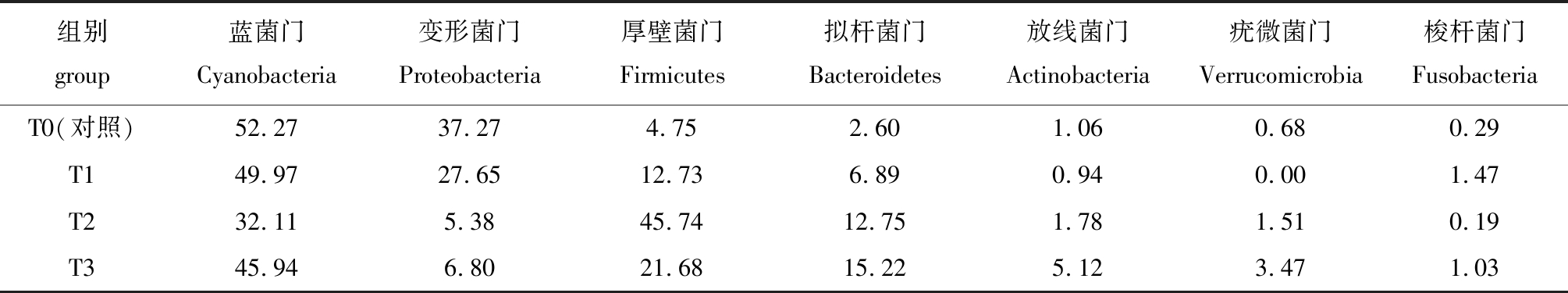
组别group 蓝菌门Cyanobacteria变形菌门Proteobacteria厚壁菌门Firmicutes拟杆菌门Bacteroidetes放线菌门Actinobacteria疣微菌门Verrucomicrobia梭杆菌门FusobacteriaT0(对照)52.2737.274.752.601.060.680.29T149.9727.6512.736.890.940.001.47T232.115.3845.7412.751.781.510.19T345.946.8021.6815.225.123.471.03
3 讨论
3.1 丁酸梭菌、凝结芽孢杆菌对虹鳟机体生长性能的影响
饲料中补充益生菌能够有效促进养殖动物的生长和存活。严芳等[7]研究表明,饲料中添加0.2%~0.4%的活性酵母制剂可明显促进刺参Apostichopus japonicus生长及免疫功能;何伟聪等[9]研究表明,基础饲料中添加枯草芽孢杆菌、嗜酸乳杆菌或二者的混合物(质量比为1∶1)均能促进军曹鱼Rachycentron canadum幼鱼的生长,且两者混合效果更佳;王纯等[10]对虹鳟的研究表明,饲料中分别补充5×106CFU/g解淀粉芽孢杆菌和5×107 CFU/g胶红酵母复合菌,能够显著提高虹鳟的增重率和特定生长率,并降低饲料系数;华洵璐等[11]研究发现,仔猪饲料中补充丁酸梭菌和凝结芽孢杆菌的组合制剂,能显著提高仔猪对饲料蛋白质和纤维素的消化吸收。本研究结果证实,饲料中添加丁酸梭菌和凝结芽孢杆菌显著提高虹鳟幼鱼的特定生长率(T1组和T3组特定生长率均达到1.41%/d),同时显著降低了饲料系数。丁酸梭菌的主要产物丁酸可为结肠黏膜细胞提供主要能量,并为肠道细胞增殖与成熟提供重要保障;凝结芽孢杆菌的主要产物乳酸能够有效促进肠道蠕动,并为肠黏膜再生修复提供重要的营养物质。本研究中两种菌的促生长作用,推测可能与丁酸梭菌和凝结芽孢杆菌代谢产物对肠黏膜修复作用有关,但具体的作用机制还需深入研究。而丁酸梭菌单一菌株对虹鳟幼鱼的生长与复配组并无显著性差异,但显著高于对照组和凝结芽孢杆菌组。
3.2 丁酸梭菌、凝结芽孢杆菌对虹鳟肝功能的影响
肝脏是鱼类机体最大的消化腺、解毒及代谢器官,肝功能可从不同指标上反映试验动物受到外源物质的损伤程度,亦可佐证肝脏组织病理学上的潜在改变[12-14]。嘌呤核苷代谢中的核酸代谢酶腺苷脱氨酶、谷胱甘肽代谢中的氧化还原酶谷氨酰基转移酶、乙酰胆碱分解中的合成酶胆碱酯酶,其活性均可作为肝功能的敏感指标,可反映肝损伤程度或肝胆疾病[15-16]。当动物机体受到外界刺激时,谷草转氨酶会释放到血液中,影响肝脏等器官对蛋白或脂类的代谢,因此,可以认为,谷草转氨酶活性升高则表示动物肝功能受到不同程度的损伤[17]。同时,总胆红素作为胆汁的重要成分之一,亦可反映肝代谢功能的强弱,并间接呈现外源物质对肝功能的刺激[18]。本研究中,各处理组中核酸代谢酶、谷草转氨酶、谷氨酰基转移酶活性及总胆红素含量均低于或接近于对照组,说明丁酸梭菌和凝结芽孢杆菌应用后对虹鳟肝功能未造成损伤。值得注意的是,本研究中益生菌处理组虹鳟血清中谷草转氨酶活性下降,且丁酸梭菌和凝结芽孢杆菌复配处理显示,谷草转氨酶活性下降最为显著,说明丁酸梭菌和凝结芽孢杆菌对肝脏起到了保护作用,且复配可起到叠加的效果。由此可见,丁酸梭菌和凝结芽孢杆菌均可有效调控虹鳟肝功能相关指标,但具体的给予剂量和给予周期还有待进一步研究,以实现肝功能的调节与鱼类的生长发育保持一致。
3.3 丁酸梭菌、凝结芽孢杆菌对虹鳟肠道微生物的影响
肠道微生物依赖或制约着宿主健康,肠道菌群结构的改变可调节动物机体的生长、免疫等,故建立正常的肠道菌群极为重要[19-22]。本研究中通过高通量测序技术发现,T1、T3组虹鳟肠道菌群中OTU数量明显减少,说明丁酸梭菌和凝结芽孢杆菌的补充改变了虹鳟肠道微生物菌群结构。可能由于不同的细菌其影响耐受性因素不同,丁酸梭菌、凝结芽孢杆菌通过竞争排斥而抑制有害菌的生长,稳定发挥益生作用。T2组中OTU数量较高,多样性丰富,可能因为凝结芽孢杆菌好氧发酵后造成的低氧环境利于厌氧菌等多种细菌生长,且产生各种能量物质,大量补充动物自身所需的某些营养物质,从而促进肠道中更多细菌的繁殖;也可能是由于特异黏附因子的存在,便于更多细菌在宿主肠道内定植[23]。本研究中Chao1、Simpson、Shannon指数变化表明,丁酸梭菌和凝结芽孢杆菌的摄入改变了优势菌群数量,进而改变了肠道微生物的多样性。丁酸梭菌和凝结芽孢杆菌补充引起蓝菌门、变形菌门丰度降低,厚壁菌门、拟杆菌门比例增加,其中变形菌门的降低和厚壁菌门增加可能与凝结芽孢杆菌加入有关。Hung等[24]研究结果与此相似,ATCC 7050菌能使空肠中乳酸杆菌数增加,并使大肠杆菌类有害菌数减少,调节肠道微生物的菌群平衡。肖英平等[25]研究结果也表明,丁酸梭菌可抑制肠道中有害微生物生长,改善菌群结构,提高生产性能。本研究中丁酸梭菌和凝结芽孢杆菌起到了调节虹鳟肠道菌群结构的作用。丁酸梭菌和凝结芽孢杆菌如何影响虹鳟幼鱼肠道微生物菌群结构和功能菌群,以及如何影响其生长还有待深入探讨。
4 结论
本研究证实,丁酸梭菌、凝结芽孢杆菌的添加可促进虹鳟机体的生长,调节其肝功能及肠道微生物菌群结构。丁酸梭菌和凝结芽孢杆菌复配相对于单一菌株并未显著增加虹鳟的特定生长率,因此,饲料中补充单一的丁酸梭菌、凝结芽孢杆菌或二者的复配均可实现提高虹鳟产量的效果。
[1] 徐鹏,董晓芳,佟建明.微生物饲料添加剂的主要功能及其研究进展[J].动物营养学报,2012,24(8):1397-1403.
[2] 王瑶,刘赛.微生物饲料添加剂的功能与安全性探讨[J].农业与技术,2016,36(16):22.
[3] Liu C H,Chiu C H,Wang Shiwei,et al.Dietary administration of the probiotic,Bacillus subtilis E20,enhances the growth,innate immune responses,and disease resistance of the grouper,Epinephelus coioides[J].Fish & Shellfish Immunology,2012,33(4):699-706.
[4] 夏汉钦,杨红玲,孙云章.活性和灭活嗜冷杆菌SE6对斜带石斑鱼肠道菌群和肠黏膜免疫基因表达的影响[C]//第九届世界华人鱼虾营养学术研讨会论文集.厦门:中国水产学会,2013.
[5] Zhang Qin,Ma Hongming,Mai Kangsen,et al.Interaction of dietary Bacillus subtilis and fructooligosaccharide on the growth performance,non-specific immunity of sea cucumber,Apostichopus japonicus[J].Fish & Shellfish Immunology,2010,29(2):204-211.
[6] Munir M B,Hashim R,Chai Y H,et al.Dietary prebiotics and probiotics influence growth performance,nutrient digestibility and the expression of immune regulatory genes in snakehead (Channa striata) fingerlings[J].Aquaculture,2016,460:59-68.
[7] 严芳,胡炜,李成林,等.饲料中添加活性酵母制剂对刺参生长、免疫力和抗病力的影响[J].动物营养学报,2017,29(2):583-589.
[8] Huang Lu,Ran Chao,He Suxu,et al.Effects of dietary Saccharomyces cerevisiae culture or live cells with Bacillus amyloliquefaciens spores on growth performance,gut mucosal morphology,hsp70 gene expression,and disease resistance of juvenile common carp (Cyprinus carpio)[J].Aquaculture,2015,438:33-38.
[9] 何伟聪,董晓慧,谭北平,等.益生菌对军曹鱼幼鱼生长性能、消化酶和免疫酶活性的影响[J].动物营养学报,2015,27(12):3821-3830.
[10] 王纯,孙国祥,刘志培,等.解淀粉芽孢杆菌和胶红酵母复合菌对虹鳟生长性能及胃黏膜、肠黏膜菌群结构的影响[J].中国水产科学,2017,24(4):746-756.
[11] 华洵璐,钱仁界,张宪中,等.芽孢杆菌复合制剂对断奶仔猪生长、腹泻和饲料消化率的影响[J].安徽农业科学,2015,43(3):166-170.
[12] 王俊东,刘宗平.兽医临床诊断学[M].2版.北京:中国农业出版社,2010:217-228.
[13] Páez-Martiíinez N,Cruz S L,López-Rubalcava C.Comparative study of the effects of toluene,benzene,1,1,1-trichloroethane,diethyl ether,and flurothyl on anxiety and nociception in mice[J].Toxicology and Applied Pharmacology,2003,193(1):9-16.
[14] 孙金辉,范泽,张美静,等.饲料蛋白水平对鲤幼鱼肝功能和抗氧化能力的影响[J].南方水产科学,2017,13(3):113-119.
[15] Malbrouck C,Trausch G,Devos P,et al.Hepatic accumulation and effects of microcystin-LR on juvenile goldfish Carassius auratus L.[J].Comparative Biochemistry and Physiology Part C:Toxicology & Pharmacology,2003,135(1):39-48.
[16] Anderson F H,Zeng Lecheng,Rock N R,et al.An assessment of the clinical utility of serum ALT and AST in chronic hepatitis C[J].Hepatology Research,2000,18(1):63-71.
[17] 贾艳菊,杨虹,侯金良,等.饲料中添加乌贼肝粉和鱼浆蛋白对中华鳖生长性能和肝功能的影响[J].浙江大学学报:农业与生命科学版,2014,40(3):348-354.
[18] 曲亚玲,袁莉刚,钱续,等.中草药复合添加剂对虹鳟鱼增重及肝功能和结构的影响[J].中国兽医科学,2012,42(8):865-869.
[19] 王珊珊,王佳堃,刘建新.肠道微生物对宿主免疫系统的调节及其可能机制[J].动物营养学报,2015,27(2):375-382.
[20] Wang Xianghong,Li Huirong,Zhang Xiaohua,et al.Microbial flora in the digestive tract of adult penaeid shrimp(Penaeus chinensis)[J].Journal of Ocean University of Qingdao,2000,30(3):493-498.
[21] Li Jiqiu,Tan Beiping,Mai Kangsen.Dietary probiotic Bacillus OJ and isomaltooligosaccharides influence the intestine microbial populations,immune responses and resistance to white spot syndrome virus in shrimp (Litopenaeus vannamei)[J].Aquaculture,2009,291(1-2):35-40.
[22] Zhou Zhigang,Ding Zhaokun,Huiyuan L V.Effects of dietary short-chain fructooligosaccharides on intestinal microflora,survival,and growth performance of juvenile white shrimp,Litopenaeus vannamei[J].Journal of the World Aquaculture Society,2007,38(2):296-301.
[23] Rendueles O,Ferrières L,Frétaud M,et al.A new zebrafish model of Oro-intestinal pathogen colonization reveals a key role for adhesion in protection by probiotic bacteria[J].PLoS Pathogens,2012,8(7):e1002815.
[24] Hung A T,Lin Shuyuan,Yang T Y,et al.Effects of Bacillus coagulans ATCC7050 on growth performance,intestinal morphology,and microflora composition in broiler chickens[J].Animal Production Science,2012,52(9):874-879.
[25] 肖英平,杨彩梅,代兵,等.基于高通量测序的丁酸梭菌对肉鸡盲肠菌群结构的影响[J].浙江农业学报,2017,29(3):373-379.