石油的主要成分及其分解产物具有细胞毒性、遗传毒性、免疫毒性、致畸性和致癌性[1],其一旦进入土壤,将对人类健康和生态环境造成严重危害[2]。随着石油工业的迅速发展,勘探、开采和运输都不可避免地对环境造成了一定污染,目前,中国石油年产量已超1.8亿t,其中有近60万t 因无法回收而直接进入自然环境[3]。在相关研究中,孙晓杰等[4]调查了环渤海湾多个海域表层海水、沉积物和海洋生物体中石油烃含量,结果显示,调查海域为石油烃轻度污染,海洋生物中石油烃超标率为6.7%。因此,探究可行有效的石油污染环境修复方法显得尤为重要。目前,最具发展前景的生物修复方法具有费用低、环境影响小、无二次污染等优点,其技术也已由最初的细菌修复拓展到植物修复、微生物修复和微生物-植物联合修复等多个方面[5]。植物的“根际效应”是指植物-土壤-微生物与根际环境的交互作用,同时对植物生长发育产生积极影响。植物的根系分泌物直接影响根际微生物[6],微生物可以利用自身代谢活动,优化土壤环境并加速对石油烃等污染物的分解,从而达到修复被石油污染土壤的效果[7]。
翅碱蓬Suaeda heteroptera为一年生草本耐盐植物,是一种优良的耐盐牧草[8]。翅碱蓬的开发与人工种植不仅可以改善盐碱地环境、修复植被,还可以防止水土流失,维护生态系统[9]。近年来,翅碱蓬有参与植物修复土壤的趋势,在土壤原油污染生物修复方面有较大潜力[10]。本研究中,以中国北方沿海滩涂优势盐碱植物翅碱蓬为对象,采用多隔层根箱翅碱蓬种植试验,通过测定翅碱蓬不同根际区域根系分泌物含量、土壤酶活性、土壤细菌数量的变化,以及土壤中原油、菲和芘的降解率,研究原油污染土壤翅碱蓬的根际效应及降解,旨在为海滨湿地原油污染环境的生物修复提供参考依据。
1 材料与方法
1.1 材料
试验用翅碱蓬种子购自辽宁省盘锦市,为当年生翅碱蓬干燥种子。土壤取自辽宁省旅顺沿海滩涂(原油背景值为8.023 mg/kg)。原油取自辽宁省盘锦市,为低黏度高蜡中质石油。海水取自辽宁省大连市黑石礁海域的沙滤海水。淡水为自来水。
1.2 方法
1.2.1 根箱设计 参考Wang等[11]的多隔层根箱设计,通过插入由300目尼龙撩网制成的隔网,将根箱分为根生长室及根周围土壤室;根周围土壤再由隔网分割为5层,每层距根的距离分别0~3.0、3.1~6.0、6.1~9.0、9.1~12.0 mm和>12.1 mm,分别记作S1、S2、S3、S4、S5。这一设计阻止根系进入根周围土壤室,既实现各层彼此分离,又确保根系分泌物及土壤细菌等在各层间迁移。未种植翅碱蓬的对照组分层与翅碱蓬种植组一样。
1.2.2 土壤的处理 取试验土壤碾碎过筛,拌入加热后的原油,使其浓度为4000 mg/kg,干湿平衡3个月后,测定原油浓度为(3945.22±14.16)mg/kg。
1.2.3 根箱种植试验 在上述根箱中加入原油污染土壤,试验组种植翅碱蓬,密度为4粒/cm2,对照组未种植翅碱蓬,每组设3个重复。试验90 d后,采集根下各区域土壤,分别测定翅碱蓬根际土壤中氨基酸含量、有机酸含量、总糖含量、酶活性、细菌数量,以及土壤中原油、菲和芘含量。
1.2.4 测定方法 采用HPLC高效液相色谱法、气相色谱定性分析法、蒽酮比色法、氯化三苯基四氮唑法(TTC)、邻苯三酚比色法、平板菌落计数法、荧光分光光度计法、气相色谱-质谱联用法分别测定土壤中的氨基酸含量、总糖含量、有机酸含量、脱氢酶活性、多酚氧化酶活性、细菌总数、原油总含量和多环芳烃含量。
1.2.5 降解的计算 原油(菲、芘)降解率的计算公式为
Tt= (Z0-Zt)/ Z0 ×100%。
其中:Tt为从试验开始至时间t(d)时原油(菲、芘)的降解率(%);Z0为试验开始时土壤原油(菲、芘)含量(mg/kg);Zt为时间t(d)时土壤原油(菲、芘)含量(mg/kg)。
1.3 数据处理
试验数据采用SPSS 13.0软件进行单因素方差分析,用Ducan法进行组间多重比较,显著性水平设为0.05。
2 结果与分析
2.1 根际距离对土壤低分子有机物的影响
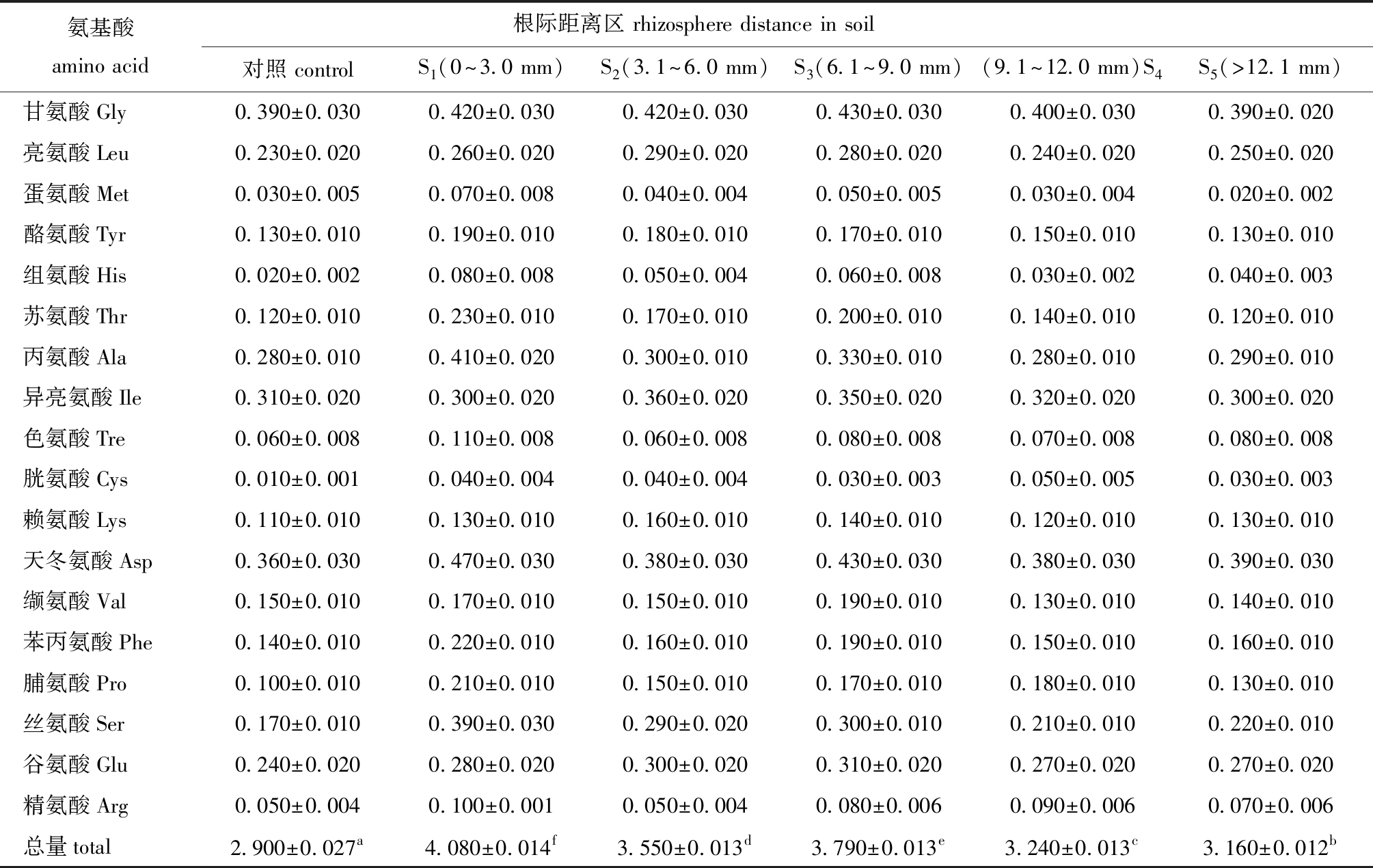
2.1.1 土壤氨基酸含量 从表1可见:在翅碱蓬不同根际距离区土壤中,氨基酸的分泌总量不同,且随着根际距离的增大总量呈下降趋势(F=627.557,P<0.05);对常见的18种氨基酸组分进行分析显示,不同根际距离对氨基酸组成无影响,但对不同氨基酸成分的分泌量有明显影响;翅碱蓬种植试验组氨基酸总量均显著高于未种植对照组(P<0.05),在S1、S2、S3根际区域内种植组氨基酸总量分别为对照组的1.41、1.23和1.31倍。
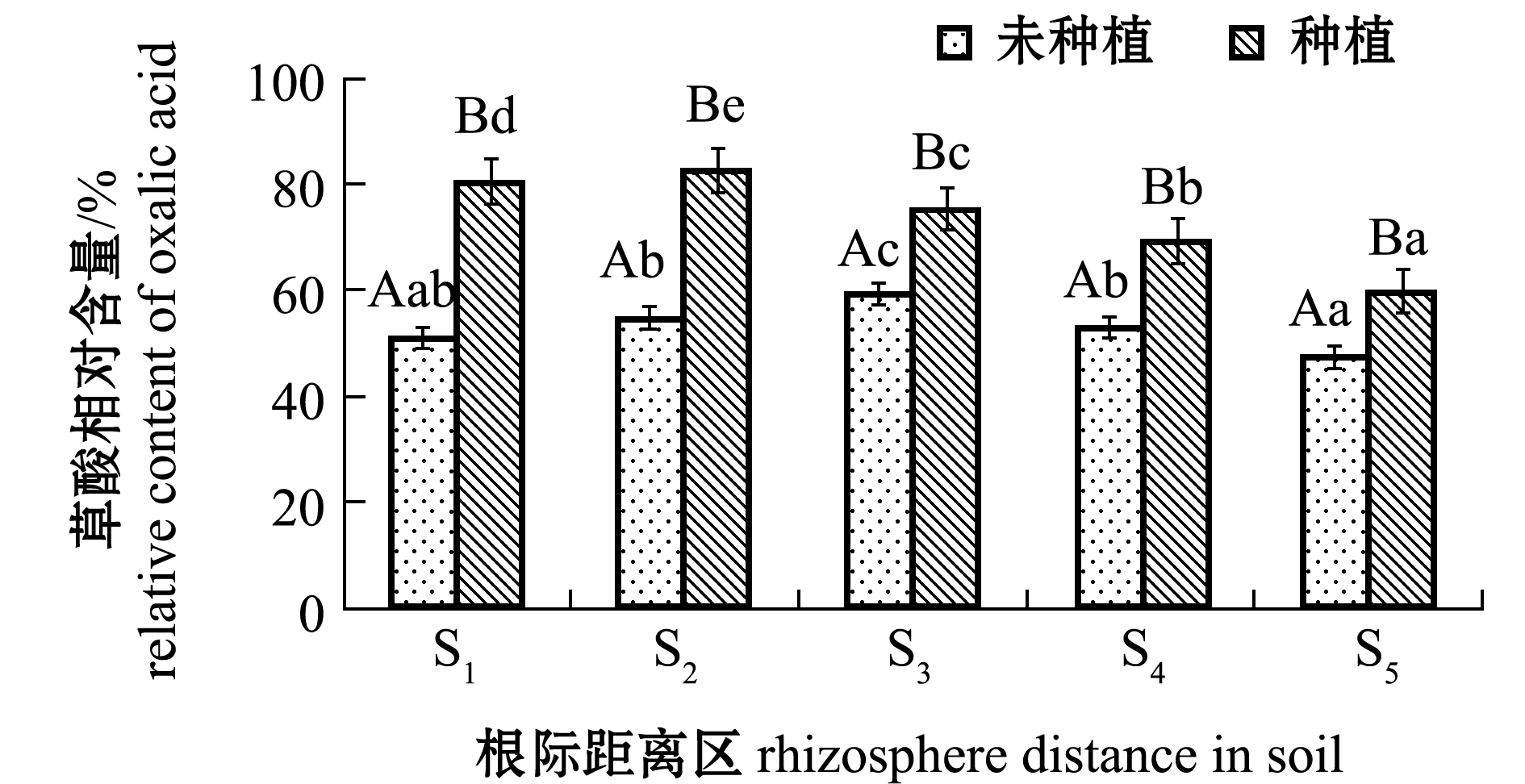
2.1.2 土壤有机酸含量 根系分泌物有机酸的分析测定中选用草酸、酒石酸、苹果酸、乙酸、乳酸、顺丁烯二酸、柠檬酸和反丁烯二酸8种分子量相对较小且比较常见的有机酸,经过分析比对,翅碱蓬根系分泌有机酸组分主要由草酸、乳酸、苹果酸和乙酸组成,其中草酸为主要成分。图1为不同根际距离土壤中草酸的相对含量,随着根际距离的不断增大,翅碱蓬种植试验组草酸相对含量呈显著减少趋势(F=285.684,P<0.05),含量最高的为S2根际距离区,达到82.7%,同一根际距离区翅碱蓬种植试验组均显著高于对照组(P<0.05)。
注:标有不同大写字母者表示组内有显著性差异(P<0.05);标有不同小写字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间或组内无显著性差异(P>0.05),下同
Note:The means with different capital letters are significantly different among groups at the 0.05 probability level; the means with different letters are significantly different between groups at the 0.05 probability level, and the means with the same letters are not significant differences, et sequentia
图1 不同根际距离区土壤中草酸相对含量
Fig.1 Amounts of oxalic acids in soils away from rhizosphere at various distances
表1 不同根际距离区土壤中氨基酸含量
Tab.1 Amounts of amino acids in soils away from rhizosphere at various distances mg/g
氨基酸amino acid根际距离区 rhizosphere distance in soil 对照 controlS1(0~3.0 mm)S2(3.1~6.0 mm)S3(6.1~9.0 mm)(9.1~12.0 mm)S4S5(>12.1 mm)甘氨酸Gly0.390±0.0300.420±0.0300.420±0.0300.430±0.0300.400±0.0300.390±0.020亮氨酸Leu0.230±0.0200.260±0.0200.290±0.0200.280±0.0200.240±0.0200.250±0.020蛋氨酸Met0.030±0.0050.070±0.0080.040±0.0040.050±0.0050.030±0.0040.020±0.002酪氨酸Tyr0.130±0.0100.190±0.0100.180±0.0100.170±0.0100.150±0.0100.130±0.010组氨酸His0.020±0.0020.080±0.0080.050±0.0040.060±0.0080.030±0.0020.040±0.003苏氨酸Thr0.120±0.0100.230±0.0100.170±0.0100.200±0.0100.140±0.0100.120±0.010丙氨酸Ala0.280±0.0100.410±0.0200.300±0.0100.330±0.0100.280±0.0100.290±0.010异亮氨酸Ile0.310±0.0200.300±0.0200.360±0.0200.350±0.0200.320±0.0200.300±0.020色氨酸Tre0.060±0.0080.110±0.0080.060±0.0080.080±0.0080.070±0.0080.080±0.008胱氨酸Cys0.010±0.0010.040±0.0040.040±0.0040.030±0.0030.050±0.0050.030±0.003赖氨酸Lys0.110±0.0100.130±0.0100.160±0.0100.140±0.0100.120±0.0100.130±0.010天冬氨酸Asp0.360±0.0300.470±0.0300.380±0.0300.430±0.0300.380±0.0300.390±0.030缬氨酸Val0.150±0.0100.170±0.0100.150±0.0100.190±0.0100.130±0.0100.140±0.010苯丙氨酸Phe0.140±0.0100.220±0.0100.160±0.0100.190±0.0100.150±0.0100.160±0.010脯氨酸Pro0.100±0.0100.210±0.0100.150±0.0100.170±0.0100.180±0.0100.130±0.010丝氨酸Ser0.170±0.0100.390±0.0300.290±0.0200.300±0.0100.210±0.0100.220±0.010谷氨酸Glu0.240±0.0200.280±0.0200.300±0.0200.310±0.0200.270±0.0200.270±0.020精氨酸Arg0.050±0.0040.100±0.0010.050±0.0040.080±0.0060.090±0.0060.070±0.006总量total2.900±0.027a4.080±0.014f3.550±0.013d3.790±0.013e3.240±0.013c3.160±0.012b
注:同列中标有不同大写字母者表示组内有显著性差异(P<0.05);同行中标有不同小写字母者表示组间有显著性差异(P<0.05);标有相同字母者表示组间或组内无显著性差异(P>0.05),下同
Note:The means with different capital letters within the same column are significantly different among groups at the 0.05 probability level; the means with different letters within the same line are significantly different between groups at the 0.05 probability level, and the means with the same letters are not significant differences, et sequentia
2.1.3 土壤总糖含量 从图2可见:随着根际距离的不断增大,翅碱蓬种植试验组总糖含量呈显著降低的趋势(F=331.900,P<0.05),总糖含量在S1根际距离区达到峰值,为52.88 mg/kg;对照组各根际距离区总糖含量也有显著性差异(P<0.05),但均显著低于翅碱蓬种植组(P<0.05)。
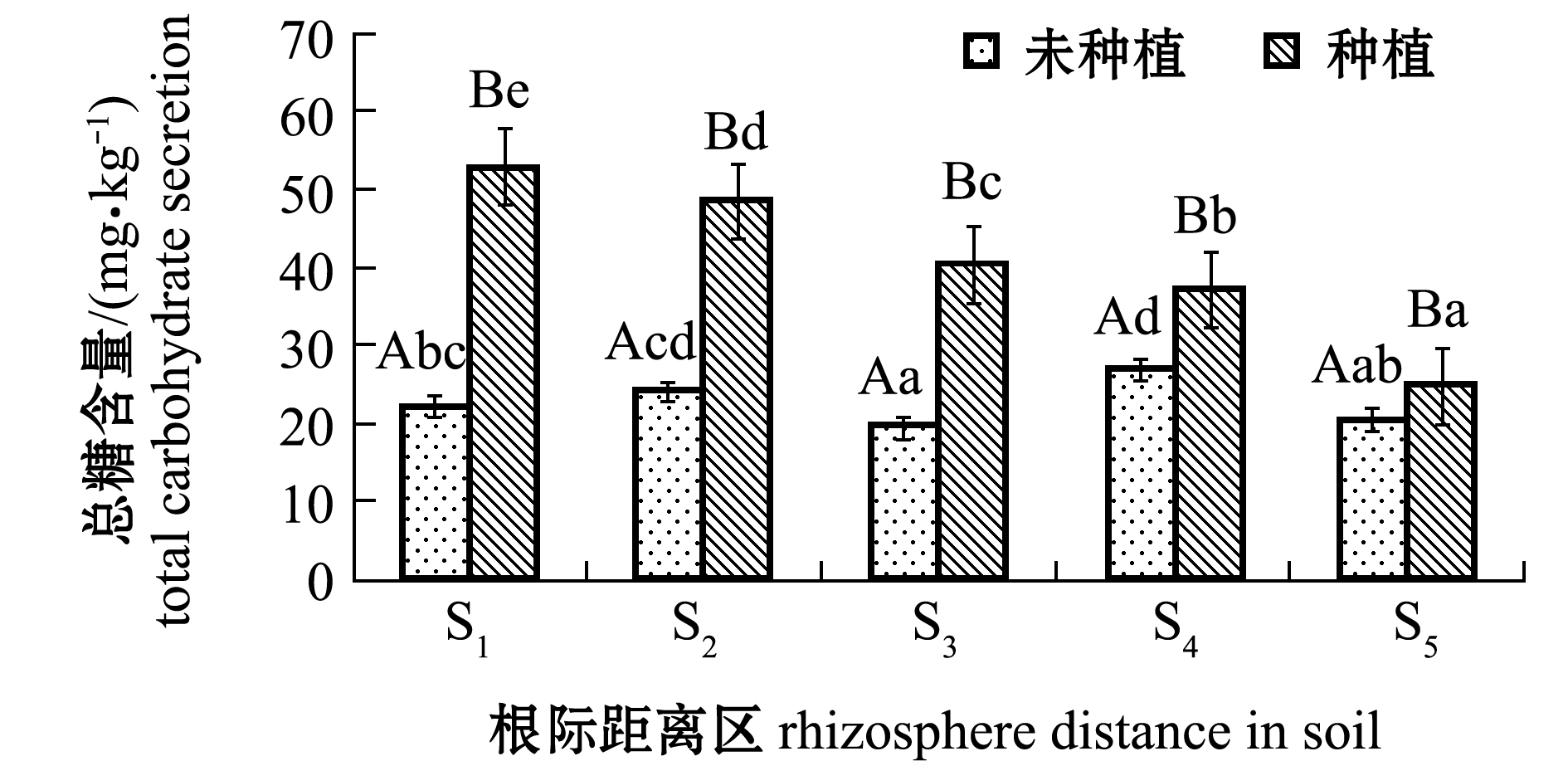
图2 不同根际距离区土壤中总糖含量
Fig.2 Amounts of total sugar in soils away from rhizosphere at various distances
2.2 根际距离对土壤酶活性的影响
从图3可见:土壤脱氢酶活性和多酚氧化酶活性变化趋势基本一致;翅碱蓬种植组中,各根际距离区土壤两种酶活性均依次为S2>S3>S1>S4>S5,表现为近根区显著高于远根区(P<0.05);未种植翅碱蓬对照组中,S3根际距离区两种酶活性最高且显著高于其他根际距离区(F=9.831,P<0.05),但各根际距离区酶活性均显著低于翅碱蓬种植组(P<0.05)(S5根际距离区多酚氧化酶除外)。
2.3 根际距离对土壤细菌数量的影响
从图4可见:随着根际距离的增加,翅碱蓬种植试验组土壤细菌数量总体呈下降趋势,细菌数量最高值出现在S2根际距离区,为5.75×105cells,种植组平均高于未种植组1.4×105 cells;除S5根际距离区外,其他根际距离区对照组细菌数量均显著低于翅碱蓬种植组(P<0.05)。
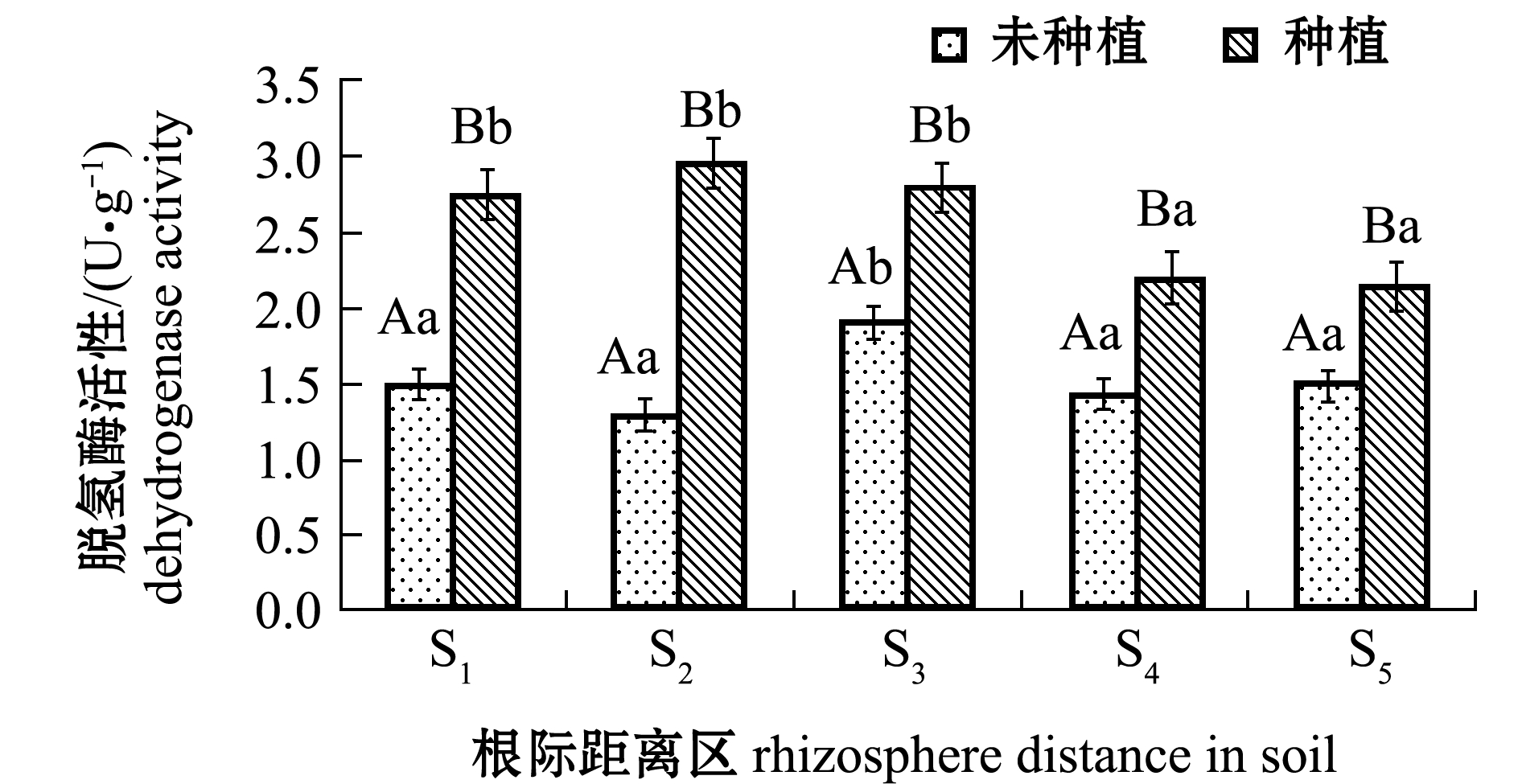
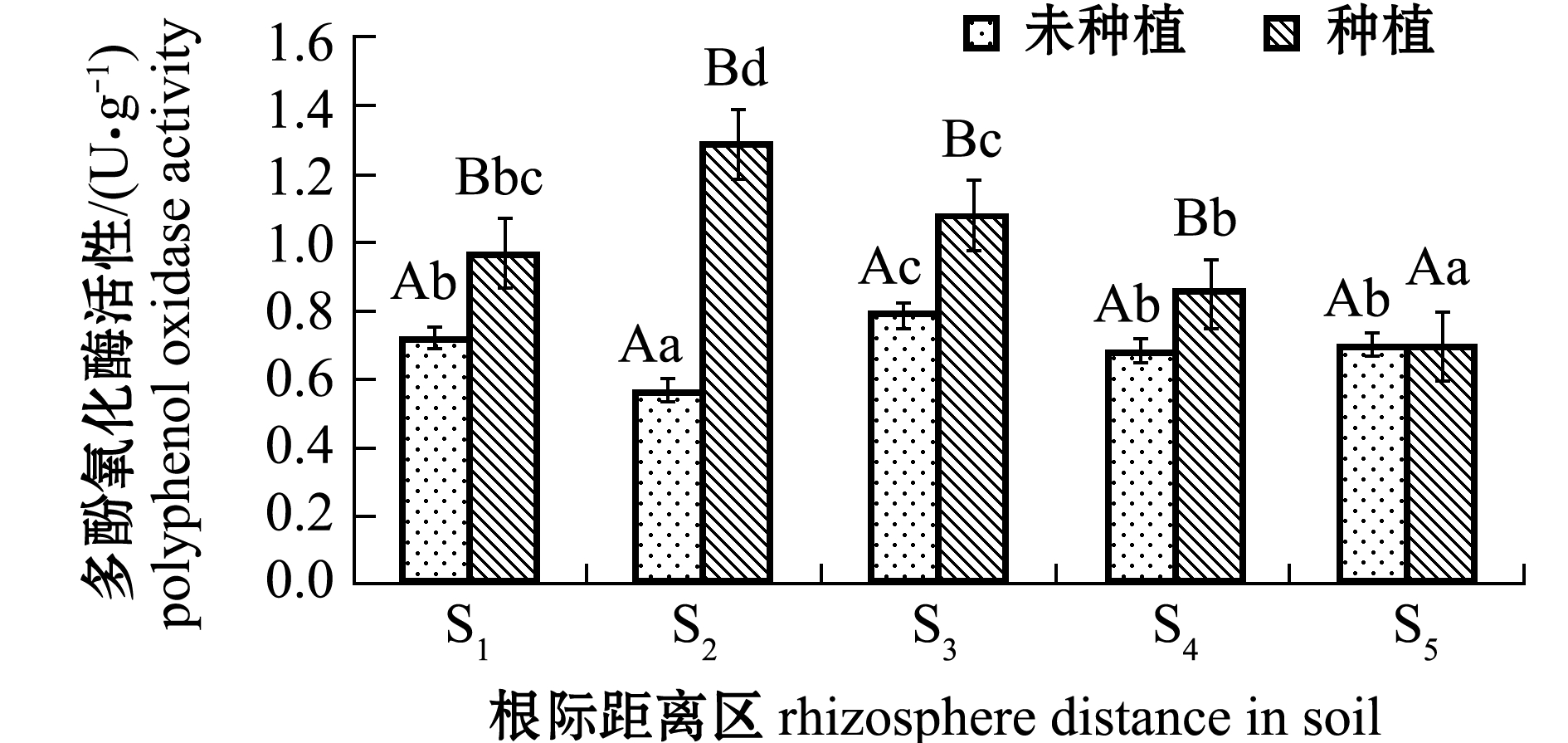
图3 不同根际距离区土壤脱氢酶和多酚氧化酶活性
Fig.3 DHO and PPO activities in soils away from rhizosphere at various distances
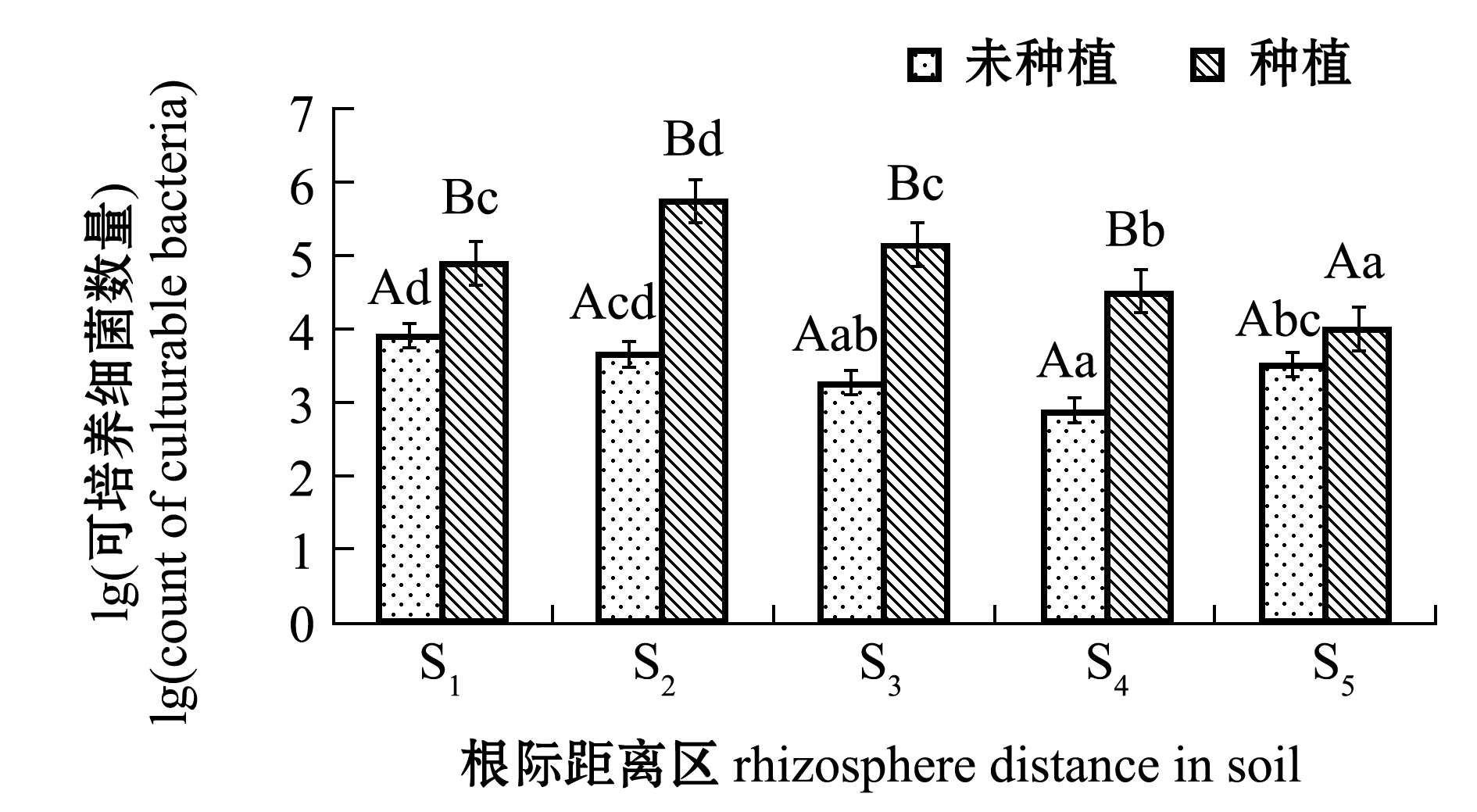
图4 不同根际距离区土壤中微生物量
Fig.4 Counts of soil microbial community away from rhizosphere at various distance
2.4 根际距离对土壤原油含量的影响
从表2可见:经过90 d试验,翅碱蓬种植试验组土壤中原油含量较对照组显著降低(P<0.05),各根际距离区土壤中原油含量依次为S5>S4>S3>S1>S2,即近根区显著低于远根区(F=10.446,P<0.05);而未种植翅碱蓬对照组原油含量与初始值相比略有下降(F=0.275,P>0.05)。
表2 不同根际距离区土壤中原油的含量
Tab.2 Petroleum contents in soils away from rhizosphere at various distances mg/kg
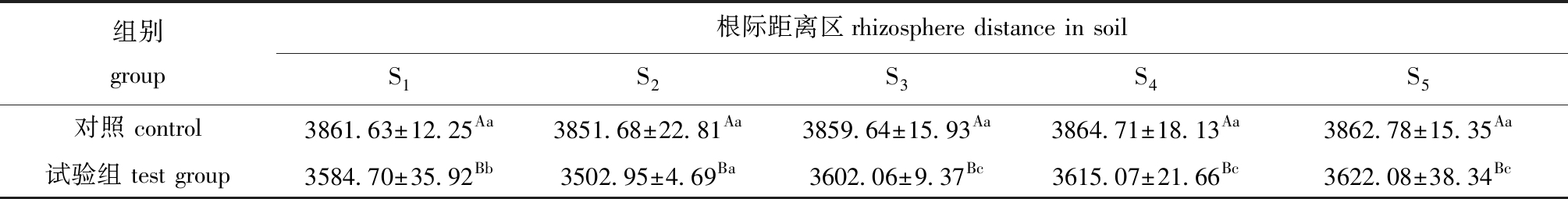
组别group根际距离区rhizosphere distance in soilS1S2S3S4S5对照 control3861.63±12.25Aa3851.68±22.81Aa3859.64±15.93Aa3864.71±18.13Aa3862.78±15.35Aa试验组 test group3584.70±35.92Bb3502.95±4.69Ba3602.06±9.37Bc3615.07±21.66Bc3622.08±38.34Bc
从图5可见:试验90 d后,翅碱蓬种植试验组中土壤原油平均降解率为9.12%,且S2根际距离区降解程度最大,达到11.21%,其减少量高达348.73 mg/kg,原油污染土壤降解的整体趋势为近根区显著高于远根区(P<0.05),可能是植物的根际效应受到了植物根际距离的限制;未种植翅碱蓬对照组土壤原油平均降解率仅为2.16%,对照组降解率均显著低于翅碱蓬种植组(P<0.05)。
从图6可见:翅碱蓬种植试验组中,各根际距离区土壤中菲的降解率依次为S1>S2>S3>S4>S5,芘的降解率依次为S2>S1>S3>S4>S5,菲降解率在S1根际距离区最大(25.77%),芘降解率在S2根际距离区最大(19.23%);未种植翅碱蓬对照组中,除了在S2根际距离区菲的降解率达到15.8%之外,其他各根际距离区土壤中菲、芘的降解程度基本未有显著性差异(P>0.05),且多数对照组降解率均显著低于翅碱蓬种植试验组(P<0.05)。
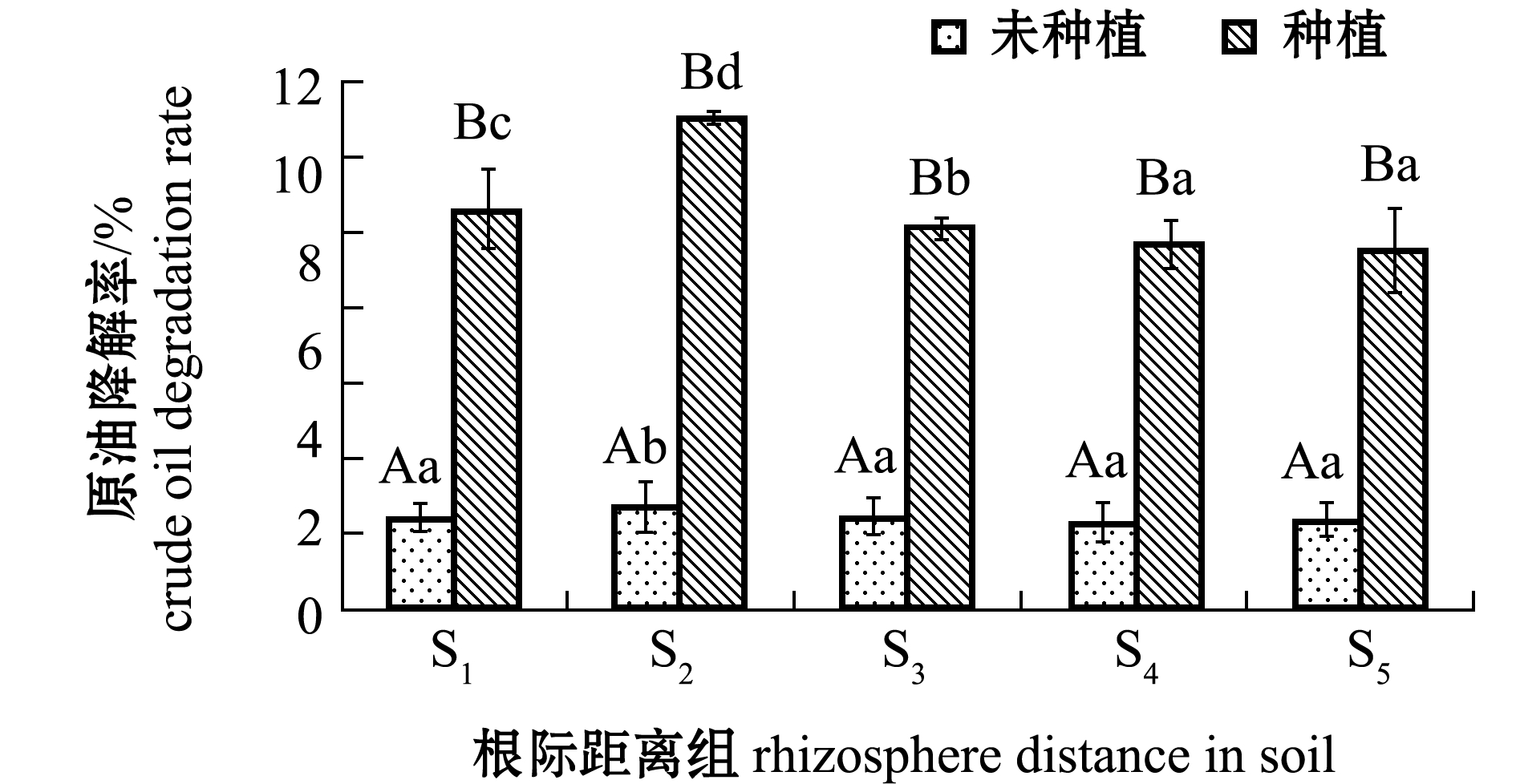
图5 不同根际距离区土壤中原油降解率
Fig.5 Degradation rates of crude oil in soils away from rhizosphere at various distances
3 讨论
3.1 翅碱蓬根际环境中根系分泌物的作用
根系分泌物是在一定的生长条件下,活的且未被扰动的根释放到根际环境中的有机物的总称[12],大致分为低分子有机物、高分子黏胶物质和植物残体的分解产物[13],其中低分子有机物主要包括有机酸、各种氨基酸、糖类和酚类等,它们通过影响土壤理化性质、土壤酶活性、土壤微生物数量等促进土壤中有毒有害物质的降解、转化和生物利用。
何洁等[14]研究表明,翅碱蓬的种植对石油污染土壤的理化性质有较好改善。土壤微生物在土壤中进行氧化、硝化、氨化、固氮、硫化等过程,促进了土壤有机质的分解和养分的转化,其数量是“土壤健康”的重要标志[15],而根系分泌物为根际微生物提供所需的能源,不同根系分泌物直接影响着根际微生物的数量、代谢和种群结构[16],所以根系分泌物是保持根际微生态系统活力的关键因素[17]。根际分泌物与微生物的相互作用较为复杂, 在某些情况下是互惠的, 这种相互作用是促进根际污染物降解的重要原因[18]。Phillips等[19]研究表明,植物根系分泌物的分泌量与土壤微生物种群数量增加,会提高有机污染物的植物利用有效性。Wu 等[20]的试验显示,微生物的添加加速了土壤石油烃污染物的降解,且石油烃的降解率与土壤微生物多样性呈正比。土壤酶是存在于土壤中各酶类的总称,是土壤的组成成分之一,作为生物催化剂,其参与了土壤的各种生物化学过程,可有效地促进土壤中有机污染物进行净化[21]。土壤酶主要来源于植物根系的分泌物和土壤微生物及动植物残体分解释放的酶[22],其活性可以反映植物根系的分泌程度、微生物的活性和功能多样性,是 “土壤肥力”的重要指标[15]。Liu等[23]对植物修复石油污染的研究表明,土壤酶活性的增加是高效降解石油烃污染物的重要原因之一。
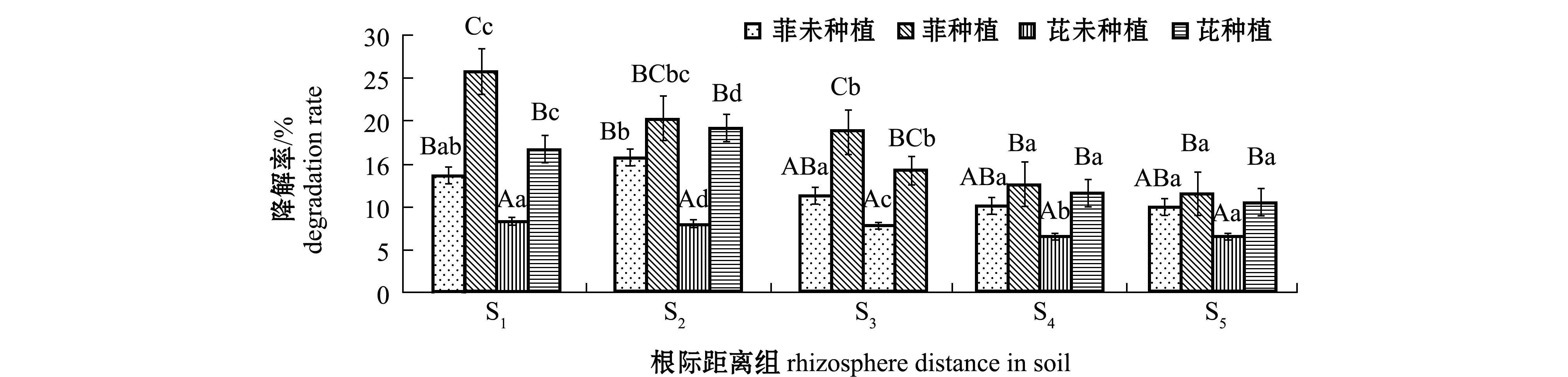
图6 不同根际距离区土壤中菲、芘的降解率
Fig.6 Degradation rates of phenanthrene and pyrene in soils away from rhizosphere at various distances
本研究中,翅碱蓬种植试验组各根际距离土壤中氨基酸和糖类含量及草酸的相对含量均显著高于未种植翅碱蓬对照组,而各种成分含量总体上随根际距离的增加而减少,表明即使在试验浓度原油胁迫下,翅碱蓬分泌活性依然较强,根际土壤中的低分子有机物主要来自翅碱蓬根系分泌物,可能以浓度差为动力之一向根际外扩散。在有毒有害物质对植物进行胁迫或毒害时, 基于应激效应,植物会增加根系分泌物中某些成分的积累[24],有效调节土壤根际环境,使得植物的根际环境向着有助于对外来有毒有害物质的降解和清除方向良性发展[25]。
本研究中根际环境中的土壤酶活性和可培养细菌数量也是翅碱蓬种植试验组显著高于对照组,表明在根际环境中,翅碱蓬根系分泌物对土壤酶活性和土壤细菌数量起主要影响作用。
3.2 翅碱蓬根际效应对土壤原油降解的影响
植物能够在体内累积吸收石油烃并有一定的降解作用[26-27],而植物根系存在能有效改善根际区土壤的持水能力,增加根际区脱氢酶的活性,提高根际区微生物数量水平及活性,有利于石油烃的降解和污染土层的修复[28-29],在石油烃污染土壤的植物修复中,根际的降解作用是去除石油烃的主要方式[30]。Peng等[31]利用观赏性植物紫茉莉Mirabilis jalapa L.研究植物对土壤石油污染的修复效果,植物种植试验区石油烃含量明显降低,且降解效果显著高于未种植植物的自然试验区。李鑫等[32]发现,高羊茅草的根际效应不仅使石油烃含量降低,还缓解了土壤盐碱化和原油污染对微生物群落的影响,对根际微生物群落具有保育作用。许崇彦等[26]研究发现,潮间带抗盐碱植物翅碱蓬可以降低土壤中石油烃的质量比,种植区与对照区相比,石油烃的降解率可以提高 21.7%~37.9%。本研究中,翅碱蓬种植试验组对原油污染土壤的平均降解率为9.12%,其中S2(3.1~6.0 mm)根际区域内的原油降解率最高达11.21%,而未种植的对照组平均降解率仅为2.16%,与上述结果相似,说明翅碱蓬通过自身吸收及根际环境的调控作用对原油污染物有降解效果。
石油烃类化合物中的芳香族烃类化合物最难降解且对人和动物的毒性较大,尤其是双环及三环以上的多环芳烃(PAHs)毒性更甚[33],因此,对石油土壤污染植物修复根际效应的研究多集中于芳香族化合物。Su等[34]研究表明,植物对PAHs的降解主要是通过根系分泌物刺激根际特定微生物功能群落数量的增加及共代谢作用来完成的。Técher等[35]研究表明,在 PAHs 污染土壤中添加芒草属植物的根系分泌物能显著增加微生物数量,促进根际环境中PAHs 的降解。Sun等[36]的盆栽试验表明,黑麦草根系分泌物使PAHs污染土壤中菲和芘的降解率分别提高 15.5%和 21.3%。根际微生物数量的增加、酶活性的提高促进了土壤中石油烃的降解,同时也降低了石油烃对植物的毒性。Liste等[37]选用9种植物进行试验,土壤中芘的降解速率在根际区域要高于并快于非根际区域。本研究中,土壤菲的降解率在根际距离为S1(0~3.0 mm)区域最大,为25.77%,土壤中芘的降解率在S2(3.1~6.0 mm)根际区域内达到了19.23%,种植组的平均降解率高于未种植翅碱蓬的对照组,这一结果与Corgié等[38]研究黑麦草Lolium perenne L.对土壤中菲的降解效果相一致,说明翅碱蓬的根际效应对土壤多环芳烃组分起到了有效地去除作用。
4 结论
(1)翅碱蓬根际土壤中氨基酸、草酸和糖类物质高于未种植翅碱蓬组,说明其分泌物中含有低分子有机物;在原油胁迫下,其根系分泌物在不同根际距离土壤中的分泌量不同,总体来说,随着根际距离的增大,分泌量均呈下降趋势。这表明,在本试验条件下,由于应激反应,翅碱蓬依然产生大量的分泌物,其在土壤中的分布主要是由浓度差及根系土壤中一系列生化反应造成的。
(2)土壤酶活性和细菌总数量在不同根际距离区域的变化不同,翅碱蓬种植组中土壤脱氢酶和多酚氧化酶活性变化一致;翅碱蓬种植组中各根际距离土壤酶活性及细菌数量的变化趋势与相应根际距离土壤中菲、芘的降解趋势存在正相关。这表明,土壤酶活性和细菌降解是土壤中原油污染物降解和清除的一个重要因素。
(3)不同根际距离对土壤中原油含量的影响不同。与未种植翅碱蓬组相比,翅碱蓬种植组土壤中原油残留含量明显降低。
[1] Samanta S K,Singh O V,Jain R K.Polycyclic aromatic hydrocarbons:environmental pollution and bioremediation[J].Trends in Biotechnology,2002,20(6):243-248.
[2] 杜显元.石油开采区土壤污染物源解析、毒性及快速检测法研究[D].北京:华北电力大学,2012.
[3] 杜亚鲁,胡韬,彭琳.土壤石油污染的生物修复技术研究进展[J].环境科学与技术,2017,40(S1):133-138.
[4] 孙晓杰,李兆新,邢丽红,等.环渤海石油污染对海区环境和海洋生物的影响研究[J].海洋湖沼通报,2016(6):73-79.
[5] 惠云芳,王鸿飞.石油污染土壤的生物修复研究进展[J].西北农业学报,2018,27(4):451-458.
[6] 张翠萍,李淑英,王蓓,等.六氯苯胁迫下2种湿地植物根际土壤微生物数量与酶活性变化[J].生态与农村环境学报,2018,34(2):177-183.
[7] 王春,姜岩,岳希权.原油污染土壤生物修复研究进展[J].应用化工,2015,44(12):2317-2320.
[8] 朱兴运,李锋瑞,毛玉林,等.改良硫酸盐盐土的理想牧草[J].中国草业科学,1998:45-47.
[9] 何洁,何晓彤,刘远,等.丁草胺和马拉硫磷对翅碱蓬生长及抗氧化酶系统的影响[J].大连海洋大学学报,2016,31(5):551-558.
[10] 许崇彦,刘先斌,刘占广,等.碱蓬对原油烃污染的海岸带修复的初步研究[J].安全与环境学报,2007,7(1):37-39.
[11] Wang Zhongwen,Shan Xiaoquan,Zhang Shuzhen.Comparison between fractionation and bioavailability of trace elements in rhizosphere and bulk soils[J].Chemosphere,2002,46(8):1163-1171.
[12] 张淑香,高子勤.连作障碍与根际微生态研究Ⅱ:根系分泌物与酚酸物质[J].应用生态学报,2000,11(1):152-156.
[13] 高子勤,张淑香.连作障碍与根际微生态研究Ⅰ:根系分泌物及其生态效应[J].应用生态学报,1998,9(5):549-554.
[14] 何洁,吉志新,王庆芝,等.翅碱蓬种植对原油污染土壤理化性质的影响[J].大连海洋大学学报,2016,31(1):75-79.
[15] Dick R P.Soil enzyme activities as indicators of soil quality[M]//Doran J W,Coleman D C,Bezdicek D F,et al.Defining Soil Quality for A Sustainable Environment.Madison:Soil Science Society of America,1994:107-124.
[16] 朱丽霞,章家恩,刘文高.根系分泌物与根际微生物相互作用研究综述[J].生态环境,2003,12(1):102-105.
[17] 王明霞,周志峰.植物根系分泌物在植物中的作用[J].安徽农业科学,2012,40(11):6357-6359.
[18] Macek T,Macková M,Káš J.Exploitation of plants for the removal of organics in environmental remediation[J].Biotechnology Advances,2000,18(1):23-34.
[19] Phillips L A,Greer C W,Farrell R E,et al.Plant root exudates impact the hydrocarbon degradation potential of a weathered-hydrocarbon contaminated soil[J].Applied Soil Ecology,2012,52:56-64.
[20] Wu Manli,Dick W A,Li Wei,et al.Bioaugmentation and biostimulation of hydrocarbon degradation and the microbial community in a petroleum-contaminated soil[J].International Biodeterioration & Biodegradation,2016,107:158-164.
[21] 杨兰芳,曾巧,李海波,等.紫外分光光度法测定土壤过氧化氢酶活性[J].土壤通报,2011,42(1):207-210.
[22] 杨万勤,王开运.土壤酶研究动态与展望[J].应用与环境生物学报,2002,8(5):564-570.
[23] Liu Rui,Xiao Nan,Wei Shuhe,et al.Rhizosphere effects of PAH-contaminated soil phytoremediation using a special plant named Fire Phoenix[J].Science of the Total Environment,2014,473-474:350-358.
[24] 张玲,王焕校.镉胁迫下小麦根系分泌物的变化[J].生态学报,2002,22(4):496-502.
[25] 许超,夏北成.芘对玉米根系分泌氨基酸的影响[J].生态环境学报,2009,18(1):172-175.
[26] 许崇彦,刘宪斌,刘占广,等.翅碱蓬对石油烃污染的海岸带修复的初步研究[J].安全与环境学报,2007,7(1):37-39.
[27] 高乃媛,刘宪斌,赵兴茹.石油烃对翅碱蓬生理特性的影响及植物-微生物联合降解[J].环境工程学报,2013,7(4):1578-1582.
[28] 陈嫣,李广贺,张旭,等.石油污染土壤植物根际微生态环境与降解效应[J].清华大学学报:自然科学版,2005,45(6):784-787.
[29] 王靖,张忠智,苏幼明,等.石油污染土壤植物修复根际效应研究[J].石油化工高等学校学报,2008,21(2):36-40.
[30] Kechavarzi C,Pettersson K,Leeds-Harrison P,et al.Root establishment of perennial ryegrass (L.perenne) in diesel contaminated subsurface soil layers[J].Environmental Pollution,2007,145(1):68-74.
[31] Peng Shengwei,Zhou Qixing,Cai Zhang,et al.Phytoremediation of petroleum contaminated soils by Mirabilis jalapa L.in a greenhouse plot experiment[J].Journal of Hazardous Materials,2009,168(2-3):1490-1496.
[32] 李鑫,张会慧,岳冰冰,等.高羊茅草对盐碱地原油污染土壤微生物的影响[J].应用生态学报,2012,23(12):3414-3420.
[33] Glick B R.The enhancement of plant growth by free-living bacteria[J].Canadian Journal of Microbiology,1995,41(2):109-117.
[34] Su Yuhong,Zhu Yongguan.Uptake of selected PAHs from contaminated soils by rice seedlings (Oryza sativa) and influence of rhizosphere on PAH distribution[J].Environmental Pollution,2008,155(2):359-365.
[35] Técher D,Laval-Gilly P,Henry S,et al.Contribution of Miscanthusx giganteus root exudates to the biostimulation of PAH degradation:an in vitro study[J].Science of the Total Environment,2011,409(20):4489-4495.
[36] Sun Tianran,Cang Long,Wang Quanying,et al.Roles of abiotic losses,microbes,plant roots,and root exudates on phytoremediation of PAHs in a barren soil[J].Journal of Hazardous Materials,2010,176(1-3):919-925.
[37] Liste HH,Alexander M.Rapid screening of plants promoting phenanthrene degradation[J].Journal of Environmental Quality,1999,28(4):1376-1377.
[38] Corgié S C,Beguiristain T,Leyval C.Differential composition of bacterial communities as influenced by phenanthrene and dibenzo[a,h]anthracene in the rhizosphere of ryegrass(Lolium perenne L.)[J].Biodegradation,2006,17(6):511-521.