近年来,随着旅游资源的过度开发和周边工业规模的扩大,辽宁盘锦红海滩湿地面源污染不断加剧,湿地植物翅碱蓬Suaeda heteroptera大面积死亡[1]。目前,有关生态因子及污染物对湿地植物生长和发育等已有许多研究[2-4],其中,盐度是所有植物生长的抑制因子,从机理上分析,盐胁迫主要影响植物光合作用、蛋白合成、能量和脂类代谢等重要生命过程[5]。但不同植物对于盐耐受水平存在较大差异。海滩植物翅碱蓬是一种典型的盐碱指示植物,能在含盐量20以下的环境中生存[6]。除环境因子外,重金属离子累积和外源除草剂也是湿地植物的潜在威胁因子。重金属作为一类难降解污染物,可以通过食物链的传递并富集,对动植物产生严重危害,目前已成为河口区的重要污染物之一[7-8]。研究表明,在高浓度铜离子胁迫下,随着处理浓度的增加,紫云英种子萌发和幼苗生长期各生长性状均受到抑制[9]。草甘膦是一种非选择性、无残留灭生性除草剂,可通过干扰植物体内蛋白质合成,进而导致植物死亡[10]。
影响翅碱蓬发芽率和生长的因素主要有其生长的沉积物及海水中的石油、盐含量、重金属、农药和土壤自身理化性质等。盘锦红海滩地处辽河与渤海交界处,河口土壤常年为盐碱地。随着水资源环境恶化,湿地土壤含盐量不断升高[11],海水盐度是影响翅碱蓬发芽和生长的重要因素。此外,经前期调研及实地监测发现,盘锦红海滩地区存在重金属铜和草甘膦污染。为此,本研究中选择盐度、重金属铜离子和草甘膦作为研究对象,分析了不同浓度的3种因子对翅碱蓬生长发育状况的影响,以期为红海滩生态修复提供参考。
1 材料与方法
1.1 材料
试验用试剂主要有五水硫酸铜(天津市北辰方正试剂厂)、草甘膦标准品(美国Sigma公司)和氯化钠(天津致远化学试剂有限公司),均为分析纯。
试验仪器主要为GXZ型智能光照培养箱(GXZ-2808,宁波江南仪器厂)。
试验用翅碱蓬种子取自盘锦红海滩,选择大小一致、饱满的翅碱蓬种子用0.05%高锰酸钾消毒后备用。盐度、铜离子和草甘膦试验用水为纯水。
1.2 方法
1.2.1 试验设计 试验于2017年4月在辽宁省近岸海洋环境科学与技术重点实验室进行。通过加氯化钠调节纯水盐度,使盐度分别为5、10、15、20、25、30,用无水硫酸铜和草甘膦标准品分别与纯水按一定比例混合,使铜离子浓度分别为0(空白对照)、0.1、0.5、2.0、5.0 mg/L,草甘膦浓度分别为0(空白对照)、1、5、10、20 mg/L,每个浓度组设3个重复。试验采用水培方式进行,以培养皿为试验容器,将含有翅碱蓬种子的不同浓度溶液的培养皿置于恒温光照培养箱(20 ℃±1 ℃,光强3000 lx,光暗比12∶12)中培养。盐度和铜离子处理组于试验的第3、9、14、18、24 天时进行采样及各项指标的测定,草甘膦处理组于试验的第3、5、7、9、11、20 天时进行采样及各项指标的测定。
1.2.2 指标测定及计算 发芽按照以黑色种子皮破裂为标准,计算发芽率。待种子发芽后定期用直尺测量翅碱蓬幼苗的株高。对发芽率或生长的抑制率计算公式为
抑制率=(对照组发芽率或株高-处理组发芽率或株高)/对照组发芽率或株高×100%。
1.3 数据处理
试验结果均用平均值±标准差表示,采用SPSS 19.0软件进行单因素方差分析,采用Duncan法进行组间多重比较,显著性水平设为0.05。
2 结果与分析
2.1 铜离子对翅碱蓬发芽率和生长的影响
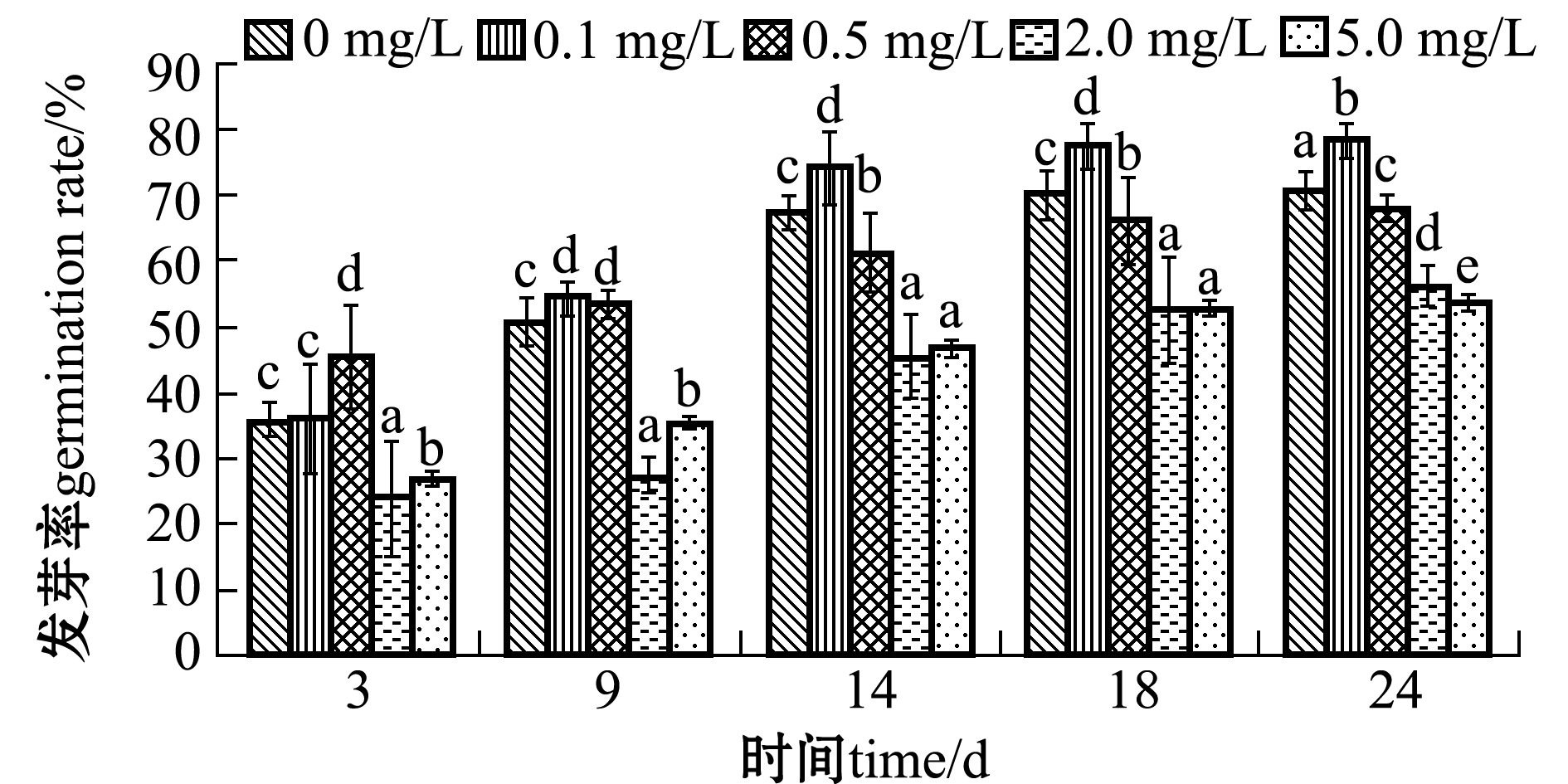
从图1可见:随着时间的延长,各种铜离子浓度下翅碱蓬种子的发芽率逐渐升高;同一时间下,随着铜离子浓度的增加,发芽率均呈先升高后降低的趋势;同一时间下,铜离子高浓度组(2.0、5.0 mg/L)翅碱蓬种子发芽率显著低于低浓度组(0. 1、0. 5 mg/L)和对照组,铜离子浓度为0.1 mg/L时发芽率最高且显著高于其他浓度组和对照组(P<0.05)(除第9天时0. 5 mg/L浓度组外)。
试验结束时(24 d),铜离子浓度为0.1 mg/L时,翅碱蓬种子的发芽率最高,为78%,比对照组提高了8%;而5.0 mg/L处理组发芽率最低,仅为53.3%,与对照组相比对翅碱蓬种子发芽率的抑制率达到23.8%(图1)。当铜离子浓度大于0.1 mg/L时,翅碱蓬种子发芽率随着铜离子浓度的增大而降低,相关方程为y=-5.6667x+82.2(R2=0.752)。
注:同一时间下,标有不同小写字母者表示组间有显著性差异(P<0.05),标有相同小写字母者表示组间无显著性差异(P>0.05),下同
Note: The means with different letters within the same time are significant differences among the groups at the 0.05 probability level, and the means with the same letters are not significant differences among the groups, et sequentia
图1 不同铜离子浓度下翅碱蓬种子的发芽率
Fig.1 Germination rate of saline seepweed Suaeda heteroptera at different concentrations of copper ion
从图2可见:低浓度(0.1、2.0 mg/L)铜离子对翅碱蓬生长有一定的促进作用,其中0.1 mg/L铜离子浓度组幼苗生长比对照组有显著提高(P<0.05);而铜离子浓度为5.0 mg/L时,对翅碱蓬幼苗的生长有明显的抑制作用(P<0.05),与对照组相比对翅碱蓬生长的抑制率为8.8%。
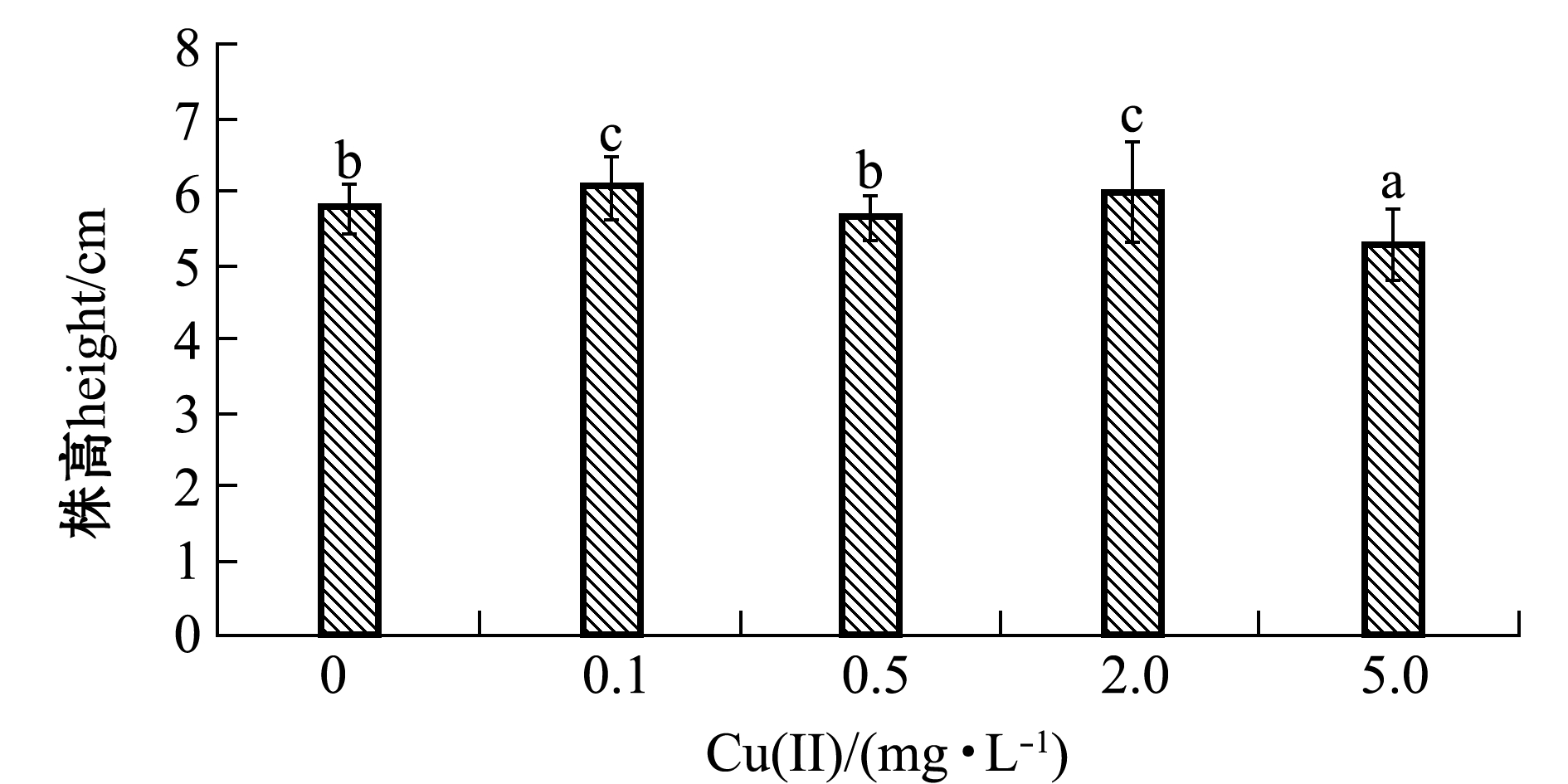
图2 第24天时铜离子浓度对翅碱蓬幼苗生长的影响
Fig.2 Effects of copper ion concentration on seedling height of saline seepweed Suaeda heteroptera on the twenty-fourth day
2.2 盐度对翅碱蓬发芽率和生长影响
从图3可见,盐度对翅碱蓬种子的发芽产生了一定的抑制作用,随着盐度的增加,发芽率逐渐下降。试验结束时(24 d),盐度为5的组发芽率最高,为47.3%,显著高于其他盐度组(P<0.05);盐度为25的组发芽率最低,仅为10.7%,显著低于其他盐度组(P<0.05),与盐度为5时相比,盐度为25时对翅碱蓬种子发芽率的抑制率达到77%。盐度(x)与发芽率(y)呈显著负相关(P<0.05),相关方程为y=-8.2667x+56(R2=0.9203)。
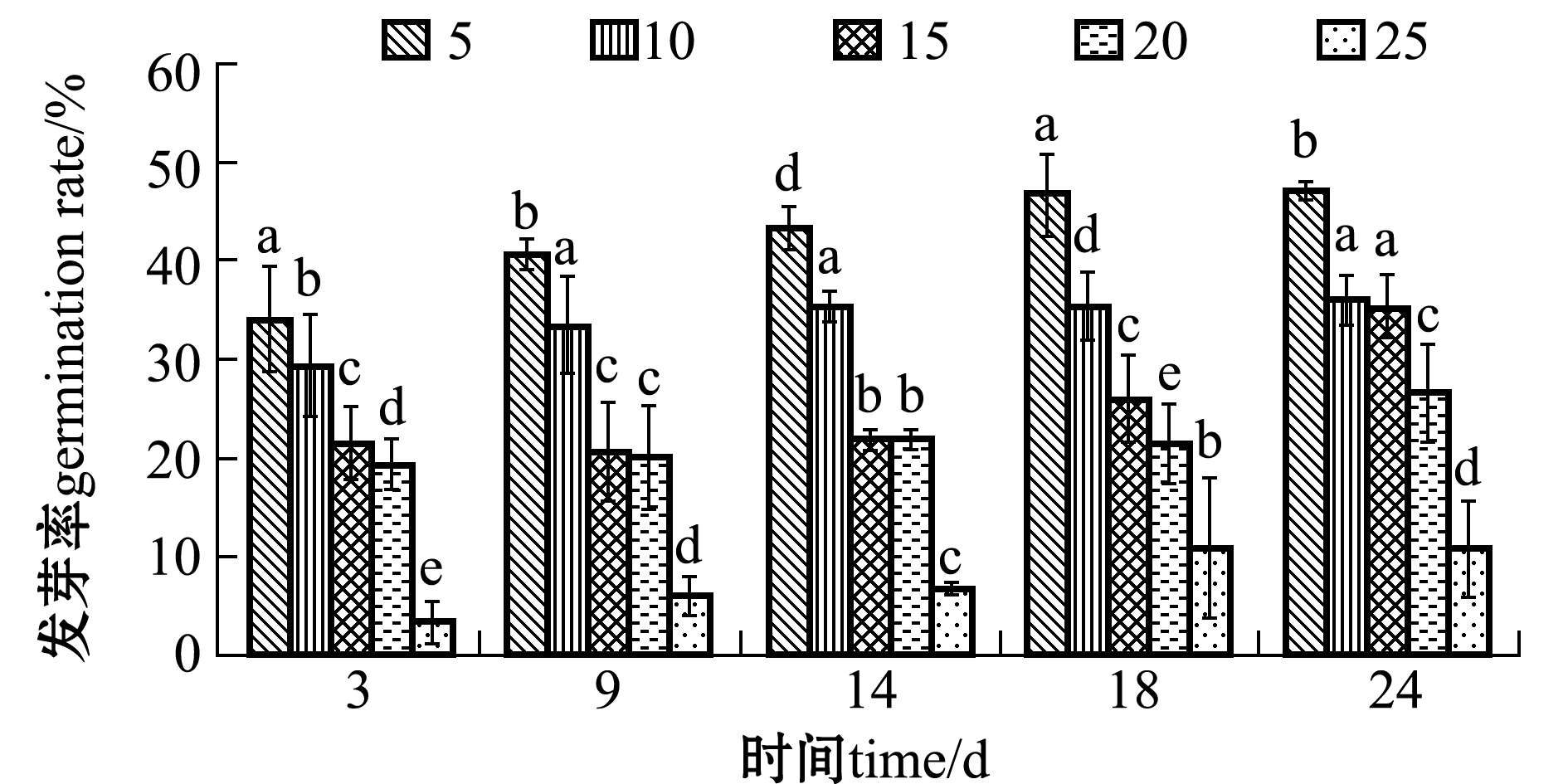
图3 不同盐度下翅碱蓬种子的发芽率
Fig.3 Germination rate of saline seepweed Suaeda heteroptera at different salinities
从图4可见:盐度为5~15时,翅碱蓬幼苗生长随盐度的增加而增加;而盐度为20~30时,翅碱蓬的生长受到了抑制,幼苗生长显著低于5~15盐度组(P<0.05),且幼苗的生长随盐度的增加而降低,说明高盐度对翅碱蓬幼苗生长有抑制作用。
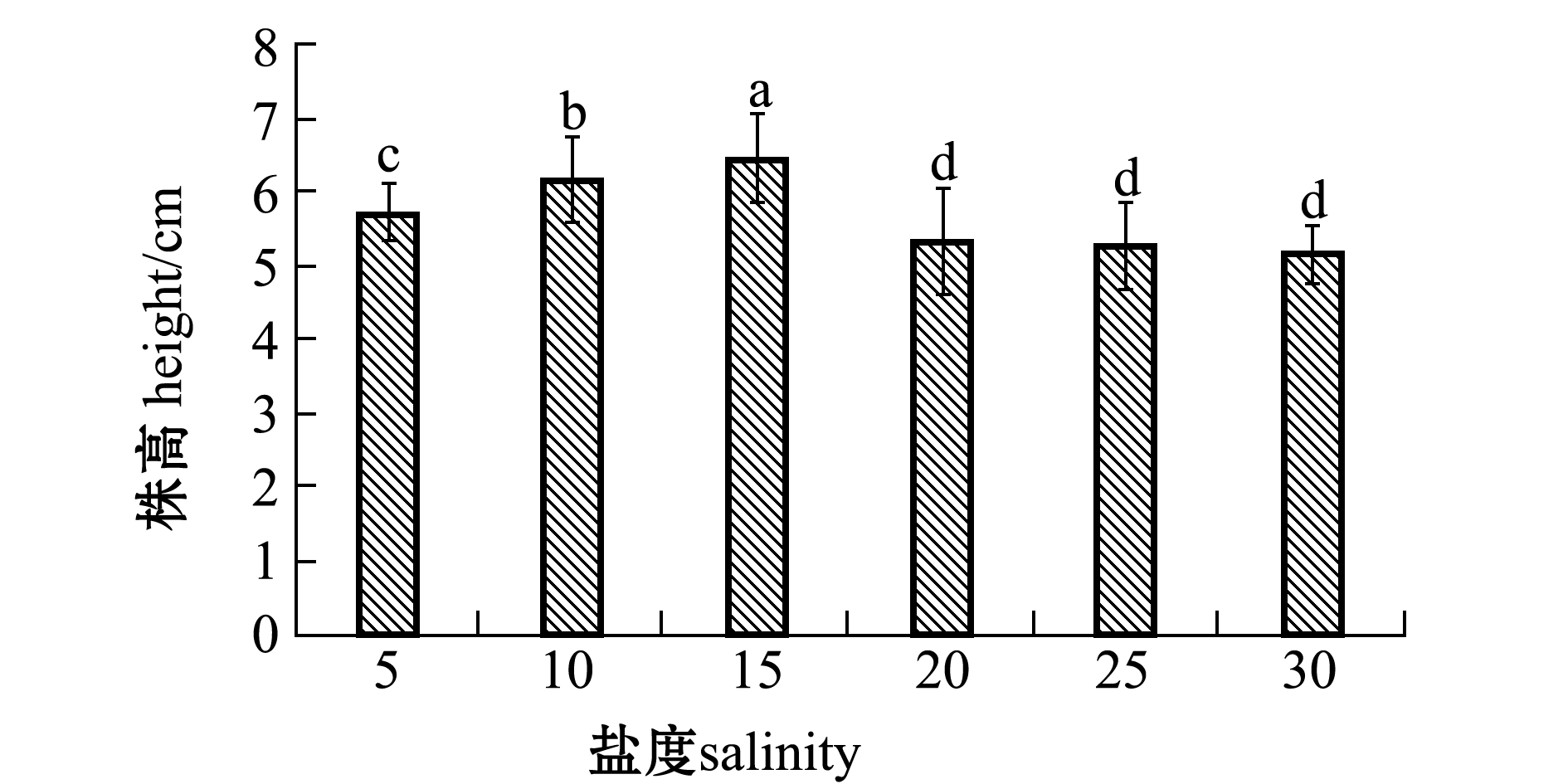
图4 第24天时盐度对翅碱蓬幼苗生长的影响
Fig.4 Effects of salinity on seedling growth of saline seepweed Suaeda heteroptera on the twenty-fourth day
2.3 草甘膦对翅碱蓬发芽率及生长的影响
从图5可见:随着草甘膦浓度的增加,草甘膦对翅碱蓬种子发芽率有明显的抑制作用,浓度越大抑制作用越明显;对照组翅碱蓬种子第3天时的发芽率为38%,第7天后发芽率逐渐趋于稳定;草甘膦浓度为20 mg/L时,第3天时的发芽率仅为11%,第9天时发芽率逐渐趋于稳定。
试验结束时(20 d),不同草甘膦浓度下翅碱蓬种子的发芽率与对照组相比均有显著性差异(P<0.05);对照组发芽率为47%,草甘膦浓度为20 mg/L时发芽率仅为17%(图5)。草甘膦浓度(x)与发芽率(y)呈显著负相关(P<0.05),相关方程为y=-0.077x+0.515(R2=0.9276)。
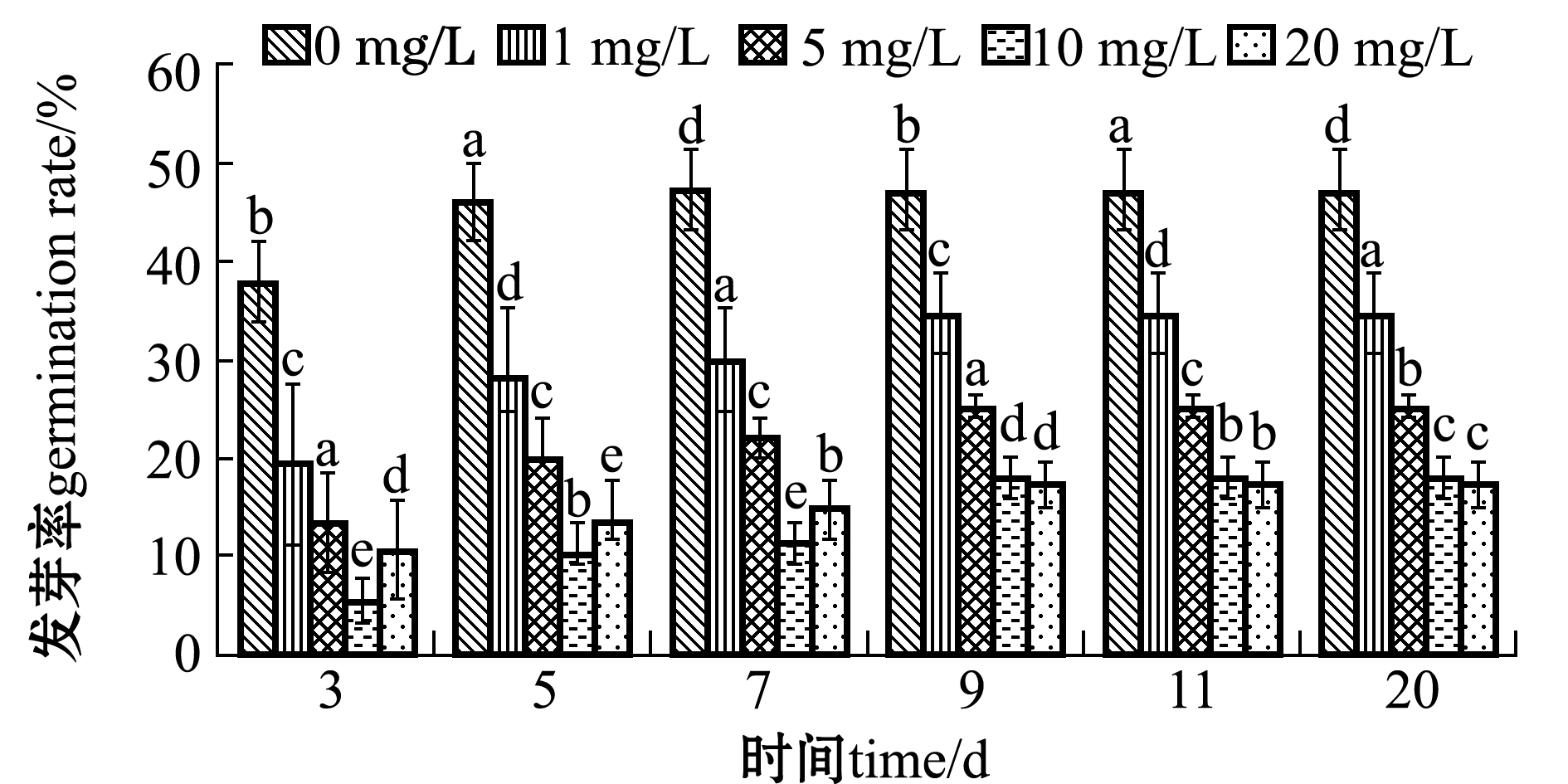
图5 不同草甘膦浓度下翅碱蓬种子的发芽率
Fig.5 Germination rates of saline seepweed Suaeda heteroptera at different concentrations of glyphosate
从图6可见:翅碱蓬幼苗生长在不同草甘膦浓度下存在显著性差异(P<0.05),与对照组相比,草甘膦对翅碱蓬生长的影响存在显著的抑制作用(P<0.05);第20天时,在纯水(对照)中的幼苗株高为28.8 mm,在1 mg/L草甘膦溶液中幼苗株高为24.4 mm,而在20 mg/L草甘膦溶液中幼苗株高仅为11.3 mm,抑制率达到60.8%。由此可见,随着草甘膦浓度的升高,翅碱蓬幼苗株高逐渐减小,在浓度低于10 mg/L时变化较为明显,而浓度在10~20 mg/L时,变化幅度逐渐降低。
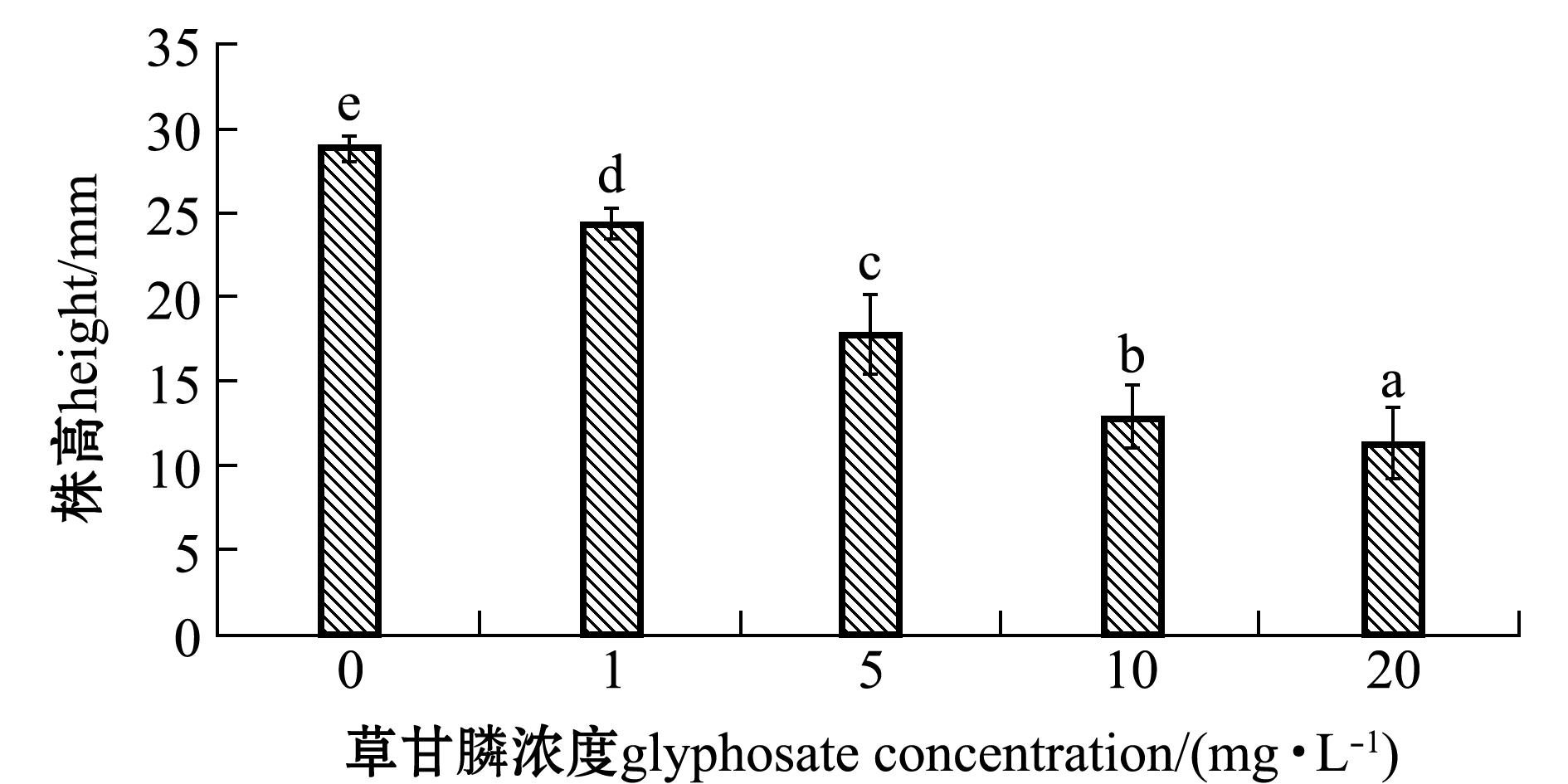
图6 第20天时草甘膦浓度对翅碱蓬幼苗生长的影响
Fig.6 Effects of glyphosate concentration on seedling growth of saline seepweed Suaeda heteroptera on the twentieth day
3 讨论
3.1 铜离子对翅碱蓬发芽及生长的影响
本研究表明,铜离子在低浓度(0.1~0.5 mg/L)时对翅碱蓬种子的萌发具有一定的促进作用,但在高浓度(2.0~5.0 mg/L)时,铜离子对翅碱蓬种子萌发具有明显的抑制作用。由于铜离子是种子发芽所需的元素,可以促进植物发芽和生殖器官的形成[12],因此,在低浓度时表现出促进发芽的特征。同时,铜离子抑制各种保护酶的活性[13],导致高浓度铜离子下抑制植物发芽,使发芽率降低。植物在萌芽期间受铜离子胁迫时,呼吸作用所需酶的产生受到抑制,植物种子发芽受抑,植物种子通过呼吸作用使底物氧化分解,产生生物能(ATP)和供给种子萌发的多种新物质,呼吸酶不足使种子萌发受限,进而对其他生理生化过程产生影响[14]。
此外,低浓度的铜离子还可以稳定植物体内的叶绿素,高浓度的铜离子可能破坏与生长相关的酶活性或者使蛋白质变性,从而抑制幼苗生长[15]。过量的铜离子对植物有明显的毒害作用,主要是妨碍植物对二价铁的吸收和在体内的运转,造成缺铁病。在生理代谢方面,过量的铜离子可抑制脱羚酶的活性,间接阻碍![]() 向谷氧酸转化,造成
向谷氧酸转化,造成![]() 的积累,使根部受到严重损伤,主根不能伸长,常在2~4 cm时就停止生长,根尖硫化,生长点细胞分裂受到抑制,根毛少甚至枯死[16]。
的积累,使根部受到严重损伤,主根不能伸长,常在2~4 cm时就停止生长,根尖硫化,生长点细胞分裂受到抑制,根毛少甚至枯死[16]。
3.2 盐度对翅碱蓬发芽及生长的影响
本研究表明,随着盐度的升高,翅碱蓬发芽率逐渐降低,反映了翅碱蓬种子对盐胁迫的响应,与高粱品种的盐胁迫现象相同[17]。植物生长周期中不同阶段对盐度的耐受能力也不同,一般认为,种子阶段的耐受能力最强[18-19],而高盐度可能抑制种子吸水,影响渗透压,使水盐平衡失调,阻碍种子的生长发育,从而使种子不易发芽[20]。翅碱蓬适宜盐度为10~16,因此,本试验中盐度在15以下的幼苗生长良好,而盐度在15以上时,同样由于高盐度影响幼苗的渗透压[21],抑制幼苗生长。在一定的盐度范围内,幼苗通过增加平均单叶面积和叶片寿命来增加光合作用面积[22],高盐度降低了植物叶片的净光合速率,使生长减慢。同时翅碱蓬的生长也需要一定的盐分,表现出在低盐度时的促进作用。
3.3 草甘膦对翅碱蓬发芽及生长的影响
本研究表明,随着草甘膦浓度的增加,翅碱蓬种子的发芽率显著降低,草甘膦浓度与翅碱蓬发芽率间出现显著的剂量效应关系。草甘膦属于有机磷除草剂,具有良好的内吸传感性能,因此,可能对翅碱蓬的发芽率产生影响[23]。草甘膦对翅碱蓬幼苗生长的影响与发芽率相似,高浓度时对幼苗生长的抑制较为明显。草甘膦可以抑制色氨酸的合成,导致生长素含量下降,还可以抑制蛋白质合成并使代谢失调,影响幼苗生长[24]。草甘膦作用于植物的根部和叶部,并通过抑制5-烯醇式丙酮莽草酸-3-磷酸合成酶活性,影响苯基丙氨酸、酪氨酸、色氨酸等芳香族氨基酸的生物合成,导致植物莽草酸合成途径受阻,从而使植物枯萎甚至死亡[25]。
4 结论
(1)铜离子在低浓度(0.1~0.5 mg/L)时对翅碱蓬种子的萌发具有一定的促进能力,对翅碱蓬幼苗生长的促进作用不明显;当铜离子浓度为5 mg/L时,第24天时翅碱蓬的发芽率达到53.3%,对幼苗株高的抑制率为8.8%。
(2)随着盐度的升高,翅碱蓬发芽率逐渐下降,呈显著的负相关关系;低盐度(5~15)对翅碱蓬幼苗生长有促进作用,高盐度(20~30)对翅碱蓬幼苗生长有抑制作用。
(3)草甘膦在试验浓度范围内对翅碱蓬发芽率及生长均有显著的抑制作用,浓度越高翅碱蓬发芽率则越低,生长越缓慢;当浓度为10、20 mg/L时,翅碱蓬发芽率最低,均为17%;翅碱蓬株高与草甘膦浓度呈负相关关系,草甘膦浓度为20 mg/L时对翅碱蓬株高抑制率达到60.8%。
今后应结合野外生态学研究,开展不同环境因子对翅碱蓬的生态学试验,为进一步查明盘锦红海滩翅碱蓬生态退化原因提供参考。
[1] 李晋,乔会婷,徐天平,等.辽河口红海滩湿地海域潮流及盐度的数值模拟[J].大连海洋大学学报,2018,33(5):625-632.
[2] 何洁,陈旭,王晓庆,等.翅碱蓬对滩涂湿地沉积物中重金属Cu、Pb的累积吸收[J].大连海洋大学学报,2012,27(6):539-545.
[3] 何洁,吉志新,王庆芝,等.翅碱蓬栽培对原油污染土壤理化性质的影响[J].大连海洋大学学报,2016,31(1):75-79.
[4] 赵满兴,贺治慧,王文强,等.不同浓度柴油污染对高羊茅和紫花苜蓿生长的影响[J].北方园艺,2018,42(4):121-127.
[5] 刘晓威,杨秀艳,刘正祥,等.MicroRNA在植物抵御盐胁迫过程中的作用[J].生物技术通报,2017,33(12):12-21.
[6] 李雪.碱蓬草在盘锦红海滩公园建设工程中的应用[J].中国园艺文摘,2017,33(1):113-114,143.
[7] Goswami S,Das S.Copper phytoremediation potential of Calandula officinalis L. and the role of antioxidant enzymes in metal tolerance[J].Ecotoxicology and Environmental Safety,2016,126:211-218.
[8] 刘志杰,李培英,张晓龙,等.黄河三角洲滨海湿地表层沉积物重金属区域分布及生态风险评价[J].环境科学,2012,33(4):1182-1188.
[9] 李娟霞.紫云英对铜尾矿矿砂的耐性机理及修复潜力研究[D].南昌:江西财经大学,2015.
[10] 王军华,王易芬,陈蕾蕾,等.除草剂草甘膦微生物降解技术研究进展[J].江苏农业科学,2016,44(4):8-12.
[11] 陈阳阳.辽河流域典型湿地生态修复方案研究[D].北京:中国石油大学(北京),2016.
[12] 薛楠.土壤铜对植物生长及叶片反射光谱的影响研究[D].沈阳:沈阳理工大学,2016.
[13] 李瑞莉,齐淑艳,刘娜,等.铅、镉、铜对4种入侵植物种子萌发及幼苗生长的影响[J].东北师大学报:自然科学版,2017,49(4):101-108.
[14] Andreazza R,Bortolon L,Pieniz S,et al.Phytoremediation of vineyard copper-contaminated soil and copper mining waste by a high potential bioenergy crop (Helianthus annus L.)[J].Journal of Plant Nutrition,2015,38(10):1580-1594.
[15] Bouazizi H,Jouili H,Geitmann A,et al.Cell wall accumulation of Cu ions and modulation of lignifying enzymes in primary leaves of bean seedlings exposed to excess copper[J].Biological Trace Element Research,2011,139(1):97-107.
[16] 公勤,康群,王玲,等.重金属铜对植物毒害机理的研究现状及展望[J].南方农业学报,2018,49(3):469-475.
[17] 刘金萍,高奔,李欣,等.盐旱互作对不同生境盐地碱蓬种子萌发和幼苗生长的影响[J].生态学报,2010,30(20):5485-5490.
[18] 王浩东,高芳磊,郭宏宇,等.盐度、水淹深度和践踏胁迫下七里海湿地盐地碱蓬种子的幼苗出土率和生长特点[J].湿地科学,2017,15(2):250-255.
[19] 王传旗,谢国平,白玛曲珍,等.NaCl对西藏不同地域野生披碱草种子萌发的影响研究[J].黑龙江畜牧兽医,2017(7):142-146.
[20] 高凤菊,曹鹏鹏,王乐政,等.盐度对不同类型甜高粱品种萌发的影响[J].山东农业科学,2011(11):44-47.
[21] 戚志伟.崇明东滩滨海围垦湿地芦苇光合和生长对土壤水盐因子的响应[D].上海:华东师范大学,2017.
[22] 刘逸泠,覃盈盈,郑海雷.红树植物耐水淹和高盐适应性研究进展[J].厦门大学学报:自然科学版,2017,56(3):314-322.
[23] 林静雯,李莹,罗洁文,等.草甘膦对杉木种子萌发及幼苗生长的毒性效应[J].江西农业大学学报,2015,37(5):843-848,858.
[24] 张冬,张宇,王萌,等.草甘膦对植物生理影响的研究进展[J].热带农业科学,2016,36(9):55-61.
[25] 苏少泉.草甘膦述评[J].农药,2005,44(4):145-149.