传染性胰腺坏死病(Infectious pancreatic necrosis,IPN)是由传染性胰腺坏死病毒(Infectious pancreatic necrosis virus,IPNV)引起的严重危害虹鳟Oncorhynchus mykiss健康养殖的急性、传染性疾病之一[1]。根据病毒株、鱼龄和饲养环境的不同,IPN一般可造成虹鳟死亡率为10%~90%[1-3]。该病最早发生于美国和加拿大[4],随后在欧洲、亚洲、非洲等地暴发,并于20世纪80年代末传入中国山西[5]、甘肃[6]、山东[7]等省份及东北[8]等地,造成虹鳟死亡率高达90%,给虹鳟养殖带来了巨大的经济损失。
IPNV是属于双RNA病毒科Birnaviridae、水生双RNA病毒属Aquabirnavirus的无囊膜病毒[9],呈二十面体对称,直径为50~75 nm[10],基因组由A、B两段双链RNA构成[11]。A段基因含有2个开放阅读框(ORFs),其中,一个ORF编码约106 000的pVP2-VP4-VP3多聚蛋白前体,另一个ORF编码约15 000的非结构蛋白VP5[12];B段基因编码约94 000的聚合酶蛋白VP1[13]。VP2蛋白是IPNV病毒表面的主要结构蛋白,含有病毒抗原决定簇,能够诱导机体产生免疫中和抗体,在病毒侵入机体时起到关键的作用,因此,被广泛用于检测和预防IPNV的研究中[11,14]。
本研究中结合前期序列比对结果,对从中国云南省某虹鳟养殖场分离出的IPNV分离株进行了系统进化分析[15],并利用生物学分析软件对VP2蛋白的跨膜区、亲水性和抗原性等进行分析后,对其特定区段进行了原核表达,利用表达的VP2蛋白制备鼠抗血清,初步进行了免疫学鉴定,旨在为以VP2为目的蛋白的IPN流行病学检测及疫苗研究提供试验依据。
1 材料与方法
1.1 材料
IPNV病毒株,分离自云南省某养殖场患病虹鳟,记为ChRtm213,由黑龙江水产研究所鱼病实验室保存;大鳞大麻哈鱼胚胎细胞(Chinook salmon embryo cells,CHSE)由中国水产科学研究院长江水产研究所鱼类病害教研室提供;Balb/c小鼠购自黑龙江中医药大学实验动物中心。
pMD19-T simple克隆载体、限制性核酸内切酶、PrimeScriptTM One Step RT-PCR Kit Ver 2.0试剂盒购自宝生物工程(大连)有限公司;SV Total RNA Isolation System购自Promega公司;HRP标记的羊抗鼠IgG、FITC标记的羊抗鼠IgG购自Abcam公司;pET-27b表达载体、大肠杆菌DH5α、Rosetta菌株由黑龙江水产研究所鱼病实验室保存。
1.2 方法
1.2.1 引物合成 根据黑龙江水产研究所鱼病实验室分离的IPNV表面蛋白VP2的基因序列(NCBI登录号:KX234591),利用Primer Premier 5.0软件设计引物,上游引物VP2-F带有BamH Ⅰ酶切位点:5′GGATCCTGGTTCCAGAGTCGGTGCC 3′,下游引物VP2-R带有Hind Ⅲ酶切位点:5′AAGCTTTCATGCCTTTGAGGTTGGTAGGTCACTTGTG AAGT 3′,引物由哈尔滨博仕生物公司合成。
1.2.2 IPNV 病毒的扩增及RNA的提取 病毒的扩增及RNA提取方法参照文献[14]。
1.2.3 同源性分析 以IPNV的VP2基因为比对基因,利用MegAlign生物学软件对分离得到的IPNV病毒株与GenBank中收录的IPNV病毒株进行核苷酸同源性分析,并建立系统进化树。本研究中所用比对毒株如表1所示。
1.2.4 VP2基因的克隆 以“1.2.2”节中提取的IPNV RNA为模板,以VP2-F和VP2-R为引物,利用一步法RT-PCR试剂盒对VP2基因进行扩增。扩增产物经10 g/L琼脂糖凝胶电泳胶分离后,利用胶回收试剂盒对克隆片段进行回收。胶产物与克隆载体pMD19-T simple连接后,转化至大肠杆菌DH5α感受态细胞中,挑取单菌落经PCR鉴定正确后,提取质粒进行测序,测序正确的重组质粒命名为pMD19-T-VP2。
表1 比对毒株信息
Tab.1 Information of IPNV isolates
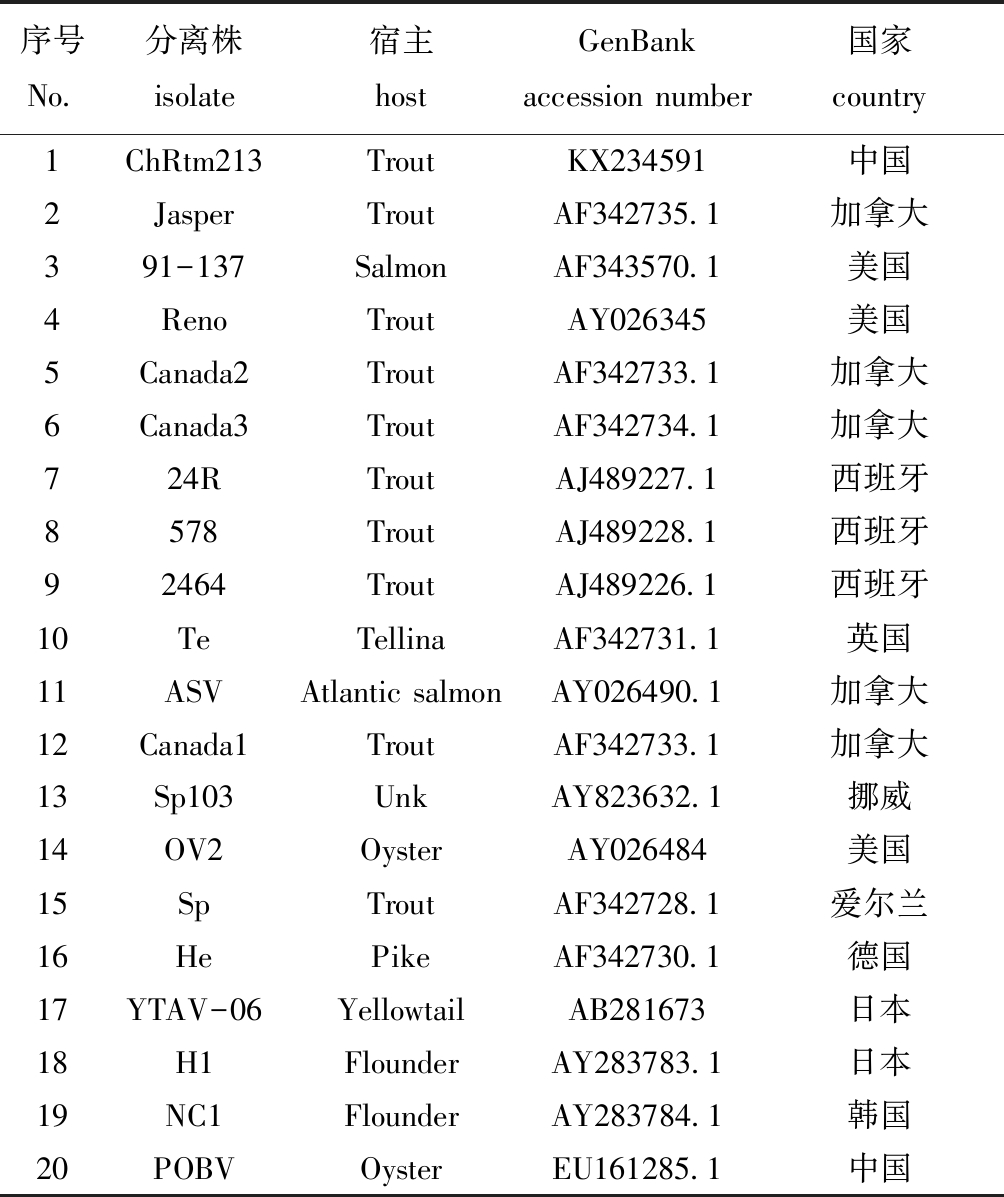
序号No.分离株isolate宿主hostGenBank accession number国家country1ChRtm213TroutKX234591中国2JasperTroutAF342735.1加拿大391-137SalmonAF343570.1美国4RenoTroutAY026345美国5Canada2TroutAF342733.1加拿大6Canada3TroutAF342734.1加拿大724RTroutAJ489227.1西班牙8578TroutAJ489228.1西班牙92464TroutAJ489226.1西班牙10TeTellinaAF342731.1英国11ASVAtlantic salmonAY026490.1加拿大12Canada1TroutAF342733.1加拿大13Sp103UnkAY823632.1挪威14OV2OysterAY026484美国15SpTroutAF342728.1爱尔兰16HePikeAF342730.1德国17YTAV-06YellowtailAB281673日本18H1FlounderAY283783.1日本19NC1FlounderAY283784.1韩国20POBVOysterEU161285.1中国
1.2.5 VP2表达载体的构建 将测序完全正确的重组质粒pMD19-T-VP2和pET-27b表达载体,分别经Hind Ⅲ和BamH Ⅰ双酶切后,利用胶回收试剂盒进行回收。回收产物利用T4 DNA连接酶连接后,转化至大肠杆菌DH5α感受态细胞中,挑取单菌落进行Hind Ⅲ和BamH Ⅰ双酶切鉴定,鉴定正确的重组质粒命名为pET-27b-VP2。
1.2.6 VP2蛋白的表达及纯化 将重组质粒pET-27b-VP2转化至大肠杆菌Rosetta感受态细胞中,挑取Rosetta/pET-27b-VP2单菌落置于含卡那霉素的LB液体培养基中,于37 ℃下振荡培养。当OD600 nm值达到0.3~0.4时,加入终浓度为0.25 mmol/L的IPTG诱导剂,于37 ℃下诱导表达VP2蛋白。分别于诱导前及诱导后2~7 h收集菌体,经PBS重悬菌液后进行超声破碎。超声破碎后的产物进行12% SDS-PAGE凝胶电泳,分析VP2蛋白诱导表达情况。
将超声破碎后的菌体于4 ℃下以12 000 r/min离心5 min,离心后的沉淀加入含有2 mol/L尿素的复性液洗涤3遍,再将沉淀用含有8 mol/L尿素的变性液溶解,待沉淀全部溶解后,缓慢加入30倍体积的复性液,于4 ℃下复性10 h后放入PBS溶液中(pH 8.0)透析24 h。透析结束后于4 ℃下以12 000 r/min离心5 min,收集上清,并进行12% SDS-PAGE电泳分析。
1.2.7 IPNV VP2 蛋白抗血清的制备 采用对Balb/c小鼠进行皮下多点注射免疫的方法制备IPNV VP2蛋白抗血清,VP2蛋白的免疫剂量为0.5 mg/kg,每次免疫间隔为10 d,共免疫3次。本研究中,将弗氏完全佐剂与纯化的VP2蛋白等体积乳化后进行首次免疫,将弗氏不完全佐剂与VP2蛋白乳化后进行第2、3次免疫,同时以PBS与佐剂乳化进行免疫作为对照组。免疫结束后,从小鼠眼球取血,将血清分装于无菌管中于超低温冰箱(-80 ℃)中保存备用。
1.2.8 IPNV VP2蛋白抗血清效价的检测 采用“1.2.5”节中表达纯化的VP2蛋白包被酶标试剂板,并分别设置阴性对照及空白对照孔。以“1.2.6”节中制备的鼠抗血清作为一抗,HRP标记的羊抗鼠IgG作为二抗;待二抗反应结束用PBST充分洗涤后,加入TMB底物液于37 ℃下避光显色5 min,加入终止液终止反应,于450 nm波长下检测酶标孔的OD值。当OD450 nm所读数值符合(阳性孔-空白孔)/(阴性孔-空白孔)>2.1时,此时的血清最大稀释倍数即为所制备的鼠抗血清的效价。
1.2.9 间接免疫荧光(IFA)检测免疫原性 参照文献[14,16]中的方法制备CHSE单层细胞爬片,并接种本实验室分离的IPNV毒株。按照文献[14]中的方法处理细胞后,分别加入本研究中制备的鼠抗血清,于37 ℃下反应1 h后孵育FITC标记的羊抗鼠IgG二抗,用PBS洗涤后置于荧光显微镜下观察结果。
1.3 数据处理
试验数据采用SPSS 22软件进行方差分析,采用t检验进行两组间显著性比较,显著性水平设为0.05。
2 结果与分析
2.1 IPNV分离株的进化分析
利用IPNV的A链基因对其进行系统进化分析,结果表明,本实验室分离的IPNV分离株ChRtm213与美国株Reno、加拿大株Jasper和91~137菌株聚为一簇,同属于基因1型(图1),ChRtm213分离株与中国已经报道的双链RNA病毒不同,为中国目前流行的IPNV毒株。
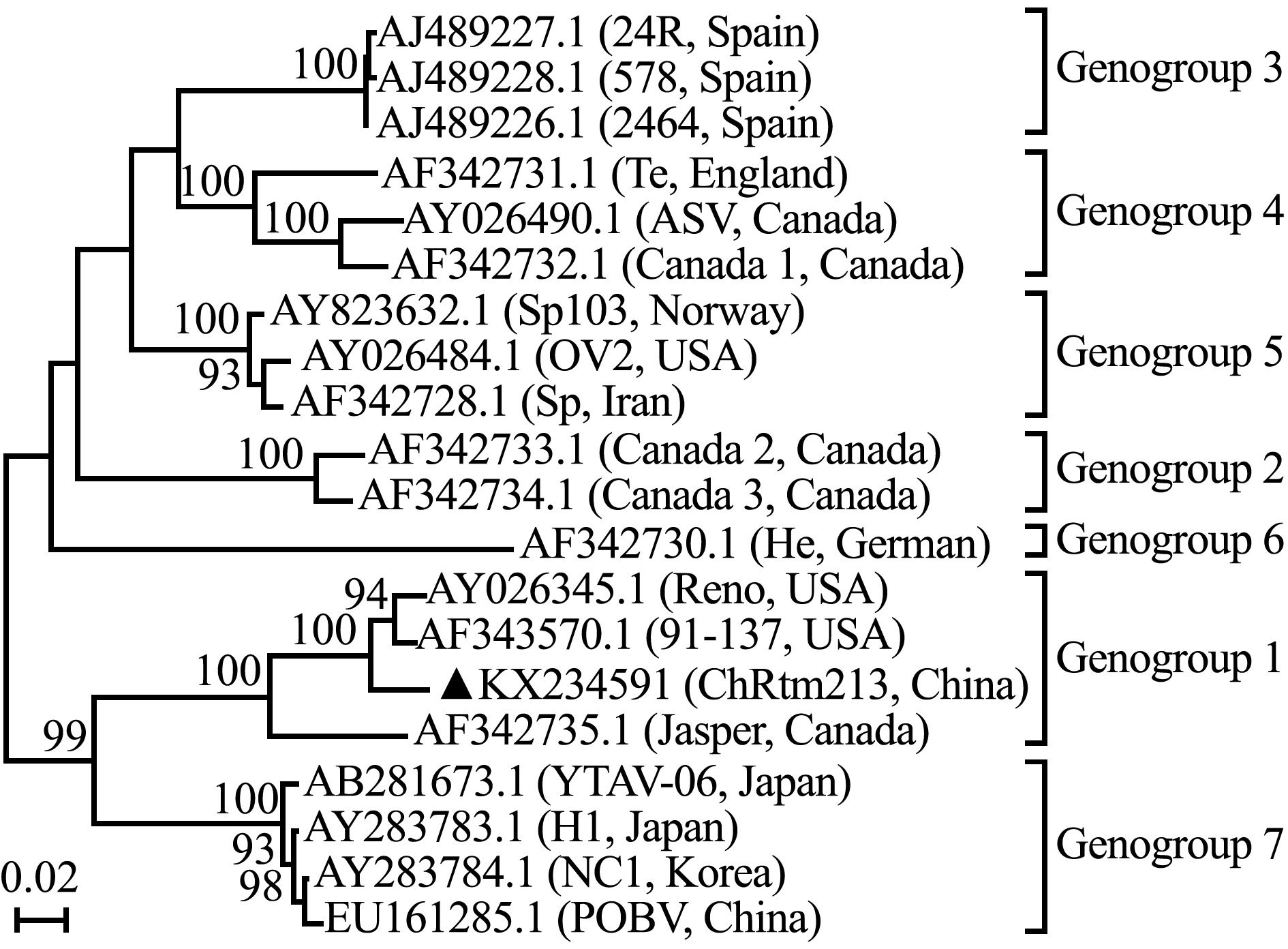
图1 云南分离株ChRtm213基于A链序列的系统发育关系
Fig.1 Phylogenetic tree of ChRtm213 isolate from Yunan,China based on complete genome of segment A
2.2 VP2蛋白的疏水性及抗原性分析
利用TMHMM Server在线分析软件及DNAStar 6.0(Protean)软件,分别对VP2蛋白的跨膜区、亲水性和抗原性等进行了分析。结果表明:VP2蛋白在第450~486位氨基酸处存在跨膜区(图2-A中红色区域),且该蛋白区段呈现出疏水性(图2-B);VP2蛋白在第48~60、160~170、248~280、345~371和453~478位氨基酸处存在较强的疏水性(图2-B)。因此,综合考虑VP2蛋白的跨膜区、亲水性、抗原性及表面可能性后,本研究中选取VP2蛋白的第68~451位氨基酸进行克隆及原核表达,选定表达区域为图2中黑色矩形框圈定区域。
2.3 VP2基因的克隆及表达载体的构建
以提取的IPNV病毒悬液的RNA为模板、VP2-F/VP2-R为引物扩增目的基因,扩增产物经10 g/L琼脂糖凝胶电泳显示,PCR产物为单一的特异性条带,大小约为1149 bp,与目的片段大小相符(图3)。将连接pMD19-T载体测序正确的片段酶切后,连接pET-27b载体,转化至大肠杆菌DH5α感受态细胞中,提取质粒进行PCR及双酶切鉴定,结果与目的片段相符(图4),表明pET-27b-VP2重组质粒构建成功。

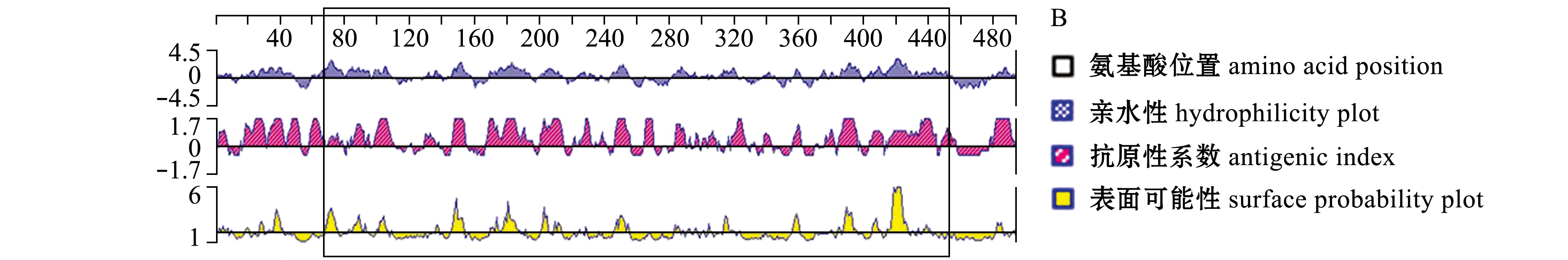
图2 VP2蛋白的跨膜区、抗原表位及疏水性分析
Fig.2 Transmembrane domain,hydrophobicity and antigenic determinants of VP2 protein
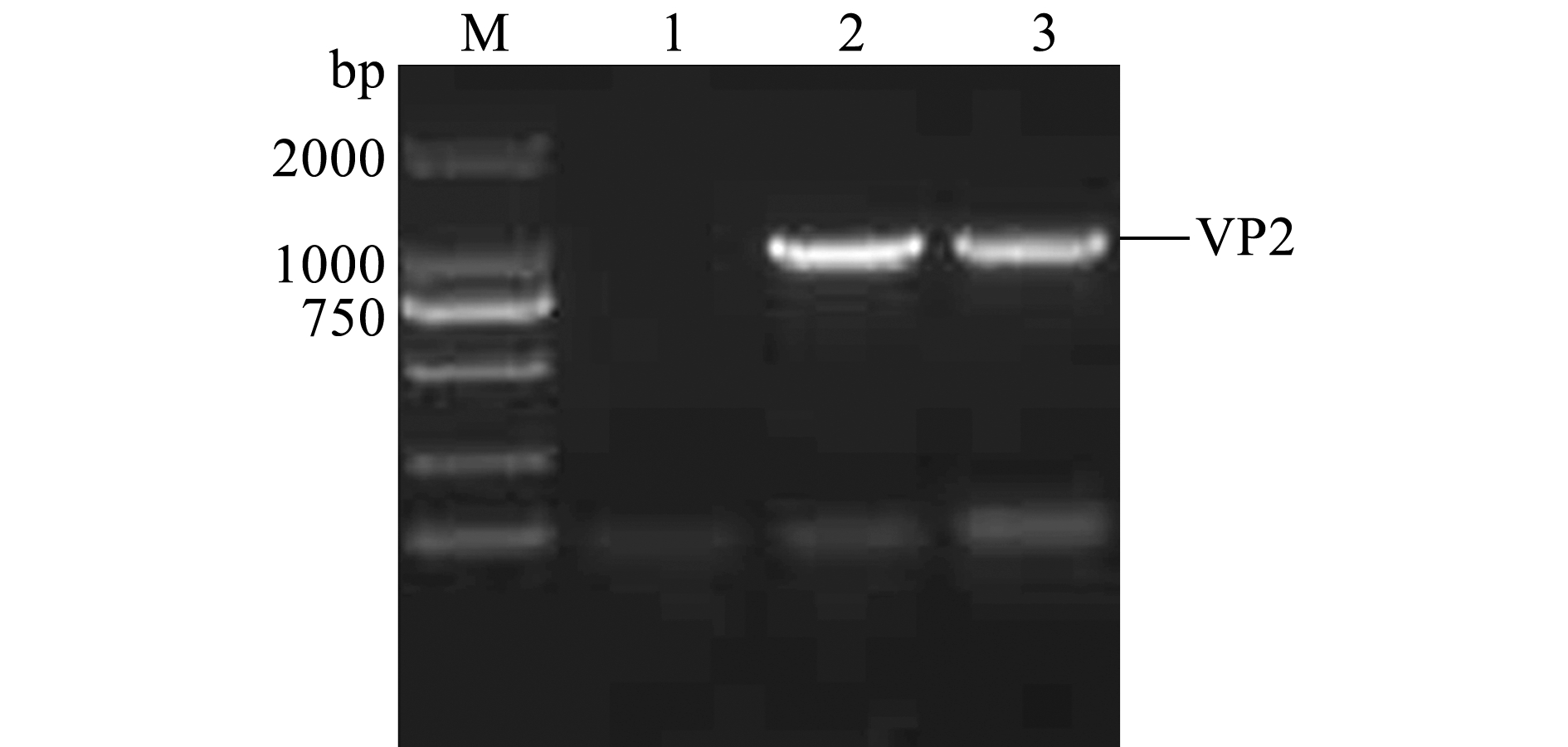
注:M为DL2000分子量标准;1为阴性对照;2~3为VP2基因片段
Note:M, DL2000 DNA Marker; 1, Negative control; 2-3, RT-PCR product of VP2 gene
图3 VP2基因克隆产物琼脂糖凝胶电泳图
Fig.3 Agarose gel electrophoresis of VP2 gene from RT-PCR
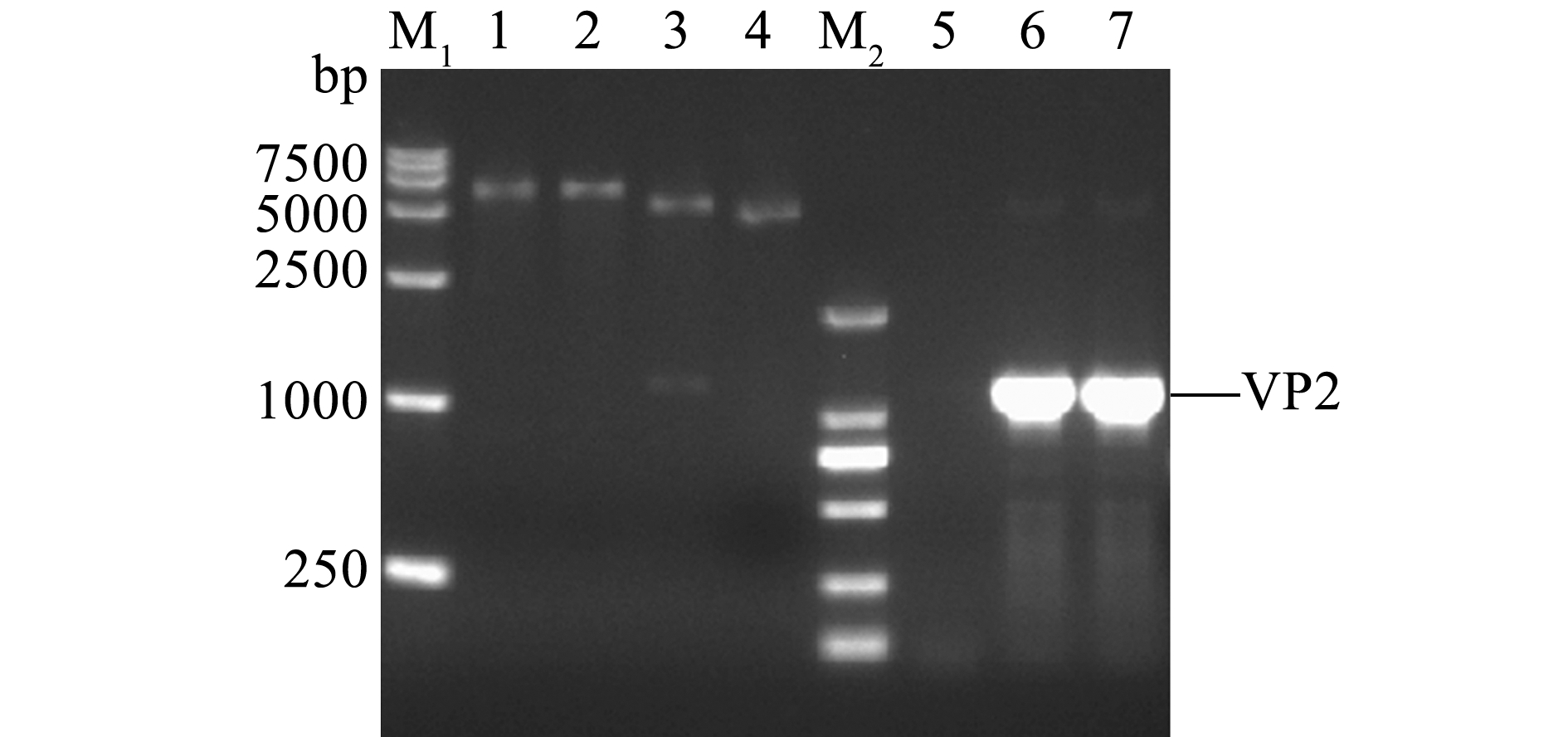
注:M1为DL15000分子量标准;M2为DL2000分子量标准;1为BamH Ⅰ酶切后的重组质粒;2为Hind Ⅲ酶切后的重组质粒;3为BamH Ⅰ和Hind Ⅲ双酶切后的重组质粒;4为未酶切的重组质粒;5为PCR鉴定阴性对照;6~7为PCR鉴定产物
Note:M1,DL15000 DNA Marker; M2,DL2000 DNA Marker; 1,Digested plasmid by BamH Ⅰ; 2,Digested plasmid by Hind Ⅲ; 3,Dual-digested plasmid by BamH Ⅰ and Hind Ⅲ; 4,Recombinant plasmid pET-27b-VP2; 5,Negative control; 6-7,PCR product of pET-27b-VP2 recombinant plasmid
图4 pET-27b-VP2重组质粒PCR及酶切鉴定
Fig.4 PCR and dual-digestion of pET-27b-VP2 recombinant plasmid
2.4 VP2蛋白的诱导表达
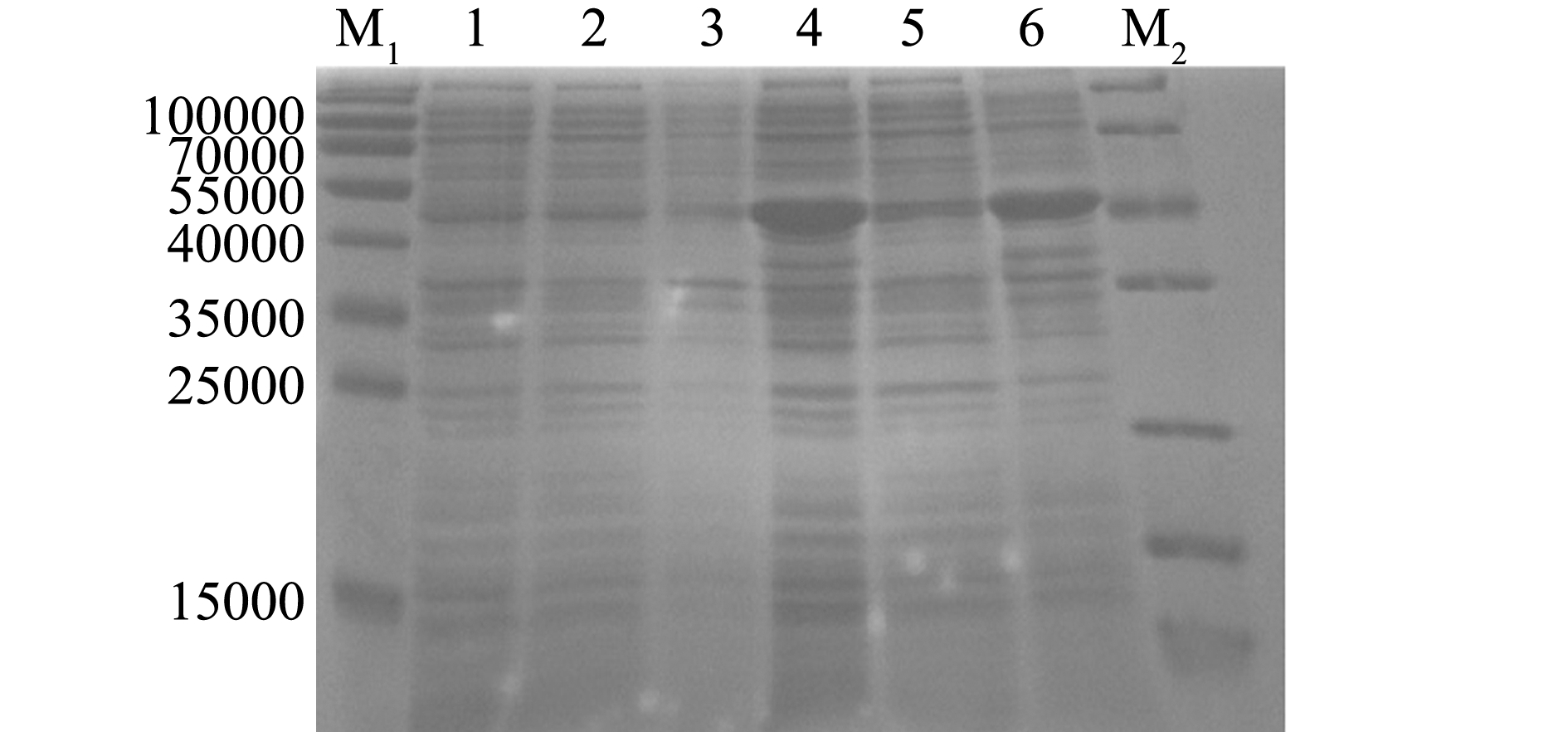
IPTG诱导前及诱导后2~7 h的菌体经超声破碎离心后,进行SDS-PAGE电泳分析,结果表明,在约46 000处有特异性蛋白条带表达,与VP2蛋白的预期理论值相符,该蛋白在IPTG诱导6 h后表达量达到最大值(图5)。对VP2蛋白表达的可溶性分析表明,VP2蛋白主要存在于菌体破碎离心后的沉淀中,说明本研究中表达的VP2蛋白以包涵体的形式存在(图6)。

注:M1、M2为蛋白分子量标准;1为未诱导的菌体蛋白;2、3、4、5、6、7分别为诱导7、6、5、4、3、2 h后的菌体蛋白
Note:M1and M2,protein Marker; 1, Uninduced bacterial protein; 2 to 7, protein expression induced for 7,6,5,4,3,and 2 h
图5 不同诱导时间下VP2蛋白的表达
Fig.5 VP2 protein expression induced for different hours
注:M1、M2为蛋白分子量标准;1为未诱导菌体总蛋白;2为未诱导菌体破碎后上清中蛋白;3为未诱导菌体破碎后沉淀中蛋白;4为诱导后破碎菌体总蛋白;5为诱导后破碎菌体上清中蛋白;6为诱导后破碎菌体沉淀中蛋白
Note:M1and M2, Protein Marker; 1, Uninduced bacterial protein; 2, Supernatant of uninduced bacteria; 3, Sediment of uninduced bacteria; 4, Induced bacteria; 5, Supernatant of induced bacteria; 6, Sediment of induced bacteria
图6 VP2蛋白的可溶性分析
Fig.6 Solubility analysis of VP2 protein
2.5 VP2蛋白的纯化
表达VP2蛋白的菌体破碎后离心收集沉淀,并经蛋白质变性及复性纯化后获得可溶性VP2蛋白,复性后的可溶性VP2蛋白于PBS溶液中透析24 h后进行SDS-PAGE电泳分析。结果表明,经蛋白质变性、洗涤、复性和PBS透析后得到了可溶性VP2蛋白,且纯化后的VP2蛋白为单一条带(图7),其纯度可用于VP2蛋白鼠抗血清的制备。
2.6 IPNV VP2蛋白鼠抗血清效价的检测
用IPNV病毒培养物和纯化的VP2蛋白分别作为抗原包被酶标板,以不同稀释度的鼠抗血清作为一抗,进行ELISA检测。结果表明,满足(阳性血清OD450 nm-空白孔OD450 nm)/(阴性血清OD450 nm-空白孔OD450 nm)>2.1时,鼠抗血清的最大稀释倍数分别为1∶20 000(包被IPNV病毒培养物)和1∶40 000(包被VP2蛋白)(图8)。这表明,本研究中制备的鼠抗血清能够识别IPNV病毒的VP2蛋白,证明表达的VP2蛋白与IPNV病毒的VP2蛋白具有相近的免疫原性。
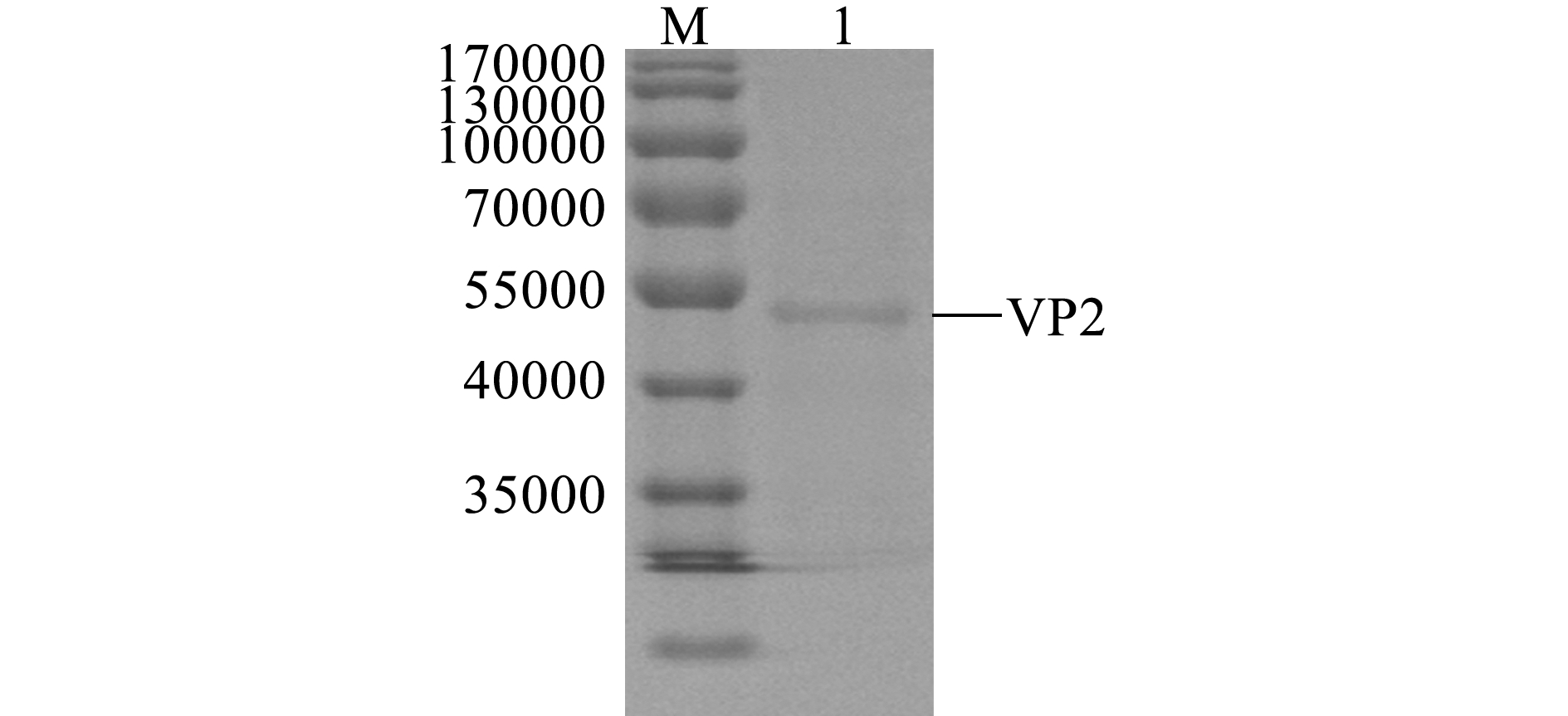
注:M为蛋白分子量标准;1为纯化后的VP2蛋白
Note:M,Protein marker; 1,Purified VP2 protein
图7 VP2蛋白纯化后的SDS-PAGE分析
Fig.7 SDS-PAGE gel analysis of purified VP2 protein
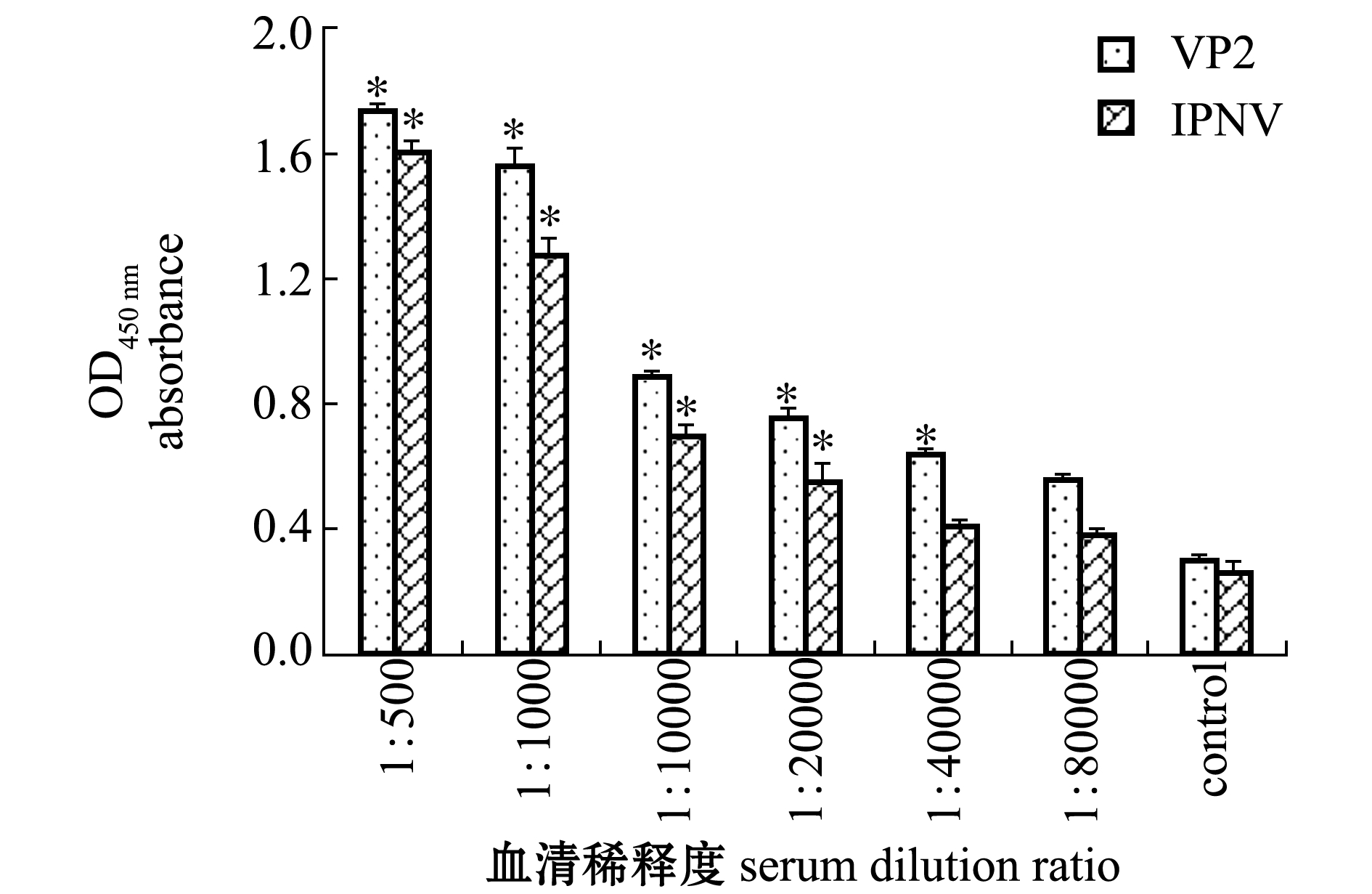
注:*表示与对照组有显著性差异(P<0.05)
Note: *means significant difference compared with the control (P<0.05)
图8 抗血清效价检测
Fig.8 ELISA analysis of anti-serum titre
2.7 间接免疫荧光检测免疫原性
将制备的CHSE单层细胞爬片接种本实验室分离的IPNV毒株,以此细胞作为间接免疫荧光检测的抗原,以本试验中制备的鼠抗血清作为检测抗体,进行免疫原性的间接免疫荧光检测。结果表明,在细胞感染病毒24、48 h后,本试验中制备的鼠抗血清均能与IPNV毒株发生特异性反应,并呈现出绿色荧光(图9),说明本试验中制备的鼠抗血清能够较好地识别病毒表面VP2蛋白,也再次证明经试验所表达的VP2蛋白与实验室分离的IPNV病毒VP2蛋白具有相近的免疫原性。
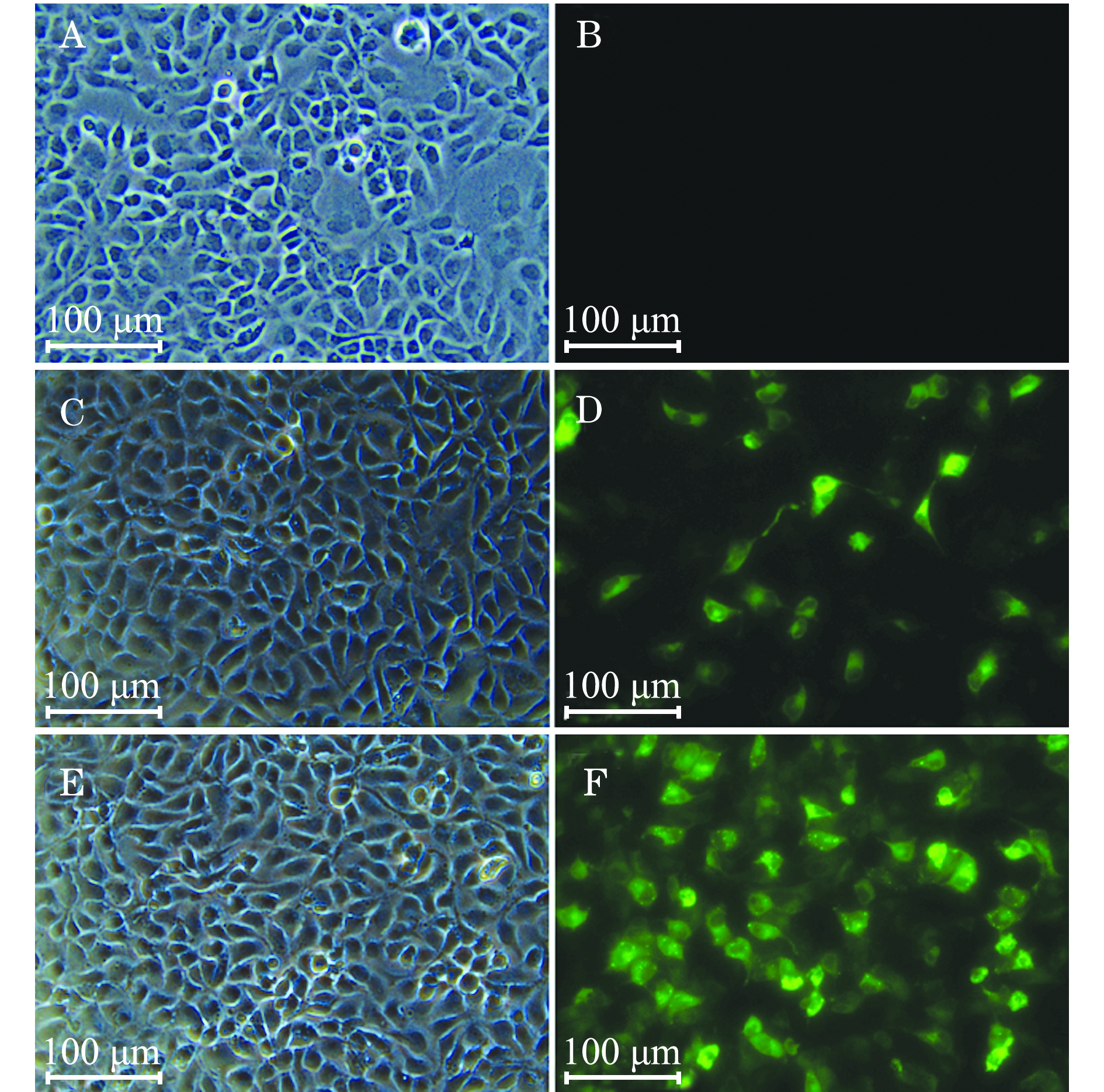
注:A为无病毒感染对照细胞形态;B为无病毒感染对照细胞免疫荧光检测结果;C为细胞感染IPNV 24 h后细胞形态;D为细胞感染IPNV 24 h后免疫荧光检测结果;E为细胞感染IPNV 48 h后细胞形态;F为细胞感染IPNV 48 h后免疫荧光检测结果
Note:A, control cells without virus infection; B, the IFA result of control cells without virus infection; C, cells infected with IPNV for 24 h; D, the IFA result of cells infected with IPNV for 24 h; E, cells infected with IPNV for 48 h; F, the IFA of cells infected with IPNV for 48 h
图9 VP2蛋白鼠抗血清间接免疫荧光检测结果
Fig.9 IFA of the antisera against VP2 protein
3 讨论
3.1 IPNV ChRtm213分离株的进化分析
随着世界范围内水产品贸易的增加,IPNV已扩散至亚洲的多个国家。从20世纪80年开始,代传染性胰腺坏死病在中国黑龙江、吉林、山东、辽宁、甘肃等地相继暴发[5,17-19]。但这些IPNV毒株的全基因组序列均未被GenBank收录,ChRtm213全基因组序列是中国提交的第一个IPNV全序列[15]。IPNV ChRtm213全基因组的相关信息,如基因组序列、基因型和血清型将为中国以后IPNV毒株的研究提供重要参考。IPN主要发生在中国北部,本研究中IPNV ChRtm213株从位于中国西南的云南省分离获得,是中国传染性胰腺坏死病暴发的现行毒株。与中国学者前期报道的其他IPNV分离株相比较,ChRtm213株具有不同的血清型及病毒毒力[20],具有非常重要的研究意义。
3.2 VP2蛋白的表达分析
由于VP2蛋白是IPNV病毒表面的主要结构蛋白,能够诱导机体产生免疫中和抗体,在病毒侵入机体时起到关键的作用,目前多将其用于传染性胰腺坏死病的检测及免疫预防研究中[21-23]。由于前期研究表明,异源蛋白在跨物种表达时存在表达困难的情况[24],而pET表达载体作为高效的异源蛋白表达载体,能够表达多种异源蛋白[25-26],因此,本研究中利用pET表达载体对VP2蛋白进行原核表达。已有研究表明,利用pET表达载体表达的蛋白多为包涵体[25-26],而蛋白的跨膜区及疏水区对于其复性过程中的正确折叠有较大影响,因此,本研究中通过已有研究报道及生物学软件分析相结合的方式,对VP2蛋白进行了截断表达。已有研究表明,VP2蛋白的高变区位于183(243)~335位氨基酸[27],同时,其217~221位氨基酸与病毒的毒力密切相关[28]。本研究中利用TMHMM Server在线分析软件及DNAStar 6.0(Protean)软件,分别对VP2蛋白的跨膜区、亲水性和抗原性等进行了分析。在综合考虑VP2蛋白的跨膜区、亲水性、抗原性和表面可能性后,选取了VP2蛋白的第68~451位氨基酸对应的核苷酸序列进行克隆及原核表达。结果表明,在经过蛋白质的变性及复性后,成功获得了可溶性的VP2蛋白;SDS-PAGE分析结果表明,本研究中所得VP2蛋白在纯度及浓度上与连科讯等[29]及王健楠等[30]的研究相比均有明显提高。这一结果可能是由于去掉跨膜区及部分蛋白质疏水区对VP2蛋白进行表达的缘故。
3.3 VP2抗血清分析
虽然王健楠等[30]于2012年针对IPNV的VP2蛋白已经制备了多克隆抗体,其抗体效价达到了1∶12 800,但其研究中所采用的IPNV病毒是从美国ATCC购买的标准毒株,其血清型为A2,与本研究中报道的中国现行IPNV ChRtm213血清型不同。而本研究中所制备的抗VP2血清为中国现行的IPNV毒株,对中国目前IPNV的检测及研究有较好的指导作用。加之间接ELISA和间接免疫荧光试验结果显示,鼠抗血清可与IPNV分离株细胞培养物或VP2蛋白产生特异反应,效价分别为1∶20 000(包被IPNV病毒培养物)和1∶40 000(包被VP2蛋白),说明本试验中获得的VP2蛋白具有与IPNV ChRtm213株相近的免疫原性,可用于IPNV的特异性检测和免疫预防[31]。
综上所述,本研究中所用的IPNV ChRtm213病毒株是中国西南地区的现行毒株,对应的血清型为A9或A1,具有与以往毒株不同的病毒毒力[20],对现行A9或A1血清型毒株的免疫防控和疫苗开发更具有针对性,可为中国不同地区尤其是西南地区的IPNV监测及免疫预防工作提供了技术支持。
[1] 王旭,颜其贵,雷燕.鱼类传染性胰腺坏死病的病毒学特征、诊断及防治研究[J].水产科学,2010,29(9):559-562.
[2] 葛均青,龚晖,陈超.水生动物双RNA病毒的研究进展[J].武夷科学,2014,30(1):162-167.
[3] Rivas-Aravena A,Cortez-San Martin M,Galaz J,et al.Evaluation of the immune response against immature viral particles of infectious pancreatic necrosis virus (IPNV):a new model to develop an attenuated vaccine[J].Vaccine,2012,30(34):5110-5117.
[4] Wolf K,Snieszko S F,Dunbar C E,et al.Virus nature of infectious pancreatic necrosis in trout[J].Proceedings of the Society for Experimental Biology and Medicine,1960,104(1):105-108.
[5] 江育林,徐伯亥,李伟,等.虹鳟传染性胰脏坏死病病毒(IPNV)的初步研究[J].水生生物学报,1989,13(4):353-358,394.
[6] 刘兴发,王熹洲,娄淑杰,等.虹鳟鱼传染性胰腺坏死病毒的分离与鉴定[J].中国兽医科技,1991,21(6):11-14.
[7] 童裳亮,Hetrick F M.山东虹鳟暴发传染性胰脏坏死病(IPN)[J].海洋通报,1989,8(1):118.
[8] 孙颖杰,陈文义,夏德昌,等.虹鳟鱼传染性胰脏坏死病毒的分离与鉴定[J].水产学杂志,1993,6(1):50-56.
[9] Dadar M,Peyghan R,Memari H R,et al.Sequence analysis of infectious pancreatic necrosis virus isolated from Iranian reared rainbow trout (Oncorhynchus mykiss) in 2012[J].Virus Genes,2013,47(3):574-578.
[10] Munang’andu H M,Mutoloki S,Evensen Ø.Acquired immunity and vaccination against infectious pancreatic necrosis virus of salmon[J].Developmental & Comparative Immunology,2014,43(2):184-196.
[11] Cuesta A,Chaves-Pozo E,de Las Heras A I,et al.An active DNA vaccine against infectious pancreatic necrosis virus (IPNV) with a different mode of action than fish rhabdovirus DNA vaccines[J].Vaccine,2010,28(19):3291-3300.
[12] Bowers R M,Lapatra S E,Dhar A K.Detection and quantitation of infectious pancreatic necrosis virus by real-time reverse transcriptase-polymerase chain reaction using lethal and non-lethal tissue sampling[J].Journal of Virological Methods,2008,147(2):226-234.
[13] Duncan R,Mason C L,Nagy E,et al.Sequence analysis of infectious pancreatic necrosis virus genome segment B and its encoded VP1 protein:a putative RNA-dependent RNA polymerase lacking the Gly-Asp-Asp motif[J].Virology,1991,181(2):541-552.
[14] 徐黎明,刘红柏,尹家胜,等.传染性造血器官坏死病毒糖蛋白原核表达及免疫原性分析[J].病毒学报,2013,29(5):529-534.
[15] Ji Feng,Zhao Jingzhuang,Liu Miao,et al.Complete genomic sequence of an infectious pancreatic necrosis virus isolated from rainbow trout (Oncorhynchus mykiss) in China[J].Virus Genes,2017,53(2):215-225.
[16] Hill B J.Infectious pancreatic necrosis virus and its virulence[M]//Roberts R J.Diseases of Fish.London:Academic Press,1982.
[17] 孙颖杰,陈文义,夏德昌,等.虹鳟鱼传染性胰脏坏死病毒的分离与鉴定[J].中国进出境动植检,1995(2):32-34.
[18] 牛鲁祺,赵志壮.东北地区虹鳟IHN和IPN流行病学的初步研究[J].水产学报,1988,12(4):327-332.
[19] 胡晓利,李伟,肇慧君,等.虹鳟鱼传染性胰脏坏死病病毒的分离与鉴定[J].中国动物检疫,2012,29(3):27-30.
[20] 刘淼,徐黎明,赵景壮,等.虹鳟传染性胰脏坏死病毒的分离鉴定及聚类分析[J].大连海洋大学学报,2017,32(1):56-61.
[21] Dadar M,Memari H R,Vakharia V N,et al.Protective and immunogenic effects of Escherichia coli-expressed infectious pancreatic necrosis virus (IPNV) VP2-VP3 fusion protein in rainbow trout[J].Fish & Shellfish Immunology,2015,47(1):390-396.
[22] Zhao Lili,Liu Min,Ge Junwei,et al.Expression of infectious pancreatic necrosis virus (IPNV) VP2-VP3 fusion protein in Lactobacillus casei and immunogenicity in rainbow trouts[J].Vaccine,2012,30(10):1823-1829.
[23] Liu Min,Zhao Lili,Ge Junwei,et al.Immunogenicity of Lactobacillus-expressing VP2 and VP3 of the infectious pancreatic necrosis virus (IPNV) in rainbow trout[J].Fish & Shellfish Immunology,2012,32(1):196-203.
[24] 赵景壮,徐黎明,刘淼,等.鱼类传染性造血器官坏死病病毒糖蛋白的截短表达及免疫原性检测[J].细胞与分子免疫学杂志,2014,30(12):1238-1242.
[25] Qi Jianying,Kan Fangming,Ye Xianlong,et al.A bispecific antibody against IL-1β and IL-17A is beneficial for experimental rheumatoid arthritis[J].International Immunopharmacology,2012,14(4):770-778.
[26] 刘林,徐诗英,李婧慧,等.草鱼出血病病毒VP6蛋白的原核表达、纯化及免疫效果[J].水产学报,2012,36(3):429-435.
[27] Blake S,Ma J Y,Caporale D A,et al.Phylogenetic relationships of aquatic birnaviruses based on deduced amino acid sequences of genome segment A cDNA[J].Diseases of Aquatic Organisms,2001,45(2):89-102.
[28] Song Haichen,Santi N,Evensen Ø,et al.Molecular determinants of infectious pancreatic necrosis virus virulence and cell culture adaptation[J].Journal of Virology,2005,79(16):10289-10299.
[29] 连科迅,赵丽丽,张琳琳,等.传染性胰腺坏死病毒VP2 COE蛋白单克隆抗体的制备与初步应用[J].水产学报,2013,37(8):1229-1235.
[30] 王健楠,赵丽丽,刘立月,等.传染性胰腺坏死病病毒分离株VP2基因抗原表位区融合表达及免疫特性的分析[J].水产学报,2012,36(11):1770-1775.
[31] Christie K E,Ness S,Djupvik H O.Infectious pancreatic necrosis virus in Norway:partial serotyping by monoclonal antibodies[J].Journal of Fish Diseases,2010,13(4):323-327.