翅碱蓬Suaeda heteroptera隶属于藜科Chenopodiaceae、碱蓬属Suaeda,为一年生聚盐性耐盐草本植物,多生长于滨海湿地、湖边、荒漠、盐碱地等[1]。翅碱蓬在重盐碱地区生长时叶片呈红色,不仅具有较强的观赏性,还具有食用、药用价值。因其抗逆性强,翅碱蓬是滩涂湿地的优势植物物种,在保护海洋生态环境、调节区域气候、净化湿地污水等方面发挥着重要作用。
作为盐碱地先锋生物,翅碱蓬适宜生长在含盐量为1%左右的湿润土壤中,易形成单一优势物种;在含盐量为2.5%~3.0%的土壤中也可生长;当土壤含盐量高于 3%时,植株难以存活[2]。除具有较强的耐盐性外,翅碱蓬还对土壤具有明显的脱盐效果。张立宾等[3]研究发现,在滨海盐渍地区种植翅碱蓬,3年后土壤含盐量从1.64%下降至1.20%,脱盐率达到26.84%。Deinlein等[4]研究发现,翅碱蓬的除盐机制是在叶片中螯合盐。目前,对翅碱蓬的研究主要集中在其生理生化方面[5-6],有关其分子水平耐盐机制的研究较为少见。解析翅碱蓬耐受高盐胁迫的分子机理有助于进一步理解其盐胁迫适应机制,这对于培育耐盐植物品种、修复改良盐渍土壤有着重要意义。
基于高通量测序的比较全转录组学方法使得解析植物耐盐的分子机制成为可能,相关研究在碱蓬(S.glauca)、海水稻(Porteresia coarctata)、灌木碱蓬(S.fruticosa)等植物中已有报道[7-9]。在高盐胁迫下,碱蓬有231个基因发生差异表达,这些差异表达基因参与包括信号转导、物质运输、细胞壁合成、植物生长、防御代谢和转录调控等在内的多个生理生化过程[7]。Garg等[8]研究发现,在高盐胁迫下,野生海水稻有118个基因发生差异表达,其中,NAC、MYB 和WKKY家族的成员占比较高。本研究中,采用比较转录组学方法研究了翅碱蓬在高盐胁迫下转录组发生的变化,并对差异表达基因富集的5个主要代谢通路进行了详细阐述,从代谢通路水平探讨了其响应盐胁迫的分子机制。
1 材料与方法
1.1 材料
试验所用翅碱蓬种子于2016年10月采自辽宁省盘锦市红海滩湿地。
1.2 方法
1.2.1 翅碱蓬植株幼苗的水培 挑取籽粒饱满健康的翅碱蓬种子若干,在超净工作台上先用无菌水冲洗2~3次,然后置于浓度为2%的NaClO溶液中浸泡2 min,最后再用无菌水冲洗3次,鼓风吹干。用无菌镊子将表面消毒后的种子移至改良霍格兰植物琼脂培养基上,置于恒温光照培养箱内发芽培养。培养箱光暗比为14 h∶10 h,白昼温度为25 ℃,黑夜温度为20 ℃,光照强度为8800 lx。每天定时观察记录翅碱蓬生长情况。植物在培养皿中培养至第10天时,选取健康翅碱蓬幼苗(株高1~3 cm)移入装有1/2改良霍格兰营养液(以下简称营养液)的水培容器中继续培养,每周更换一次营养液,其他培养条件不变,观察记录其生长情况。
1.2.2 盐胁迫浓度的筛选及处理 参照辽东湾辽河口海域海水盐度约为32,将试验组盐胁迫浓度设置为7个组:盐度0(0 mmol/L NaCl,对照组)、5(86 mmol/L NaCl)、10(171 mmol/L NaCl)、20(342 mmol/L NaCl)、35(599 mmol/L NaCl)、50(856 mmol/L NaCl)、60(1026 mmol/L NaCl),每个盐度组设3个重复。选取水培30 d且长势相同的植株共计105株,取5株将其移植到装有各对应盐浓度溶液的烧杯中,然后将烧杯放到恒温光照培养箱中培养3 d,观察记录各盐浓度组植株的生长情况。由于盐胁迫对翅碱蓬植株根的生长影响最为明显,因而将此作为生长差异的区分标准,测量各盐浓度组胁迫3 d后植株的根长。最终选定盐度50(856 mmol/L NaCl)作为胁迫浓度。
1.2.3 高盐胁迫试验 选取水培30 d且健康的植株60株,将其分为盐胁迫处理组(856 mmol/L NaCl)和对照组(0 mmol/L NaCl),每组设3个重复,每个重复10株。将翅碱蓬植株用纯水冲洗去除原营养液后,分别移入加有856 mmol/L NaCl的营养液和新鲜营养液中处理2 h[4],将植株取出,再用无菌滤纸快速吸干残余营养液,用液氮速冻后保存于冰箱(-80 ℃)中,用于提取RNA。
1.2.4 RNA提取及cDNA合成 植物组织总RNA提取试剂盒购自宝生物工程(大连)有限公司(TaKaRa),参照其说明书方法分别提取两组翅碱蓬植株的总RNA。用10 g/L琼脂糖凝胶电泳检测提取RNA的完整性,用NanoDrop检测其浓度和纯度。使用Oligo(dT)磁珠富集样品中的mRNA,用random hexamers合成第一条cDNA,并以此为模板合成第二条cDNA,再用AMPure XP beads对双链cDNA进行纯化。
1.2.5 测序文库制备及转录组测序 对纯化后的cDNA加A尾及连接测序接头来对其进行末端修复,使用AMPure XP beads选择片段大小,进行PCR扩增,最终利用纯化后的PCR产物来构建文库。使用Qubit 2.0软件进行初步定量以对构建完成的文库进行库检,当稀释文库至1.5 ng/μL时,使用insert size(Agilent 2100文库)进行检测,随后利用Q-PCR方法准确定量(浓度>2 nmol为文库有效浓度)。最后使用Illumina Hi Seq对cDNA文库进行测序。
1.2.6 生物信息学分析 为确定测序数据是否适用于后续分析,首先对转录组测序所得到的原始序列(Raw reads)进行质控(QC)。由于本研究中无参考基因组,因此,为了后续参考序列分析,需要将获得的Clean reads用Trinity程序拼接起来,选取每个基因中最长的转录本作为Unigene后续分析。测序后用RPKM法计算基因表达量,根据基因表达量(RPKM值)确定出差异表达倍数大于2倍(含2倍)的基因,即为差异表达基因。为获得全面的基因功能信息,本研究中将拼接得到的Unigene与Nr、Nt、Pfam、KOG/COG、Swiss-Prot、KEGG、GO数据库进行基因功能注释。
1.2.7 实时定量PCR 为验证RNA-seq结果的可靠性,从144个差异表达基因中随机抽取6个进行qRT-PCR验证,其中包括3个表达下调基因(DN34016、DN30647、DN35733)和3个表达上调基因(DN30286、DN37854、DN29039)。将提取好的翅碱蓬总RNA,采用TaKaRa公司的PrimeScriptTMRT reagent Kit with gDNA Eraser试剂盒反转录合成cDNA第一链,作为实时定量PCR模板。各基因做3组重复,采用 2-ΔΔCT法计算基因的相对表达量。qRT-PCR引物序列见表1,6个差异表达基因的引物序列根据RNA-seq结果设计,而内参基因ACTIN的引物根据翅碱蓬同属植物碱蓬S.glauca、S.maritime、S.liaotungensis和盐地碱蓬S.salsa的ACTIN基因序列比对结果中的保守区域设计。
2 结果与分析
2.1 盐胁迫浓度筛选结果
从图1可见:经不同浓度NaCl胁迫处理3 d后,翅碱蓬植株根生长情况出现明显差异;当盐度为10(171 mmol/L NaCl)及以上时,翅碱蓬根生长受到显著抑制(P<0.05);当盐度为50(856 mmol/L NaCl)及以上时,碱蓬根部基本不再生长,平均根长变化仅为0.3 mm;而当盐度增至60(1026 mmol/L NaCl)时,植物根部出现明显萎蔫。因此,选择盐度50(856 mmol/L NaCl)作为下一步的盐胁迫试验浓度。
表1 实时定量PCR引物序列
Tab.1 Sequences of primers for quantitative real-time PCR

引物primer 序列(5′-3′)sequence(5′-3′) 目标基因target gene34016RT-FAGCCATCCAGGCCGTACTCT34016RT-RAGGATGGCATGAGGCAAGGCDN3401630647RT-FTCTCTCGTCGCAAGGCCCTA30647RT-RACGGCTACCTTTGCCTTGAGCDN3064735733RT-FACTGCTTCTCGGCAGCCAAA35733RT-RCACGCCGTCTCCTCCTCCTADN3573330286RT-FCGGAAGCGAGTCTTTAATATCAGGCT30286RT-RGAGCCGAGGGAAGAGCTGACDN3028637854RT-FTCTGAAGCGCCTCTCCCTTT37854RT-RTTCACGCAGCAGCGTACCACDN3785429039RT-FGCGTGCTCGGCTGAGAGTAG29039RT-RGCGCATCAAGGGCCAACAACDN29039ACTRT-FTSGAYTCTGGTGATGGTGTACTRT-RRTCACGACCMGCAAGATCACTIN
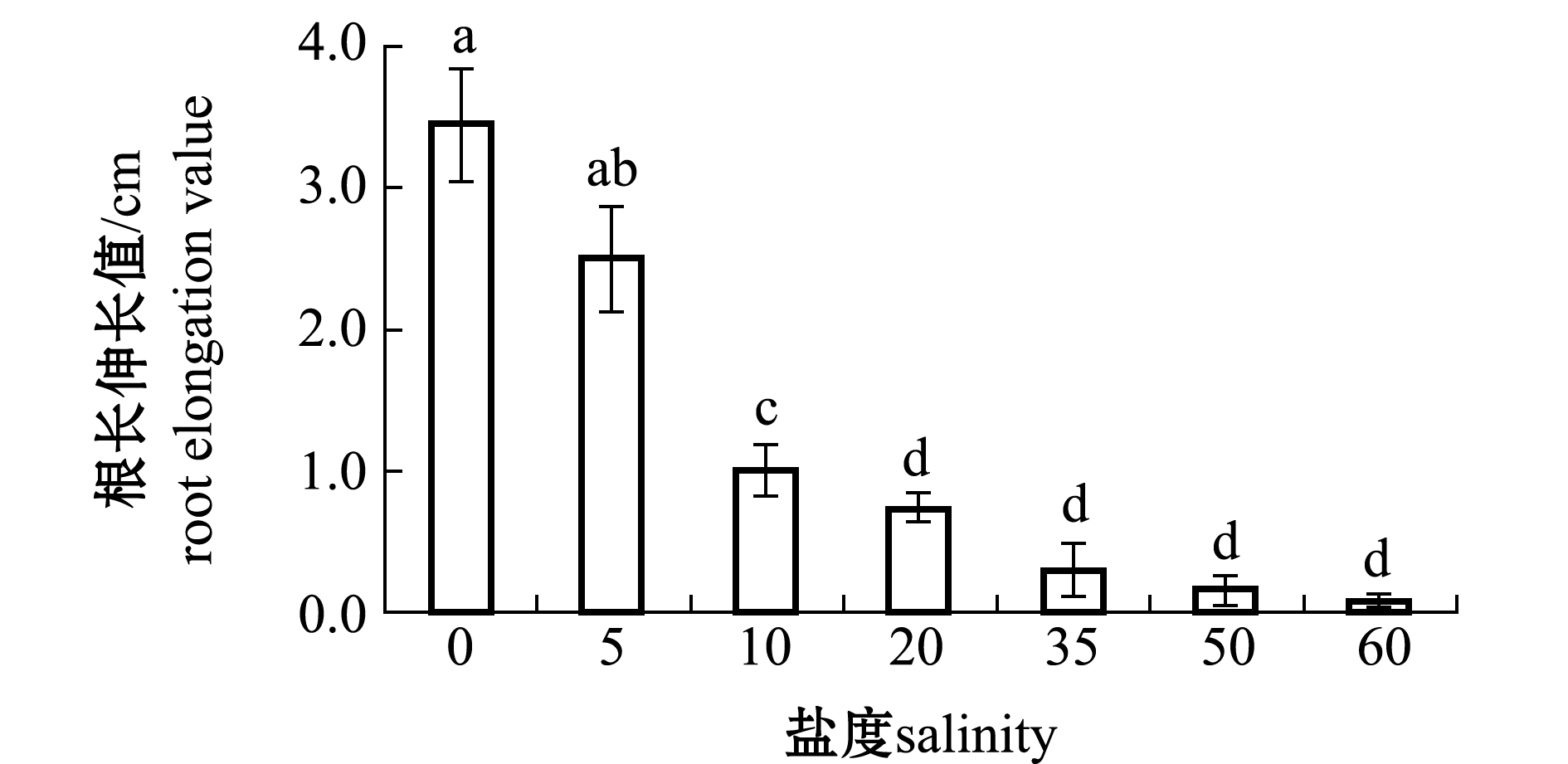
注:标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05)
Note:The means with different letters are significantly different among the groups at the 0.05 probability level, and the means with the same letters are not significantly different
图1 盐胁迫处理后翅碱蓬根长变化
Fig.1 Root elongation of Suaeda heteroptera after salt stress
2.2 测序结果分析
对高盐处理和对照处理2 h后的翅碱蓬植株进行RNA-seq分析,分别获得4308.1万条和4801.7万条原始序列(Raw reads),经过滤得到的高质量Clean reads 数量分别为4104.8万条和4537.0万条,两个组的Raw reads与Clean reads比例接近,说明cDNA文库构建和测序质量较高。高盐组和处理组Clean reads数量之和为129.4亿条,错误率均为0.01%;两个组的GC含量分别为42.82%和42.89%。经过对测序结果进行错误率分析,包括A、G、C、T含量分布及过滤检查,本研究中所获得测序数据质量均符合要求。
为获得更加全面的基因功能信息,将拼接得到的84 545个Unigenes分别在7大数据库(NR、NT、KO、Prot、PFAM、GO、KOG)进行基因功能注释。其中有5.89%的(4982个)Unigenes在7个数据库中均注释成功,有53.43%的(45 174个)Unigenes至少在1个数据库注释成功,更多注释结果信息详如表2所示。从注释结果中选出5个数据库绘制维恩图(图2)。
表2 基因注释成功率统计
Tab.2 Success rate of gene annotation
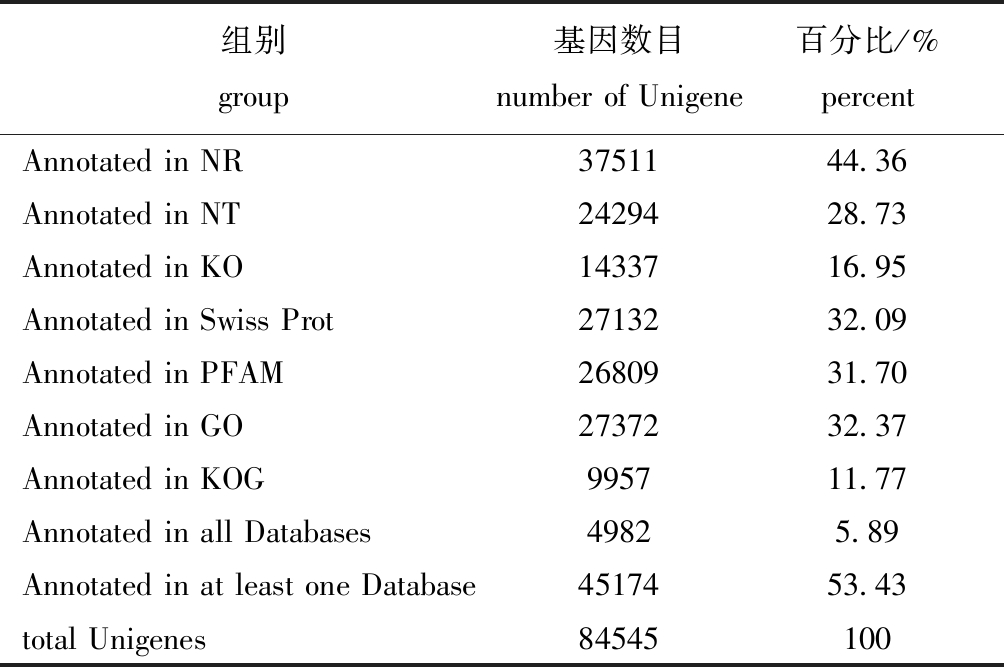
组别group基因数目number of Unigene百分比/%percentAnnotated in NR3751144.36Annotated in NT2429428.73Annotated in KO1433716.95Annotated in Swiss Prot2713232.09Annotated in PFAM2680931.70Annotated in GO2737232.37Annotated in KOG995711.77Annotated in all Databases49825.89Annotated in at least one Database4517453.43total Unigenes84545100
2.3 差异表达基因
对高盐处理组与对照组翅碱蓬的基因表达进行分析,差异表达基因(differentially expressed genes,DEGs)为差异检验伪发现率(false discovery rate)值≤0.001且差异倍数不低于2的基因。本试验中,翅碱蓬共检测到144个基因的表达发生了改变。在高盐胁迫下,有55个DEGs表达上调,89个DEGs表达下调,表达下调基因数显著高于上调基因数(图3)。通过检测共得到基因76 076个,其中两个组共有45 034个重合基因数,分别占对照组和高盐处理组基因数量的73.29%和75.48%。
2.4 差异表达基因的GO功能显著性富集分析
GO功能显著性富集分析是通过与数据库比较,筛选出DEGs的GO分类条目,并找出与DEGs相关的主要特征功能分类。主要功能分类为生物学过程(biological processes)和分子功能(molecular function)两大类。此外,有2个基因在光合系统Ⅱ的光合电子传递(photosynthetic electron transport in photosystem Ⅱ)中发生上调表达(图4)。
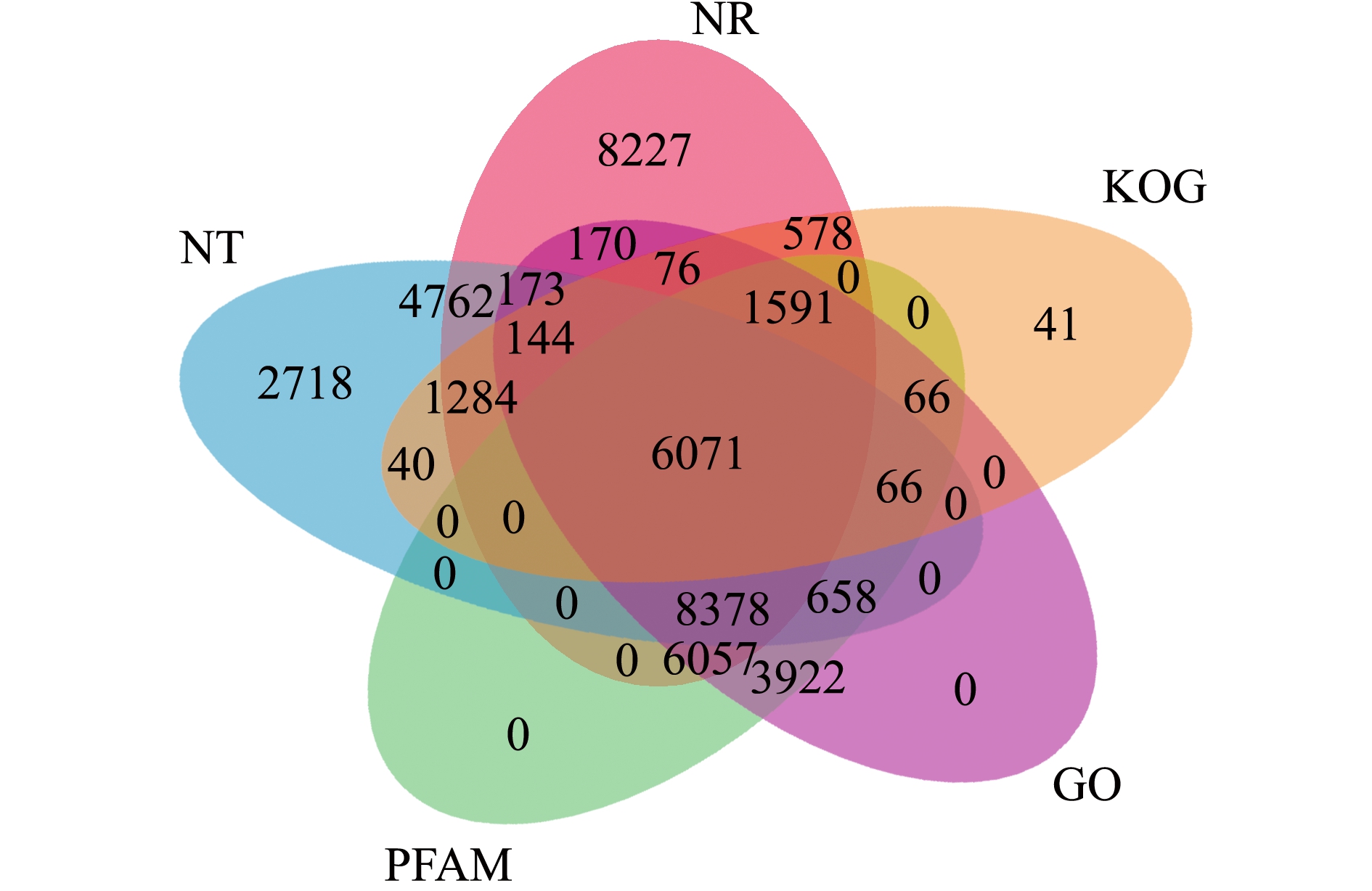
注:图中数字代表Unigenes在各数据库中注释成果的数量及各数据库间注释成功的Unigenes间的重叠关系
Note:The numbers in the figure represent the number of annotated Unigenes in each database as well as the overlapping relationships among various databases
图2 基因注释结果维恩图
Fig.2 Venn diagram of the gene annotation results
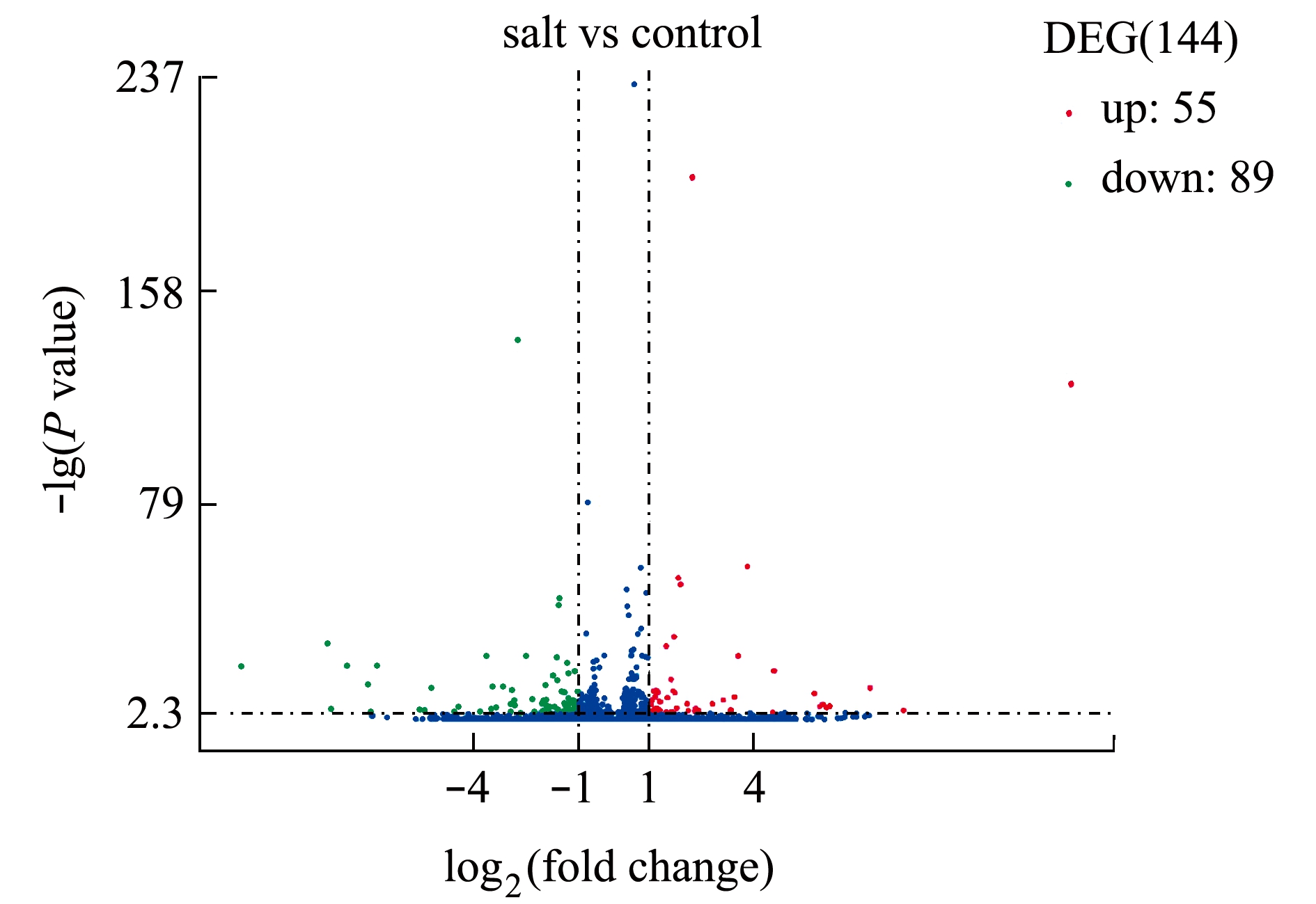
注:横坐标代表基因在不同试验组中表达倍数变化;纵坐标代表基因表达量变化的统计学显著程度,校正后的P value越小,则-lg(P value)值越大,即差异越显著
Note:The horizontal axis represents the fold change of gene expression level in different experimental groups; the vertical axis represents the statistical significance of gene expression level change. The smaller the corrected P value, the larger the -lg(P value) is, and the more significant the difference is
图3 基因差异表达分析火山图
Fig.3 Volcano map for gene differential expression analysis
2.5 差异表达基因的代谢通路富集分析
通路(pathway)分析有助于更进一步了解生物体内不同基因相互协调作用下的相关生物学功能。通过对DEGs在KEGG(Kyoto encyclopedia of genes and genomes)数据库中进行比对,对DEGs做出功能注释和分类,并由显著性富集确定出差异表达基因主要参与的生化代谢及信号转导途径。对高盐处理组和对照组差异表达基因的KEGG富集分析结果表明,差异表达基因主要分布在光合作用(Photosynthesis)、淀粉与蔗糖代谢(Starch and sucrose metabolism)、植物激素信号转导(Plant hormone signal transduction)、苯丙基类生物合成(Phenylpropanoid biosynthesis)、半胱氨酸与甲硫氨酸代谢(Cysteine and methionine metabolism)等14个代谢通路中(图5)。
2.6 实时定量PCR验证比较转录组数据
qRT-PCR验证结果显示,与对照组相比,随机选取的6个基因在高盐胁迫处理后出现了差异表达,发生表达上调或下调与比较转录组数据一致(图6)。尽管用qRT-PCR法分析得到的基因表达差异与用比较转录组学法得到的基因表达差异在具体数值上不相同,但高盐胁迫诱导基因表达变化的趋势是一致的,说明采用比较转录组学方法对差异表达基因的分析结果是可靠的。
2.7 5个主要通路中差异表达基因编码的蛋白
与对照组相比,高盐处理组翅碱蓬产生差异表达的基因主要在14个代谢通路发生富集,其中5个主要通路中差异表达基因编码的部分蛋白见表3。
表3 5个主要通路中差异表达基因编码的部分蛋白
Tab.3 Representative proteins coded by DEGs in five major pathways
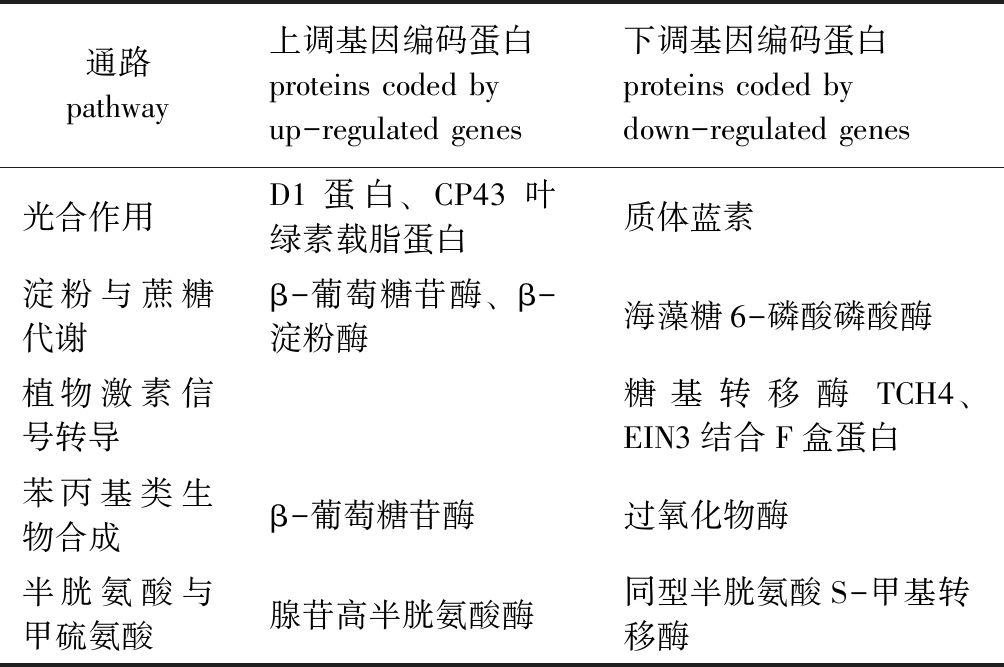
通路pathway上调基因编码蛋白proteins coded by up-regulated genes下调基因编码蛋白proteins coded by down-regulated genes光合作用D1蛋白、CP43叶绿素载脂蛋白质体蓝素淀粉与蔗糖代谢β-葡萄糖苷酶、β-淀粉酶海藻糖6-磷酸磷酸酶植物激素信号转导糖基转移酶TCH4、EIN3结合F盒蛋白苯丙基类生物合成β-葡萄糖苷酶过氧化物酶半胱氨酸与甲硫氨酸腺苷高半胱氨酸酶同型半胱氨酸S-甲基转移酶
3 讨论
3.1 光合作用途径
植物耐受与响应非生物胁迫的过程是一系列复杂的耗能反应,其消耗的能量主要来源于光合作用。本研究中KEGG 富集分析表明,翅碱蓬转录组中注释到光合作用途径的Unigenes共有63个。翅碱蓬在高盐胁迫下,编码D1蛋白和D2蛋白的基因表达发生上调,这两个蛋白通常以异二聚体形式出现,是PSⅡ反应中心的重要组成之一,两者可以形成一种多亚基蛋白色素复合物锚定在细胞内,参与组成或合成ATP的PSⅡ复合体[10-11]。

注:横坐标为GO三个大类的下一层级的GO term,纵坐标为注释到该term下(包括该term的子 term)的差异基因数目
Note:The horizontal axis is GO term at the next level of the three categories of GO, and the vertical axis is the number of differential genes annotated to the term (including the sub-term of the term)
图4 差异基因GO富集柱状图
Fig.4 Histogram of differential gene GO enrichment
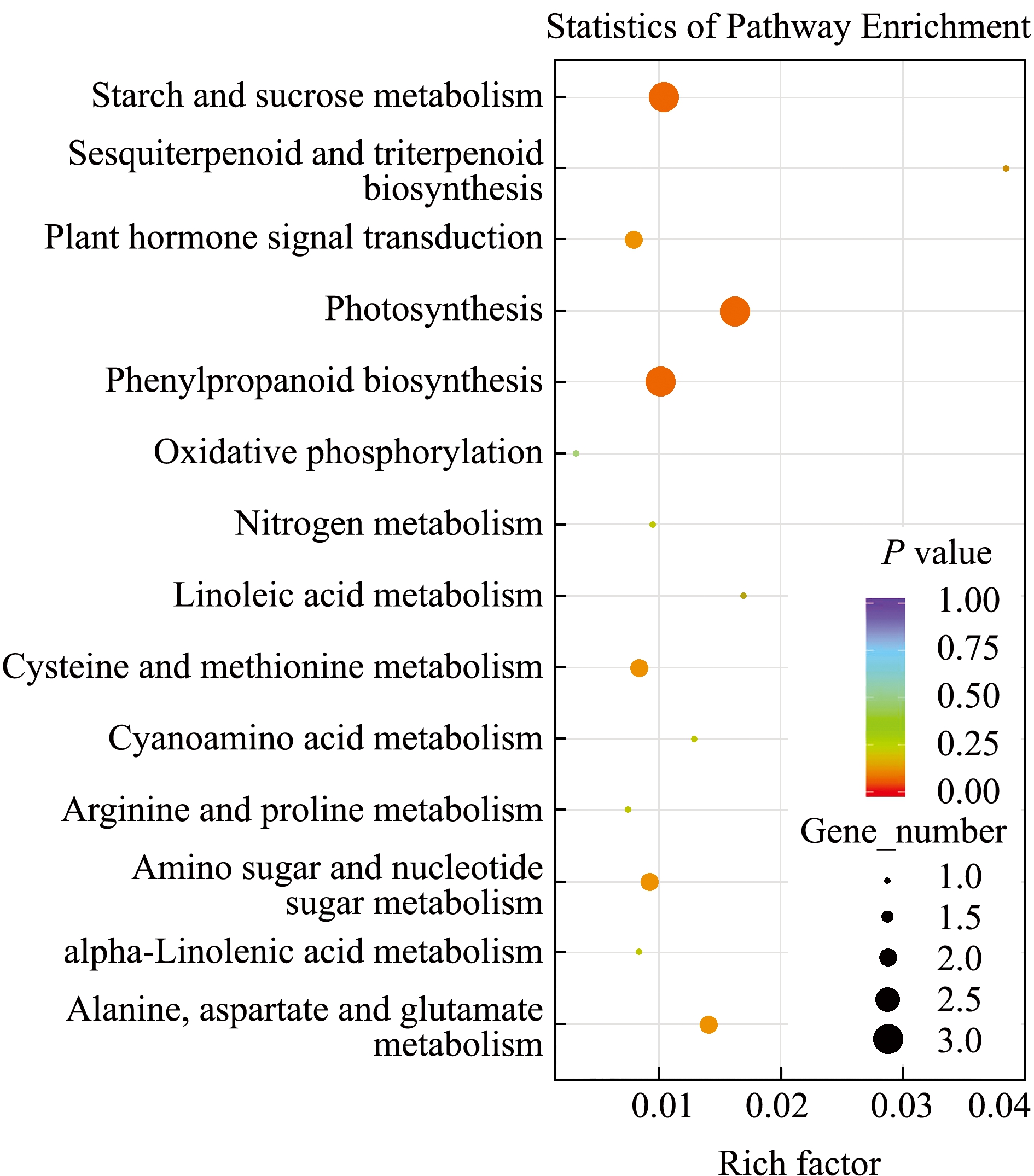
注:横坐标为pathway对应的Rich factor;纵坐标为pathway名称;每个pathway下包含的差异基因的多少用点的大小来表示;P value的大小用点的颜色来表示,P value越小则颜色越接近红色
Note:The horizontal axis is the Rich factor corresponding to pathway; the vertical axis is the name of pathway.The number of different genes contained in each pathway is expressed by the size of dots; the size of the P value is expressed by the color of dots, and the smaller the P value, the closer the color is red
图5 KEGG通路富集散点图
Fig.5 Scatter plot of KEGG pathway enrichment
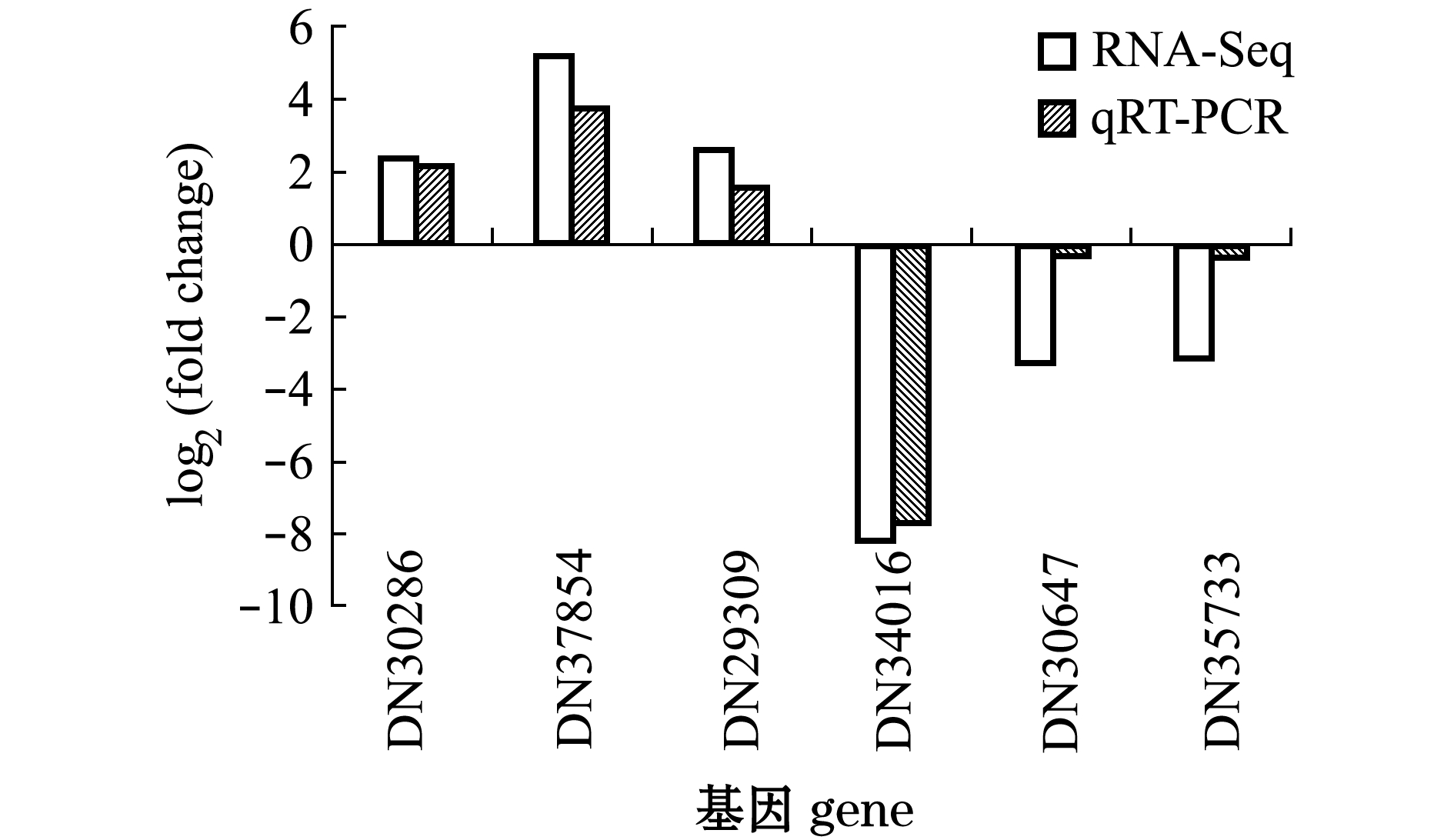
图6 差异表达基因的qRT-PCR验证
Fig.6 Validation of the differentially expressed genes by qRT-PCR
此外,编码CP43叶绿素载脂蛋白的基因也发生表达上调,CP43也是组成PSⅡ反应中心的重要蛋白之一,其主要作用是参与形成放氧复合体和稳定QA结合位点,并在光失活情况下作为蛋白酶与D1蛋白共价交联,降解D1蛋白[12-14]。另有研究表明,CP43可能参与了PSⅡ反应中心的组装[15]。Ponnu等[16]通过光饱和试验发现,CP43参与贡献了核心复合体采光能力的30%。比较转录组分析表明,编码D1蛋白和CP43叶绿素载脂蛋白的基因表达上调,这说明翅碱蓬在高盐胁迫下可能通过提高PSⅡ采光能力来增加光合作用效率,提高光合作用能力。
在光合作用通路中,编码质体蓝素的基因在高盐处理后发生表达下调。质体蓝素是一个相对分子质量仅为10 500的水溶性含铜蛋白,一般存在于细胞的类囊体腔内,其主要功能是在细胞色素b6f复合体和P700间转移电子。由于光合作用的两个光化学反应事件在空间上是相互独立的,故质体蓝素作为载体扩散于细胞色素b6f复合体和P700间运送电子,是光合链中的重要组成部分。高盐胁迫下,翅碱蓬编码质体蓝素的基因表达下调,这可能是植物受盐胁迫后在光合采光能力增强之后的一种反馈调节,致使光合作用能力又部分受到抑制。
结合上述分析,可做出如下推论:编码D1和CP43蛋白的基因表达上调提升了PSⅡ反应中心效率,相应地产生的电子也随之增多。这些由PSⅡ产生的大量电子经由质体蓝素转移至PSⅠ中的铁氧还蛋白受体,共同参与下一步的反应,将NADP+还原为NADPH。然而,由于PSⅠ中的铁氧还蛋白受体是一种较强的还原剂,易将分子态氧还原成一种对生物膜非常有害的活性氧——超氧化物,这使得PSⅠ极易受到活性氧损伤。而编码质体蓝素的基因表达下调降低了电子的传递效率,能有效减轻PSⅠ中的氧化性损伤。
3.2 淀粉与蔗糖代谢途径
本研究表明,翅碱蓬在高盐胁迫下编码β-葡萄糖苷酶和β-淀粉酶的基因表达上调。这两种酶是糖代谢途径的重要酶类,能够水解淀粉。其中,β-葡萄糖苷酶能水解糖苷或寡糖上的葡萄糖苷键、释放葡萄糖,β-淀粉酶能将直链淀粉水解成麦芽糖。淀粉是植物体内的重要储能物质。高盐胁迫下,翅碱蓬植株内催化淀粉水解的这两种酶基因表达上调,提示其可能通过水解淀粉生成葡萄糖来释放能量,用于对抗高盐环境。
糖类除了在生物体代谢过程中发挥重要作用外,还可作为细胞信号转导的信使。海藻糖存在于许多动植物体内,是一种非还原性二糖,由两个葡萄糖分子通过半缩醛羟基缩合以α-1,1糖苷键相连形成[16],它具有独特的抗冷冻、抗脱水等生物学功能[17]。植物合成海藻糖需要两步反应:第一步是由海藻糖-6-磷酸合酶(trehalose-6-phosphate synthase, Tps)催化二磷酸尿苷-葡萄糖和葡萄糖-6-磷酸,生成海藻糖-6-磷酸(trehalose-6-phosphate,T6p);第二步是TPP催化T6p,发生去磷酸化反应生成海藻糖。另有研究表明,T6p在植物中会对多种胁迫做出响应,其中包括盐度胁迫[18]。本研究中,翅碱蓬在高盐胁迫下编码TPP的基因表达发生下调,这说明植物可能通过降低TPP的表达量来减少T6p的代谢,从而累积T6p,以此来增强对盐胁迫的耐受性。
3.3 植物激素信号转导途径
本研究中的翅碱蓬转录组数据中共有45条Unigenes被注释到植物激素信号转导代谢(Plant hormone signal transduction) KEGG 通路中。翅碱蓬在高盐胁迫下,发生表达下调的基因有木葡聚糖(xyloglucan)中编码糖基转移酶TCH4(xyloglucosyltransferase TCH4)的基因和编码EIN3结合F盒蛋白(EIN3-binding F-box protein)的基因。
木葡聚糖是一类存在于所有高等植物细胞壁中的半纤维素类多糖。已有研究表明,它们可以控制植物的发育与代谢。其中,分离自苹果与罗望子中的一种寡糖被认为具有生物肥料和植物体主动防御机能诱导剂的作用[19]。除此之外,木葡聚糖还被认为具有调控植物体免疫调节活性的功能[19]。Li等[20]对拟南芥Arabidopsis thaliana (L.) Heynh.的研究结果表明,由RSA3/MUR3/KAM1编码的一种木糖半乳糖基转移酶和其他细胞壁相关蛋白,通过维持肌动蛋白的适当结构以尽量减少过量活性氧所造成的损害,在拟南芥耐受盐胁迫过程中起着关键作用。而在本研究结果中也证实了这一观点,与木糖葡聚糖合成密切相关的编码糖基转移酶TCH4的基因显示为下调表达。
EBF蛋白在植物体中参与乙烯信号通路的传导。乙烯是一种植物激素,广泛参与植物的发育过程,包括种子萌发、叶片膨大、根毛形成、果实成熟、营养衰老时间,以及非生物胁迫和生物胁迫(病原体侵袭等)响应[21]。Potuschak等[22]研究表明,在拟南芥中EBF过表达导致植物对乙烯不再敏感;相反,携带EBF1和EBF2突变基因的植物表现出一种组成型乙烯反应,并在缺乏乙烯的情况下积累EIN3蛋白。Binder等[23]研究发现,拟南芥的两种EBF蛋白EBF1和EBF2在乙烯信号传导中可通过介导作为其主要靶蛋白EIN3和EIL1的泛素化来调控乙烯信号识别,EBF1和EBF2在此过程中调控的时间段不同,但作用相互重叠。这同样证实了EBF同乙烯信号传导的密切关系。因此,本研究中,经高盐胁迫后的翅碱蓬显示出EBF表达下调,这提示翅碱蓬可能通过改变EBF表达量来调节体内乙烯激素含量,以此应对盐胁迫。
3.4 苯丙基类生物合成途径
本研究发现,翅碱蓬在高盐胁迫下,苯丙基类生物合成途径中发生表达上调的有编码β-葡萄糖苷酶的基因,其相关讨论见“3.2”节;发生表达下调的有编码过氧化物酶(peroxidase)的基因。过氧化物酶是一类氧化还原酶,其参与的反应包括呼吸作用、光合作用和生长素的氧化等。过氧化物酶还是植物体内的重要防御酶之一。非生物胁迫易导致植物中活性氧(ROS)的过度产生,ROS具有较高的活性和毒性,会对蛋白质、脂类、碳水化合物和DNA等造成损害,最终导致氧化应激[24]。过氧化物酶能清除逆境(包括盐)胁迫下植物体内的ROS,抑制膜内不饱和脂肪酸的过氧化作用,提高植物抗逆性。孙静等[25]在以小麦为材料的盐胁迫条件下分析过氧化物同工酶谱变化中发现,小麦根、叶中过氧化物酶同工酶发生显著变化。本研究中,在高盐胁迫下翅碱蓬体内编码过氧化物酶的基因表达发生下调,这提示高盐胁迫可能会降低过氧化物酶量,导致植株易发生过氧化损伤。
3.5 半胱氨酸与甲硫氨酸途径
本研究中,翅碱蓬在高盐胁迫下,编码腺苷高半胱氨酸酶(adenosylhomocysteinase)的基因发生表达上调。该酶能将S-腺苷高半胱氨酸(S-adenosylhomocysteine)转变为高半胱氨酸与腺苷,具有重要的细胞内甲基循环的代谢调节功能,与生物表观遗传机制密切相关。而表观遗传机制如胞嘧啶甲基化(Cytosine Methylation)在植物胁迫响应中发挥重要作用。近期针对拟南芥的非生物胁迫响应研究发现,经NaCl处理的拟南芥植株发生了表观遗传调控[26]。潘雅姣等[27]研究发现,在干旱条件下,水稻基因组中约 20%的 CCGG 位点发生了胞嘧啶甲基化,这说明胁迫明显增加了DNA 甲基化的平均水平,其中增加幅度最为明显的为根部。本研究发现的高盐胁迫导致翅碱蓬中编码腺苷高半胱氨酸酶的基因表达上调这一现象同拟南芥、水稻等植物中发生的情形类似,说明翅碱蓬应对高盐胁迫机制可能也涉及表观遗传层面的变化。本研究还发现,盐处理导致翅碱蓬编码同型半胱氨酸S-甲基转移酶(homocysteine S-methyltransferase,HMTs)的基因表达发生下调。HMTs是一种广泛分布的酶,在植物体内存在广泛,功能较为基础,可利用S-腺苷甲硫氨酸(AdoMet)或植物次级产物S-甲基甲硫氨酸(SMM)作为甲基供体,将同型半胱氨酸(Hcy)转化为甲硫氨酸(Met)。
4 结论
盐胁迫对植物生长发育会产生负面影响,破坏渗透压和离子平衡,干扰蛋白合成,妨碍光合作用、能量产生和脂质代谢[28]。相应地,植物进化出一系列生理生化机制来应对、适应乃至耐受盐胁迫,包括调节离子平衡、合成渗透调节物、去除ROS、调节激素水平等[28]。从分子水平看,这些适应机制涉及激活基因的级联调控及合成防御代谢物[28]。本研究中,利用基于高通量测序的比较转录组学方法研究了高盐胁迫下翅碱蓬的基因表达变化,共获得了144个差异表达基因,其中,55个基因表达上调,89个基因表达下调;对差异表达基因进行GO富集分析和KEGG富集分析,明确了差异表达基因富集的分子功能与代谢途径;从代谢通路水平探讨了翅碱蓬响应高盐胁迫机理,涉及光合作用途径、植物激素信号转导通路、表观遗传等多重调控。本研究结果可望为更深入研究翅碱蓬耐盐分子机制、挖掘耐盐关键基因提供数据资料。
[1] 中国科学院中国植物志编辑委员会.中国植物志:第25卷[M].北京:科学出版社,1979:115-135.
[2] 刘彧,丁同楼,王宝山.不同自然盐渍生境下盐地碱蓬叶片肉质化研究[J].山东师范大学学报:自然科学版,2006,21(2):102-104.
[3] 张立宾,徐化凌,赵庚星.碱蓬的耐盐能力及其对滨海盐渍土的改良效果[J].土壤,2007,39(2):310-313.
[4] Deinlein U,Stephan A B,Horie T,et al.Plant salt-tolerance mechanisms[J].Trends in Plant Science,2014,19(6):371-379.
[5] 何洁,陈旭,王晓庆,等.翅碱蓬对滩涂湿地沉积物中重金属Cu、Pb的累积吸收[J].大连海洋大学学报,2012,27(6):539-545.
[6] 何洁,何晓彤,刘远,等.丁草胺和马拉硫磷对翅碱蓬生长及抗氧化酶系统的影响[J].大连海洋大学学报,2016,31(5):551-558.
[7] Jin Hangxia,Dong Dekun,Yang Qinghua,et al.Salt-responsive transcriptome profiling of Suaeda glauca via RNA sequencing[J].PLoS One,2016,11(3):e0150504.
[8] Garg R,Verma M,Agrawal S,et al.Deep transcriptome sequencing of wild halophyte rice,Porteresia coarctata,provides novel insights into the salinity and submergence tolerance factors[J].DNA Research,2014,21(1):69-84.
[9] Diray-Arce J,Clement M,Gul B,et al.Transcriptome assembly,profiling and differential gene expression analysis of the halophyte Suaeda fruticosa provides insights into salt tolerance[J].BMC Genomics,2015,16:353.
[10] Nadtochenko V A,Semenov A Y,Shuvalov V A.Formation and decay of P680 (PD1-PD2)+PheoD1- radical ion pair in photosystem II core complexes[J].Biochimica et BiophysicaActa(BBA)- Bioenergetics,2014,1837(9):1384-1388.
[11] Nelson N,Yocum C F.Structure and function of photosystems I AND II[J].Annual Review of Plant Biology,2006,57:521-565.
[12] Petersen J,Dekker J P,Bowlby N R,et al.EPR characterization of the CP47-D1-D2-cytochrome b-559 complex of photosystem II[J].Biochemistry,1990,29(13):3226-3231.
[13] Philbrick J B,Diner B A,Zilinskas B A.Construction and characterization of cyanobacterial mutants lacking the manganese-stabilizing polypeptide of photosystem II[J].Journal of Biological Chemistry,1991,266(20):13370-13376.
[14] Komenda J,Masojídek J.Functional and structural changes of the photosystem II complex induced by high irradiance in cyanobacterial cells[J].FEBS Journal,1995,233(2):677-682.
[15] Putnam-Evans C,Bricker T M.Site-directed mutagenesis of the CPa-1 protein of photosystem II:alteration of the basic residue pair 384,385R to 384,385G leads to a defect associated with the oxygen-evolving complex[J].Biochemistry,1992,31(46):11482-11488.
[16] Ponnu J,Wahl V,Schmid M.Trehalose-6-phosphate:connecting plant metabolism and development[J].Frontiers in Plant Science,2011,2:70.
[17] 葛宇,袁勤生.海藻糖对生物活性物质的保护作用机理研究进展[J].药物生物技术,2002,9(5):297-300.
[18] Goddijn O J,Van Dun K.Trehalose metabolism in plants[J].Trends in Plant Science,1999,4(8):315-319.
[19] Rosário M M,Noleto G R,Bento J F,et al.Effect of storage xyloglucans on peritoneal macrophages[J].Phytochemistry,2008,69(2):464-472.
[20] Li Wenbo,Guan Qingmei,Wang Zhenyu,et al.A bi-functional xyloglucan galactosyltransferase is an indispensable salt stress tolerance determinant in Arabidopsis[J].Molecular Plant,2013,6(4):1344-1354.
[21] Wang K L,Li Hai,Ecker J R.Ethylene biosynthesis and signaling networks[J].The Plant Cell,2002,14(S1):S131-S151.
[22] Potuschak T,Lechner E,Parmentier Y,et al.EIN3-dependent regulation of plant ethylene hormone signaling by two Arabidopsis F box proteins:EBF1 and EBF2[J].Cell,2003,115(6):679-689.
[23] Binder B M,Walker J M,Gagne J M,et al.The Arabidopsis EIN3 binding F-Box proteins EBF1 and EBF2 have distinct but overlapping roles in ethylene signaling[J].The Plant Cell,2007,19(2):509-523.
[24] Gill S S,Tuteja N.Reactive oxygen species and antioxidant machinery in abiotic stress tolerance in crop plants[J].Plant Physiology and Biochemistry,2010,48(12):909-930.
[25] 孙静,王宪泽.盐胁迫对小麦过氧化物酶同工酶基因表达的影响[J].麦类作物学报,2006,26(1):42-44,61.
[26] Ar kan B,Özden S,Turgut-Kara N.DNA methylation related gene expression and morphophysiological response to abiotic stresses in Arabidopsis thaliana[J].Environmental and Experimental Botany,2018,149:17-26.
kan B,Özden S,Turgut-Kara N.DNA methylation related gene expression and morphophysiological response to abiotic stresses in Arabidopsis thaliana[J].Environmental and Experimental Botany,2018,149:17-26.
[27] 潘雅姣,傅彬英,王迪,等.水稻干旱胁迫诱导DNA甲基化时空变化特征分析[J].中国农业科学,2009,42(9):3009-3018.
[28] Muchate N S,Nikalje G C,Rajurkar N S,et al.Plant salt stress:adaptive responses,tolerance mechanism and bioengineering for salt tolerance[J].The Botanical Review,2016,82(4):371-406.