海洋经济贝类是中国海洋渔业的支柱产业,在其生产活动过程中,活品是最受市场欢迎且经济价值最高的产品类型,活品流通也是国内市场最传统的流通模式,而贝类的风味品质在活品流通过程中至关重要,决定了其货架期及商品价值。目前,包括海洋经济贝类在内的海洋生物,在捕后活品流通过程中会频繁面临干露[1-7],由干露所造成的无氧或低氧是贝类在活品流通过程中所面临的重要胁迫因素之一[8-9],干露时间过长会导致活品品质迅速下降,最终影响其商品价值。
在无氧或低氧条件下,由于缺少氧气作为电子受体,正常的产能代谢受阻,部分或全部无氧代谢开始发挥作用[10]。无氧代谢包括环境型无氧代谢和功能型无氧代谢,前者是指整个生物体所处的环境氧气供给不足,后者是指剧烈运动过程中特定组织中氧消耗大于氧供给[11]。包括经济贝类在内的海洋无脊椎动物主要存在4种无氧代谢途径,其中葡萄糖-opine途径在无氧代谢初期发挥了重要作用,无脊椎动物中特有的Opine脱氢酶(OpDHs)保证了这一过程的顺利进行。
有关海洋无脊椎生物体内OpDHs的研究进程大致可以分为两个阶段,从20世纪中期开始至20世纪末为第一阶段,该阶段陆续发现6种不同的OpDHs,并在分离纯化的基础上进行了各种酶学性质的研究,与此同时,OpDHs在不同物种及不同组织中的分布也出现了大量研究报道。第二阶段为21世纪初至今,这一阶段除了探讨其分子反应机制[12-13],另一突出特点是研究生物体在环境胁迫下的OpDHs活性应答。
本研究中,从4个方面对海洋无脊椎动物特别是经济贝类在无氧代谢中起到重要作用的OpDHs进行了综述,即OpDHs在无氧代谢中所起的作用及其分类,OpDHs在经济贝类中的分布,经济贝类在面临环境胁迫时OpDH的活性应答,OpDHs基本酶学性质,旨在为相关领域的研究,以及探讨海洋经济贝类在捕后处置过程中能否以OpDHs活性作为一种品质评价指标提供参考。
1 海洋无脊椎动物中的OpDHs
1.1 海洋无脊椎动物的无氧代谢途径
海洋无脊椎动物无氧代谢主要存在4种途径[14-15]:(1)天冬氨酸-琥珀酸途径。无氧代谢初期,天冬氨酸转氨偶联糖酵解生成丙氨酸。无脊椎动物体内游离氨基酸含量丰富,为该途径提供了充足的能量底物[16]。天冬氨酸的碳骨架通过转氨作用进入苹果酸,而后在线粒体中进入延胡索酸,最后进入琥珀酸。(2)葡萄糖-乳酸途径。无氧代谢初期能量供应主要依赖糖酵解途径,糖酵解产生的丙酮酸不再由丙酮酸脱氢酶的作用下进入三羧酸循环,而是在乳酸脱氢酶(LDH;EC 1.1.1.28)的作用下还原成乳酸。(3)葡糖糖-Opine途径。该途径与葡萄糖-乳酸途径类似,区别在于OpDHs代替LDH发挥作用,形成Opine而不是乳酸。(4)葡萄糖-琥珀酸途径。当面临长期无氧代谢时,无氧酵解与之前相同,直到形成了磷酸烯醇式丙酮酸,此时,不再由丙酮酸激酶催化生成丙酮酸,而是由磷酸烯醇式丙酮酸羧激酶催化形成草酰乙酸,草酰乙酸最终形成琥珀酸和挥发性脂肪酸(乙酸盐、丙酸盐)(图1)。

注:(1)为葡萄糖-乳酸途径;(2)为葡糖糖-Opine途径;(3)为葡萄糖-琥珀酸途径;(4)为天冬氨酸-琥珀酸途径
Note: (1), glucose-lactate pathway; (2),glucose-opine pathway; (3),glucose-succinate pathway; (4),aspartate-succinate pathway
图1 海洋无脊椎动物中无氧代谢的4种主要途径[15, 17]
Fig.1 Four main kinds of anaerobic metabolic pathways in marine invertebrates[15, 17]
1.2 OpDHs在无氧代谢中的作用
糖原是无氧代谢过程中的主要能源物质,相比其他小分子而言,糖原可以在细胞中大量储存而不引起渗透压增高[18-19]。在海洋无脊椎动物中,糖原占干基的10%~35%[20]。在无氧代谢过程中,糖原在细胞质中通过EMP途径生成三磷酸腺苷(ATP)来供能,此时,ATP通过底物水平磷酸化而产生,不需要氧分子的参与。在此过程中还形成了NADH,若要维持糖酵解继续进行,就需要把NADH再氧化成NAD+,从而确保甘油醛-3-磷酸的继续氧化。脊椎动物存在LDH 维持细胞内的氧化还原平衡。而在海洋无脊椎动物中,不仅存在LDH来完成此生理过程[21],还存在OpDHs发挥同样的作用[15, 22],把丙酮酸与特异性氨基酸还原缩合成Opine。从以往研究来看,大多数海洋无脊椎动物的总OpDHs活性超过了LDH活性[23]。
海洋无脊椎动物含有丰富的游离氨基酸[18],这样可以为细胞内OpDHs提供充足的反应底物。Opine途径相较于乳酸途径的另一个优势在于其终产物Opine在改变细胞内pH的程度上要比乳酸小得多,因此,细胞内渗透压更容易维持恒定[24]。
1.3 不同类型OpDHs 的发现历程
OpDHs是一系列酶的总称。OpDHs中最早被发现的是Octopine脱氢酶(ODH;EC 1.5.1.11),Van Thoai和Robin于1959年报道了多种海洋无脊椎动物通过酶促反应生成章鱼碱,随后在1969年,Van Thoai等[25]首次从扇贝闭壳肌中分离纯化出ODH。在此之后,其他OpDHs陆续被发现,Fields等[26]在太平洋牡蛎闭壳肌中发现了Alanopine脱氢酶(ADH;EC 1.5.1.17)。Strombine脱氢酶(SDH;EC 1.5.1.22)早先被称为ADH,于1980年在牡蛎中被发现,1981年重新命名为SDH,把ADH定义为以丙氨酸为最适底物,而SDH则定义为以甘氨酸为最适底物[27]。Tauropine脱氢酶(TDH;EC 1.5.1.23)于1986年在鲍鱼肌肉组织中被发现[28],β-Alanopine脱氢酶(BADH;EC 1.5.1.26)于1987年在双壳类中被发现[29]。
迄今为止共发现6种OpDHs,包括ADH、ODH、SDH、TDH、BADH和LyDH,其作用原理与LDH类似,区别在于不同的OpDHs需要相应的氨基酸作为反应底物,然后生成相应的亚氨基酸。ADH、ODH、SDH、TDH、BADH和LyDH所需的特异性氨基酸底物分别是丙氨酸、精氨酸、甘氨酸、牛磺酸、β-丙氨酸和赖氨酸,所形成的亚氨基酸分别为Alanopine、Octopine、Strombine、Tauropine、β-Alanopine和Lysopine(图2)。尽管已检测到LyDH活性,但其反应产物Lysopine在海洋无脊椎动物中仍未被发现[15],且关于LyDH的研究较少,此处为了完整罗列而提及,后文不再叙述。
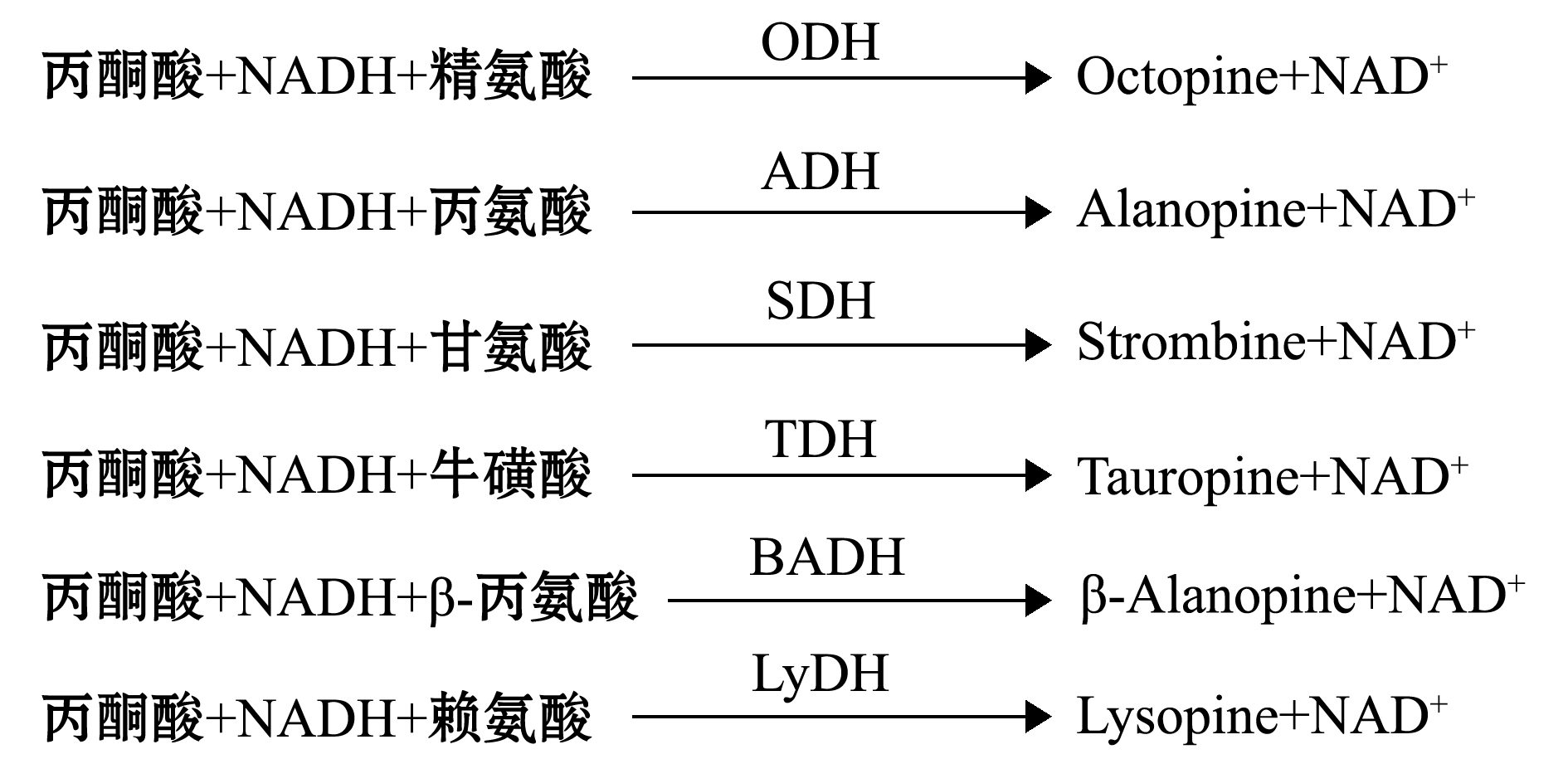
图2 海洋无脊椎动物中的6种OpDHs[25-29]
Fig.2 Six kinds of OpDHs in marine invertebrates[25-29]
2 OpDHs分布的物种及组织特异性
2.1 OpDHs在海洋无脊椎动物中的分布
对于OpDHs在不同海洋无脊椎动物中的分布或同一物种不同组织中的分布,已有较为详尽的报道。Livingstone等[30]对13类160余种物种中的OpDHs进行了分析,发现海绵动物中有较高的SDH活性,软体动物中ODH活性较高,腹足动物中ADH和SDH活性较高。Sato等[22]对于海洋动物中OpDHs的分布进行了报道,发现OpDHs存在于6类海洋无脊椎动物中,即多孔动物、腔肠动物、环节动物、软体动物、节肢动物、棘皮动物,其中TDH分布最广泛。Harcet等[15]根据动植物演化分析和酶学分析,将OpDHs分为两类:软体/环节动物类和海绵动物类。总之,OpDHs在海洋无脊椎动物中分布十分广泛。
2.2 OpDHs在经济贝类中的分布
OpDHs在经济贝类中的分布如表1所示,贝类中ODH活性最高,这与贝类在贮藏过程中闭壳肌中Octopine大量积累相符合[31]。而在甲壳类动物中,几乎未发现ODH活性,而在环节动物中只有少数动物存在ODH且活性较低,ADH和SDH起主要作用。Sato等[22]从物种演化的角度解释了这一现象。少数贝类也存在例外情况,如鲍鱼的闭壳肌和足肌中只存在TDH活性,其他OpDHs酶均未测出,Gäde[3]认为,这是由于其生物组织中含有大量牛磺酸,促使其向正反应方向进行。
从OpDHs在不同组织中的分布来看,OpDHs在贝类各组织中均有广泛分布。其中,肌肉组织中OpDHs活性远高于其他组织,因为肌肉组织中不仅存在环境型无氧代谢,同时存在功能型无氧代谢。贝类在追捕猎物、逃离天敌、挖洞钻地等过程中均需要特定的肌肉参与,此时,肌肉在短时间内需要消耗大量ATP,仅靠有氧代谢无法提供,需要无氧代谢提供部分能量[18]。除此之外,肌肉中糖原储备最多,而糖原正是无氧代谢的主要能量来源[32]。其他组织中OpDHs活性较低,其生理作用尚不明确。
3 经济贝类在环境胁迫下的OpDHs
近年来,对OpDHs的研究主要集中在其活性变化与所受胁迫间的关系。关于酶活性与环境胁迫的研究屡见报道,1985年就出现了关于绿青鳕Pollachius virens中溶酶体酶活性变化与饥饿及再喂养关系的研究[33];维吉尼亚牡蛎Crassostrea virginica中糖代谢相关酶(己糖激酶、柠檬酸合酶、细胞色素c氧化酶、醛缩酶)对镉和低氧的胁迫应答[34];欧洲墨鱼Sepia officinalis中关于糖和脂肪代谢的酶(琥珀酰辅酶A、肉碱棕榈酰转移酶、羟酰辅酶A脱氢酶、己糖激酶、磷酸果糖激酶、丙酮酸激酶、章鱼碱脱氢酶、葡萄糖6-磷酸酶、果糖1,6二磷酸酶、磷酸烯醇式丙酮酸羧激酶、果糖6-磷酸脱氢酶、3-磷酸脱氢酶、天冬氨酸转氨酶、柠檬酸合酶)对饥饿胁迫的应答[35]。而OpDHs作为无氧代谢初期重要的调节酶之一,其活性变化与环境胁迫间的关系也值得深入研究。
关于OpDHs活性变化与环境胁迫的研究如表2所示。从最终的酶活应答可发现,面对环境胁迫时OpDHs活性应答情况十分复杂,酶活性既有上升的也有下降的,还有保持不变的。造成这种现象的主要原因为:(1)不同物种或是同一物种的不同组织中,OpDHs的分布本来就不尽相同,不同的OpDHs其胁迫应答不能一概而论;(2)OpDHs面临不同的胁迫因素时(如低氧、饥饿、温度波动等),可能存在各自不同应答机制;(3)即使同一种胁迫(如低氧),其胁迫强度、胁迫时长等因素同样不可忽视。因此,未来仍需更为详尽地研究来解释OpDHs 面临环境胁迫时的胁迫应答规律。
4 OpDHs基本性质的研究
虽然不同物种来源的OpDHs存在一定的差异,但在很多方面表现出相同或相似的性质。目前,分离纯化出的OpDHs均为单体结构,相对分子质量均为40 000左右。太平洋牡蛎 Crassostrea gigas 闭壳肌中ADH,相对分子质量为47 000[36];鳞沙蚕Aphrodite aculeate咽中SDH,相对分子质量为44 000[37];鲍鱼Haliotis lamellose腹足肌中TDH,相对分子质量为42 000[3] ;皇后扇贝 Chlamys opercularis 闭壳肌中ODH,相对分子质量为43 000[42]。OpDHs的最适温度为45 ℃[43],最适pH约为7[44];OpDHs还有相似的酶促反应机制[45]和动力学性质[46];一些小分子代谢产物,特别是有关能量代谢的物质对OpDHs表现出一定的抑制作用,如生物体内最重要的高能磷酸化合物——ATP对ODH具有一定的抑制作用[47],无氧代谢的标志性产物——琥珀酸对ADH具有一定的抑制作用[43]。而对于等电点而言,不同物种来源的OpDHs表现出较大差异,欧洲乌贼Loligo vulgaris中两种ODH同工酶等电点分别为8.7和8.3[48],海纽虫Cerebratulus lacteus中两种ODH同工酶等电点分别为5.4和5.6[49],厚壳玉黍螺 Littorina littorea足肌中ADH等电点为5.6[46],美国硬壳蛤Mercenaria mercenaria足肌中SDH的等电点为4.8[23]。总之,不同来源的OpDHs在基本酶学性质上都表现出相同或相似的性质,这可能是由于其相同生理功能所决定的。而存在的某些差异可能是因物种长期进化以适应环境所致。
表1 OpDHs在海洋经济贝类中的分布
Tab.1 The distribution of OpDHs in marine commercial shellfishes
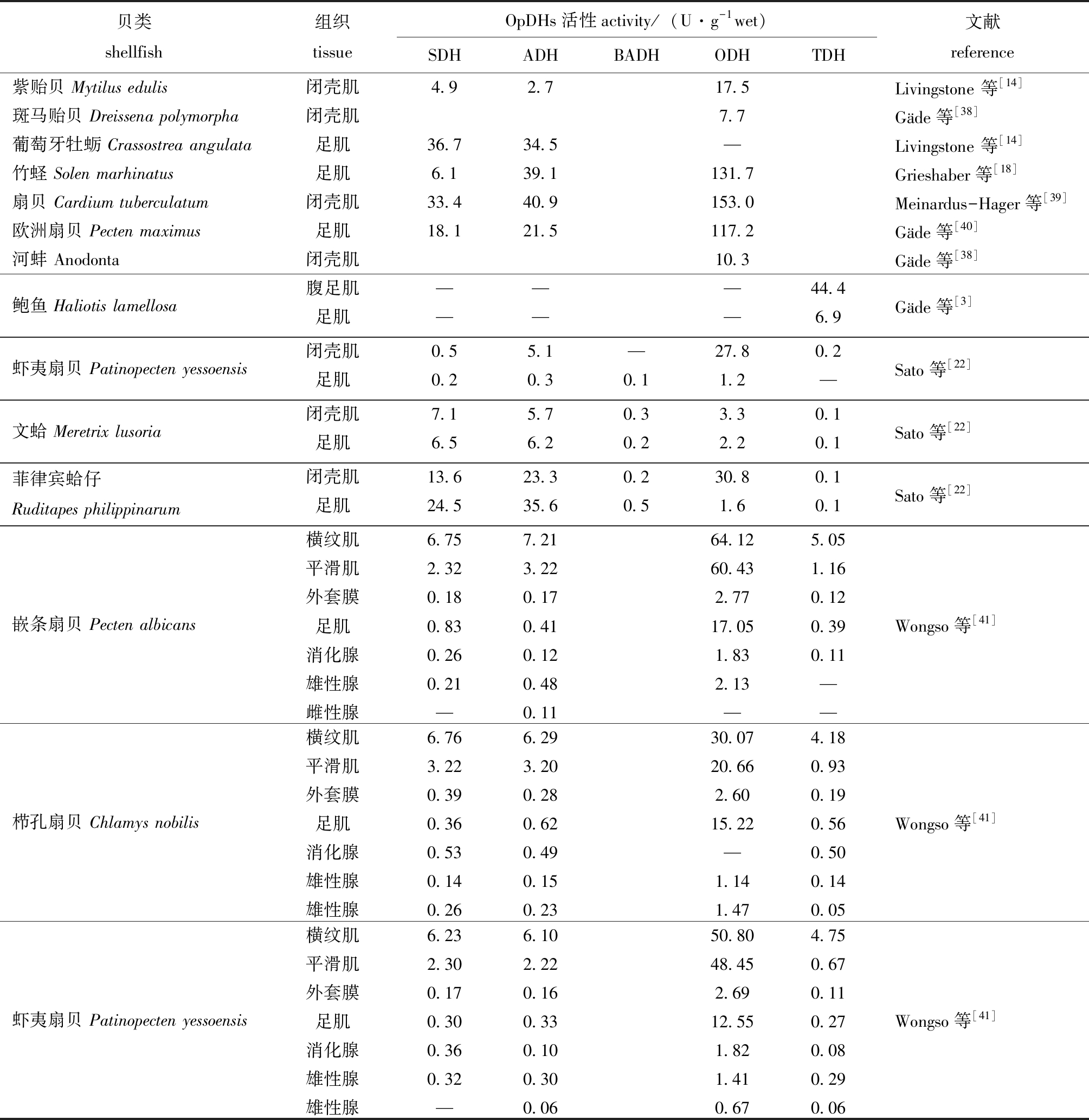
贝类shellfish组织tissueOpDHs活性activity/(U·g-1wet)SDHADHBADHODHTDH文献reference紫贻贝 Mytilus edulis闭壳肌4.92.717.5Livingstone 等[14]斑马贻贝 Dreissena polymorpha闭壳肌7.7Gäde等[38]葡萄牙牡蛎 Crassostrea angulata足肌36.734.5—Livingstone 等[14]竹蛏 Solen marhinatus足肌6.139.1131.7Grieshaber等[18]扇贝 Cardium tuberculatum 闭壳肌33.440.9153.0Meinardus-Hager等[39]欧洲扇贝 Pecten maximus足肌18.121.5117.2Gäde等[40]河蚌 Anodonta闭壳肌10.3Gäde等[38]鲍鱼 Haliotis lamellosa腹足肌———44.4足肌———6.9Gäde等[3]虾夷扇贝 Patinopecten yessoensis闭壳肌0.55.1—27.80.2足肌0.20.30.11.2—Sato等[22]文蛤 Meretrix lusoria闭壳肌7.15.70.33.30.1足肌6.56.20.22.20.1Sato等[22]菲律宾蛤仔 Ruditapes philippinarum闭壳肌13.623.30.230.80.1足肌24.535.60.51.60.1Sato等[22]嵌条扇贝 Pecten albicans横纹肌6.757.2164.125.05平滑肌2.323.2260.431.16外套膜0.180.172.770.12足肌0.830.4117.050.39消化腺0.260.121.830.11雄性腺0.210.482.13—雌性腺—0.11——Wongso等[41]栉孔扇贝 Chlamys nobilis横纹肌6.766.2930.074.18平滑肌3.223.2020.660.93外套膜0.390.282.600.19足肌0.360.6215.220.56消化腺0.530.49—0.50雄性腺0.140.151.140.14雄性腺0.260.231.470.05Wongso等[41]虾夷扇贝 Patinopecten yessoensis横纹肌6.236.1050.804.75平滑肌2.302.2248.450.67外套膜0.170.162.690.11足肌0.300.3312.550.27消化腺0.360.101.820.08雄性腺0.320.301.410.29雄性腺—0.060.670.06Wongso等[41]
注:—表示未检出;空格表示尚未检测
Note:—, undetected; open space, not determined
表2 不同物种中OpDHs对环境胁迫的应答
Tab.2 OpDHs activity of different species in response to environmental stress

物种 species组织 tissueOpDHs胁迫因素 stress factor酶活应答 enzymatic response欧洲扇贝[32]Pecten maximus闭壳肌ODH常氧(100%)+10 ℃无低氧(7.6%)+10 ℃无常氧(100%)+18 ℃无低氧(7.7%)+18 ℃无常氧(100%)+25 ℃上升低氧(14%)+25 ℃上升文蛤[50]Meretrix lusoria鳃外套膜足闭壳肌{ADH/BADH/LYDH/ODH/SDH/TDH}无氧ADH、SDH、LDH上升ADH、SDH无变化ADH、ODH、LDH、SDH上升除TDH外均上升北极贝[51]Arctica islandica外套膜闭壳肌鳃血淋巴ODH低氧(处理组2 kPa,对照组21 kPa)无无无无欧洲墨鱼[35]Sepia officinalis鳃体心脏外套膜消化腺ODH短期饥饿/长期饥饿(短期饥饿3~5 d,长期饥饿12 d)无/无无/无无/下降下降/下降表孔珊瑚[52]Montipora capitata整体ODHSDHADH无氧(处理组氮气,对照组空气)无上升上升
5 存在问题及展望
5.1 存在问题
目前,相较于脊椎动物体内的乳酸脱氢酶研究,对海洋经济贝类中Opine脱氢酶的研究还相对较少,尤其就国内而言还需要进行大量基础研究。主要应在以下几个方面进行深入研究:(1) OpDHs在海洋经济贝类中的分布,包括物种特异性及组织特异性;(2) OpDHs的分离纯化及其基本酶学性质的研究;(3) OpDHs的反应机制,从酶促反应动力学及分子反应机制的角度阐释其内在反应机制;(4) OpDHs的胁迫应答规律,包括物种特异性、不同胁迫因素的应答差异、相同胁迫因素在不同胁迫强度下的应答差异、多种胁迫因素交互作用等;(5) OpDHs的应答机理,是通过激活或抑制以改变细胞内已有酶分子的催化活性,还是通过影响酶分子的合成或降解以改变酶分子的含量。
5.2 展望
目前,常用的品质评价指标在评价经济贝类捕后活品流通过程中的风味品质变化均存在一定局限。酶活性变化是反应代谢能力和代谢途径的良好指标,OpDHs酶作为海洋无脊椎动物特有的丙酮酸还原酶,在无氧代谢中起到重要作用。OpDHs的分离、分析过程均较简单快速,加之其在面临环境胁迫时表现出的酶应答效应,使其具有作为一种快速、精确的生物指标用于活品品质评价的潜力。未来将OpDHs酶应用于海洋经济贝类活品品质主要评价检测,这样能够实现经济贝类在活品流通过程中品质的可控和可预测,从而可延长其货架期,提高其商品价值。
[1] 王晓雯,朱华,胡红霞,等.低氧胁迫对西伯利亚鲟幼鱼生理状态的影响[J].水产科学,2016,35(5):459-465.
[2] Seibel B A,Häfker N S,Trübenbach K,et al.Metabolic suppression during protracted exposure to hypoxia in the jumbo squid,Dosidicus gigas,living in an oxygen minimum zone[J].Journal of Experimental Biology,2014,217(14):2555-2568.
[3] Gäde G.Purification and properties of tauropine dehydrogenase from the shell adductor muscle of the ormer,Haliotis lamellosa[J].European Journal of Biochemistry,1986,160(2):311-318.
[4] 郑尧,刘俊荣,周晏琳,等.捕后虾夷扇贝闭壳肌免疫因子与活品品质评价初探[J].大连海洋大学学报,2017,32(2):217-223.
[5] 杨婷婷.采捕后活品虾夷扇贝(Patinopecten yessoensis)的风味变化[D].大连:大连海洋大学,2014.
[6] 周晏琳,郑尧,刘慧慧,等.干露对活品虾夷扇贝闭壳肌SOD酶活性及其性质的影响[J].大连海洋大学学报,2018,33(5):651-657.
[7] 田元勇,刘金洋,刘慧慧,等.捕后暂养对虾夷扇贝闭壳肌硬化的影响[J].水产学报,2017,41(6):888-895.
[8] 刘金洋,刘俊荣,田元勇,等.捕后处置对活品底播虾夷扇贝生化代谢的影响[J].水产学报,2017,41(1):81-87.
[9] 杨婷婷,刘俊荣,俞微微,等.活品流通过程中虾夷扇贝风味品质的变化[J].水产学报,2015,39(1):136-146.
[10] Lee A C,Lee M C,Lee Y H,et al.Candidates for a hypoxia-stress indicator in the hard clam,Meretrix lusoria[J].Aquaculture,2008,278(1-4):150-155.
[11] Carroll J L,Wells R M G.Strategies of anaerobiosis in New Zealand infaunal bivalves:adaptations to environmental and functional hypoxia[J].New Zealand Journal of Marine and Freshwater Research,1995,29(2):137-146.
[12] Müller A,Janssen F,Grieshaber M K.Putative reaction mechanism of heterologously expressed octopine dehydrogenase from the great scallop,Pecten maximus (L.)[J].FEBS Journal,2007,274(24):6329-6339.
[13] Van O N,Smits S H J,Schmitt L,et al.Control of D-octopine formation in scallop adductor muscle as revealed through thermodynamic studies of octopine dehydrogenase[J].Journal of Experimental Biology,2012,215(9):1515-1522.
[14] Livingstone D R,De Zwaan A,Leopold M,et al.Studies on the phylogenetic distribution of pyruvate oxidoreductases[J].Biochemical Systematics and Ecology,1983,11(4):415-425.
[15] Harcet M,Perina D,Pleše B.Opine dehydrogenases in marine invertebrates[J].Biochemical Genetics,2013,51(9-10):666-676.
[16] Hochachka P W.Fuels and pathways as designed systems for support of muscle work[J].Journal of Experimental Biology,1985,115:149-164.
[17] Livingstone D R.Invertebrate and vertebrate pathways of anaerobic metabolism:evolutionary considerations[J].Journal of the Geological Society,1983,140(1):27-37.
[18] Grieshaber M K,Hardewig I,Kreutzer U,et al.Physiological and metabolic responses to hypoxia in invertebrates[M]//Reviews of Physiology,Biochemistry and Pharmacology.Berlin:Springer,1993,125:43.
[19] Chen S Q,Zhang C H,Xiong Y F,et al.A GC-MS-based metabolomics investigation on scallop (Chlamys farreri) during semi-anhydrous living-preservation[J].Innovative Food Science & Emerging Technologies,2015,31:185-195.
[20] De Zwaan A,Zandee D I.Body distribution and seasonal changes in the glycogen content of the common sea mussel Mytilus edulis[J].Comparative Biochemistry and Physiology Part A:Physiology,1972,43(1):53-58.
[21] De Zwaan A,Putzer V.Metabolic adaptations of intertidal invertebrates to environmental hypoxia (a comparison of environmental anoxia to exercise anoxia)[J].Symposia of the Society for Experimental Biology,1985,39:33-62.
[22] Sato M,Takeuchi M,Kanno N,et al.Distribution of opine dehydrogenases and lactate dehydrogenase activities in marine animals[J].Comparative Biochemistry and Physiology Part B:Comparative Biochemistry,1993,106(4):955-960.
[23] Fields J H A,Storey K B.Tissue-specific alanopine dehydrogenase from the gill and strombine dehydrogenase from the foot muscle of the cherrystone clam Mercenaria mercenaria (Linn.)[J].Journal of Experimental Marine Biology and Ecology,1987,105(2-3):175-185.
[24] Nakanishi K,Fujii T,Szekely J.Possible relationship between energy dissipation and agitation in steel processing operations[J].Ironmaking & Steelmaking,1975,2(3):193-197.
[25] Van Thoai N,Huc C,Pho D B,et al.Octopine déshydrogénase Purification et propriétés catalytiques[J].Biochimica et Biophysica Acta (BBA)-Enzymology,1969,191(1):46-57.
[26] Fields J H A,Eng A K,Ramsden W D,et al.Alanopine and strombine are novel imino acids produced by a dehydrogenase found in the adductor muscle of the oyster,Crassostrea gigas[J].Archives of Biochemistry and Biophysics,1980,201(1):110-114.
[27] Dando P R,Storey K B,Hochachka P W,et al.Multiple dehydrogenases in marine molluscs:electrophoretic analysis of alanopine dehydrogenase,strombine dehydrogenase,octopine dehydrogenase and lactate dehydrogenase[J].Marine Biology Letters,1981,28(2):261-268.
[28] Sato M,Gäde G.Rhodoic acid dehydrogenase:a novel amino acid-linked dehydrogenase from muscle tissue of Haliotis species[J].Naturwissenschaften,1986,73(4):207-209.
[29] Sato M,Takahara M,Kanno N,et al.Isolation of a new opine,β-alanopine,from the extracts of the muscle of the marine bivalve mollusc,Scapharca broughtonii[J].Comparative Biochemistry and Physiology Part B:Comparative Biochemistry,1964,88(3):803-806.
[30] Livingstone D R,Stickle W B,Kapper M A,et al.Further studies on the phylogenetic distribution of pyruvate oxidoreductase activities[J].Comparative Biochemistry and Physiology Part B:Comparative Biochemistry,1990,97(4):661-666.
[31] Wongso S,Ushio H,Ohshima T,et al.Changes in content of octopine,acidic opines,related amino acids and phosphoarginine in the adductor muscle of three species of scallop during storage[J].Journal of Food Biochemistry,1998,22(1):65-81.
[32] Artigaud S,Lacroix C,Richard J,et al.Proteomic responses to hypoxia at different temperatures in the great scallop (Pecten maximus)[J].Peer J,2015,3:e871.
[33] Beardall C H,Johnston I A.Lysosomal enzyme activities in muscle following starvation and refeeding in the saithe Pollachius virens L.[J].European Journal of Cell Biology,1985,39(1):112-117.
[34] Ivanina A V,Froelich B,Williams T,et al.Interactive effects of cadmium and hypoxia on metabolic responses and bacterial loads of eastern oysters Crassostrea virginica Gmelin[J].Chemosphere,2011,82(3):377-389.
[35] Speers-Roesch B,Callaghan N I,Maccormack T J,et al.Enzymatic capacities of metabolic fuel use in cuttlefish (Sepia officinalis) and responses to food deprivation:insight into the metabolic organization and starvation survival strategy of cephalopods[J].Journal of Comparative Physiology B,2016,186(6):711-725.
[36] Fields J H,Hochachka P W.Purification and properties of alanopine dehydrogenase from the adductor muscle of the oyster,Crassostrea gigas (Mollusca,Bivalvia)[J].European Journal of Biochemistry,1981,114(3):615-621.
[37] Storey K B.Tissue-specific alanopine dehydrogenase and strombine dehydrogenase from the sea mouse,Aphrodite aculeata (Polychaeta)[J].Journal of Experimental Zoology,1983,225(3):369-378.
[38] Gäde G,Zebe E. Über den Anaerobiosestoffwechsel von Molluskenmuskeln[J].Journal of Comparative Physiology,1973,85(3):291-301.
[39] Meinardus-Hager G,Gäde G.The pyruvate branch point in the anaerobic energy metabolism of the jumping cockle Cardium tuberculatum L.:D-lactate formation during environmental anaerobiosis versus octopine formation during exercise[J].Experimental Biology,1986,45(2):91-110.
[40] Gäde G,Weeda E,Gabbott P A.Changes in the level of octopine during the escape responses of the scallop,Pecten maximus (L.)[J].Journal of Comparative Physiology,1978,124(2):121-127.
[41] Wongso S,Ushio H,Yamanaka H.Glycolytic enzymes in the tissues of three species of scallop (Bivalvia:Pectinidae)[J].Fisheries Science,1999,65(1):123-128.
[42] Mulcahy P,Griffin T,O’Carra P.Biospecific affinity chromatographic purification of octopine dehydrogenase from molluscs[J].Protein Expression and Purification,1997,9(1):109-114.
[43] Lee A C,Lee K T,Pan L Y.Purification and kinetic characteristics of strombine dehydrogenase from the foot muscle of the hard clam (Meretrix lusoria)[J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,2011,158(1):38-45.
[44] Carvajal N,Kessi E.Properties of octopine dehydrogenase from the foot muscle of Concholepas concholepas[J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,1988,90(1):77-79.
[45] Urich K.Comparative Animal Biochemistry[M].Berlin Heidelberg:Springer,1994:263-264.
[46] Plaxton W C,Storey K B.Alanopine dehydrogenase:purification and characterization of the enzyme from Littorina littorea foot muscle[J].Journal of Comparative Physiology,1982,149(1):57-65.
[47] Vollmer M,Hochachka P W,Mommsen T P.Octopine dehydrogenase and phosphoarginine kinase in squid mantle:cooperation of two enzymes at the arginine branch point in cephalopod muscle[J].Canadian Journal of Zoology,1981,59(7):1447-1453.
[48] Grieshaber M,Kronig E,Koormann R.A photometric estlmation of phospho-L-arginine,arginine and octopine using homogenous octopine dehydrogenase isoenzyme 2 from the squid,Loligo vulgaris Lam[J].Hoppe-Seyler’s Zeitschrift für physiologische Chemie,1978,359(1):133-136.
[49] Gäde G,Carlsson K H.Purification and characterisation of octopine dehydrogenase from the marine nemertean Cerebratulus lacteus (Anopla:Heteronemerta):comparison with scallop octopine dehydrogenase[J].Marine Biology,1984,79(1):39-45.
[50] Lee A C,Lee K T.The enzyme activities of opine and lactate dehydrogenase in the gills,mantle,foot,and adductor of the hard clam Meretrix lusoria[J].Journal of Marine Science & Technology,2011,19(4):361-367.
[51] Strahl J,Dringen R,Schmidt M M,et al.Metabolic and physiological responses in tissues of the long-lived bivalve Arctica islandica to oxygen deficiency[J].Comparative Biochemistry and Physiology Part A:Molecular & Integrative Physiology,2011,158(4):513-519.
[52] Murphy J W A,Richmond R H.Changes to coral health and metabolic activity under oxygen deprivation[J].Peer J,2016,4(2):e1956.