小GTPase蛋白(Small GTP binding protein)作为重要的调控蛋白家族之一,自20世纪80年代被发现以来,有关研究主要集中在哺乳类(mammals)、植物类(plants)和昆虫类(insects)。有关海洋生物小GTPase蛋白的研究最早可以追溯到20世纪90年代,但是,相较于哺乳动物和植物而言,对海洋生物小GTPase蛋白的研究仍处于相对滞后状态,但随着人们对海洋生态环境及海洋生物的逐渐重视,海洋生物小GTPase蛋白的研究也取得了一定成果。本研究中就近年来对海洋生物小GTPase蛋白家族的研究进行综述,旨在为深入了解海洋生物小GTPase蛋白家族成员的生物学功能提供参考。
1 小GTPase蛋白
1.1 小GTPase蛋白作用机制
小GTPase蛋白广泛存在于真核细胞中,是一类可以结合并水解鸟苷三磷酸(Guanosine triphosphate,GTP)的水解酶超家族。小GTPase蛋白与异源三聚体G蛋白(G-protein,是一类能与鸟嘌呤核苷酸结合,具有GTP水解酶活性的信号转导蛋白)的α亚基同源,但是其相对分子质量却要比G蛋白小许多,因此,也被称为小G蛋白。
小GTPase蛋白的作用机制主要是通过作为独立水解酶结合并水解鸟苷三磷酸(GTP)形成鸟苷二磷酸(Guanosine diphosphate,GDP),通过GTP结合态(激活态)和GDP结合态(失活态)这两种状态的转换,形成小GTPase蛋白循环,进而发挥其分子开关的作用(图1)。首先,鸟苷酸交换因子(Guanine nucleotide exchange factors,GEFs)可以促使GDP结合态的小GTPase发生基团解离,GDP与小GTPase结合形成GEF-小GTPase复合物,有利于GTPase进一步与GTP结合,形成小GTPase-GTP复合物(即小GTPase的GTP结合态)。随后,处于小GTP结合态的GTPase与效应因子(effector)结合产生相应的细胞效应(cellular outcome)。之后,在GTPase激活蛋白(GTPase activating protein,GAPs)的作用下,小GTPase从GTP结合态再次转换成GDP结合态。一般认为,小GTPase蛋白由激活态向失活态转变有两种方式:一种方式是小GTPase蛋白本身的水解酶活性被GAPs激活,可将GTP水解成GDP和磷酸基团(Phosphate group,Pi);另一种方式则是在鸟苷酸解离抑制蛋白(Guanine nucleotide dissociation inhibitors,GDI)的作用下,形成GDI-小GTPase-GDP复合物,从膜上将GDP结合态的小GTPase回收进入胞质中。最后,GDI置换因子(GDI differentiation factor,GDFs)与GDI-小GTPase-GDP复合物中的GDI分子相结合,从而释放GDP结合态的小GTPase,被释放的GDP结合态小GTPase再次插入到细胞膜相应的靶点位置,完成小GTPase的循环[1-2](图1)。
1.2 小GTPase蛋白分类及功能
1980年,Chang等[3]分别在Harvery鼠肉瘤病毒(Harverymouse sarcoma virus)和Kirsten鼠肉瘤病毒(Kirsten mouse sarcoma virus)中首次发现了小GTPase蛋白Ha-Ras(Rat Sarcoma)和Ki-Ras,随后,关于小GTPase蛋白的相关研究逐渐展开。1985年,Madaule等[4]又在雨虎属Aplysia生物中发现了另一个小GTPase蛋白家族成员——Rho(Ras homolog),研究证实,Rho是Ras的同源基因,它们所编码的蛋白序列长度一致,在氨基酸序列上具有35%的一致性,同时,两者具有相同的膜附着所需的C-末端序列,这些结果提示,这两种蛋白在生物功能上具有相同的作用。
随着研究的不断深入,哺乳类、植物类、昆虫类等生物细胞中的小GTPase蛋白家族成员陆续被发现。1992年,在细胞生物学研讨会议上,人们按照小GTPase蛋白结构、序列和功能的不同,将其家族成员分为Rho、Rab(Ras-like proteins in brain)、Ran(Ras-related nuclear protein)、Ras和Arf(ADP ribosylation factors)5大类[5](表1)。
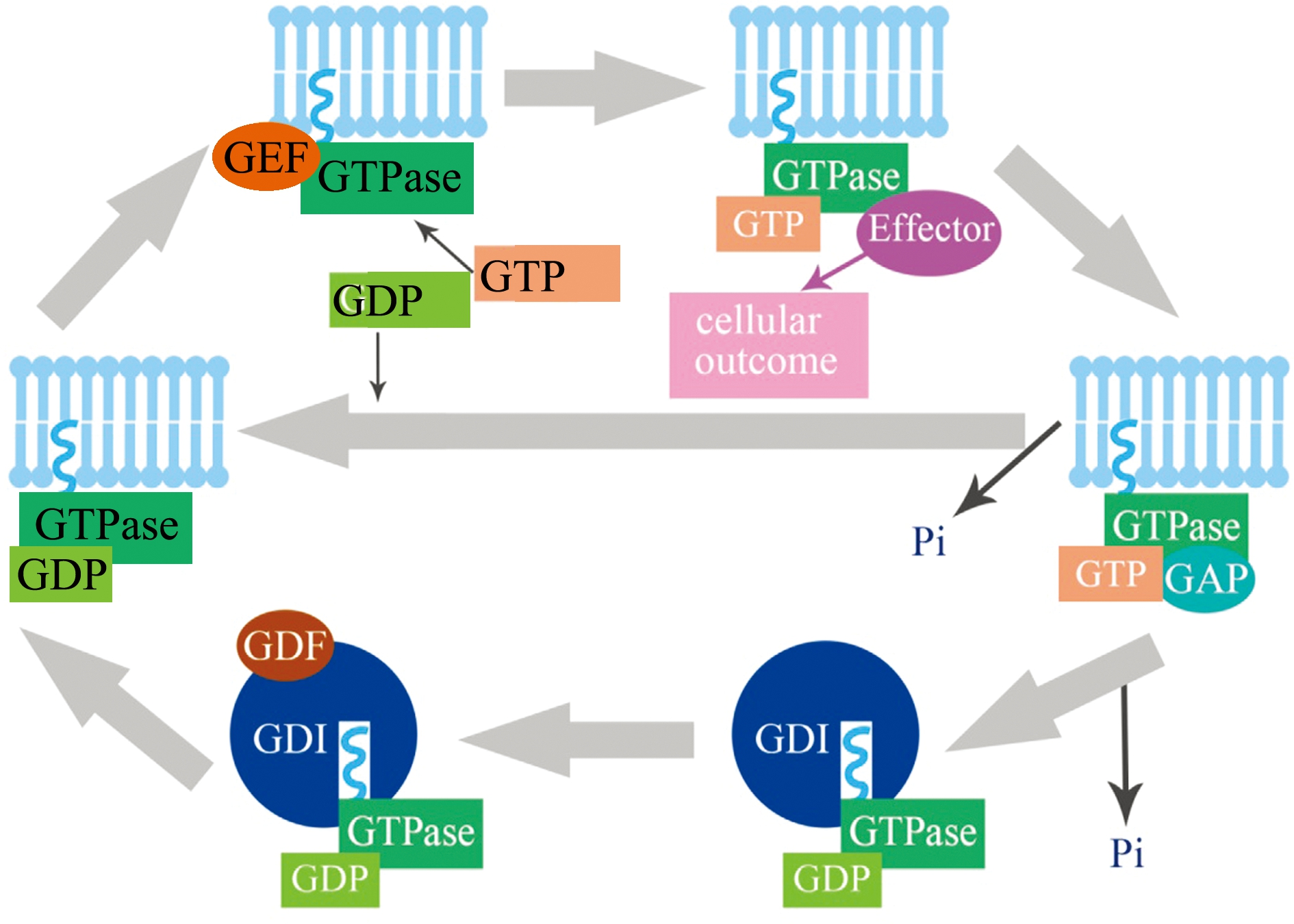
注:GTPase为小GTPase蛋白;GDP为鸟苷二磷酸;GTP为鸟苷三磷酸;GEF为鸟苷酸交换因子;Effector为效应因子;Pi为磷酸基团;GAP为GTP酶激活蛋白;GDI为鸟苷酸解离抑制蛋白;GDF为GDI置换因子;箭头方向为小GTPase循环方向
Note:GTPase,small GTP binding protein;GDP,guanosine diphosphate;GTP,guanosine triphosphate;GEF,guanine nucleotide exchange factors;effector,effector molecule;Pi,phosphate group;GAP,GTPase activating protein;GDI,guanine nucleotide dissociation inhibitors;GDF,GDI differentiation factor; Arrow direction indicates the direction of the small GTPase cycling
图1 小GTPase蛋白循环示意图(引自Seabra等[2])
Fig.1 Cycling diagram of the small GTPase (from Seabra et al.[2])
迄今为止,在各种真核生物中被发现的小GTPase蛋白家族成员已经超过100种[6],截至2018年3月,在美国国立生物技术信息中心(National Center for Biotechnology Information,NCBI,https://www.ncbi.nlm.nih.gov/)上登录的各种生物的小GTPase基因和蛋白序列信息多达1 233 678条,其中包括哺乳动物类242 153条、植物类的24 718条、真菌类的69 604条、原生动物类的24 964条、细菌类的866 221条、其他种类的6018条。
表1 小GTPase蛋白分子特征和生物学功能
Tab.1 Molecular features and biological functions of small GTPase proteins
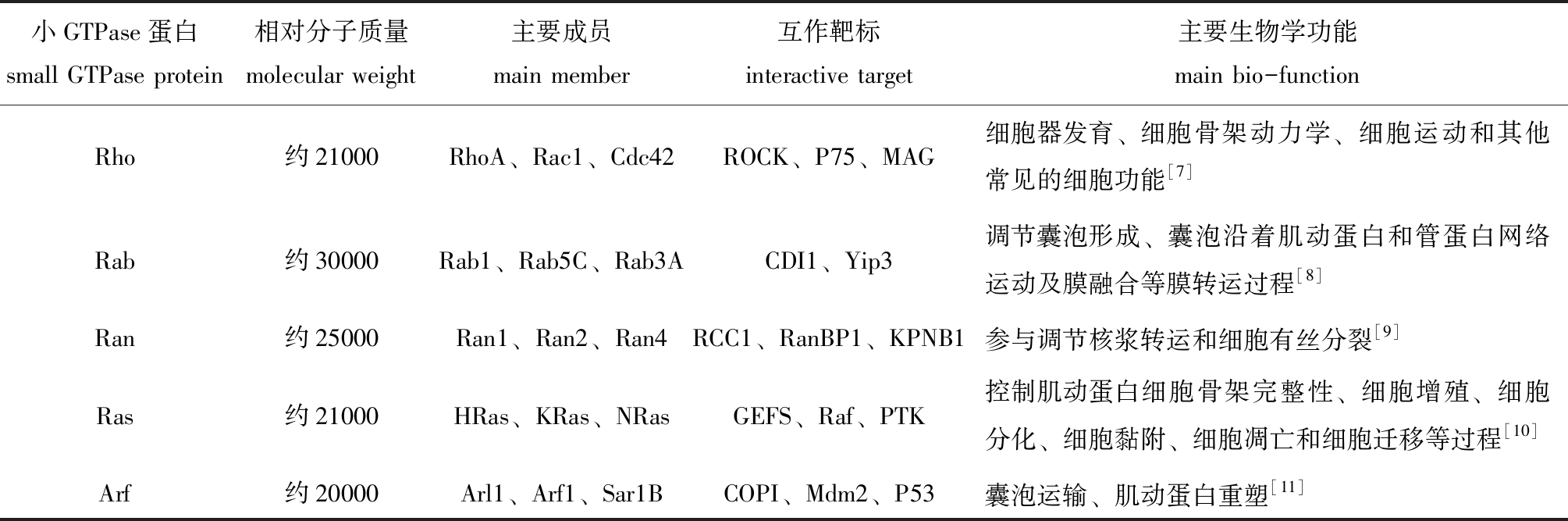
小GTPase蛋白small GTPase protein相对分子质量molecular weight主要成员main member互作靶标interactive target主要生物学功能main bio-functionRho约21000RhoA、Rac1、Cdc42ROCK、P75、MAG细胞器发育、细胞骨架动力学、细胞运动和其他常见的细胞功能[7]Rab约30000Rab1、Rab5C、Rab3ACDI1、Yip3调节囊泡形成、囊泡沿着肌动蛋白和管蛋白网络运动及膜融合等膜转运过程[8]Ran约25000Ran1、Ran2、Ran4RCC1、RanBP1、KPNB1参与调节核浆转运和细胞有丝分裂[9]Ras约21000HRas、KRas、NRasGEFS、Raf、PTK控制肌动蛋白细胞骨架完整性、细胞增殖、细胞分化、细胞黏附、细胞凋亡和细胞迁移等过程[10]Arf约20000Arl1、Arf1、Sar1BCOPI、Mdm2、P53囊泡运输、肌动蛋白重塑[11]
2 海洋生物小GTPase蛋白
2.1 Rho GTPase
Rho GTPase蛋白家族是真核生物中普遍存在的一类相对分子质量约为21 000的小GTPase蛋白,主要成员包括Cdc42(Cell division control protein 42 homolog)、Rac(Ras-related C3 botulinum toxin substrate )和RhoA(Ras homolog gene family, member A)3个亚家族。大量研究证实,Rho GTPase蛋白家族成员可以调节细胞器发育、细胞骨架动力学、细胞运动等细胞内肌动蛋白动力学相关过程[7,12-16]。
2.1.1 Rac亚家族 Rac亚家族的成员主要包括Rac1、Rac2(Ras-related C3 botulinum toxin substrate 2)、Rac3(Ras-related C3 botulinum toxin substrate 3)和RhoG(Ras homology growth-related)。目前被鉴定的海洋生物Rac亚家族成员主要集中在棘皮动物门Echinodermata、节肢动物门Arthropoda等生物中,截至2018年3月,登录到NCBI数据库的海洋生物Rac亚家族成员序列共有全长序列571条,部分序列2330条。多序列比对结果显示,刺参Apostichopus japonicus、凡纳滨对虾Litopenaeus vannamei、大菱鲆Scophthalmus maximus中Rac亚家族成员的进化保守性为67.19%~88.54%(图2)。

注:截至2018年3月,下同
Note: By March 2018,et sequentia
图2 NCBI数据库中已经登录的海洋生物Rho家族蛋白多序列比对结果
Fig.2 Multiple sequence alignment of deduced amino acid sequences from Rho family in marine lifes in NCBI database
近年研究发现,Rac亚家族在海洋生物的免疫应答和宿主防御生理过程中发挥了重要作用。Li等[17]研究显示:刺参Rac1基因(AjRac1)在受到弧菌感染后呈表达上调趋势,序列分析表明,AjRac1与其他真核生物的Rac1基因具有高度保守性;系统发育树分析显示,AjRac1的氨基酸序列与紫球海胆SpRac1的氨基酸序列极为相似,AjRac1在刺参的囊胚期、成熟体腔细胞和呼吸树中表达量较高,成熟体细胞中AjRac1的转录水平在弧菌感染后的4 ~12 h时变化显著,这表明AjRac1可能参与刺参的宿主防御和免疫应答。2015年,Cha等[18]将溶藻弧菌Vibrio alginolyticus注射到凡纳滨对虾Litopenaeus vannamei中发现,细菌可诱导凡纳滨对虾肝胰腺中的Rac1基因(LvRac1)表达上调,与未注射溶藻弧菌的凡纳滨对虾组相比,注射溶藻弧菌的试验组对虾的累积死亡率显著降低,利用RNA干扰(RNA interference,RNAi)技术沉默LvRac1后发现,凡纳滨对虾对细菌的清除能力大幅度下降,对溶藻弧菌的刺激也表现得更为敏感,这说明LvRac1在凡纳滨对虾对溶藻弧菌感染的先天性免疫应答中具有重要作用。刘岚萍[19]研究显示,当大黄鱼Larimichthys crocea受到脂多糖(Lpopolysaccharide,LPS)、聚肌胞苷酸(Polyinosinic polycytidylic acid,PolyI:C)和副溶血弧菌Vibrio parahemolyticus刺激后,其肝脏、脾脏和头肾中Rac1、Rac2、Rac3的表达量均呈现显著上调趋势,推测Rac家族成员在大黄鱼的免疫应答中可能发挥重要作用。
与海洋生物相比,有关哺乳动物Rac亚家族的研究主要集中在肿瘤发生方面。Nohata等[20]研究发现,Rac1在小鼠胚胎血管完整性维持、血管生成和新生小鼠视网膜血管网络发育过程中发挥重要作用,他们同时提出了利用Rac1及其下游分子代表潜在的抗血管生成治疗靶点,用于治疗新血管形成异常和血管过度生长等相关疾病的设想。研究显示,由RhoG介导的RhoG、SGEF(Src homology 3 domain-containing Guanine nucleotide Exchange Factor)、桩蛋白磷酸化(paxillin phosphorylation)的新型信号通路,可以在调控乳腺癌细胞侵袭性伪足分解中发挥作用[21]。
2.1.2 RhoA亚家族 RhoA亚家族的主要成员包括RhoA、RhoB(Ras homolog gene family,member B)和RhoC(Ras homolog gene family,member C)。
近年研究发现,RhoA亚家族在海洋生物胚胎发育和细胞骨架动力学生理过程中发挥了重要作用。Allaire等[22]研究显示,Rho蛋白可抑制新星海葵Nematostella vectensis触手的过度延伸,导致海葵触手上的可调式发束机械感受器不能正常检测附近游泳猎物的运动,进而影响海葵的捕食。Gray等[23]研究发现,章鱼科Octopodidae视网膜中的Rho蛋白可在黑暗中被激活,激活的Rho蛋白可与视网膜的横纹膜结合并启动相应的信号传导途径,从而促进章鱼视网膜弹状细胞微绒毛的生长。Armenta-Armenta等[24]研究发现,紫球海胆Strongylocentrotus purpuratus的Rho蛋白可参与维持其卵子的活化,进而影响紫球海胆的生殖过程,该研究还发现,RhoA依赖的信号通路对于紫球海胆早期胚胎发育至关重要。近年来,随着高通量测序技术的迅猛发展,从基因组层面全方位考量蛋白家族成员的数字表达谱已经成为科研关注的热点领域。对贝类基因组的研究显示,在虾夷扇贝Patinopecten yessoensis、栉孔扇贝Chlamys (Azumapecten)farreri和太平洋牡蛎Crassostrea gigas中,Rho基因表现出比其他无脊椎动物更高的保守性[25]。
与Rac亚家族相似,有关哺乳动物RhoA亚家族的研究也集中在肿瘤形成方面。Muramatsu等[26]研究显示,通过激活RhoA信号通路,可以增加口腔鳞状细胞癌细胞的细胞运动、侵袭、转移及生长;此外,他们还发现,使用DHPS抑制剂(N1-Guanyl-1,7-氨基庚烷)抑制RhoA信号通路活性,可显著降低口腔鳞状细胞癌细胞的形成,进而提出从分子层面进行口腔鳞状细胞癌治疗的新设想。
2.1.3 Cdc42亚家族 Cdc42亚家族的主要成员包括Cdc42、TC10(Rho-related GTP-binding protein RhoQ)、TCL(Rho-related GTP-binding protein RhoJ)、Chp(Wnt-2 responsive Cdc42 homolog)和Wrch-1(Wnt-1 responsive Cdc42 homolog)。
近年研究发现,Cdc42亚家族在海洋生物细胞凋亡调节生理过程中发挥了重要作用,但研究资料相对较少。Peng等[27]通过使用dsRNA介导的RNA干扰抑制来探测Cdc42对暴露在镉中的凡纳滨对虾的作用,结果显示,该过程中降低了MAPK基因的表达水平(包括p38、JNK和ERK),镉暴露引起Cdc42和MAPKs表达水平显著增加,并伴随着总血细胞数(THC)的减少及凋亡血细胞比率和ROS产生的增加。然而,通过抑制Cdc42基因在虾中的表达,所有这些反应都要弱得多,其中死亡率高于对照组。这表明Cdc42基因的表达在虾中对镉的反应、细胞凋亡的调节及相关的应激反应中起重要作用。
与海洋生物相比,有关哺乳动物Cdc42亚家族的研究主要集中在胚胎发育方面。李媛等[28]研究显示,Cdc42基因在小鼠牙胚发育早期可能参与了牙胚的增殖及迁移,在牙胚发育晚期可能参与了成牙本质细胞和成釉细胞的分化,尤其在小鼠成牙本质细胞和成釉细胞极性的形成与维持中可能发挥重要作用。
2.2 Rab GTPase
Rab(Ras-like proteins in brain)是存在于真核生物质膜和细胞器膜中的一类调节型小分子GTPase蛋白,也是调节型小分子GTPase蛋白家族中最大的亚家族,Rab蛋白家族的相对分子质量约为30 000,主要成员包括Rab1(Ras-related protein Rab-1)、Rab3A(Ras-related protein Rab-3A)和Rab5C(Ras-related protein Rab-5C)等。研究显示,Rab GTPase可参与调节膜运输的许多环节,如囊泡的形成、囊泡沿肌动蛋白与微管蛋白网络的运动及膜融合等,进而调控真核细胞各细胞器间的物质交换和信息传递[29]。
有关海洋生物Rab蛋白家族成员的研究主要集中在形态发生和免疫方面,但资料相对较少。Yu等[30]研究证实,枪乌贼Loligo pealei Rab27(Ras-related protein Rab-27)蛋白的抗体存在于枪乌贼突触小泡上,突触电刺激试验结果发现,枪乌贼Rab27抗体在电刺激下可抑制突触释放,表明枪乌贼Rab27主要参与了再生囊泡的成熟及转运过程。Wöllert等[31]研究指出,枪乌贼体内的Rab3A可与突触小泡运动蛋白Myosinva - Va (Myo5a)结合形成Rab3A/Myo5a复合物,进而参与乌贼神经元囊泡的转运。2015年,Wang等[32]利用基因克隆技术获得了凡纳滨对虾Rab基因(LvRab)的cDNA全长,初步分析了LvRab在细菌感染、不同pH条件、重金属胁迫、盐度变化和低温胁迫条件下的表达规律,发现LvRab对细菌感染、pH和重金属胁迫的反应较为敏感,说明LvRab可能与环境胁迫引起的凡纳滨对虾抗压力机制有关[33]。
2.3 Ran GTPase
Ran蛋白家族是一种由Ran基因编码的蛋白,相对分子质量约为25 000,主要成员包括Ran1(RAs-related nuclear protein 1)、Ran2(RAs-related nuclear protein 2)和Ran4(RAs-related nuclear protein 4)等,已被广泛证明参与细胞质和细胞核之间的物质运输,在信号转导通路中起到分子开关的作用。在真核生物细胞中,Ran以GDP结合(Ran-GDP)和GTP结合(Ran-GTP)两种形式存在,两种形式的转换通过Ran的核苷酸交换因子(Regulator of chromosome condensation 1,RCC1)的作用实现。
Ran蛋白家族成员参与了海洋生物的生殖、胚胎发育和免疫防御。Hino等[34]研究发现,在虾夷扇贝精子发生过程中,Ran基因在虾夷扇贝睾丸中大量表达,通过检测Ran基因在成熟虾夷扇贝睾丸中的周期表达谱,发现Ran的表达水平在减数分裂和精子发生期间增加,这表明Ran可以调控虾夷扇贝精子发生过程。Zhou等[35]从斑节对虾Penaeus monodon的眼柄cDNA文库中获得Ran基因,且该基因在班节对虾的肝胰脏、卵巢、肌肉、肠、眼柄、脑、胃和心脏等器官中均有表达,其中Ran基因在斑节对虾卵巢发育的6个阶段中表达最为显著,这表明Ran可能在斑节对虾的卵巢发育中发挥重要作用。Zhao等[36]研究发现,Ran蛋白在病毒抗性克氏原鳌虾Procambarus clarkii中呈显著上调趋势,提示Ran蛋白可能涉及先天免疫(innate immune)系统对抗病毒感染的防御过程。Liu等[37]研究显示,在日本对虾Peneaus japonicus中,Ran蛋白通过与肌球蛋白形成蛋白复合物,通过调节吞噬作用参与了抗病毒免疫。Fang等[38]研究发现,大黄鱼Larimichthys crocea的Ran基因在其肾、肝、鳃、肌肉、脾脏、皮肤、心脏、肠和血液组织中均有表达,其中在肾中表达量最高,在皮肤中表达最低;通过感染失活的溶血性弧菌发现,大黄鱼肾、血液和脾脏中Ran基因表达呈明显上调趋势,这表明大黄鱼Ran基因在防御病原体感染方面发挥重要作用。
2.4 Ras GTPase
Ras是大鼠肉瘤(Rat sarcoma)的英文缩写,Ras蛋白是原癌基因c-ras的表达产物,由190个氨基酸残基组成,主要成员包括HRas、KRas和NRas等,相对分子质量约为21 000。Ras属小的单体GTP结合蛋白,具有弱GTP酶活性,分布于质膜胞质一侧。Ras蛋白的活性状态对细胞生长、分化、细胞骨架、蛋白运输和分泌等均具有影响。
目前,NCBI数据库中已经登录的有关海洋生物Ras序列主要有欧洲鳗鲡Anguilla anguilla(ABA82135.1)、大西洋小鳕Microgadus tomcod(AAA83022.1)、贻贝Mytilus edulis(AAT81171.1)、紫贻贝Mytilus galloprovincialis(ABC46896.1)、织纹螺Nassarius reticulatus(ABA82136.1)和中国对虾Fenneropenaeus chinensis(AHA93923.1),多序列比对结果显示,这6种生物的Ras进化保守性为61.58%~89.47%(图3)。
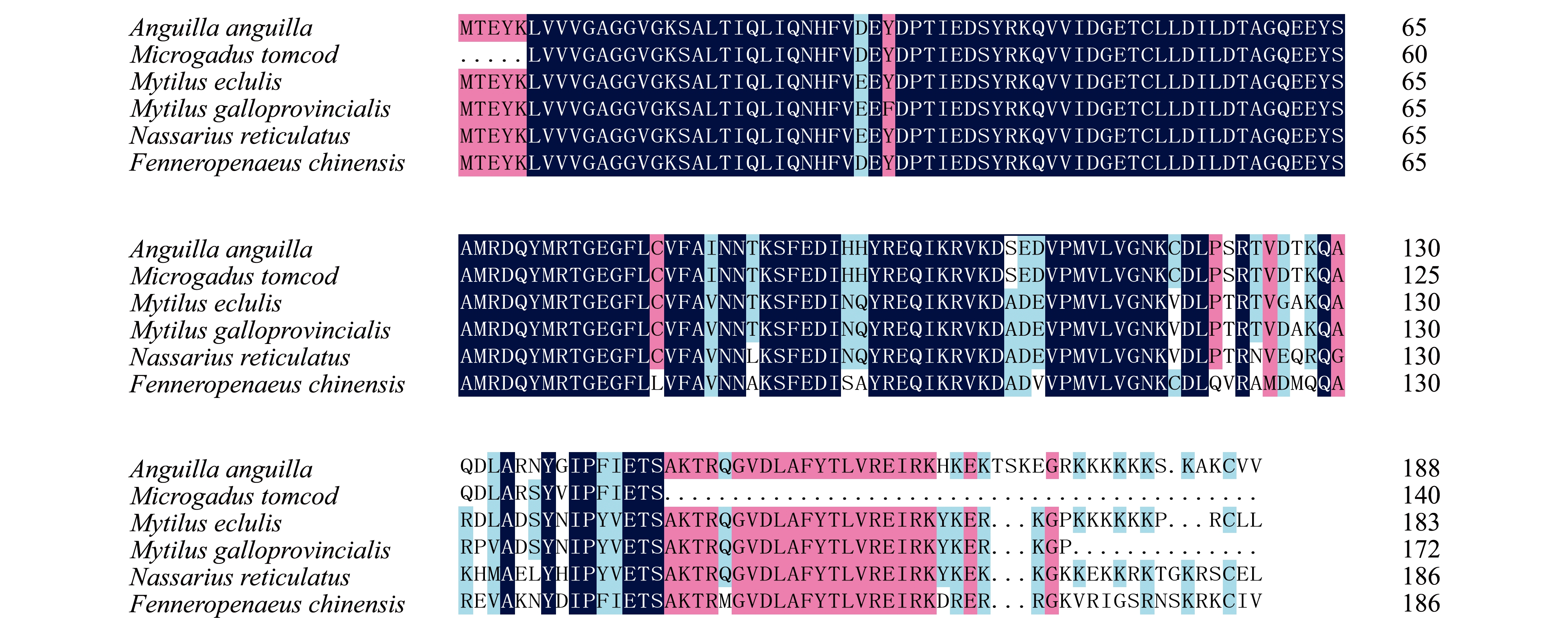
图3 NCBI数据库中已经登录的6种海洋生物Ras家族蛋白多序列比对结果
Fig.3 Multiple sequence alignment of deduced amino acid sequences from Ras family in 6 species of marine lifes in NCBI database
迄今为止,关于海洋生物Ras GTPase蛋白亚家族功能的报道相对较少,且主要集中在细胞增殖方面。Jouaux等[39]检测了太平洋牡蛎Crassostrea gigas中Ras基因的组织表达规律,发现Ras通过转录激活胰岛素途径元件来调节胰岛素信号。Di等[40-41]研究报道了海洋贻贝Mytilus edulis可以在自然环境中形成性腺瘤,与这些疾病相关的是肿瘤抑制基因Ras编码的蛋白,它们在软体动物和脊椎动物中均高度保守。通过多环芳烃(Polycyclic aromatic hydrocarbon,PAH)和苯并芘(Benzo[α]pyrene)的攻毒试验,对贻贝中Ras基因进行组织特异性表达分析,显示出Ras以组织特异性方式表达,这表明Ras基因在贻贝肿瘤的形成中起到重要作用。
与海洋生物相比,有关哺乳动物Ras GTPase蛋白亚家族成员的研究主要集中在信号通路和治疗癌症方面。在真核细胞中,Ras是PTKs(Protein tyrosine kinase)介导的信号通路中的一种关键组分。Ras是在所有动物细胞谱系和器官中表达的相关蛋白家族,参与细胞内信号传递(细胞信号转导),并调节多种细胞行为。当Ras被输入信号“接通”时,随后开启其他蛋白,最终打开参与细胞生长、分化和存活的基因。Ras基因中的突变可导致产生永久激活的Ras蛋白。因此,即使在无输入信号的情况下,这也会在小区内引起意外和过度活跃的信号。由于这些信号导致细胞生长和分裂,过度活跃的Ras信号最终会导致癌症[9]。人类中的3个Ras基因(HRas、KRas和NRas)是人类癌症中最常见的癌基因,永久性激活Ras的突变占所有人类肿瘤的20%至25%,在某些类型的癌症(如胰腺癌)中高达90%[42]。因此,Ras抑制剂正在被研究用于作为治疗癌症和Ras过表达的其他疾病中。
2.5 Arf GTPase
Arf(ADP ribosylation factors)GTP结合蛋白是胞内囊泡运输发生的主要调控因子[10]。它们是小GTPase蛋白家族的新兴成员,其相对分子质量约为20 000,主要成员包括Arl1(ADP-ribosylation factor-like protein 1)、Arf1(ADP-ribosylation factor 1)和Sar1B(SAR1 gene homolog B)。
目前有关海洋生物Arf蛋白家族成员的信息尚相对匮乏,仅有Stepicheva等[44]的研究显示,紫球海胆的Arf6(ADP-ribosylation factor 6)蛋白在紫球海胆早期发育中可介导胚胎细胞的形态发生,通过对受精卵注射MASO(Morpholino oligonucleotide),抑制了Arf6蛋白的表达,显示出发育的健康胚胎只有12%,并且具有原肠胚缺陷,而无注射MASO的受精卵,可正常发育,这表明Arf6蛋白可在海胆骨架和肠道的内胚层细胞形成过程中发挥重要作用。
与海洋生物相比,有关哺乳动物Arf家族成员的研究主要集中在医学领域。Davis等[43]的研究显示,在小鼠异种移植模型中,Arf1的过表达对前列腺癌细胞的增殖呈正相关系,前列腺癌中异常的丝分裂激活蛋白激酶信号受到Arf1的控制,与Ras相似,Arf1是前列腺癌发生的重要调节因子,这些数据也提示Arf1可能是前列腺癌治疗和诊断的关键分子靶点。Sané等[45]利用基因敲除技术证实,敲除Sar1A(SAR1 gene homolog A)、Sar1B可以完全消除Caco-2/15细胞(结肠癌Caco-2细胞系)乳糜微粒的分泌。
3 展望
海洋生物小GTPase蛋白作为重要的调控蛋白家族之一,已经受到了人们的广泛关注。近年来,利用高通量测序和生物信息技术大规模挖掘海生生物体内小GTPase蛋白家族成员的工作已经陆续展开,利用生物化学和分子生物的技术手段深入地解析海洋小GTPase蛋白家族成员的结构特点和生物学功能的工作,也逐渐成为水产养殖学和海洋生物学研究的热点。虽然目前关于海洋生物小GTPase蛋白家族成员的研究仍主要停留于基因鉴定、系统进化分析和表达模式检测等方面,对于海洋生物小GTPase蛋白家族成员的生物功能、调控模式和涉及的主要细胞信号通路均没有系统深入的研究,但通过系统地了解海洋生物小GTPase蛋白家族成员的基因序列特征、进化特点和生物学功能,可以进一步加深对海洋生物小GTPase蛋白家族的认识。关于海洋生物小GTPase蛋白仍有许多问题需要进一步的研究和探讨,如小GTPase蛋白家族成员之间在调控海洋生物机体生理生化过程中的相互作用(cross-talking),小GTPase蛋白家族成员在调控海洋生物免疫应答中的作用机制及调控网络,非编码RNA(non-coding RNA)与小GTPase蛋白家族成员之间的互作(interaction)调控关系,以及海洋生物小GTPase蛋白亚家族成员模体(motifs)(如Rac1-RhoA模体)的调控作用,因此,只有不断深入地解析和阐明这一系列问题,才能更加全面和充分地认识海洋生物小GTPase蛋白家族成员的生物学功能及其作用,从而利用海洋生物小GTPase蛋白家族成员提升水产养殖和海洋生物产业发展。
[1] 张冬梅.稻瘟病菌Rab蛋白功能研究[D].福州:福建农林大学,2009.
[2] Seabra M C,Wasmeier C.Controlling the location and activation of Rab GTPases[J].Current Opinion in Cell Biology,2004,16(4):451-457.
[3] Chang E H,Gonda M A,Ellis R W,et al.Human genome contains four genes homologous to transforming genes of Harvey and Kirsten murine sarcoma viruses[J].Proceedings of the National Academy of Sciences of the United States of America,1982,79(16):4848-4852.
[4] Madaule P,Axel R.A novel ras-related gene family[J].Cell,1985,41(1):31-40.
[5] Munemitsu S,Innis M A,Clark R,et al.Molecular cloning and expression of a G25K cDNA,the human homolog of the yeast cell cycle gene CDC42[J].Molecular and Cellular Biology,1990,10(11):5977-5982.
[6] Wennerberg K,Rossman K L,Der C J.The Ras superfamily at a glance[J].Journal of Cell Science,2005,118(Pt 5):843-846.
[7] Bustelo X R,Sauzeau V,Berenjeno I M.GTP-binding proteins of the Rho/Rac family:regulation,effectors and functions in vivo[J].Bio Essays,2007,29(4):356-370.
[8] Stenmark H,Olkkonen V M.The Rab GTPase family[J].Genome Biology,2001,2(5):3007.1-3007.7
[9] Avis J M,Clarke P R.Ran,a GTPase involved in nuclear processes:its regulators and effectors[J].Journal of Cell Science,1996,109(Pt 10):2423-2427.
[10] Goodsell D S.The molecular perspective:the ras oncogene[J].The Oncologist,1999,4(3):263-264.
[11] Donaldson J G,Honda A.Localization and function of Arf family GTPases[J].Biochemical Society Transactions,2005,33(Pt 4):639-642.
[12] Ridley A J.Rho GTPase signalling in cell migration[J].Current Opinion in Cell Biology,2015,36:103-112.
[13] Ridley A J.Anne ridley:networking with Rho GTPases[J].Trends in Cell Biology,2016,26(7):465-466.
[14] Heasman S J,Ridley A J.Mammalian Rho GTPases:new insights into their functions from in vivo studies[J].Nature Reviews Molecular Cell Biology,2008,9(9):690-701.
[15] 孙中雅.靶向肿瘤相关重要蛋白BRD4和RhoA小分子抑制剂的发现及作用机制的研究[D].南昌:南昌大学,2017.
[16] Boureux A,Vignal E,Faure S,et al.Evolution of the Rho family of Ras-Like GTPases in eukaryotes[J].Molecular Biology and Evolution,2007,24(1):203-216.
[17] Li Kaiquan,Liu Lin,Shang Shengnan,et al.cDNA cloning,expression and immune function analysis of a novel Rac1 gene (AjRac1) in the sea cucumber Apostichopus japonicus[J].Fish & Shellfish Immunology,2017,69:218-226.
[18] Cha Guihong,Wang Weina,Peng Ting,et al.A Rac1 GTPase is a critical factor in the immune response of shrimp (Litopenaeus vannamei) to Vibrio alginolyticus infection[J].Developmental & Comparative Immunology,2015,51(2):226-237.
[19] 刘岚萍.大黄鱼Rac、Rab7和Rab5A基因的分子特征与免疫功能的研究[D].厦门:集美大学,2017.
[20] Nohata N,Uchida Y,Stratman A N,et al.Temporal-specific roles of Rac1 during vascular development and retinal angiogenesis[J]. Developmental Biology,2016,411(2):183-194.
[21] Goicoechea S M,Zinn A,Awadia S S,et al.A RhoG-mediated signaling pathway that modulates invadopodiadynamics in breast cancer cells[J].Journal of Cell Science,2017,130(6):1064.
[22] Allaire K M,Watson G M.Rho participates in chemoreceptor-induced changes in morphology to hair bundle mechanoreceptors of the sea anemone,Nematostella vectensis[J].Comparative Biochemistry and Physiology Part A:Molecular & Integrative Physiology,2013,165(2):139-148.
[23] Gray S M,Kelly S,Robles L J.Rho signaling mediates cytoskeletal re-arrangements in octopus photoreceptors[J].American Malacological Bulletin,2008,26(1-2):19-26.
[24] Aguirre-Armenta B,López-Godínez J,Martínez-Cadena G,et al.Rho-kinase in sea urchin eggs and embryos[J].Development,Growth & Differentiation,2011,53(5):704-714.
[25] Li Xue,Wang Ruijia,Xun Xiaogang,et al.The Rho GTPase family genes in bivalvia genomes:sequence,evolution and expression analysis[J].PLoS One,2015,10(12):e0143932.
[26] Muramatsu T,Kozaki K I,Imoto S,et al.The hypusine cascade promotes cancer progression and metastasis through the regulation of RhoA in squamous cell carcinoma[J].Oncogene, 2016,35(40):5304-5316.
[27] Peng Ting,Wang Weina,Gu Meimei,et al.Essential roles of Cdc42 and MAPK in cadmium-induced apoptosis in Litopenaeus vannamei[J]. Aquatic Toxicology,2015,163:89-96.
[28] 李媛,史册,张雪,等.细胞极性相关蛋白CDC42和PAR3在小鼠牙胚发育过程中的表达[J].吉林大学学报(医学版), 2018(1):41-44.
[29] Seabra M C,Mules E H,Hume A N.Rab GTPases,intracellular traffic and disease[J].Trends in Molecular Medicine,2002,8(1):23-30.
[30] Yu E,Kanno E,Choi S,et al.Role of Rab27 in synaptic transmission at the squid giant synapse[J].Proceedings of the National Academy of Sciences of the United States of America,2008,105(41):16003-16008.
[31] Wöllert T,Patel A,Lee Y L,et al.Myosin5a tail associates directly with Rab3A-containing compartments in neurons[J].Journal of Biological Chemistry,2011,286(16):14352-14361.
[32] Wang Lei,Wang Xiaorong,Liu Jin,et al.Rab from the white shrimp Litopenaeus vannamei:characterization and its regulation upon environmental stress[J].Ecotoxicology,2015,24(7-8):1765-1774.
[33] 向赟,吴宇学,王刚,等.不同温度下哈维氏弧菌和白斑综合症病毒对凡纳滨对虾的致病性[J].大连海洋大学学报,2015,30(1):56-61.
[34] Hino H,Arimoto K,Yazawa M,et al.Ran and calcineurin can participate collaboratively in the regulation of spermatogenesis in scallop[J].Marine Biotechnology,2012,14(4):479-490.
[35] Zhou Falin,Zheng Liming,Yang Qibin,et al.Molecular analysis of a Ras-like nuclear (Ran) gene from Penaeus monodon and its expression at the different ovarian stages of development[J].Molecular Biology Reports,2012,39(4):3821-3827.
[36] Zhao Zhe,Jiang Chunxia,Zhang Xiaobo.Effects of immunostimulants targeting Ran GTPase on phagocytosis against virus infection in shrimp[J].Fish & Shellfish Immunology,2011,31(6):1013-1018.
[37] Liu Weifeng,Han Fang,Zhang Xiaobo.Ran GTPase regulates hemocytic phagocytosis of shrimp by interaction with myosin[J].Journal of Proteome Research,2009,8(3):1198-1206.
[38] Fang Hang,Wang Xiaoqing,Yao Cuiluan,et al.Molecular characterization of Ran gene up-regulated in large yellow croaker (Pseudosciaena crocea) immunity[J].Fish & Shellfish Immunology,2010,29(2):327-333.
[39] Jouaux A,Franco A,Heude-Berthelin C,et al.Identification of Ras,Pten and p70S6K homologs in the Pacific oyster Crassostrea gigas and diet control of insulin pathway[J].General and Comparative Endocrinology,2012,176(1):28-38.
[40] Di Yanan,Schroeder D C,Highfield A,et al.Tissue-specific expression of p53 and Ras genes in response to the environmental genotoxicant Benzo(α)pyrene in marine mussels[J].Environmental Science & Technology,2011,45(20):8974-8981.
[41] Di Yanan,Aminot Y,Schroeder D C,et al.Integrated biological responses and tissue-specific expression of p53 and Ras genes in marine mussels following exposure to benzo(α)pyrene and C60 fullerenes,either alone or in combination[J].Mutagenesis,2017,32(1):77-90.
[42] Downward J.Targeting RAS signalling pathways in cancer therapy[J].Nature Reviews Cancer,2003,3(1):11-22.
[43] Davis J E,Xie Xiayang,Guo Jianhui,et al.ARF1 promotes prostate tumorigenesis via targeting oncogenic MAPK signaling[J].Oncotarget,2016,7(26):39834-39845.
[44] Stepicheva N A,Dumas M,Kobi P,et al.The small GTPase Arf6 regulates sea urchin morphogenesis[J].Differentiation,2017,95:31-43.
[45] Sané A T,Seidman E,Peretti N,et al.Understanding chylomicron retention disease through Sar1b GTPase gene disruption:insight from cell culture[J].Arteriosclerosis,Thrombosis,and Vascular Biology,2017,37(12):2243-2251.