菲律宾蛤仔Ruditapes philippinarum是辽宁海域主要的滩涂贝类[1],辽宁省东港市是菲律宾蛤仔的主产地。经实地调研发现,菲律宾蛤仔的流通过程主要由采捕、净化、运输、销售4个环节组成。采捕后的菲律宾蛤仔体内含有大量泥沙,干露运至码头后分别进入工厂净化加工或国内批发销售渠道。规模化净化工厂往往用于出口产品加工,因规范的质量控制措施,其产品质量较高。至于进入国内市场的菲律宾蛤仔原料,大部分经各级销售渠道,最后由终端零售商户负责净化处理,净化操作主要依赖经验,净化效果仅凭含沙与否和存活率[2]来评价,期间风味品质的减损一直未受重视,而具有上乘风味品质的活品对于拓展菲律宾蛤仔的消费市场十分必要。
近年来,有关菲律宾蛤仔活品保藏特性方面的研究主要围绕净化后的环节[3-5],采捕后到净化阶段的研究基本处于空白,本研究团队前期调研发现,该阶段是贝类离水后的品质易逝期(图1),关系到后续活品净化加工与流通过程的品质控制。干露对菲律宾蛤仔的影响主要围绕生长情况[6-7]和呼吸代谢反应[8-9]展开;从食品科学的角度分析,曾出现关于干露对其复水湿藏稳定性影响的研究[10],而针对捕后的干露处置对菲律宾蛤仔活品贮藏特性影响的延迟效应鲜有报道。
菲律宾蛤仔生长于潮间带,天然具有较强的耐干露能力[11];另一方面,菲律宾蛤仔捕后早期干露条件下的处置,对于活品而言,在减少运输贮藏成本、扩大销售范围并延长货架期等多方面具有实际意义。本试验中,通过研究不同干露处理时间对菲律宾蛤仔净化效果及净化后贮藏特性的影响,从核苷酸能荷、存活率和感官等角度进行综合评价,以期探究菲律宾蛤仔采捕后可容忍的干露时间。
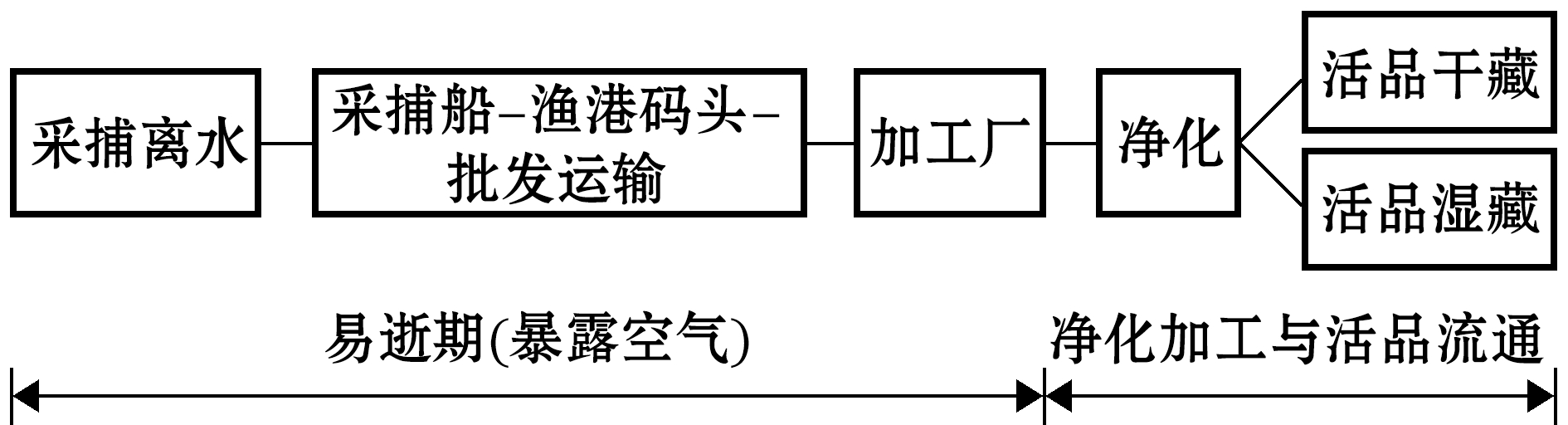
图1 菲律宾蛤仔采捕、运输、加工及活品贮藏流程图
Fig.1 Flow chart from landing, transportation, depuration to live storage in Manila clam Ruditapes philippinarum
1 材料与方法
1.1 材料
试验用菲律宾蛤仔样品于2017年10月采捕自辽宁省丹东市大鹿岛,环境温度为14 ℃,规格为(7.37±1.58)g/枚,壳长为(3.26±0.38)cm,壳宽为(2.13±0.22)cm,壳高为(1.34±0.13)cm。将50 kg蛤仔置于编织袋中,经6 h运至大连海洋大学食品挤压实验室,样品到达时中心温度为12.9 ℃。
试验仪器:Agilent 1260高效液相色谱仪(美国Agilent公司);Shim-pack CLC-ODS色谱柱(6.0 mm×150 mm,5 μm,日本岛津公司);高速冷冻离心机(德国HERMLE Labortechnik GmbH公司);Milli-Q超纯水净化仪(美国Millipore公司);PB-10 pH计(德国Sartorius公司);IMS-40全自动雪花制冰机(常熟市雪科公司);抽真空封口机(宁波市得力公司)。
试验试剂:ATP、ADP、AMP、IMP、HxR、Hx标准品及色谱级甲醇、乙腈(美国Sigma公司);分析纯高氯酸、氢氧化钾、磷酸、磷酸二氢钾、磷酸氢二钾、三乙胺(国药集团化学试剂有限公司)。
2 方法
1.2.1 原料预处理
挑选分组:样品到达实验室后,挑选剔除死贝,将挑选好的菲律宾蛤仔分成6组,每组7 kg,分置于6个网筐中,网筐上下均湿布覆盖。6个处理组分别为湿藏对照组(CW)、干藏对照组(CD)、干露0 d组(E0)、干露1 d组(E1)、干露3 d组(E3)和干露4 d组(E4)。
干露处理:将菲律宾蛤仔上下均覆盖湿布置于4 ℃冷柜中贮藏,E0组、E1组、E3组和E4组分别贮藏0、1、3、4 d。
净化:E0组直接将菲律宾蛤仔分置于2个网筐中,干露组处理结束后分别分置于2个网筐中,均于充氧海水中净化48 h(24 h更换一次海水)。
活品贮藏:各组净化后均分为湿藏组、干藏组,湿藏组置于海水中(室温),每24 h更换海水,干藏组置于4 ℃冷柜中,每24 h更换湿布。
样品保藏条件及处理组编码分别见表1、表2。
1.2.2 样品的采集 干藏和湿藏对照组每天取0.5 kg蛤仔活品用于感官分析,另取0.5 kg菲律宾蛤仔活品去壳去内脏后干冰速冻,并于-40 ℃下保存,用于生化指标分析。干露0、1、3、4 d组在净化后及1~2 d贮藏期内每天取0.5 kg蛤仔活品用于感官分析,在净化后及贮藏1~7 d时,另取0.5 kg菲律宾蛤仔活品去壳去内脏后干冰速冻,于-40 ℃下保存,用于生化指标分析。试验全程在4 ℃条件下进行。
1.2.3 分析测试
存活率:试验期间,每天检查并记录菲律宾蛤仔存活率,参考双壳贝类死亡情况的判断方式[12],轻触菲律宾蛤仔的软组织,若有收缩反应,双壳有闭合趋势,则认为菲律宾蛤仔存活,若无明显变化,则认为其已经死亡。当日存活数占当日总数百分比为日存活率。
表1 活品菲律宾蛤仔原料及保藏条件
Tab.1 Raw Manila clam Ruditapes philippinarum and live storage conditions
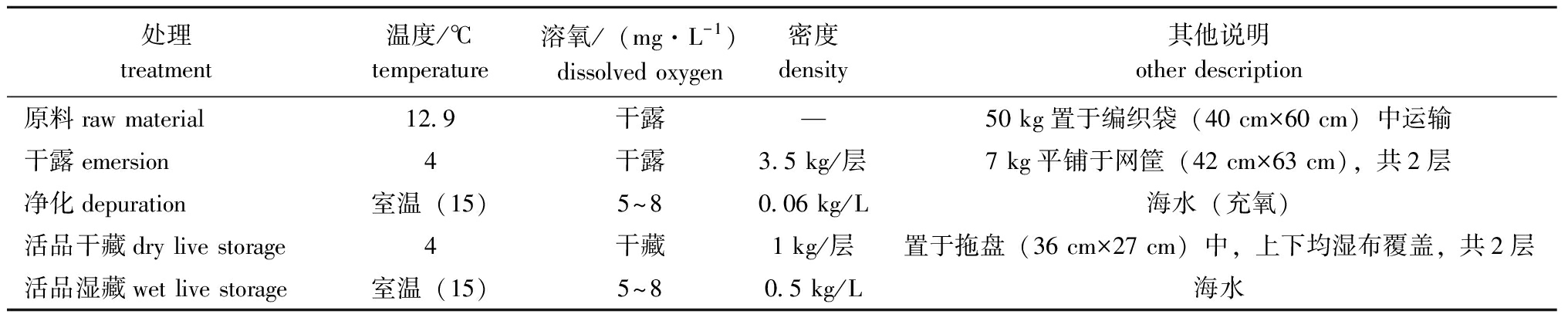
处理treatment温度/℃temperature溶氧/(mg·L-1)dissolved oxygen密度density其他说明other description原料raw material12.9干露—50 kg置于编织袋(40 cm×60 cm)中运输干露emersion4干露3.5 kg/层7 kg平铺于网筐(42 cm×63 cm),共2层净化depuration室温(15)5~80.06 kg/L海水(充氧)活品干藏dry live storage4干藏1 kg/层置于拖盘(36 cm×27 cm)中,上下均湿布覆盖,共2层 活品湿藏wet live storage室温(15)5~80.5 kg/L海水
表2 菲律宾蛤仔活品贮藏处理组编码
Tab.2 Treatment codes of live Manila clam Ruditapes philippinarum storage

处理 treatment编码code分组详细说明 detail description原料 raw materialI—原料湿藏 wet raw storageCWCW1,CW2,CW3,CW4,CW5,CW6,CW7,CW8,CW9原料干藏dry raw storageCDCD1,CD2,CD3,CD4,CD5干露 emersionEE0,E1,E3,E4净化 depurationExdpx-干露时间(d)E0dp,E1dp,E3dp,E4dp活品干藏dry live storageExdyx-干露时间(d);y-贮藏时间(d)E0d1,E0d2,E0d3,E0d4,E0d5,E0d6,E0d7E1d1,E1d2,E1d3,E1d4,E1d5,E1d6,E1d7E3d1,E3d2,E3d3,E3d4,E3d5,E3d6,E3d7E4d1,E4d2,E4d3,E4d4,E4d5,E4d6,E4d7活品湿藏 wet live storageExwyx-干露时间(d);y-贮藏时间(d)E0w1,E0w2,E0w3,E0w4,E0w5,E0w6,E0w7E1w1,E1w2,E1w3,E1w4,E1w5,E1w6,E1w7E3w1,E3w2,E3w3,E3w4,E3w5,E3w6,E3w7E4w1,E4w2,E4w3,E4w4,E4w5,E4w6,E4w7
三磷酸腺苷(ATP)及其关联物:参考Hu等[13]的提取方法,取1.0 g肉糜放入10 mL 5% 高氯酸溶液中,搅拌10 min,以2 mol/L KOH调节pH为2~3.5,定容至20 mL,以3000 g离心5 min,取上清液用0.45 μm滤膜过滤,取4 mL滤液,加入1 mL 0.1 mol/L磷酸缓冲液(pH 7.5),于-40 ℃中贮藏,待分析。试验全程在4 ℃下进行,每个样品做3个平行。
色谱分析:采用高效液相色谱法,检测器为二极管阵列检测器(DAD),检测波长为254 nm,温度为35 ℃;流动相流速为1.5 mL/min,进样量为20 μL;流动相为三乙胺溶液∶乙腈溶液(4.2∶9),用磷酸调整混合液的pH值为5.5。
K值和核苷酸能荷(AEC)值的计算:计算公式分别为
(1)
(2)
其中:ATP为三磷酸腺苷含量;ADP为二磷酸腺苷含量;AMP为磷酸腺苷含量;IMP为肌苷酸含量;HxR为肌苷含量;Hx为次黄嘌呤含量。
感官分析:参考国标[14-15]、Naima等[16] 和Tomic等[17]的方法,通过感官评价小组建立、描述词确定、评价小组能力评估确立菲律宾蛤仔的感官评价体系(表3)。由经过培训的9名感官评价员评价菲律宾蛤仔的风味特点。感官样品清洗后置于真空包装袋中,每袋3只,共9袋,真空包装后沸水煮6 min,冷却至室温提供给评价员,评价员依据感官评价表对样品打分。
表3 活品菲律宾蛤仔感官评价描述词
Tab.3 Sensory descriptors for live Manila clam Ruditapes philippinarum
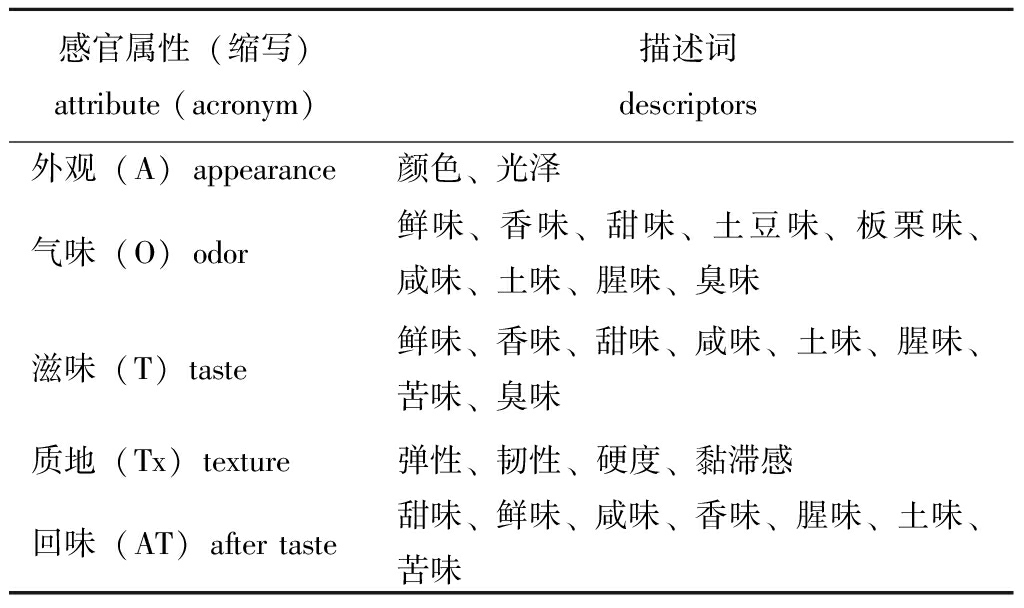
感官属性(缩写)attribute (acronym)描述词 descriptors外观(A)appearance颜色、光泽气味(O)odor鲜味、香味、甜味、土豆味、板栗味、咸味、土味、腥味、臭味滋味(T)taste鲜味、香味、甜味、咸味、土味、腥味、苦味、臭味质地(Tx)texture弹性、韧性、硬度、黏滞感回味(AT)after taste甜味、鲜味、咸味、香味、腥味、土味、苦味
1.3 数据处理
采用Excel 2010和SPSS 17.0软件对理化结果进行统计及单因素方差分析(One-way ANOVA),采用Unscrambler 10.5软件(CAMO)对感官结果进行主成分分析。
2 结果与分析
2.1 干露对活品原料的影响
2.1.1 存活率 不同干露时间下菲律宾蛤仔的存活率如表4所示,经1 d内的干露处理菲律宾蛤仔均有100%的存活率,干露至3 d时还有99%的存活率,干露4 d后仍有92%的存活率,而干露至5 d时存活率急剧下降至33%。从存活率分析来看,菲律宾蛤仔对干露的最大容忍期限为4 d。而湿藏对照组CW在9 d内可一直维持100%的存活率。
表4 干露对菲律宾蛤仔原料存活率的影响
Tab.4 Effects of emersion on survival of raw Manila clam Manila clam Ruditapes philippinarum %
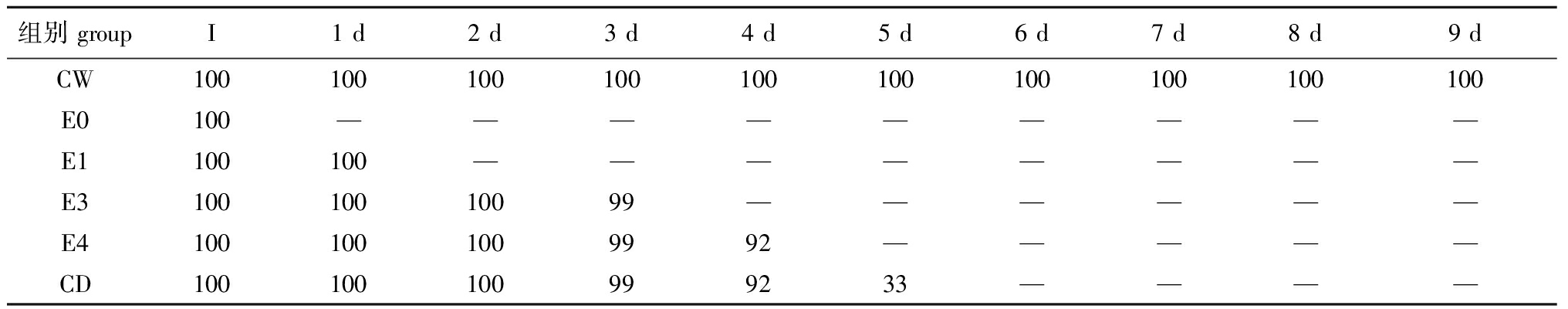
组别 groupI1 d2 d3 d4 d5 d6 d7 d8 d9 dCW100100100100100100100100100100E0100—————————E1100100————————E310010010099——————E41001001009992—————CD100100100999233————
注:I为初始原料,CW为湿藏对照组,E0为干露0 d组,E1为干露1 d组,E3为干露3 d组,E4为干露4 d组,CD为干藏对照组,下同
Notes: I,initial raw material; CW,wet storage control; E0,air expourse for 0 d; E1,air expourse for 1 d; E3,air expourse for 3 d; E4,air expourse for 4 d; CD,dry storage control,et sequential
2.1.2 核苷酸代谢及核苷酸能荷值
(1)ATP含量。ATP及其关联物的含量常用于鱼、贝类的鲜度评价[18]。干露4 d时菲律宾蛤仔仍有92%的存活率,进一步对其在不同干露时间下的能量物质进行分析。从表5可见:干露0 d时 ATP含量较低,为1.21 μmol/g,可能是运输过程中受到胁迫导致[19];干露1、3、4 d后ATP含量分别为1.74、1.68、1.88 μmol/g,且无显著性差异(P>0.05)。与干露0 d相比,干露1、3、4 d后胁迫均可缓解,ATP含量恢复;同时与湿藏对照组CW相比,干露1、3、4 d后菲律宾蛤仔的ATP含量与CW组(1.51~1.96 μmol/g)接近。这表明,采捕后初期的原料受到胁迫,代谢活动减弱,短期的干露静置(4 d内)可以恢复。
表5 干露对菲律宾蛤仔原料ATP含量的影响
Tab.5 Effects of emersion on ATP content of raw Manila clam Ruditapes philippinarum μmol/g

组别group I1 d2 d3 d4 d5 d6 d7 d8 d9 dCW1.21±0.36aA1.88±0.30aA1.61±0.19aA1.84±0.34aA1.96±0.15aA1.51±0.15A1.82±0.28A1.63±0.21A1.97±0.16A1.62±0.29AE01.21±0.36a—————————E11.21±0.36aA1.74±0.09aA————————E31.21±0.36aA1.74±0.09aA1.83±0.33aA1.68±0.50aA——————E41.21±0.36aA1.74±0.09aA1.83±0.33aA1.68±0.50aA1.88±0.31aA—————CD1.21±0.36aA1.74±0.09aA1.83±0.33aA1.68±0.50aA1.88±0.31aA1.94±0.28A————
注:同列中标有不同小写字母者表示组间有显著性差异(P<0.05),同行中标有不同大写字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同
Note:The means with different letters within the same column are significantly different in the groups at the 0.05 probability level.The means with different capital letters within the same line are significantly different in the groups at the 0.05 probability level, and the means with the same letters are not significant differences, sequentia
(2)AEC值。AEC值被普遍认为适用于贝类的评价[20],当75%<AEC<90%时,水产品处于最优生长、繁殖条件;当50%<AEC<75%时,水产品缓慢生长,不能繁殖,此状态可以恢复;而当AEC<50%时,水产品不能生长繁殖,已经死亡。从表6可见:初始原料I的 AEC值较低,为69.90%,与运输过程中受到胁迫有关;干露1 d、3 d、4 d后AEC值恢复,分别为75.48%、72.15%和78.10%,且无显著性差异(P>0.05),AEC值均与湿藏对照组CW(71.18%~81.77%)接近。这进一步证明,短期干露静置可缓解采捕运输过程中的胁迫,可恢复至与常规湿藏相同的水平。
(3)K值。K值是用来评价水产品鲜度的常用指标[21]。不同干露时间下菲律宾蛤仔原料的K值如表7所示,干露0、1、3、4 d后的K值均在5%以下,且无显著性差异(P>0.05),且与CW组一致。这表明,此时菲律宾蛤仔新鲜,但K值并未反映出初始原料I与经过干露后的菲律宾蛤仔间的差异,K值在本研究中的适用性有待考量。
综上,菲律宾蛤仔干露0、1 d后均具有100%的存活率,干露3、4 d后仍可保持90%以上的存活率;从能量角度来看,干露0 d的原料I由于受到运输过程中的胁迫,能量有所损失,但干露1、3、4 d后均可恢复至与常规湿藏相同的水平。不同干露处理对随后加工净化及活品贮藏的影响需要进一步考察。
2.2 干露对净化效果的影响
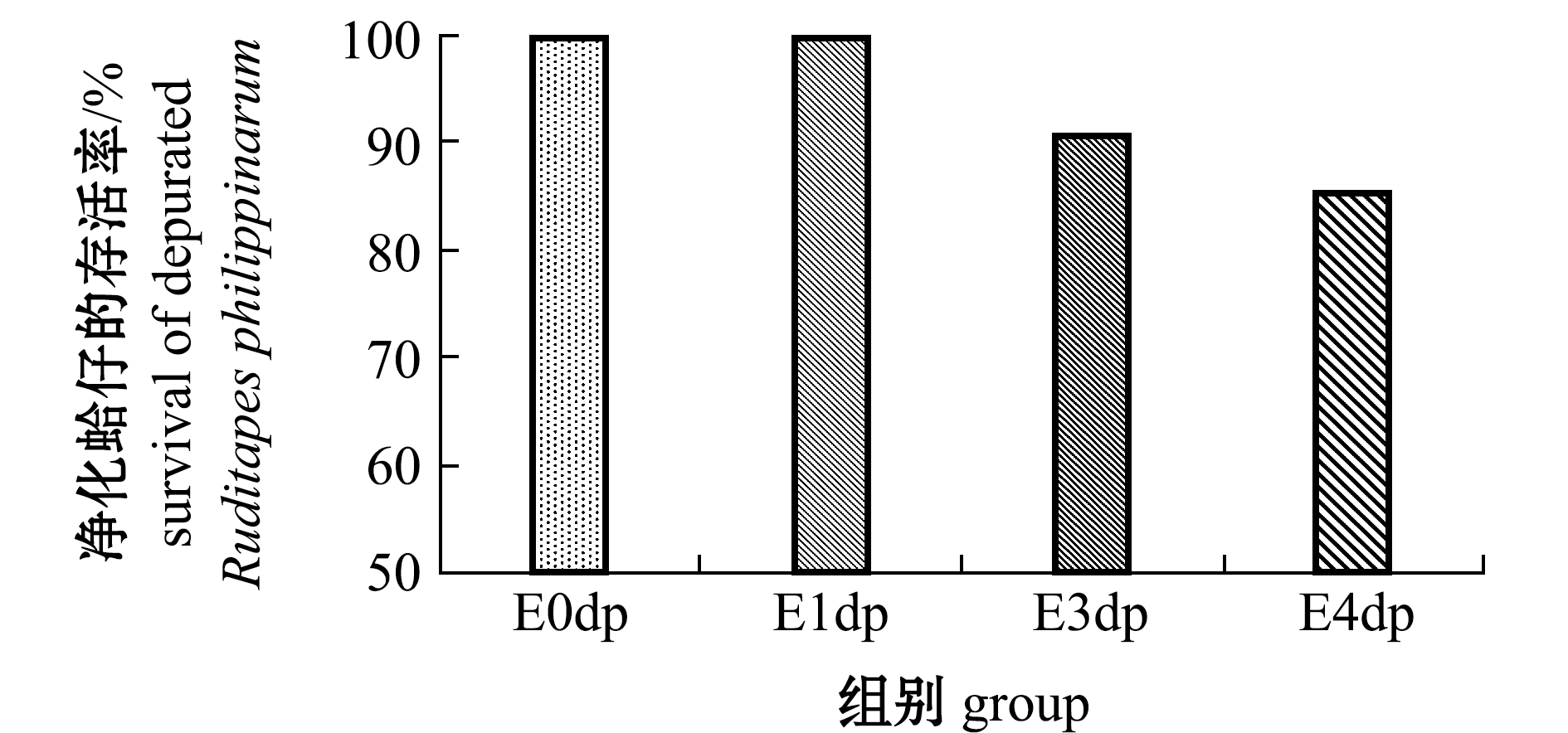
2.2.1 存活率 干露处置对48 h净化效果的影响如图2所示,E0dp、E1dp组菲律宾蛤仔的存活率均为100%,E3dp组为91%,E4dp则为85%。总体上,相比E0组,干露时间越长,净化后的菲律宾蛤仔存活率越低。干露处理≤3 d时可保持90%以上的净化存活率。
表6 干露对菲律宾蛤仔原料AEC值的影响
Tab.6 Effects of emersion on AEC value of raw Manila clam Ruditapes philippinarum %

组别group I1 d2 d3 d4 d5 d6 d7 d8 d9 dCW69.90±1.36aC81.77±2.66aA77.23±2.64aABC76.72±1.80aABC79.80±0.75aAB71.18±3.09BC75.49±4.49ABC72.37±2.77BC79.08±1.42AB79.23±2.89ABE069.90±1.36a—————————E169.90±1.36a75.48±0.80b————————E369.90±1.36aA75.48±0.80bA72.95±1.55aA72.15±7.24aA——————E469.90±1.36aA75.48±0.80bA72.95±1.55aA72.15±7.24aA78.10±0.73aA—————CD69.90±1.36aA75.48±0.8bA72.95±1.55aA72.15±7.24aA78.10±0.73aA80.33±3.00A————
表7 干露对菲律宾蛤仔原料K值的影响
Tab.7 Effects of emersion on K value of raw Manila clam Ruditapes philippinarum %

组别group I1 d2 d3 d4 d5 d6 d7 d8 d9 dCW3.89±2.20aA2.83±0.10aA3.04±0.40aA2.39±0.70aA2.18±0.40aA1.85±1.16A2.35±0.84A2.49±0.95 A1.33±0.39 A2.25±0.81 AE03.89±2.20a—————————E13.89±2.20a1.90±0.30a————————E33.89±2.20aA1.90±0.30aA2.17±0.00bA2.33±0.90aA——————E43.89±2.20aA1.90±0.30aA2.17±0.00bA2.33±0.90aA2.85±0.30aA—————CD3.89±2.20aA1.90±0.30aA2.17±0.00bA2.33±0.90aA2.85±0.30aA4.31±1.46A————
注:样品编码见表2,下同
Note:Sample codes were detailed in Table 2, et sequentia
图2 干露对净化后菲律宾蛤仔存活率的影响
Fig.2 Effects of emersion on survival of depurated Manila clam Ruditapes philippinarum
2.2.2 核苷酸代谢及核苷酸能荷值
(1)ATP含量。不同干露时间下的菲律宾蛤仔净化后ATP含量的变化如图3所示,净化后,E0dp 组菲律宾蛤仔ATP含量为1.61 μmol/g,E1dp、E3dp、E4dp组ATP含量分别为1.57、1.46、1.39 μmol/g,净化后的ATP含量随干露时间的延长而降低。
与净化前的原料相比:净化前原料I ATP含量为1.21 μmol/g,净化后E0dp组ATP含量升至1.61 μmol/g ;净化前其余干露组原料CD1、CD3和CD4的ATP含量分别为1.74、1.68、1.88 μmol/g(表5),净化后E1dp、E3dp、E4dp组ATP含量均有所降低,表明净化过程是一个能量消耗过程。E0dp组ATP含量上升,可能是初始时刻的蛤仔在运输过程中受到胁迫导致原料I的ATP含量过低,从湿藏对照组CW1的ATP含量为1.88 μmol/g可知,净化中ATP含量恢复,但净化本身会造成能量的消耗,所以净化结束时ATP含量为1.61 μmol/g,即净化过程对该组蛤仔既是恢复又是能量消耗过程,净化后ATP含量上升是二者共同作用的结果。有关捕后虾夷扇贝Patinopecten yessoensis在低温(1.0 ℃±0.5 ℃)下干露不同时间(0、12、24 h)后复水湿藏的研究也发现,虾夷扇贝在复水湿藏后ATP含量呈现恢复趋势[22]。原料CD1、CD3和CD4的ATP含量未有明显差别,均在1.70 μmol/g左右,而E1dp、E3dp、E4dp组的 ATP含量依次降低,说明虽然4 d内的干露处理对蛤子原料的ATP含量未有明显影响,但是干露时间的延长会导致后期净化过程ATP消耗更快。
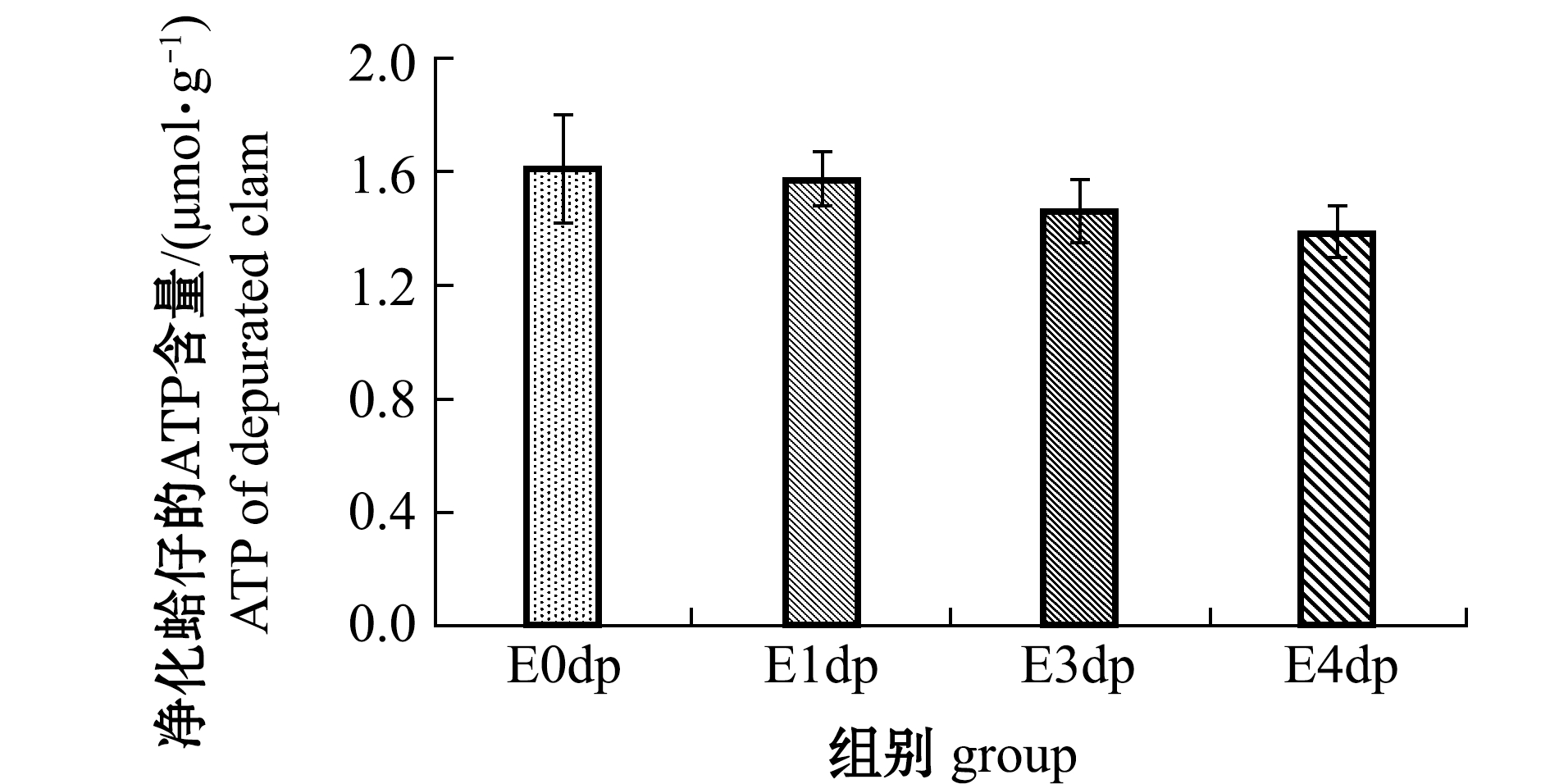
图3 干露对净化后菲律宾蛤仔ATP含量的影响
Fig.3 Effects of emersion on ATP level of depurated Manila clam Ruditapes philippinarum
(2)AEC值。干露处理对净化后AEC值的影响如图4所示,E0dp、E1dp、E3dp、E4dp组的AEC值无明显差别,均维持为71%~79%。与原料I(AEC值为69.90%)相比,E0dp组的AEC值升高,表明净化后E0组菲律宾蛤仔受到的胁迫得到缓解,其余各组净化后与原料CD1、CD3和CD4的AEC值差别不大。
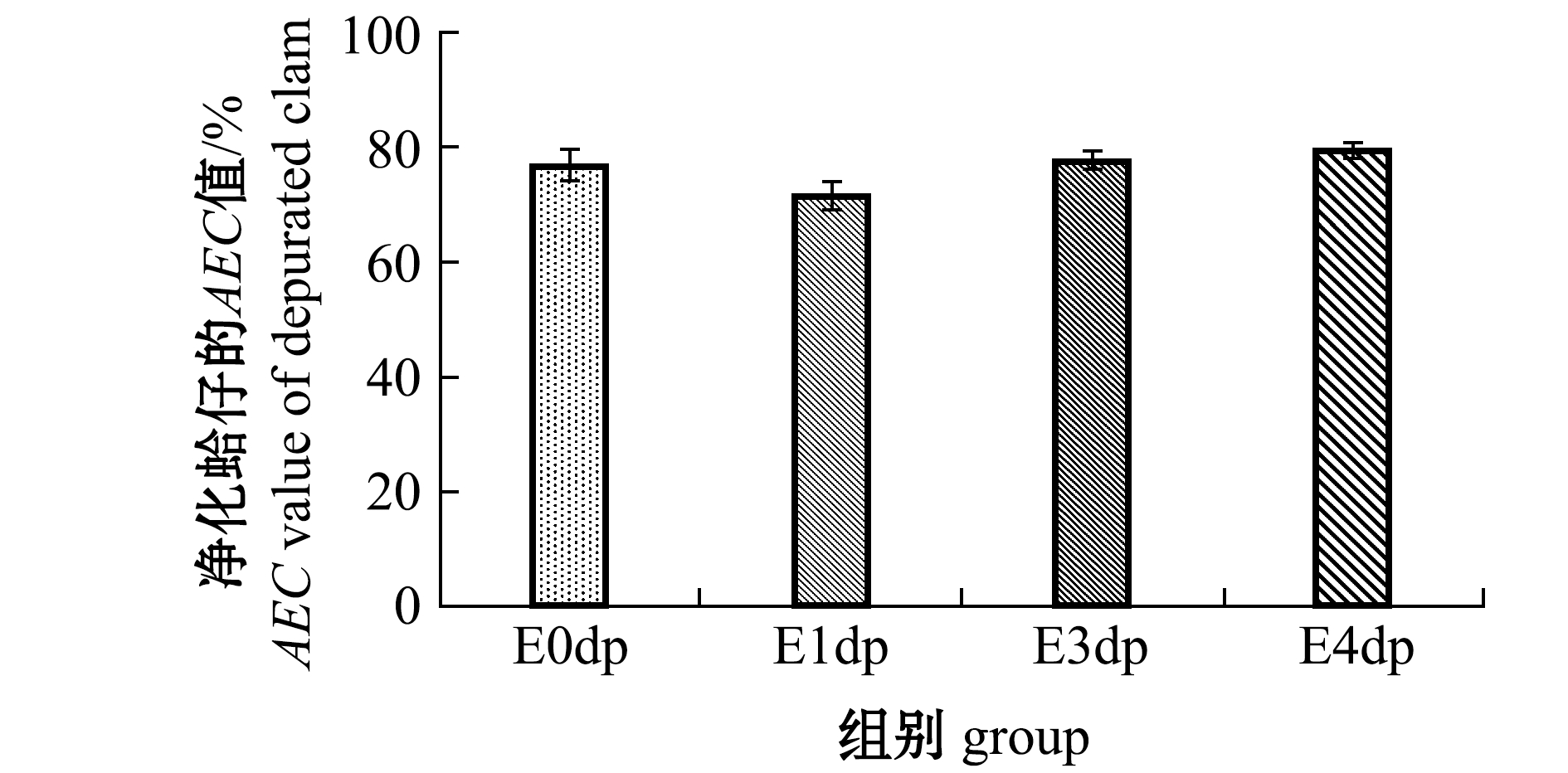
图4 干露对净化后菲律宾蛤仔AEC值的影响
Fig.4 Effects of emersion on AEC value of depurated Manila clam Ruditapes philippinarum
(3)K值。干露处理对净化后K值的影响如图5所示,E0dp、E1dp、E3dp组的K值均维持在3%左右,E4dp的 K值显著升高至18%(P<0.05),而原料CD1、CD2、CD3、CD4的K值均低于5%,反映出3 d内的干露处理仍可保持净化后菲律宾蛤仔新鲜。
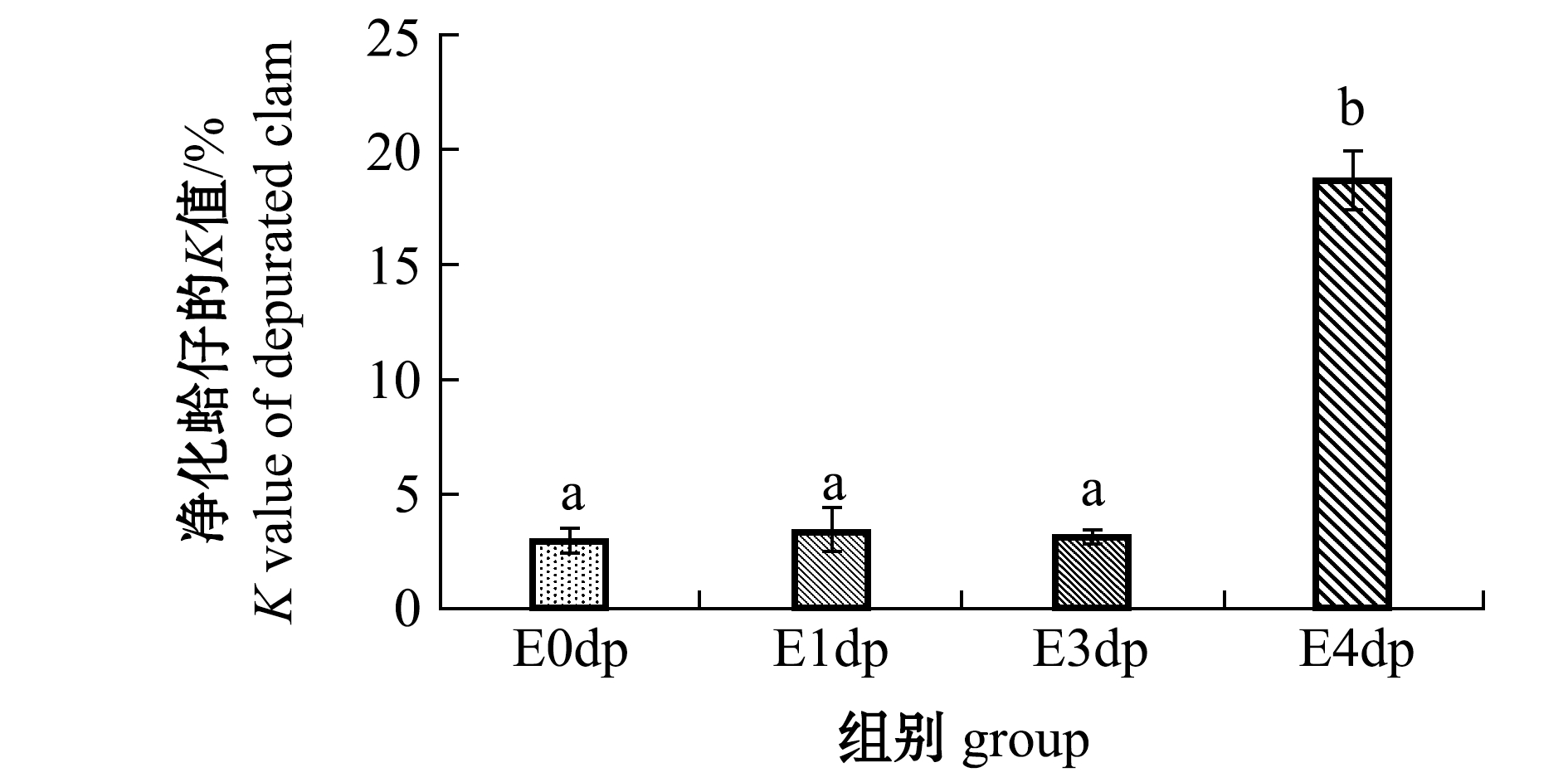
注:标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05)
Note:The means with different letters are significantly different in the groups at the 0.05 probability level, and the means with the same letters are not significant differences
图5 干露对净化后菲律宾蛤仔K值的影响
Fig.5 Effects of emersion on K value of depurated Manila clam Ruditapes philippinarum
2.3 干露对净化后活品贮藏的影响
2.3.1 日存活率 贮藏过程中菲律宾蛤仔的日存活率变化如图6所示,贮藏过程中,干露组E0、E1、E3的日存活率未有明显差别,干藏、湿藏组均可维持在85%以上,而E4组的日存活率呈现下降趋势,湿藏组更加明显,贮藏第7 天时降至50%,干藏组存活率虽低于其他预处理组,但可维持80%以上存活。由于取样过程会造成菲律宾蛤仔非自然死亡,因此,以每日存活数占当日菲律宾蛤仔总数的百分比统计的日存活率表示贮藏结果,可反映不同处理组间的差异。通过实际观察,E4w组的存活率下降迅速,至贮藏7 d后实际存活率几乎为0,E3w组可维持70%以上的实际存活率,E1w组和E0w组可保持90%以上的实际存活率。而干藏条件下的E0、E1组同样具有90%以上的存活率,E3、E4组则可维持80%以上的存活率。随着干露处理时间的延长,菲律宾蛤仔在贮藏过程中存活率下降,3 d内的干露处理可维持7 d贮藏期内70%以上的存活率。有研究指出,牡蛎Crassostrea madrasensis在冰藏48 h期间复水,在后续8 d的贮藏期内可保持存活率90%以上[23]。
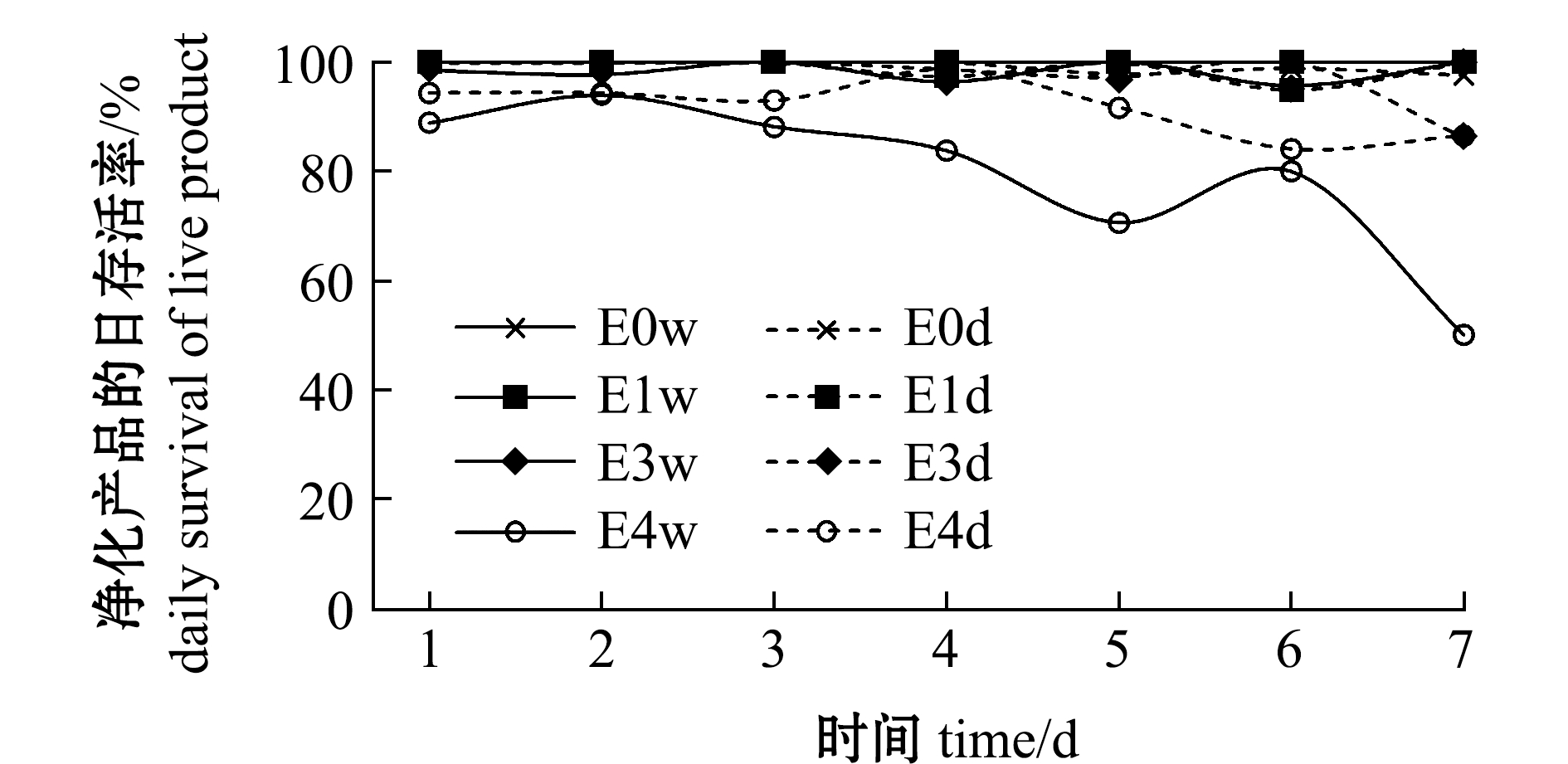
图6 干露对菲律宾蛤仔贮藏过程中日存活率的影响
Fig.6 Effects of emersion on daily survival of live products during storage
2.3.2 核苷酸代谢及核苷酸能荷值
(1)ATP含量。贮藏过程中ATP含量的变化如图7所示,除E4w组外,其余各处理组ATP含量均为1~2 μmol/g,E4w组ATP含量在1 μmol/g以下。从ATP含量变化来看,E4w组的菲律宾蛤仔状态明显下降,3 d以内干露处理后的菲律宾蛤仔贮藏特性较好。
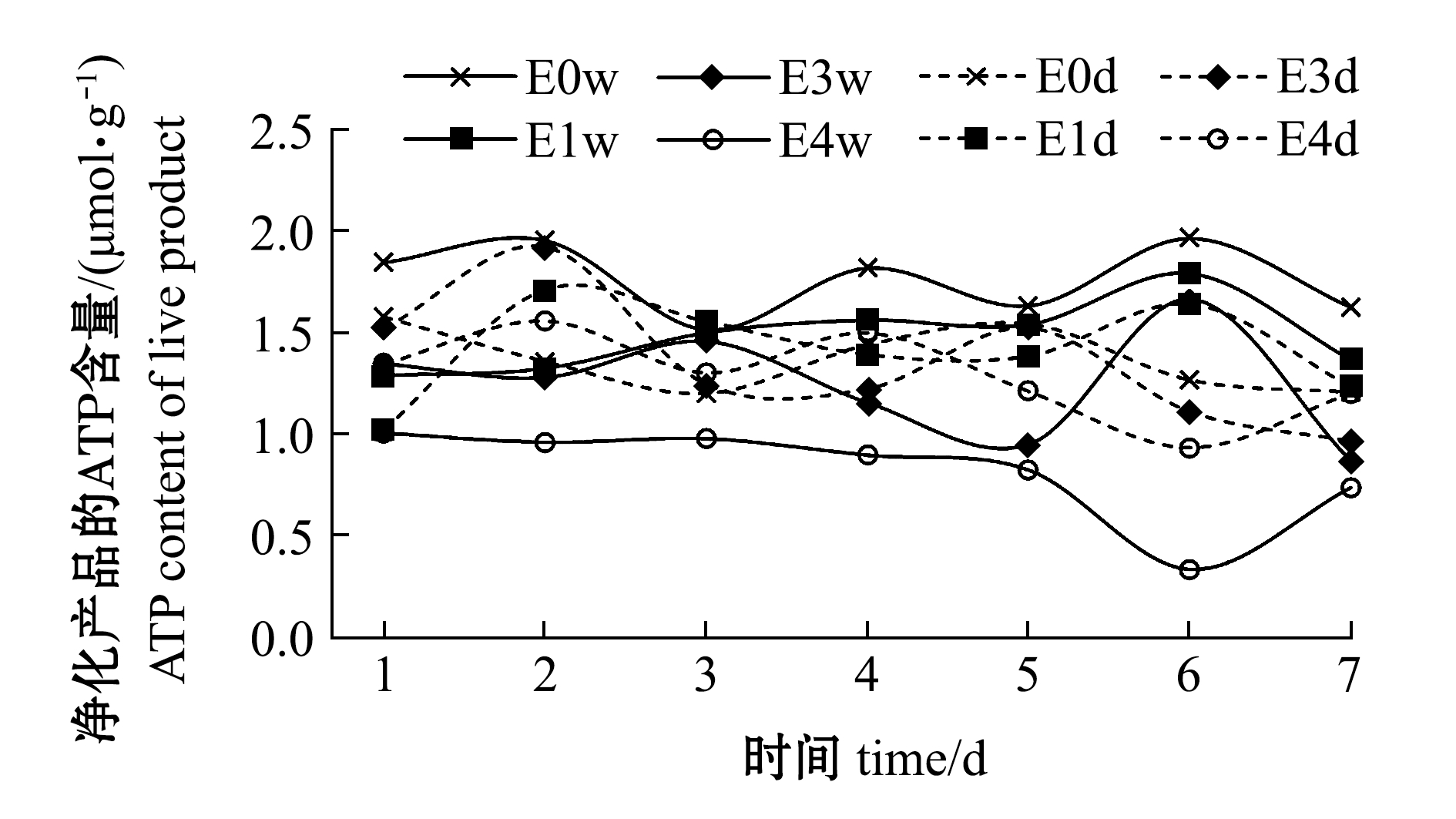
图7 干露对贮藏过程中菲律宾蛤仔ATP含量的影响
Fig.7 Effects of emersion on ATP content of live products during storage
(2)AEC值。贮藏过程中AEC值的变化如图8所示,E4w组的AEC值在贮藏过程中明显低于其他各组,且呈现下降趋势,其余组均维持相同平稳水平。
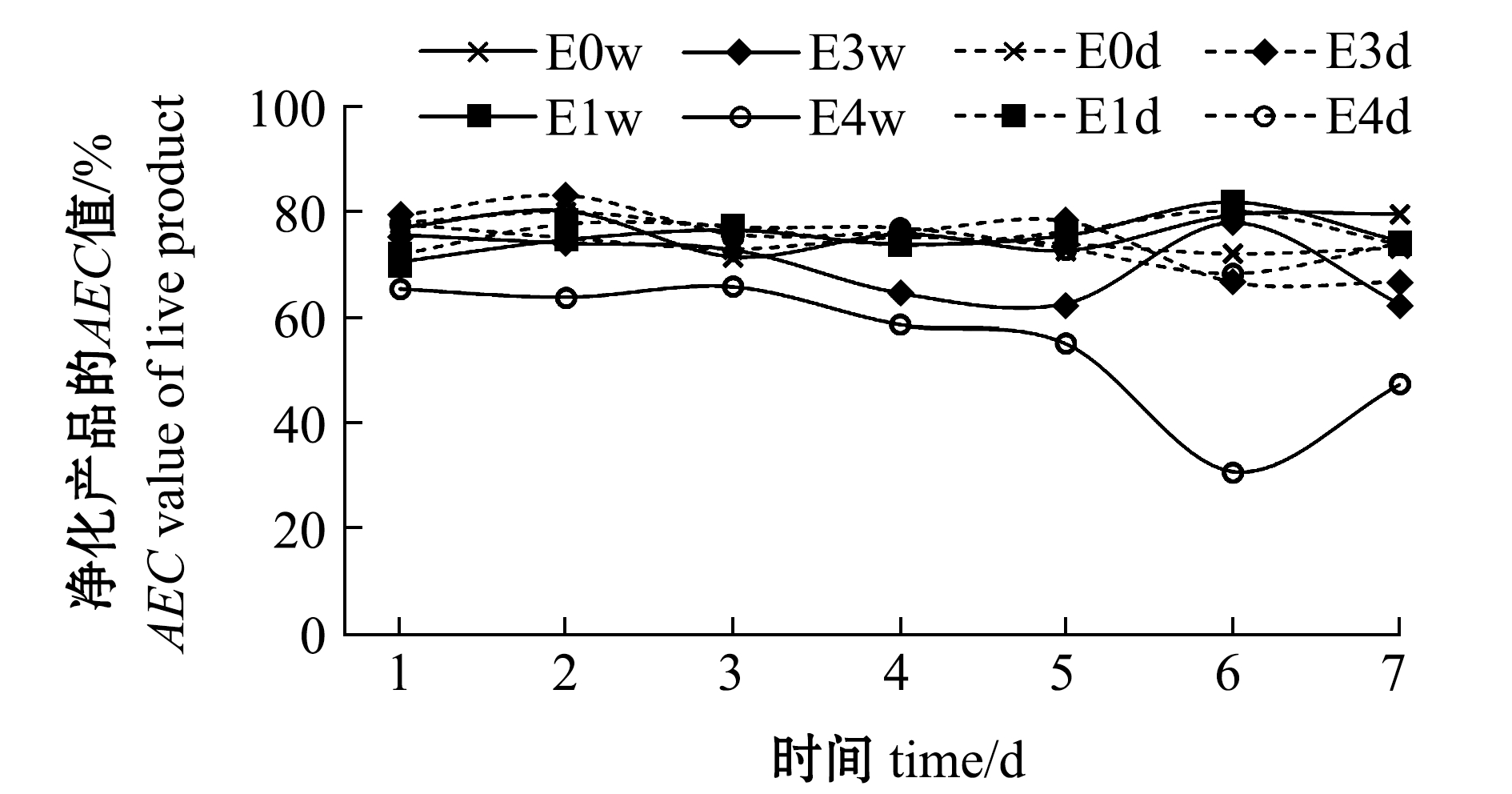
图8 干露对贮藏过程中菲律宾蛤仔AEC值的影响
Fig.8 Effects of emersion on AEC value of live products during storage
(3)K值。贮藏过程中K值的变化如图9所示,E0、E1组的K值与E3、E4(E3w组除外)组出现了明显差别,E0、E1组K值为1%~5%,而E3、E4组为10%~21%。统计分析显示,贮藏过程中E3d、E4w、E4d组的K值均显著高于E0w、E0d、E1w、E1d组(P<0.05)。由于干露后期菲律宾蛤仔已出现腥臭味,可能K值能更明显地反映该条件下菲律宾蛤仔的贮藏特性,适用于长期贮藏的评价。总体上,干露3 d以内菲律宾蛤仔贮藏性较好,E4组贮藏性较差。
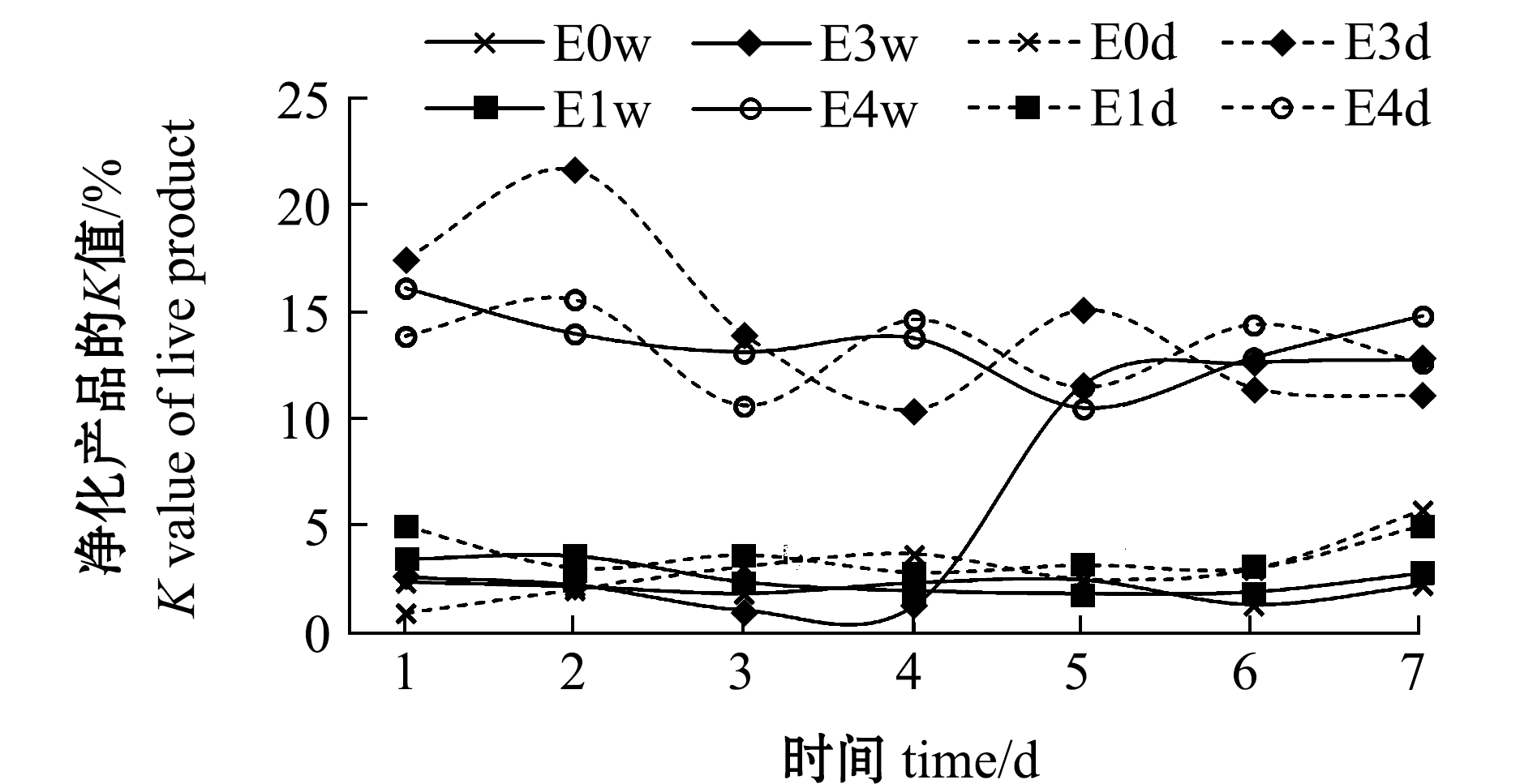
图9 干露对贮藏过程中菲律宾蛤仔K值的影响
Fig.9 Effects of emersion on K value of live products during storage
2.4 风味变化
2.4.1 干露前后原料风味的变化 感官评价是评价水产品品质最重要的方法之一[24],系统的感官评价体系已应用于活品虾夷扇贝[25]、鲍鱼Haliotis laevigata、Haliotis rubra[26]、海胆Chinoidea chloroticus[27]等的品质评价。当前对菲律宾蛤仔的评价多通过含沙量和存活率,本研究在探究菲律宾蛤仔的存活率、ATP及其关联物含量的基础上,系统地跟踪了不同干露处理的菲律宾蛤仔从原料到贮藏阶段的风味品质变化。
首先,对净化前的几组蛤仔进行感官评价。从图10可见:初始原料的风味以非愉悦性特征为主,主要体现为土味、腥味和苦味;在随后的干露静止期间,原料风味发生了恢复迹象,前3天(CD1、CD2、CD3)逐渐呈现出咸、鲜、甜和香等愉悦性味觉与嗅觉特征;长时间干露则导致风味下降,如图CD4已明显区别于干露前3 d的样品,此时风味特征以非愉悦性臭味为主。虾夷扇贝风味品质变化的研究中也发现了相同情况[28]。由此可见,采捕及捕后初期是原料风味品质的易逝期,急性胁迫导致贝类风味急骤下降。本研究中,即便经过短期干露静置,原料风味也可恢复,由此可再次推断贝类易逝期品质控制的重要性。
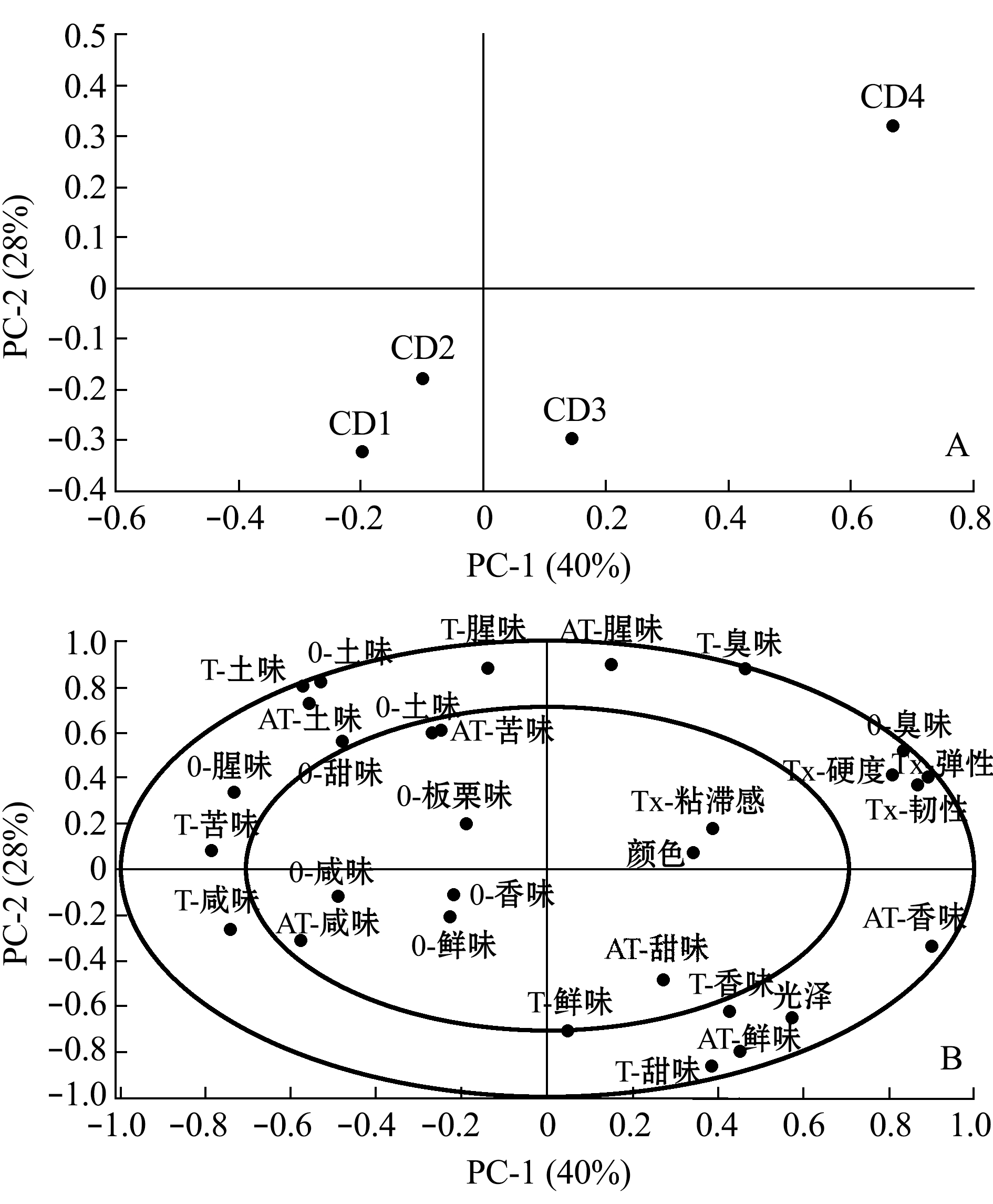
注:A为得分图,表示单个样品的总体分值(样品编码见表2);B为载荷量图,表示蛤仔样品的感官属性差异(字母缩写见表3),下同
Note:A,score plot, showing total scores of single sample(sample codes are detailed in Table 2); B, loading plot, showing differences in sensory attribute of samples(letter acronyms are detailed in Table 3), et sequentia
图10 干露对菲律宾蛤仔原料风味的影响
Fig.10 Effects of emersion on flavor of raw Manila clam Ruditapes philippinarum
2.4.2 干露时间对净化蛤仔风味的影响 菲律宾蛤仔的食用形式应为净化后的产品。首先分析干露时间对净化蛤仔风味的影响。感官评价的主成分分析结果如图11所示,主成分1的贡献率为67%,主成分2的贡献率为20%,二者累计贡献率达87%,可以代表蛤仔的感官风味特征。其中,E0dp、E1dp组的特征风味为鲜、香味和甜等愉悦性描述词,E3dp组以泥土味和腥味为特征,E4dp则明显突出了臭味。上述结果表明,2 d内干露处理的蛤仔具有良好的风味品质,3 d开始出现非愉悦性特征,从而导致菲律宾蛤仔净化后品质下降,干露4 d处理后的菲律宾蛤仔已失去食用价值。
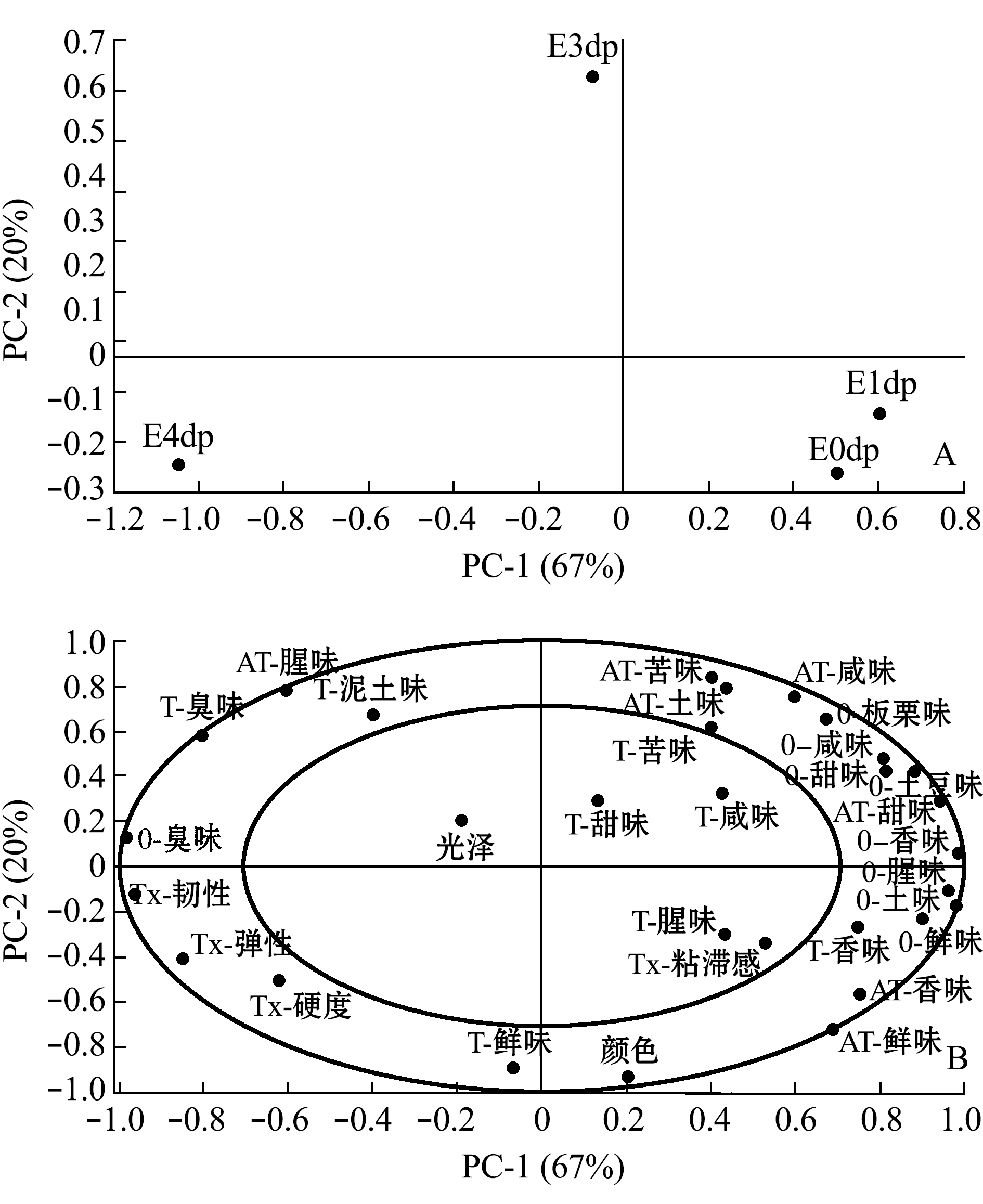
图11 干露对净化后菲律宾蛤仔风味的影响
Fig.11 Effects of emersion on sensory of depurated Manila clam Ruditapes philippinarum
2.4.3 净化产品保活过程中风味的变化 为保证感官评价的安全性,仅对贮藏早期(前2 d)的菲律宾蛤仔进行了风味品质评价。湿藏过程中菲律宾蛤仔风味变化如图12所示,主成分1的贡献率为80%,主成分2的贡献率为6%,二者累计贡献率达86%,可反映样品的主要信息。如“2.4.2节”所述,干露4 d后净化的菲律宾蛤仔已经突出了臭味。在后期的贮藏过程中,E4w组在贮藏早期呈现明显的臭味;而其余湿藏组E0w、E1w、E3w在2 d活品贮藏过程中仍保持鲜味、香味、甜味等愉悦性气味。
干藏过程中菲律宾蛤仔风味变化如图13所示,主成分1和主成分2的累计贡献率为59%,对样品信息的概括性一般。同E4w组,E4d组在贮藏早期也突出了臭味,此外,E3d组在贮藏2 d时突出了非愉悦性特征腥臭味。而E0d、E1d组在贮藏2 d内依然保持鲜味、香味和甜味等愉悦性气味。
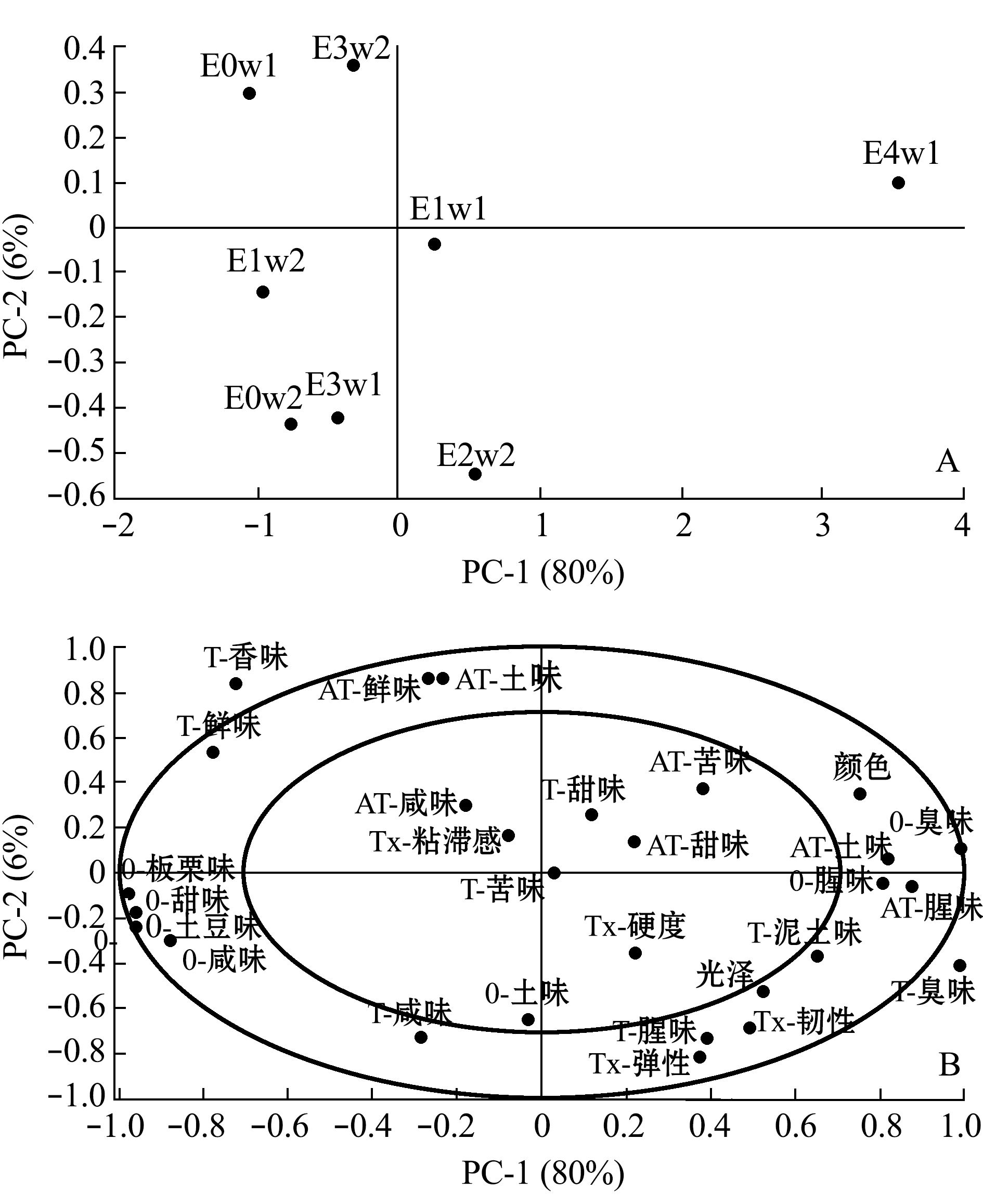
图12 干露对菲律宾蛤仔湿藏过程中风味的影响
Fig.12 Effects of emersion on sensory of live products during wet storage
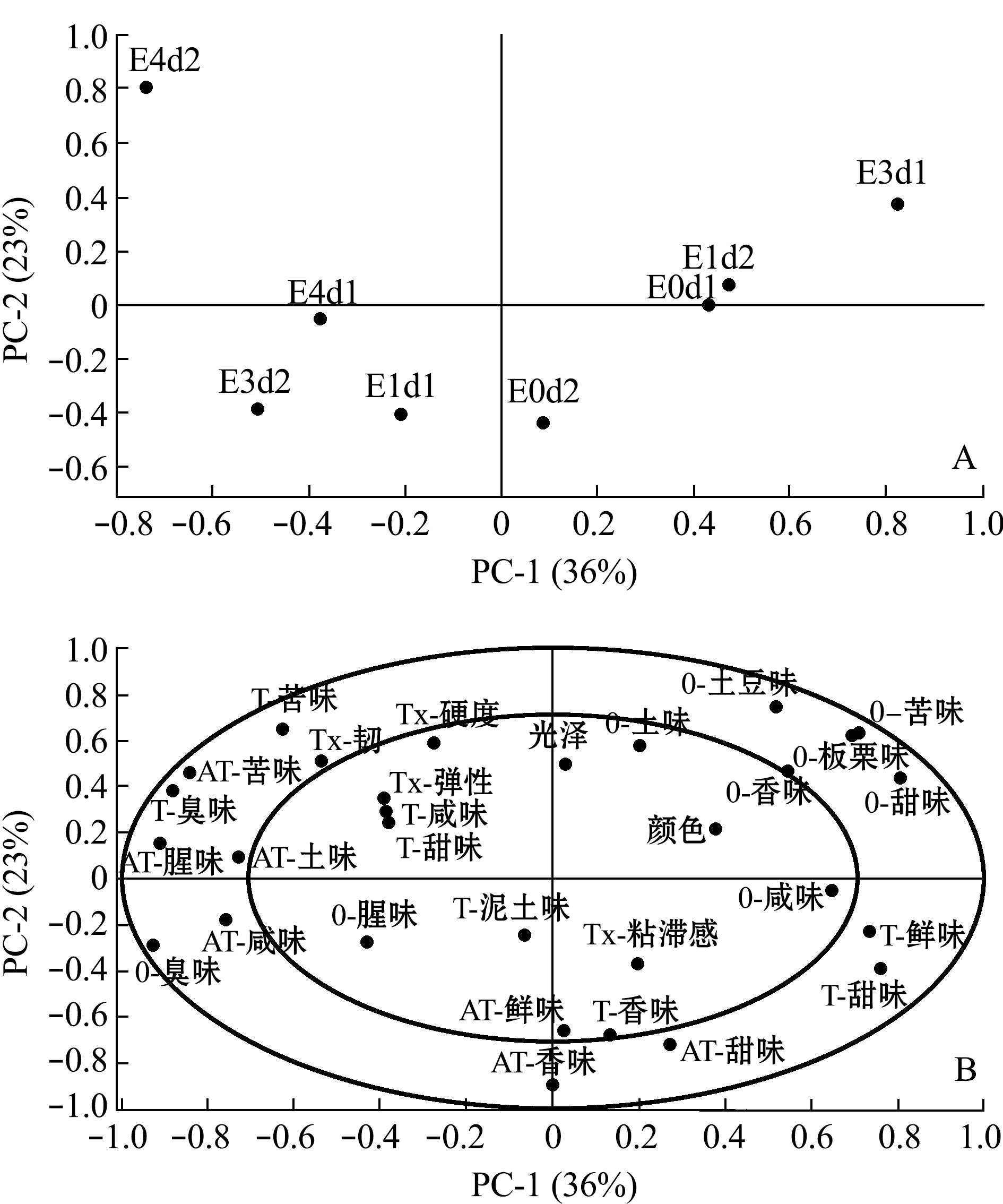
图13 干露对菲律宾蛤仔干藏过程中风味的影响
Fig.13 Effects of emersion on sensory of live products during dry storage
综上,从风味变化来看,随着干露时间的延长,贮藏过程中菲律宾蛤仔风味品质下降,3 d内的干露处理在湿藏前2 d仍以愉悦性特征为主,干露延长至4 d时,菲律宾蛤仔突出臭味,无法食用。1 d内的干露处理在干藏前2 d以愉悦性特征为主,干露3 d后干藏,菲律宾蛤仔即会突出腥臭味,干露4 d仍然突出臭味。
3 结论
(1)从采捕起至加工净化是菲律宾蛤仔风味品质的易逝期,急性胁迫导致风味急剧下降,短期的干露静置(3 d内)使其生化指标及风味品质均呈现恢复。
(2)易逝期处置对随后的加工净化及活品贮藏特性有重要的延迟效应,经过2 d以内的冷却干露预处理,菲律宾蛤仔仍具有较好的净化及贮藏特性。
(3)3 d的干露会导致净化后菲律宾蛤仔品质下降,经过4 d干露的菲律宾蛤仔贮藏性明显下降,失去食用价值。因此,易逝期菲律宾蛤仔的耐干露期限为4 ℃冷却条件下2 d,且无论是干藏还是湿藏均具有7 d的活品货架期。
[1] 张国范,闫喜武.蛤仔养殖学[M].北京:科学出版社,2010.
[2] Anacleto P,Maulvault A L,Barrento S,et al.Physiological responses to depuration and transport of native and exotic clams at different temperatures[J].Aquaculture,2013,408-409:136-146.
[3] Anacleto P,Maulvault A L,Chaguri M,et al.Microbiological responses to depuration and transport of native and exotic clams at optimal and stressful temperatures[J].Food Microbiology,2013,36(2):365-373.
[4] 刘慧慧,刘俊荣,田元勇,等.菲律宾蛤仔的干湿藏保活特性初探[J].水产科学,2017,36(3):267-273.
[5] Gonçalves A,Pedro S,Duarte A,et al.Effect of enriched oxygen atmosphere storage on the quality of live clams (Ruditapes decussatus)[J].International Journal of Food Science & Technology,2009,44(12):2598-2605.
[6] Numaguchi K.SHORT COMMUNICATION Preliminary experiments on the influence of water temperature,salinity and air exposure on the mortality of Manila clam larvae[J].Aquaculture International,1998,6(1):77-81.
[7] 杨凤,谭文明,闫喜武,等.干露及淡水浸泡对菲律宾蛤仔稚贝生长和存活的影响[J].水产科学,2012,31(3):143-146.
[8] Ali F,Nakamura K.Metabolic characteristics of the Japanese clam Ruditapes philippinarum (Adams & Reeve) during aerial exposure[J].Aquaculture Research,2000,31(2):157-165.
[9] Ali F,Nakamura K,Yamasaki S.Physiological characteristics of aerial survival in Japanese clam,Ruditapes philippinarum (Adams & Reeve)[J].Suisanzoshoku,1999,47(3):381-389.
[10] 刘慧慧,周晏琳,张晴,等.菲律宾蛤仔捕后干露处置对其复水湿藏稳定性的影响[J].大连海洋大学学报,2018,33(2):244-250.
[11] Yin Xuwang,Chen Peng,Chen Hai,et al.Physiological performance of the intertidal Manila clam (Ruditapes philippinarum) to long-term daily rhythms of air exposure[J].Scientific Reports,2017,7:41648.
[12] Chen Shanqiao,Zhang Chunhua,Xiong Yuefeng,et al.A GC-MS-based metabolomics investigation on scallop (Chlamys farreri) during semi-anhydrous living-preservation[J].Innovative Food Science & Emerging Technologies,2015,31:185-195.
[13] Hu Yaqin,Zhang Jiaqi,Ebitani K,et al.Development of simplified method for extracting ATP-related compounds from fish meat[J].Nippon Suisan Gakkaishi,2013,79(2):219-225.
[14] 中国农业科学院质量标准与检测技术研究所,农业部蔬菜水果质量监督检验测试中心(广州).GB/T 16291.1—2012 感官分析选拔、培训与管理评价员一般导则 第1部分:优选评价员[S].北京:中国标准出版社,2012.
[15] 中国标准化与信息分类编码研究所.GB/T 16861—1997 感官分析 通过多元分析方法鉴定和选择用于建立感官剖面的描述词[S].北京:中国标准出版社,1998.
[16] Naima H A,Mehdi S,Morched C H.Training and control of performance of a tactile sensory panel[J].Journal of Applied Sciences,2013,13(3):366-376.
[17] Tomic O,Luciano G,Nilsen A,et al.Analysing sensory panel performance in a proficiency test using the Panel Check software[J].European Food Research and Technology,2010,230(3):497-511.
[18] Hong Hui,Regenstein J M,Luo Yongkang.The importance of ATP-related compounds for the freshness and flavor of post-mortem fish and shellfish muscle:a review[J].Critical Reviews in Food Science and Nutrition,2017,57(9):1787-1798.
[19] 刘金洋,刘俊荣,田元勇,等.捕后处置对活品底播虾夷扇贝生化代谢的影响[J].水产学报,2017,41(1):81-87.
[20] Atkinson D E.Energy charge of the adenylate pool as a regulatory parameter.Interaction with feedback modifiers[J].Biochemistry,1968,7(11):4030-4034.
[21] Ehira S,Uchiyama H.Determination of fish freshness using the K Value and comments on some other biochemical changes in relation to freshness[C]//Kramer D E,Liston J.Seafood Quality Determination:Proceedings of an International Symposium Coordinated by the University of Alaska Sea Grant College Program,Anchorage,Alaska.Amsterdam,The Netherlands:Elsevier,1987.
[22] 刘金洋.虾夷扇贝在活品流通过程中的代谢变化[D].大连:大连海洋大学,2016.
[23] Chinnadurai S,Kripa V,Venkatesan V,et al.Effect of low temperature on the survival of edible oyster Crassostrea madrasensis during transportation and storage[J].Journal of the Marine Biological Association of India,2013,55(2):83-86.
[24] Hyldig G,Green-Petersen D M B.Quality index method—an objective tool for determination of sensory quality[J].Journal of Aquatic Food Product Technology,2005,13(4):71-80.
[25] 杨婷婷,刘俊荣,俞微微,等.活品流通过程中虾夷扇贝风味品质的变化[J].水产学报,2015,39(1):136-146.
[26] Cochet M,Brown M,Kube P,et al.Sensory and physicochemical assessment of wild and aquacultured green and black lip abalone (Haliotis laevigata and Haliotis rubra)[J].Journal of Shellfish Research,2013,32(1):81-88.
[27] Phillips K,Hamid N,Silcock P,et al.Effect of season on the sensory quality of sea urchin (Evechinus chloroticus) Roe[J].Journal of Food Science,2010,75(1):S20-S30.
[28] 杨婷婷.采捕后活品虾夷扇贝(Patinopecten yessoensis)的风味变化[D].大连:大连海洋大学,2014.