牛磺酸又称牛胆碱、牛胆素,化学名为2-氨基乙磺酸,是一种以游离的形式存在于动物体各组织细胞中含量丰富的小分子β型含硫氨基酸[1-3],在动物体内具有重要的营养作用和生理功能,如促进动物生长[4],在肝脏中生成胆汁酸促进脂类营养物质的代谢[5-7],维持钙离子调节稳态和细胞内外渗透压平衡[1],调节鱼类的免疫能力与抗氧化能力[8],保证动物机体中枢神经系统与视网膜的正常发育[9-10]等。虽然牛磺酸不直接参与蛋白质代谢,但在高脂饲料水平下缺乏牛磺酸会导致仓鼠Mesocricetus auratus[11]、大鼠Rattus norvegicus[12-13]机体抗氧化能力降低,肝脏发生脂肪性病变等,添加牛磺酸可明显提高动物机体抗氧化能力并缓解肝脏脂肪化程度[14]。牛磺酸还可使日本鳗鲡Anguilla japonica的生殖细胞不受氧化应激的影响[15],提高军曹鱼Rachycentron canadum消化酶活力[16],影响牙鲆Paralichthys olivaceus结合胆汁酸合成[17]。
鱼粉是水产动物饲料中蛋白质的主要原料,其具有蛋白质含量高且与水产动物所需的氨基酸比例最接近等优点,使其成为水产动物优质的蛋白源,也是牛磺酸含量最丰富的饲料原料。由于资源减少和价格上升,饲料中鱼粉用量已逐渐降低。植物蛋白源虽可成为鱼粉的替代蛋白源,但植物蛋白中几乎不存在牛磺酸[3],从而会导致饲料中牛磺酸含量降低。研究表明,饲料中缺乏牛磺酸会抑制虹鳟Oncorhynchus mykiss[18]、军曹鱼的生长[6,19],导致真鲷Pagrosomus major出现绿肝[20]、鰤鱼Seriolaquin queradiata发生贫血[21]。而饲料中添加适量的牛磺酸可明显促进牙鲆[22]、大菱鲆Scophthalmus maximus[7]和真鲷[23]的生长。
红鳍东方鲀Takifugu rubripes隶属于鲀形目Telraodontiformes、鲀科Teraodontoidae、东方鲀属Takifugu,是一种底栖肉食性近海鱼类。其味道鲜美,肉质含有丰富的蛋白质,是河鲀鱼中经济价值较高的一个种类[24-25]。研究表明,饲料中添加牛磺酸能促进红鳍东方鲀幼鱼生长,提高幼鱼的增重率、特定生长率、饲料效率和摄食率,且在添加量为1.0%时各项生长指标最好,随着牛磺酸添加量的增加,红鳍东方鲀幼鱼生长呈现先上升后下降的趋势(已另文发表)。本试验中,以红鳍东方鲀作为研究对象,通过在低鱼粉饲料中添加不同水平的牛磺酸,研究了牛磺酸对红鳍东方鲀肝脏免疫酶和抗氧化能力及肠道消化酶等指标的影响,以期为红鳍东方鲀低鱼粉饲料中选择适宜的饲料添加剂提供理论依据。
1 材料与方法
1.1 材料
试验用红鳍东方鲀幼鱼购自大连天正实业有限公司。鱼粉(蛋白质含量为65%)购自大连龙源鱼粉股份有限公司,豆粕(蛋白质含量为40%)购自上海克源实业有限公司,小麦粉(蛋白质含量为18%)、玉米蛋白粉、磷虾粉、啤酒酵母、α-淀粉、羧甲基纤维素、大豆卵磷脂、鱼油、螺旋藻、甜菜碱、胆碱均购自大连新市场公司。酪蛋白、牛磺酸和甘氨酸购自河南华阳生物科技有限公司。
以酪蛋白和鱼粉作为蛋白质源,以鱼油和大豆卵磷脂作为脂肪源,配制牛磺酸水平分别为0(T1,对照)、0.5%(T2)、1.0%(T3)、2.0%(T4)和5.0%(T5)的5种等能量低鱼粉试验饲料,用甘氨酸调平饲料中的含氮量。具体配方及营养成分见表1,原料过60目筛,所有原料按照配方混合均匀后制成直径为4 mm的软颗粒饲料,在-20 ℃下保存备用。
1.2 方法
1.2.1 试验设计及饲养管理 将试验鱼暂养2周,暂养期间投喂T1组基础饲料以适应实验室养殖条件。试验设置5个处理组,每个处理设3个平行,共用15个200 L的方形聚乙烯水槽,所有水槽位置随机分配。正式试验开始前,停食24 h,随机挑选大小均匀、体格健壮且体表无伤、初始体质量为(32.28±0.20)g的红鳍东方鲀幼鱼225尾,随机分配到15个水槽中,每个水槽15尾幼鱼。
养殖试验共进行56 d,每天8:00和17:00投喂保存于冰箱中(4 ℃)提前分装好的饲料,至表观饱食,9:30和18:30换水,换水量为总水体的2/3,每天早上投喂前吸底清理粪便。24 h连续充气,7:00~19:00日光灯照明,保持试验环境光暗条件为12 D∶12 L。试验期间及时捞出死亡鱼并记录体质量,每天通过YSI多参数水质测量仪(购自上海捷辰仪器有限公司)测定水体温度,并控制水温在23.0~24.5 ℃,溶解氧浓度大于6 mg/L,pH值为7.3~7.8。
1.2.2 样品采集 试验结束后,停止投喂24 h后采集样品。
体表黏液的采集:将红鳍东方鲀放于解剖盘上,用蒸馏水冲洗体表,再用消毒脱脂棉球在鱼体表面反复刮取黏液至棉球完全湿润,将沾满红鳍东方鲀体表黏液的棉球放于提前准备好的5 mL离心管中,4 ℃下保存,将离心管于4 ℃下以4000 r/min离心10 min,取上清液,转移至超低温冰箱(-80 ℃)中保存待测。
组织样品的采集:将采集完体表黏液的试验鱼于冰袋上解剖,取出内脏,分离出肝脏和中肠,将样品于液氮中速冻,然后转移至超低温冰箱(-80 ℃)中保存,以测定肝脏组织免疫酶、抗氧化酶和肠道消化酶活力。
1.2.3 指标测定 肝脏组织免疫酶测定指标包括酸性磷酸酶(ACP)和碱性磷酸酶(AKP);肝脏抗氧化酶测定指标包括谷胱甘肽过氧化物酶(GSH-PX)、丙二醛(MDA)、总抗氧化能力(T-AOC)、总超氧化物歧化酶(SOD)和过氧化氢酶(CAT);肠道消化酶测定指标包括蛋白酶和脂肪酶(LPS);体表黏液溶菌酶。上述指标均采用南京建成生物工程研究所试剂盒进行测定。
1.3 数据处理
试验数据以平均值±标准差(mean±S.D.)表示。用SPSS 21.0软件对试验数据进行单因素方差分析(One-way ANOVA),若差异显著时,则用Tukey法进行组间多重比较,显著性水平设为0.05。
表1 试验饲料组成[26](干物质基础)
Tab.1 Ingredient and approximate composition of the experimental diets[26] (dry matter basis) w/%
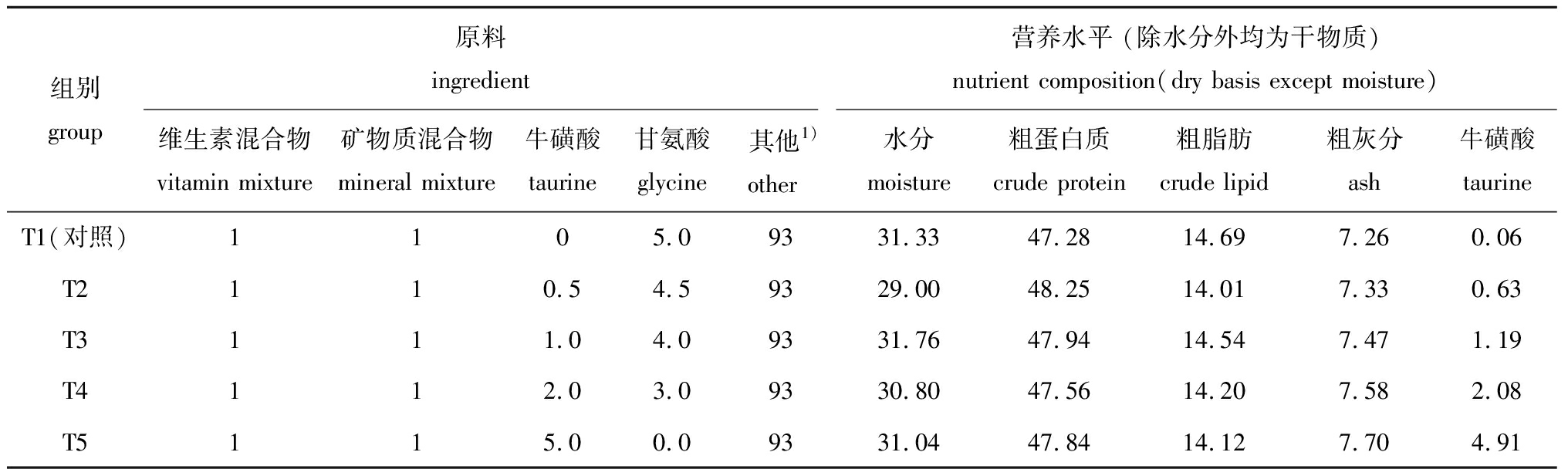
组别group原料ingredient维生素混合物vitamin mixture矿物质混合物mineral mixture牛磺酸taurine甘氨酸glycine 其他1)other营养水平 (除水分外均为干物质)nutrient composition(dry basis except moisture)水分moisture粗蛋白质crude protein粗脂肪crude lipid粗灰分ash牛磺酸taurineT1(对照)1105.09331.3347.2814.697.260.06T2110.54.59329.0048.2514.017.330.63T3111.04.09331.7647.9414.547.471.19T4112.03.09330.8047.5614.207.582.08T5115.00.09331.0447.8414.127.704.91
注:1)其他原料包含鱼粉15%、磷虾粉5%、豆粕10%、小麦粉9%、玉米蛋白粉10%、酪蛋白20%、啤酒酵母2%、α-淀粉8%、羧甲基纤维素2.4%、大豆卵磷脂5%、鱼油5%、螺旋藻1%、甜菜碱0.3%、胆碱0.3%。2)维生素混合物为每千克预混料提供维生素A 1 000 000 IU、维生素D3 300 000 IU、维生素E 4000 IU、维生素K3 1000 mg、维生素B1 2000 mg、维生素B2 1500 mg、维生素B6 1000 mg、维生素B12 5 mg、烟酸 1000 mg、维生素C 5000 mg、泛酸钙 5000 mg、叶酸 100 mg、肌醇 10 000 mg、载体葡萄糖及水≤10%。3)矿物质混合物为每千克预混料提供氯化钠 2.69 g、七水硫酸镁 9.50 g、二水磷酸氢钠 6.05 g、磷酸二氢钾 16.63 g、二水磷酸钙 9.42 g、柠檬酸铁 2.06 g、乳酸钙 22.68 g、氢氧化铝 0.01 g、七水硫酸锌 0.25 g、硫酸铜 0.01 g、七水硫酸锰 0.06 g、碘酸钙 0.01 g、水和硫酸钴 0.07 g
Note:1)Other ingredients:15% fishmeal, 5% krill meal, 10% soyabean, 9% flour, 10% corn gluten meal, 20% casein, 2% beer yeast, 8% α-starch, 2.4% CMC, 5% soybean lecithin, 5% fish oil, 1% spirulina, 0.3% betaine, and 0.3% choline.2)Vitamin mixture (per kilogram of premix):1 000 000 IU vitamin A, 300 000 IU vitamin D3, 4000 IU vitamin E, 1000 mg vitamin K3,2000 mg vitamin B1, 1500 mg vitamin B2, 1000 mg vitamin B6, 5 mg vitamin B12, 1000 mg nicotinic acid, 5000 mg vitamin C,5000 mg Ca-pantothenate, 100 mg folic acid, 10 000 mg inositol, carrier glucose and H2O ≤ 10%.3)Mineral mixture (per kilogram of premix):2.69 g NaCl, 9.50 g MgSO4·7H2O, 6.05 g NaHPO4·2H2O,16.63 g KH2PO4, 9.42 g Ca (H2PO4)2·2H2O, 2.06 g Fe citrate, 22.68 g Ca lactate, 0.01 g Al(OH)3,0.25 g ZnSO4·7H2O, 0.01 g CuSO4, 0.06 g MnSO4·7H2O, 0.01 g Ca(IO3)2, and 0.07 g CoSO4·H2O
2 结果与分析
2.1 饲料中添加不同水平牛磺酸对红鳍东方鲀肝脏抗氧化酶及AKP、ACP活力的影响
从表2可见:饲料中添加不同水平的牛磺酸对红鳍东方鲀肝脏T-AOC、SOD、CAT、GSH-PX和MDA均有显著性影响(P<0.05);与对照组(T1)相比,T3和T4组的SOD和CAT活力显著升高(P<0.05),且在T3组达到峰值;T3、T4组 T-AOC活力显著高于对照组、T2组(P<0.05),且在T4组达到峰值;T3组的GSH-PX活力显著高于对照组、T4、T5组(P<0.05);添加牛磺酸的各组MDA含量显著低于对照组(P<0.05)。
表2 不同水平牛磺酸对红鳍东方鲀肝脏抗氧化酶活力的影响
Tab.2 Effects of different taurine levels on activities of antioxidanat enzymes in liver of redfin puffer Takifugu rubripes
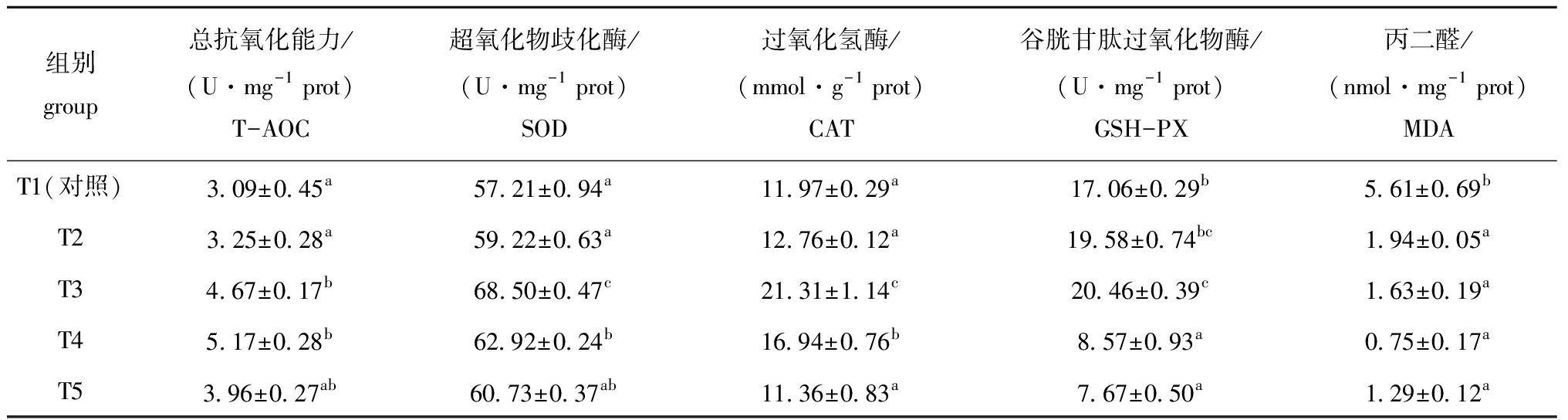
组别group总抗氧化能力/(U·mg-1 prot)T-AOC超氧化物歧化酶/(U·mg-1 prot)SOD过氧化氢酶/(mmol·g-1 prot)CAT谷胱甘肽过氧化物酶/(U·mg-1 prot)GSH-PX丙二醛/(nmol·mg-1 prot)MDAT1(对照)3.09±0.45a57.21±0.94a11.97±0.29a17.06±0.29b5.61±0.69bT23.25±0.28a59.22±0.63a12.76±0.12a19.58±0.74bc1.94±0.05aT34.67±0.17b68.50±0.47c21.31±1.14c20.46±0.39c1.63±0.19aT45.17±0.28b62.92±0.24b16.94±0.76b8.57±0.93a0.75±0.17aT53.96±0.27ab60.73±0.37ab11.36±0.83a7.67±0.50a1.29±0.12a
注:同列中标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同
Note:The means with different letters within the same column are significant differences at the 0.05 probability level, and the means with the same letters within the same column are not significant differences, et sequentia
从表3可见,饲料中添加不同水平的牛磺酸对红鳍东方鲀肝脏ACP活力无显著性影响(P>0.05),但AKP活力随饲料中牛磺酸含量的增加呈先升高后下降的趋势,并在T3组达到最大值且显著高于其他各组(P<0.05)。
表3 饲料中添加不同水平牛磺酸对红鳍东方鲀肝脏AKP和ACP活力的影响
Tab.3 Effects of different taurine levels on activities of AKP and ACP in liver of redfin puffer Takifugu rubripes
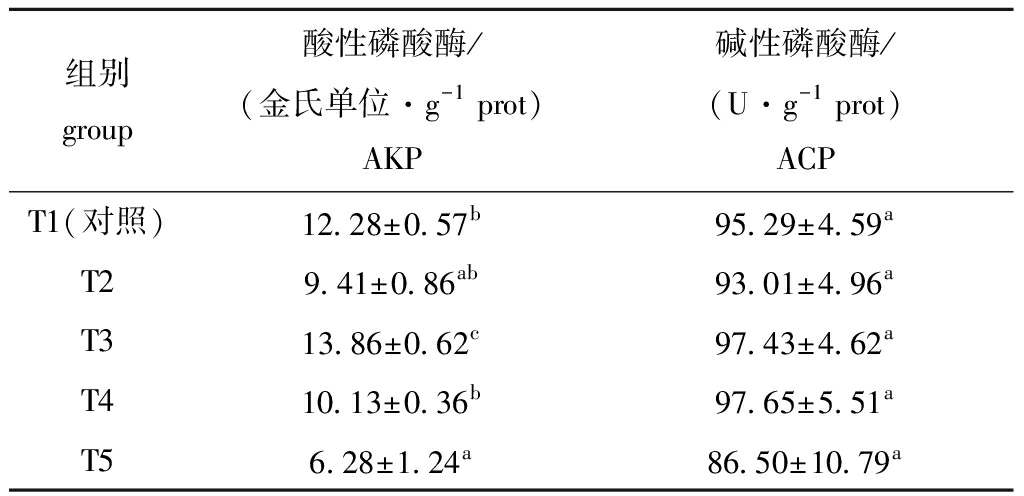
组别group酸性磷酸酶/(金氏单位·g-1 prot)AKP碱性磷酸酶/(U·g-1 prot)ACPT1(对照)12.28±0.57b95.29±4.59aT29.41±0.86ab93.01±4.96aT313.86±0.62c97.43±4.62aT410.13±0.36b97.65±5.51aT56.28±1.24a86.50±10.79a
2.2 饲料中添加不同水平牛磺酸对红鳍东方鲀肠道消化酶活力的影响
从表4可见:随着饲料中牛磺酸含量的增加,红鳍东方鲀肠道酶活力呈先升高后降低的趋势; T4组LPS活力最高且显著高于其他组(P<0.05),其他组间无显著性差异(P>0.05);牛磺酸的添加量对蛋白酶活力无显著影响(P>0.05)。
表4 饲料中添加不同水平牛磺酸对红鳍东方鲀肠道消化酶活力的影响
Tab.4 Effects of different taurine levels on activities of digestive enzymes in intestine of redfin puffer Takifugu rubripes
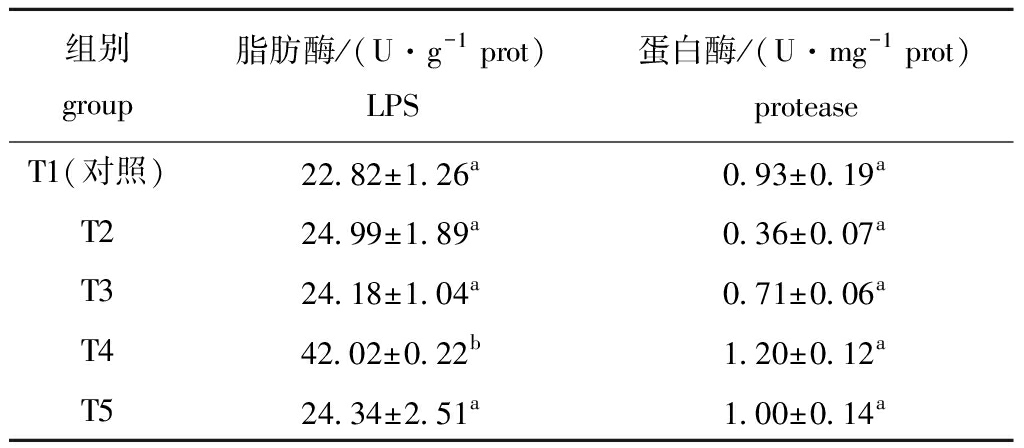
组别group脂肪酶/(U·g-1 prot)LPS蛋白酶/(U·mg-1 prot)proteaseT1(对照)22.82±1.26a0.93±0.19aT224.99±1.89a0.36±0.07aT324.18±1.04a0.71±0.06aT442.02±0.22b1.20±0.12aT524.34±2.51a1.00±0.14a
2.3 饲料中添加不同水平牛磺酸对红鳍东方鲀体表黏液溶菌酶活力的影响
从图1可见:投喂添加不同水平牛磺酸的饲料对红鳍东方鲀体表黏液的溶菌酶有显著性影响(P<0.05);对照组溶菌酶活力最低,T4组酶活力最高,T3、T4和T5组酶活力显著高于对照组(P<0.05)。
2.4 根据回归模型分析低鱼粉饲料中适宜的牛磺酸添加量
采用折线模型回归分析饲料中牛磺酸水平与红鳍东方鲀T-AOC、LPS和溶菌酶间的关系,结果如图2~图4所示。从回归方程求得,当饲料中牛磺酸水平为1.79 g/100 g(干饲料)时,红鳍东方鲀幼鱼肝脏T-AOC活力达到最大值(图2);饲料中牛磺酸水平为2.21 g/100 g(干饲料)时,红鳍东方鲀幼鱼肠道LSP活力达到最大值(图3);饲料中牛磺酸水平为1.35 g/100 g(干饲料)时,红鳍东方鲀幼鱼体表黏液溶菌酶活力达到最大值(图4)。
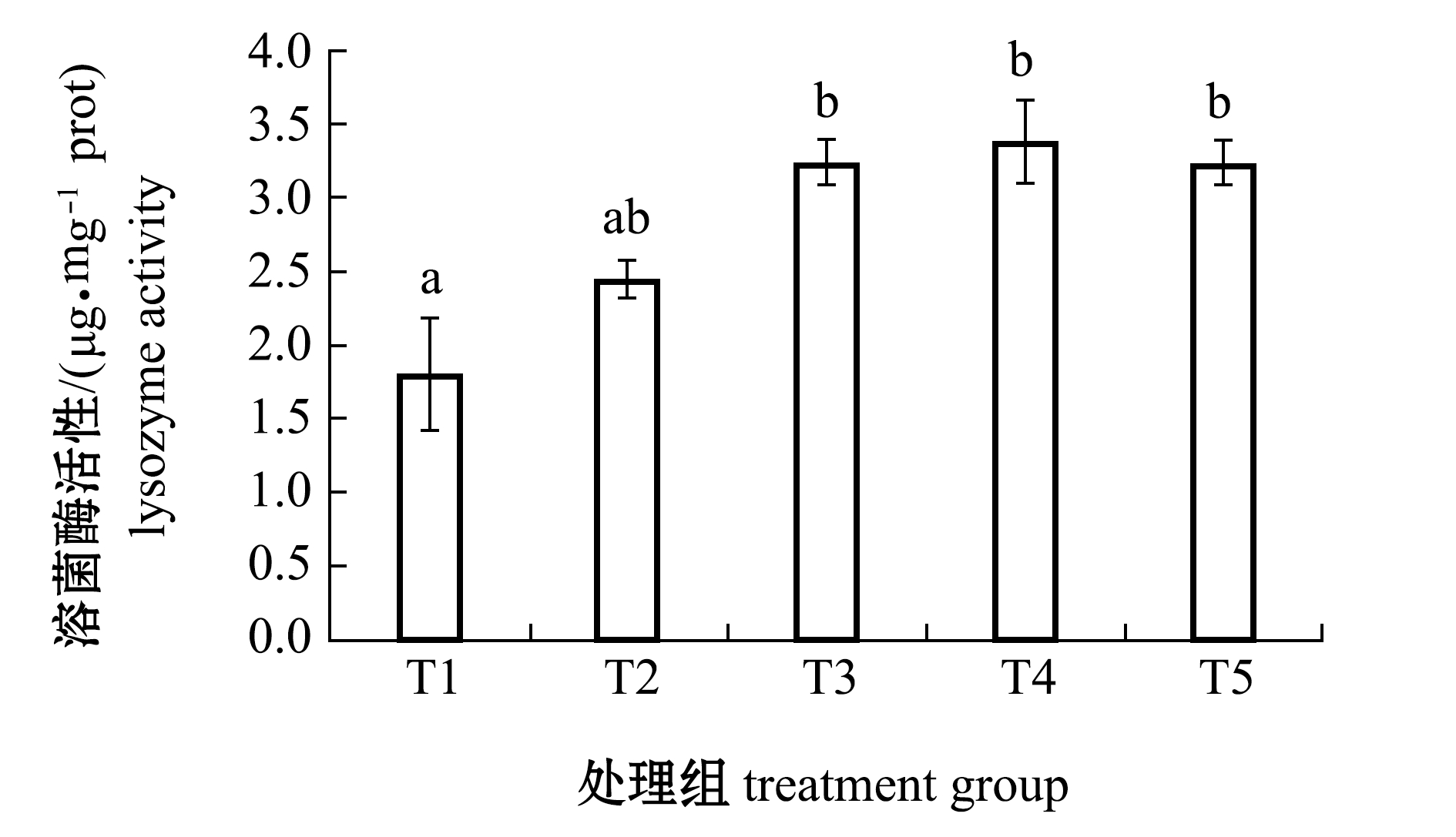
注:标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同
Note:The means with different letters are significant differences at the 0.05 probability level, and the means with the same letters are not significant differences, et sequentia
图1 饲料中添加不同水平牛磺酸对红鳍东方鲀体表黏液溶菌酶活力的影响
Fig.1 Effects of different taurine levels on activities of lysozyme enzyme in mucus on body surface of redfin puffer Takifugu rubripes
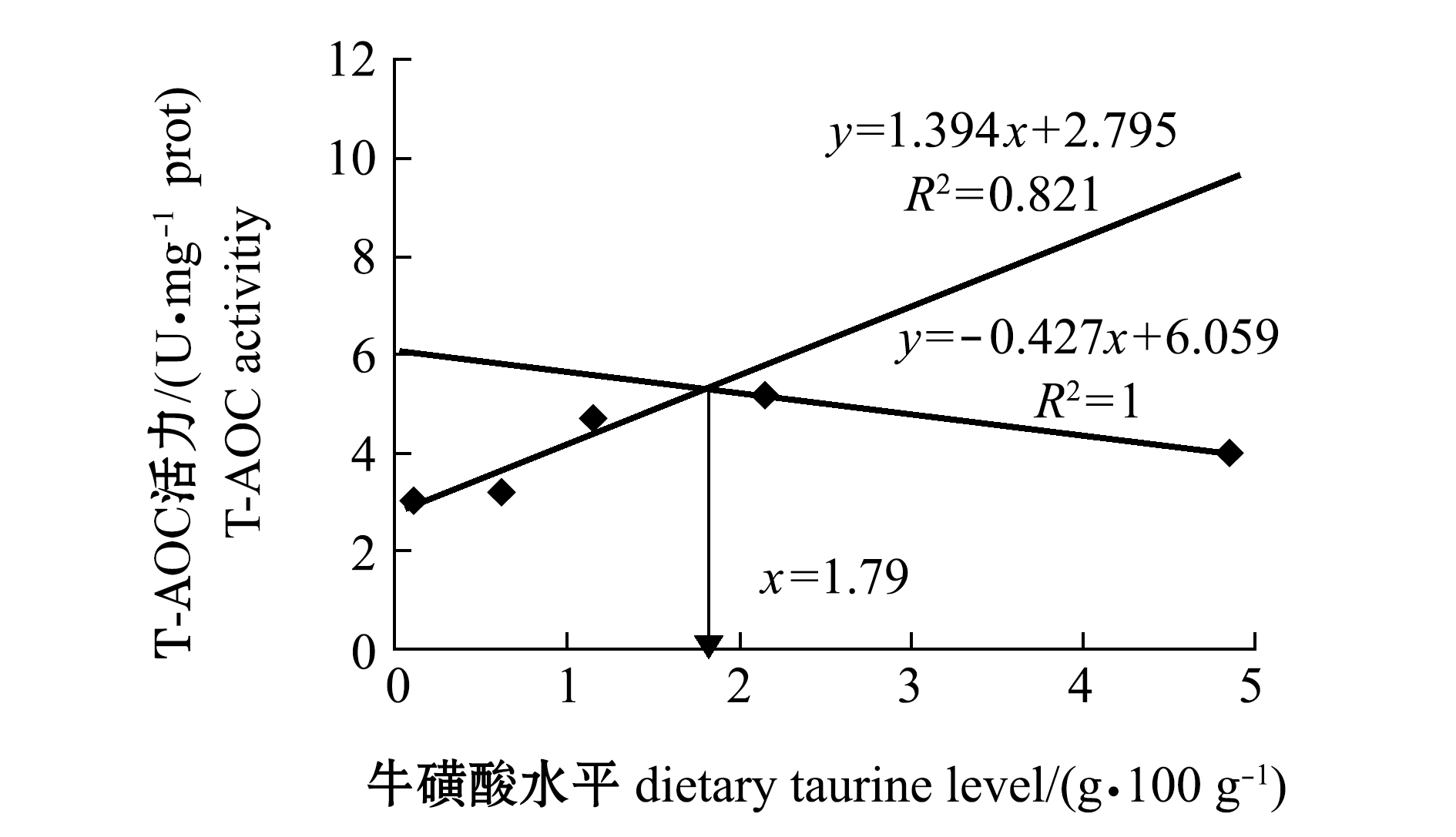
图2 红鳍东方鲀肝脏T-AOC和饲料牛磺酸的折线回归关系
Fig.2 Broken line analysis between activity of T-AOC in liver of redfin puffer Takifugu rubripes and dietary taurine levels
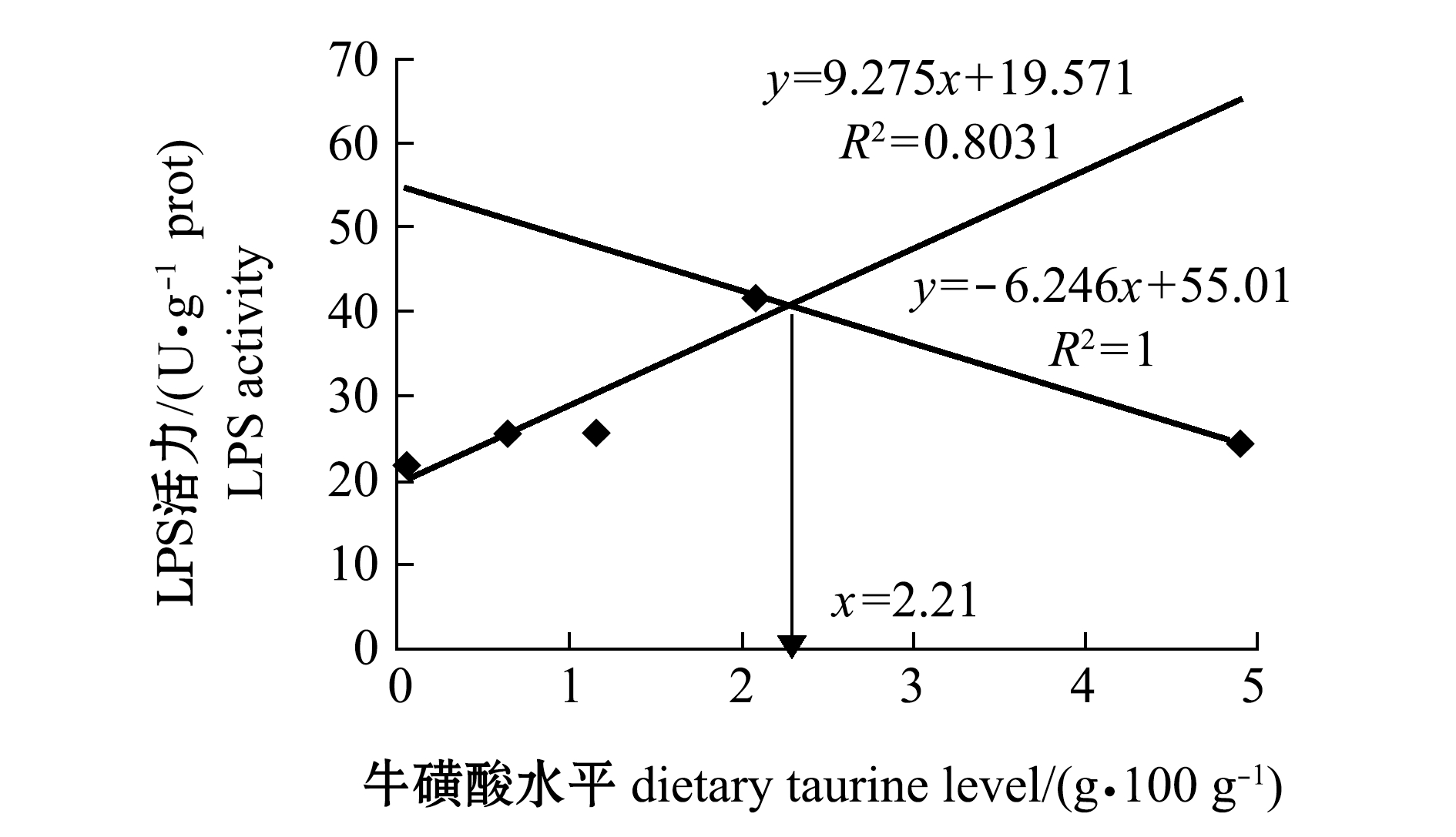
图3 红鳍东方鲀肠道LPS和饲料牛磺酸的折线回归关系
Fig.3 Broken line analysis between activity of LPS in intestine of redfin puffer Takifugu rubripes and dietary taurine levels
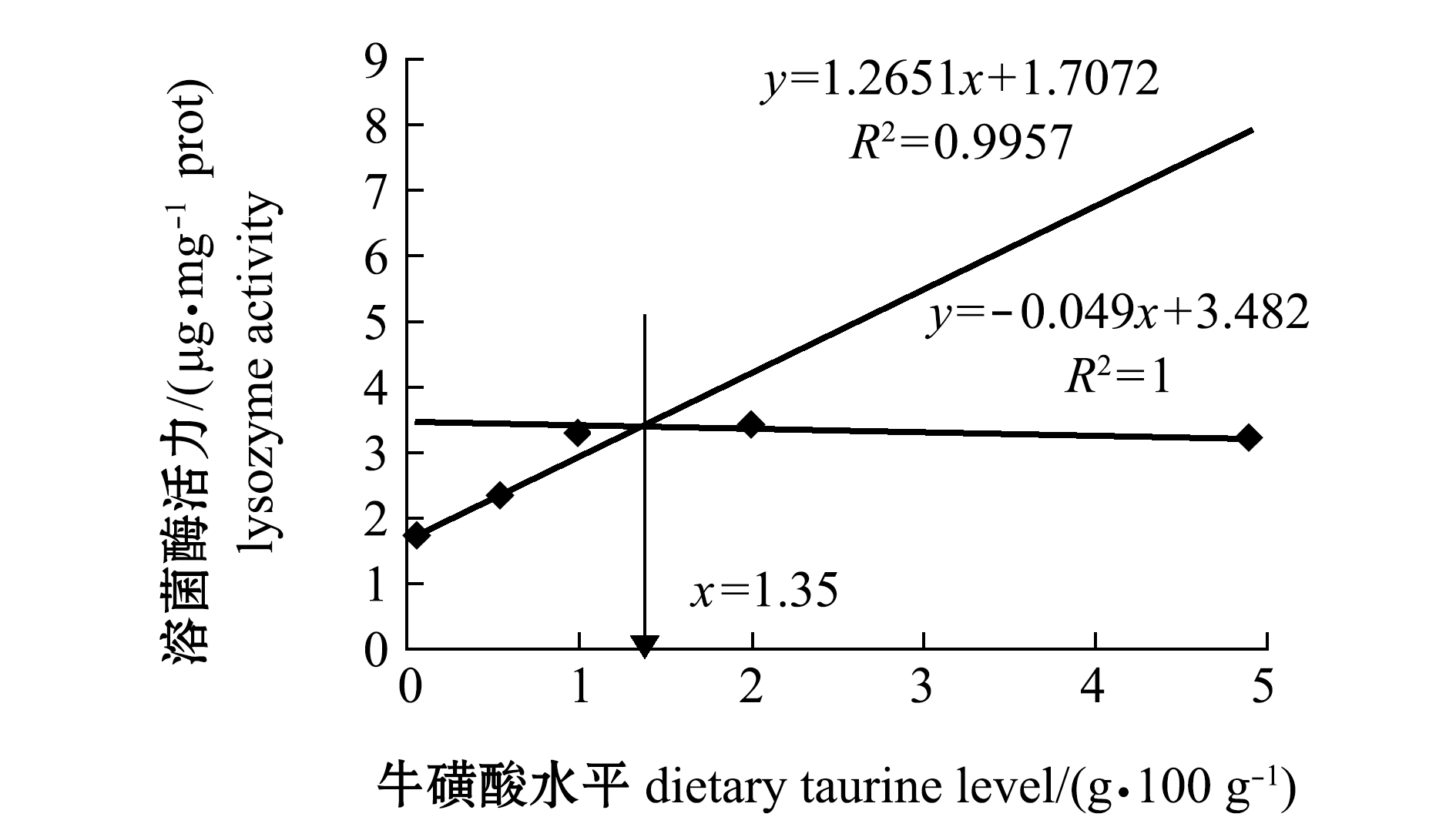
图4 红鳍东方鲀体表黏液溶菌酶和饲料牛磺酸的折线回归关系
Fig.4 Broken line analysis between activity of LPS of lysozyme in mucus on body surface of redfin puffer Takifugu rubripes and dietary taurine levels
3 讨论
3.1 牛磺酸对红鳍东方鲀肝脏抗氧化酶及AKP和ACP活力的影响
肝脏的新陈代谢中会产生大量的氧自由基(ROS)[27],正常机体的抗氧化防御系统能够清除各种氧自由基,在维持其产生与清除动态平衡的同时,还能修复或代谢氧化产物,把氧自由基对机体的危害调控在最低程度,减少水产动物严重的氧化损伤[28]。氧化应激不仅是肝功能障碍的一部分,也是所有肝损伤的病理生理基础[28-29]。缺乏牛磺酸的动物模型中,存在肝脏组织发育异常或不完全的现象,而牛磺酸则可以保护肝脏不受氧化应激等多重损害[30]。Miyazaki等[31]研究表明,牛磺酸可使肝脏组织中氧化应激的代谢物减少。
本试验中发现,饲料中添加牛磺酸可显著提高红鳍东方鲀肝脏中T-AOC、SOD、CAT和GSH-PX的活性,同时显著降低MDA的含量,即对机体内自由基的清除能力升高,促进蛋白性抗氧化剂GSH-PX的产生,降低脂质过氧化反应的发生,减少MDA的产生,提高了红鳍东方鲀肝脏抗氧化酶的活性和抗氧化物质的含量。杨春波等[32]研究表明,对休克家兔Oryctolagus cuniculus灌注牛磺酸可提高其SOD和GSH-PX活性,同时降低MDA含量。李丽娟等[33]的试验结果表明,饲料中添加0.10%、0.15%的牛磺酸时,肉鸡肝脏中T-AOC、SOD和GSH-PX活性最高,MDA含量最低,本试验与其试验结果一致。SOD和CAT可分别清除机体内超氧阴离子自由基和过氧化氢,其活性高低可以体现机体清除氧自由基能力的大小[14];GSH-PX可以催化过氧化氢和还原型谷胱甘肽反应生成水,从而保护细胞和细胞膜免受氧化损伤[30];MDA是自由基引发脂质过氧化作用的最终分解产物,其含量的高低可反映活性氧自由基含量的多少[34]。当机体细胞内氧自由基与抗氧化酶类系统平衡被打破时,可导致氧自由基在体内蓄积,并易与膜多聚不饱和脂肪酸和胆固醇发生氧化反应,破坏膜结构,进而引起细胞器损伤[35-36]。饲料中添加牛磺酸能够提高红鳍东方鲀肝脏抗氧化能力,但随着牛磺酸添加量的持续升高,红鳍东方鲀的抗氧化能力并没有一直增强,在5.0%添加量时,T-AOC、SOD、CAT和GSH-PX的活性出现下降,MDA含量出现上升趋势,这可能是由于摄入过量的牛磺酸可引起动物机体出现抗氧化抑制作用,导致红鳍东方鲀抗氧化酶活性降低,过氧化产物增加,颉志刚等[34]对虎纹蛙Hoplobtrachus rugulosus的研究表明,牛磺酸发挥免疫作用时存在明显的剂量效应,浓度过高的牛磺酸对机体的抗氧化能力产生抑制作用。
碱性磷酸酶对水产动物吸收水中钙质和机体磷酸钙的形成具有重要作用,能够催化各种含磷化合物水解[37],是水产动物生长和生存的重要酶类之一[38]。本试验结果表明,饲料中添加牛磺酸可显著提高红鳍东方鲀肝脏AKP活性,AKP在牛磺酸添加量为1.0%时有峰值,与张小龙[39]在仔猪饲料中添加牛磺酸的研究结果一致。AKP是生物体内重要的代谢调控酶,为ADP磷酸化提供更多所需的无机磷酸,可促进生物体内ATP合酶将无机磷酸和ADP合成ATP;直接参与钙磷代谢、脊椎动物骨化等重要代谢过程,具有高度的成骨作用[40-41],说明牛磺酸在一定程度上能抑制成骨细胞活力,促进骨骼生长。徐奇友等[42]认为,AKP可催化有机磷酸酯水解, 打开磷酸酯键, 释放磷酸离子, 可以通过改变细菌表面的结构, 增强其异己性, 从而被动物体内的吞噬细胞吞噬和降解。由此可以推断,牛磺酸可显著提高红鳍东方鲀幼鱼肝脏的免疫力,但在牛磺酸添加量为2.0%和5.0%时,AKP活性显著下降,说明过多的牛磺酸会降低红鳍东方鲀免疫力及钙磷代谢活力。罗莉等[43]在对草鱼Ctenopharyngodon idellus的研究上有相似的发现。
3.2 牛磺酸对红鳍东方鲀肠道消化酶的影响
本试验结果表明,饲料中添加牛磺酸可使红鳍东方鲀肠道脂肪酶活力显著增强,具有促进脂肪消化、吸收和代谢的作用。大量的研究表明,牛磺酸与游离胆酸形成牛磺胆酸,再结合以胆汁酸盐的形式随胆汁进入消化道的胆汁酸,能促进脂肪和脂溶性维生素的消化吸收,同时还能增加胆固醇的溶解与排出[3,5]。高春生等[44]、罗莉等[43]和龙勇等[45]研究表明,牛磺酸可提高黄河鲤Cuprinus carpio、草鱼C.idellus肠道消化酶活力,促进营养物质的消化吸收,提高营养效应,促进生长,提高饲料利用率。
3.3 牛磺酸对红鳍东方鲀体表黏液溶菌酶的影响
鱼类皮肤的上皮组织中分布着大量的黏液细胞,分泌的黏液广泛覆盖在鱼体表面,黏液调节渗透压以适应环境的变化;在免疫方面有保护鱼体免遭病菌、寄生虫和病毒的侵袭等功能,是鱼类自身抵抗外来侵入和免疫系统的第一道防线[46],在鱼类整个生命过程中起着至关重要的作用[47]。溶菌酶是非特异性免疫的重要组成部分[48],有研究表明,饲料中添加牛磺酸能够显著提高鲤肝脏溶菌酶活力,调节动物的免疫反应[49]。本试验结果表明,饲料中添加适量牛磺酸可显著提高红鳍东方鲀体表黏液溶菌酶的活性,在2.0%的添加量时达到最大值。田芊芊等[46]在低鱼粉饲料中添加牛磺酸后青鱼Mylopharyngodon piceus幼鱼血浆溶菌酶活性升高,得出了牛磺酸能使青鱼幼鱼非特异性免疫增强的研究结果,本研究结果与此研究结果一致,说明牛磺酸可作为有效的免疫添加剂添加在饲料中。牛磺酸能促进溶解酶水解革兰氏阳性菌细胞壁中黏肽的乙酰氨基多糖,并使之裂解被释放出来,破坏和消除侵入体的细菌等病原体,从而承担行使机体防御的功能[49-51]。
3.4 红鳍东方鲀幼鱼对牛磺酸的需求量
鱼类对营养物质的需要量可以根据抗氧化能力试验出现的剂量-抗氧化酶效应,采用不同数学模型加以确定,已有报道中采用较多的数学模型主要有折线模型(Broken-line regression)或二次曲线模型(Quadratic regression)[52-53]。本试验中采用折线模型,以鱼体T-AOC作为效应指标,得出红鳍东方鲀幼鱼对饲料中牛磺酸的需求量为1.79 g/100 g(干饲料)。在研究鱼类牛磺酸需求量时,除用抗氧化指标作为确定需求量依据外,一些研究者还用其他的指标验证,发现氨基酸沉积率、蛋白质效率、脂肪酶、胰蛋白酶活力、AKP和溶菌酶等也是有效指标[54-57]。本试验中分别采用肠道脂肪酶和体表黏液溶菌酶作为效应指标,得出红鳍东方鲀幼鱼对牛磺酸的需求量分别为2.21、1.35 g/100 g(干饲料),表明肠道脂肪酶和体表黏液溶菌酶作为确定牛磺酸需求量验证指标也是有效的,因此,红鳍东方鲀幼鱼对饲料中牛磺酸的适宜需求量为1.35~2.21 g/100 g(干饲料)。这一结果高于草鱼C.idellus的1.5 g/kg[58],欧洲鲈Dicentrarchus labrax的0.2%[59],与牙鲆P.olivaceus的1.5%~2.0%[60]相近,造成这种差异的原因可能是试验用鱼的种类、大小、饲料组成与适口性等不同[6,61]。
4 结论
饲料中添加牛磺酸可显著提高红鳍东方鲀的机体抗氧化以及免疫功能,但过多的牛磺酸会导致抗氧化及免疫功能降低。牛磺酸也可提高红鳍东方鲀肠道的消化活力。基于上述相关指标的评估及折线模型分析,牛磺酸在红鳍东方鲀低鱼粉饲料中的最适添加量为1.35~2.21 g/100 g(干饲料)。
[1] Huxtable R J.Physiological actions of taurine[J].Physiological Reviews,1992,72(1):101-163.
[2] 董晓庆,张东鸣,葛晨霞.牛磺酸在鱼类营养上的研究进展[J].中国畜牧兽医,2013,39(6):125-127.
[3] 王和伟,叶继丹,陈建春.牛磺酸在鱼类营养中的作用及其在鱼类饲料中的应用[J].动物营养学报,2013,25(7):1418-1428.
[4] 何天培,周毓平,王玉江.牛磺酸对肉仔鸡生产性能的影响及其作用机制的研究[J].吉林农业大学学报,1995,17(2):68-73.
[5] Mizushima S,Nara Y,Sawamura M,et al.Effects of oral taurine supplementation on lipids and sympathetic nerve tone[M]//Taurine 2:Basic and Clinical Aspects.Boston,MA:Springer,1996:615-622.
[6] 王学习,周铭文,黄岩,等.饲料牛磺酸水平对不同生长阶段斜带石斑鱼幼鱼生长性能和体成分的影响[J].动物营养学报,2017,29(5):1810-1820.
[7] Yun Biao,Ai Qinghui,Mai Kangsen,et al.Synergistic effects of dietary cholesterol and taurine on growth performance and cholesterol metabolism in juvenile turbot (Scophthalmus maximus L.) fed high plant protein diets[J].Aquaculture,2012,324-325:85-91.
[8] 邱小琮,赵红雪.牛磺酸对鲤生长及血清T3、T4含量的影响[J].淡水渔业,2016,36(1):22-24.
[9] Campbell G L,Classen H L.Effect of dietary taurine supplementation on sudden death syndrome in broiler chickens[J].CanadianJournal of Animal Science,1989,69(2):509-512.
[10] Tufft L S,Jensen L S.Influence of dietary taurine on performance and fat retention in broilers and turkey poults fed varying levels of fat[J].Poultry Science,1992,71(5):880-885.
[11] Chang Y Y,Chou C H,Chiu C H,et al.Preventive effects of taurine on development of hepatic steatosis induced by a high-fat/cholesterol dietary habit[J].Journal of Agricultural and Food Chemistry,2011,59(1):450-457.
[12] 倪鸿昌,李俊,金涌,等.大鼠实验性高脂血症和高脂血症性脂肪肝模型研究[J].中国药理学通报,2004,20(6):703-706.
[13] 陈思文,陈岳祥,张兴荣,等.牛磺酸对大鼠实验性脂肪肝的防治作用[J].中华肝脏病杂志,2006,14(3):226-227.
[14] 王清滨,王秋举,杨翼羽,等.牛磺酸对投喂高脂饲料草鱼幼鱼生长、肌肉品质及抗氧化能力的影响[J].西北农林科技大学学报:自然科学版,2015,43(7):49-56.
[15] Higuchi M,Celino F T,Shimizu-Yamaguchi S,et al.Taurine plays an important role in the protection of spermatogonia from oxidative stress[J].Amino Acids,2012,43(6):2359-2369.
[16] Salze G,McLean E,Craig S R.Dietary taurine enhances growth and digestive enzyme activities in larval cobia[J].Aquaculture,2012,362-363:44-49.
[17] Kim S K,Takeuchi T,Yokoyama M,et al.Effect of dietary taurine levels on growth and feeding behavior of juvenile Japanese flounder Paralichthys olivaceus[J].Aquaculture,2005,250(3-4):765-774.
[18] Gaylord T G,Barrows F T,Teague A M,et al.Supplementation of taurine and methionine to all-plant protein siets for rainbow trout (Oncorhynchus mykiss)[J].Aquaculture,2007,269(1-4):514-524.
[19] Lunger A N,McLean E,Gaylord T G,et al.Taurine supplementation to alternative dietary proteins used in fish meal replacement enhances growth of juvenile cobia (Rachycentron canadum)[J].Aquaculture,2007,271(1-4):401-410.
[20] Takagi S,Murata H,Goto T,et al.Efficacy of taurine supplementation for preventing green liver syndrome and improving growth performance in yearling red sea bream Pagrus major fed low-fishmeal diet[J].Fisheries Science,2006,72(6):1191-1199.
[21] Takagi S,Murata H,Goto T,et al.Taurine is an essential nutrient for yellowtail Seriolaquin queradiata fed non-fish meal diets based on soy protein concentrate[J].Aquaculture,2008,280(1-4):198-205.
[22] Kim S K,Matsunari H,Takeuchi T,et al.Effect of different dietary taurine levels on the conjugated bile acid composition and growth performance of juvenile and fingerling Japanese flounder Paralichthys olivaceus[J].Aquaculture,2007,273(4):595-601.
[23] Matsunari H,Furuita H,Yamamoto T,et al.Effect of dietary taurine and cystine on growth performance of juvenile red sea bream Pagrus major[J].Aquaculture,2008,274(1):142-147.
[24] 孙中之.红鳍东方鲀的生物学特性及人工育苗技术[J].齐鲁渔业,2002,19(8):44-46.
[25] 王缙云,李霞,秦艳杰,等.红鳍东方鲀鳍细胞系的建立及生长特性研究[J].大连海洋大学学报,2018,33(6):703-708.
[26] 谭北平,麦康森,艾庆辉,等.红鳍东方鲀配合饲料:中国,CN1264418C[P].2006-07-19.
[27] 骆作勇.仿刺参幼参对不同刺激的应激机制及维生素C、E抗应激作用研究[D].青岛:中国科学院研究生院(海洋研究所),2014.
[28] 欧阳冬生,王珍珊,袁浩泳,等.肝脏脂肪酸结合蛋白抗氧化作用研究进展[J].中国现代医学杂志,2011,21(26):3284-3287.
[29] 谷川久一.氧化应激与肝病[J].秦丽娟,译.日本医学介绍,2006,27(12):560-562.
[30] 刘志媛,吴高峰,徐哲,等.牛磺酸与肝脏疾病——牛磺酸多种护肝作用的重点阐述[J].现代畜牧兽医,2013(3):60-64.
[31] Miyazaki T,Matsuzaki Y.Taurine and liver diseases:a focus on the heterogeneous protective properties of taurine[J].Amino Acids,2014,46(1):101-110.
[32] 杨春波,王政,刘秀萍,等.牛磺酸对缺血再灌注家兔抗氧化能力影响的实验研究[J].哈尔滨医科大学学报,2002,36(2):109-111.
[33] 李丽娟,王安,王鹏.牛磺酸对爱拔益加肉雏鸡生长性能及抗氧化功能的影响[J].动物营养学报,2010,22(3):696-701.
[34] 颉志刚,凌洁彬,鲁纪刚,等.牛磺酸对虎纹蛙非特异性免疫及血清氧化还原状态的影响[J].动物学杂志,2017,52(6):996-1002.
[35] Kowaltowski A J,DeSouza-Pinto N C,Castilho R F,et al.Mitochondria and reactive oxygen species[J].Free Radical Biology and Medicine,2009,47(4):333-343.
[36] Valko M,Leibfritz D,Moncol J,et al.Free radicals and antioxidants in normal physiological functions and human disease[J].The International Journal of Biochemistry & CellBiology,2007,39(1):44-84.
[37] 刘晴,董惠芬,蒋明森,等.日本血吸虫培养细胞SDH、AKP和ACP的组织化学观察[J].中国公共卫生,2002,18(5):557-558.
[38] 张辉,张海莲.碱性磷酸酶在水产动物中的作用[J].河北渔业,2003(5):12-13,32.
[39] 张小龙.牛磺酸对早期断奶仔猪生长性能和肠道发育的影响及机制[D].重庆:西南大学,2015.
[40] 朱忠勇.实用医学检验学[M].北京:人民军医出版社,1997:368-378.
[41] Jankovic A,Korac Z,Bozic N B,et al.Influence of knee flexion and atraumatic mobilisation of infrapatellar fat pad on incidence and severity of anterior knee pain after tibial nailing[J].Injury,2013,44(S3):S33-S39.
[42] 徐奇友,许红,郑秋珊,等.牛磺酸对虹鳟仔鱼生长、体成分和免疫指标的影响[J].动物营养学报,2007,19(5):544-548.
[43] 罗莉,文华,王琳,等.牛磺酸对草鱼生长、品质、消化酶和代谢酶活性的影响[J].动物营养学报,2006,18(3):166-171.
[44] 高春生,范光丽,王艳玲.牛磺酸对黄河鲤鱼生长性能和消化酶活性的影响[J].中国农学通报,2007,23(6):645-647.
[45] 龙勇,罗莉,幺相姝,等.灌喂牛磺酸对草鱼消化酶活性的影响[J].西南农业大学学报:自然科学版,2004,26(5):650-653.
[46] 田芊芊,胡毅,毛盼,等.低鱼粉饲料中添加牛磺酸对青鱼幼鱼生长、肠道修复及抗急性拥挤胁迫的影响[J].水产学报,2016,40(9):1330-1339.
[47] 黄智慧,马爱军,汪岷.鱼类体表黏液分泌功能与作用研究进展[J].海洋科学,2009,33(1):90-94.
[48] Dunier M,Siwicki A K,Dema⊇l A.Effects of organophosphorus insecticides:effects of trichlorfon and dichlorvos on the immune response of carp (Cyprinus carpio):III.In vitro effects on lymphocyte proliferation and phagocytosis and in vivo effects on humoral response[J].Ecotoxicology and Environmental Safety,1991,22(1):79-87.
[49] 邱小琮,赵红雪,王远吉,等.牛磺酸对鲤非特异性免疫及抗氧化能力的影响[J].上海水产大学学报,2008,17(4):429-434.
[50] 杨先乐.鱼类免疫学研究的进展[J].水产学报,1989,13(3):271-284.
[51] 刘树青,江晓路,牟海津,等.免疫多糖对中国对虾血清溶菌酶、磷酸酶和过氧化物酶的作用[J].海洋与湖沼,1999,30(3):278-283.
[52] 王朝明,罗莉,张桂众,等.饲料脂肪水平对胭脂鱼幼鱼生长、体组成和抗氧化能力的影响[J].淡水渔业,2010,40(5):47-53.
[53] 杨继华,陈冰,黄燕华,等.饲料中添加桑叶黄酮对吉富罗非鱼生长性能、体成分、抗氧化指标及抗亚硝酸盐应激能力的影响[J].动物营养学报,2017,29(9):3403-3412.
[54] 黄爱霞,孙丽慧,陈建明,等.饲料亮氨酸水平对幼草鱼生长、饲料利用及体成分的影响[J].饲料工业,2018,39(2):26-32.
[55] 陈永坡.饲粮中添加磷脂对幼草鱼生长和肠道免疫功能的影响及作用机制研究[D].雅安:四川农业大学,2015.
[56] 赵红霞,曹俊明,谭永刚,等.军曹鱼幼鱼维生素C需要量的研究[J].动物营养学报,2008,20(4):435-441.
[57] 何明.花鳗鲡白仔鳗淡化方式、转口饵料及幼鳗饲料中牛磺酸添加效果研究[D].上海:上海海洋大学,2016.
[58] 徐璐茜,明建华,张易祥,等.牛磺酸对草鱼幼鱼生长、非特异性免疫与抗氧化能力以及消化酶活性的影响[J].浙江海洋学院学报:自然科学版,2016,35(6):464-471.
[59] Martinez J B,Chatzifotis S,Divanach P,et al.Effect of dietary taurine supplementation on growth performance and feed selection of sea bass Dicentrarchus labrax fry fed with demand-feeders[J].Fisheries Science,2004,70(1):74-79.
[60] Park G S,Takeuchi T,Yokoyama M,et al.Optimal dietary taurine level for growth of juvenile Japanese flounder Paralichthys olivaceus[J].Fisheries Science,2002,68(4):824-829.
[61] Tacon A G J,Cowey C B.Protein and amino acid requirements[M]//Fish Energetics.Dordrecht:Springer,1985:155-183.