大黄鱼Pseudosciaena crocea隶属于硬骨鱼纲、鲈形目Perciformes、石首鱼科Sciaenidae、黄鱼属Chuanchia,为暖温性近海中下层集群洄游性鱼类,主要分布在中国黄海南部、东海、台湾海峡及南海北部[1]。从20世纪90年代发展至今,大黄鱼已成为中国重要的海水经济养殖鱼种,优质的大黄鱼苗种供不应求。大黄鱼亲鱼的营养健康是保证大黄鱼繁殖能力和种苗质量的关键因素[2-4],因此,在培育过程中,优选亲鱼强化模式和评估养殖亲本的营养健康具有重要意义。
目前,有关大黄鱼营养的研究较多。高有领等[5]研究指出,投喂鲜杂鱼和配合饲料,可使得大黄鱼的氨基酸总量和粗脂肪含量存在显著性差异;周飘苹等[6]研究指出,不同养殖模式和饵料下,野生组、饲料组与深水网箱组大黄鱼背部肌肉脂肪酸总量、不饱和脂肪酸总量和高不饱和脂肪酸总量高于冰鲜鱼组、池塘组和闽东组。李明云等[7]研究表明,反交家系、岱衢洋家系、官井洋家系间的氨基酸总含量存在显著性差异。李桑等[8]研究表明,植物油替代鱼油投饲大黄鱼后,可不影响肌肉与肝脏的总脂肪含量,但显著影响肌肉与肝脏的脂肪酸组成。Duan等[9]研究了豆油、棕榈油100%替代鱼油可显著提升大黄鱼腹部脂肪酸含量等。上述研究分别从不同饵料类型、养殖模式、繁育家系、饵料组成等研究热点对大黄鱼营养影响进行了研究,旨在改良大黄鱼肉质或降低养殖成本,但关于如何优选亲鱼强化模式、增强养殖亲本营养健康等方面的研究却鲜见报道。
本研究中,采用当前养殖场常用亲鱼培育模式投饲黄占鱼Trachurus japonicus、中华管鞭虾Solenocera crassicornis、沙蚕Nereis succinea等冰鲜饵料或鲜活饵料,并辅以强化剂[10-12]进行大黄鱼的亲鱼培养,期间阶段性地测定大黄鱼雌性亲鱼肌肉营养成分,以获得基础的营养强化数据,从而分析大黄鱼雌性亲鱼肌肉的营养变化,旨在为大黄鱼亲鱼营养优化、健康评估及种质改良等研究提供参考依据,同时也对今后标准化亲鱼培育模式的建立具有重要的实际意义。
1 材料与方法
1.1 材料
2016年11月20日,浙江华兴水产科技有限公司从舟山六横台门网箱运回2龄同批养殖大黄鱼至朱家尖养殖基地进行养殖,以备于2017年大黄鱼育苗之需。2016年11月20日之前网排投喂饵料为天邦精制大黄鱼5号料。
1.2 方法
1.2.1 饲养管理 运回朱家尖后,将大黄鱼分别养殖于车间9个水池(4 m×4 m)中,养殖密度约为4 kg/m3。于2016年11月21日—2017年1月25日,投喂冰鲜饵料(黄占鱼、中华管鞭虾)和鲜活饵料(沙蚕)。于2017年1月26日—3月26日,投喂冰鲜饵料(黄占鱼、中华管鞭虾)和鲜活饵料(沙蚕),并辅以强化剂(购自青岛越洋进出口有限公司)。亲鱼培育期间投饵的具体信息见表1。养殖期间,每天投饵2次,换水量每天为200%,养殖水温低于18 ℃时,通过烧锅炉等方法使养殖水温保持在(18±2)℃。
1.2.2 样本采集与指标测定 试验期间,每隔2月采样1次,总共取样3次。2016年11月20日采样1次,记为A阶段(大黄鱼卵巢发育至Ⅰ期或少数Ⅱ期);2017年1月25日采样1次,记为B阶段(大黄鱼卵巢发育至Ⅱ期或少数Ⅲ期);2017年3月26日采样1次,记为C阶段(大黄鱼卵巢发育至Ⅳ期)。取样时,每次从各个养殖池中取大黄鱼雌鱼各1尾,共计9尾,各取每尾鱼的腹部肌肉和背部肌肉,每3尾相同部位混合,用于肌肉营养成分测定,共设3个重复。其中取样A阶段样本体长为(27.32±0.64)cm,体质量为(311.39±57.27)g;B阶段体长为(27.81±1.17)cm,体质量为(394.14±52.84)g;C阶段体长为(28.03±1.56)cm,体质量为(592.43±124.92)g。
表1 亲鱼培育期间投饵的具体信息
Tab.1 Feeding pattern of the broodstock during broodstock fish rearing
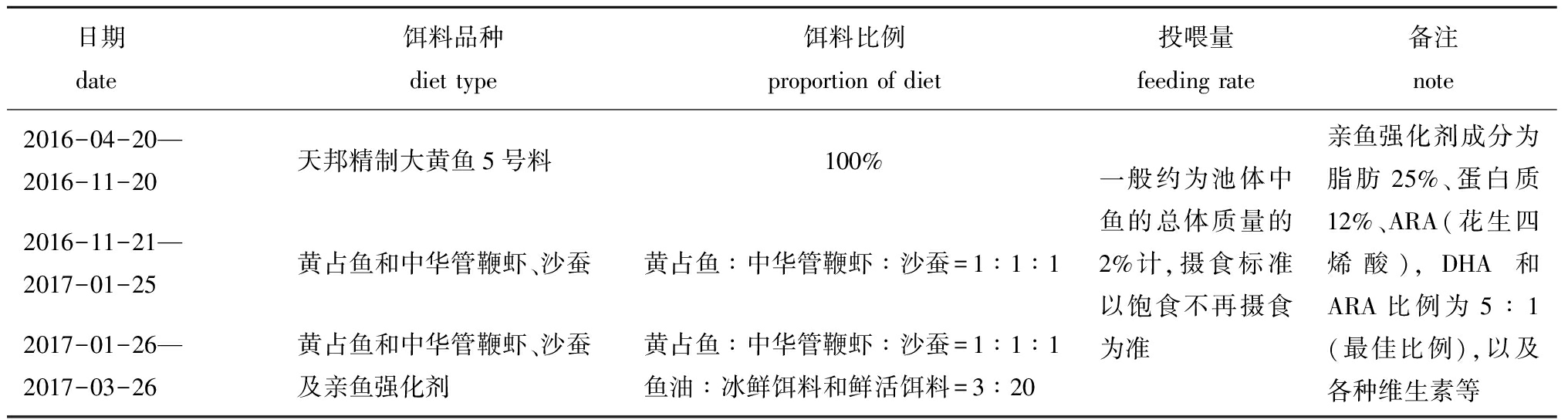
日期 date饵料品种diet type饵料比例 proportion of diet投喂量feeding rate备注note2016-04-20—2016-11-20天邦精制大黄鱼5号料100%2016-11-21—2017-01-25黄占鱼和中华管鞭虾、沙蚕黄占鱼∶中华管鞭虾∶沙蚕=1∶1∶12017-01-26—2017-03-26黄占鱼和中华管鞭虾、沙蚕及亲鱼强化剂黄占鱼∶中华管鞭虾∶沙蚕=1∶1∶1鱼油∶冰鲜饵料和鲜活饵料=3∶20一般约为池体中鱼的总体质量的2%计,摄食标准以饱食不再摄食为准亲鱼强化剂成分为脂肪25%、蛋白质12%、ARA(花生四烯酸),DHA和ARA比例为5∶1(最佳比例),以及各种维生素等
肌肉基础营养成分的测定:采用凯氏定氮法(GB 5009.5—2016)、索氏抽提法(GB/T 6433—2006)、550 ℃燃烧后称量残余物方法(GB 5009.4—2016)、直接干燥法(GB 5009.3—2016)分别测定肌肉中粗蛋白质、粗脂肪、灰分和水分含量。
肌肉氨基酸和脂肪酸的测定:样品前处理,将肌肉组织使用组织粉碎机粉碎,-20 ℃下冷冻保存,使用时将其解冻。采用酸水解氨基酸法(GB/T5009.124—2003),用IE363 氨基酸分析仪(日本日立 L-8900)测定氨基酸含量;采用水解提取-气相色谱法(GB/22223—2008),用气相色谱仪(日本岛津GC-2010)测定脂肪酸含量。
1.3 数据处理
试验数据采用SPSS 17.0统计软件进行单因素方差分析(ANOVA),当差异显著时(P<0.05)进行Duncan多重比较。
2 结果与分析
2.1 不同养殖阶段大黄鱼雌性亲鱼肌肉基础营养成分的变化
不同养殖阶段大黄鱼雌性亲鱼肌肉基础营养成分见表2。从表2可见:A、B、C阶段大黄鱼雌性亲鱼腹部和背部肌肉的水分含量均呈下降趋势,且同一组织中C阶段肌肉水分含量均显著低于A阶段和B阶段(P<0.05);在养殖过程中,背部肌肉粗蛋白质含量呈增长趋势,腹部肌肉呈下降趋势,但A、B、C阶段间无显著性差异(P>0.05);背部和腹部肌肉的粗脂肪含量阶段性增长,且C阶段显著高于B阶段(P<0.05),B阶段显著高于A阶段(P<0.05);背部和腹部肌肉粗灰分含量各阶段间呈显著性增长(P<0.05)。
表2 不同养殖阶段大黄鱼雌性亲鱼肌肉基础营养成分比较(以鲜基计,n=3)
Tab.2 Proximate compositions of muscle of female large yellow croaker Pseudosciaena crocea in different breeding stages w/%
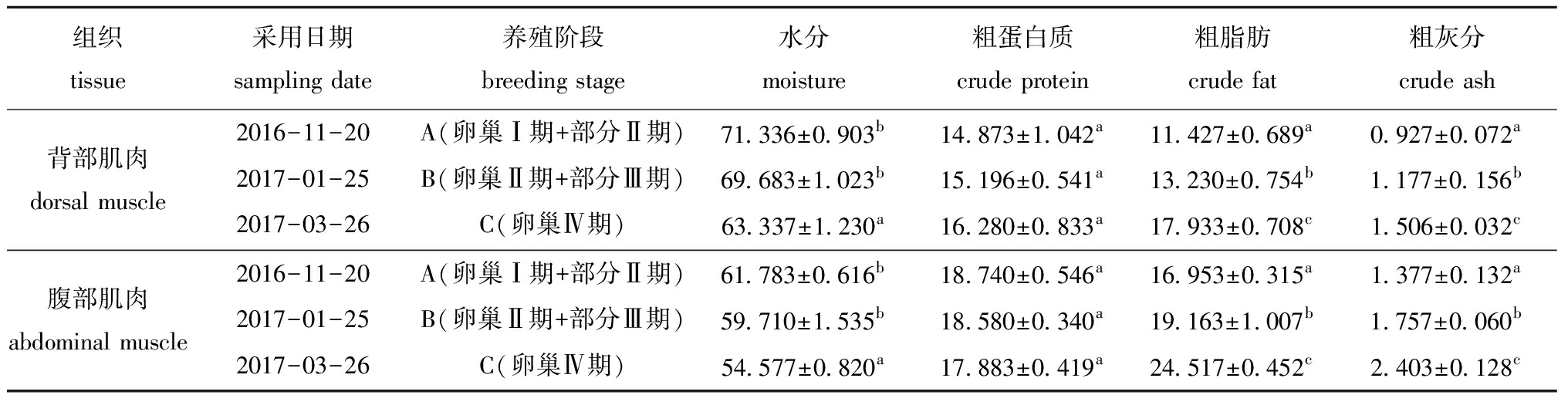
组织tissue采用日期sampling date养殖阶段breeding stage水分moisture粗蛋白质crude protein粗脂肪crude fat粗灰分crude ash背部肌肉dorsal muscle2016-11-20A(卵巢Ⅰ期+部分Ⅱ期)71.336±0.903b14.873±1.042a11.427±0.689a0.927±0.072a2017-01-25B(卵巢Ⅱ期+部分Ⅲ期)69.683±1.023b15.196±0.541a13.230±0.754b1.177±0.156b2017-03-26C(卵巢Ⅳ期)63.337±1.230a16.280±0.833a17.933±0.708c1.506±0.032c腹部肌肉abdominal muscle2016-11-20A(卵巢Ⅰ期+部分Ⅱ期)61.783±0.616b18.740±0.546a16.953±0.315a1.377±0.132a2017-01-25B(卵巢Ⅱ期+部分Ⅲ期)59.710±1.535b18.580±0.340a19.163±1.007b1.757±0.060b2017-03-26C(卵巢Ⅳ期)54.577±0.820a17.883±0.419a24.517±0.452c2.403±0.128c
注:同列中标有不同字母者表示同一组织不同养殖阶段间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同
Note:The means with different letters within the same column in same tissue are significant differences in different beeding stages at the 0.05 probability level,the means with the same letters are not significant differences, et sequentia
2.2 不同养殖阶段大黄鱼雌性亲鱼肌肉氨基酸含量的变化
2.2.1 亲鱼背部肌肉氨基酸含量的变化 从表3可见:大黄鱼背部肌肉C阶段氨基酸总量最高,是A阶段的1.206倍,是B阶段的1.160倍,但各阶段间无显著性差异(P>0.05);必需氨基酸中色氨酸(TRP)由于检测方法采用酸水解法无法测得,因此,在本试验中只计算其余9种必需氨基酸,由结果可知,大黄鱼背部肌肉必需氨基酸总量依次为C阶段>B阶段>A阶段,且C阶段显著高于A阶段(P<0.05);非必需氨基酸、呈味氨基酸含量为C阶段>B阶段>A阶段,但仅C阶段呈味氨基酸总量显著高于A阶段(P<0.05);随着养殖时间的延长,大黄鱼背部肌肉的16种氨基酸组分大多呈增长趋势,但普遍无显著性差异(P>0.05),只有个别氨基酸组分,如谷氨酸C阶段是A阶段的1.283倍,是B阶段的1.200倍,C阶段的谷氨酸含量相比A、B阶段有显著性差异(P<0.05)。
2.2.2 亲鱼腹部肌肉氨基酸含量的变化 从表4可见:大黄鱼腹部氨基酸总含量B阶段最高,是A阶段的1.174倍,是C阶段的1.229倍,且各阶段间无显著性差异(P>0.05);必需氨基酸总量B阶段为A阶段的1.168倍,为C阶段的1.245倍,各阶段间也无显著性差异(P>0.05);非必需氨基酸含量、呈味氨基酸含量均是B阶段>A阶段>C阶段,各阶段间也无显著性差异(P>0.05);在养殖期间,大黄鱼雌性亲鱼腹部肌肉的16种氨基酸组分均呈先增长后降低的趋势,但普遍阶段间无显著性差异(P>0.05),只有个别氨基酸如缬氨酸B阶段、C阶段的含量分别是A阶段的2.97倍和2.426倍,且B、C阶段显著高于A阶段(P<0.05),B、C阶段间无显著性差异(P>0.05)。
2.3 不同养殖阶段大黄鱼雌性亲鱼肌肉脂肪酸含量的变化
2.3.1 亲鱼背部肌肉脂肪酸含量的变化 从表5可见:不同养殖阶段的大黄鱼雌性亲鱼背部肌肉脂肪酸总量、饱和脂肪酸、不饱和脂肪酸、单不饱和脂肪酸、多不饱和脂肪酸、高不饱和脂肪酸、EPA+DHA含量随养殖时间的延长均呈增长趋势,且均为C阶段>B阶段>A阶段;脂肪酸总量、不饱和脂肪酸、单不饱和脂肪酸含量均为C阶段显著高于B阶段(P<0.05),B阶段显著高于A阶段(P<0.05),多不饱和脂肪酸、高不饱和脂肪酸、EPA+DHA含量均为C阶段略高于B阶段,二者均显著高于A阶段(P<0.05);C16∶0、C18∶1n9c含量均为C阶段>B阶段>A阶段,且各阶段之间有显著性差异(P<0.05);C20∶4n6(ARA)含量 B、C阶段分别是A阶段的2.579、2.333倍,C20∶5n3(EPA)含量B、C阶段分别是A阶段的 1.627、1.474倍,3阶段间ARA、EPA均无显著性差异(P>0.05);C22∶6n3(DHA)含量B、C阶段分别是A阶段的1.655、1.856倍,B、C阶段显著高于A阶段(P<0.05)。
2.3.2 亲鱼腹部肌肉脂肪酸含量的变化 从表6可见:不同养殖阶段大黄鱼亲鱼雌性亲鱼腹部肌肉脂肪酸总量、饱和脂肪酸、不饱和脂肪酸、多不饱和脂肪酸和高不饱和脂肪酸含量总体呈增长趋势,总脂肪酸含量和饱和脂肪酸含量均为C阶段显著高于B阶段(P<0.05),B阶段显著高于A阶段(P<0.05);不饱和脂肪酸含量、单不饱和脂肪酸含量、高不饱和脂肪酸、EPA+DHA含量均为C、B阶段显著高于A阶段(P<0.05);C14∶0、C17∶0、C18∶0、C22∶1n9含量在3个时间段上呈先升后下降的趋势,B、C阶段显著高于A阶段(P<0.05),但B、C阶段间无显著性差异(P>0.05);C16∶0含量为B阶段>C阶段>A阶段,且各阶段间有显著性差异(P<0.05);C20∶4n6(ARA)含量 B、C阶段是A阶段的2.169、2.205倍;C20∶5n3(EPA)含量B、C阶段分别是A阶段的1.088、2.972倍,C阶段显著高于A、B阶段(P<0.05);C22∶6n3(DHA)含量B、C阶段分别是A阶段2.776、2.404倍,B、C阶段显著高于A阶段(P<0.05);其余脂肪酸含量在养殖期间普遍呈增长趋势。
表3 不同养殖阶段大黄鱼雌性亲鱼背部肌肉氨基酸分析(以鲜基计,n=3)
Tab.3 Amino acid contents in dorsal muscles of female large yellow croaker Pseudosciaena crocea in different breeding stages %

氨基酸amino acid养殖阶段breeding stageABC天门冬氨酸(ASP)○1.590±0.147a1.603±0.185a1.863±0.156a丝氨酸(SER) 0.563±0.126a0.640±0.220a0.760±0.135a谷氨酸(GLU)○2.187±0.163a2.340±0.201a2.807±0.192b脯氨酸(PRO) 0.493±0.070a0.627±0.125a0.603±0.184a甘氨酸(GLY)○0.717±0.111a0.853±0.095a0.993±0.199a丙氨酸(ALA)○1.040±0.276a0.983±0.230a1.163±0.166a酪氨酸(TYR) 0.520±0.066a0.537±0.121a0.660±0.132a苏氨酸(THR)★0.770±0.187a0.770±0.252a0.933±0.291a缬氨酸(VAL)★0.780±0.223a0.730±0.082a0.897±0.427a蛋氨酸(MET)★0.533±0.085a0.527±0.097a0.643±0.159a异亮氨酸(ILE)★0.707±0.147a0.653±0.093a0.783±0.147a亮氨酸(LEU)★1.313±0.105a1.233±0.194a1.440±0.120a苯丙氨酸(PHE)★0.533±0.139a0.782±0.225a0.753±0.135a赖氨酸(LYS)★1.470±0.141a1.537±0.230a1.753±0.097a组氨酸(HIS)★0.317±0.126a0.273±0.075a0.337±0.120a精氨酸(ARG)★○0.960±0.085a0.977±0.231a1.090±0.121a氨基酸总量 TAA14.493±1.626a15.065±1.798a17.480±1.187a非必需氨基酸总量 NEAA7.383±0.687a7.481±1.253a8.630±0.411a必需氨基酸总量EAA7.110±0.940a7.583±0.545ab8.850±0.826b呈味氨基酸总量FAA6.493±0.765a6.757±0.760a7.917±0.267b
注:同行中标有不同小写字母者表示组间有显著性差异(P<0.05),标有相同小写字母者表示组间无显著性差异(P>0.05);★为必需氨基酸,○为呈味氨基酸,下同
Note: The means with different letters within the same line are significantly different among the groups at the 0.05 probability level, and the means with the same letters within the same line are not significant differences;★ represents essential amino acid, and ○ represents flavor amino acid,et sequentia
表4 不同养殖阶段大黄鱼雌性亲鱼腹部肌肉氨基酸分析(以鲜基计,n=3)
Tab.4 Amino acid of contents in abdominal muscles in female large yellow croaker Pseudosciaena crocea in different breeding stage %

氨基酸amino acid养殖阶段breeding stageABC天门冬氨酸(ASP)○1.543±0.297a1.620±0.286a1.473±0.255a丝氨酸(SER) 0.600±0.155a0.720±0.265a0.677±0.283a谷氨酸(GLU)○2.117±0.235a2.430±0.207a2.120±0.225a脯氨酸(PRO) 0.730±0.181a0.833±0.156a0.553±0.119a甘氨酸(GLY)○1.077±0.262a1.340±0.330a0.897±0.245a丙氨酸(ALA)○1.073±0.390a1.267±0.195a1.027±0.184a酪氨酸(TYR) 0.537±0.106a0.760±0.220a0.460±0.225a苏氨酸(THR)★0.697±0.075a0.763±0.215a0.687±0.191a缬氨酸(VAL)★0.267±0.083a0.793±0.225b0.647±0.115b蛋氨酸(MET)★0.503±0.150a0.530±0.121a0.507±0.151a异亮氨酸(ILE)★0.720±0.165a0.667±0.315a0.607±0.110a亮氨酸(LEU)★1.260±0.246a1.433±0.272a1.153±0.160a苯丙氨酸(PHE)★0.627±0.120a0.800±0.183a0.660±0.229a赖氨酸(LYS)★1.353±0.285a1.500±0.173a1.210±0.105a组氨酸(HIS)★0.310±0.105a0.417±0.221a0.273±0.081a精氨酸(ARG)★○1.063±0.133a1.120±0.212a0.873±0.156a氨基酸总量 TAA14.477±2.109a16.993±2.866a13.823±1.938a非必需氨基酸总量 NEAA6.800±0.888a7.953±0.983a6.617±0.771a必需氨基酸总量 EAA7.677±1.221a8.970±1.606a7.207±1.667a呈味氨基酸总量 FAA6.873±1.050a7.727±1.218a6.390±0.702a
3 讨论
3.1 营养强化对亲鱼肌肉氨基酸的影响
氨基酸含量是亲鱼营养健康的重要指标之一,是水生动物胚胎发育过程中重要的能量来源,也是幼体组织和器官发育的重要物质基础[13],而亲鱼肌肉的氨基酸含量是评价亲鱼营养健康的重要依据。本研究中发现,大黄鱼背部氨基酸总量、必需氨基酸总量在养殖过程中均有所增长,仅C阶段的背部肌肉必需氨基酸总量显著高于A阶段。腹部肌肉非必需氨基酸、必需氨基酸、呈味氨基酸含量A、B、C 3阶段均先增加后减少,且各阶段间无显著性差异,可见采用冰鲜饵料或鲜活饵料,辅以强化剂的亲鱼强化模式,对大黄鱼肌肉必需氨基酸和氨基酸总含量影响不大。这与王际英等[14]、黄旭雄等[15]、周飘苹等[6]的研究结果相符合,随着性腺的成熟,亲鱼肌肉中氨基酸含量较为稳定。此外,在本研究中发现,大黄鱼腹部肌肉的必需氨基酸含量C阶段低于B阶段,这可能是因为机体中卵巢的发育需要大量的营养物质,而在营养需要的情况下,机体自主动用了腹部肌肉贮存的营养物质,使得腹部肌肉中的必需氨基酸含量减少,符合Gunasekera等[16]研究得出的亲鱼在发育过程中常从肌肉中动用必需氨基酸进行“母体补偿”的研究结果。
表5 不同养殖阶段大黄鱼雌性亲鱼背部肌肉脂肪酸分析(以鲜基计,n=3)
Tab.5 Fatty acid in dorsal muscles of female large yellow croaker Pseudosciaena crocea in different breeding stages %

脂肪酸fatty acid养殖阶段breeding stageABCC14∶00.153±0.045a0.307±0.133ab0.373±0.043bC15∶00.027±0.011a0.043±0.015a0.078±0.007bC16∶01.480±0.177a2.440±0.425b3.743±0.355cC17∶00.043±0.015a0.057±0.021a0.078±0.017aC18∶00.433±0.199a0.437±0.221a0.742±0.007aC20∶00.033±0.006a0.043±0.006a0.047±0.008aC22∶00.011±0.002a0.017±0.011a0.010±0.006aC16∶1n7 ∗△0.570±0.197a0.967±0.345ab1.481±0.208bC18∶1n9c∗△1.523±0.233a2.200±0.206b3.960±0.357cC20∶1∗△0.103±0.049a0.240±0.108ab0.341±0.085bC22∶1n9∗△0.014±0.006a0.021±0.010a0.189±0.024bC24∶1n9∗△0.033±0.006a0.040±0.011a0.083±0.009bC18∶2n6c∗●0.783±0.172a1.013±0.193a0.777±0.089aC18∶3n3∗●0.120±0.036a0.132±0.046a0.185±0.036aC20∶2∗●0.043±0.015a0.021±0.009a0.074±0.016bC20∶3n6∗●☆/0.012±0.004a0.025±0.008bC20∶3n3 ∗●☆/0.023±0.015a0.045±0.005bC20∶4n6(ARA)∗●☆0.057±0.031a0.147±0.081a0.133±0.026aC22∶2n6∗●0.030±0.010a0.047±0.021a0.055±0.016aC20∶5n3(EPA)∗●☆0.287±0.110a0.467±0.168a0.423±0.099aC22∶6n3(DHA)∗●☆0.743±0.202a1.230±0.225b1.379±0.026b饱和脂肪酸SFA2.181±0.450a3.334±0.818a5.071±0.386b不饱和脂肪酸UFA4.307±1.042a6.556±1.078b9.146±0.610c单不饱和脂肪酸MUFA2.244±0.489a3.468±0.633b6.109±0.165c多不饱和脂肪酸PUFA2.063±0.555a3.092±0.452b3.096±0.469b高不饱和脂肪酸HUFA1.087±0.342a1.878±0.171b2.006±0.374bEPA+DHA1.030±0.311a1.697±0.072b1.802±0.356b脂肪酸总量 total FA6.488±0.492a9.904±1.89b14.221±0.966c
注:*为不饱和脂肪酸;△为单不饱和脂肪酸;●为多不饱和脂肪酸;☆为高不饱和脂肪酸;/表示未检出,下同
Note: * represents unsaturated fatty acid; △ represents monounsaturated fatty acid; ● represents polyunsaturated fatty acids; ☆ represents highly unsaturated fatty acid;/ represents negative, et sequentia
表6 不同养殖阶段大黄鱼雌性亲鱼腹部肌肉脂肪酸分析(以鲜基计,n=3)
Tab.6 Fatty acid in abdominal muscles of female large yellow croaker Pseudosciaena crocea in different breeding stage %

脂肪酸fatty acid养殖阶段breeding stageABCC14∶00.150±0.066a0.688±0.232b0.563±0.274bC15∶00.020±0.010a0.101±0.026a5.387±0.437bC16∶01.050±0.296a5.294±0.522c1.973±0.296bC17∶00.040±0.01a0.098±0.021b0.085±0.018bC18∶00.297±0.139a1.039±0.211b0.973±0.331bC20∶00.023±0.006a0.045±0.020ab0.067±0.04bC22∶0//2.157±0.146C14∶1n5 ∗△/0.012±0.007a0.015±0.006aC16∶1n7 ∗△0.363±0.078a1.916±0.329b0.097±0.021aC18∶1n9c∗△0.973±0.248a4.688±0.917b5.327±0.315bC20∶1 ∗△0.137±.081a0.422±0.107b0.437±0.110bC22∶1n9∗△0.014±0.006a0.296±0.243b0.243±0.107bC24∶1n9∗△0.050±0.026a0.130±0.004a0.087±0.031aC18∶2n6c∗●0.617±0.224b0.021±0.008a2.157±0.184cC18∶3n6 ∗●0.014±0.006a0.210±0.040b0.360±0.288bC18∶3n3∗●0.087±0.038a0.159±0.047a0.267±0.160aC20∶2 ∗●0.057±0.031a0.077±0.029a0.080±0.026aC20∶3n6 ∗●☆/0.027±0.008a0.020±0.010aC20∶3n3∗●☆/0.045±0.008a0.043±0.015aC20∶4n6(ARA)∗●☆0.083±0.032a0.180±0.027a0.183±0.131aC22∶2n6∗●0.030±0.010a0.066±0.013b0.090±0.026bC20∶5n3(EPA)∗●☆0.250±0.095a0.272±0.335a0.743±0.210bC22∶6n3(DHA) ∗●☆0.757±0.215a2.102±0.048b1.820±0.177b饱和脂肪酸SFA1.580±0.475a7.265±1.001b11.205±1.528c不饱和脂肪酸UFA3.432±0.789a10.611±1.980b11.954±1.268b单不饱和脂肪酸MUFA1.537±0.160a7.464±1.540b6.206±0.510b多不饱和脂肪酸 PUFA1.895±0.645a3.159±0.525a5.763±0.758b高不饱和脂肪酸HUFA1.090±0.338a2.569±0.477b2.810±0.131bEPA+DHA1.007±0.311a2.374±1.502b2.563±0.051b脂肪酸总量 total FA5.012±1.262a17.876±2.911b23.159±2.791c
3.2 营养强化对亲鱼肌肉脂肪酸的影响
脂肪酸是鱼类组织细胞的组成成分,也是鱼类生长发育及幼体繁育的必需营养物质,其中必需脂肪酸,特别是 n-3 高度不饱和脂肪酸(n-3 HUFA)作为组成生物膜的重要结构组分和转运因子,对胚胎发育进程及早期仔鱼的存活至关重要[17]。本研究中,通过为期4个月的营养强化,大黄鱼腹部肌肉的脂肪酸含量在养殖期间逐渐增长,其中脂肪酸总量B阶段是A阶段的3.17倍,C阶段是B阶段的1.30倍。笔者认为,在亲鱼整个养殖阶段中,大黄鱼腹部脂肪酸,前期蓄积能力较强,后期增长量有所下降,这是因为腹部肌肉中的脂肪酸有部分已用于性腺发育所需,这与施兆鸿等[18]的研究结果符合,处于繁殖季节的灰鲳Pampus cinereus雌亲鱼,其组织中脂肪酸等营养和能量会优先供给以保障卵巢发育;与黄旭雄等[19]的研究也相似,银鲳Pampus argenteus亲鱼在性腺发育过程中,必需脂肪酸会从肌肉和肝脏向性腺中转移。
此外,本研究中在亲鱼强化过程中,将配合饲料改为冰鲜或鲜活饵料投喂后,大黄鱼背部肌肉C14∶0、C16∶0、C16∶1n7、C22∶6n3(DHA)含量B、C阶段显著高于A阶段,机体内影响海水幼鱼发育的C20∶4n6(ARA)、C22∶6n3(DHA)、C20∶5n3(EPA)等3种必需脂肪酸也均呈不同程度的增长。可见,此种亲鱼培育模式,可显著提高大黄鱼雌性亲鱼肌肉中的不饱和脂肪酸、多不饱和脂肪酸、高不饱和脂肪酸、EPA+DHA含量。这可能是因为大黄鱼的脂肪酸组成与其摄食的饵料息息相关[20-22],而冰鲜及鲜活饵料等可优化鱼类的脂质代谢和生长性能[23-24]。本研究结果还发现,大黄鱼背部和腹部肌肉中的DHA、EPA、ARA含量变化不一,造成此结果的原因可能是因为DHA、EPA、ARA等必需脂肪酸会从肌肉和肝脏向性腺中转移,且在同一组织中不同脂肪类别间存在一定程度的转移造成的[19]。
[1] 颜孙安,姚清华,林香信,等.不同养殖模式大黄鱼肌肉营养成分比较[J].福建农业学报,2015,30(8):736-744.
[2] 王武.鱼类增养殖学[M].北京:中国农业出版社,2000:167-171.
[3] 常青,梁萌青,薛华,等.亲鱼营养的研究进展[J].海洋水产研究,2002,23(2):65-71.
[4] Watanabe T,Vassallo-Agius R.Broodstock nutrition research on marine finfish in Japan[J].Aquaculture,2003,227(1-4):35-61.
[5] 高有领,江玲丽,徐旭栋,等.饵料类型对岱衢族大黄鱼鱼体和肌肉营养成分、体色、肉色的影响[J].动物营养学报,2014,26(9):2874-2882.
[6] 周飘苹,金敏,吴文俊,等.不同养殖模式、投喂不同饵料及不同品系大黄鱼营养成分比较[J].动物营养学报,2014,26(4):969-980.
[7] 李明云,郑岳夫,管丹东,等.大黄鱼四家系肌肉营养成分差异及品质选育分析[J].水产学报,2009,33(4):632-638.
[8] 李桑,陈春燕,黄旭雄,等.植物油部分替代饲料中鱼油对大黄鱼脂肪及脂肪酸的影响[J].上海海洋大学学报,2015,24(5):726-736.
[9] Duan Qingyuan,Mai Kangsen,Shentu Jikang,et al.Replacement of dietary fish oil with vegetable oils improves the growth and flesh quality of large yellow croaker (Larmichthys crocea)[J].Journal of Ocean University of China,2014,13(3):445-452.
[10] 郑美芬.岱衢族大黄鱼室内人工育苗技术的研究[J].河北渔业,2006(10):40-42.
[11] 邹记兴,常林,向文洲,等.点带石斑鱼的亲鱼培育、产卵受精和胚胎发育[J].水生生物学报,2003,27(4):378-384.
[12] 杨家坚,林勇,陈忠,等.斑鳠亲鱼营养饲料研制及培育效果的研究[J].内陆水产,2001(3):5-7.
[13] 霍湘,王安利,杨建梅.鱼类对氨基酸的吸收代谢与需求[J].水利渔业,2005,25(3):1-3,21.
[14] 王际英,李培玉,宋志东,等.野生和人工养殖褐牙鲆亲鱼不同组织氨基酸的比较[J].水产学报,2010,34(11):1736-1743.
[15] 黄旭雄,施兆鸿,李伟微,等.银鲳亲鱼不同组织的氨基酸及其随性腺发育的变化[J].水产学报,2009,33(2):278-287.
[16] Gunasekera R M,Shim K F,Lam T J.Influence of dietary protein content on the distribution of amino acids in oocytes,serum and muscle of Nile tilapia,Oreochromis niloticus (L.)[J].Aquaculture,1997,152(1-4):205-221.
[17] 王际英,苗淑彦,张利民,等.野生与人工养殖牙鲆亲鱼不同组织脂肪酸的比较[J].水产学报,2012,36(5):748-755.
[18] 施兆鸿,黄旭雄,李伟微,等.海捕灰鲳亲鱼不同组织中脂肪及脂肪酸分析[J].水产学报,2008,32(2):309-314.
[19] 黄旭雄,温文,危立坤,等.闽东海域银鲳亲鱼性腺发育后期脂类及脂肪酸蓄积特点[J].水产学报,2014,38(1):99-108.
[20] 段青源,钟惠英,斯列钢,等.网箱养殖大黄鱼与天然大黄鱼营养成分的比较分析[J].浙江海洋学院学报:自然科学版,2000,19(2):125-128.
[21] Watanabe T,Arakawa T,Kitajima C,et al.Effect of nutritional quality of broodstock diets on reproduction of red sea bream[J].Nippon Suisan Gakkaishi,1984,50(3):495-501.
[22] Fernãndez-Palacios H,Izquierdo M S,Robaina L,et al.Effect of n-3 HUFA level in broodstock diets on egg quality of gilthead sea bream (Sparus aurata L.)[J].Aquaculture,1995,132(3-4):325-337.
[23] 牛化欣,雷霁霖,常杰,等.冰鲜野杂鱼和商品饲料对大菱鲆生长、脂质代谢及抗氧化功能的影响[J].动物营养学报,2013,25(11):2696-2704.
[24] 朱择敏,马冬梅,白俊杰,等.配合饲料、冰鲜杂鱼对大口黑鲈生长和LPL基因mRNA表达的影响[J].大连海洋大学学报,2014,29(4):360-363.