滤食性贝类是中国重要的海水养殖类群之一,可摄食浮游动物、浮游植物、有机碎屑和细菌等。在自然环境中,Silina等[1]通过镜检虾夷扇贝Patinopecten yessoensis胃含物,认为浮游植物是其主要的食物来源;而Bustamante等[2]在研究滤食性贝类饵料来源时,发现海带对颗粒有机物(POM)的贡献(65%)远高于浮游植物(6%)。在滤食性贝类人工育苗中,均以单胞藻作为主要饵料,并以鸡蛋黄等作为辅助。但无论在自然环境中还是在人工育苗环节,各种饵料对滤食性贝类生长贡献情况尚有待进一步研究。
稳定同位素技术,被广泛应用于追踪食物网中有机物传递途径、判断不同食物对消费者贡献比例的研究中[2-3]。与传统的胃含物分析法相比,稳定同位素分析反映了消费者较长一段时间内消化、吸收的食物来源,其判别值是确定食物贡献率的重要参数,被认为具有较恒定的范围,即碳氮同位素判别值(Δ13C和Δ15N)分别为0~1.0‰、3.0‰~4.0‰[4-5],并已广泛应用于营养关系的研究中。然而DeNiro等[6]在研究食物对不同物种的碳同位素影响时,发现同位素判别值的平均值为0.8‰,但种间变化较大(0.6‰~2.7‰),即判别值具有物种特异性。除物种外,温度和饵料也是影响稳定同位素富集过程的重要因素。Bosley等[7]研究发现,温度变化会引起美洲拟鲽Pseudopleuronectes americanus碳氮稳定同位素转化周期的显著变化。Gamboa-Delgado等[8]用蛋白质含量不同的饲料投喂凡纳滨对虾Litopenaeus vannamei,发现其肌肉组织中Δ15N值存在显著性差异。Dubois等[9]研究表明,若忽略稳定同位素判别值的变化则会造成对食物贡献率的错误估计。目前,判别值的经验值仍被应用于野外调查研究[10-11],但有关判别值变化的研究也越来越受到关注[12-14]。本试验中,探讨了3种因素对滤食性贝类的碳氮稳定同位素判别值和半衰期的影响大小,以及各因素之间、相同因素不同水平之间的影响是否存在显著差异,旨在阐明营养级之间判别值的变化来源,丰富物种特异性判别值的科学数据,为进一步研究自然条件下滤食性贝类的饵料来源、贝类育苗阶段各饵料的贡献率奠定基础。
1 材料与方法
1.1 材料
试验用虾夷扇贝(壳高0.69 cm±0.11 cm,体质量0.03 g±0.02 g)、海湾扇贝Argopecten irradians(壳高0.82 cm±0.08 cm,体质量0.09 g±0.04 g)和太平洋牡蛎Crassostrea gigas(壳高1.02 cm±0.19 cm),均采自辽宁省大连市长海县小长山乡养殖海域,水温约21 ℃。饵料藻新月菱形藻Nitzschia closterium、小球藻Chlorella vulgaris、叉鞭金藻Dicrateria inornata密度分别为1.0×107、2.0×107、2.0×106cells/mL,均由大连市濒危海洋哺乳动物保护生物学重点实验室培养,并置于3 ℃条件下保存。
1.2 方法
1.2.1 试验设计及日常管理 将3种滤食性贝类暂养一周,剔除死亡个体,挑选健康个体用于正式试验。选取温度(6、14、23 ℃),饵料(新月菱形藻、小球藻、叉鞭金藻),贝类(虾夷扇贝、海湾扇贝、太平洋牡蛎),按L9(33)正交试验方法设计9组(表1),每组设置3个平行。每个试验均在独立的玻璃钢水槽(容积为10 L)中进行,每个水槽放试验贝约200枚。将室温组(23 ℃)继续暂养,待低温组(6 ℃和14 ℃)以每天降温2 ℃降至设定温度时,对所有试验组进行投喂。试验期间持续充氧,每12 h彻底换水一次,水源为经沉淀、沙滤后的海水,换水后进行投喂,投喂量均为200 mL,试验共进行62 d。另外,在3种温度下分别设置3种贝类的饥饿组,始终不投饵,其他日常管理与试验组完全相同。
表1 正交试验因素及水平
Tab.1 Factors and levels of the orthogonal test

水平level因素 factor物种species饵料diet温度/℃temperature1虾夷扇贝P.yessoensis新月菱形藻N.closterium62太平洋牡蛎C.gigas小球藻C.vulgaris143海湾扇贝A.irradians叉鞭金藻D.inornata23
1.2.2 样品处理 将开始投喂日设为第0 天,分别在第0、11、20、26、38、50、62天时从每槽各取10枚,测量壳高、体质量后,取其软体部组织在60 ℃下烘干24 h,测定干质量后用玛瑙研钵研磨成粉末,经100目筛绢网过滤,作为贝类稳定同位素样品,同时在各时间点取用玻璃纤维滤膜抽滤的3种饵料藻,在60 ℃下烘干24 h,作为藻类稳定同位素样品,用于碳氮稳定同位素比值(δ15N和δ13C)的测定。
1.2.3 碳氮稳定同位素的测定 所有样品的δ15N、δ13C值在辽宁省海洋水产科学研究院稳定同位素实验室进行测定。稳定同位素质谱仪为Delta V Advantage,元素分析仪为Flash 2000 HT。δ13C、δ15N的标准分别为PDB(Pee Dee Belemnite)和N2[15]。碳、氮稳定同位素的比率(‰)表示为
δR=[(Xsample /Xstandard)-1]×1000。
其中:R代表13C或15N;X代表13C/12C或15N/14N。每个样品测定3个平行样,每测定10个样品后插测1个标准样。δ15N、δ13C精密度<±0.15‰。
1.2.4 指标计算 应用指数衰减曲线对同位素的特征变化与时间进行拟合:
y=b+ae(-λt)。
其中:t为时间(d);y为t时各组织的δ13C或δ15N值;b为组织同位素渐进值;a为初始与平衡条件间的差异;λ为C或N同位素的转化率。
判别值[16]、半衰期和生长率计算公式为
c=b-DV,
半衰期t1/2=ln(2)/λ,
生长率R=Wf /Wi。
其中:c为判别值;DV为饵料的同位素值;t1/2为半衰期(d);R为试验贝类生长率;Wi 、Wf分别为试验第0 天、第62 天时单枚贝类软体部干质量(g)。
1.3 数据处理
试验结果用平均值±标准差表示。采用SPSS 13.0软件进行方差分析,采用SigmaPlot 13.0软件进行生长曲线拟合。
2 结果与分析
2.1 3种滤食性贝类的生长情况
试验期间,饥饿组3种贝类的软体部干质量均较其他组织显著下降(P<0.05),且不同温度不同物种饥饿组生长率均为0.25~0.50,故表2中仅列出一组数据(3个温度下的平均值)。从表2可见:试验组3种滤食性贝类均生长缓慢,壳高均未发生显著变化(P>0.05);虾夷扇贝和海湾扇贝的体质量也未发生显著变化(P>0.05),太平洋牡蛎由于幼贝附着生长,故不能准确称量其体质量。同一种贝类在不同温度下的生长率均无显著性差异(P>0.05)。
表2 试验组3种贝类生长情况
Tab.2 Growth of the three mollusk species in the experiment
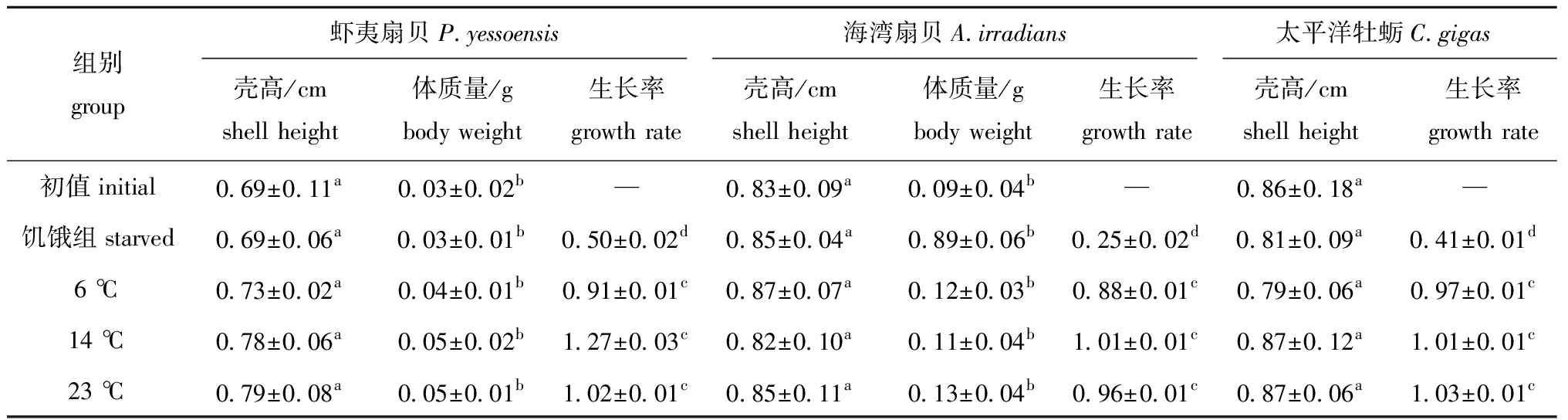
组别group虾夷扇贝P.yessoensis海湾扇贝A.irradians太平洋牡蛎C.gigas壳高/cmshell height体质量/gbody weight生长率growth rate壳高/cmshell height体质量/gbody weight生长率growth rate壳高/cmshell height生长率growth rate初值initial0.69±0.11a0.03±0.02b—0.83±0.09a0.09±0.04b—0.86±0.18a—饥饿组starved0.69±0.06a0.03±0.01b0.50±0.02d0.85±0.04a0.89±0.06b0.25±0.02d0.81±0.09a0.41±0.01d6 ℃0.73±0.02a0.04±0.01b0.91±0.01c0.87±0.07a0.12±0.03b0.88±0.01c0.79±0.06a0.97±0.01c14 ℃0.78±0.06a0.05±0.02b1.27±0.03c0.82±0.10a0.11±0.04b1.01±0.01c0.87±0.12a1.01±0.01c23 ℃0.79±0.08a0.05±0.01b1.02±0.01c0.85±0.11a0.13±0.04b0.96±0.01c0.87±0.06a1.03±0.01c
注:同列中标有不同小写字母者表示组间有显著性差异(P<0.05),标有相同小写字母者表示组间无显著性差异(P>0.05)
Note:The means with different letters within the same column are significantly different in the groups at the 0.05 probability level, and the means with the same letters within the same column are not significant differences
2.2 3种滤食性贝类和饵料的稳定同位素变化情况
试验期间,饥饿组贝类和饵料的碳氮稳定同位素变化如表3所示。由于不同温度下饥饿组贝类稳定同位素变化无显著性差异(P>0.05),故表3仅列出一组数据(3个温度下的平均值)。从表3可见:试验期间饥饿组3种贝类和3种饵料的δ13C值均未发生显著变化(P>0.05);而δ15N值在第30、62天时变化显著(P<0.05)。饥饿组虾夷扇贝、海湾扇贝和太平洋牡蛎δ15N值分别由初始的6.55‰、6.02‰和5.13‰显著增加为第62天时的7.23‰、6.98‰和6.19‰(P<0.05);新月菱形藻、叉鞭金藻和小球藻δ15N值分别由初始的12.87‰、8.69‰、7.70‰显著增加为第62天时的15.31‰、10.30‰、9.86‰(P<0.05)。由此可知,δ13C符合试验要求,而δ15N值波动较大,无法满足试验要求,故以下试验中均省略δ15N值。
表3 试验期间饥饿组贝类(n=10)及饵料(n=3)的碳氮稳定同位素变化情况
Tab.3 Changes in δ13C and δ15N values in the mollusks starved(n=10) and food algae (n=3) in the experiment

物种species碳稳定同位素值δ13C/‰氮稳定同位素值δ15N/‰0 d30 d62 d0 d30 d62 d虾夷扇贝P.yessoensis-21.59±0.15a-21.50±0.20a-21.43±0.10a6.55±0.13b6.89±0.11c7.23±0.09d海湾扇贝 A.irradians-21.73±0.21a-21.66±0.06a-21.59±0.23a6.02±0.20b6.76±0.20c6.98±0.13d太平洋牡蛎C.gigas-22.87±0.40a-22.56±0.30a-21.79±0.11a5.13±0.30b5.80±0.43c6.19±0.19d新月菱形藻 N.closterium-20.79±0.14a-20.68±0.09a-20.70±0.08a12.87±0.33b10.69±0.29c15.31±0.48d叉鞭金藻D.inornata-15.69±0.09a-15.63±0.08a-15.76±0.08a8.69±0.36b9.37±0.19c10.30±0.31d小球藻 C.vulgaris-19.50±0.11a-19.44±0.10a-19.48±0.09a7.70±0.40b6.62±0.31c9.86±0.25d
注:同行中标有不同小写字母者表示同一指标不同时间点有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同
Note:The means with different letters in the same line are significantly different in different time in the same index at the 0.05 probability level, and the means with the same letters are not significant differences, et sequentia
试验期间,试验组碳稳定同位素随时间的变化如图1和表4所示。从表4可见:第0天时,6 ℃下虾夷扇贝、海湾扇贝和太平洋牡蛎软体部的δ13C值分别为-21.59‰、-21.73‰和-22.87‰,第62天时,6 ℃下虾夷扇贝、海湾扇贝和太平洋牡蛎软体部δ13C的渐进值分别为-20.40‰、-21.52‰和-21.34‰,判别值分别为0.40‰、-5.57‰和-1.89‰,半衰期分别为10.24、49.16、21.13 d;14 ℃时,虾夷扇贝、海湾扇贝和太平洋牡蛎软体部δ13C的渐进值分别为-15.97‰、-20.28‰和-21.36‰,判别值分别为-0.20‰、-0.65‰和-0.56‰,半衰期分别为19.92、12.79、10.71 d;23 ℃时,虾夷扇贝、海湾扇贝和太平洋牡蛎δ13C的渐进值分别为-18.82‰、-19.28‰和-19.05‰,判别值分别为0.81‰、1.75‰和-3.51‰,半衰期分别为10.05、11.09、21.33 d。
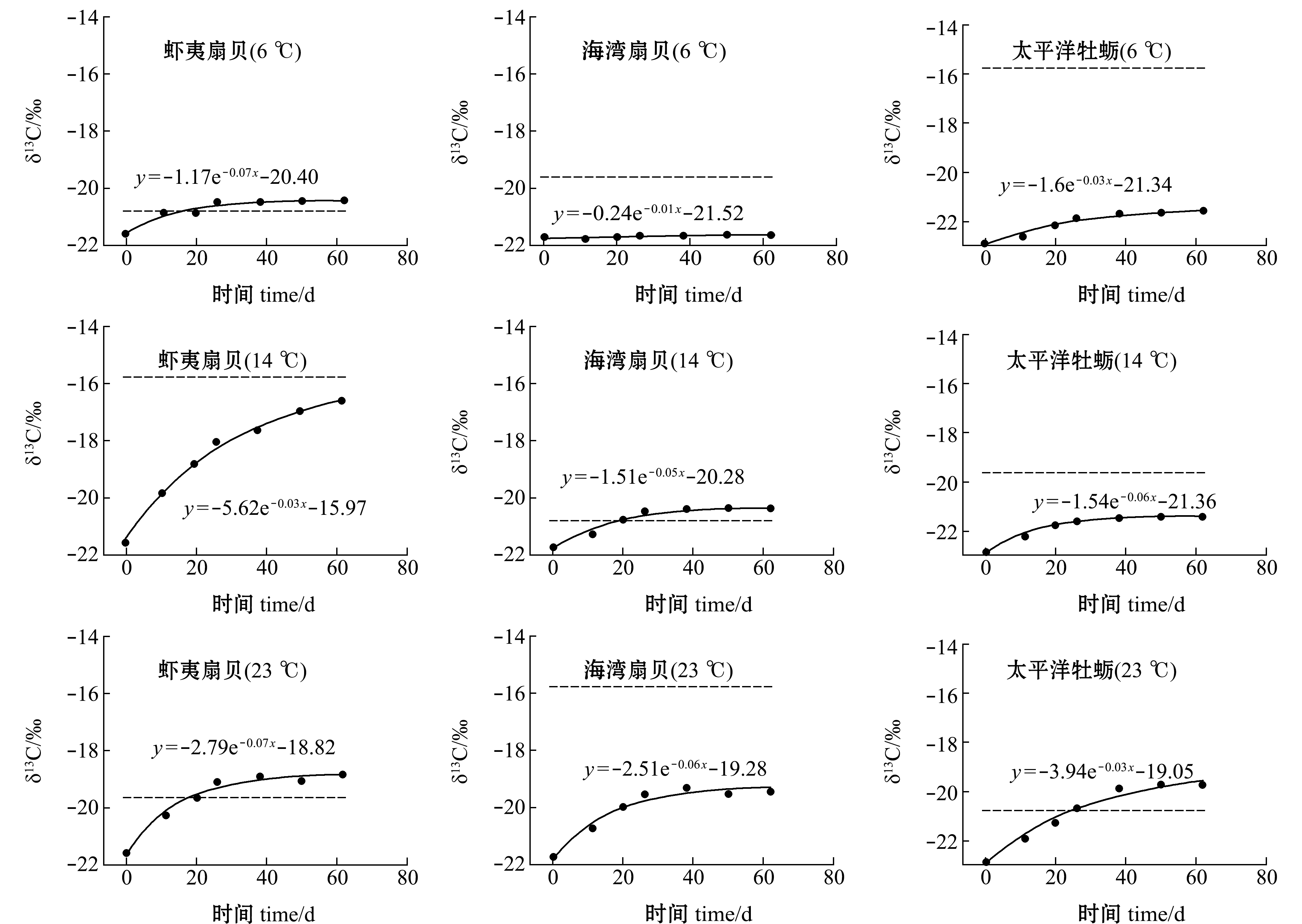
注:拟合曲线代表试验贝类δ13C随时间的变化情况;虚线代表饵料δ13C随时间变化的情况,因试验期间饵料碳稳定同位素值变化较小,故以平均值表示
Note: Fitting curves mean the δ13C changes in the three mollusk species during the experiment; dashed lines indicate the δ13C changes which are shown by mean value during the experiment due to no significant different in δ13C values in diets
图1 不同温度下3种贝类碳稳定同位素值随时间的变化
Fig.1 δ13C values changes with time in the three mollusk species at the different temperatures during the experiment
表4 贝类组织碳稳定同位素值和判别值的正交试验设计及试验结果
Tab.4 Design and results of the orthogonal test for carbon stable isotope in mollusk tissues
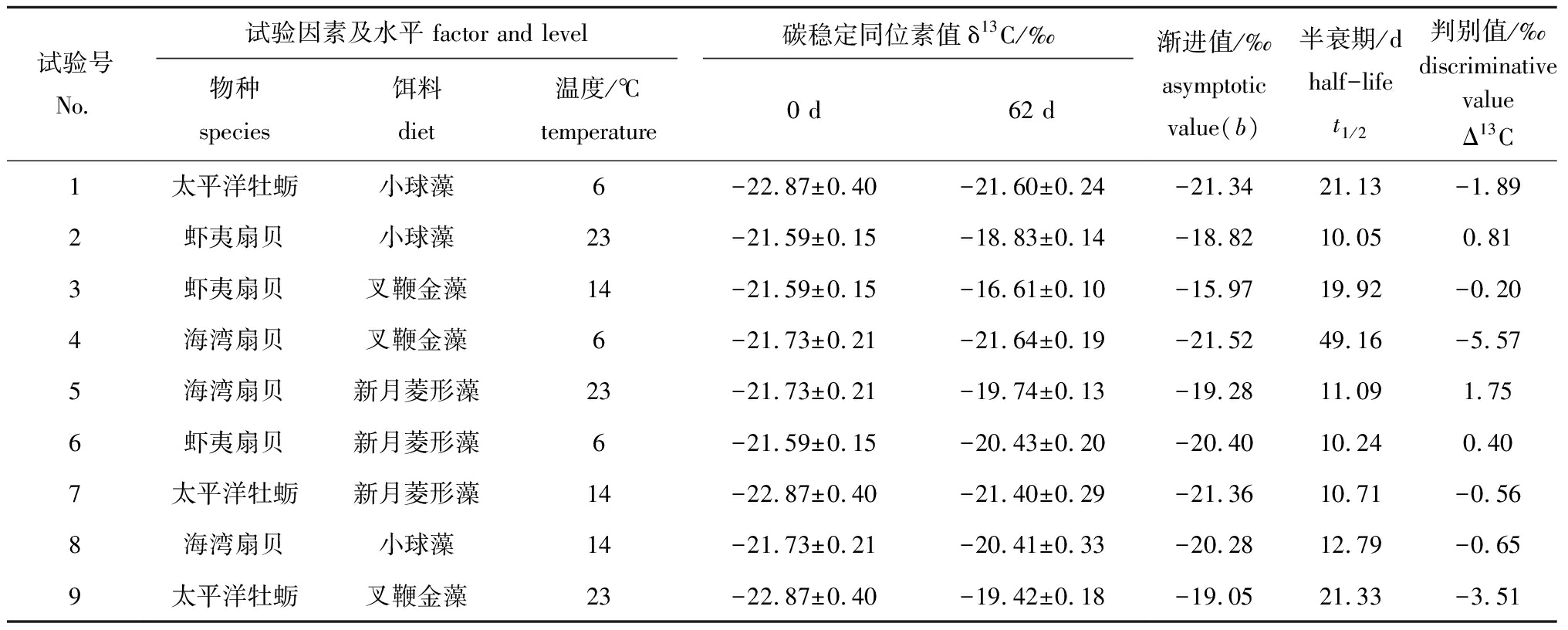
试验号No.试验因素及水平 factor and level碳稳定同位素值δ13C/‰物种species饵料diet温度/℃temperature0 d62 d渐进值/‰asymptotic value(b) 半衰期/dhalf-lifet1/2判别值/‰ discriminative value Δ13C1太平洋牡蛎小球藻6-22.87±0.40-21.60±0.24-21.3421.13-1.892虾夷扇贝小球藻23-21.59±0.15-18.83±0.14-18.8210.050.813虾夷扇贝叉鞭金藻14-21.59±0.15-16.61±0.10-15.9719.92-0.204海湾扇贝叉鞭金藻6-21.73±0.21-21.64±0.19-21.5249.16-5.575海湾扇贝新月菱形藻23-21.73±0.21-19.74±0.13-19.2811.091.756虾夷扇贝新月菱形藻6-21.59±0.15-20.43±0.20-20.4010.240.407太平洋牡蛎新月菱形藻14-22.87±0.40-21.40±0.29-21.3610.71-0.568海湾扇贝小球藻14-21.73±0.21-20.41±0.33-20.2812.79-0.659太平洋牡蛎叉鞭金藻23-22.87±0.40-19.42±0.18-19.0521.33-3.51
2.3 正交试验结果分析
由极差分析可知(表5),各因素对碳稳定同位素转化周期的影响由大到小为温度(12.75)>物种(10.95)>饵料(8.52),而各因素对试验贝类Δ13C的影响程度极为接近。方差分析表明,物种、饵料和温度不同水平之间,贝类组织的碳稳定同位素转化周期和判别值的变化均不显著(P>0.05)。从生物学角度分析,Δ13C值为-5.57‰~1.75‰,已超出经验值0~1.0‰的范围。
表5 正交试验结果分析
Tab.5 Result analysis of the orthogonal test

水平 level半衰期t1/2/d判别值|Δ13C|/‰物种species饵料diet温度temperature物种species饵料diet温度temperatureI40.2144.3680.741.412.807.86II73.0469.9243.426.053.261.41III53.1752.1442.477.889.286.07I113.4014.7926.910.470.932.62I224.3523.3114.472.021.090.47I317.7217.3814.162.633.092.02R10.958.5212.752.162.162.15方差分析 analysis of varianceP value0.3860.2670.1530.2040.1790.205
注:I为同一因素1水平的结果之和(II、III同理),I1为同一因素1水平结果的平均值(I2、I3同理);R为极差,即同一因素最小平均值与最大平均值之差
Note:I represents the sum of level 1 in the same factor (both II and III are the same), I1 represents the mean of level 1 in the same factor (both I2 and I3 are the same);R represents the range which is the difference between the maximal and minimal values.
3 讨论
3.1 试验贝类稳定同位素组成的影响因素
作为探索消费者间营养关系和有机物传递途径的重要工具,稳定同位素分析的应用备受关注[3]。动物组织稳定同位素组成受动物自身条件(种类、年龄等)与环境因素(食物、理化因素等)的综合影响。其中,食物的稳定同位素组成是捕食者稳定同位素组成的决定性因素[6, 17]。食物的改变,可通过新陈代谢和组织生长两个过程影响动物组织稳定同位素组成[18-21]。本研究中,投饵试验组贝类壳高、体质量和生长率均未发生显著变化,饵料主要通过新陈代谢影响试验贝类同位素组成,因此,能够影响新陈代谢的因素均可能影响试验贝类稳定同位素组成。
3.2 试验贝类及饵料稳定同位素变化情况
早期研究表明,消费者富集的食物中的重同位素(13C或15N),有较恒定的营养参数及碳氮判别值。尽管Δ13C 和 Δ15N可能会受物种、食物、环境及含氮排泄物等影响大幅变化,但由于稳定同位素室内饲喂试验周期较长、工作量大,故绝大多数野外生态学调查研究仍采用经验值,判别值的相关数据仍相当匮乏。其中,要保持滤食性动物饵料的同位素长期恒定更是非常困难。本研究中,3种饵料藻的氮稳定同位素比率变化幅度较大,因此,无法获得有效的氮稳定同位素判别值。研究表明,微藻在吸收![]() 和
和![]() 时,自身的氮稳定同位素特征会呈现迅速变化(几小时之内),并可能出现负的Δ15N值,无法满足试验要求[9]。因此,在以微藻为饵料的稳定同位素分馏研究中,要谨慎选择氮稳定同位素作为参考指标。
时,自身的氮稳定同位素特征会呈现迅速变化(几小时之内),并可能出现负的Δ15N值,无法满足试验要求[9]。因此,在以微藻为饵料的稳定同位素分馏研究中,要谨慎选择氮稳定同位素作为参考指标。
相比于Δ15N值,物种间的Δ13C值变化较小,一些研究甚至忽略物种间的Δ13C值,并将其设定为0‰用于混合模型。本研究中,Δ13C值为-5.57‰~1.75‰,已超过经验值0~1.0‰。Dubois等[9]在研究滤食性生物营养级间的同位素分馏时,发现太平洋牡蛎和紫贻贝Mytilus edulis的Δ13C是经验值的两倍,并证明仅凭经验值研究营养关系,会造成对饵料贡献率的错误估计。而Yokoyama等[22]在研究河口大型底栖动物组织与食物间同位素判别值的多样性时,发现以微藻投喂的四角蛤蜊Mactra veneriformis和菲律宾蛤仔Ruditapes philippinarum的Δ13C和Δ15N 值分别为 0.6‰~ 0.9‰ 和 3.4‰~ 3.6‰, 均在经验值范围内。由此可见,不同物种、不同栖息环境均可能引起试验贝类Δ13C的变化。
3.3 温度、物种和饵料对滤食性贝类碳稳定同位素分馏的影响
若所有消费者具有相似的同位素判别值,则会极大地促进稳定同位素技术研究,并阐明物种之间的营养关系。但生物的物种特异性[6]及环境参数,例如食物[8]、温度[7]等均可能对分馏造成影响,即所有影响新陈代谢的因素均可能影响分馏过程。因此,为更好地应用稳定同位素技术,需探究环境因素及物种与同位素分馏的关系,确定如何权衡各因素对同位素分馏的综合影响。为评估温度、饵料和物种对分馏的影响程度,本研究中进行了正交试验。结果表明,3种因素对碳稳定同位素t1/2的影响大小顺序为温度>物种>饵料,而对Δ13C的影响程度极为接近。
本研究表明,6 ℃时,试验组Δ13C范围为-5.57‰~0.40‰,与饥饿组的δ13C变化基本相同,并未受到饵料因素的影响。这可能是由于虾夷扇贝、海湾扇贝和太平洋牡蛎适宜生长温度均高于6 ℃,在低温条件下变温动物的新陈代谢会大幅减缓[23]。因此,6 ℃时3种试验贝类可能未有效摄入、吸收饵料藻,导致试验贝类未能与饵料达到稳定同位素平衡,进而影响了判别值的计算。本试验中,判别值绝对值的最大值(5.57‰)出现在6 ℃下投喂叉鞭金藻的海湾扇贝组,由于海湾扇贝新陈代谢缓慢,未能有效摄入或吸收叉鞭金藻,同时叉鞭金藻与试验贝类δ13C值的差距最大,进而造成该组判别值的绝对值为最大值。14 ℃时,适宜3种试验贝类生长,试验组Δ13C范围为-0.65‰~-0.20‰,判别值变化范围明显缩小。DeNiro等[6]报道,稳定同位素判别值具有物种特异性,Gorokhova等[24]研究发现,饵料同位素组成差异可影响稳定同位素分馏。23 ℃时,试验组Δ13C范围为-3.51‰~0.81‰,判别值变化范围较大。此温度不适宜虾夷扇贝生长,其死亡率明显升高;虽仍适宜海湾扇贝和太平洋牡蛎,但本试验中二者死亡率也明显升高。这可能是由于在高温条件下,试验贝类新陈代谢途径及速率发生变化,饵料品种单一、量少等原因限制了试验贝类的生长,进而使得物种和饵料对判别值的影响更加明显。
3.4 研究的指导意义与存在问题
稳定同位素室内控制试验,既有助于阐明物种间的营养关系,也为该技术的完善奠定了基础。本试验中发现,在应用判别值评估营养关系时,首先要考虑环境因素是否制约试验物种的新陈代谢,若环境因素(例如温度等)已严重减缓试验物种的新陈代谢,则无法有效评估营养关系;若环境因素适宜试验物种生长,则需先针对试验对象的潜在食物源进行长期、详细的调查,确定试验动物已与潜在食物源达到了稳定同位素平衡后,再考虑试验物种对饵料的分馏。同时,由本试验结果可以看出,室内控制试验仍存在局限性:试验期间,为满足饵料具有稳定的同位素值,饵料种类往往过于单一,有可能导致试验对象的营养不良,进而影响试验对象的稳定同位素分馏;室内控制试验周期较长,尤其对于水生动物而言,试验对象死亡率较高;室内控制试验得出的数据与自然环境中的真实情况是否完全吻合,如何将室内控制试验更好地服务于自然生态系统研究,需要室内与野外研究更多的结合、校正。总之,若要更加准确、精确地将稳定同位素技术应用于物种之间的营养关系研究,须充分考虑环境因素及物种特异性对判别值的影响,并且建立系统、科学的试验分析方法,而不能盲目使用经验值。
[1] Silina A V,Zhukova N V.Growth variability and feeding of scallop Patinopecten yessoensis on different bottom sediments: evidence from fatty acid analysis[J].Journal of Experimental Marine Biology and Ecology,2007,348(1):46-59.
[2] Bustamante R H,Branch G M.The dependence of intertidal consumers on kelp-derived organic matter on the west coast of South Africa[J].Journal of Experimental Marine Biology and Ecology,1996,196(1-2):1-28.
[3] Fry B.Stable Isotope Ecology[M].Heidelberg:Springer,2006.
[4] Peterson B J,Fry B.Stable isotopes in ecosystem studies[J].Annual Review of Ecology and Systematics,1987,18(1):293-320.
[5] Post D M.Using stable isotopes to estimate trophic position:models,methods,and assumptions[J].Ecology,2002,83(3):703-718.
[6] DeNiro M J,Epstein S.Influence of diet on the distribution of carbon isotopes in animals[J].Geochimica et Cosmochimica Acta,1978,42(5):495-506.
[7] Bosley K L,Witting D A,Chambers R C,et al.Estimating turnover rates of carbon and nitrogen in recently metamorphosed winter flounder Pseudopleuronectes americanus with stable isotopes[J].Marine Ecology Progress,2002,236(7):233-240.
[8] Gamboa-Delgado J,Vay L L.Natural stable isotopes as indicators of the relative contribution of soy protein and fish meal to tissue growth in Pacific white shrimp (Litopenaeus vannamei) fed compound diets[J].Aquaculture,2009,291(1):115-123.
[9] Dubois S,Jean-Louis B,Bertrand B,et al.Isotope trophic-step fractionation of suspension-feeding species:implications for food partitioning in coastal ecosystems[J].Journal of Experimental Marine Biology and Ecology,2007,351(2):121-128.
[10] 颜云榕,张武科,卢伙胜,等.应用碳、氮稳定同位素研究北部湾带鱼(Trichiurus lepturus)食性及营养级[J].海洋与湖沼,2012,43(1):192-200.
[11] 金波昌.池塘养殖刺参(Apostichopus japonicus)食物来源的稳定同位素法研究[D].青岛:中国海洋大学,2010.
[12] 周晖,陈刚,施钢,等.不同蛋白源对军曹鱼幼鱼碳、氮稳定同位素分馏的影响[J].热带海洋学报,2014,33(5):35-40.
[13] 张妙,陈新军,陈亚,等.黄颡鱼不同组织碳氮稳定同位素的周转与分馏研究[J].上海海洋大学学报,2016,25(6):822-830.
[14] 王媛,徐东坡,王小林,等.基于碳氮稳定同位素技术探究太湖北部湖区鲢、鳙食性差异[J].大连海洋大学学报,2017,33(5):579-602.
[15] Mariotti A.Atmospheric nitrogen is a reliable standard for natural 15N abundance measurements[J].Nature,1983,303(5919):685-687.
[16] Hobson K A,Bairlein F.Isotopic fractionation and turnover in captive garden warblers (Sylvia borin):implications for delineating dietary and migratory associations in wild passerines[J].Canadian Journal of Zoology,2003,81(9):1630-1635.
[17] Yoneyama T,Ohta Y,Ohtani T.Variations of natural 13C and 15N abundances in the rat tissues and their correlation[J].Radioisotopes,1983,32(7):330-332.
[18] Hobson K A,Clark R G.Assessing avian diets using stable isotopes I:turnover of 13C in tissues[J].The Condor,1992,94(1):181-188.
[19] Hesslein R H,Hallard K A,Ramlal P.Replacement of sulfur,carbon,and nitrogen in tissue of growing broad whitefish (Coregonus nasus) in response to a change in diet traced by d34S,d13C,and d15N[J].Canadian Journal of Fisheries and Aquatic Sciences,1993,50(6):2071-2076.
[20] Fry B,Arnold C.Rapid 13C/12C turnover during growth of brown shrimp (Penaeus aztecus)[J].Oecologia,1982,54(2):200-204.
[21] Herzka S Z,Holt G J.Changes in isotopic composition of red drum (Sciaenops ocellatus) larvae in response to dietary shifts:potential applications to settlement studies[J].Canadian Journal of Fisheries and Aquatic Sciences,2000,57(1):137-147.
[22] Yokoyama H,Tamaki A,Harada K,et al.Variability of diet-tissue isotopic fractionation in estuarine macrobenthos[J].Marine Ecology Progress Series,2005,296:115-128.
[23] Laurence G C.Laboratory growth and metabolism of the winter flounder Pseudopleuronectes americanus from hatching through metamorphosis at three temperatures[J].Marine Biology,1975,32(3):223-229.
[24] Gorokhova E,Hansson S.An experimental study on variations in stable carbon and nitrogen isotope fractionation during growth of Mysis mixta and Neomysis integer[J].Canadian Journal of Fisheries and Aquatic Sciences,1999,56(11):2203-2210.