花鳗鲡Anguilla marmorata隶属于鳗鲡目、鳗鲡科、鳗鲡属,为典型的洄游性鱼类,其鲜肉中蛋白质含量为11.4%,脂肪含量为5.08%,水分含量为77.94%,是一种高蛋白低脂肪鱼类[1],同时,花鳗鲡含有人体所需的多种必需氨基酸[2],营养丰富,经济价值极高。近年来,随着养殖规模不断扩大,集约化程度不断提高,养殖生产中病害的发生频率亦相应增加[3],与此同时,随着养殖过程中残饵、粪便等不断累积,水体中的氨氮、亚硝酸氮等有毒物质浓度逐渐增加,导致水质恶化,进而影响到养殖鱼体的生长。而未经处理的养殖废水直接排放,又进一步影响了水环境。
生物絮团技术是一种改善养殖生态环境的新技术,其原理就是无机氮的同化过程,水体中的异养细菌利用碳源将氨氮等转化为自身的蛋白质,同时与水中的颗粒物、细菌等形成养殖动物可以摄食的生物絮团[4-5],在改善水体环境[6]、降低换水量的同时,实现饵料的二次利用[7-8]。 此外,生物絮团技术还具有促进营养物质循环利用、提高养殖生物成活率和降低饵料系数等作用[9-10]。近年来,有关生物絮团技术的研究大多集中在罗非鱼、虾类、草鱼、团头鲂等水产养殖动物上[11-14],但在花鳗鲡养殖中则鲜有报道。本试验中,在花鳗鲡养殖中引入生物絮团技术,选择被广泛使用的淀粉作为碳源,探讨其在花鳗鲡养殖效果、水质变化、絮体形成和氮磷利用率等方面的作用,旨在为研究碳源对花鳗鲡养殖系统水质及生产性能的影响提供数据资料。
1 材料与方法
1.1 材料
试验用花鳗鲡购自福建吉祥花鳗渔业有限公司,尼罗罗非鱼Oreochromis niloticus购自海南新吉水产科技有限公司;蕹菜 Ipomoea aquatica Forsk购自当地菜场。
花鳗鲡饲料由福建高农饲料有限公司提供,为粉状饲料,玉米淀粉购自玉锋实业集团有限公司,木薯淀粉购自广西红枫淀粉有限公司。
1.2 方法
1.2.1 试验条件 试验在12个室内水泥池(5.0 m×3.0 m×1.2 m)中进行,养殖池在使用前进行清淤、洗刷并用高锰酸钾浸泡24 h消毒,清水冲洗完全后注入养殖用水,曝气1周后放入养殖对象,并在养殖池一侧放置一网箱(2 m×1 m×1 m),用于罗非鱼的养殖;最后放入带孔的聚乙烯泡沫板(1.0 m×1.2 m)作为载体种植蕹菜。根据花鳗鲡喜阴的生物学特点,在养殖池上方遮盖遮阳网(覆盖养殖池一侧,覆盖率约为50%)。整个试验在上海海洋大学滨海养殖基地进行,试验期间养殖用水抽取自养殖场附近的河道,经沉淀后使用,盐度为1。同时,配备一台增氧机,由纳米微孔曝气盘进行底部充气,每个养殖池设饵料台一个,置于遮阳网下,用于观察花鳗鲡的摄食及生长情况,投喂1 h后,捞取残饵并称重记录。
1.2.2 试验设计 试验设计方案如表1所示,从暂养池中随机挑选体色正常、规格一致、活力良好的花鳗鲡和罗非鱼于各个试验池中,花鳗鲡放养密度为120 ind./pond,规格约为141.5 g/ind.,罗非鱼的放养密度为16 ind./pond,规格约为74.5 g/ind.,并放入聚乙烯泡沫板,栽种蕹菜。每天6:00、18:00投饵,仅投喂花鳗鲡商品饲料,每池的日投喂量为花鳗鲡体质量的2%~3%,各池每次投喂量保持一致,具体投喂量根据天气、水温、水质、摄食情况等做适当调整,当C/N>10时,絮团的产生和降低氨氮效果最佳[15],考虑成本因素,试验组中两种淀粉的添加量为每千克饲料添加0.75 kg淀粉,试验组C/N值为12。每天记录各养殖池的投喂量、残饵量及试验池淀粉添加量。试验持续进行78 d,整个养殖过程中不换水,仅在试验后期适量补充由于蒸发所损失的水量。
表1 试验设计方案
Tab.1 Experimental design scheme
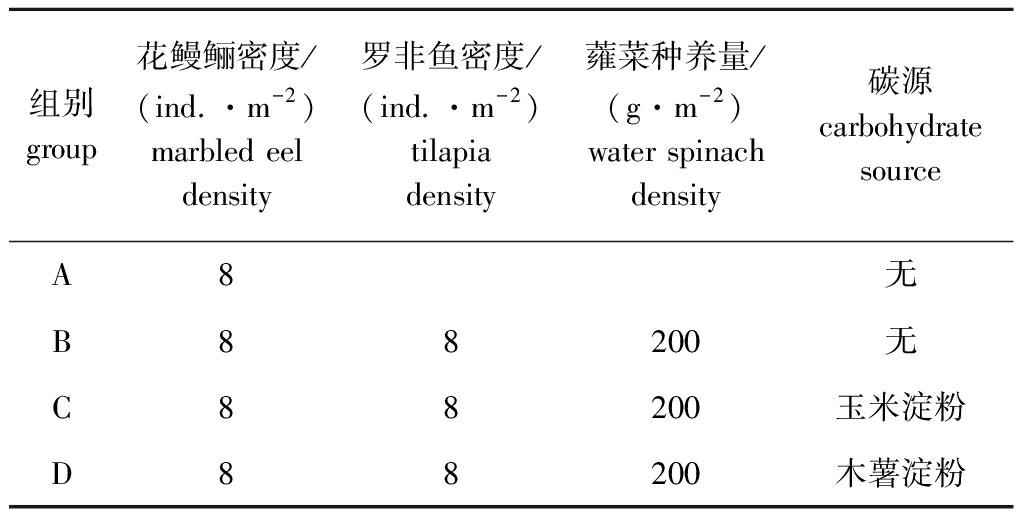
组别group花鳗鲡密度/(ind.·m-2)marbled eel density罗非鱼密度/(ind.·m-2)tilapia density蕹菜种养量/(g·m-2)water spinach density碳源carbohydratesourceA8无B88200无C88200玉米淀粉D88200木薯淀粉
1.2.3 指标的测定与计算
(1) 水质指标测定。试验期间,每周在固定测试点定时对溶解氧(DO)、pH、水温(WT)、透明度(SD)等水质指标现场测定,其中,采用 SevenGo Pro-SG6 便携式溶氧仪测定溶解氧,采用 HANNA HI98128 防水型 pH/温度测试笔测量pH、水温,用塞氏盘测定透明度(SD)。按照国家环境保护总局的水质检测分析方法[16]测定总氮(TN)、总磷(TP)、硝酸氮![]() 亚硝酸氮
亚硝酸氮![]() 氨氮(TAN)、叶绿素a(Chl-a)和悬浮物(TSS)含量。
氨氮(TAN)、叶绿素a(Chl-a)和悬浮物(TSS)含量。
(2) 絮体成分的测定。每周定点定时采集1次各试验池水样。絮体体积(FV)的测定,采用Imhoff锥形管测定1 L水样经过沉淀15 min后絮体所占的体积(FV-15);TSS测定,取水样 1000 mL,使用TOYO定量滤纸抽滤,在105 ℃烘箱中烘干称量。试验结束时,采集各个养殖池的絮体,采用国际标准方法[17]对其营养成分进行测定,包括粗脂肪、粗纤维、粗蛋白质含量。
(3) 饲料中氮磷利用率的测定。在试验初始及结束时,分别采集花鳗鲡、罗非鱼和蕹菜的样品,检测各样品中总氮及总磷含量;同时,测定试验中用于投喂的商品饲料中总氮及总磷含量。分别采用元素分析仪法和国标法[17]测定总氮、总磷含量。饲料中氮(磷)转化率(G,%)计算公式为
G=(A-B)/C×100%。
其中:A为试验结束时总氮(磷)量(kg);B为试验开始时总氮(磷)量(kg);C为投喂饲料的总氮(磷)量(kg)。
(4) 花鳗鲡、罗非鱼和蕹菜生长指标的测定。试验结束时,将试验鱼饥饿24 h后统计并称量每个养殖池中花鳗鲡和罗非鱼的总数量和总质量,以及各池中蕹菜的质量,并计算每个养殖池中花鳗鲡和罗非鱼的终末平均体质量、存活率、净产量、增重率、饵料系数及特定生长率。各指标计算公式为
Wt=Wn/Nt,
S=Nt/N0×100%,
Bn=Bt-B0,
WGR=(Bt-B0)/B0×100%,
Rfc=Fn/Bn,
Rsg=(lnWt-lnW0)/t×100%。
其中:W0、Wt分别为试验开始及结束时花鳗鲡(罗非鱼)的平均体质量(g);S为存活率(%);Bn为净产量(g);WGR为增重率(%);Rfc为饵料系数;Rsg为特定生长率(%·d-1);t为试验时间(d);Wn为试验结束时花鳗鲡(罗非鱼)的总质量(g);B0、Bt分别为试验开始及试验结束时每池花鳗鲡(罗非鱼)总质量(g);N0、Nt分别为养殖初始及结束时花鳗鲡(罗非鱼)的数量(ind.);Fn为饲料投喂总量(g)。
1.3 数据处理
试验数据采用Excel软件进行处理,用平均值±标准差(mean±S.D.)表示,采用SPASS 17.0软件进行单因素方差分析(ANOVA),如组间有显著差异,则采用Duncan法进行多重比较,以0.05作为差异显著性水平。
2 结果与分析
2.1 不同养殖试验组水质指标的变化
2.1.1 水温、pH、溶解氧和透明度 养殖期间,水温、pH、透明度和溶解氧等水质指标变化情况如图1所示。从图1可见:整个试验中,水温先升高后不断降低,水温变化范围为29.8~21.0 ℃;各养殖组pH为8.38~6.15,且均在第4次采样时达到峰值,A组与B组pH变化趋势相同,均呈先升高后降低趋势,C组与D组pH呈先升高后降低,养殖后期又略升高,养殖结束时,C组、D组pH显著高于A组和B组(P<0.05),但C组与D组间无显著性差异(P>0.05);溶解氧变化趋势各养殖组大致相当,虽然试验期间均有起伏,但整体上均随着时间的延长其值逐渐降低,变化范围为8.20~5.55 mg/L,养殖结束时,各养殖组溶解氧水平接近,均无显著性差异(P>0.05);试验期间,各养殖池透明度整体上不断降低,但各组均有起伏,试验结束时各组透明度均略有升高,A组透明度变化最为剧烈,且透明度最低。

注:标有不同字母者表示同一采样时间下不同组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同
Note: The means with different letters in same sampling time are significant differences in different groups at the 0.05 probability level, and the means with the same letters are not significant differences, et sequentia
图1 试验期间水温、pH、溶解氧及透明度的变化
Fig.1 Variations in water temperature,pH, DO and transparency during the trial
2.1.2 总氮与总磷含量 从图2可见:试验期间,各养殖组的总氮和总磷含量整体上均随时间的延长逐渐升高,但在养殖后期,C组和D组总氮水平趋于平稳,并在最后一周略有下降;试验结束时,C组和D组的总氮和总磷含量显著低于A组(P<0.05),但C、D两组间无显著性差异(P>0.05)。
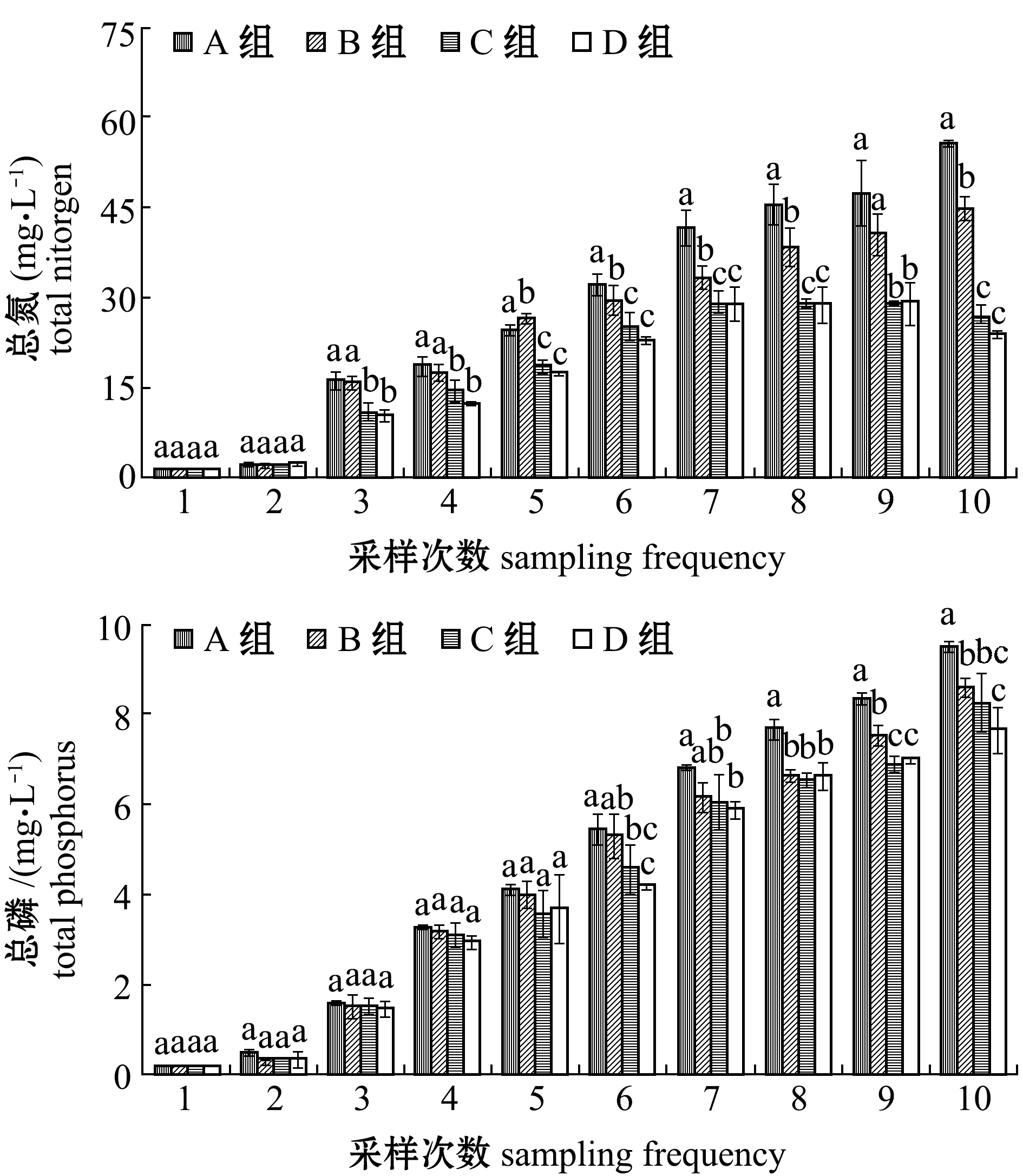
图2 试验期间各养殖池总氮、总磷含量的变化
Fig.2 Variations in TN and TP levels in each treatment during the trial
2.1.3 亚硝酸氮含量 从图3可见:试验前期各养殖组亚硝酸氮含量不断升高,并在第4周时达到峰值,之后迅速降低,后期趋于稳定;试验结束时,C组和D组亚硝酸氮含量显著低于A组和B组(P<0.05),但C组和D组间无显著性差异(P>0.05)。
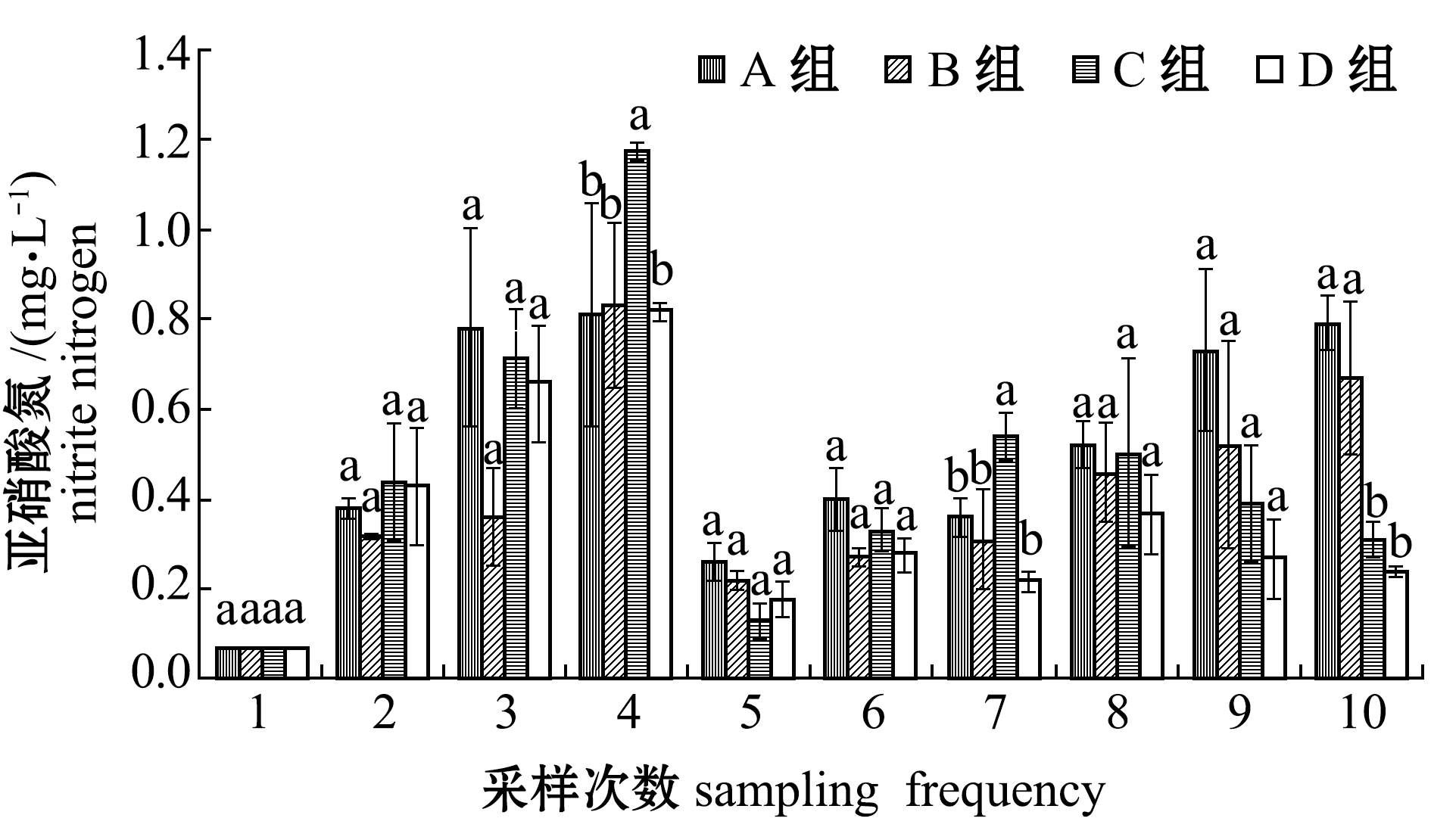
图3 试验期间各养殖池亚硝酸氮含量的变化
Fig.3 Variations in nitrite-N level in each treatment during the trial
2.1.4 硝酸氮含量 氨氮最终氧化产物是硝酸氮。从图4可见:随着试验的进行,各组硝酸氮含量不断升高,养殖后期,C组和D组硝酸氮含量变化较为平稳;试验结束时,C、D组硝酸氮含量显著低于A组和B组(P<0.05),但C组和D组间无显著性差异(P>0.05)。这表明,淀粉的添加能够降低水体中的硝酸氮含量。
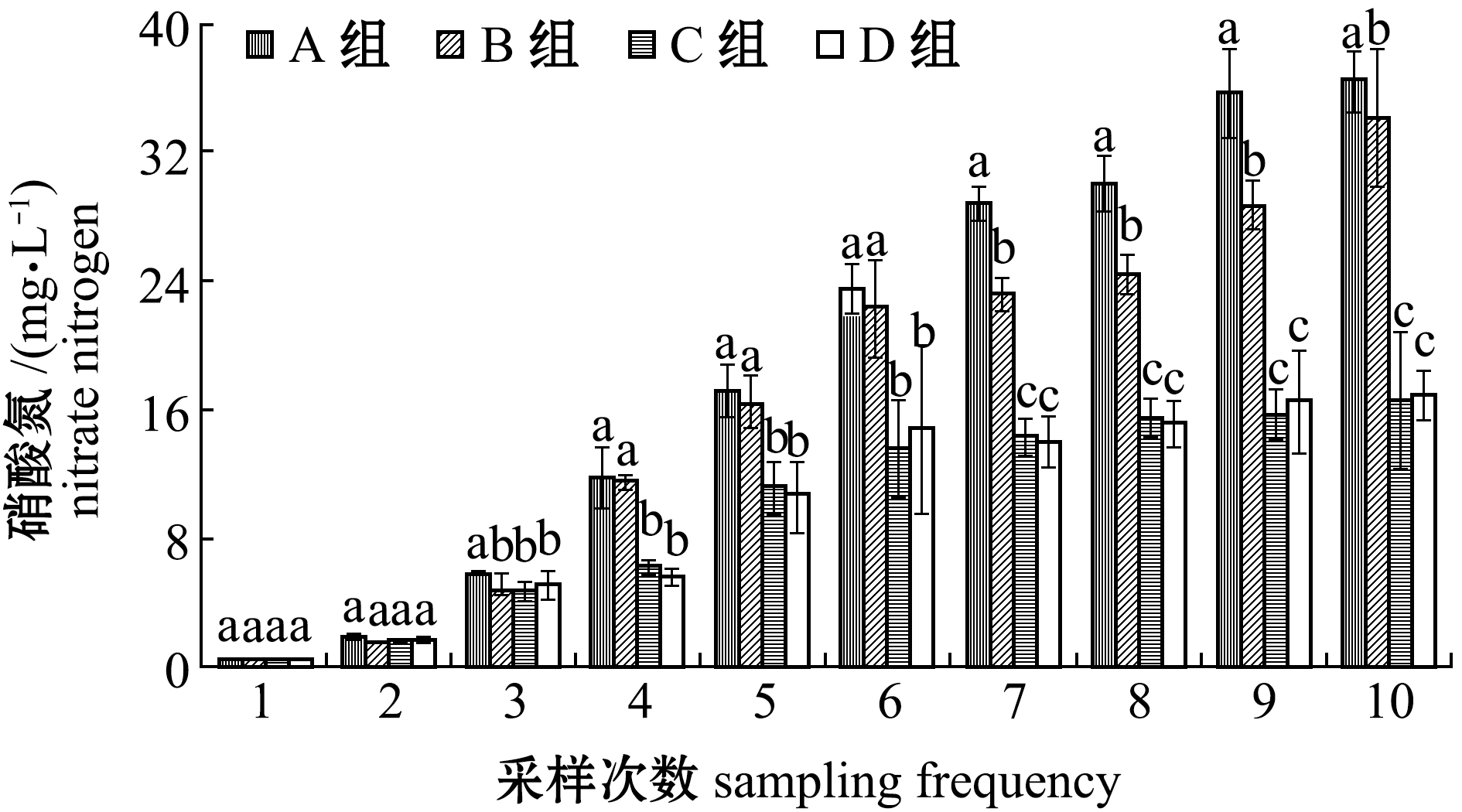
图4 试验期间各养殖池硝酸氮含量的变化
Fig.4 Variations in nitrate-N level in each treatment during the trial
2.1.5 氨氮含量 从图5可见:试验期间,各组氨氮含量的变化趋势大致相当,试验前期变化较为剧烈,后期略微平缓;试验结束时,C、D组氨氮含量显著低于A、B组(P<0.05)。
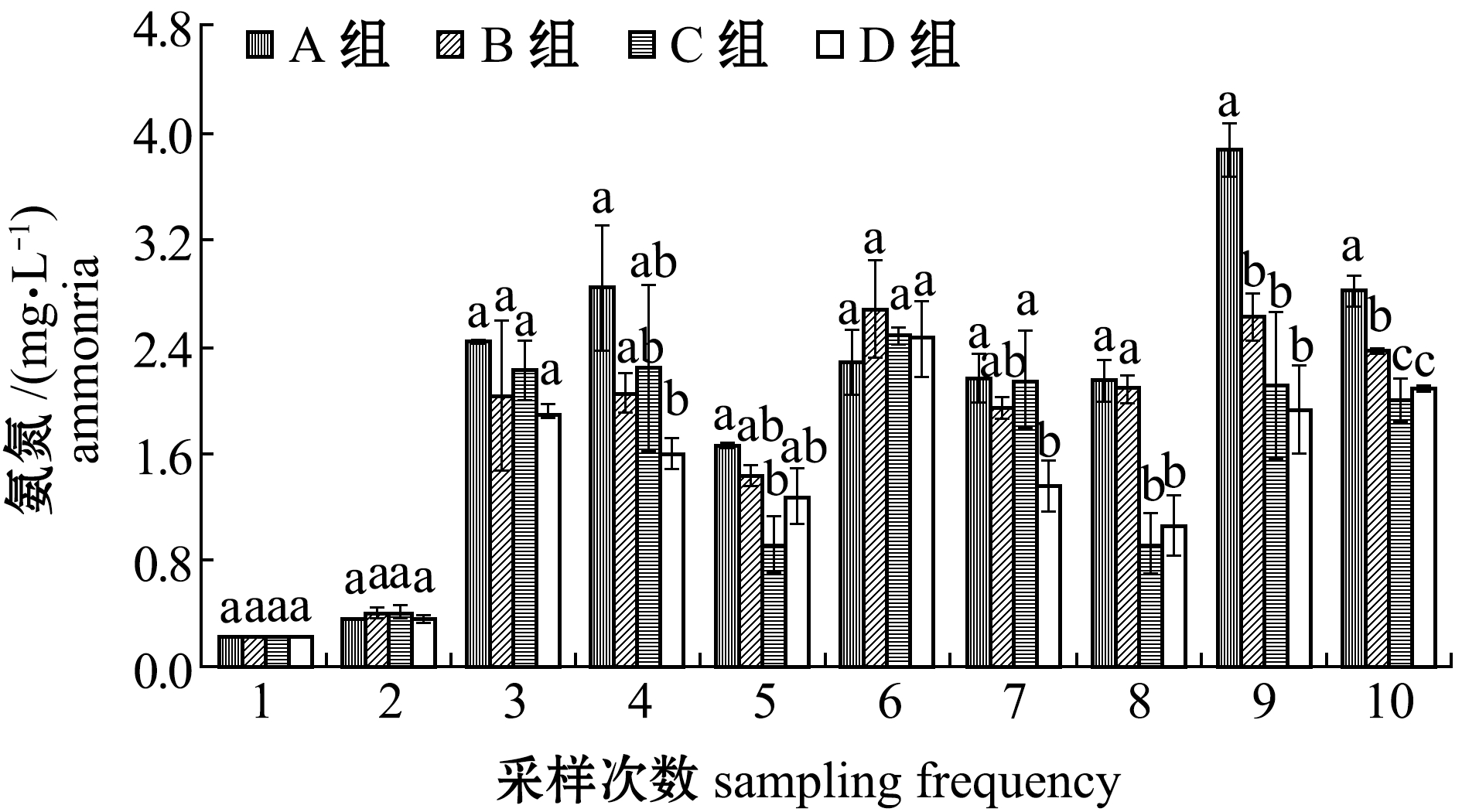
图5 试验期间各养殖池氨氮含量的变化
Fig.5 Variations in TAN level in each treatment during the trial
2.1.6 叶绿素a含量 从图6可见:试验期间,各组叶绿素a含量的变化趋势相同,养殖前期各组叶绿素a含量不断升高,并在第8周时达到峰值,主要是水温较高,水体中营养物质丰富,有利于浮游藻类的生长所致;后期叶绿素a值出现下降,主要是温度降低,藻类活动减弱所致;整个试验期间,C组和D组变化较为平稳,试验结束时,A、B组叶绿素a含量显著高于C组和D组(P<0.05)。这表明,有机碳源的添加能够抑制水体中总的浮游藻类数量。
2.1.7 COD含量 从图7可见:试验期间,各养殖组COD含量变化趋势大致相同;养殖前期(第1~4周),各组COD含量不断升高,其中A组显著高于C组和D组(P<0.05);养殖中期(第5~9周),COD含量先降低后升高,均在第9周时达到峰值;养殖后期(第10周),各养殖组COD含量降低,C组和D组COD含量显著低于A组和B组(P<0.05),但C组和D组间无显著性差异(P>0.05)。这表明,添加淀粉可有效降低养殖水体中的有机物含量。
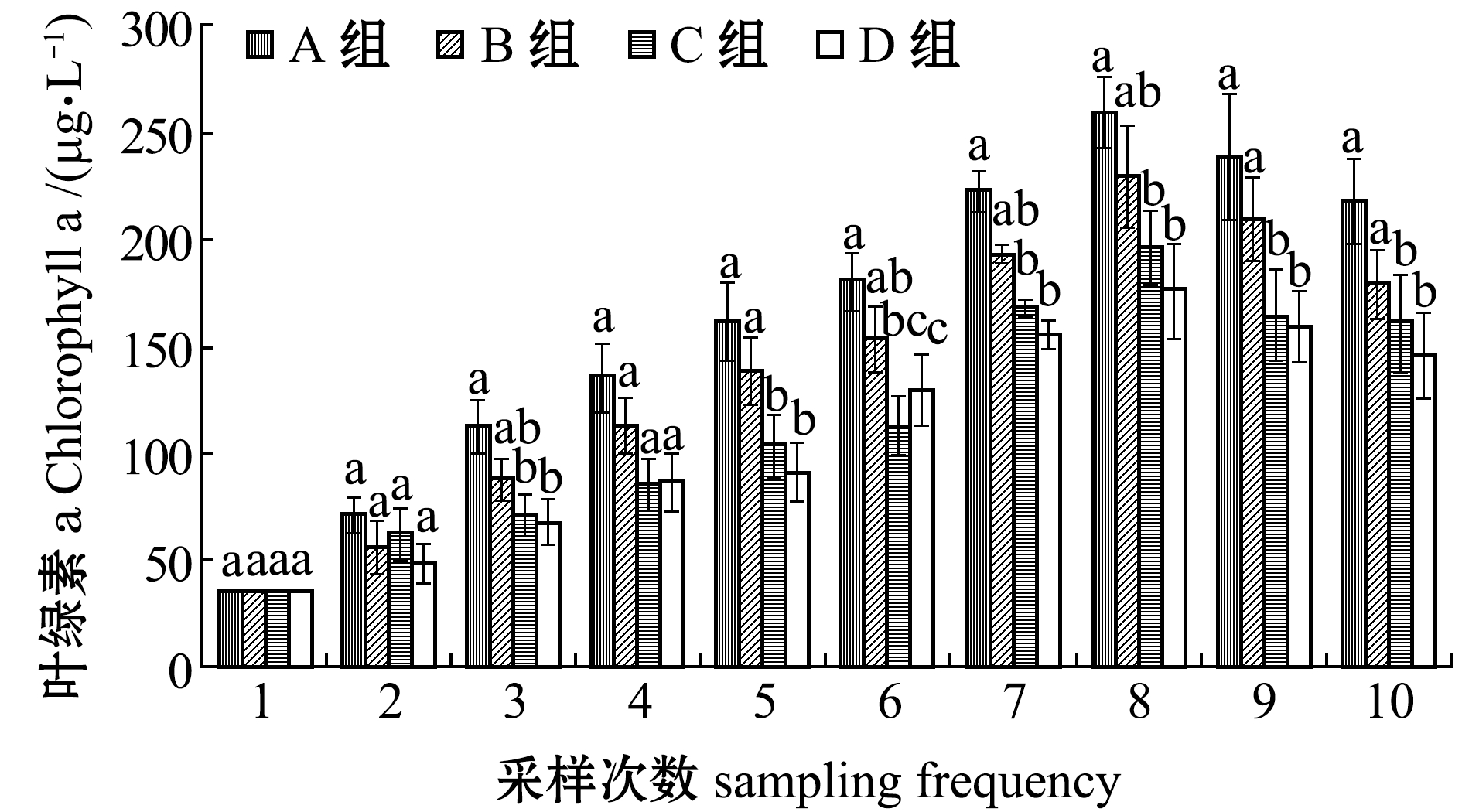
图6 试验期间各养殖池叶绿素a含量的变化
Fig.6 Variations in Chlorophyll a level in each treatment during the trial
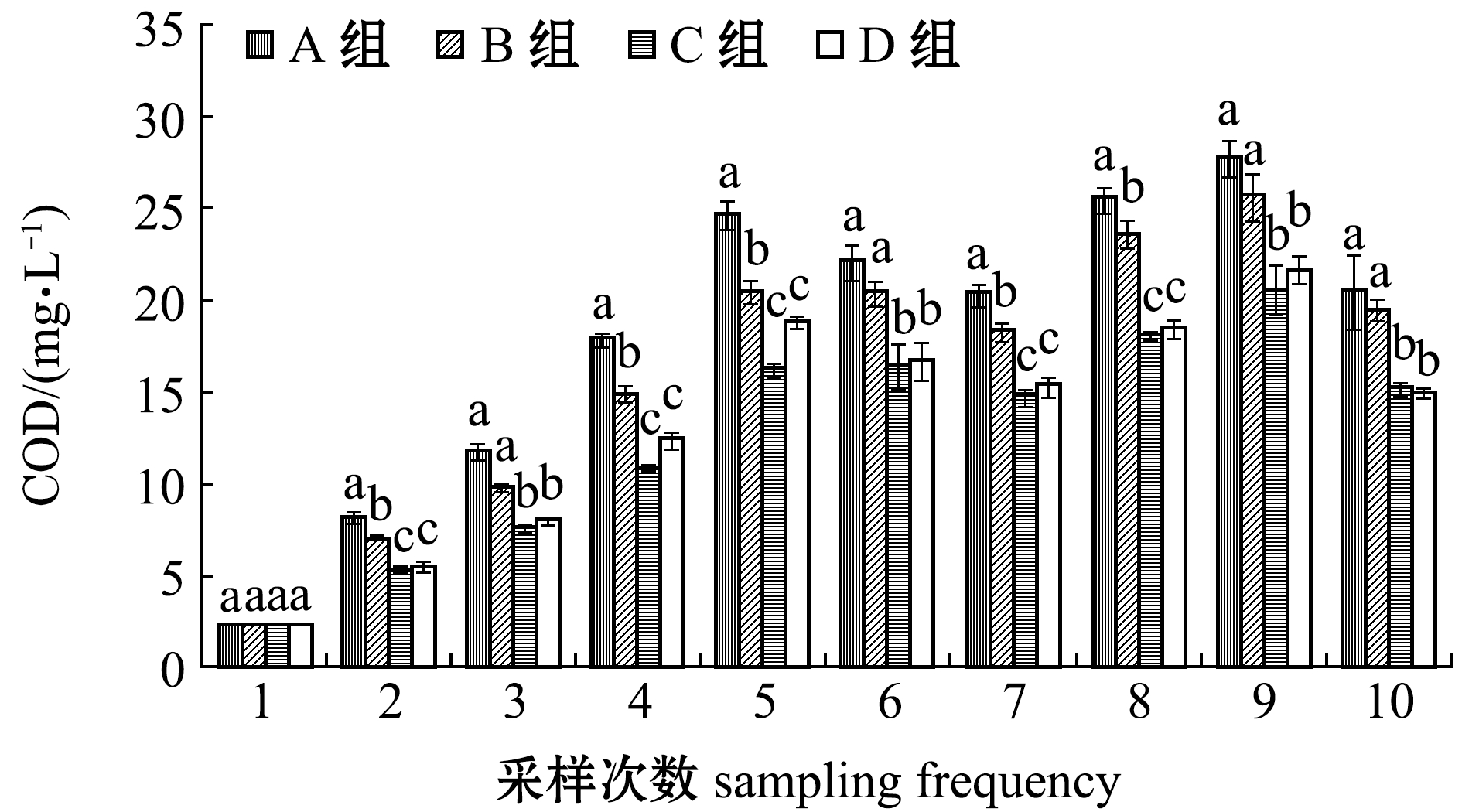
图7 试验期间各养殖池COD含量的变化
Fig.7 Variations in COD level in each treatment during the trial
2.1.8 生物絮团 从图8可见:试验期间,生物絮团整体上均随养殖时间的延长,絮体体积不断增加,并在试验结束时达到最高值;C组和D组絮体体积在第8周时短暂下降之后快速回升,试验后期,C组和D组絮体形成量及形成速度显著高于A组和B组(P<0.05)。这表明,添加淀粉可有效提高生物絮体体积。
从图9可见:试验期间,各养殖组总悬浮颗粒物TSS含量随时间的延长不断增加;C组和D组在第8周时略有下降,但回升较快,试验结束时,C组TSS值最高,达到187.45 mg/L,显著高于A组和B组(P<0.05),但与D组间无显著性差异(P>0.05)。这表明,添加淀粉可有效提高总悬浮颗粒物含量。
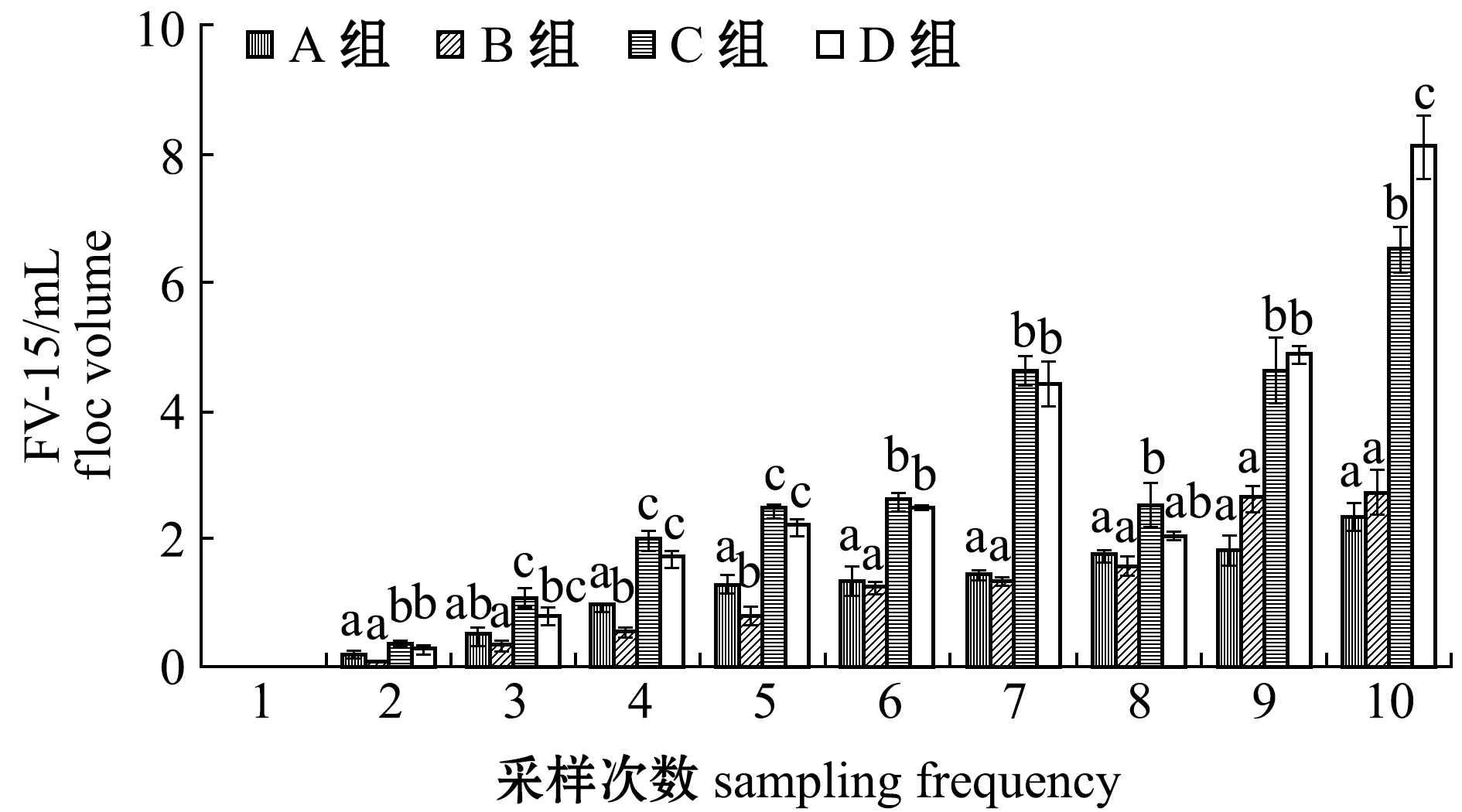
图8 试验期间各养殖池形成生物絮体体积(FV-15)的变化
Fig.8 Variations in biofloc volume (FV-15) after 15 min sedimentationin each treatment during the trial
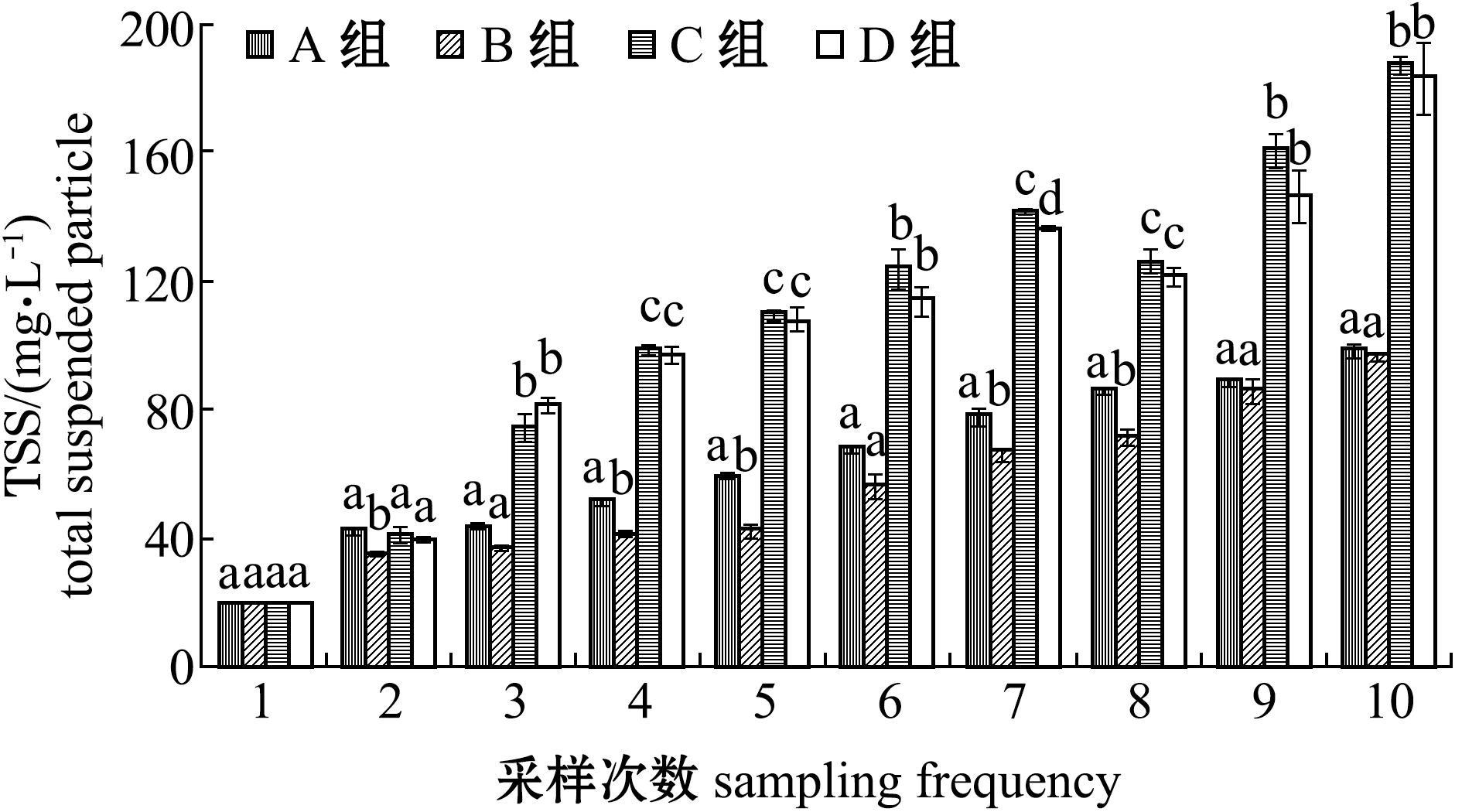
图9 试验期间各养殖池是浮颗粒物(TSS)含量的变化
Fig.9 Variations in TSS level in each treatment during the trial
从表2可见:试验结束时,生物絮团C组和D组的粗蛋白质含量分别为21.88%和23.68%,显著高于A组(17.33%)和B组(16.98%)(P<0.05);粗脂肪含量规律与粗蛋白质相似,粗纤维含量C组、D组分别为5.77%和4.85%,也显著高于A组(2.15%)和B组(2.03%)(P<0.05),但C组和D组间也有显著性差异(P<0.05)。
表2 各养殖组生物絮体营养成分
Tab.2 Mean proximate chemical composition of biofloc in each treatment during the trial w/%
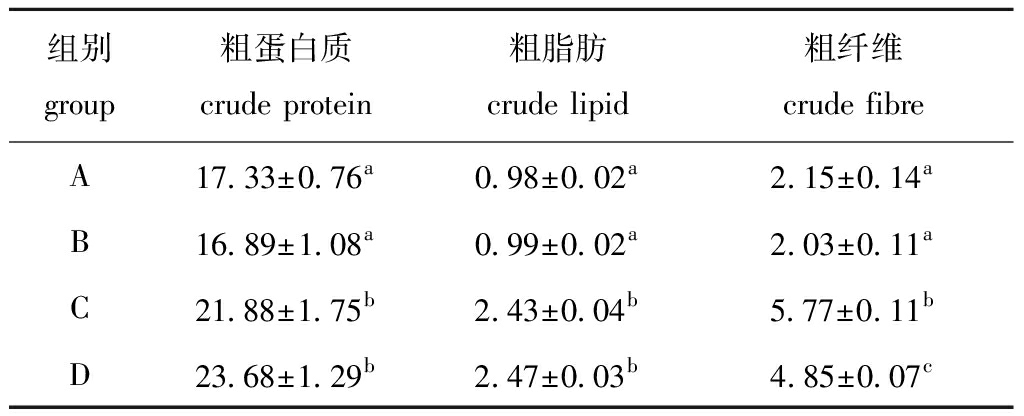
组别group粗蛋白质crude protein粗脂肪crude lipid粗纤维crude fibreA17.33±0.76a0.98±0.02a2.15±0.14aB16.89±1.08a0.99±0.02a2.03±0.11aC21.88±1.75b2.43±0.04b5.77±0.11bD23.68±1.29b2.47±0.03b4.85±0.07c
注:同列中标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同
Note:The means with different letters within the same column are significantly different in the groups at the 0.05 probability level, and the means with the same letters within the same column are not significant differences, et sequentia
2.2 不同养殖试验组生产性能
2.2.1 不同养殖试验组氮磷利用率 从表3可见:试验结束时,A、B、C、D组花鳗鲡对氮的利用率分别为18.43%、19.91%、31.43%和28.04%;添加有机碳源的C组和D组花鳗鲡对氮的利用率显著高于A组和B组(P<0.05),而A组与B组,C组与D组间均无显著性差异(P>0.05);综合养殖组比较,C组花鳗鲡、罗非鱼和蕹菜对饲料中氮的总利用率最高,为36.95%,其次是D组,但两组间无显著性差异(P>0.05),养殖生物对氮的总利用率效果依次为C组>D组>B组>A组。
表3 不同养殖试验组生物对氮的利用情况
Tab.3 Efficiency of total nitrogen utilization in different treatments during the experiment period %

组别group花鳗鲡利用率utilization in marbled eel罗非鱼利用率utilization in tilapia蕹菜利用率utilization in water spinach总利用率total utilizationA18.43±1.79a18.43±1.79aB19.91±1.14a1.67±0.49a2.50±0.05a24.07±1.68bC31.43±1.08b2.86±0.42a2.67±0.07a36.95±1.43cD28.04±2.09b2.68±0.33a2.51±0.18a33.22±2.24c
从表4可见:试验结束时,A、B、C、D组花鳗鲡对磷的利用率分别为9.23%、8.42%、14.14%和13.69%,不同养殖试验组对饲料中磷的利用率与对氮的利用率规律相似;添加有机碳源的C组和D组花鳗鲡对磷的利用率显著高于A组和B组(P<0.05),而A组与B组,C组与D组间均无显著性差异(P>0.05);综合养殖组比较,C组对饲料中磷的总利用率最高,其次为D组,但两组间无显著性差异(P>0.05),养殖生物对磷的总利用率效果依次为C组>D组>B组>A组。
表4 不同养殖试验组生物对磷的利用情况
Tab.4 Efficiency of total phosphorous utilization in different treatments during the experiment period %

组别group花鳗鲡利用率utilization in marbled eel罗非鱼利用率utilization in tilapia蕹菜利用率utilization in water spinach总利用率total utilizationA9.23±1.58a9.23±1.58cB8.42±1.61a2.92±0.06a2.16±0.03a13.49±1.53aC14.14±0.64b2.96±0.02a2.30±0.06a19.40±0.71bD13.69±0.86b3.05±0.07a2.19±0.04a18.92±0.93b
2.2.2 不同养殖试验组花鳗鲡生产性能 不同养殖试验组花鳗鲡产出效果如图10所示,生物絮团组(C、D)花鳗鲡单位水体的产出效果最好,分别为3.05 kg/pond和3.01 kg/pond,平均体质量分别为257.42 g/ind.和254 g/ind.,均显著高于单养组A及不添加碳源的综合养殖组B(P<0.05),但C组和D组间无显著性差异(P>0.05)。
不同养殖试验组花鳗鲡生物量、终末平均体质量、特定生长率、增重率、存活率、饵料系数如表5所示。从表5可知:生物絮团组(C、D)在花鳗鲡特定生长率、增重率方面显著高于非絮团组(A、B)(P<0.05);D组花鳗鲡饵料系数最低,为1.57,显著低于单养组A和不添加碳源的综合养殖组B(P<0.05),但与C组间无显著性差异(P>0.05)。这表明,碳源的添加能够一定程度上降低花鳗鲡的饵料系数。
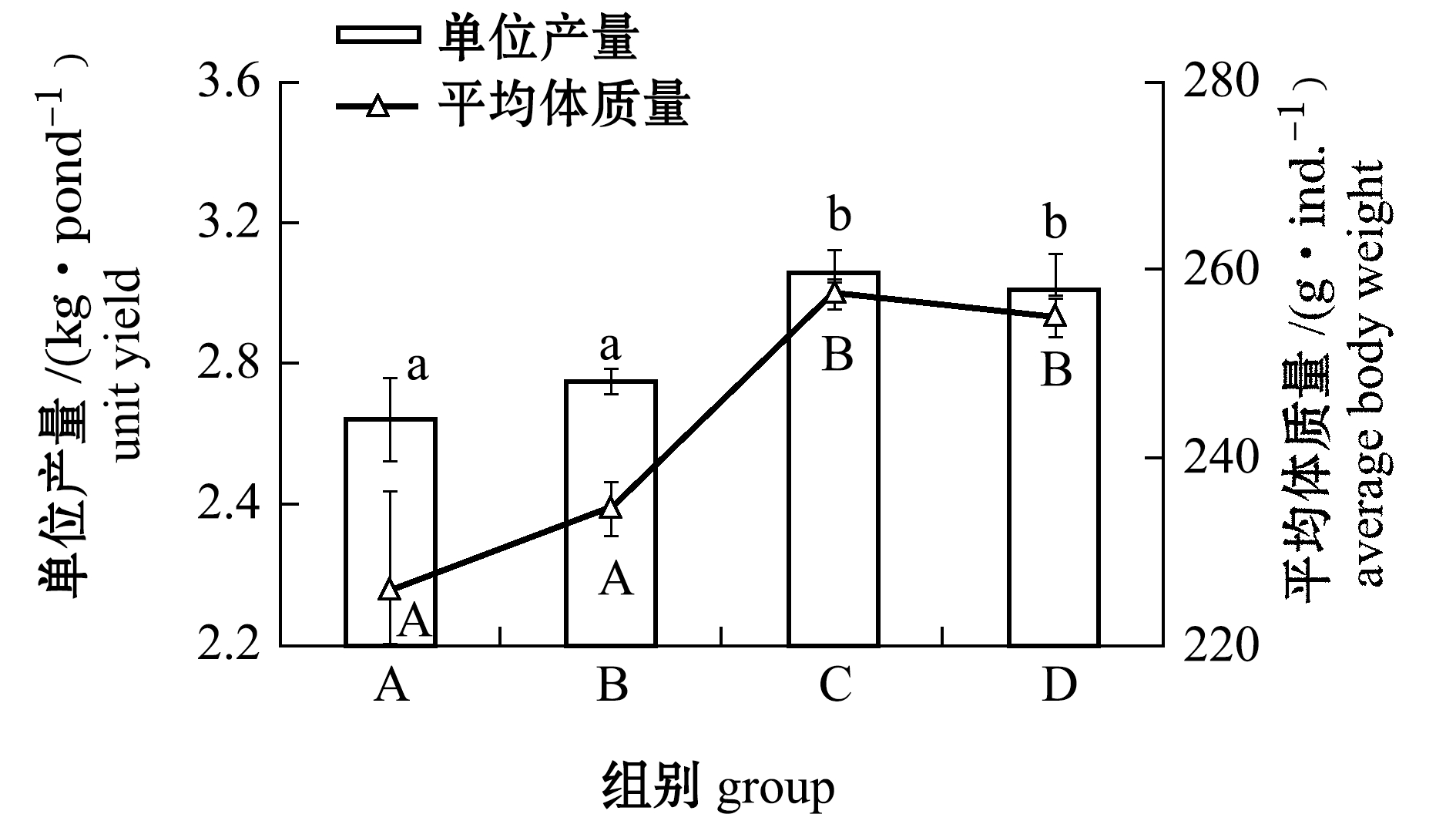
注:同一指标下,标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同
Note:The means with different letters at same index are significantly different in the groups at the 0.05 probability level, and the means with the same letters are not significant differences, et sequentia
图10 不同养殖试验组花鳗鲡产出效果
Fig.10 Production performance of marbled eel Anguilla marmorata in differnt treatments
表5 不同养殖试验组花鳗鲡生物量、终末平均体质量、特定生长率、增重率、存活率和饵料系数的比较
Tab.5 Comparison of biomass,final average body weight, specific growth rate,weight gain rate,survival rate and food conversion ratio of marbled eel in different treatments
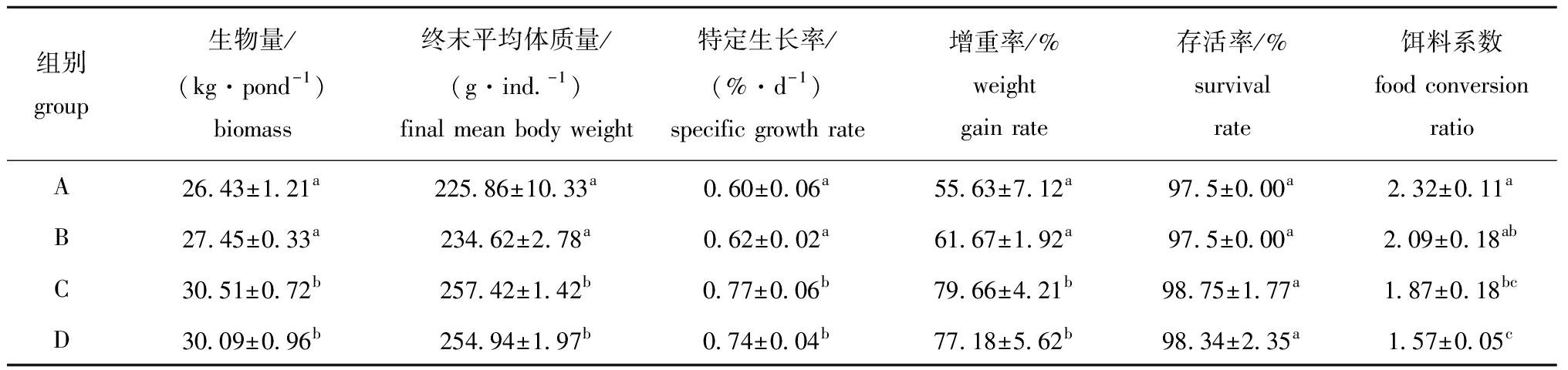
组别group生物量/(kg·pond-1)biomass终末平均体质量/(g·ind.-1)final mean body weight特定生长率/(%·d-1)specific growth rate增重率/%weight gain rate存活率/%survival rate饵料系数food conversion ratioA26.43±1.21a225.86±10.33a0.60±0.06a55.63±7.12a97.5±0.00a2.32±0.11aB27.45±0.33a234.62±2.78a0.62±0.02a61.67±1.92a97.5±0.00a2.09±0.18abC30.51±0.72b257.42±1.42b0.77±0.06b79.66±4.21b98.75±1.77a1.87±0.18bcD30.09±0.96b254.94±1.97b0.74±0.04b77.18±5.62b98.34±2.35a1.57±0.05c
2.2.3 不同养殖试验组罗非鱼生产性能 不同养殖试验组罗非鱼生物量、存活率和平均体质量如表6所示。从表6可见:养殖结束后,C组罗非鱼产量最高,达到2.65 kg/pond,与D组无显著性差异(P>0.05),但两组的生物量均显著高于不添加碳源的综合养殖B组(P<0.05);在平均体质量方面,其变化规律与生物量的变化类似,C组最高,达到165.63 g/ind.,C组与D组间无显著性差异(P>0.05),但两组的平均体质量均显著高于B组(P<0.05)。这表明,碳源添加后形成的生物絮团能够被罗非鱼很好地利用。
表6 不同养殖试验组罗非鱼生物量、存活率和平均体质量的比较
Tab.6 Comparison of biomass,survival rate and average body weight of tilapia in different treatments
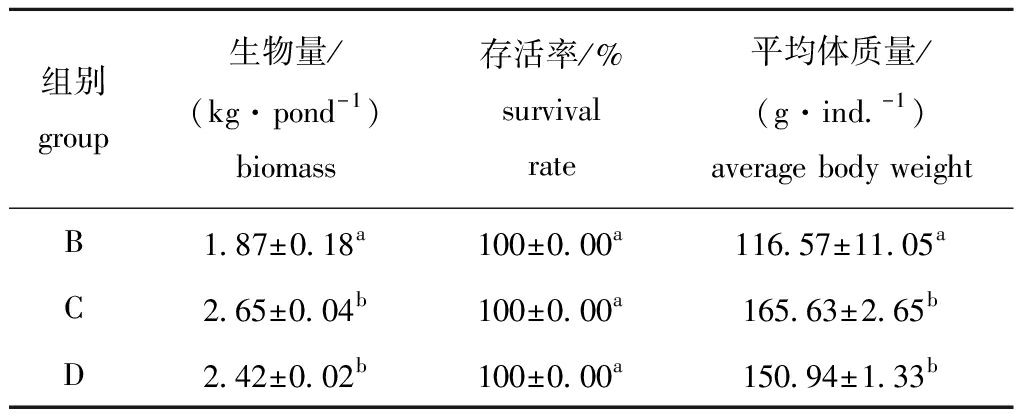
组别group生物量/(kg·pond-1)biomass存活率/%survival rate平均体质量/(g·ind.-1)average body weightB1.87±0.18a100±0.00a116.57±11.05aC2.65±0.04b100±0.00a165.63±2.65bD2.42±0.02b100±0.00a150.94±1.33b
3 讨论
3.1 碳源对花鳗鲡养殖系统水体水质的影响
3.1.1 温度、溶解氧、pH和透明度的变化 适宜的温度是微生物能够正常代谢的重要因素,也是生物絮团产生的条件之一。Wilén等[18]研究发现,与4 ℃相比,18~20 ℃更有利于絮团的生成,主要是低温导致絮团中微生物活性减弱。本试验期间,各养殖池平均水温为26.72 ℃,有利于生物絮团的正常生成,另外,花鳗鲡最适生长水温为25~30 ℃[19],养殖期间水温也有利于花鳗鲡的快速生长[20]。溶解氧是生物絮团能够形成的另一个重要因素之一,异养微生物呼吸需要消耗大量氧气,本试验中各养殖组溶解氧为7.98~5.60 mg/L,能够满足絮体形成和养殖动物的耗氧需要。本试验期间,pH的降低,主要是由于水体中积累的残饵、排泄物等有机物较多,异养代谢旺盛,产生较多的有机酸所致,而各组pH的波动可能是因为各养殖组实际花鳗鲡摄食量及添加碳源量的不同而引起。养殖过程中,各组透明度整体上不断减小,这可能是因为水体中颗粒物的增多和絮体的不断形成所致,而立体综合养殖组较单一花鳗鲡养殖组略高,主要是由于蕹菜对颗粒物质的吸附作用[21]。
3.1.2 添加碳源对养殖水质的影响 碳源的添加能够有效调节养殖水质。本试验结束时,单养组A水体中总氮和总磷含量明显高于其他3个综合养殖组,这说明混养能够有效去除水体中的氮磷。其原因主要是:在花鳗鲡—罗非鱼—蕹菜立体综合养殖体系中,罗非鱼通过滤食水体中的浮游生物、腐屑和残饵等促进养殖系统内的物质循环,从而减少有机质的积累,而蕹菜则能够直接吸收水体中的氮磷等元素。这与李先宁等[21]、陈家长等[22]的研究结果类似。由于本试验中只考虑花鳗鲡的养殖效果,蕹菜的种养量和种植面积是否合适,以及对氮磷等营养元素的实际去除效果如何,在之后的研究中还需要进一步研究。
Avnimelech[23]研究发现,养殖水环境中,氨氮的积累是限制高密度集约化养殖产量的重要因素。养殖水体中氨氮含量过高不仅会损害养殖动物的鳃组织,影响气体在动物体内的正常运输[24],还会导致各种致病菌大量滋生[25],降低养殖效益。亚硝酸氮是氨氮转化为硝酸氮的不稳定中间产物,一般是由氨氮经硝化作用氧化或者硝酸盐经还原和浮游植物代谢产生,也是诱发养殖动物发病的重要因子之一[26]。目前,生物絮团技术在改善养殖水质方面的作用已有诸多研究。Crab等[7]在罗非鱼养殖中添加淀粉作为有机碳源,亚硝酸氮、硝酸氮和氨氮指标明显低于对照组。Emerenciano等[27]在粉对虾养殖系统中运用生物絮团技术,氨氮、亚硝酸氮、硝酸氮等水质指标均在粉对虾安全生长范围之内。本试验中通过添加玉米淀粉和木薯淀粉,C、D综合养殖组的氨氮、亚硝酸氮、硝酸氮等指标均有不同程度的降低。分析其原因,与依靠硝化细菌的硝化作用去除水体中的氨氮相比,异养细菌生长速度是硝化细菌的10倍[8],有机碳源的添加,促使异养细菌能够大量利用水体中的氨氮生成新的细菌蛋白,从而达到了去除水体中氨氮的目的。此外,生成的细菌蛋白作为一种絮凝剂可以絮凝水体中的溶解有机物、颗粒物等,形成絮团,从而降低水体中的COD[28]。本试验期间,各组指标有不同程度的波动,主要是由于鳗鲡饲料为粉状饲料,每次投喂后0.5 h会将未被摄食的饵料清理出水泥池,导致了各池中鱼的实际摄食量不同。试验结束时,两种碳源在改善水质效果方面无显著性差异,可能是因为两种碳源均为淀粉类物质,性质、结构相似导致。
3.1.3 添加碳源对生物絮团形成的影响 碳源对水体中絮团的形成具有重要作用。通过添加有机碳源调节水体中的碳氮比,能够对生物絮团的形成进行控制[15],Samocha等[29]研究认为,不同的有机碳源会导致生成絮团结构发生改变。本试验中选取玉米淀粉、木薯淀粉作为碳源,结果表明,在整个试验期间,絮体形成体积(FV-15)、总悬浮颗粒物整体上处于不断增加趋势,这一结果与Avnimelech[23]、Burford等[30]的研究结果类似,试验中期絮体形成体积和总悬浮颗粒物有一明显下降过程,推测是因为温度突变,导致花鳗鲡摄食量减少,甚至不摄食,碳源添加量随之减少,从而总悬浮物颗粒物降低,但之后迅速恢复。试验结束时,木薯淀粉添加组D絮体形成体积显著高于其他3组,但絮团组间总悬浮颗粒物无显著性差异。
3.2 添加碳源对花鳗鲡养殖系统生产性能的影响
3.2.1 碳源对氮磷利用率的影响 不同养殖生物对饲料中氮磷的利用率虽有不同,但总体上均不高。罗非鱼精养模式下,对投入物质中的氮、磷利用率分别为18.0%~21.0%、16.0%~18.0%[31];主养草鱼池塘中,草鱼对氮、磷的利用率分别为35.4%~37.9%、18.9%~20.2%[32];欧洲鲑鱼养殖中,饲料中只有大约25%的氮磷被鱼体利用[33],其余则排入水环境中。本试验中,各养殖组花鳗鲡对氮、磷的利用率分别为18.43%~28.04%、9.23%~14.14%,其中,添加有机碳源的C组和D组显著高于其他两组,这与这两组中花鳗鲡较高的生物量有关。在氮磷总利用率方面,综合养殖组B、C、D组罗非鱼显著高于单养组A,一方面是因为罗非鱼通过对水体中残饵、颗粒物、絮团等的摄食,将进入水体中的一部分氮以鱼体形式输出[32],实现了对氮的二次利用,另一方面,其“搅底”作用,促进了底泥的再悬浮,有利于养殖生物对氮磷的吸收[34],从而提高了对总氮、总磷的利用率。
3.2.2 添加碳源对花鳗鲡生长的影响 目前,生物絮团技术对养殖生物生长的影响,已经有诸多研究。如罗文等[35]将生物絮团技术与彭泽鲫养殖相结合,显著提高了养殖生物的个体增重率、饵料蛋白利用率和特定生长率等。李朝兵等[36]运用生物絮团技术培养小规格罗非鱼鱼种,在获得较好的生长性能的同时,显著提高了罗非鱼肌肉营养成分。邓应能等[37]在凡纳滨对虾封闭养殖中应用生物絮团技术,在提高对虾存活率的同时,养殖产量明显升高。Burford等[30]利用15N追踪技术发现,养殖对虾每天摄取的氮中有18%~29%来自生物絮团。本试验中,到养殖结束时,生物絮团组在花鳗鲡生物量、平均体质量、特定生长率、增重率等方面明显高于非絮团组,说明有机碳源的添加,使得异养细菌能够充分利用水体中的氨氮、亚硝氮等氮源转化成自身的蛋白质,形成可被养殖生物直接摄食的絮团[38-39],这些絮团在被罗非鱼摄食的同时,降低了水体中的氨氮等有害物质,改善了养殖水环境,进而提高了絮团组花鳗鲡的实际摄食量。饵料系数的降低可能是在日常养殖过程中花鳗鲡摄食了部分生物絮团,使得饲料蛋白获得二次利用,另外,絮团中的营养物质或有益生物可能弥补了商品饲料中某些不足的营养成分,使花鳗鲡的营养更加全面,进而促进其生长。试验结束时,两种碳源添加组的花鳗鲡生长方面无显著性差异,这可能是由于淀粉类碳源作用效果类似所致。
综上所述,将综合养殖与生物絮团技术相结合,能够有效改善养殖水环境并显著提高养殖生物的生长性能。
致谢:感谢本实验室陈健荣等同学在试验过程中给予的帮助!
[1] 闵志勇.花鳗鲡和日本鳗鲡肌肉生化成分的比较研究[J].集美大学学报,1998,3(3):132-135.
[2] 罗鸣钟,关瑞章,靳恒.五种鳗鲡的含肉率及肌肉营养成分分析[J].水生生物学报,2015,39(4):714-722.
[3] 葛均青,杨金先,李友娟,等.鳗鲡病毒性疾病病料中鳗鲡疱疹病毒的PCR检测[J].福建农业学报,2012,27(9):961-964.
[4] De Schryver P,Crab R,Defoirdt T,et al.The basics of bio-flocs technology:the added value for aquaculture[J].Aquaculture,2008,277(3-4):125-137.
[5] Crab R,Avnimelech Y,Defoirdt T,et al.Nitrogen removal techniques in aquaculture for a sustainable production[J].Aquaculture,2007,270(1-4):1-14.
[6] Schneider O,Sereti V,Eding E H,et al.Analysis of nutrient flows in integrated intensive aquaculture systems[J].Aquacultural Engineering,2005,32(3-4):379-401.
[7] Crab R,Kochva M,Verstraete W,et al.Bio-flocs technology application in over-wintering of tilapia[J].Aquacultural Engineering,2009,40(3):105-112.
[8] Hargreaves J A.Photosynthetic suspended-growth systems in aquaculture[J].Aquacultural Engineering,2006,34(3):344-363.
[9] Ballester E L C,Abreu P C,Cavalli R O,et al.Effect of practical diets with different protein levels on the performance of Farfantepenaeus paulensis juveniles nursed in a zero exchange suspended microbial flocs intensive system[J].Aquaculture Nutrition,2010,16(2):163-172.
[10] Furtado P S,Poersch L H,Wasielesky Jr W.Effect of calcium hydroxide,carbonate and sodium bicarbonate on water quality and zootechnical performance of shrimp Litopenaeus vannamei reared in bio-flocs technology (BFT) systems[J].Aquaculture,2011,321(1-2):130-135.
[11] 王潮辉,高启,谭洪新,等.生物絮凝系统构建过程对吉富罗非鱼免疫酶和生长的影响[J].中国水产科学,2015,22(4):707-715.
[12] 杨章武,张哲,葛辉,等.几种不同碳源对凡纳滨对虾生物絮团技术育苗效果的影响[J].福建水产,2015,37(5):347-352.
[13] 卢炳国,王海英,谢骏,等.不同C/N水平对草鱼池生物絮团的形成及其水质的影响[J].水产学报,2013,37(8):1220-1228.
[14] 江晓浚,孙盛明,戈贤平,等.添加不同碳源对零换水养殖系统中团头鲂鱼种生长、肠道生化指标和水质的影响[J].水产学报,2014,38(8):1113-1122.
[15] Goldman J C,Caron D A,Dennett M R.Regulation of gross growth efficiency and ammonium regeneration in bacteria by substrate C:N ratio[J].Limnology and Oceanography,1987,32(6):1239-1252.
[16] 国家环境保护总局.水和废水监测分析方法[M].4版.北京:中国环境科学出版社,2002.
[17] AOAC.Official Methods of Analysis[M].18th ed.Maryland:AOAC International Gaithersburg,2005.
[18] Wilén B M,Nielsen J L,Keiding K,et al.Influence of microbial activity on the stability of activated sludge flocs[J].Colloids and Surfaces B:Biointerfaces,2000,18(2):145-156.
[19] 李育培,权衡,盛晓洒,等.花鳗鲡的生物学特性及人工养殖技术[J].渔业致富指南,2008(10):50-52.
[20] Luo Mingzhong,Guan Ruizhang,Li Zhonhqin,et al.The effects of water temperature on the survival,feeding,and growth of the juveniles of Anguilla marmorata and Abicolor pacifica[J].Aquaculture,2013,400-401:61-64.
[21] 李先宁,宋海亮,吕锡武,等.水耕植物过滤法去除氮磷的影响因素及途径[J].环境科学,2007,28(5):982-986.
[22] 陈家长,孟顺龙,胡庚东,等.空心菜浮床栽培对集约化养殖鱼塘水质的影响[J].生态与农村环境学报,2010,26(2):155-159.
[23] Avnimelech Y.Feeding with microbial flocs by tilapia in minimal discharge bio-flocs technology ponds[J].Aquaculture,2007,264(1-4):140-147.
[24] 李波.氨氮和亚硝酸盐对黄颡鱼的毒性研究[D].武汉:华中农业大学,2010.
[25] 运珞珈,李谷,刘志伟,等.稚鳖养殖水体中异养细菌及自养细菌的初步研究[J].同济医科大学学报,2000,29(5):397-399.
[26] 尹文林,沈锦玉,潘晓艺,等.复合硝化菌制剂对水质改良的应用效果[J].水产养殖,2010,31(9):12-17.
[27] Emerenciano M,Ballester E L C,Cavalli R O,et al.Effect of biofloc technology (BFT) on the early postlarval stage of pink shrimp Farfantepenaeus paulensis:growth performance,floc composition and salinity stress tolerance[J].Aquaculture International,2011,19(5):891-901.
[28] Crab R,Chielens B,Wille M,et al.The effect of different carbon sources on the nutritional value of bioflocs,a feed for Macrobrachium rosenbergii postlarvae[J].Aquaculture Research,2010,41(4):559-567.
[29] Samocha T M,Patnaik S,Speed M,et al.Use of molasses as carbon source in limited discharge nursery and grow-out systems for Litopenaeus vannamei[J].Aquacultural Engineering,2007,36(2):184-191.
[30] Burford M A,Thompson P J,Mcintosh R P,et al.The contribution of flocculated material to shrimp (Litopenaeus vannamei) nutrition in a high-intensity,zero-exchange system[J].Aquaculture,2004,232(1-4):525-537.
[31] Green B W,Boyd C E.Chemical budgets for organically fertilized fish ponds in the dry tropics[J].Journal of the World Aquaculture Society,1995,26(3):284-296.
[32] 高攀,蒋明,赵宇江,等.主养草鱼池塘水质指标的变化规律和氮磷收支[J].云南农业大学学报,2009,24(1):71-77.
[33] Rosenthal H,Bradburg N B.Internationalaqua-Culture:Trends and Perspective[M].Ghent (Belgium):European Aquaculture Society Special Publication,1995.
[34] Rahman M M,Jo Q,Gong Y G,et al.A comparative study of common carp (Cyprinus carpio L.) and calbasu (Labeo calbasu Hamilton) on bottom soil resuspension,water quality,nutrient accumulations,food intake and growth of fish in simulated rohu (Labeo rohita Hamilton) ponds[J].Aquaculture,2008,285(1-4):78-83.
[35] 罗文,王广军,龚望宝,等.生物絮团技术对彭泽鲫生长及养殖水质的影响[J].南方农业学报,2014,45(2):318-322.
[36] 李朝兵,李志斐,韩林强,等.生物絮团技术对室内培育小规格罗非鱼种的影响[J].水产养殖,2015,36(7):29-35.
[37] 邓应能,赵培,孙运忠,等.生物絮团在凡纳滨对虾封闭养殖试验中的形成条件及作用效果[J].渔业科学进展,2012,33(2):69-75.
[38] 赵培.生物絮团技术在海水养殖中的研究与应用[D].上海:上海海洋大学,2011.
[39] Hari B,Kurup B M,Varghese J T,et al.Effects of carbohydrate addition on production in extensive shrimp culture systems[J].Aquaculture,2004,241(1-4):179-194.