罗非鱼Oreochromis sp.是全球重要的水产养殖品种之一[1],目前,养殖较多的品种有吉富罗非鱼Oreochromis niloticus、奥尼罗非鱼Oreochromis niloticus×O.aureus、红罗非鱼Oreochromis mossambicus×O.niloticus等。近年来,随着罗非鱼养殖规模不断扩大及养殖环境恶化,罗非鱼链球菌病频繁暴发,严重制约着中国罗非鱼养殖业的健康发展[2-4]。
无乳链球菌是罗非鱼链球菌病的主要致病菌之一[5],又称B族链球菌。目前,国内外对链球菌病的研究热点主要包括病原分离鉴定、疫苗研发和药物防治,这些研究对该病的防控起到了积极的作用,但是想要全面有效地控制该病的发生,尚有诸多科学问题有待解决,对该病流行病学的研究正是其中之一。近年来,中国罗非鱼无乳链球菌株型间发生了遗传变异[3,6]。血清型研究结果表明,在中国流行 3 种分子血清型的无乳链球菌,其中Ⅰa型是主要的流行株型[4,6-7],且多为β溶血,但也有部分为γ溶血(即不溶血) [8]。多位点序列分型(Multilocus Sequence Typing, MLST)研究结果表明,主要流行菌株为ST7型[9]。因此,对无乳链球菌进行分子分型,并通过数据库与世界各地实验室间的数据进行比较,分析它们在分子水平上的差异性,可为开发疫苗、筛选候选菌株等提供理论依据。
红罗非鱼又称为彩虹鲷,是尼罗罗非鱼O.niloticus与体色变异的莫桑比克罗非鱼O.mossambicus杂交并经多代选育的优良品种[10]。目前,针对吉富罗非鱼、奥尼罗非鱼等品种开展的链球菌病研究报道较多,而对红罗非鱼链球菌病的研究报道相对较少。本研究中,从福建省漳州市某养殖场患病红罗非鱼脑组织中分离获得1株无乳链球菌,并对其进行分子血清分型、多位点序列分型(MLST)、毒力相关基因及药物敏感性等分析,以期为福建省红罗非鱼无乳链球菌病的病原学研究、流行病学分析和防控技术研发提供基础材料。
1 材料与方法
1.1 材料
患病红罗非鱼样本于2017年采自福建省漳州市芗城区红罗非鱼养殖场,个体体质量为250 g左右。
BHI培养基购自广东环凯微生物科技有限公司,革兰氏染色用试剂盒和绵羊血平板购自北京陆桥技术股份有限公司,PCR相关试剂购自宝生物(大连)有限公司,细菌基因组DNA提取试剂盒购自QIAGEN公司,试验用相关引物由福州尚亚生物技术有限公司合成,琼脂糖为SIGMA公司产品,除磺胺异噁唑购自杭州滨和微生物试剂有限公司,其余药敏纸片均购自杭州微生物试剂有限公司。
1.2 方法
1.2.1 病鱼的采集及优势菌的分离纯化 患病红罗非鱼样本具有双侧眼球突出、眼眶四周充血、眼角膜发白、游姿失衡、打转、食欲减退、鳃盖与口腔充血等典型症状。将病鱼于无菌条件下解剖,取其眼、脑、肝、肾和脾等组织划线接种于BHI平板上,30 ℃下倒置培养24~48 h,观察菌落的形态特征,并挑取培养平板上占优势形态的单菌落进行纯化培养,取纯化后的单菌落接种于绵羊血平板上,30 ℃下振荡培养12~24 h后观察其溶血性,同时用40%的甘油将其保存于超低温冰箱(-80 ℃)中备用。
1.2.2 分离菌株的鉴定 按常规方法对分离菌株进行革兰氏染色,观察其形态和染色特性[11],进行初步判定。采用细菌基因组DNA提取试剂盒提取分离菌株的基因组DNA,使用细菌16S rRNA通用引物,从分离菌株基因组DNA中扩增得到16S rRNA序列。PCR 产物经铂尚生物技术(上海)有限公司测序后,通过 NCBI中的 Nucleotide blast进行序列同源性分析,并采用ClustalX 1.8 软件进行序列比对,使用MEGA 4.0软件构建系统发育树。
1.2.3 人工回归感染试验 将分离菌株于BHI平板上30 ℃下培养24~36 h,挑取单菌落至BHI液体培养基中,30 ℃下以200 r/min振荡培养18~24 h,然后用0.9%的无菌生理盐水制成菌悬液,测定其活菌数。用浓度为4×108 CFU/mL的菌悬液,腹腔注射9尾健康罗非鱼,每尾注射0.5 mL,对照组(9尾)腹腔注射0.5 mL 0.9%的无菌生理盐水,试验设置3个重复组。水温控制在(29±1)℃,观察并记录试验组和对照组罗非鱼的发病死亡情况,连续观察14 d。
1.2.4 分离菌株的分子血清型鉴定 参照Ye等[4]的方法对分离菌株进行分子血清型检测,即利用PCR法扩增分离菌株荚膜多糖(cps)基因鉴定其血清型,扩增引物见表1,以分离菌株的基因组DNA为模板分别进行PCR扩增,并将PCR产物测序后分析。
表1 扩增cps基因不同特异性基因片段的引物序列
Tab.1 The primer suquences of amplication cps gene fragments of different specificity genes

引物 primer 序列 sequence(5′-3′)基因 genecpsES1-FCAGAAGCGACGCCTTAGTTTTAAGCCAGGAATCACcpsGA1-RCCGCCRTGTGTGATAACAATCTCAGCTTC cpsE-GⅠacpsHS1-FGGCCTGCTGGGATTAATGAATATAGTTCCAGGTTTGCⅢcpsHS-RGAATACTATTGGTCTGTATGTTGGTTTTATTAGCATCGCcpsⅠa-RAGTATAACTTCTATCAATGGATGAGTCTGTTGTAGTACGGcpsH-I
1.2.5 分离菌株的MSTL分型分析 参照Jones等[12]的方法分析分离菌株的多位点序列分型(MLST),PCR 引物参见官网http: //pubmlst.org/sagalactiae/,分别对adhP、pheS、atr、glnA、sdhA、glcK和tkt共7个管家基因进行PCR扩增和测序。然后将这7个基因的测序序列与网上相应的等位基因序列进行比对分析,获得菌株的等位基因编号及序列型(Sequence types, STs)。
1.2.6 分离菌株毒力相关基因的检测 通过PCR扩增检测分离菌株的毒力相关基因,包括以下10种基因:bac(βC蛋白)、bca(αC蛋白)、cfb(CAMP因子)、hylB(透明质酸酶)、fbsA (纤维蛋白结合蛋白A)、fbsB (纤维蛋白结合蛋白B)、lmb (层黏连蛋白结合蛋白)、scpB (C5a肽酶)、cpsE(荚膜多糖合成基因E)和sip(表面免疫相关蛋白),其中cpsE和sip基因的PCR扩增引物和扩增条件参考彭民毅[13]的方法,其余毒力基因引物和PCR扩增条件均参考Godoy等[14]的方法。若PCR扩增产物片段大小与预期片段大小一致,则将PCR 产物测序验证。
1.2.7 药敏试验 按照美国临床检验标准委员会(CLSI)推荐的K-B药敏纸片扩散法操作标准,检测分离菌株对26种抗菌药物的敏感性,结果判定严格按照CLSI制定的标准执行,个别CLSI没有列出的药物则参考厂家提供的标准进行判断。
2 结果与分析
2.1 分离菌株的培养特征
从自然发病红罗非鱼(图1)脑组织中分离纯化获得1株优势菌,命名为FZT5。该分离菌株在绵羊血平板及BHI平板上均生长良好,为乳白色隆起、圆形、边缘较光滑的菌落,且呈γ溶血。革兰氏染色呈阳性,单个、成双或链状排列且长短不一(图2)。
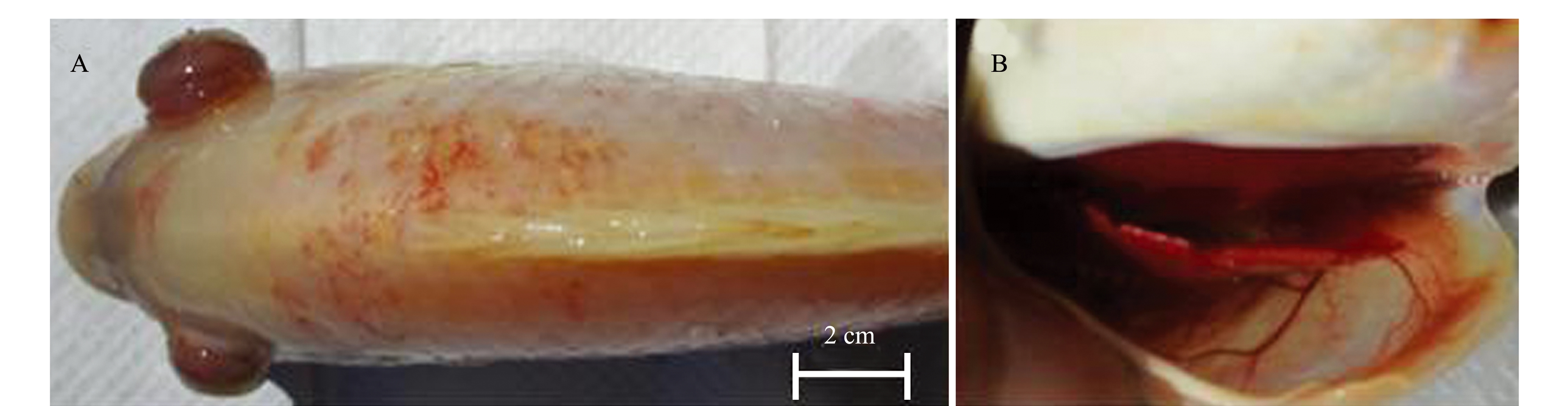
注:A为外观症状;B为鳃盖
Note: A, outer symptoms; B, opercula
图1 自然发病红罗非鱼的主要症状
Fig.1 Main symptoms of naturally diseased red tilapia
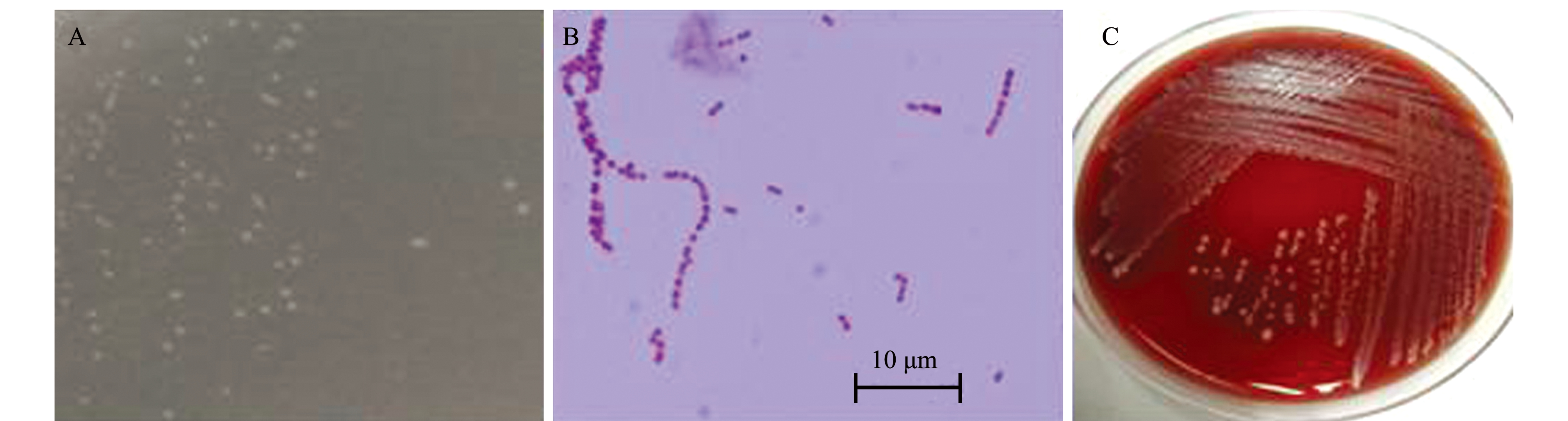
注:A为BHI培养基上的菌落形态;B为革兰氏染色的阳性菌株;C为血平板上的菌落形态
Note: A, colony morphology on BHI medium; B, gram-positive strain; C, colony morphology on blood agar
图2 菌株FZT5的菌落形态和细胞显微形态
Fig.2 Colony morphology and micro-morphology of strain FZT5
2.2 16S rRNA序列及系统发育树分析
PCR扩增FZT5分离菌株的16S rRNA基因,获得约为1500 bp左右的预期片段。PCR 扩增产物经测序及Blastn在线比对分析后,结果表明,菌株FZT5的16S rRNA与NCBI数据库的Streptococcus agalactiae GRS2047(GenBank登录号:JQ039376.1)、Streptococcus agalactiae GRS0574(GenBank登录号:JQ039371.1)和Streptococcus agalactiae HN0204(GenBank登录号:JQ910927.1)的16S rRNA基因序列一致性均为100%。基于16S rRNA序列构建分离菌株FZT5的系统发育树,从构建的系统发育树(图3)可知,该分离菌株与无乳链球菌一起归属在同一分支里,即与无乳链球菌聚为一类,这表明该分离菌株为无乳链球菌。
2.3 分离菌株的致病性
人工感染试验中,注射菌液浓度为4×108 CFU/mL的试验组鱼出现急性死亡,3个试验组第1 天均开始出现死亡,3 d内死亡率分别达到89%、78%、89%,而14 d内对照组鱼无死亡和发病现象。由于受试鱼在人工感染后短时间内死亡,所以未出现突眼等症状。
2.4 分离菌株的分子血清型
参照Ye等[4]的检测方法,用引物cpsES1和cpsGA1扩增分离菌株的cpsE-G基因,得到预期大小(约790 bp)的条带(图4,泳道3),通过Blast比对,结果与NCBI数据库中无乳链球菌(GenBank登录号:LC341250、LC341249、LT671983)cps基因的一致性为99%。将测序序列与无乳链球菌(GenBank登录号:AF332908)序列比对,SNPs出现了T1413C 和A1527T,根据Ye等[4]无乳链球菌的血清型分类标准,初步判断分离菌株的血清型属于Ⅰa或Ⅲ。然后通过扩增cps基因簇的cps H-I基因将血清型Ⅰa和Ⅲ分开。引物ⅠacpsHS1和cpsⅠa只能在Ⅰa型菌株中扩增出条带,而ⅠacpsHS1和ⅢcpsHS引物只能从Ⅲ型菌株中扩增出条带。PCR扩增结果表明,FZT5 PCR菌株可以用引物ⅠacpsHS1 和cpsⅠa扩增出条带,而用引物ⅠacpsHS1和ⅢcpsHS则没有扩增出条带,表明分离菌株的血清型应为Ⅰa型。用引物ⅠacpsHS1和cpsⅠa扩增出354 bp产物(图4,泳道2)与GenBank中Ⅰa血清型无乳链球菌(GenBank登录号:LT671983.1)对应序列一致性为100%,因此,该分离株的血清型应为Ⅰa型。

图3 FZT5菌株的系统发育树
Fig.3 Phylogenetic tree of strain FZT5
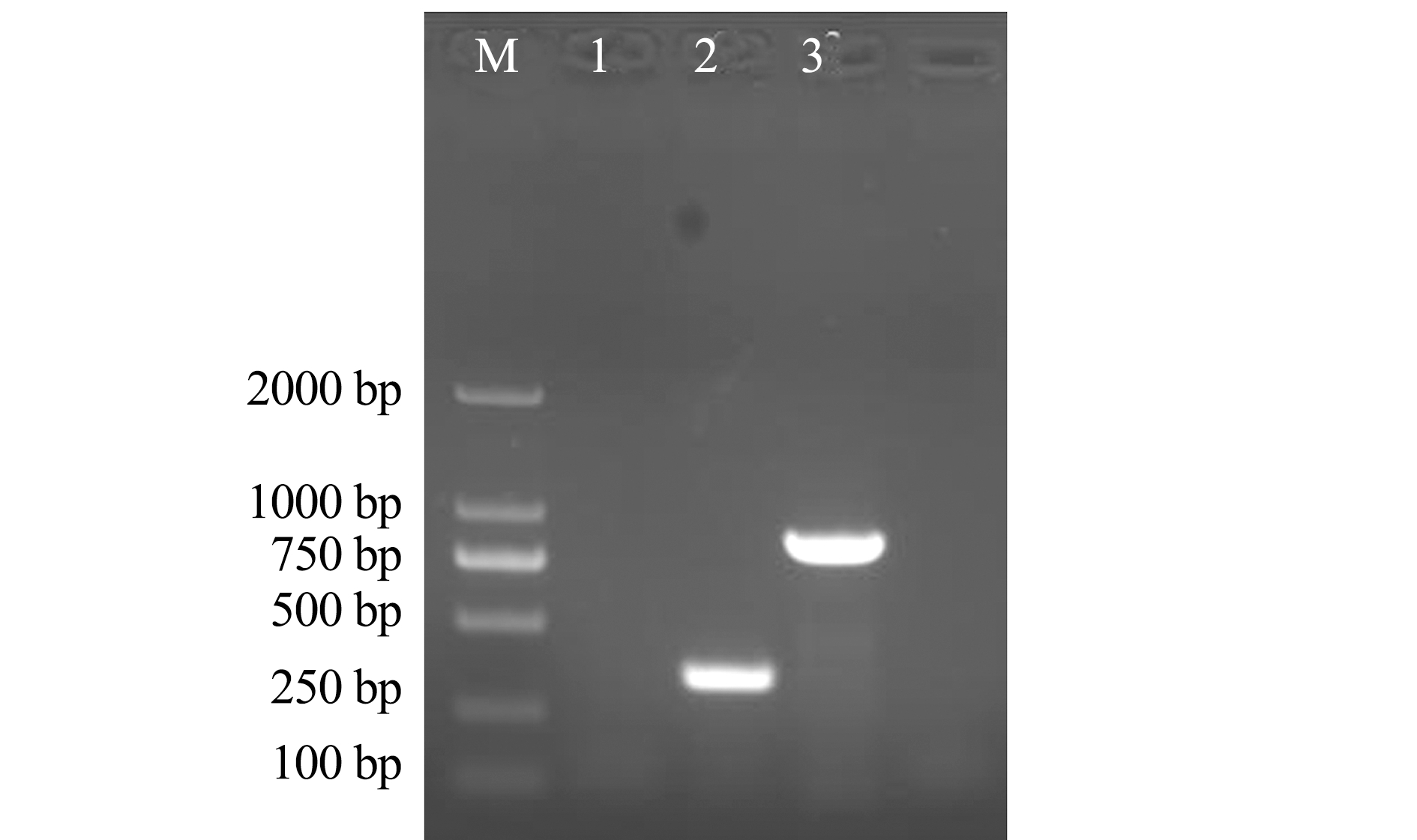
注:M为DNA分子质量标准;1为空白对照;2为cpsH-I基因(354 bp);3为cpsE-G 基因 (790 bp)
Note:M,DNA Marker;1,blank control;2,cpsH-I gene (354 bp);3,cpsE-G gene (790 bp)
图4 PCR扩增荚膜多糖基因
Fig.4 PCR amplification of capsular polysaccharide gene
2.5 分离菌株的MLST 分型
分离菌株FZT5的adhP、pheS、atr、glnA、sdhA、glcK和tkt等7个管家基因扩增产物测序结果表明,这7个等位基因类型分别为10、1、2、1、3、2和2,然后根据这些等位基因的类型查找其相应的ST型,结果表明,该菌株为ST7型(图5)。
注:M为DNA分子质量标准;1为adhP基因;2为pheS基因;3为tkt基因;4为sdhA基因;5为art基因;6为glcK基因;7为glnA基因
Note:M, DNA Marker;1, adhP gene;2, pheS gene;3, tkt gene;4, sdhA gene;5, art gene;6, glcK gene;7, glnA gene
图5 FZT5菌株的7个管家基因PCR扩增结果
Fig.5 PCR products of seven housekeeping genes from the isolated strain FZT5
2.6 分离菌株的毒力基因型
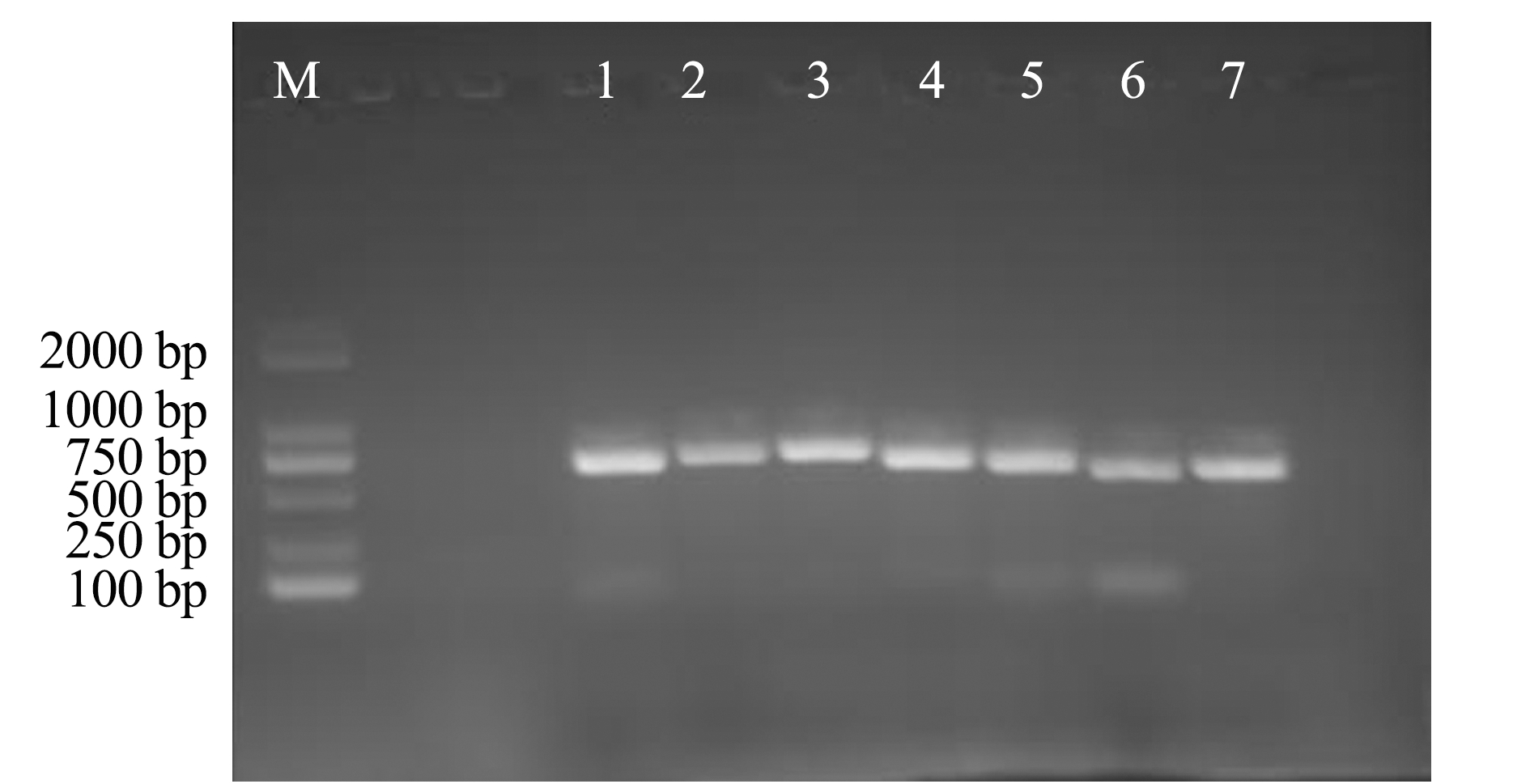
分离菌株FZT5的毒力基因检测结果表明,该菌株的毒力基因型为bac+-bca+-cfb+-hylB+-fbsA+-fbsB+-lmb--scpB--cpsE+-sip+。本研究中所选取的10个毒力基因中有2个为阴性,即该分离菌株缺失与入侵相关的基因lmb和scpB(图6)。
2.7 药敏试验结果
由药敏试验结果(表2)可知,FZT5菌株对26种试验药物敏感性存在差异,其对头孢哌酮、头孢克洛、头孢他啶、头孢拉定、强力霉素、四环素、氧氟沙星、环丙沙星、左氧氟沙星、氨苄青霉素、氟苯尼考、利福平、克林霉素等13种药物敏感,对头孢曲松、氟罗沙星、多粘菌素B、青霉素G等4种药物中度敏感,而对红霉素、诺氟沙星、链霉素、新霉素、庆大霉素、卡那霉素、磺胺异噁唑、甲氧苄氨嘧啶、复方新诺明等9种药物耐药。
表2 分离株FZT5对26种药物的敏感性
Tab.2 Sensitivity of FZT5 isolated from diseased red tilapia to 26 kinds of antimicrobial drugs
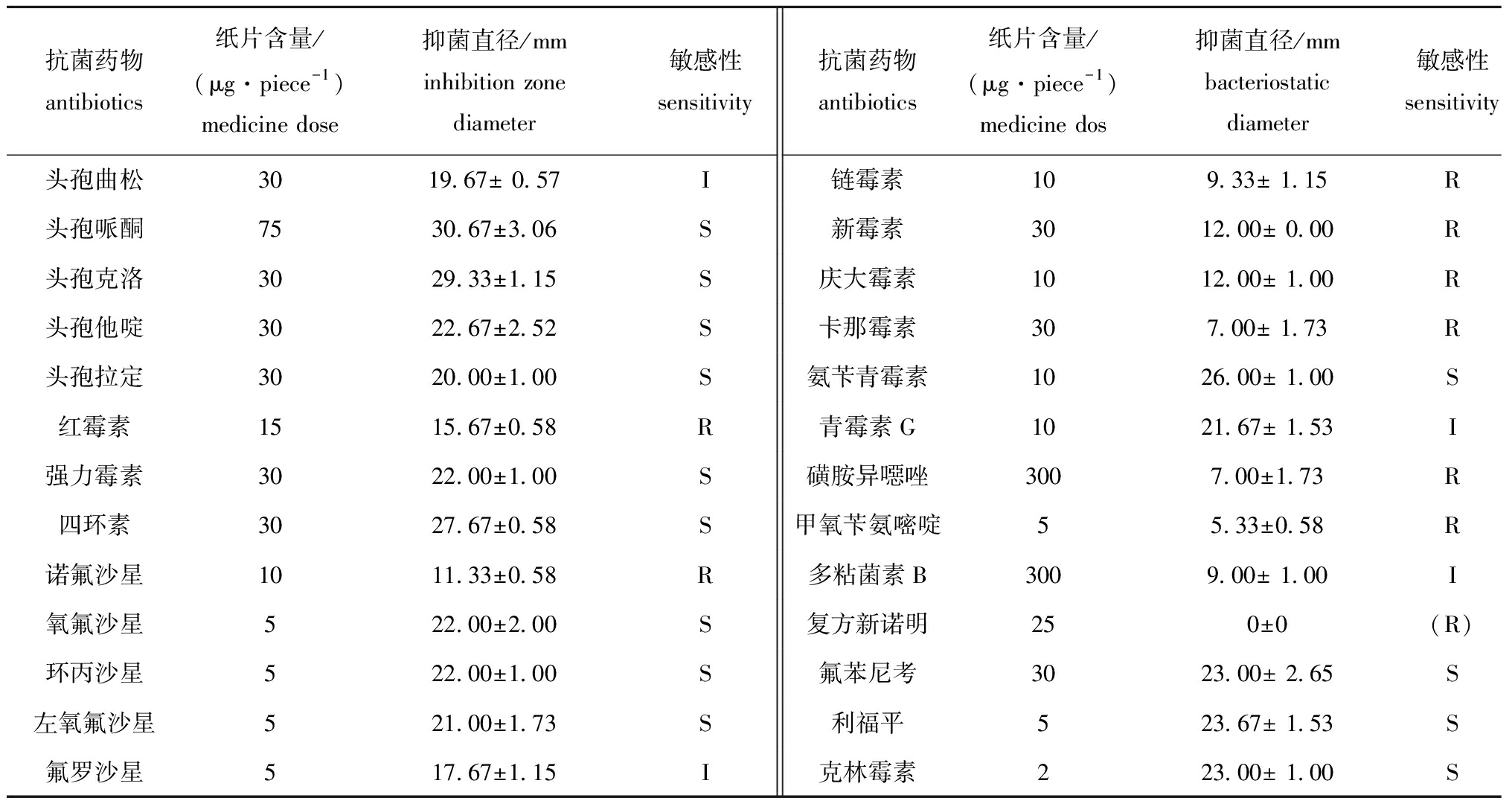
抗菌药物antibiotics纸片含量/(μg·piece-1)medicine dose抑菌直径/mminhibition zone diameter敏感性sensitivity抗菌药物antibiotics纸片含量/(μg·piece-1)medicine dos抑菌直径/mmbacteriostatic diameter敏感性sensitivity头孢曲松3019.67± 0.57I链霉素109.33± 1.15R头孢哌酮7530.67±3.06S新霉素3012.00± 0.00R头孢克洛3029.33±1.15S庆大霉素1012.00± 1.00R头孢他啶3022.67±2.52 S卡那霉素307.00± 1.73R头孢拉定3020.00±1.00S氨苄青霉素1026.00± 1.00 S红霉素1515.67±0.58R青霉素G1021.67± 1.53 I强力霉素3022.00±1.00 S磺胺异噁唑3007.00±1.73R四环素3027.67±0.58 S甲氧苄氨嘧啶55.33±0.58 R诺氟沙星1011.33±0.58 R多粘菌素B3009.00± 1.00 I氧氟沙星522.00±2.00S复方新诺明250±0(R)环丙沙星522.00±1.00 S氟苯尼考3023.00± 2.65S左氧氟沙星521.00±1.73S利福平523.67± 1.53S氟罗沙星517.67±1.15I克林霉素223.00± 1.00S
注:S为敏感,I为中度敏感,R为耐药,上述数据为3组试验的平均值
Note:S,sensitive; I,intermediately sensitive;R,resistant; a value represents the mean±S.D.(n=3)
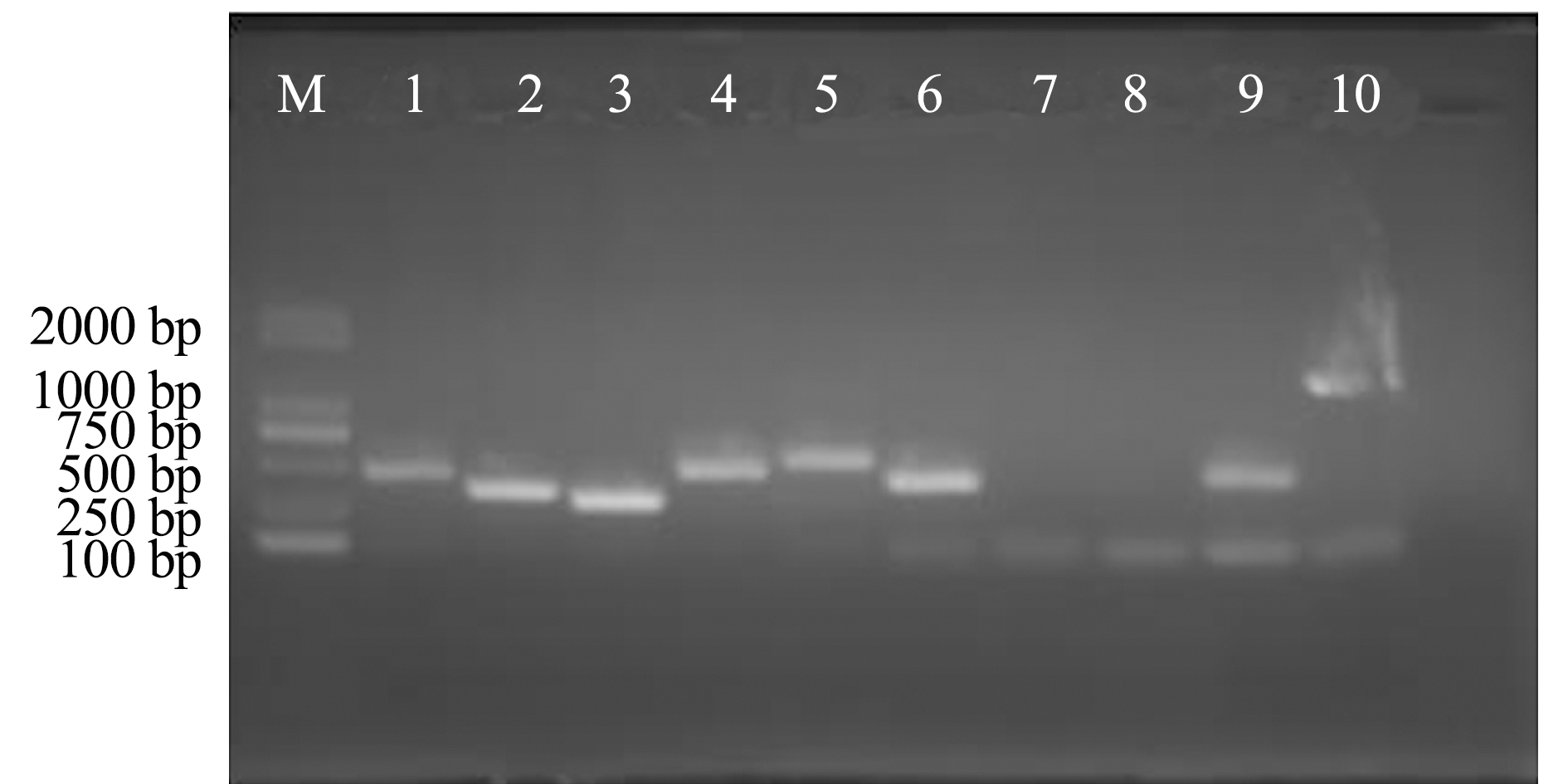
注:M为DNA分子质量标准;1为bac基因;2为bca基因;3为cfb基因;4为hylB基因;5为fbsA基因;6为fbsB基因;7为lmb基因;8为scpB基因;9为cpsE基因;10为sip基因
Note:M, DNA Marker;1, bac gene;2, bac gene;3, cfb gene;4, hylB gene;5, fbsA gene;6, fbsB gene;7, lmb gene;8, scpB gene;9, cpsE gene;10, sip gene
图6 FZT5菌株的毒力基因PCR扩增结果
Fig.6 PCR products of the virulence-related genes from the isolated strain FZT5
3 讨论
3.1 患病红罗非鱼无乳链球菌的分子分型
本研究中,从具有典型症状的红罗非鱼脑组织中分离获得1株γ溶血(即不溶血)无乳链球菌,已有的报道中,中国罗非鱼源无乳链球菌主要为β溶血,而α溶血和γ溶血的无乳链球菌较少[7,15],人工感染试验表明,γ溶血的无乳链球菌对罗非鱼具有较强的毒力[7]。本研究中,在福建省漳州市红罗非养殖场中发现了γ溶血的无乳链球菌,说明该地区存在γ溶血活性的无乳链球菌。
分子血清型检测结果表明,FZT5菌株为Ⅰa型。目前,鱼类无乳链球菌主要有3种血清型[16],分别是Ⅰa、Ⅰb和Ⅲ型,其中Ⅰa型是中国无乳链球菌的主要分子血清型[7],而Ⅰb 和Ⅲ型无乳链球菌则相对较少发现。Bachrach等[17]用血清型为Ⅰ型海豚链球菌株制备的疫苗接种了虹鳟,发现该疫苗对血清型为Ⅱ型的菌株免疫保护效果不佳。因此,确定无乳链球菌血清型对于链球菌病疫苗的研制和应用具有重要意义。
MLST分型结果表明,FZT5菌株为ST7型。目前,国外的一些研究团体对罗非鱼源无乳链球菌MLST分型进行了比较深入的研究,也发现了多种分型[18-19]。如在泰国养殖的罗非鱼中相继发现了ST7、ST500、ST283型无乳链球菌;在比利时及印度尼西亚养殖的罗非鱼中发现了ST261型无乳链球菌;在洪都拉斯、哥伦比亚等国家养殖的罗非鱼中发现了ST260型无乳链球菌;在越南养殖的罗非鱼中发现了ST491型无乳链球菌;中国养殖的罗非鱼中主要流行着Ⅰa-ST7型和Ⅰb-ST261型无乳链球菌[20],尚未发现如ST260、ST491、ST500和 ST283型罗非鱼源无乳链球菌。
3.2 患病红罗非鱼无乳链球菌的毒力基因分型
无乳链球菌作为条件致病菌,其致病性因毒力因子在表达上存在差异而有所不同[21],目前,对荚膜多糖和表面蛋白等毒力因子研究相对较多。本试验中,对毒力基因的检测结果表明,分离菌株FZT5的毒力基因型为bca+-bca+-cfb+-hylB+-fbsA+-fbsB+-lmb--scpB--cpsE+-sip+,即该菌株不携带lmb和scpB基因,这与Kayansamruaj等[22]报道的罗非鱼源Ⅰa 型无乳链球菌的基因组中没有lmb和scpB基因序列的研究结果相似,说明这两种基因可能不是罗非鱼无乳链球菌的主要毒力基因。
3.3 药物敏感性分析
目前,在实际生产中主要是使用抗菌药物来预防和治疗罗非鱼无乳链球菌病,而药物的敏感试验对临床用药具有重要的指导作用。本试验药敏结果显示,分离菌株FZT5对β-内酰胺类药物氨苄青霉素及环素类药物强力霉素、四环素等敏感,这与罗非鱼源无乳链球菌对氨苄青霉素、强力霉素、四环素较敏感的研究报道[23-24]一致;而FZT5菌株对大环内酯类红霉素和氨基糖苷类卡那霉素却表现为耐药,与张新艳等[23]得出的罗非鱼源无乳链球菌对红霉素和卡那霉素较敏感的结论不同,这可能与菌株来源地间的养殖因子和用药习惯不同有关。据胡大胜等[25]报道,长期大量使用抗菌药物会影响罗非鱼无乳链球菌的耐药性。因此,在进行药物治疗时应根据药敏结果科学用药,且不宜长期使用同一种药,以避免病原菌产生耐药性。
4 结论
本研究中从患病红罗非鱼脑组织中分离得到了1株Ⅰa-ST7型、不携带lmb和scpB毒力基因的无乳链球菌,该菌不具溶血性,说明福建漳州地区红罗非鱼存在γ溶血活性的无乳链球菌。药敏试验结果证实,该菌对强力霉素等13种药物敏感,本研究结果为福建省红罗非鱼无乳链球菌病的防治提供了基础数据。
致谢:感谢福建省水产技术推广总站吴斌高级工程师、福建省农业科学院所有老师和漳州市水产技术推广站所有老师对本研究提供的支持和帮助!
[1] 陈素芝,叶卫.我国引进的罗非鱼类的初步研究[J].动物学杂志,1994,29(3):18-23.
[2] 刘志刚,可小丽,卢迈新,等.温度对尼罗罗非鱼无乳链球菌毒力的影响[J].水产学报,2013,37(11):1733-1741.
[3] Li Liping,Wang Rui,Liang Wanwen,et al.Rare serotype occurrence and PFGE genotypic diversity of Streptococcus agalactiae isolated from tilapia in China[J].Veterinary Microbiology,2013,167(3-4):719-724.
[4] Ye Xing,Li Jiong,Lu Maixin,et al.Identification and molecular typing of Streptococcus agalactiae isolated from pond-cultured tilapia in China[J].Fisheries Science,2011,77(4):623-632.
[5] Pasnik D J,Evans J J,Klesius P H.Duration of protective antibodies and correlation with survival in Nile tilapia Oreochromis niloticus following Streptococcus agalactiae vaccination[J].Diseases of Aquatic Organisms,2005,66(2):129-134.
[6] 李莉萍,王瑞,黄婷,等.2007—2012年中国罗非鱼无乳链球菌流行菌株血清型分析[J].大连海洋大学学报,2014,29(5):469-475.
[7] 郭玉娟,张德锋,樊海平,等.中国南方地区罗非鱼无乳链球菌的分子流行病学研究[J].水产学报,2012,36(3):399-406.
[8] 黎娅,罗福广,左跃,等.罗非鱼源γ溶血性无乳链球菌的分离鉴定[J].淡水渔业,2014,44(4):63-66,76.
[9] 方伟,梁宇恒,宁丹,等.广东地区感染养殖罗非鱼的无乳链球菌分子分型研究[J].中山大学学报:自然科学版,2016,55(2):97-101.
[10] 李学军,李思发,冯金海,等.以色列红罗非鱼耐盐性的初步研究[J].上海水产大学学报,2003,12(3):205-208.
[11] 李双双,贺志沛,罗俊娜,等.兔源大肠杆菌的分离鉴定及药物敏感性检测研究[J].江西农业学报,2013,25(8):70-72.
[12] Jones N,Bohnsack J F,Takahashi S,et al.Multilocus sequence typing system for group B Streptococcus[J].Journal of Clinical Microbiology,2003,41(6):2530-2536.
[13] 彭民毅.广西罗非鱼无乳链球菌病病原分离、鉴定及毒力基因检测分析[D].南宁:广西大学,2014.
[14] Godoy D T,Carvalho-Castro G A,Leal C A G,et al.Genetic diversity and new genotyping scheme for fish pathogenic Streptococcus agalactiae[J].Letters in Applied Microbiology,2013,57(6):476-483.
[15] 可小丽,卢迈新,李庆勇,等.罗非鱼无乳链球菌鉴定及基于cfb和16S rRNA基因同源性分析[J].中国农学通报,2013,29(20):52-62.
[16] Dangwetngam M,Suanyuk N,Kong F,et al.Serotype distribution and antimicrobial susceptibilities of Streptococcus agalactiae isolated from infected cultured tilapia (Oreochromis niloticus) in Thailand:nine-year perspective[J].Journal of Medical Microbiology,2016,65(3):247-254.
[17] Bachrach G,Zlotkin A,Hurvitz A,et al.Recovery of Streptococcus iniae from diseased fish previously vaccinated with a Streptococcus vaccine[J].Applied and Environmental Microbiology,2001,67(8):3756-3758.
[18] Delannoy C M,Crumlish M,Fontaine M C,et al.Human Streptococcus agalactiae strains in aquatic mammals and fish[J].BMC Microbiology,2013,13:41.
[19] Lusiastuti A M,Textor M,Seeger H,et al.The occurrence of Streptococcus agalactiae sequence type 261 from fish disease outbreaks of tilapia Oreochromis niloticus in Indonesia[J].Aquaculture Research,2014,45(7):1260-1263.
[20] 张德锋,袁伟,可小丽,等.中国罗非鱼主养区无乳链球菌的分子流行特征及其传播方式[J].中国水产科学,2017,24(3):606-614.
[21] Rajagopal L,Vo A,Silvestroni A,et al.Regulation of cytotoxin expression by converging eukaryotic-type and two-component signalling mechanisms in Streptococcus agalactiae[J].Molecular Microbiology,2006,62(4):941-957.
[22] Kayansamruaj P,Pirarat N,Kondo H,et al.Genomic comparison between pathogenic Streptococcus agalactiae isolated from Nile tilapia in Thailand and fish-derived ST7 strains[J].Infection,Genetics and Evolution,2015(36):307-314.
[23] 张新艳,樊海平,钟全福,等.罗非鱼无乳链球菌的分离、鉴定及致病性研究[J].水产学报,2008,32(5):772-779.
[24] 祝璟琳,杨弘,邹芝英,等.海南养殖罗非鱼(Oreochromis niloticus)致病链球菌的分离、鉴定及其药敏试验[J].海洋与湖沼,2010,41(4):590-596.
[25] 胡大胜,黄钧,黄艳华,等.12种药物对罗非鱼无乳链球菌的抑菌试验[J].中国水产,2012(8):60-63.