在生物免疫反应研究中,主要组织相容性复合体(Major histocompatibility complex,MHC)对诱导和调节免疫应答具有重要作用,且是目前已知的多态性最丰富的一个基因系统,存在大量基因座位,每个基因座位存在着大量等位基因,这种多态性导致每个个体都能结合和呈递相当数量的、与免疫反应相关的多肽,成为疾病抗性和易感性候选标记基因[1-2]。MHC蛋白分为3类,其中,MHCⅡ类是由α链和β链组成的跨膜糖蛋白,具有向T细胞呈递抗原的功能,主要在与呈递抗原有关的细胞中表达,如树突细胞、B细胞、胸腺上皮细胞,静止状态的单核细胞和巨噬细胞表达MHCⅡ类分子甚少,但活化时表达显著增强,大多数动物活化的T细胞也表达Ⅱ类分子[3]。自1990年克隆出鲤Cyprinus carpio[4]的MHC基因部分序列以来,研究人员已对印度斑马鱼Brachydanio rerio [5]、半滑舌鳎Cynoglossus semilaevis[6]、尼罗罗非鱼Oreochromis niloticu[7]和真鲷Chrysophrys major[8]等多种鱼类的MHC基因的表达和多态性进行了研究。在鱼类抗病育种方面,随着MHCⅡ类基因多态性研究的广泛开展,可以为更准确地探讨鱼类Ⅱ类基因种群间多态性、种群内个体多态性与鱼体抗病力的关系[1]:张玉喜等[9]开展了牙鲆Paralichthys olivaceus MHCⅡβ基因多态性与鱼体抗病力关系的研究,发现13个不同的等位基因及MHC位点多态性与抗病力的关系,筛选到2个与牙鲆抗病密切相关的基因型。
鲟为古老的软骨硬鳞类,具有水中“活化石”之称,又是大型水生经济动物,具有重要的科研、经济价值,西伯利亚鲟Acipernser baerii隶属于鲟形目、鲟科、鲟属,是重要的鲟鱼养殖品种和育种材料,近年来,鲟养殖病害问题已经凸显[10-13],给水产品质量安全带来了隐患,制约着鲟鱼产业的健康可持续发展。目前,对鲟MHC的研究较少,且多用来研究物种进化,而对西伯利亚鲟MHCⅡβ的研究鲜有报道,因此,对该基因结构、功能、多态性与疾病关联性的深入研究,将有助于发现与疾病相关联的易感基因或抗性基因,为鲟鱼抗病选育及健康养殖提供帮助。
1 材料与方法
1.1 材料
试验用西伯利亚鲟采自北京市水产科学研究所国家级鲟鱼良种场,平均体质量为260 g,将试验鱼暂养两周后开始试验,暂养期间水温约为22 ℃,每天投喂两次,投饲量为鱼体质量的1%。
RNA提取和RNase-Free DNase Set试剂盒购自Qiagen公司。Trizol、RT试剂盒购自Invitrogen公司,RACE 试剂盒(clontech)、pGM-19T 载体和胶回收试剂盒均购自TaKaRa公司。实时定量试剂为AB公司的2×Sybrgreen PCR Master Mix。克隆菌株DH10B由渔业生物技术北京市重点实验室保存。使用Primer 5.0软件设计引物(表1),引物合成及序列测定由北京擎科生物工程有限公司完成。
表1 试验用引物
Tab.1 Primers used in the experiment

序号 No.引物 primer序列 sequence(5′-3′)1M2β-FCACCCAGTGTCAGAGTTCG2M2β-RGATAGGTCCAGTCTCCATCA33′M2βACGGCTGATGTATCCTCG4APGGCCACGCGTCGACTAGTACTTTTTTTTTT55′ M2β-FCAGCAGCCTTCCCTAACA65′ M2β-RAGCCAGGTCACCTTTATCTCA7McdS-FCCCTAACAATGGTAGCCTCT8McdS-RAAGCTCTTAATGTAGCGAAT9S7ATGGTAGCCTCTTCATTG10Anti-306CATCATGTCCTTATCCTTG1118S-FTGCCCTATCAACTTTCGATGG1218S-RCTGCCTTCCTTGGATGTGGT
1.2 方法
1.2.1 细菌人工感染和采样 取暂养鱼3尾,快速深度麻醉后先从尾静脉采血,然后采集肝、鳃、脾、肠、心脏、性腺、脑、肌肉、皮肤组织样品,用液氮速冻后于-80 ℃下保存,用于分析基因的组织表达。
试验用维氏气单胞菌由北京市水产科学研究所水产动物营养与病害防治研究室提供,将菌株活化后,用平板菌落计数法测定菌液浓度。通过预试验,确定攻毒浓度,取50尾鱼作为处理组,进行细菌人工感染试验,每100 g体质量注射0.1 mL浓度为2.0×107 CFU/mL的菌液,对照组30尾鱼注射同体积的生理盐水,水温为22.6~24.5 ℃。感染期间停止投喂,感染后持续观察鱼的活动状况,处理组在感染40 h后出现濒临死亡个体,即身体失去平衡,翻白漂浮在水面,呼吸微弱接近死亡,以“濒死”作为敏感个体取样标准。处理组在40、44、62、93 h处取样,记为40、44、62、93 h处照组,对照组只在有代表性的时间节点即试验组开始死亡时和停止死亡时取样,即40、93 h时取样,记为40、93 h对照组。在每个时间点从各组取3尾鱼,采集肝、脾、肠组织样品用液氮速冻后于-80 ℃下保存,用于分析细菌感染后基因的组织表达变化。
1.2.2 MHCⅡβ cDNA克隆 提取各样品组织的总RNA,在RNase-Free DNase set柱上处理基因组,用Nanodrop测定浓度和OD值,根据OD260 nm/OD280 nm比值和琼脂糖凝胶电泳判断RNA的质量,根据SuperScript Ⅲ First-Strand Synthesis System for RT-PCR(Invitrogen)使用说明进行RT-PCR反应,以oligo(dT)20为引物,合成cDNA第一链。
以上述脾脏的cDNA第一链为模板,根据GenBank中登录的MHCⅡβ保守区设计引物M2β-F和M2β-R扩增中间片段。PCR反应体系为:10×buffer 2 μL,10 mmol/L dNTPs 0.8 μL,10 μmol/L上、下游引物各0.6 μL,5 U/μL Taq酶0.2 μL,RT液2.0 μL,加ddH2O至20 μL。反应条件为:94 ℃下预变性3 min;94 ℃下循环变性30 s,58 ℃下退火复性30 s,72 ℃下延伸30 s,共进行35个循环;最后在72 ℃下再延伸10 min,PCR产物经过胶回收后克隆测序。根据中间片段测序结果,设计引物3′端引物,以上述cDNA第一链为模板,通过引物3′ M2β和AP进行扩增。5′端根据相邻物种的OFR设计引物5′M2β-F和5′M2β-R进行扩增。扩增产物用胶回收,蓝白斑筛选和菌液鉴定后测序。利用上述中间片段、3′端和5′端片段重叠区域,使用DNAStar中的Seqman拼接成完整的西伯利亚鲟MHCⅡβ cDNA全序列。为验证拼接的准确性,设计引物McdS-F和McdS-R,克隆包含可读编码框(OFR)在内的长片段1236 bp,并与全长比较。
1.2.3 荧光定量PCR 取各样品组织总RNA 1 μg进行反转录,同时进行无反转录酶(NRT)和无RNA(NOT)对照,以18S为内参基因,采用2ΔΔCT法进行荧光定量分析。在健康组织基因表达中以肌肉组织表达量为基准1,在细菌攻毒后的组织基因表达中以40 h时组织表达量为基准1。反应体系(25 μL):2×sybrgreen PCR Master Mix 12.5 μL,10 μmol/L上、下游引物各0.3 μL,模板2 μL,加ddH2O至25 μL。每个模板设3个重复。反应程序为:50 ℃下预变性2 min;95 ℃下循环变性10 min,95 ℃下退火复性15 s,60 ℃下延伸30 s并采集荧光信号,共进行40个循环。反应结束后进行溶解曲线分析,结果使用IBM SPSS Statistics进行单因素方差分析(One-way ANOVA),方差具有齐次性时采用Duncan进行多重比较。
2 结果与分析
2.1 MHCⅡβ cDNA全长克隆
中间片段经克隆测序为180 bp,通过NCBI的Blast检索,该片段和GenBank中匙吻鲟Polyodon spathula、大西洋鲟Acipenser sturio的MHCⅡβ mRNA重叠区相似度为98%,编码的氨基酸与GenBank中MHCⅡβ蛋白序列有很高的相似性,所以该片段为MHCⅡβ cDNA部分序列。3′RACE得到915 bp,5′端扩增得到509 bp。将上述5′、中间和3′序列使用DNAStar中的Seqman拼接得到西伯利亚鲟MHCⅡβ cDNA序列1443 bp,使用引物McdS-F和McdS-R克隆得到1236 bp,通过与全长比较证明序列拼接正确可靠。
2.2 序列分析
西伯利亚鲟MHCⅡβ的cDNA全序列1443 bp(NCBI:JQ288773)(图1),使用DNAStar中的Editseq分析其5′非编码区18 bp,3′非编码区624 bp,可读编码框801 bp,编码266个氨基酸,预测蛋白相对分子质量为29 790 230,氨基酸残基中包含26个强碱性氨基酸(+)(K,R),29个强酸性氨基酸(-)(D,E),82个疏水氨基酸(A,I,L,F,W,V),85个极性氨基酸(N,C,Q,S,T,Y),等电点为6.2,整个蛋白带负电荷-2.459(pH 7.0),利用Smart站点进行蛋白质结构预测(http://smart.embl-heidelberg.de/Smart),44-119aa为SMART MHC_Ⅱ_beta 结构域(SM000921),144-215aa为SMART IGc1 结构域(SM000407)。氨基酸序列可分为先导肽(信号肽的一种)LP、β1结构域、β2-1结构域、β2-2结构域及TM/CY跨膜区和胞质区。

注:LP为先导肽;TM为跨膜结构域;CY为胞质结构域;下划线为跨膜结构域的多疏水残基特征基序
Note:LP,leader peptide;TM,transmembrane region;CY,cytoplasmic domain;The multiple hydrophobic residues motifs in transmembrane region are underlined
图1 西伯利亚鲟的MHCⅡβ cDNA序列及推导出的氨基酸序列
Fig.1 cDNA sequence and deduced amino acid sequence of MHCⅡβ in Siberian sturgeon Acipenser baerii
2.3 同源性分析
将西伯利亚鲟MHCⅡβ cDNA在NCBI上用Blast进行分析,结果显示,与鲟科鱼类相似度较高,与匙吻鲟一致性为85%,除鲟科鱼类外,与其他物种的相似度较低,例如,与相似度最高的斑点雀鳝Lepisosteus oculatus的覆盖率(query cover)40%,一致性为73%。因氨基酸序列比对的相似性较高,在GenBank中选取一些物种的氨基酸序列(表2),使用ClustalX软件对这些氨基酸序列进行比对,用MEGA6软件采用邻接法(Neighbor-Joining)构建的系统发育树(图2),Bootstrap验证,重复1000次。由图2可见,西伯利亚鲟首先和匙吻鲟聚为一支,然后和斑点雀鳝聚为一个分支,与其他硬骨鱼类聚为一大支,亲缘关系较近。
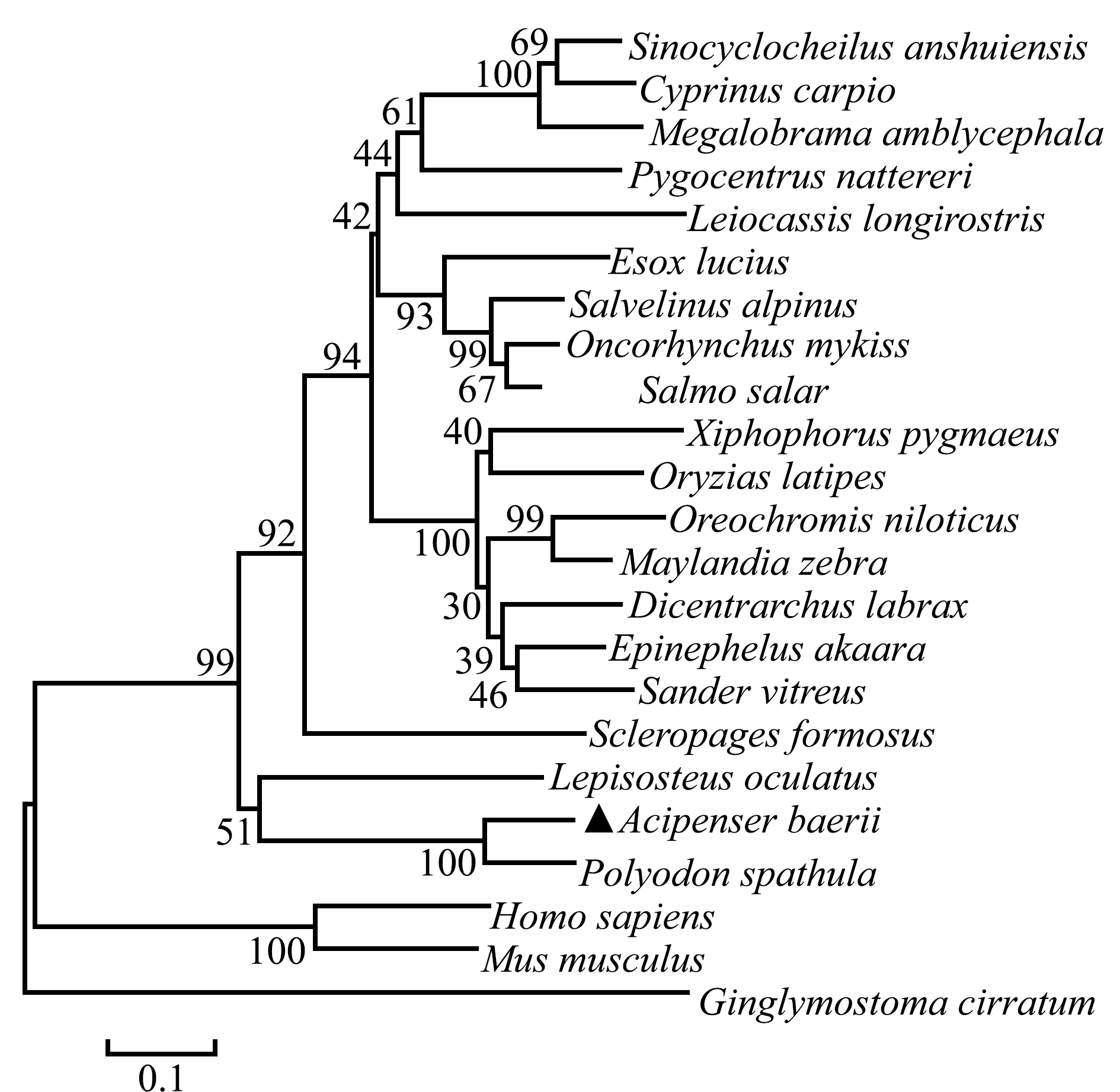
图2 西伯利亚鲟MHCⅡβ氨基酸序列系统发育树
Fig.2 Phylogenetic tree of MHCⅡβ amino acid sequence in Siberian sturgeon Acipenser baerii
2.4 蛋白质二级结构预测
用DNAStar中的Protean对西伯利亚鲟MHCⅡβ编码蛋白的二级结构、抗原位点、亲水性、疏水性等进行预测(图3)。经Hydropathy-Kyte-Doolittle预测,该蛋白亲水性区域远远大于疏水性区域,表明该蛋白是亲水性的。图3中,Alpha Regions为α螺旋区,Beta Regions为β折叠区,Turn Regions为转角区,Coli Regions为无规则卷曲区,Hydrophilcity Polt为亲水区,Antigen Index为抗原性指数,Surface Probablity为表面可能性。
经Antigenic-Jameson-Wolf预测潜在的蛋白质抗原决定簇,发现该蛋白的抗原位点丰富,具有良好的抗原性。二级结构中chou-fasman方案预测α-螺旋为19.5%,β-折叠为33%,转角区域为39%,Gmier-Roboson预测α-螺旋为32.6%,β-折叠为53.2%,转角区域为10.1%,无规则卷曲为4.49%。利用信号肽预测工具SignalP-noTM对西伯利亚鲟MHCⅡβ蛋白序列在线搜索,在34aa和35aa之间具有信号肽切割位点[14]。
表2 用于构建系统发育树的氨基酸序列
Tab.2 Amino acid sequences of NJ tree

种类speciesGenBank accession No.金线鲃Sinocyclocheilus anshuiensisXP_016303638.1鲤Cyprinus carpioCAA88847.1团头鲂Megalobrama amblycephalaAGV52144.1红腹食人鱼Pygocentrus nattereriXP_017543783.1长吻鮠Leiocassis longirostrisACY72850.1大西洋鲑Salmo salarXP_013988542.1北极红点鲑Salvelinus alpinusACI05078.1白斑狗鱼Esox luciusXP_010867780.2虹鳟Oncorhynchus mykissCBX11171.1剑尾鱼Xiphophorus pygmaeusACF49165.1青鳉Oryzias latipesBAA94279.1尼罗罗非鱼Oreochromis niloticusXP_003459301.2斑马鱼Maylandia zebraXP_004575505.1鲈鱼Dicentrarchus labraxCAJ34344.1石斑鱼Epinephelus akaaraACA63825.1玻璃梭鲈Sander vitreusAAO19848.1亚洲龙鱼Scleropages formosusXP_018602306.1斑点雀鳝Lepisosteus oculatusXP_006643426.1西伯利亚鲟Acipenser baeriiAFL72081.1匙吻鲟Polyodon spathulaACZ26348.1人Homo sapiensNP_002114.3小鼠Mus musculusP18469.1护士鲨Ginglymostoma cirratumAAF82681.1
2.5 MHCⅡβ mRNA组织分布和细菌感染后的表达变化
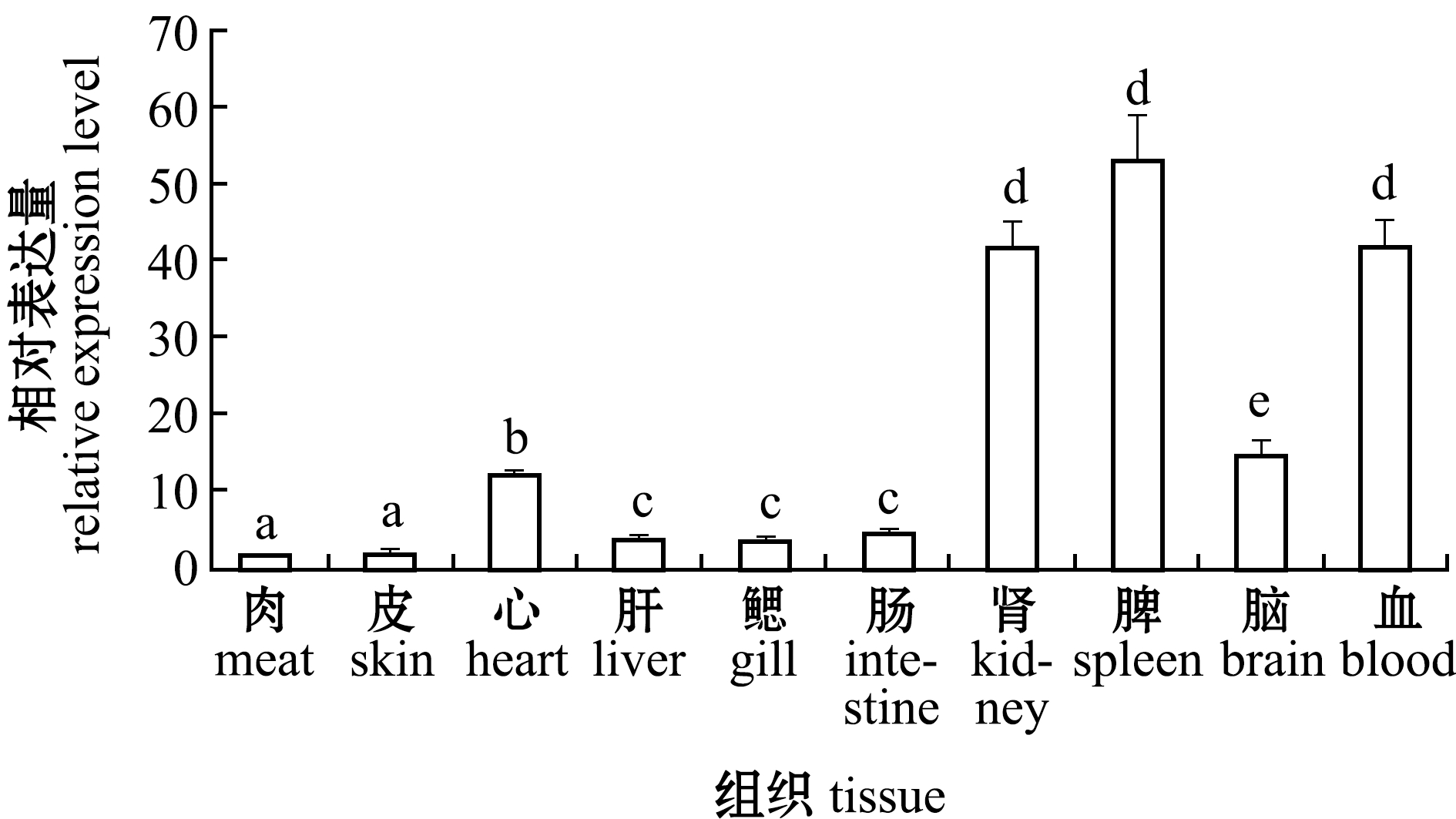
实时定量分析表明,正常情况下,西伯利亚鲟肌肉、皮肤、心脏、肝脏、鳃、肠、头肾、脾脏、脑、血液10种组织中均有MHCⅡβ基础表达(图4),其中,脾脏、血液和头肾表达量较高(P<0.05),心和脑中等程度表达,肝、鳃、肠表达水平较低,皮肤和肌肉中的表达量极低(P<0.05)。
从图5可见:细菌攻毒40 h后,西伯利亚鲟肠、肝脏和脾脏的MHCⅡβ mRNA表达量低于未感染细菌的对照组水平;脾脏40 h时表达水平显著下降(P<0.05),之后44 h、62 h一直保持较低水平,93 h时脾脏表达量恢复到对照组水平,变化显著(P<0.05);肝脏和肠的表达也呈现40~62 h下降93 h上升的趋势,但由于方差较大,无显著性差异(P>0.05)。
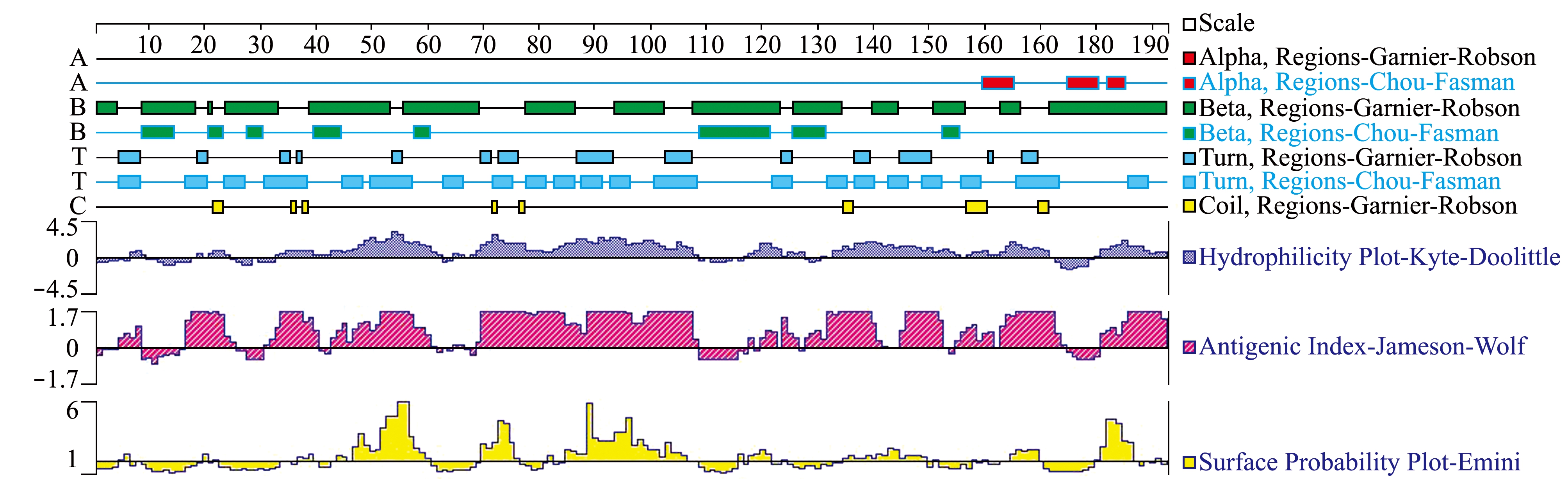
图3 用DNAStar预测西伯利亚鲟MHCⅡβ二级结构
Fig.3 Predict secondary structure of MHCⅡβ in Siberian sturgeon Acipernser baerii by DNAStar
注:标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同
Note:The means with different letters are significantly different in the groups at the 0.05 probability level,and the means with the same letters are not significant differences,et sequentia
图4 西伯利亚鲟MHCⅡβ mRNA的组织分布(n=3)
Fig.4 Tissue expression of MHCⅡβ mRNA of Siberian sturgeon Acipernser baerii(n=3)
3 讨论
3.1 MHCⅡβ基因的组织表达
MHCⅡ类基因参与机体外源性抗原的呈递,在细胞免疫和体液免疫中起着重要作用,哺乳类MHCⅡ类基因表达主要局限在B细胞、巨噬细胞、树突状细胞[2,15]。近年来,对多种鱼类研究表明,大多数鱼类在脾、肾、胸腺和肠等免疫相关组织中表达量较高[1,16]。但日本七鳃鳗L.japonica MHCⅡβ在鳃、心脏、血液中高表达,在肾脏只有少量表达[17],Pang等[7]发现,罗非鱼MHCⅡβ在胃和鳃中高表达,在肌肉和脑中低表达。本研究表明,西伯利亚鲟MHCⅡβ在检测的各组织均有基础表达,具有一定的组织特异性:脾脏、血液和头肾中表达量较高,心和脑中等程度表达,肝、鳃、肠表达水平较低,皮肤和肌肉中的表达量极低。脾脏是重要的免疫器官,田照辉等[18]在对西伯利亚鲟HSP70 mRNA组织特异性分析时发现,脾脏表达量最高,此结果与本研究结果较一致。鲟的心包组织和脑膜髓组织具有免疫功能[19],这可能是心和脑中等程度表达的原因。

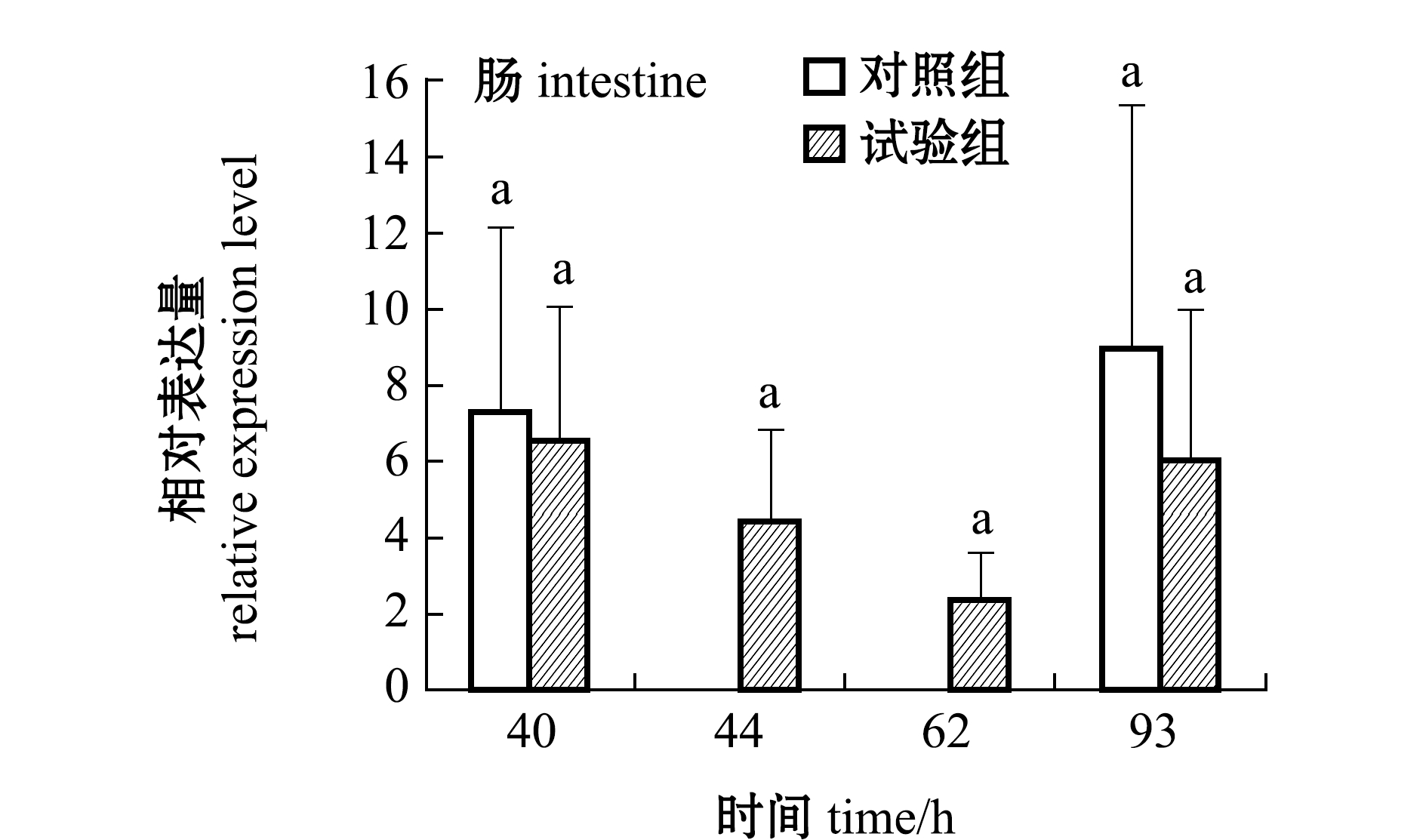
图5 注射维氏气单胞菌后西伯利亚鲟组织中MHCⅡβ表达的变化(n=3)
Fig.5 Changes in MHCⅡβ mRNA expression in tissues of Siberian sturgeon Acipenser baerii injected with Aeromonas veronii(n=3)
3.2 细菌感染后MHCⅡβ基因的表达变化
凡是能激活免疫细胞的刺激源,如感染的病原体、抗原及各种炎症反应都能刺激局部组织发生MHC上调,细胞因子IFN-γ可诱发和增强免疫细胞(除B细胞外)表达Ⅱ类分子并增强它们的表达,肿瘤坏死因子TNF-α系统上调白细胞介素4、10、13,从而增强B细胞表达Ⅱ类分子[2]。但是,不同鱼类经抗原刺激后MHCⅡβ表达情况并不一致:七鳃鳗被脂多糖LPS刺激后MHCⅡβ表达无明显变化[16];半滑舌鳎被迟缓爱德华氏菌感染后,脾脏24~96 h时表达明显降低,肝脏和肠的表达24 h内显著升高,24~72 h显著降低,96 h时显著升高[6];真鲷被鳗弧菌感染后5~72 h时,肝脏、脾脏、头肾和肠的MHCⅡβ表达量降低,96 h时恢复至正常水平[8];Wolk等[20]进行单核细胞培养时加入使用2 ng/mL脂多糖LPS,在36 h时可以导致单核细胞表面MHCⅡ分泌急剧减少;Kunz等[21]探究了LPS致使单核细胞MHCⅡ减少的多种机制;Zhou等[22]对罗非鱼Oreochromis niloticus用嗜水气单胞菌A.hydrophila攻毒后,96 h时肠和脾脏MHCⅡβ未有变化,肝和鳃48 h后发生下调随后恢复,肾脏24~72 h时明显下调;而Pang等[7]对罗非鱼注射弧菌Streptococcus agalactiae后,鳃、肾、肠、脾的MHCⅡβ表达显著升高。
有研究表明,MHC表达量影响T细胞反应,增加MHC的表达会影响特定抗原激活T细胞的机会[3],林茜草黄酮能增加MHCⅠ、MHCⅡ在肿瘤细胞表面的表达,从而增强特异性细胞的抗肿瘤免疫反应[23]。西伯利亚鲟在细菌攻毒后,肠、肝脏和脾脏的MHCⅡβ mRNA的表达量呈先降低后升高的趋势,其中,脾脏变化显著,说明西伯利亚鲟的MHCⅡβ参与了免疫反应,93 h后表达量开始恢复和增加的现象,与西伯利亚鲟被感染维氏气单胞菌93 h后免疫球蛋白IGM重链区mRNA表达量开始增加一致[24],此时机体可能已经开始逐步形成特异性免疫,具体作用机制还有待于深入研究。
3.3 MHCⅡβ基因的内含子
MHCⅡβ多态性高,尤其是第二外显子变异高度丰富,因而MHCⅡβ核酸序列保守性差,但氨基酸序列的保守性相对较强,例如,日本七鳃鳗核酸序列与大菱鲆同源性最高,仅为63.8%,与虹鳟、斑马鱼、鲤鱼一致性只有39.9%~30.2%[17]。鉴于本研究中克隆西伯利亚鲟MHCⅡβ cDNA序列的保守性较差,因此,依据其氨基酸序列比对进行了该基因外显子界限的预测,主要参考斑点雀鳝Lepisosteus oculatus(NCBI:NW_006270278.1)、白斑狗鱼Esox lucius(NCBI:NW_011545392.1)和青鳉Oryzias latipesMHCⅡβ基因外显子的划分[25],将西伯利亚鲟MHCⅡβ推到的氨基酸序列划分为先导肽LP、β1结构域、β2-1结构域、β2-2结构域及TM/CY跨膜区和胞质区。
MHC的肽结合区决定了与外源肽结合的亲和力和T细胞识别的特异性,是多态性残基集中的主要区域。 MHCⅡβ多态性位点主要在外显子2上。本研究设计了多对引物扩增MHCⅡβ基因的DNA序列未能成功,根据外显子界限的预测,通过设计跨第一外显子和第二外显子的引物S7和anti306进行扩增,扩增结果为预测的第一外显子和第二外显子之间不含内含子。Venkatesh等[26]认为,在物种进化过程中基因内含子有可能丢失或增加,形成不同的剪切体,例如,他们在扩增箱鲀Ostracion cubicus的MHCⅡα基因时得到两种PCR产物,一种含有内含子,一种不含内含子,扩增得到的闪光鲟MHCⅡα基因未有内含子。但因未见MHCⅡβ基因不含内含子的报道,所以也可能本研究中预测的外显子界限有误,西伯利亚鲟MHCⅡβ基因第一外显子和第二外显子是否含有内含子还有待于深入研究。
[1] 于辉,李波,李华,等.鱼类主要组织相容性Ⅱ类基因的研究进展[J].中国水产科学,2007,14(2):336-342.
[2] 何球藻,吴厚生,曹雪涛.细胞与分子免疫学[M].上海:上海科学技术文献出版社,1997:77-79.
[3] Neilson E G,Couser W G,主编.韩瑞发,姚智,王林主,译.免疫肾脏病学[M].沈阳:辽宁科学技术出版社,2006:177.
[4] Hashimoto K,Nakanishi T,Kurosawa Y.Isolation of carp genes encoding major histocompatibility complex antigens[J].Proceedings of the National Academy of Sciences of the United States of America,1990,87(17):6863-6867.
[5] Sültmann H,Mayer W E,Figueroa F,et al.Organization of Mhc,Class Ⅱ B genes in the zebrafish(Brachydanio rerio )[J].Genomics,1994,23(1):1-14.
[6] Xu T J,Chen S L,Ji X S,et al.Molecular cloning,genomic structure,polymorphism and expression analysis of major histocompatibility complex class ⅡA and ⅡB genes of half-smooth tongue sole(Cynoglossus semilaevis)[J].Fish & Shellfish Immunology,2009,27(2):192-201.
[7] Pang J C,Gao F Y,Lu M X,et al.Major histocompatibility complex class ⅡA and ⅡB genes of Nile tilapia Oreochromis niloticus:genomic structure,molecular polymorphism and expression patterns[J].Fish & Shellfish Immunology,2013,34(2):486.
[8] Chen S L,Zhang Y X,Xu M Y,et al.Molecular polymorphism and expression analysis of MHC class Ⅱ B gene from red sea bream(Chrysophrys major)[J].Developmental & Comparative Immunology,2006,30(4):407-418.
[9] 张玉喜,陈松林.牙鲆MHCⅡB基因多态性及其与鱼体抗病力关系的分析[J ].水产学报,2006,30(5):633-639.
[10] 赵凤岐,曹谨玲,刘青.西伯利亚鲟败血症病理学观察与病原学研究[J].水生生物学报,2009,33(2):316-323.
[11] 马志宏,杨慧,李铁梁,等.西伯利亚鲟(Acipenser baerii)致病性维氏气单胞菌的分离鉴定[J].微生物学报,2009,49(10):1289-1294.
[12] 储卫华,于勇.鲟鱼嗜水气单胞菌的分离与鉴定[J].淡水渔业,2003,33(2):16-17.
[13] 曹海鹏,杨先乐,王玉洁,等.鲟源致病性豚鼠气单胞菌的分离及其生长特性[J].动物学杂志,2007,42(6):1-6.
[14] Petersen T N,Brunak S,von Heijne G,et al.Signal P 4.0:discriminating signal peptides from transmembrane regions[J].Nature Methods,2011,8:785-786.
[15] 王重庆.分子免疫学基础[M].北京:北京大学出版社,1997,155-159.
[16] 董忠典,周芬娜,王慧.MHC基因的遗传变异及其与鱼类抗病性研究进展[J].水生态学杂志,2011,32(2):6-10.
[17] 宋德利.日本七鳃鳗中MHCⅡB基因的克隆、表达与生物信息学分析[D].大连:辽宁师范大学,2011:40-45.
[18] 田照辉,徐绍刚,王巍,等.西伯利亚鲟热休克蛋白HSP70 cDNA的克隆、序列分析和组织分布[J].大连海洋大学学报,2012,27(2):150-157.
[19] Fänge R.Lymphoid organs in sturgeons(Acipenseridae)[J].Veterinary Immunology & Immunopathology,1986,12(1-4):153-161.
[20] Wolk K,Do¨cke W D,Von B V,et al.Impaired antigen presentation by human monocytes during endotoxin tolerance[J].Blood,2000,96(1):218-223.
[21] Kunz S,Crompton N E A,et al.Multiple mechanisms of reduced major histocompatibility complex class Ⅱ expression in endotoxin tolerance [J].Journal of Biological Chemistry,2003,278(20):18030-18036.
[22] Zhou F,Dong Z,Fu Y,et al.Molecular cloning,genomic structure,polymorphism and expression analysis of major histocompatibility complex class Ⅱ B gene of Nile tilapia(Oreochromis niloticus)[J].Aquaculture,2013,372-375(1):149-157.
[23] 田照辉,徐绍刚,胡红霞,等.西伯利亚鲟免疫球蛋白M重链区mRNA的组织分布和细菌感染后的表达[J].大连海洋大学学报,2014,29(3):217-220.
[24] 刘德财,王雪,兰莹,等.林茜草根黄酮对S-180小鼠肿瘤TG-3、MHC-Ⅰ和MHC-Ⅱ蛋白表达的影响[J].黑龙江医药科学,2017(6):22-24.
[25] Bannai H P,Nonaka M.Comprehensive analysis of medaka major histocompatibility complex(MHC) class Ⅱ genes:implications for evolution in teleosts[J].Immunogenetics,2013,65(12):883-895.
[26] Venkatesh B,Ning Y,Brenner S.Late changes in spliceosomal introns define clades in vertebrate evolution[J].Proc Natl Acad Sci U S A,1999,96(18):10267-10271.