人类第10号染色体缺失的磷酸酶-张力蛋白(Phosphatase and tensin homolog deleted on chromosome 10,PTEN)基因是一种抑癌基因,又被称为MMAC1(Mutated in Multiple Advanced Cancer)或TEP1(TGF beta regulated and epithelial cell enriched phos-phatasel),在细胞增殖、存活和细胞凋亡中发挥重要调控作用[1]。PTEN基因最初在人类第10号染色体(10q23.3)上被鉴定为肿瘤抑制基因,含有与蛋白磷酸酶和细胞骨架蛋白序列相似的关键催化基序[2]。PTEN生理功能的发挥与双特异性磷酸酶主要底物磷脂酰肌醇3,4,5-三磷酸酯(PIP3)相关,进而调节细胞内PI3K/Akt信号传导[3]。同时,PTEN能够通过阻断PI3K/Akt信号传导来诱导凋亡性细胞死亡和生长抑制[4]。当PTEN表达缺失时会导致癌症发生,并与淋巴结转移密切相关[5]。因此,PTEN作为一种重要的肿瘤抑制因子,在调节细胞正常生长方面也有着不可替代的作用。
PTEN过表达可以增加细胞凋亡并抑制小鼠Mus musculus的细胞增殖和分化,敲除PTEN后,导致在小鼠胚胎发育的第8.5天左右胚胎死亡[5-6],表明PTEN对于胚胎正常发育是必需的调控因子。另外,在小鼠中条件性敲除PTEN,会导致卵泡细胞异常增长,卵巢体积变大,体内的卵泡刺激素(FSH)和黄体生成素(LH)激素水平升高[7]。有关水产动物PTEN基因的研究鲜有报道,仅见对斑马鱼Danio rerio、斜带石斑鱼Epinephelus coioides等少数物种在肿瘤形成、基因功能和免疫应答方面的研究[1,8]。在斑马鱼中,特异性敲除PTENa,会影响胚胎发育中耳囊的形成;特异性敲除PTENb,会导致组织形成的程序混乱,身体轴缩短,在36 hpf时胚胎死亡,这些结果证实了PTEN在胚胎发育中的重要调控作用[9]。但到目前为止,有关PTEN在鱼类生长的研究还未见报道,相关研究亟待开展。
黄条鰤Seriola aureovittata隶属于鲈形目Perciformes、鯵科Carangidae、鰤属Seriola,又被称为黄犍牛、黄犍子,是一种广泛分布的海洋暖温性周期洄游性鱼类。其肉质鲜嫩,可生吃,亦可用于煎、烤等多种食用方式,深受国内外消费者喜爱,对其消费需求不断增加,是一种具有极大消费市场潜力的鱼类。目前,中国对黄条鰤的人工繁育和养殖技术研发已经开展[10-11],但是苗种产量远无法满足市场需求。本研究中,克隆了黄条鰤PTEN cDNA全长序列,利用荧光定量技术对PTEN基因在黄条鰤组织器官及早期发育阶段中的表达规律进行了研究,旨在探索PTEN基因在黄条鰤生长发育过程中的调控功能及其作用机制,为黄条鰤规模化繁育技术研发奠定理论基础。
1 材料与方法
1.1 材料
试验用黄条鰤取自辽宁省大连市富谷水产有限公司。
试验鱼培育条件:养殖期间投喂新鲜杂鱼饵料,控制水温为18~25 ℃、盐度为20~23、pH为8.0~8.3;每日投饵2~3次,饲喂量为鱼体质量的3%~6%。试验用3龄黄条鰤(雌性3尾)全长为90~95 cm,体质量为11 005~12 045 g。
受精卵采用连续充气、流水孵化,控制孵化水温在20~22 ℃。
1.2 方法
1.2.1 试验设计及样品的采集 用MS-222(260 mg/L)将鱼麻醉后快速解剖,取脑、垂体、鳃、心脏、胃、肠、性腺、肾、肌肉、头肾、肝脏、脾脏12个组织样品投入液氮中速冻后,转入超低冰箱(-80 ℃)中保存,提取各组织总RNA,用于PTEN基因克隆及组织分布研究。
黄条鰤胚胎的取样:根据对黄条鰤早期发育阶段的划分标准[12],利用NIKON(MSZ800)解剖镜进行胚胎发育观察,记录发育时序,并采集受精卵(0.5 hpf)、2 cell(1 hpf)、4 cell(1.5 hpf)、8 cell(2 hpf)、16 cell(2.5 hpf)、32 cell(3 hpf)、多细胞(3.5 hpf)、桑椹胚(4.5 hpf)、高囊胚(5.5 hpf)、低囊胚(9 hpf)、原肠胚(18 hpf)、神经胚(21 hpf)、胚体期(60 hpf)和初孵仔鱼(73 hpf)14个发育阶段的胚胎样本及孵化后的仔稚幼鱼(1~55日龄)等10个时期的样品,提取总RNA,用于胚胎和早期发育阶段的PTEN表达分析。
1.2.2 总RNA提取和cDNA第一链的合成 利用RNAiso Plus(TaKaRa,日本)提取肌肉组织中的总RNA,通过12 g/L琼脂糖凝胶电泳检测RNA的质量,使用Nanodrop2000 (Thermo,美国)测定RNA浓度。以PrimeScript RT reagent Kit反转录试剂盒(TaKaRa,日本)合成cDNA第一链用于保守区域扩增。5′RACE及3′RACE cDNA第一链通过SMARTerTM RACE cDNA Amplification Kit (Clontech,美国)合成,用于后续的RACE试验,合成的模板需放置于-20 ℃下保存。
1.2.3 PTEN基因的克隆 PTEN基因克隆及定量分析所使用引物见表1,中间片段扩增以肌肉cDNA为模板。PCR反应体系(25 μL):10×PCR Buffer 2 μL,PTEN-F 2 μL,PTEN-R 2 μL,Taq酶 0.5 μL,dNTP Mixture 2.5 μL,模板 2 μL,ddH2O 14 μL。反应条件:94 ℃下预变性5 min;95 ℃下循环变性30 s,59 ℃下退火复性30 s,72 ℃下延伸40 s,共进行36个循环;最后在72 ℃下再延伸 10 min。以12 g/L琼脂糖凝胶电泳跑胶检测PCR产物,通过E.Z.N.A.TM Gel Extraction Kit Manual(Omega,美国)回收目的条带,并与pEASY-T1载体快速连接,后转到Transl-T1感受态细胞(全式金,中国)中,在37 ℃培养箱中培养过夜,挑取阳性克隆送至生工生物工程(上海)股份有限公司进行测序。
通过得到的中间片段序列设计RACE引物(表1)。第一次梯度PCR反应体系(25 μL):PCR Grade 50×Advantage 2 Polymerase Mix 0.5 μL,ddH2O 17.5 μL,50×dNTP Mix 2 μL,10×Advantage 2 PCR Buffer 2.5 μL,模板 1 μL,UPM 1 μL,PTEN-5′-R1 0.5 μL,混匀, 离心。PCR 反应条件: 94 ℃下预变性5 min;95 ℃下循环变性30 s,59 ℃退火复性30 s,72 ℃下延伸40 s,共进行38个循环。以10倍稀释后的第一次PCR产物为模板,PTEN-5′-R2、NUP为引物,进行第二次PCR扩增PTEN基因的5′RACE(3′末端PCR体系及反应条件与5′末端相似),测序操作同上。
表1 黄条鰤PTEN基因克隆、定量分析使用的PCR扩增引物序列
Tab.1 Nucleotide sequences of primers used for cloning and PCR amplification of PTEN gene in goldstriped amberjack Seriola aureovittata

引物 primer 序列 sequence (5′-3′)作用 purposePTEN-FACTACGATGCTGCTAAATPTEN-RGGTGCTGGGATGAAGAA中间片段PCRUPMTAATACGACTCACTATAGGGCAAGCAGTGGTATCAACGCAGAGTUniversal primersNUPCTAATACGACTCACTATAGGGCUniversal primersPTEN-5′-R1GAACTCCACTTTGATGTCTCC5′RACE,1st PCRPTEN-5′-R2CTGAGGAGGGTTGTGGTCT5′RACE,2nd PCRPTEN-3′-F1TAAGCCGTTTTGTGAAGACCTGGAC3′RACE,1st PCRPTEN-3′-F2CTGCCAGTGTGTGGAGACATCAAAG3′RACE,2nd PCRqPTEN-FGAAGTCAGGACAAGGGACAAGAAqPTEN-RCGAACACCATTTTGTGGAAGAGqPCR18S-FTACCACATCCAAAGAAGGCA18S-RTCGATCCCGAGATCCAACTAqPCR
1.2.4 PTEN mRNA实时荧光定量表达分析 通过克隆获得的黄条鰤PTEN cDNA序列设计定量PCR引物qPTEN-F、qPTEN-R,长度为133 bp,以18 S为内参,设计引物18S-F和18S-R[13]。使用SYBR Premix Ex TaqTMⅡ试剂盒(Takara),仪器为Mastercyclerep realplex Real-time PCR仪(Eppendorf,德国)。PCR反应体系(20 μL):SYBR Premix Ex TaqTMⅡ 10 μL,ddH2O 6.4 μL,cDNA模板 2 μL,上、下游引物(10 μmol/L) 各0.8 μL。扩增反应条件:95 ℃下预变性30;95 ℃下循环变性5 s,60 ℃下退火复性20 s,72 ℃下延伸30 s,共进行40 个循环。标准曲线以肌肉组织cDNA为模板,通过10倍梯度稀释,选取其中8个梯度浓度绘制而成。PTEN基因和18S的扩增效率E 值分别为 0.97和 1.02, 相关系数r2分别为 0.996和 0.997。每个样品测试设置3个重复,以18S mRNA 表达量为基础,利用2-ΔΔCT方法计算获得[14]。
1.3 数据处理
使用Expasy在线数据库预测(www.expasy.org/tools/protparam.html)黄条鰤PTEN的结构、分子量、等电点;使用DNAMAN 6.0软件进行氨基酸序列推导、序列拼接和氨基酸同源性分析;通过SignalP 4.1(http://www.cbs.dtu.dk/services/SignalP/)预测信号肽;使用PSORT Ⅱ软件(https://psort.hgc.jp/form2.html)进行亚细胞定位;使用NCBI数据库(https://www.ncbi.nlm.nih.gov/Structure/ cdd/wrpsb.cgi)进行结构域预测;使用ClustalW在线软件进行氨基酸序列比对(http://www.genome.jp/tools-bin/clustalw),使用MEGA 6软件进行系统进化分析;通过SOPM在线软件(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl/page=npsa_sopma.html)分析蛋白质二级结构,通过SWISS-MODEL在线软件预测蛋白质三级结构(http://www.swissmodel.expasy.org/)。
以平均值±标准差(mean±S.D.)表示获得的试验数据,采用 SPSS 19.0统计软件进行单因素方差分析(One-way ANOVA)和Duncan多重比较,显著性水平设为0.05。
2 结果与分析
2.1 PTEN cDNA全长序列及其氨基酸序列结构
对黄条鰤PTEN cDNA扩增获得1575 bp(GenBank登录号:MH144052),包括222 bp的5′非编码区(UTR)、1287 bp的开放阅读框和66 bp的3′UTR,编码428个氨基酸,预测蛋白的相对分子质量为49 000,等电点为6.16,不稳定系数为50.45,为不稳定蛋白。推导的PTEN氨基酸序列包含两个主要结构域:PTP(PTPc)催化基序和PTEN-C2结构域,PTP位于第87~187位氨基酸,PTEN-C2位于第188~374位氨基酸。其中,在PTPc基序中含有高度保守活性位点的标签基序“HCXXGXXR”(氨基酸123~130)和保守残基“VTI”(氨基酸166~168)(图1)。
PTEN氨基酸序列中包含8个半胱氨酸残基,不含有信号肽和糖基化位点。亚细胞定位位于细胞核和细胞质上。通过SOPMA 软件分析黄条鰤PTEN编码的蛋白空间二级结构:在PTEN成熟蛋白的二级结构中α-螺旋为22.2%,β-转角为3.50%,无规则卷曲为54.44%,延伸链为19.86%。通过SWISS-MODEL网站预测获得PTEN编码的蛋白三级结构,如图2所示。

注:上面为核苷酸,下面为氨基酸序列; 单字母表示推导的氨基酸序列,起始氨基酸用阴影显示的甲硫氨酸开始计算; *表示终止密码子,保守的半胱氨酸残基用下划线标出; 保守基序(HCXXGXXR)和保守的残留物(VTI)分别用框和椭圆圈出
Note:Nucleotides are shown in the upper of the Fig, and amino acid sequences below the Fig.Single letter abbreviations indicate the deduced amino, beginning from the initiating methionine shadowed.Asterisk(*) indicates the stop codon, and the conserved cysteine residue is underlined; the conserved signature motif (HCXXGXXR) and the conserved residues (VTI) are marked by boxes and by ellipses, respectively
图1 黄条鰤PTEN基因cDNA全长序列及推导的氨基酸序列
Fig.1 Full-length cDNA sequence and deduced amino acid sequence of PTEN gene in goldstrip amberjack Seriola aureovittata
图2 SWISS-MODEL预测的黄条鰤PTEN蛋白三级结构
Fig.2 Tertiary structure of PTEN proteins predicted by SWISS-MODEL in goldstrip amberjack Seriola aureovittata
2.2 PTEN氨基酸序列比对及系统进化树分析
同源性分析显示,黄条鰤PTEN氨基酸序列与高体鰤的一致性为95.2%,与鲽形目和鲈形目一致性为90%以上,与鲤形目一致性为82.4%,与禽类和哺乳类的一致性达83.4%,与爬行类的一致性为73.3%(图3)。为分析黄条鰤与其他物种PTEN的进化关系,根据当前研究中克隆和测序的黄条鰤PTEN基因编码区推断的氨基酸序列,利用NJ法构建了基于PTEN氨基酸序列的黄条鰤和其他脊椎动物(表2)的系统进化树(图4),结果表明,黄条鰤与高体鰤聚为一个分支,再与鲈形总目聚为一支。
2.3 PTEN mRNA的组织表达
利用实时荧光定量PCR技术检测黄条鰤脑、垂体、肝脏、肌肉、肾、脾、鳃、心、头肾、胃、肠、性腺等12种组织PTEN基因的表达情况。从图5可见:PTEN mRNA在所检测的组织中均表达,其中,在心脏中的表达量最高且显著高于其他组织(P<0.05);在脾脏、头肾、肾、胃、肠、鳃中也检测到较高表达;在肝脏、肌肉、脑、垂体、性腺中也有表达,且5种组织间表达量均无显著性差异(P>0.05)。

注:.为低保守度的氨基酸,:为高度保守度的氨基酸,*为一致的氨基酸
Note: .showing low degree conserved amino acid sequences; : showing highly conserved amino acid sequences; * showing identical amino acid sequences
图3 黄条鰤与其他物种的PTEN氨基酸序列比较
Fig.3 Comparison of the amio acid sequences of PTEN between goldstrip amberjack Seriola aureovittata and other species
2.4 PTEN mRNA在不同发育阶段的表达
从图6可见:在黄条鰤仔鱼孵化出膜(73 hpf)之前的早期胚胎中,PTEN mRNA表达量呈现持续增加的趋势;在受精卵(0.5 hpf)、2 细胞(1 hpf)、4 细胞(1.5 hpf)、8 细胞(2 hpf)、16 细胞(2.5 hpf)、32 细胞(3 hpf)、多细胞(3.5 hpf)、桑椹胚(4.5 hpf)、高囊胚(5.5 hpf)期PTEN mRNA表达量呈现无规律的上下波动趋势(1.35±0.55),但表达量均较低且无显著性差异(P>0.05);从低囊胚(9 hpf)到孵化出膜(73 hpf)这一阶段PTEN mRNA的表达量显著升高(P<0.05),在初孵仔鱼(73 hpf)时表达量达到最高且显著高于其他发育阶段(P<0.05)。
从图7可见:仔稚幼鱼发育阶段,2~3日龄时,PTEN mRNA表达水平明显降低(P<0.05);6~15日龄时,PTEN mRNA表达量无显著性变化(P>0.05);15~35日龄时,PTEN mRNA表达量呈现先升高后下降的趋势;45日龄时,PTEN mRNA表达量显著降低(P<0.05),之后一直维持在较低水平。
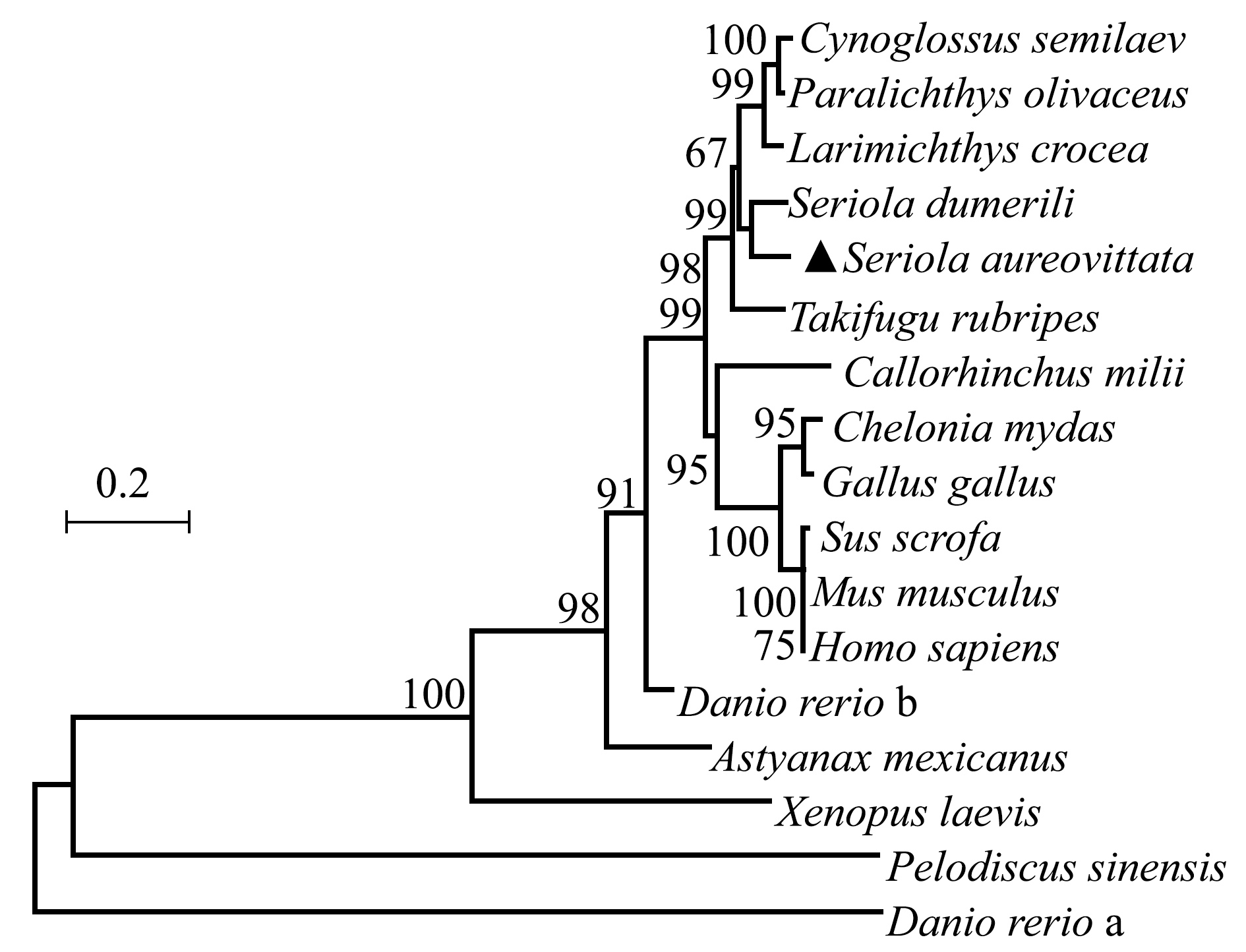
图4 基于PTEN氨基酸序列的黄条鰤与其他物种的NJ系统进化树
Fig.4 NJ phylogenetic tree of goldstrip amberjack Seriola aureovittata and other species based on PTEN amino acid sequences
表2 用于构建NJ系统进化树的物种
Tab.2 Species of NJ phylogenetic tree

种类speciesGenBank accession No.高体鰤Seriola dumeriliXP_022619472牙鲆Paralichthys olivaceusXP_019951077红鳍东方鲀Takifugu rubripesAAL08419半滑舌鳎Cynoglossus semilaevisXP_008320667大黄鱼Larimichthys croceaXP_010742537叶吻银鲛Callorhinchus miliiAFP01503墨西哥丽脂Astyanax mexicanusXP_007251223斑马鱼Danio rerio aAY398668斑马鱼Danio rerio bAY398671非洲爪蟾Xenopus laevisNP_001083831中华鳖Pelodiscus sinensisXP_006121547绿龟Chelonia mydasXP_007071643原鸡Gallus gallusXP_421555小鼠Mus musculusNP_032986猪Sus scrofaNP_001137168人Homo sapiensNP_000305黄条鰤Seriola aureovittataMH144052
3 讨论
3.1 黄条鰤PTEN基因编码的蛋白结构
本研究中获得了黄条鰤PTEN cDNA序列全长,结构分析显示,PTEN氨基酸序列包含两个主要结构域,分别是PTP(PTPc基序)和PTEN-C2结构域,这与其他脊椎动物PTEN氨基酸序列呈高度相似性[1]。在黄条鰤PTEN中发现了“HCXXGXXR”和“VTI”,这与哺乳动物结构相同[15];HCXXGXXR在哺乳动物中活性位点起催化作用,VTI有助于促进PTEN发挥其催化活性,两者均位于黄条鰤PTPc基序高度保守的活性位点中,暗示PTEN与其他脊椎动物有相似的生理功能。亚细胞定位显示,PTEN主要位于细胞核上,另有少量位于细胞质上,这与在斜带石斑鱼中PTEN的定位一致[1]。有研究表明,细胞核中PTEN在调节细胞内平衡和稳定方面发挥了重要作用,它有助于染色体稳定、DNA修复和正常的细胞周期,PTEN丢失会导致染色体改变和不受控制的细胞周期[16]。同源性分析表明,黄条鰤PTEN的氨基酸序列与高体鰤PTEN的一致性达95%,与其他鱼类、两栖类、爬行类和人的PTEN氨基酸同源性也处于较高水平,表明其在进化过程中保守性较强。从系统进化树分析看出,黄条鰤PTEN和其他鲈形目鱼类聚为一支,说明黄条鰤PTEN和鲈形目鱼类的亲缘关系更近。
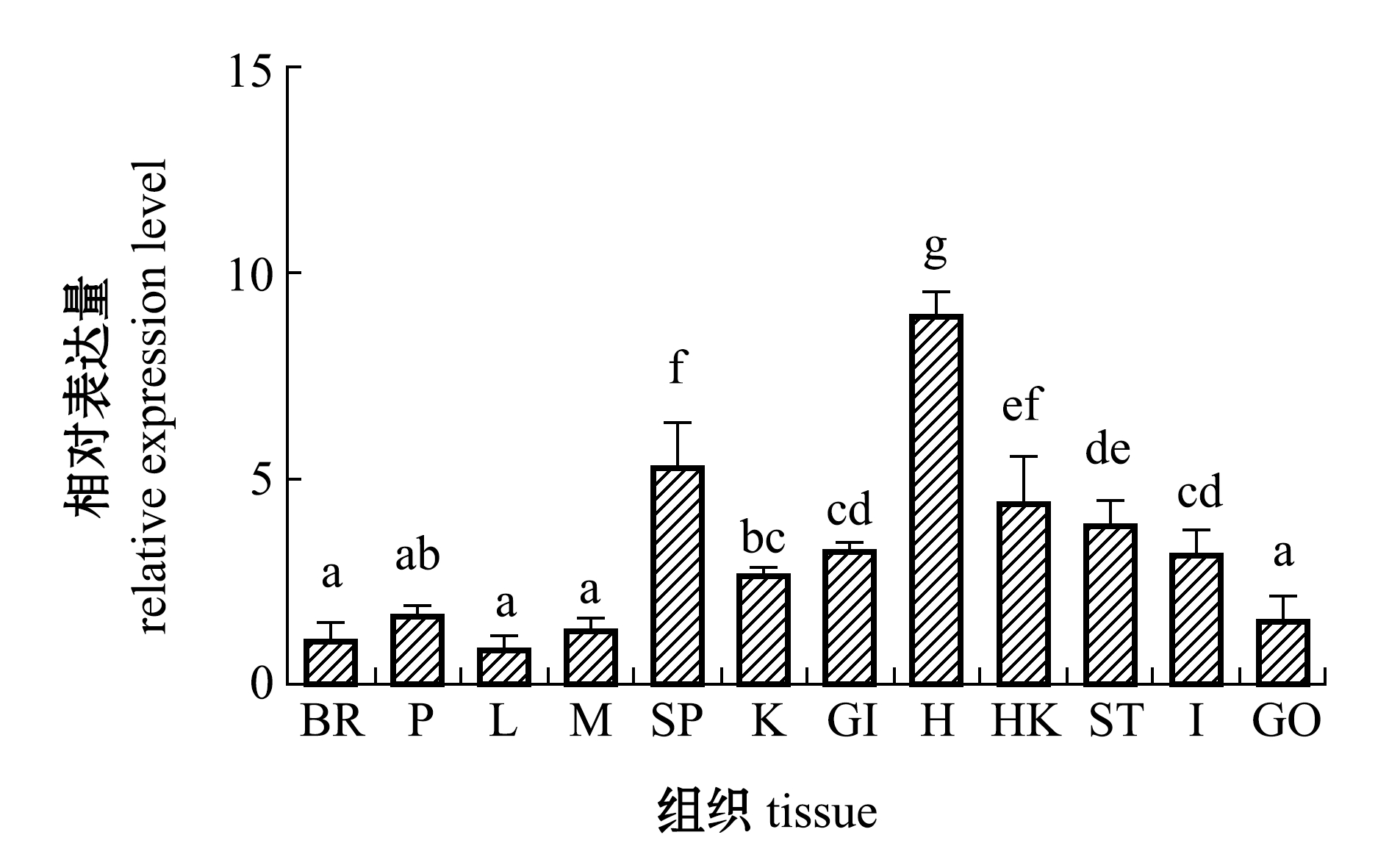
注:BR为脑;HK为头肾; GI为鳃; H为心脏; L为肝脏; SP为脾脏; K为肾; ST为胃; I为肠;GO为性腺;M为肌肉; P为垂体;标有不同字母者表示同一时期不同组织间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同
Note:B,brain;HK, head-kidney; GI, gill; H,heart; L, Liver; SP, Spleen; K,kindey; ST, stomach; I, intestine; GO, gonad; M, muscle; P, pituitary.The means with different letters in different tissues in the same time are significantly different at the 0.05 probability level,and the means with the same letters are not significant differences, et sequentia
图5 3龄黄条鰤主要组织中PTEN mRNA的表达水平
Fig.5 Relative expression levels of PTEN mRNA in main tissues of goldstrip amberjack Seriola aureovittata
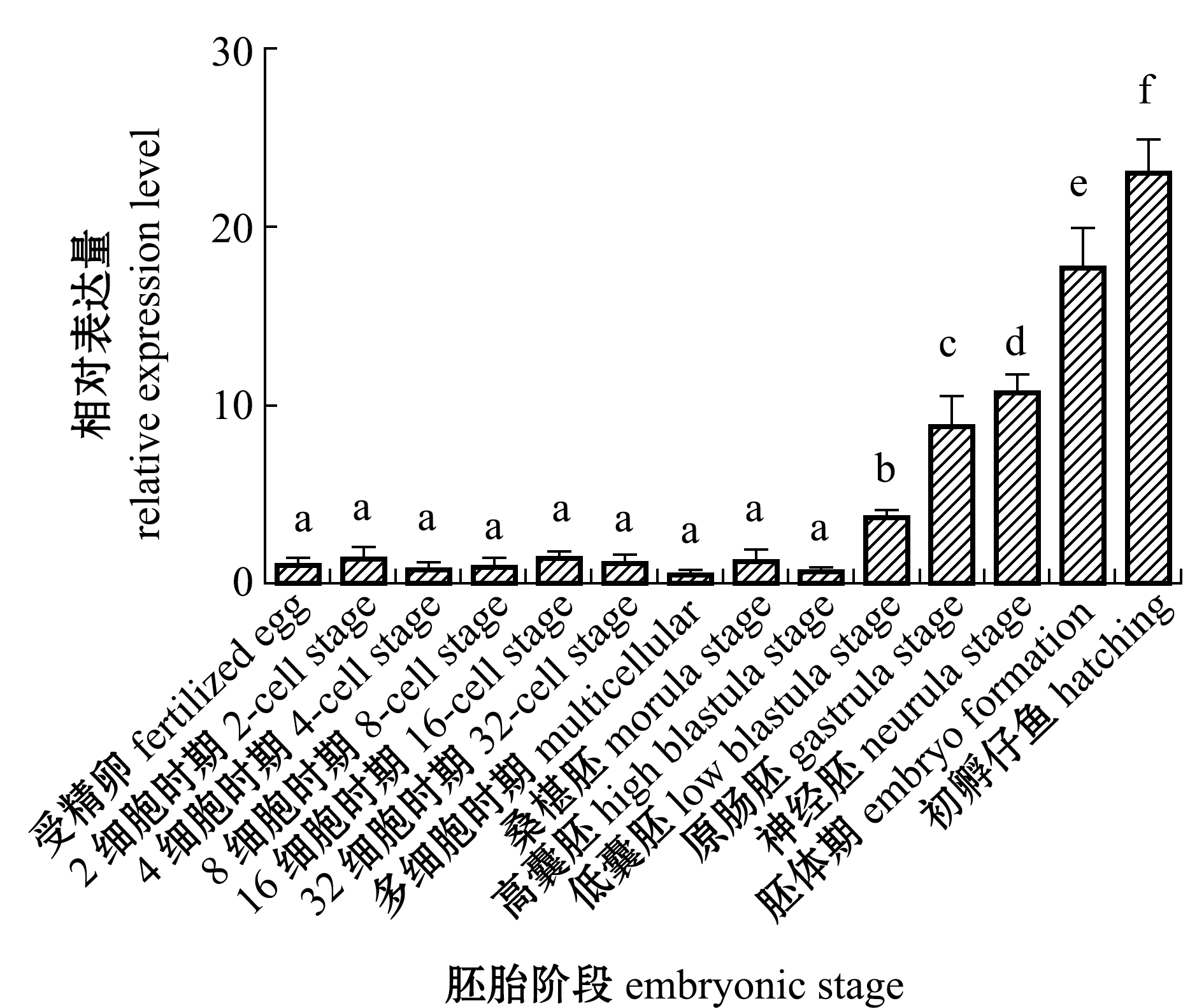
图6 黄条鰤胚胎发育过程PTEN mRNA中表达量的变化
Fig.6 Relative expression levels of PTEN mRNA during embryonic development of goldstrip amberjack Seriola aureovittata
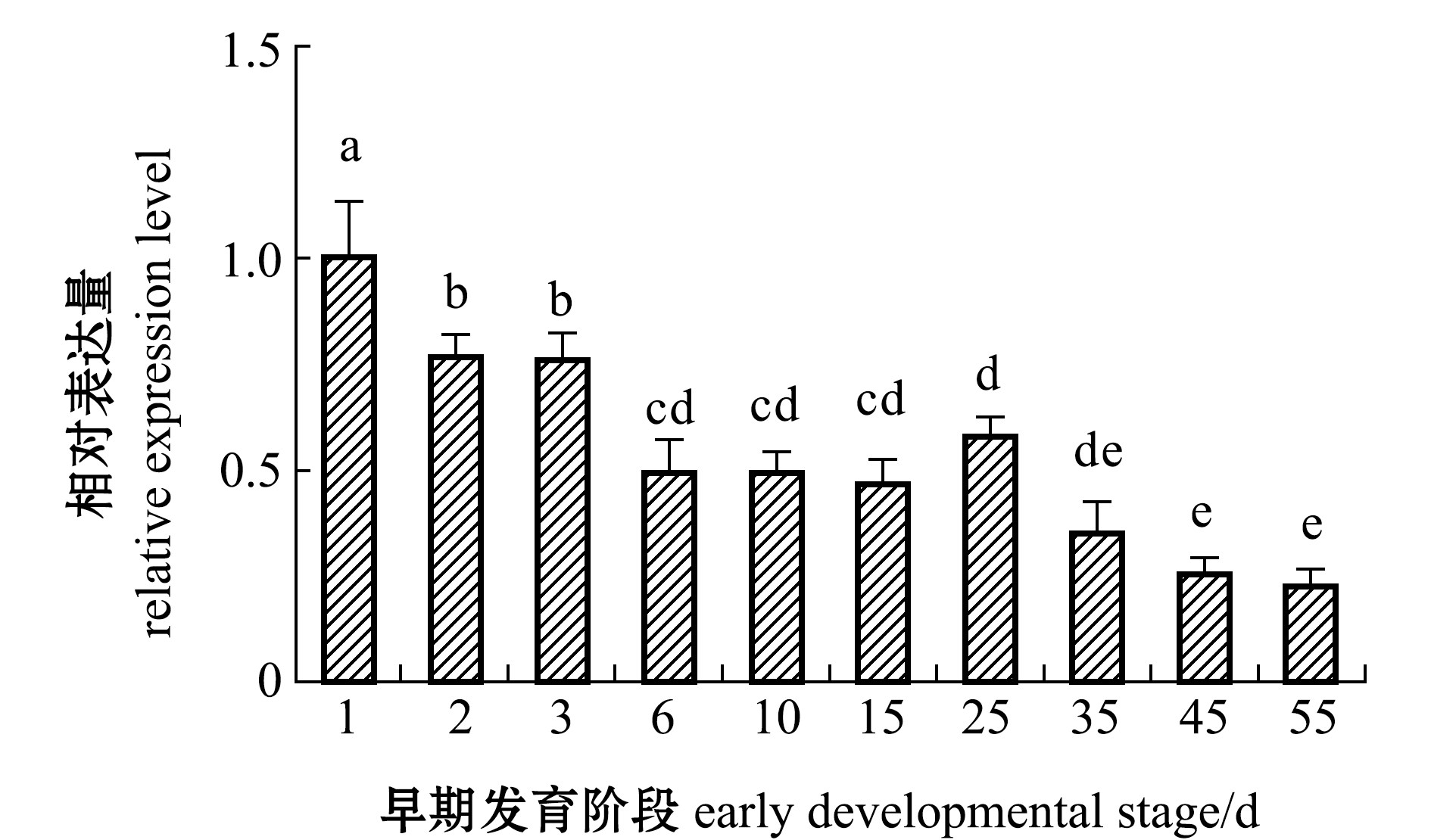
图7 黄条鰤早期发育过程中PTEN mRNA表达量的变化
Fig.7 Relative expression levels of PTEN mRNA in early developmental stages of goldstrip amberjack Seriola aureovittata
3.2 黄条鰤PTEN基因的组织表达
PTEN基因的生物作用非常依赖于其组织特异性,可以在某一组织中发挥特异性功能的调节[17]。本研究中发现,黄条鰤PTEN在心脏中显著高表达,推测心脏为其主要靶器官,且在肌肉、脾脏、肾脏等其他检测组织中均有表达,这种广泛地表达特性与已有的研究报道结果相似。斜带石斑鱼组织表达的研究结果表明,PTEN主要表达在肝脏,另外,在肾脏、脾脏等其他组织均有广泛表达;肝脏的正常功能包括代谢和解毒,推测其可能通过凋亡过程清除死亡细胞来维持组织稳态[1]。在哺乳动物中发现,PTEN在免疫组织中广泛表达,而在硬骨鱼类中,肝脏、肾脏和脾脏是免疫防御系统中的主要器官,Luo等[1]通过给斜带石斑鱼注射溶藻弧菌,发现抗溶藻弧菌的石斑鱼PTEN在免疫组织中表达水平呈现一直增加的趋势,上述结果表明,PTEN可能会对弧菌刺激产生反应并中和弧菌入侵的不利影响。本研究中,PTEN在脾脏和肾脏表达也较高,推测PTEN在防止病原菌入侵、维持黄条鰤体内生态平衡等免疫调节过程中也发挥了重要作用。免疫和生长密切相关,这与PTEN在调控细胞增殖中发挥重要作用的功能相符。骨骼肌在鱼体质量生长中占比达到40%~60%。已有研究表明,PTEN对骨骼肌生长有着举足轻重的作用。例如,通过长期给小鼠喂养高脂肪食物,PTEN的表达使磷脂酰肌醇3,4,5-三磷酸酯(PIP3)增加,从而抑制了小鼠的肌肉再生[18]。Feng等[19]研究发现,PTEN在静止和活跃小鼠肌源性细胞中的表达量丰富,其中,在静息肌源性细胞中的缺失使其自身发生了活化和过早分化而没有增殖,导致肌源性细胞再生失败。本研究中也发现,PTEN在肌肉中表达量较高,暗示其在肌肉组织中有着重要调控作用,但具体的作用机制还需进一步通过基因敲除等方法进行研究。
3.3 黄条鰤PTEN基因在胚胎发育时期的表达特征
目前,有关PTEN基因在鱼类中的相关研究十分有限。Halet等[20]利用时差显微技术(time lapse microscopy)发现,PI3K/AKT 信号通路在哺乳动物早期胚胎发育中起着重要作用,而PTEN是该通路中的负调节因子。本研究中分析了PTEN在黄条鰤早期胚胎中的表达情况,发现在胚胎发育早期(0.5~5.5 hpf)PTEN表达量相对较低。在黄条鰤受精卵(0.5 hpf)到高囊胚阶段(5.5 hpf),细胞分裂迅速,数目不断增加,此发育过程中PTEN相对较低的表达,可认为其对细胞分裂无抑制作用,有利于胚胎细胞增殖。王喜宏等[21]利用PTEN特异性抑制剂阻断其活性,结果表明,较高浓度抑制剂可影响小鼠早期胚胎的发育进程,而低浓度抑制剂并未影响小鼠卵细胞的成熟,这与本研究结果相似,与Jagarlamudi等[22]在小鼠中的研究结果也较一致。黄条鰤PTEN表达水平从低囊胚阶段(9 hpf)显著升高,而从该阶段黄条鰤的眼囊、肌节、耳囊和心脏等组织器官逐步发育形成,表明PTEN在此过程中有着重要调控作用,推断PTEN影响组织器官的形成并可能与其他发育调控基因共同促进胚胎持续向前发育。在斑马鱼胚胎发育后期敲出PTENa,会影响其耳囊发育,该结果也佐证了黄条鰤PTEN在后期胚胎发育过程中具有重要调控功能[9]。另外,本研究中,对各组织表达的研究结果发现,PTEN在心脏中表达丰度最高,这也暗示PTEN在发育过程中具有组织特异性。
3.4 黄条鰤PTEN基因在仔稚幼鱼时期的表达特征
黄条鰤仔稚幼鱼生长阶段呈现早期生长速度慢、后期生长速度快的特点,这是一种异速生长模式,与智利、日本海域黄条鰤生长模式一致[23-24]。在黄条鰤仔稚幼鱼发育阶段,PTEN表达量呈现逐步下降趋势,这与鱼苗的生长速度是相符合的。黄条鰤早期生长主要依靠卵黄囊的营养,在4日龄开口后摄食进入混合营养阶段,6日龄卵黄囊消耗殆尽,此后主要依靠外源物质。从图8可以看出:黄条鰤在1~6日龄全长增长缓慢,同时PTEN在这一阶段表达量较高;从6~15日龄,PTEN表达水平未有明显变化;在15~30日龄表达量呈现先升高后降低的波动模式,在25日龄时PTEN表达量相对升高;25日龄左右为鱼苗大量死亡阶段,此时PTEN表达量升高,推断出现鱼苗死亡的内因可能是调控发育的基因表达异常,当前PTEN异常表达的内在机制尚不清楚,有待于结合其他调控因子的表达情况进一步探讨;在35~55日龄时,PTEN表达量呈现下降趋势,45日龄时表达量显著降低,此阶段为育苗快速生长期,这表明,PTEN相对较低的表达有利于黄条鰤的生长。
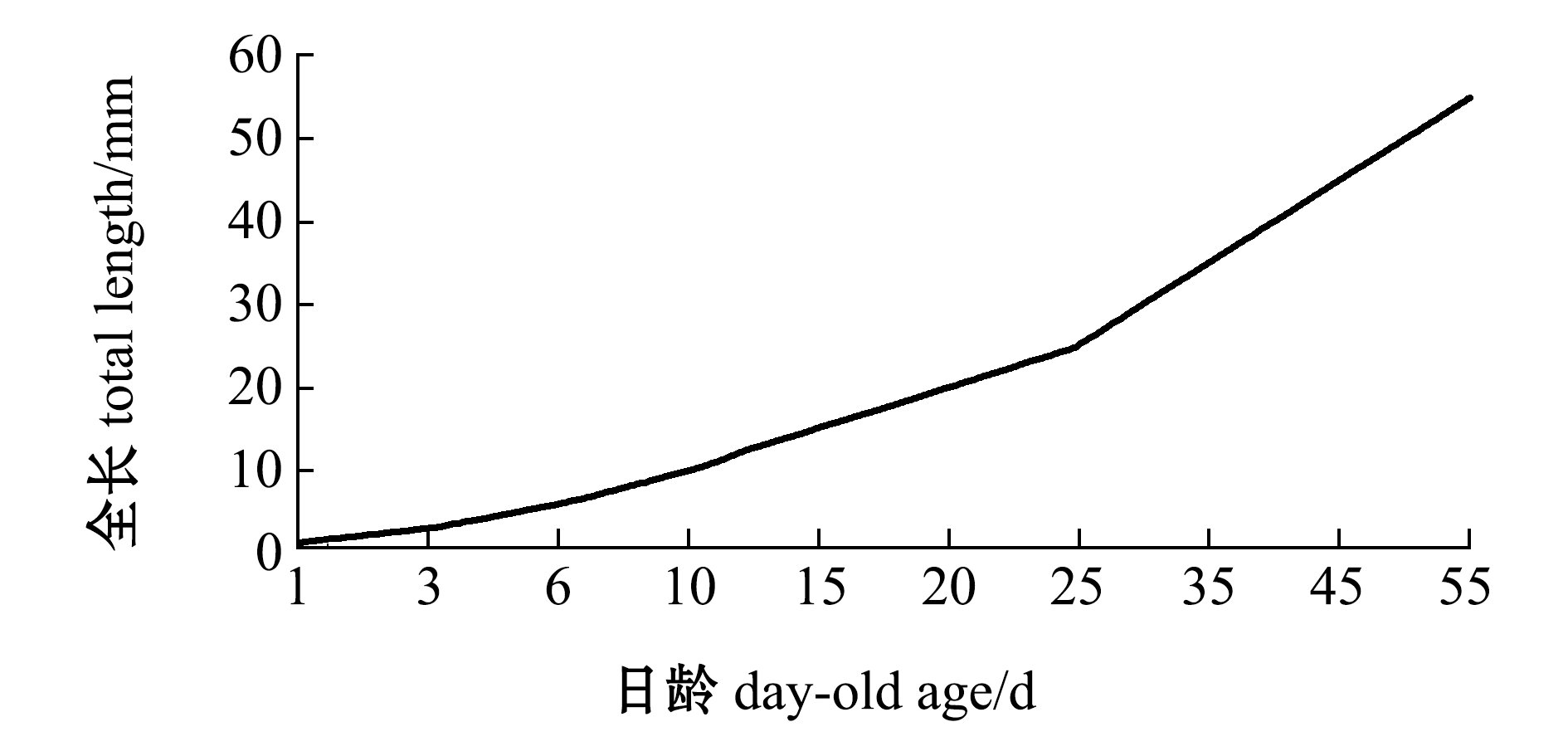
图8 黄条鰤日龄和全长的特征
Fig.8 Characteristics of day-old age and total length of goldstrip amberjack Seriola aureovittata
综上所述,本研究首次在黄条鰤中获得了PTEN基因的全长cDNA序列,分析了PTEN基因结构,以及PTEN在不同组织、胚胎发育和仔稚幼鱼时期中的表达分析,推断其作为细胞增殖调控因子在黄条鰤生长发育过程中起重要作用,可为进一步探索黄条鰤规模化养殖提供内在的分子机理和数据资料。
[1] Luo Shengwei,Wang Weina,Xie Renchong,et al.Molecular cloning and characterization of PTEN in the orange-spotted grouper (Epinephelus coioides)[J].Fish & Shellfish Immunology,2016,58:686-700.
[2] Furnari F B,Huang H J S,Cavenee W K.The phosphoinositol phosphatase activity of PTEN mediates a serum-sensitive G1 growth arrest in glioma cells[J].Cancer Research,1998,58(22):5002-5008.
[3] Xu Zheng,Stokoe D,Kane L P,et al.The inducible expression of the tumor suppressor gene PTEN promotes apoptosis and decreases cell size by inhibiting the PI3K/Akt pathway in Jurkat T cells[J].Cell Growth & Differentiation,2002,13(7):285-296.
[4] Rhei E,Kang Lan,Bogomolniy F,et al.Mutation analysis of the putative tumor suppressor gene PTEN/MMAC1 in primary breast carcinomas[J].Cancer Research,1997,57(17):3657-3659.
[5] Dupont J,Renou J P,Shani M,et al.PTEN overexpression suppresses proliferation and differentiation and enhances apoptosis of the mouse mammary epithelium[J].The Journal of Clinical Investigation,2002,110(6):815-825.
[6] Podsypanina K,Ellenson L H,Nemes A,et al.Mutation of Pten/Mmac1 in mice causes neoplasia in multiple organ systems[J].Proceedings of the National Academy of Sciences of the United States of America,1999,96(4):1563-1568.
[7] Reddy P,Liu Lian,Adhikari D,et al.Oocyte-specific deletion of Pten causes premature activation of the primordial follicle pool[J].Science,2008,319(5863):611-613.
[8] Stumpf M,Choorapoikayil S,Den Hertog J.Pten function in zebrafish:anything but a fish story[J].Methods,2015,77-78:191-196.
[9] Croushore J A,Blasiole B,Riddle R C,et al.Ptena and ptenb genes play distinct roles in zebrafish embryogenesis[J].Developmental Dynamics,2010,234(4):911-921.
[10] 柳学周,徐永江,李荣,等.黄条鰤(Seriola aureovittata)肌肉营养组成分析与评价[J].渔业科学进展,2017,38(1):128-135.
[11] 史宝,刘永山,柳学周,等.黄条鰤(Seriola aureovittata)染色体核型分析[J].渔业科学进展,2017,38(1):136-141.
[12] 钟建兴,蔡良候,郑惠东,等.黄条鰤胚胎发育观察[J].福建水产,2010(2):22-25.
[13] Tom M,Chen N,Segev M,et al.Quantifying fish metallothionein transcript by real time PCR for its utilization as an environmental biomarker[J].Marine Pollution Bulletin,2004,48(7-8):705-710.
[14] Livak K J,Schmittgen T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method[J].Methods,2001,25(4):402-408.
[15] Lee J O,Yang Haijuan,Georgescu M M,et al.Crystal structure of the PTEN tumor suppressor:implications for its phosphoinositide phosphatase activity and membrane association[J].Cell,1999,99(3):323-334.
[16] Planchon S M,Waite K A,Eng C.The nuclear affairs of PTEN[J].Journal of Cell Science,2008,121:249-253.
[17] Wijesekara N,Konrad D,Eweida M,et al.Muscle-specific Ptendeletion protects against insulin resistance and diabetes[J].Molecular and Cellular Biology,2005,25(3):1135-1145.
[18] Hu Zhaoyong,Wang Huiling,Lee I H,et al.PTEN inhibition improves muscle regeneration in mice fed a high-fat diet[J].Diabetes,2010,59(6):1312-1320.
[19] Feng Yue,Bi Pengpeng,Wang Chao,et al.Pten is necessary for the quiescence and maintenance of adult muscle stem cells[J].Nature Communications,2017,8:14328.
[20] Halet G,Viard P,Carroll J.Constitutive PtdIns(3,4,5)P3 synthesis promotes the development and survival of early mammalian embryos[J].Development,2008,135(3):425-429.
[21] 王喜宏,和协超,韩树标,等.PTEN在小鼠卵细胞和早期胚胎发育中的功能研究[J].动物学研究,2011,32(6):647-650.
[22] Jagarlamudi K,Liu Lian,Adhikari D,et al.Oocyte-specific deletion of Pten in mice reveals a stage-specific function of PTEN/PI3K signaling in oocytes in controlling follicular activation[J].PLoS One,2009,4(7):e6186.
[23] Yang S G,Hur S W,Ji S C,et al.Morphological development of embryo,larvae and juvenile in yellowtail kingfish,Seriola lalandi[J].Development & Reproduction,2016,20(2):131-140.
[24] Martínez-Monta o E,González-
o E,González- lvarez K,Lazo J P,et al.Morphological development and allometric growth of yellowtail kingfish Seriola lalandi V.larvae under culture conditions[J].Aquaculture Research,2016,47(4):1277-1287.
lvarez K,Lazo J P,et al.Morphological development and allometric growth of yellowtail kingfish Seriola lalandi V.larvae under culture conditions[J].Aquaculture Research,2016,47(4):1277-1287.