目前,三倍体鱼类的产业需求量正在与日俱增,由于大多数三倍体鱼类雌性不育,故其在水产养殖中具有生长快、增肉快、饲养管理容易等优点[1],可以大幅提高养殖经济效益,且三倍体鱼类不育还可以防止种质传播。同时,诱导三倍体鱼类可作为一种基因操控手段来阻止外来物种基因的污染[2-3]。对于多倍体硬骨鱼类早期胚胎发育及成鱼发育时期,内分泌关键基因表达的研究目前仍处于空白阶段,使得多倍体鱼类生殖调控的机制无法得到深入研究。
硬骨鱼类中的多种生理过程,如性腺发育与性激素的合成与释放,主要受到两种促性腺激素的调控,分别为促卵泡激素(Follicle-stimulating hormone, FSH)和促黄体激素(Luteinizing hormone, LH)[4-5]。促卵泡激素主要调控卵母细胞发育和卵泡形成等,而促黄体激素主要调控卵泡最终成熟与排卵过程[6]。对鲑科鱼类的研究表明,当个体达到卵母细胞最终成熟或排卵阶段时,促黄体激素达到最高水平[7-8]。促性腺激素必须与分布相应打靶细胞上的促性腺激素受体(FSHR和LHR)结合,从而行使相应的生理功能[9],FSHR和LHR均为G蛋白偶联受体,与TSHRs一起构成糖蛋白激素受体亚族[10]。FSHR或者LHR可调控促性腺激素作用于颗粒细胞或膜细胞,从而生成类固醇[11]。促性腺激素受体(FSHR和LHR)的表达水平与卵泡的发育水平紧密相关[12],促性腺激素释放激素(GnRH)可刺激促性腺激素(FSH和LH)的释放,然而下丘脑释放的多巴胺可抑制促性腺激素的释放[13]。促性腺激素可受到外周性腺激素水平(E2、P4、17a和20b-P)、垂体内旁分泌因子和多重环境因子改变的影响[14-15]。
虹鳟Oncorhynchus mykiss受精后35~63 d(35~63 days post fertilization, dpf)为性别分化的关键时期[16],为探究内分泌关键调节基因在不同倍性雌性虹鳟早期发育和后期发育不同阶段的表达模式,本研究中分别对二、三倍体雌性虹鳟早期发育阶段(31~68 dpf)脑组织和不同发育阶段(160~450 dpf)性腺组织中促性腺激素释放激素(Gonadotropin-releasing hormone 1,GnRH1)、促性腺激素释放激素受体(Gonadotropin-releasing hormone receptor,GnRHr)和促性腺激素α亚基(Gonadotropin hormone α subunit, GRHa)基因的表达模式进行研究,旨在从下丘脑—垂体—性腺轴的角度揭示三倍体雌性虹鳟性腺败育的根本原因,为多倍体鱼类生殖调控机制研究提供数据资料。
1 材料与方法
1.1 材料
试验用全雌二、三倍体虹鳟发眼卵均购于美国鳟鱼庄公司(Troutlodge),全雌二倍体虹鳟和全雌三倍体虹鳟成鱼均饲养于黑龙江水产研究所渤海试验基地。
试验试剂:荧光定量试剂盒与反转录试剂盒均购于Roche公司,RNAlater和RNAiso plus均购于TaKaRa公司,分别用于保存和提取RNA,DNA Marker购于北京全式金(Transgene)生物技术有限公司。
1.2 方法
1.2.1 样品的采集 发眼卵培养于10 ℃孵育槽中,随后移至带有循环水系统的水族箱中,水温始终控制在(12.0±0.1)℃,光周期为12L∶12D,每天定时投喂虹鳟商业饲料。从31 dpf开始每天采集鱼苗的头部组织,从160 dpf开始分阶段采集性腺组织,采集脑组织的具体发育阶段为31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、51、53、55、56、62、65、68 dpf,采集性腺组织的具体发育阶段为160、180、200、240、270、360、450 dpf。以上试验组织均放置于RNAlater中并保存于-80 ℃下。二、三倍体雌性虹鳟的样本量均为150尾,各采样时间点均采集3尾鱼。
1.2.2 总RNA的提取及cDNA合成 用RNAiso Plus试剂提取不同发育阶段二、三倍体雌性虹鳟脑和性腺组织中的总RNA,按照反转录试剂盒(Transcriptor First Strand cDNA Synthesis Kit, Roche)说明书将各阶段的脑和性腺组织分别反转为cDNA。反转录PCR第一步反应体系为:Total RNA 5 μL,Anchored-oligo (dT) Primer 1 μL, ddH2O 7 μL。反应程序为65 ℃ 10 min。第二步反应体系为:第一步的混合物 13 μL,Transcriptor RT buffer 4 μL,RNase Inhibitor 0.5 μL,Deoxynucleotide Mix 2 μL,Transcriptor RTase 0.5 μL。反应程序为:55 ℃下预变性30 min,85 ℃下变性5 min,4 ℃下退火1 h。
1.2.3 实时定量PCR 利用Real-time PCR检测以上各发育阶段脑组织或性腺组织中gnrh1、gnrhr和gtha基因的表达。反应体系(20 μL):上、下游引物 各 0.4 μL,SYBR Mix 10 μL,cDNA 1 μL,ddH2O 8.2 μL。反应程序为:95 ℃下预变性30 s;95 ℃下循环变性5 s,60 ℃下退火复性34 s,共进行40 个循环;95 ℃下再变性15 s,60 ℃下退火1 min,95 ℃下再延伸15 s。检测内分泌关键基因表达的引物信息见表1。
表1 实时定量PCR引物信息
Tab.1 Primer sequences for Real-time PCR

引物primer序列(5′-3′)sequence (5′-3′)GenBank accession No.gnrh1-Fgnrh1-RACTGTAAGAAGGAATAGACCGAACGCAATGGTTACCTATTCAACATGCACAF110992.1gnrhr-Fgnrhr-RGTCTTTTCCAACCCAGGATGTCGGAAACTGGGACATGTTTGAGAGAJ272116.1gtha-Fgtha-RATCAACTGGACTATTCCTCATCCTGGATTGTGTTCGGCTTCAGTGTGAB050834.1β-actin-Fβ-actin-RATCCTGACGGAGCGCGGTTACAGCTGCCCATCTCCTGCTCAAAGTCCAAJ438158
1.3 数据处理
采用2-△△CT方法分析实时定量PCR相关基因的相对表达量,以检测初期的基因表达量为基准1。试验数据采用SPSS 13.0软件进行单因素方差分析(One-way ANOVA),采用t检验法进行组间多重比较。
2 结果与分析
2.1 不同倍性虹鳟脑中内分泌调节基因的表达
在对二、三倍体雌性虹鳟早期发育阶段(31~68 dpf)脑组织中内分泌关键基因的检测表明:二倍体虹鳟早期发育阶段gtha基因的表达呈现波动变化的趋势,从31~40 dpf时期呈现逐渐升高的趋势,之后表达迅速下降,直到56 dpf时又上升达到峰值,显著高于检测初期(31 dpf)(P<0.05),而检测后期阶段该基因的表达又呈现回落状况;在相同发育时期内,三倍体虹鳟脑组织中gtha基因的表达始终保持在较低水平,只在36 dpf时呈现了显著上升(P<0.05)(图1-A)。gnrh1基因在二倍体虹鳟38 dpf时期的脑组织中调节较检测初期(31 dpf)显著高表达(P<0.05),在随后的发育阶段表达维持在较低水平;该基因在三倍体虹鳟38 dpf时期表达也达到了峰值(P<0.05),而在随后的41~46 dpf阶段内呈现先升高再降低的趋势,在55 dpf时又呈现显著升高(P<0.05)(图1-B)。gnrhr基因在二、三倍体虹鳟早期发育阶段脑中的表达均呈现显著的波动变化趋势,将检测时期分为较明显的3个区间,分别为31~38、41~46、55~68 dpf,二者均呈现先升高后降低或再升高的趋势(图1-C)。
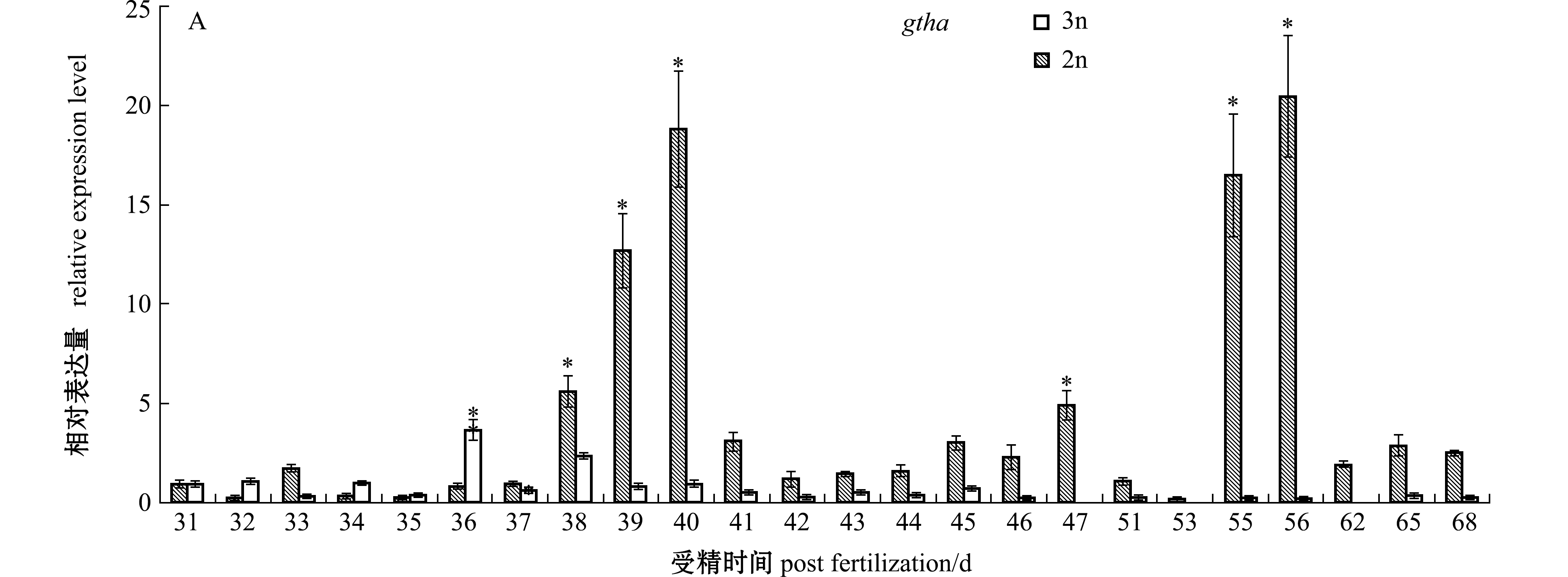
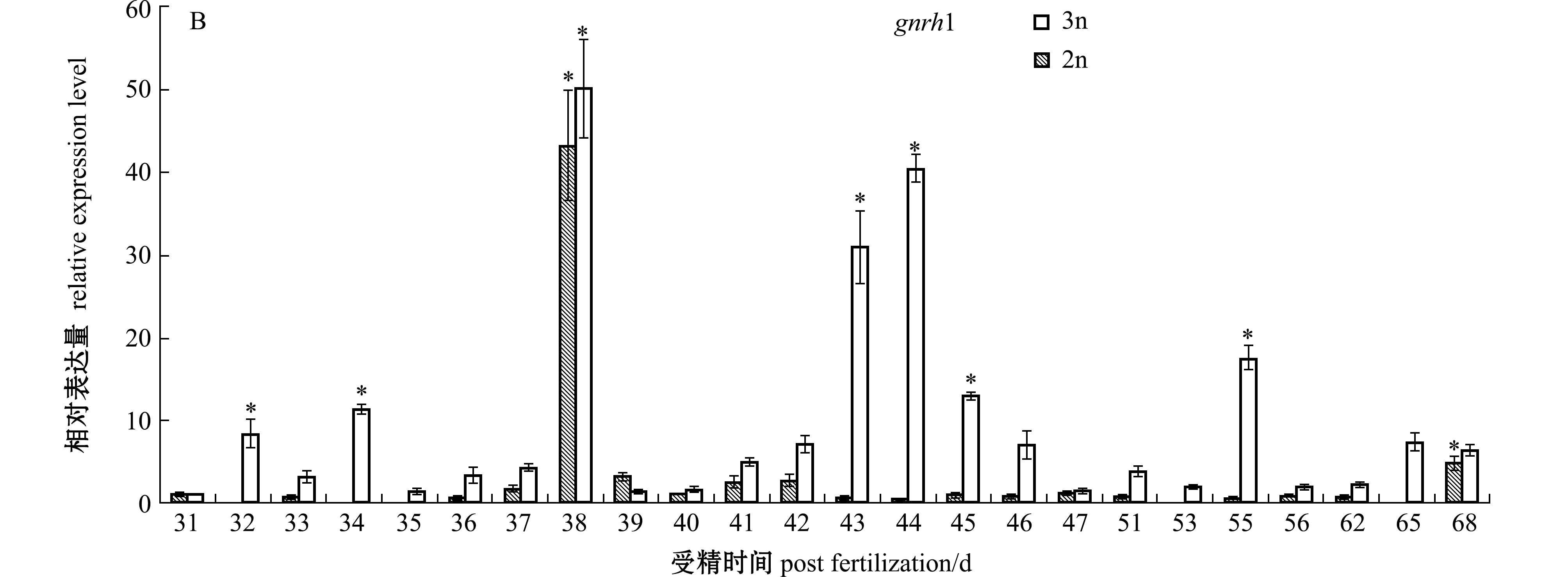
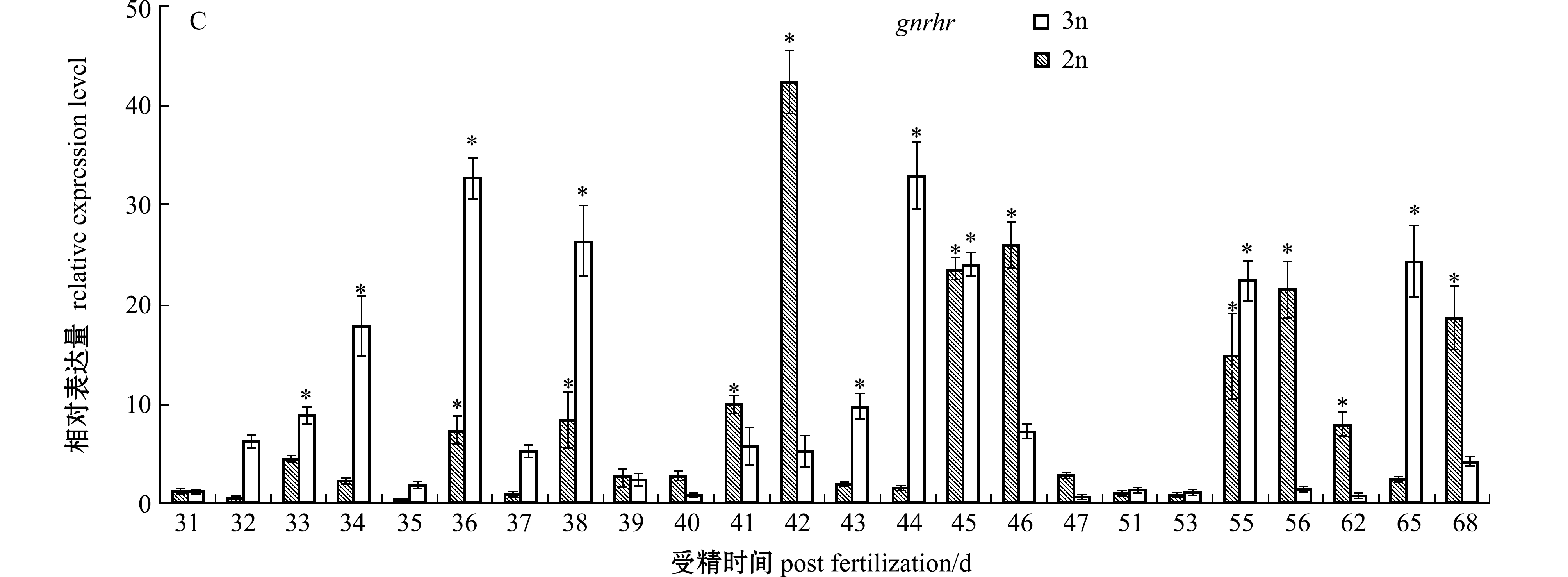
注:*表示与检测初期相比有显著性差异(P<0.05),下同
Note: * shows significant difference compared with that in initial detection(P<0.05),et sequentia
图1 二、三倍体雌性虹鳟早期发育阶段脑中内分泌调节基因的表达
Fig.1 Expressions of modulating endocrine system genes in brains of diploid and triploid female rainbow trout during early developmental period
2.2 不同倍性虹鳟性腺中内分泌调节基因的表达
内分泌关键基因的表达检测表明:三倍体雌性虹鳟在180~270 dpf时期,性腺组织中的gtha、gnrh1和gnrhr基因的表达量均较检测初期(160 dpf)出现了显著下降(P<0.05),在发育后期(360~450 dpf),这3个基因的表达量均较检测初期(160 dpf)下降了90%以上(P<0.05);二倍体雌性虹鳟gtha基因在不同发育时期的表达与检测初期(160 dpf)无显著性差异(P>0.05),gnrh1基因表达在360~450 dpf时期显著高于检测初期(P<0.05),gnrhr基因在270~450 dpf时期的表达呈显著上升趋势(P<0.05)(图2)。
3 讨论
下丘脑—垂体—性腺轴(HPG轴)为调节生殖功能的重要体系,在生殖活动中起着至关重要的作用,下丘脑合成并分泌促性腺激素释放激素,与腺垂体细胞表面的促性腺激素释放激素受体结合,作用于腺垂体使其分泌促性腺激素,与性腺表面的促性腺激素受体特异性结合,从而促进性腺的发育,使性腺分泌性激素,进而再进行反馈调节[17]。本研究中检测了二、三倍体雌性虹鳟早期发育阶段(31~68 dpf)脑组织和不同发育阶段(160~450 dpf)性腺组织中促性腺激素释放激素基因、促性腺激素释放激素受体基因和促性腺激素基因的表达变化模式,并进行了比较。
3.1 虹鳟早期发育阶段脑中内分泌调节基因的表达差异
性激素的合成与平衡均受到HPG轴关键基因的调控[18]。GnRH是调控FSH与LH合成与释放的关键因素[19]。三倍体雌性虹鳟早期发育阶段脑组织中gnrh1和gnrhr基因的表达趋势在某些发育时期较二倍体呈现显著上升。其中,gnrh1基因在31~38 dpf时呈现逐渐升高的趋势,在41~46 dpf时期也始终保持较高水平,甚至高于同时期二倍体虹鳟脑中的表达,表明由于三倍体虹鳟染色体的加倍导致下丘脑分泌促性腺激素释放激素的能力增加,因此,可能导致其后期性激素的不平衡性。而gnrhr基因在三倍体虹鳟脑组织的表达趋势与二倍体虹鳟基本相同,然而在许多时期的表达均高于同时期二倍体虹鳟,表明三倍体虹鳟腺垂体细胞表面的促性腺激素释放激素受体也处于活跃状态。但gnrh1与gnrhr间平衡关系的任何改变均可影响性激素的合成与分泌[20]。另外,gtha基因的表达在三倍体雌性虹鳟早期发育阶段脑组织中表达呈现异常状态,在检测各个时期的表达均维持在较低水平,而该基因的表达在二倍体虹鳟中处于不断的波动状态,在38~40、 55~56 dpf时期的表达均显著高于检测初期(31 dpf)。在经过丙二酚处理后的斑马鱼中,GnRH和GTH的表达均呈现显著上升,其性腺发育和繁殖能力均出现了障碍[21-22]。本研究结果表明,三倍体雌性虹鳟下丘脑和腺垂体在早期发育阶段分泌GnRH和GTH的能力呈现异常,这可能与其原始生殖细胞迁移和性腺分化异常有紧密的联系,三倍体雌性虹鳟性腺败育导致性激素分泌障碍,使其不能正常反馈于腺垂体,导致促性腺激素分泌异常,这种异常导致下丘脑—垂体—性腺循环受阻。因此,需要在性腺组织水平验证促性腺激素分泌异常的影响。
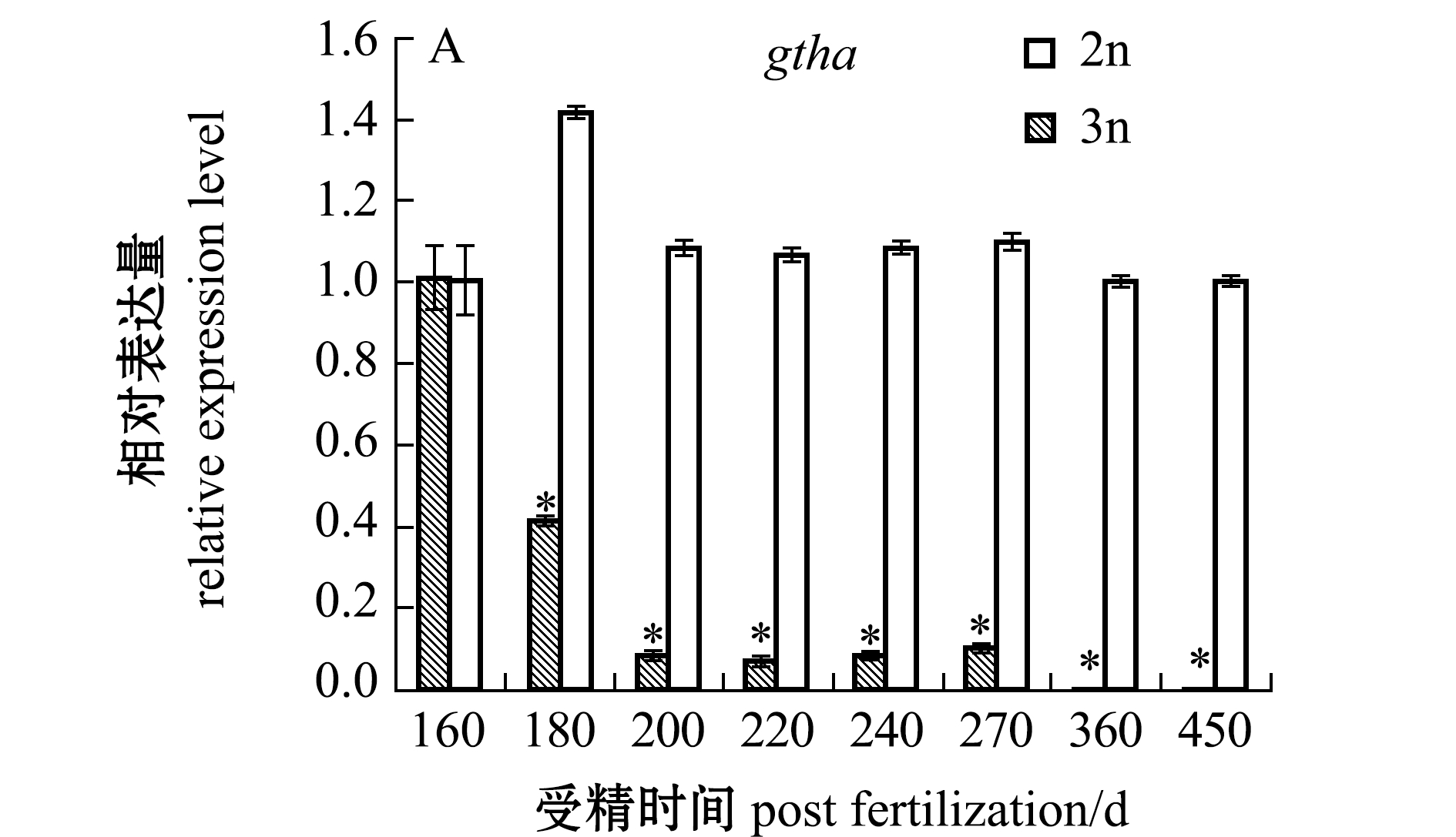
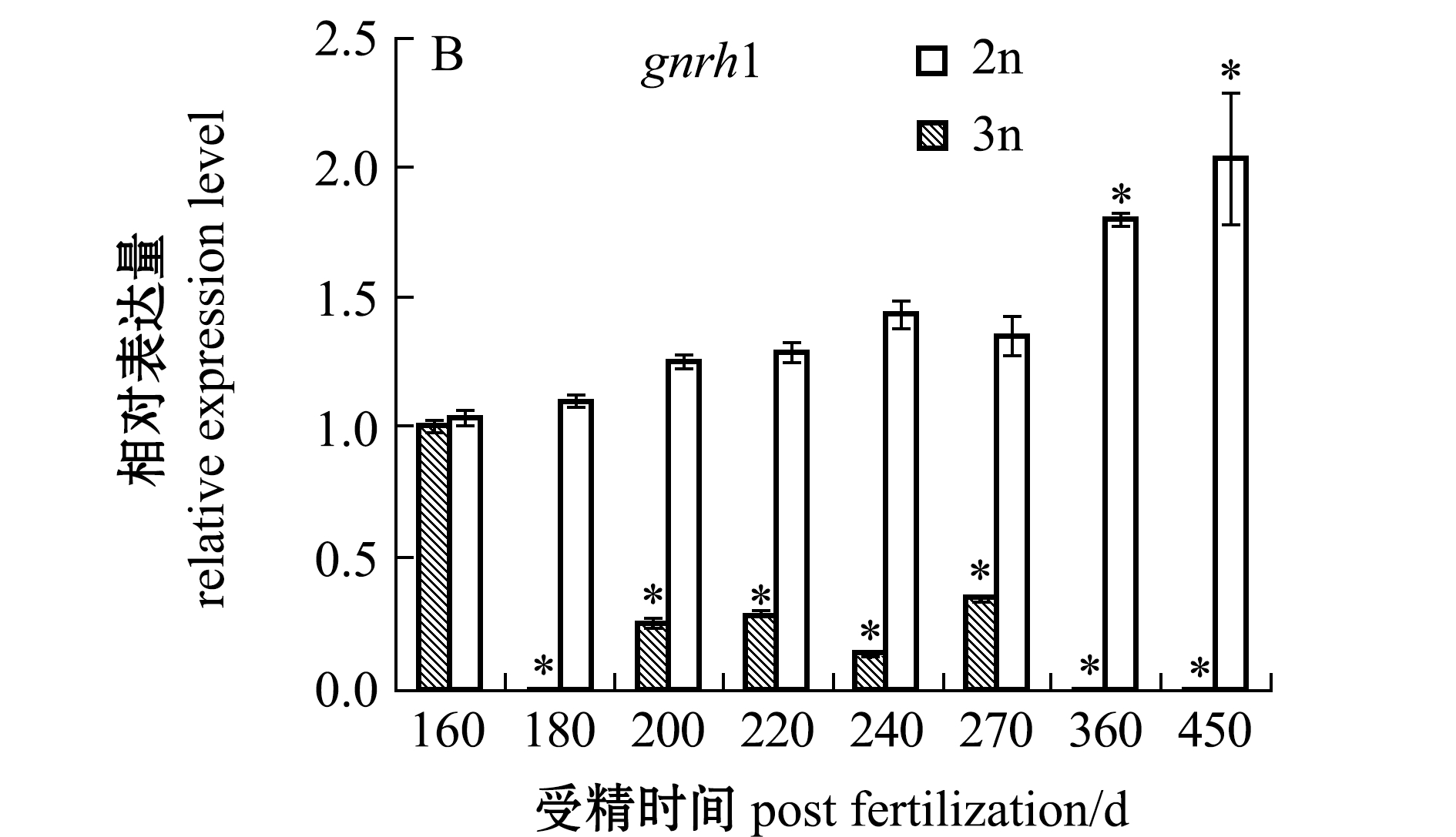
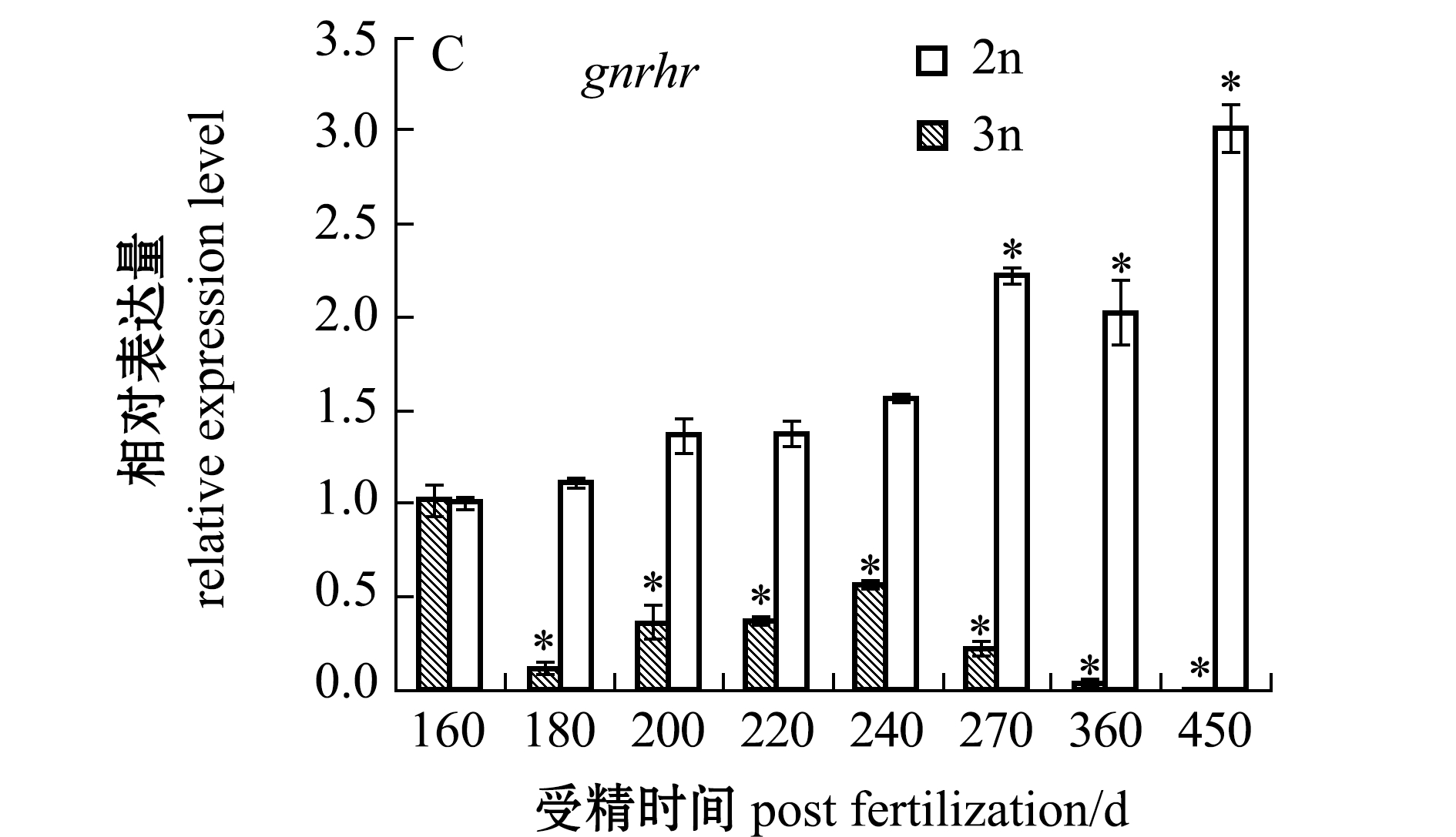
图2 二、三倍体雌性虹鳟不同发育时期性腺中内分泌调节基因的表达
Fig.2 Expressions of modulating endocrine system genes in gonads of diploid and triploid female rainbow trout during different developmental periods
3.2 虹鳟性腺中内分泌调节基因的表达差异
在三倍体雌性虹鳟性腺发育的180~270 dpf时期,gnrh1、gnrhr和gtha 3个基因的表达量均较检测初期(160 dpf)出现了显著下降,直到发育后期450 dpf阶段,基本检测不到这3个基因的表达。而二倍体雌性虹鳟性腺中gtha基因在不同发育时期的表达无显著性差异,gnrh1和gnrhr基因在360~450 dpf时期的表达水平显著高于检测初期(160 dpf)。表明随着二倍体雌性虹鳟性腺的发育,其生殖活动水平增强,其促性腺激素释放激素与促性腺激素释放激素受体结合的能力逐渐增强,从而腺垂体分泌促性腺激素及促进性腺正常分泌性激素,维持个体的发育和生殖过程。然而,在三倍体雌性虹鳟性腺组织中,gnrhr基因的表达随生长发育呈显著下降趋势,结合之前的研究结果,在200~270 dpf发育阶段,三倍体雌性虹鳟性腺中LC3B-Ⅱ/LC3B-Ⅰ的表达水平较高,结合透射电镜观察证明性腺细胞在此过程中发生了强烈的自噬,细胞自噬导致性腺细胞结构受损,呈现败育现象[23]。因此,性腺激素不能有效作用于性腺细胞,从而导致三倍体雌性虹鳟性激素分泌的异常和性腺败育。根据以往的研究,繁殖季节的三倍体鱼类HPG轴分泌的激素水平显著低于同时期的二倍体与四倍体鱼类,推测是因为三倍体鱼类性腺不能正常发育所导致[24]。
4 结论
本试验中利用Real-time PCR分别检测了二、三倍体雌性虹鳟早期发育阶段(31~68 dpf)脑组织和不同发育阶段(160~450 dpf)性腺组织中gnrh1、gnrhr和gtha基因的表达模式。结果表明,三倍体雌性虹鳟下丘脑和腺垂体在早期发育阶段内分泌关键调节基因表达呈现异常,内分泌生殖轴下丘脑—腺垂体—性腺循环受到阻断,导致后期发育阶段性腺组织呈现败育。本研究中从生殖轴调节的关键基因表达入手,从发育生物学和分子生物学的角度验证了三倍体雌性虹鳟性腺败育的根本原因。
[1] 王炳谦,谷伟,孙大江.无公害虹鳟标准化生产[M].北京:中国农业出版社,2006:101.
[2] Sumpter J P,Lincoln R F,Bye V J,et al.Plasma growth hormone levels during sexual maturation in diploid and triploid rainbow trout (Oncorhynchus mykiss)[J].Gen Comp Endocrinol,1991,83(1):103-110.
[3] Piferrer F,Beaumont A,Falguiere J C,et al.Polyploid fish and shellfish:production,biology and applications to aquaculture for performance improvement and genetic containment[J].Aquaculture,2009,293(3-4):125-156.
[4] Nagahama Y,Kobayashi T,Matsuda M.Sex determination,gonadal sex differentiation and sex change in fish[J].Tanpakushitsu Kakusan Koso.Protein,Nucleic Acid,Enzyme,2004,49(2):116-123.
[5] Avtanski D,Novaira H J,Wu Sheng,et al.Both estrogen receptor α and β stimulate pituitary GH gene expression[J].Mol Endocrinol,2014,28(1):40-52.
[6] Busby E R,Soeta S,Sherwood N M,et al.Molecular analysis of the koala reproductive hormones and their receptors:gonadotrophin-releasing hormone (GnRH),follicle-stimulating hormone β and luteinising hormone β with localisation of GnRH[J].J Neuroendocrinol,2014,26(12):870-887.
[7] Dickey J T,Swanson P.Effects of salmon gonadotropin-releasing hormone on follicle stimulating hormone secretion and subunit gene expression in Coho salmon (Oncorhynchus kisutch)[J].Gen Comp Endocrinol,2000,118(3):436-449.
[8] Bhandari R K,Taniyama S,Kitahashi T,et al.Seasonal changes of responses to gonadotropin-releasing hormone analog in expression of growth hormone/prolactin/somatolactin genes in the pituitary of masu salmon[J].Gen Comp Endocrinol,2003,130(1):55-63.
[9] Breen K M,Thackray V G,Hsu T,et al.Stress levels of glucocorticoids inhibit LHβ-subunit gene expression in gonadotrope cells[J].Mol Endocrinol,2012,26(10):1716-1731.
[10] Angelova K,Puett D.Differential responses of an invariant region in the ectodomain of three glycoprotein hormone receptors to mutagenesis and assay conditions[J].Endocrine,2002,19(2):147-154.
[11] 相福生,黄天晴,谷伟,等.硬骨鱼脑芳香化酶的表达调节、功能推测以及类固醇合成酶的研究进展[J].水产学杂志,2018,31(1):42-51.
[12] Wang Yaqin,Li Yingwen,Chen Qiliang,et al.Diethylstilbestrol impaired oogenesis of yellow catfish juveniles through disrupting hypothalamic-pituitary-gonadal axis and germ cell development[J].J Appl Toxicol,2018,38(3):308-317.
[13] Jeng S R,Yueh W S,Pen Y T,et al.Neuroendocrine gene expression reveals a decrease in dopamine D2B receptor with no changes in GnRH system during prepubertal metamorphosis of silvering in wild Japanese eel[J].Gen Comp Endocrinol,2014,206:8-15.
[14] Valcarce D G,Vuelta E,Robles V,et al.Paternal exposure to environmental 17-alpha-ethinylestradiol concentrations modifies testicular transcription,affecting the sperm transcript content and the offspring performance in zebrafish[J].Aquat Toxicol,2017,193:18-29.
[15] 闫浩,梁利群,常玉梅,等.遗传和温度因素对鱼类性别分化相关基因表达及性别比例的影响[J].大连海洋大学学报,2017,32(1):111-118.
[16] Ramachandra R K,Salem M,Gahr S,et al.Cloning and characterization of microRNAs from rainbow trout (Oncorhynchus mykiss):their expression during early embryonic development[J].BMC Dev Biol,2008,8:41.
[17] Park J W,Jin Y H,Oh S Y,et al.Kisspeptin2 stimulates the HPG axis in immature Nile tilapia (Oreochromis niloticus)[J].Comp Biochem Physiol Part B:Biochem Mol Biol,2016,202:31-38.
[18] Yang Qian,Yang Xianhai,Liu Jining,et al.Effects of BPF on steroid hormone homeostasis and gene expression in the hypothalamic—pituitary—gonadal axis of zebrafish[J].Environ Sci Pollut Res,2017,24(26):21311-21322.
[19] Filby A L,Van Aerle R,Duitman J,et al.The kisspeptin/gonadotropin-releasing hormone pathway and molecular signaling of puberty in fish[J].Biol Reprod,2008,78(2):278-289.
[20] Liu Xiaoshan,Ji K,Jo A,et al.Effects of TDCPP or TPP on gene transcriptions and hormones of HPG axis,and their consequences on reproduction in adult zebrafish (Danio rerio)[J].Aquat Toxicol,2013,134-135:104-111.
[21] Ji K,Hong S,Kho Y,et al.Effects of bisphenol S exposure on endocrine functions and reproduction of zebrafish[J].Environ Sci Technol,2013,47(15):8793-8800.
[22] Yang Xiaoxi,Liu Yuchen,Li Jia,et al.Exposure to bisphenol AF disrupts sex hormone levels and vitellogenin expression in zebrafish[J].Environ Toxicol,2016,31(3):285-294.
[23] Huang Tianqing,Sun Huizhi,Wang Yanna,et al.Effect of follicle cell autophagy on gonadal development of triploid female rainbow trout (Oncorhynchus mykiss)[J].Fish Physiol Biochem,2018,44(1):185-196.
[24] Espigares F,Carrillo M,Gómez A,et al.The forebrain-midbrain acts as functional endocrine signaling pathway of Kiss2/Gnrh1 system controlling the gonadotroph activity in the teleost fish European sea bass (Dicentrarchus labrax)[J].Biol Reprod,2015,92(3):70.