红鳍东方鲀Takifugu rubripes生长速度快,经济价值高,是中国重要的海水养殖鱼类。近年来,红鳍东方鲀的集约化工厂化养殖发展迅速,由于养殖密度高、水环境质量差、技术滞后等原因,红鳍东方鲀的养殖病害问题屡屡发生[1]。
哈氏弧菌Vibrio harveyi广泛存在于海洋环境中,是一种常见的条件致病菌。在适宜条件下,哈氏弧菌可以大量繁殖,通过伤口和消化道感染,导致动物伤口肌肉溃烂化脓和内脏严重病变,引起动物死亡[2]。该菌可以感染海洋脊椎动物和无脊椎动物[3],并引起多种鱼[4]、虾[5]及贝类[6]感染发病,造成大量死亡,对水产养殖威胁很大。红鳍东方鲀是肉食性鱼类,在自然状态下,有相互咬噬的特性,容易造成体表创伤,因此,当环境中病原微生物大量存在时,可通过伤口造成局部细菌感染[7]。近年来,由于细菌感染已出现多次大规模病害暴发,这给红鳍东方鲀养殖生产和出口创收造成了经济损失,严重影响了红鳍东方鲀作为一种经济物种的价值。为了防治疾病,对红鳍东方鲀大多采取抗生素治疗,养殖生产中不规范、不科学的药物使用,使得周围的水环境污染恶化,危害食用者的健康,是水产品质量的安全隐患[8]。为了解决集约化养殖所带来的病害问题,需要对红鳍东方鲀自身免疫相关因子进行研究。其中,细胞因子信号传导抑制因子-3(Suppressor of cytokine signaling-3, SOCS3)可以对多种细胞因子产生的信号传导过程进行调节,这些信号传导过程的作用涉及启动免疫反应,控制炎症过程[9],从而达到降低集约化养殖所带来的负面影响。
细胞因子信号传导抑制因子(SOCS3)是细胞因子信号通路的负调节因子,可通过负反馈抑制细胞因子的信号传递,防止过度的信号反应干扰机体代谢平衡和细胞功能[9]。目前,对小鼠、人类的研究中发现了8个SOCS家族成员,如细胞因子诱导的含SH2的蛋白(Cytokine inducible SH2-containing protein, CIS)和SOCS1~SOCS7[10]。而鱼类SOCS家族已经被克隆出12个家族成员,除以上提及的8个外还包括SOCS3b、SOCS5b、SOCS8和SOCS9[11]。SOCS3作为SOCS3家族重要成员,主要参与酪氨酸蛋白激酶/信号传导子和转录激活子信号传导途径(Janus protein tyrosine kinase/signal transducer and activator of transcription, JAK/STAT)的负反馈调节,与免疫反应相关。近年来,关于哺乳动物socs3基因的研究较为广泛,在哺乳动物中,SOCS系统已经对胰岛素信号通路[12]、瘦素(leptin)信号通路[13]、白介素信号通路[14]及肿瘤[15]、癌症[16]等均具有调控作用。但对于鱼类socs基因的研究,仅限于基因组已经解码的模式鱼类,如斑马鱼Danio rerio、青鳉Oryzias latipes、三棘刺鱼Gasterosteus aculeatus、虹鳟Oncorhynchus mykiss等[17],而这些研究主要集中在基因的克隆和鉴定,对于socs基因在鱼类组织中的表达研究较少。笔者前期通过转录组分析获得的差异表达基因中,socs3基因是关键的差异表达基因。
本试验中,通过对红鳍东方鲀socs3基因序列进行分析,检测红鳍东方鲀socs3基因在6个不同组织的表达情况,以及感染哈氏弧菌后3个组织socs3基因的免疫反应进行分析,旨在为红鳍东方鲀免疫应答研究提供数据支持,从而从根源上解决红鳍东方鲀集约化养殖所带来的环境问题和经济问题。
1 材料与方法
1.1 材料
试验用红鳍东方鲀购自大连天正实业集团有限公司,正式试验前将试验鱼在大连海洋大学北方海水增养殖农业农村部重点实验室暂养14 d。
反转录试剂盒(PrimerScriptTM RT Reagent Kit)购自大连宝生物工程有限公司,动物组织总RNA提取试剂盒(RNAprep Pure Tissue Kit)购自天根生化科技有限公司,GoldView I型核酸染色剂、荧光定量PCR引物购自生工生物工程(上海)股份有限公司,Marker(DL2000)、DNA酶I(无RNA酶)购自大连万泽生物工程有限公司。
1.2 方法
1.2.1 试验设计及样本采集 取暂养14 d的红鳍东方鲀,将鱼麻醉(MS-222,40 mg/L)并称重,随机挑选健康活泼、规格一致、体质量为(290.34±5.13)g的红鳍东方鲀15尾,每5尾鱼为1组,每组设置3个平行,采集健康组织样品。在红鳍东方鲀处于半昏迷状态时,放于冰上解剖,并迅速采集其脑、脾脏、肠、肌肉、鳃和肝脏组织,分别置于1.5 mL离心管中,取得的样品放入5倍体积的RNAlater液中,每个管中的组织量约为20 mg,于超低温冰箱(-80 ℃)中下保存备用。
细菌感染试验中,取暂养14 d的健康红鳍东方鲀120尾,分为4组,每组设置3个平行。暂养期间活化并培养哈氏弧菌。将哈维氏弧菌(VIB645,取自大连市海珍品疾病防控重点实验室)菌株纯化后接入2216E液体培养基中,培养18 h后作为供试菌液。取1 mL菌液离心后用生理盐水配成一定梯度的菌悬液,用平板涂布法计数菌液浓度。感染试验开始时向每尾红鳍东方鲀肌下注射浓度为9×106 cells/mL的哈氏弧菌0.1 mL。感染试验开始后分别在24、48、72 h采集红鳍东方鲀肝脏、脾脏和肠组织样品,将样品放入5倍体积的RNAlater溶液中,放入冰箱(-80 ℃)中保存备用。
1.2.2 红鳍东方鲀各组织总RNA的提取及反转录 从健康红鳍东方鲀组织中提取脑、脾脏、肠、肌肉、鳃、肝脏组织的总RNA,以及哈氏弧菌感染后0、24、48、72 h 4个不同阶段红鳍东方鲀肝脏、脾脏和肠组织的总RNA。即取各组织样品20 mg,加入300 μL裂解液RL和3 μL的β-巯基乙醇,用电动研磨棒将组织彻底研磨。提取方法参照动物组织总RNA提取试剂盒说明书。取4 μL总RNA,用10 g/L琼脂糖凝胶进行电泳,取2 μL总RNA,用微量核酸测定仪(NV3000 Spectrophtometer)测定RNA的A260 nm/A280 nm值,其比值为1.9~2.1的RNA选为可用RNA。按照TaKaRa PrimerScriptTM RT-PCR Kit说明书步骤,以20 μL体系对1 pg总RNA进行反转录反应。
1.2.3 socs3基因在不同组织中的荧光定量PCR测定 根据NCBI中已报道的红鳍东方鲀socs3(NC_018894.1)和β-actin(XM_003964421)的基因序列,应用Primer Premier 5.0软件设计荧光定量引物(表1),引物由生工生物工程(上海)股份有限公司合成。用普通PCR筛选出条带单一且无二聚体的引物,然后通过荧光定量PCR 检测引物的特异性,挑选条带单一且特异性好的引物进行荧光定量PCR试验。利用实时荧光定量PCR(qPCR)仪对红鳍东方鲀所取组织中的socs3基因表达情况进行荧光定量分析,试验按照试剂盒SYBR©Premix Ex TaqTM说明书进行。向反应体系中依次加入下列反应溶液(共20 μL):10 μL SYBR Premix ExTaq,0.8 μL Primer(10 mol/L),0.4 μL ROX Reference Dye II (50×),2 μL Template cDNA,6.8 μL ddH2O。将样品试剂混匀,利用ABI 7500 Real-Time PCR仪(Applied Biosystems,美国)进行分析。PCR反应程序为:95 ℃下预变性30 s;95 ℃下变性5 s,60 ℃下退火1 min,共进行40个循环;最后在95 ℃下变性15 s,60 ℃下退火1 min,再升温到95 ℃时变性15 s,最后温度降到60 ℃时终止反应。
表1 socs3基因和β-actin引物序列
Tab.1 Primer sequences of socs3 and β-actin gene
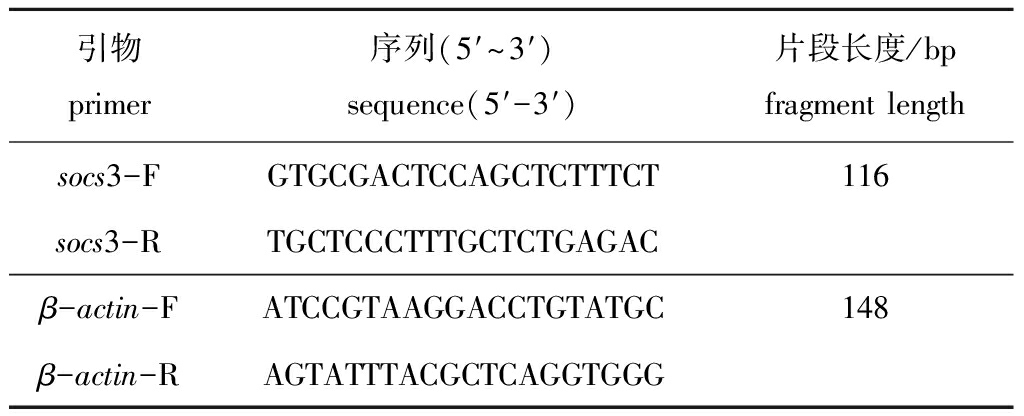
引物primer序列(5′~3′)sequence(5′-3′)片段长度/bpfragment lengthsocs3-FGTGCGACTCCAGCTCTTTCT116socs3-RTGCTCCCTTTGCTCTGAGACβ-actin-F ATCCGTAAGGACCTGTATGC148β-actin-R AGTATTTACGCTCAGGTGGG
1.2.4 基因序列的生物信息学分析 使用NCBI的ORF Finder程序(http://www.ncbi.nlm.nih.gov/gorf/gorf.html)鉴定所获得的红鳍东方鲀SOCS3(NP_001072096.1)序列的潜在开放阅读框(ORF)。通过模块化结构研究工具(SMART;http://smart.embl-heidelberg.de/)来鉴定保守结构域和信号肽。运用Clustal W软件进行7个物种间的SOCS3氨基酸序列比对,结果用GeneDoc进行格式处理。
为了鉴定SOCS3的进化关系,选择红鳍东方鲀SOCS3(NP_001072096.1)和其他18个物种的SOCS3氨基酸序列来构建系统发生树,使用邻接法(Neighbor-joining method)在分子进化遗传分析MEGA 6.0软件中进行系统发育和分子进化分析。使用泊松校正分析系统发生树,通过完全缺失(complete deletion)去除缺口,并使用1000次自举重复来评估邻接树的拓扑稳定性。
1.3 数据处理
试验数据用平均值±标准差表示,使用Calculation Software for the Relative Expression in Real-time PCR软件对试验数据进行单因素方差分析,显著性水平设为0.05。
2 结果与分析
2.1 各组织总RNA的提取结果
样品的浓度和纯度结果表明,提取的总RNA的A260 nm/A280 nm的值为1.90~2.15,均可在荧光定量中作为模板使用。
使用琼脂糖凝胶电泳仪来测定提取RNA的完整性,可清晰地观察到28S和18S两个条带,且28S条带亮度大约是18S条带的2倍,证明所提取RNA完整性达标,可用于荧光定量中作为模板使用(图1、图2)。
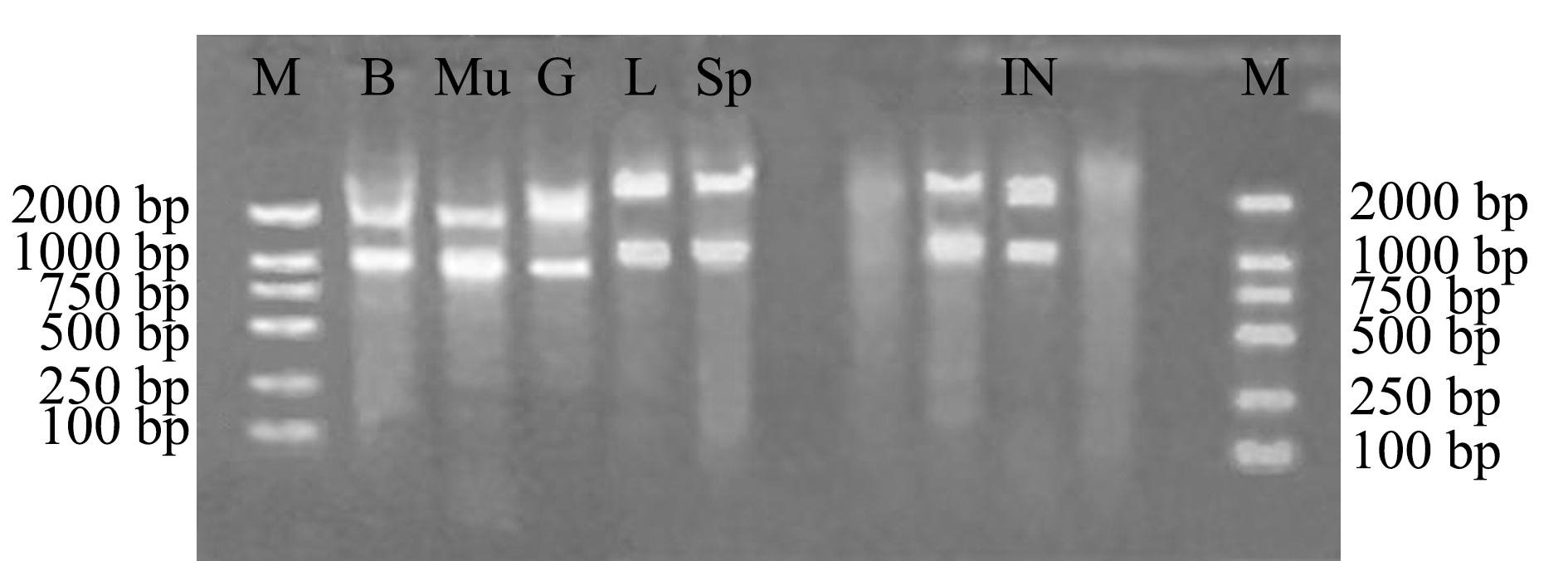
注:B为脑;Mu为肌肉;G为鳃;L为肝脏;Sp为脾脏;IN为肠;M为2000 DNA Marker
Note: B, brain; Mu,muscle; G,gill; L,liver; Sp,spleen;IN, intestine; M, 2000 DNA Marker
图1 健康红鳍东方鲀各组织样品的socs3基因RNA产物琼脂糖凝胶电泳结果
Fig.1 Agarose gel electrophoresis of the socs3 gene RNA product in various tissues from healthy redfin puffer Takifugu rubripes
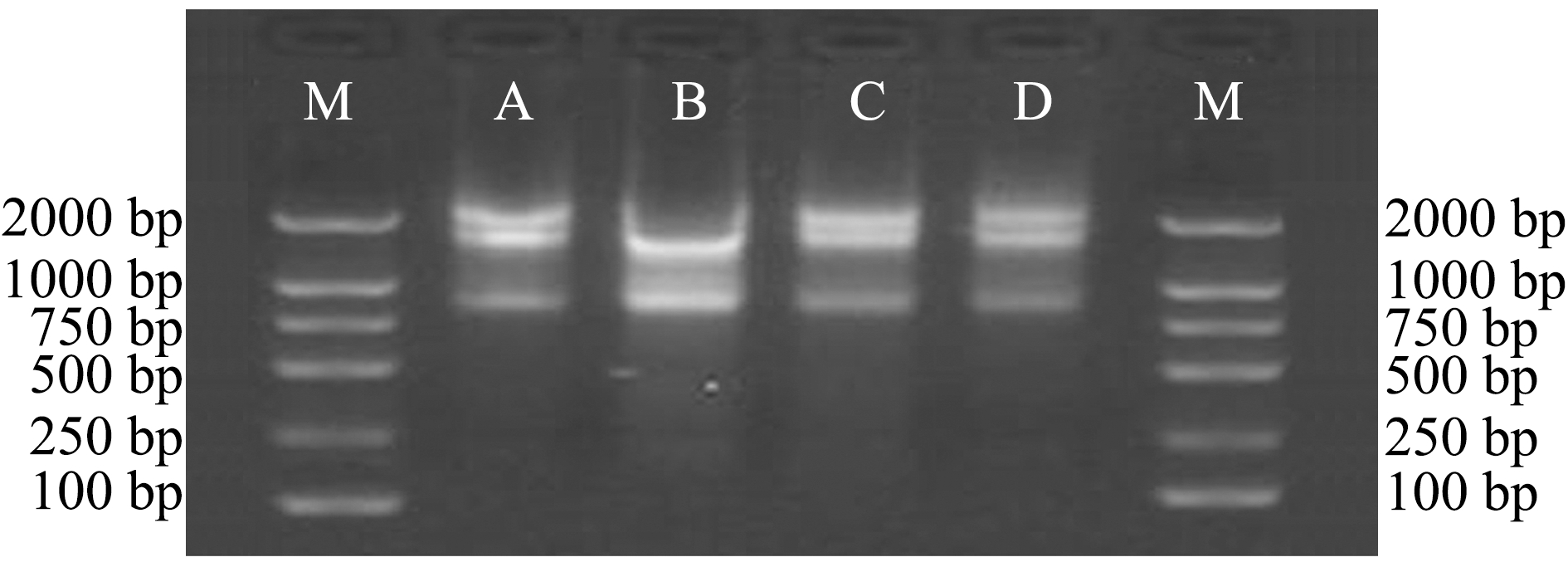
注:A为0 h;B为24 h;C为48 h;D为72 h
Note: A,0 h; B,24 h; C,48 h; D,72 h
图2 被染菌后的红鳍东方鲀肝脏组织样品4个阶段socs3基因RNA产物琼脂糖凝胶电泳结果
Fig.2 Agarose gel electrophoresis of socs3 gene RNA product in liver of redfin puffer Takifugu rubripes infected in four stages
2.2 红鳍东方鲀socs3基因的组织表达差异
以脑作为基准1,由图3可知,同一时间段内的socs3基因在肝脏、肌肉中显著表达(P<0.05),分别为脑表达量的8倍和2倍。可明显看出,socs3基因在肠、鳃、脾脏中表达量相对较少(P>0.05)。
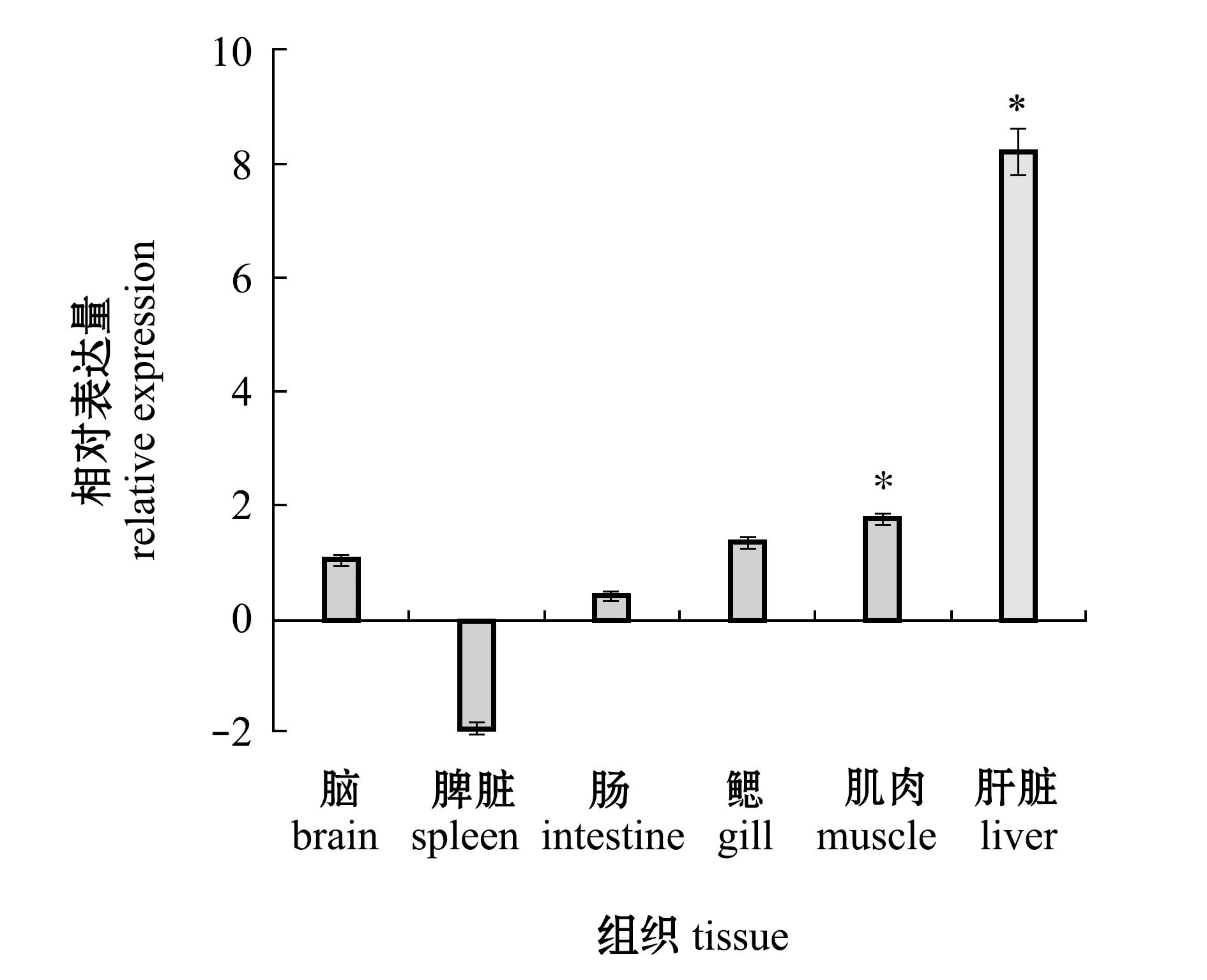
注:*表示与脑组织相比有显著性差异(P<0.05)
Note: * represents a significant difference from the brain(P<0.05)
图3 红鳍东方鲀各组织样品中socs3基因相对表达量的变化
Fig.3 Relative expression level of socs3 gene in the tissues of redfin puffer Takifugu rubripes
感染哈氏弧菌后的红鳍东方鲀各组织中的socs3基因在细菌感染后的不同时间段内同样出现了表达差异。从图4可见:socs3基因在不同组织中的表达量随着感染时间的延长,均呈先升高后降低的趋势;在感染后24 h、48 h时,肝脏组织中的socs3基因表达量显著高于0 h(P<0.05),分别为0 h表达量的10倍和8倍,而在72 h时socs3基因的表达量又降低至接近0 h水平;脾脏和肠组织中的socs3基因表达量在不同时间段变化幅度不大(P>0.05)。
2.3 红鳍东方鲀SOCS3氨基酸序列分析
将从NCBI上得到的socs3基因全长cDNA序列利用ORF Finder进行分析。结果显示,该序列全长为1533 bp,其中5′ 端非编码区和3′ 端非编码区分别为215 bp和713 bp,开放阅读框(ORF)长度为606 bp,共编码201个氨基酸。
利用SMART分析,预测出由socs3基因编码的SOCS3蛋白具有两个功能域SH2 domain和SOCS3盒。SOCS3总蛋白相对分子质量为24 700,由氨基端(N端)、位于中央的SH2区和羧基端的SOCS3盒组成。其C末端有一个由40个氨基酸构成的SOCS3盒,SH2区是由从N端第48位氨基酸开始的137个氨基酸构成(图5)。
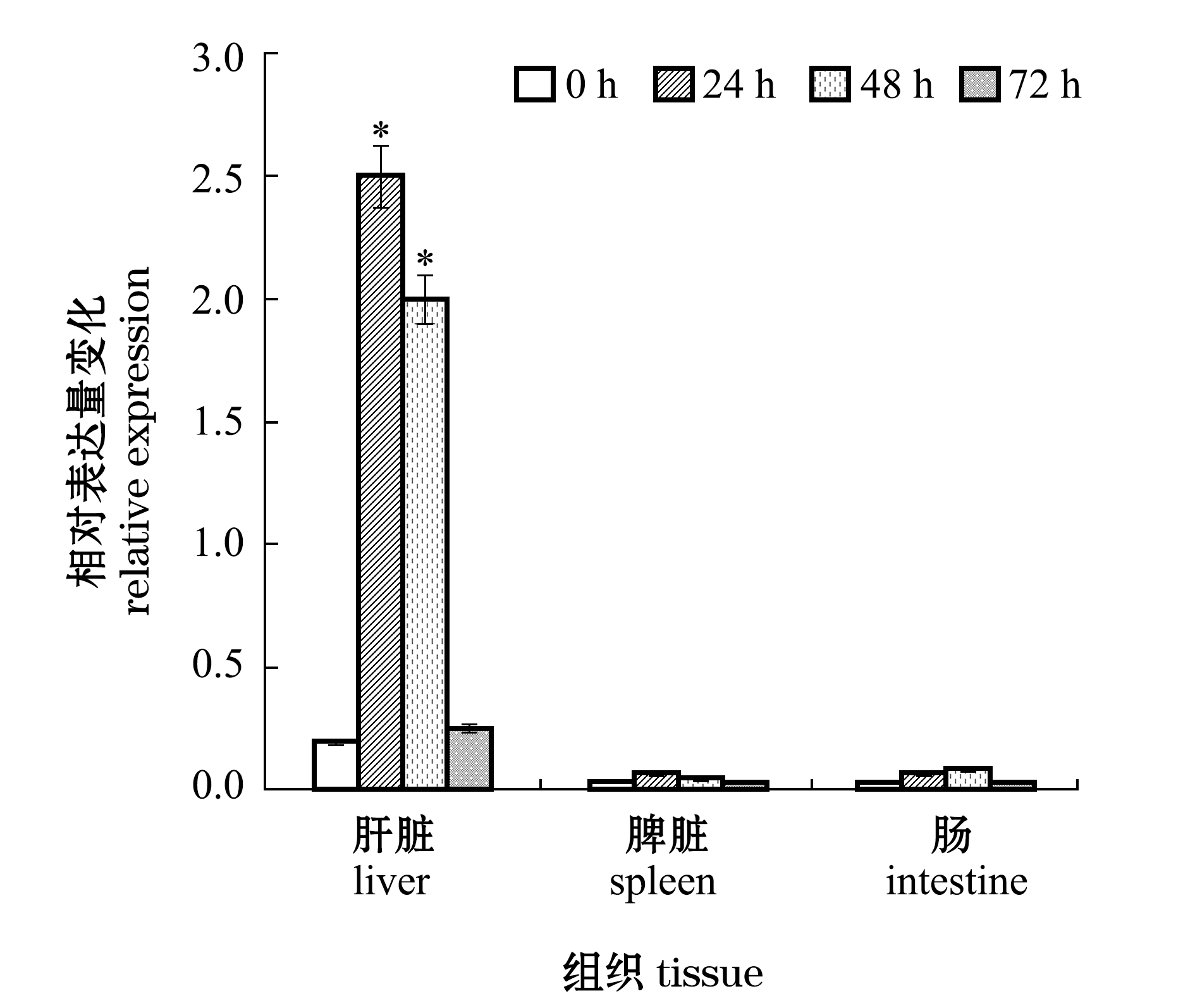
注:*表示与0 h相比有显著性差异
Note: * represents a significant difference from 0 h
图4 感染哈氏弧菌后24、48、72 h时红鳍东方鲀3种组织中socs3基因的表达情况
Fig.4 Expression of socs3 gene in three tissues of redfin puffer Takifugu rubripes infected with Vibrio harveyi for 24 h,48 h,and 72 h
2.4 系统进化树和同源性分析
使用MEGA 6.0软件对在NCBI上所找到的18个物种的SOCS3氨基酸序列(表2)和红鳍东方鲀SOCS3氨基酸序列构建系统进化树,结果如图6所示。
从图6可见:包括人类、小鼠、鸡、牛、鬃狮蜥等在内的高等动物聚为一支,而硬骨鱼类单独聚集为一支,部分具有SOCS3b蛋白的硬骨鱼类单独聚为一支;红鳍东方鲀与其同科的黑青斑河豚Tetraodon nigroviridis聚在一起;除了黑青斑河豚的硬骨鱼外,红鳍东方鲀与三刺鱼Gasterosteus aculeatus的SOCS3a最为相近,在鱼类中与斑马鱼Danio rerio距离最远,亲缘关系较远。
利用Blastp软件分析SOCS3氨基酸在不同硬骨鱼类中的相似性,其中与黑青斑河豚的SOCS3a氨基酸序列一致性最高,为88%,与斑马鱼一致性最低,为63%,而与绝大部分硬骨鱼类的一致性均大于70%。这表明,SOCS3在硬骨鱼类中十分保守。

图5 红鳍东方鲀( NP_001072096.1 )SOCS3蛋白与其他6个物种SOCS3蛋白序列比对
Fig.5 Sequence alignment of the SOCS3 protein (NP_001072096.1) of redfin puffer Takifugu rubripes and the other six species
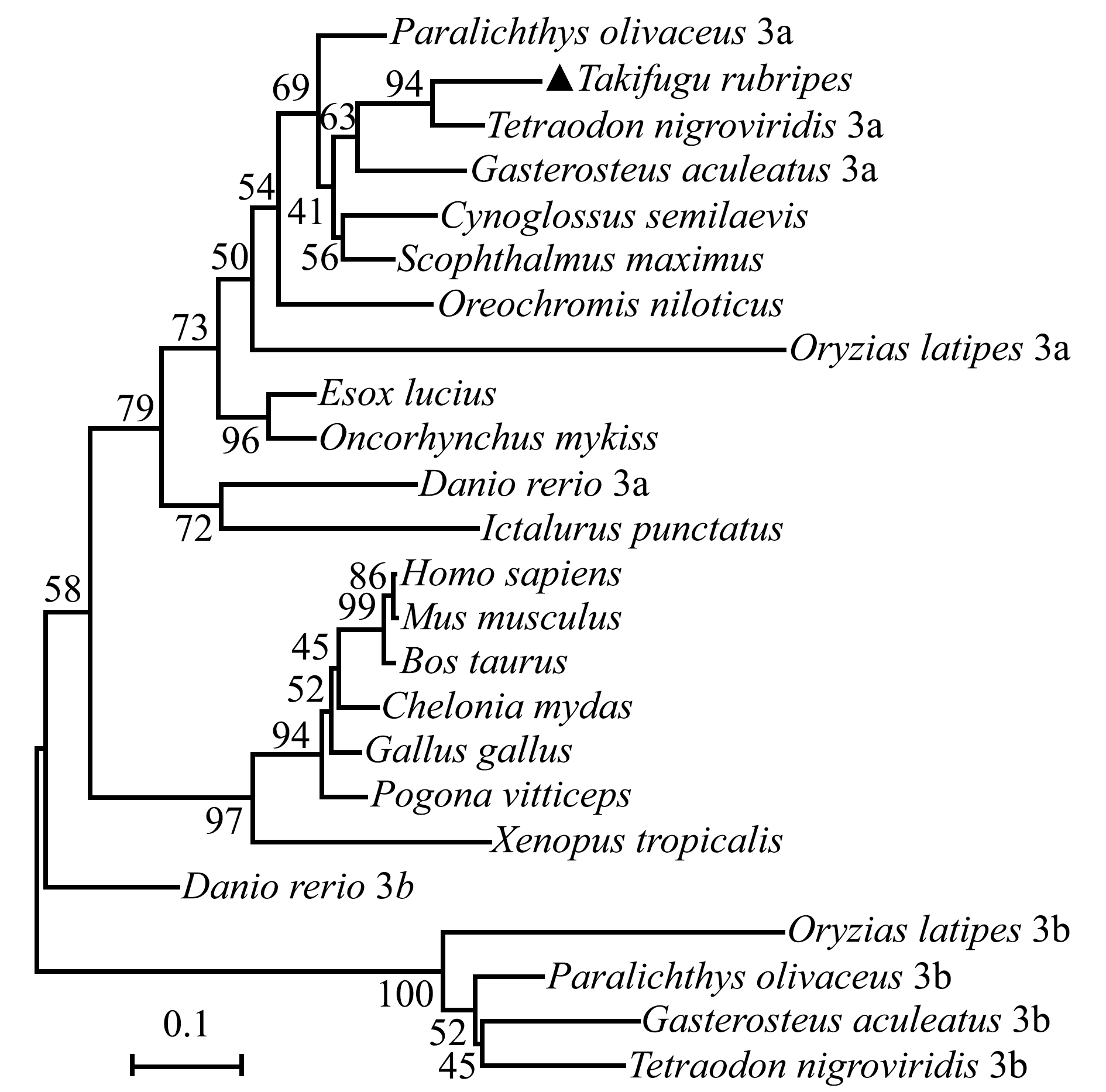
图6 基于红鳍东方鲀SOCS3(NP_001072096.1)与其他18个物种SOCS3氨基酸序列构建的系统发育树
Fig.6 Phylogenetic tree was constructed from redfin puffer Takifugu rubripes (NP_001072096.1) with the amino acid sequences of SOCS3 in the other 18 species
3 讨论
3.1 SOCS3的作用机制
SOCS3蛋白结构与SOCS家族其他成员相似,由N区(位于氨基端)、SH2区(位于中央)和SOCS盒(位于羧基端)3部分组成。N区中含有两个非常重要的结构,分别为激酶抑制区(Kinase inhibitory region, KIR)和前SH2位点[18]。其中SOCS盒是SOCS3蛋白羧基端的保守序列,由40个氨基酸组成,同源性极强,在所有的动物的SOCS中都存在[19]。
表2 各物种SOCS3信息
Tab.2 SOCS3 information of different species

物种名称species nameGenBank accession No.类型type人类Homo sapiensNP_003946.3SOCS3小鼠 Mus musculusNP_031733.1SOCS3鸡Gallus gallus NP_989931.1SOCS3牛Bos taurus NP_776891.1SOCS3西部爪蛙Xenopus tropicalis NP_001005696.1SOCS3鬃狮蜥Pogona vitticeps XP_020669696.1SOCS3绿海龟Chelonia mydas XP_007063413.1SOCS3半滑舌鳎Cynoglossus semilaevis XP_008327772.1SOCS3虹鳟Oncorhynchus mykiss NP_001139640.1SOCS3斑点叉尾鮰Ictalurus punctatus NP_001188183.1SOCS3大菱鲆Scophthalmus maximus ADM67576.1SOCS3尼罗罗非鱼Oreochromis niloticus NP_001306799.1SOCS3白斑狗鱼Esox lucius XP_t10872621.1SOCS3青鳉Oryzias latipes NP_001265795.1SOCS3a青鳉Oryzias latipes ABQ53611.1SOCS3b牙鲆Paralichthys olivaceus XP_019949709.1SOCS3a牙鲆Paralichthys olivaceus BAW03227.1SOCS3b黑青斑河鲀Tetraodon nigroviridis ABC60040.1SOCS3a黑青斑河鲀Tetraodon nigroviridis ABQ53605.1SOCS3b斑马鱼Danio rerio ABQ53605.1SOCS3a斑马鱼Danio rerio NP_998469.1SOCS3b三刺鱼Gasterosteus aculeatus NP_001254587.1SOCS3a三刺鱼Gasterosteus aculeatus ABQ53602.1SOCS3b
SOCS是具有负调控细胞因子信号通路功能的蛋白家族,最初是作为JAK-STAT通路的负性调控因子被发现的[20]。目前,SOCS3的负反馈调节主要有3种方式:(1) 由于SH2结构域与STAT的相似性,竞争结合细胞因子受体区胞质区的磷酸化Tyr位点,阻止转录因子STAT的活化;(2) 利用SH2结构域与JAK结合,靠近SH2结构域N端的激酶抑制区(KIR)竞争性抑制JAK与底物结合;(3) 通过SOCS3的C端SOCS盒与elongin BC复合体结合,将SOCS3结合的信号蛋白JAK和STAT通过泛素化降解,从而阻断细胞因子的信号传递[21]。
在鱼类相关细胞分化研究中,socs3基因可以平衡STAT/SOCS3通路,由于STAT途径的过活化或活化抑制会抑制毛发细胞再分化,socs3基因可以确保STAT途径正向调节毛发再生基因,确保丢失的毛发细胞进行适当的补充[22];在对转基因斑马鱼的研究中,socs3基因可以通过与JAK结合抑制其活性或gh基因受体,阻止STAT与gh结合,从而抑制gh的过表达,防止由于gh过表达造成的生育力下降、老化等副作用[23];在视神经再生的研究中,JAK/STAT信号可以刺激斑马鱼视神经再生,具有强大的再生能力,但是视神经损伤同时会刺激socs3基因的表达,抑制JAK/STAT途径,从而抑制视神经再生,可为鱼类视神经再生研究奠定基础[24];研究还表明,socs3的过表达可显著降低巨噬细胞呼吸爆发活性,降低NO的产生和细菌活性,是对抗细菌先天性免疫的最佳途径[25];socs3在炎症性疾病、病毒感染、肥胖及肿瘤等疾病的发生发展中发挥重要作用,socs3可作为一些疾病诊断及预测后的生物分子指标,是治疗多种疾病的潜在靶标[26]。
3.2 健康红鳍东方鲀各组织中socs3的表达
本研究结果显示,健康情况下,红鳍东方鲀socs3基因在肝脏和肌肉中显著表达,分别约为脑组织的8倍和2倍,在其他组织中微量表达甚至不表达。目前,已经从多种鱼类中得到SOCS3氨基酸序列,其与红鳍东方鲀SOCS3氨基酸序列的一致性为63%~88%。这表明,SOCS3蛋白在功能上具有高度保守。对虹鳟socs3基因的研究表明,其所有8个组织中均具有高于socs1和socs2的表达量[27]。正常条件下,在大菱鲆各个组织中socs3均有表达,主要在肌肉、肝脏和鳃中有显著表达[25],本文中的红鳍东方鲀各个组织中的表达情况与其表达相似。
3.3 哈氏弧菌感染后红鳍东方鲀组织中socs3表达的变化
SOCS3蛋白广泛分布于肝脏、胸腺、脑、胰腺、肾脏、肺、胎盘等组织器官中,参与脂肪和肌肉组织中多种细胞因子的负调控,生理功能十分广泛。正常情况下,socs3的表达水平非常低,但当有大量细胞因子、激素及生长因子存在时,socs3会被迅速诱导表达,且这种诱导表达具有细胞和组织特异性。过度表达的SOCS3蛋白又特异性地抑制细胞因子介导的信号通路,对信号转导起到负反馈抑制作用,进而形成一个负反馈调节的通路[28]。提示socs3基因可能与红鳍东方鲀的免疫相关。
本研究中,利用哈氏弧菌感染红鳍东方鲀,采用相对实时荧光定量PCR方法,对其组织中socs3基因的表达情况进行荧光定量分析,结果表明,肝脏组织内的socs3基因在感染后24、48 h显著表达,但在脾脏和肠组织中表达不显著。原因可能是肝脏作为最主要的免疫器官,试验结果较为显著。相似的研究有,对半滑舌鳎socs3基因的研究中,被哈氏弧菌感染后的半滑舌鳎,其肝脏在12、24 h内socs3基因有1.6~3倍的轻微上调,而被感染的脾脏和肠等组织未表现出明显的上调[29]。肖占刚[30]研究了鲤被SVCV感染后的socs3基因的表达,结果发现,socs3在感染中后期的免疫相关器官中明显上调,提示socs3在调节细菌和病毒诱导的先天免疫和防止一些细胞因子的过表达方面可能具有一定作用。本研究表明,socs3基因在感染哈氏弧菌后的肝组织内随着感染时间的延长,呈现先升高后降低的趋势。其原因存在两种可能:(1) 在感染前期,socs3基因作为细胞因子信号传导抑制因子调节体内的免疫系统,对细菌进行攻击,但是后期由于感染加重,出现socs3的“沉默”,使肝组织内socs3的表达量降低。已有研究表明,人体内socs3的表达水平可以初步判断前列腺癌的恶性程度,在前列腺增生时期socs3基因表达量较高,可以调控肿瘤细胞的活动,加快肿瘤细胞的凋亡,但在癌症时期,socs3基因表达量下调[31]。Ru等[32]通过Western Blot检测不同乳腺癌细胞系发现,在各种乳腺癌细胞中socs3均表现出低表达状态,提示在乳腺肿瘤恶变过程中可能出现了socs3表达的“沉默”状态,导致乳腺细胞的失控性增生及恶性转化,癌变程度增高。(2) 在大量针对哺乳动物的研究中,socs3作为免疫相关因子可以负调控细胞信号传导,推测socs3在感染后期(72 h)下降的原因是细胞因子的信号传导恢复正常,进行感染的细菌被控制或清除,机体恢复正常的生理功能。而在正常的生理功能下,socs3的表达并不显著,故表现出socs3在肝脏中的表达含量下调。
4 结论
socs3基因广泛存在于红鳍东方鲀的6种组织中,在免疫相关组织中含量丰富,在应对哈氏弧菌感染时,socs3在红鳍东方鲀肝脏组织中产生了显著的表达水平变化。通过动态监测socs3的表达水平,并结合其他指标,可以为及时发现鱼类的感染病情、了解鱼类感染程度和感染早期的治疗提供支持。
[1] 杜佳垠.红鳍东方鲀健康养殖之四健康养殖科学治病[J].齐鲁渔业,2004(9):54-56.
[2] 孙鲲.哈氏弧菌种特异性分子标记的发现及其在哈氏弧菌快速诊断和免疫防治中的应用[D].青岛:中国科学院研究生院(海洋研究所), 2009.
[3] Austin B,Zhang X H.Vibrio harveyi:a significant pathogen of marine vertebrates and invertebrates[J].Letters in Applied Microbiology,2010,43(2):119-124.
[4] 王保坤,余俊红,李筠,等.花鲈弧菌病病原菌(哈维氏弧菌)的分离与鉴定[J].中国水产科学,2002,9(1):52-55.
[5] Jayasree L,Janakiram P,Madhavi R.Characterization of Vibrio spp.associated with diseased shrimp from culture ponds of Andhra Pradesh (India)[J].Journal of the World Aquaculture Society,2006,37(4):523-532.
[6] 邓欢,陈俅,刘权恕,等.养殖海湾扇贝弧菌病的研究[J].应用与环境生物学报,2003,9(5):517-521.
[7] 马爱军,李伟业,王新安,等.红鳍东方鲀养殖技术研究现状及展望[J].海洋科学,2014,38(2):116-121.
[8] 胡梦红.抗生素在水产养殖中的应用、存在的问题及对策[J].水产科技情报,2006,33(5):217-221.
[9] Croker B A,Kiu H,Nicholson S E.SOCS regulation of the JAK/STAT signalling pathway[J].Seminars in Cell & Developmental Biology,2008,19(4):414-422.
[10] Larsen L,Röpke C.Suppressors of cytokine signalling:SOCS[J].APMIS:Acta Pathologica,Microbiologica,Et Immunologica Scandinavica,2010,110(12):833-844.
[11] Jin H J,Shao J Z,Xiang L X,et al.Global identification and comparative analysis of SOCS genes in fish:insights into the molecular evolution of SOCS family[J].Molecular Immunology,2008,45(5):1258-1268.
[12] Banks A S,Li J Z,Mckeag L,et al.Deletion of SOCS7 leads to enhanced insulin action and enlarged islets of Langerhans[J].Journal of Clinical Investigation,2005,115(9):2462-2471.
[13] 冷俊楠,赵素梅,高士争.Leptin介导的SOCS3信号通路研究进展[J].云南农业大学学报,2011,26(3):405-411.
[14] Lejeune D,Demoulin J B,Renauld J C.Interleukin 9 induces expression of three cytokine signal inhibitors:cytokine-inducible SH2-containing protein,suppressor of cytokine signalling(SOCS)-2 and SOCS-3,but only SOCS-3 overexpression suppresses interleukin 9 signalling[J].Biochemical Journal,2001,353(1):109-116.
[15] 刘春来,刘红雨,陈军.SOCS家族分子在肿瘤发生发展中的作用[J].中国肺癌杂志,2016,19(9):620-625.
[16] 李景,肖光雄.三阴性乳腺癌中SOCS3及IL-6的表达[J].现代肿瘤医学,2016,24(6):917-920.
[17] Jin H J,Xiang L X,Shao J Z.Identification and characterization of suppressor of cytokine signaling 1 (SOCS-1) homologues in teleost fish[J].Immunogenetics,2007,59(8):673-686.
[18] Jager L D,Dabelic R,Waiboci L W,et al.The kinase inhibitory region of SOCS-1 is sufficient to inhibit T-helper 17 and other immune functions in experimental allergic encephalomyelitis[J].Journal of Neuroimmunology,2011,232(1-2):108-118.
[19] Boyle K,Zhang J G,Nicholson S,et al.Deletion of the SOCS box of suppressor of cytokine signaling 3 (SOCS3) in embryonic stem cells reveals SOCS box-dependent regulation of JAK but not STAT phosphorylation[J].Cellular Signalling,2009,21(3):394-404.
[20] Walker D G,Whetzel A M,Lue L F.Expression of suppressor of cytokine signaling genes in human elderly and Alzheimer’s disease brains and human microglia[J].Neuroscience,2015,302:121-137.
[21] Naka T,Narazaki M,Hirata M,et al.Structure and function of a new STAT-induced STAT inhibitor[J].Nature,1997,387(6636):924-929.
[22] Liang J,Wang D M,Renaud G,et al.The stat3/socs3a pathway is a key regulator of hair cell regeneration in zebrafish stat3/socs3a pathway:regulator of hair cell regeneration[J].Journal of Neuroscience,2012,32(31):10662-10673.
[23] Studzinski A L,Almeida D V,Lanes C F C,et al.SOCS1 and SOCS3 are the main negative modulators of the somatotrophic axis in liver of homozygous GH-transgenic zebrafish (Danio rerio)[J].General and Comparative Endocrinology,2009,161(1):67-72.
[24] Elsaeidi F,Bemben M A,Zhao X F,et al.Jak/stat signaling stimulates zebrafish optic nerve regeneration and overcomes the inhibitory actions of Socs3 and Sfpq[J].Journal of Neuroscience,2014,34(7):2632-2644.
[25] Zhang M,Xiao Z Z,Sun L.Suppressor of cytokine signaling 3 inhibits head kidney macrophage activation and cytokine expression in Scophthalmus maximus[J].Developmental & Comparative Immunology,2011,35(2):174-181.
[26] Babon J J,Nicola N A.The biology and mechanism of action of suppressor of cytokine signaling 3[J].Growth Factors,2012,30(4):207-219.
[27] Wang T H,Secombes C J.Rainbow trout suppressor of cytokine signalling (SOCS)-1,2 and 3:molecular identification,expression and modulation.[J].Molecular Immunology,2008,45(5):1449-1457.
[28] Meng J,Yao X G,Zhou L,et al.GW25-e0422 relationship between polymorphism of SOCS-3 and dyslipidemia in China Xinjiang Uygur[J].Journal of the American College of Cardiology,2014,64(16):C28.
[29] 郝连旭.半滑舌鳎CC型趋化因子和SOCS的系统发育和表达模式分析[D].青岛:中国科学院研究生院(海洋研究所),2016.
[30] 肖占刚.鲤免疫相关基因SOCS-3、Prothymosin α和Thymosin β-like的分子克隆及相关特性研究[D].北京:中国科学院大学,2010.
[31] 朱建国,江福能,毕学成,等.细胞因子通路抑制因子3在前列腺癌中的表达及其意义[J].中华实验外科杂志,2012,29(6):1047-1049.
[32] Ru P,Steele R,Hsueh E C,et al.Anti-miR-203 upregulates SOCS3 expression in breast cancer cells and enhances cisplatin chemosensitivity[J].Genes & Cancer,2011,2(7):720-727.