邻苯二甲酸酯(Phthalate acid esters,PAEs)又称酞酸酯,是邻苯二甲酸形成的酯类衍生物,化学性质稳定且具有一定的生殖毒性,可在人和动物体内模拟雌性激素干扰内分泌系统,导致机体发育异常和生殖障碍,属于典型的环境激素类物质,其中,邻苯二甲酸二(2-乙基己基)酯[di(2-ethylhexyl)phthalate,DEHP]等6种PAEs已被美国和欧盟列为优先控制类有机污染物[1-4]。作为塑料制品的增塑剂,PAEs在化工材料、医疗用品、个人护理品、食品包装、儿童玩具等各领域应用广泛[5-6]。据报道,全球每年生产PAEs超过800万t[6],而中国每年PAEs的用量高达220万t[7]。由于PAEs与塑料基质间不形成化学共价键,而是以氢键和范德华力连接,彼此保持各自独立的化学性质,因此,在生产使用过程中会不断解离溶出,并随降雨等环境变化进入水域生态系统的食物链和食物网,进而通过生物富集对高营养级水生生物乃至人类健康构成潜在危害[8-10]。目前,中国多个湖泊、河流、城市水体(含饮用水)中检出的PAEs浓度(>8.00 μg/L)超过了地表水环境质量标准(PRC-NS GB 3838—2002)和饮用水质量标准(PRC-NS GB 5749—2006),已成为中国水环境的重要风险因子,故由PAEs引起的水生态污染及其对水生生物生长发育的潜在影响备受关注[11-16]。现阶段取得的研究成果主要集中在不同水体中PAEs的来源分布及健康风险评价方面,然而PAEs在生物体内可长期存留,并能沿食物链进行传递,因此,研究PAEs在水环境中对生物的长期暴露影响具有重要意义[10,16]。
枝角类是湖泊、河流、水库等水域生态系统中初级消费者——浮游动物的重要组成部分,处于食物链和营养循环的中间环节,其生长状况和种群变动在水域生态学和古湖沼学研究中起着关键指示作用[17]。对一些常见枝角类的生存繁殖能力影响的慢性试验已成为国内外评价环境激素类污染物生态毒性的常规方法,特别是对受试生物多个世代的生殖毒性效应已有一些报道。刘伟杰等[18]在实验室条件下研究了邻苯二甲酸二丁酯(DBP)对多刺裸腹溞Moina macrocopa的急性毒性和连续4个世代的慢性毒性影响。唐思等[19]研究了壬基酚对多刺裸腹溞连续3个世代的毒性效应。Brennan等[20]评估了4种环境雌激素(雌甾二醇、己烯雌酚、双酚A和4-壬基酚)对大型溞Daphnia magna连续两个世代生长与存活的影响。但这些工作关注的是枝角类连续世代毒物暴露的多代效应(multigenerational effects),而有关亲代毒物暴露是否对其子代继续产生毒性效应即跨代效应(transgenerational effects)的报道较少[21]。
本研究中,以水生态环境模式生物大型溞[22]为受试生物,研究了在水环境中常被检出的低分子量(烷基链<6)酞酸酯DEHP[23]对大型溞的急性毒性影响,以及大型溞亲代(P)经DEHP暴露后对其子代F1和F3种群生长干扰的跨代效应,以期揭示DEHP进入水体后对浮游动物枝角类的长期干扰效应,为全面认知PAEs的水生态风险提供基础数据。
1 材料与方法
1.1 材料
试验用大型溞由辽宁省水生生物学重点实验室提供,长期稳定培养于光照培养箱(Thermo 3744)中,温度为(23±1)℃,光照强度为100 μmol/(m2·s),光周期为12L∶12D。使用脱氯自来水作为培养液,总硬度为(1.95±0.39) mmol/L,碱度为(1.32±0.04) mmol/L,pH为7.8±0.2,溶解氧为(7.96±0.50) mg/L。定期投喂鲜活饵料栅藻Scenedesmus sp.,密度为3×105~4×105 ind./mL。试验开始前取雌溞1只,待孤雌生殖第一胎后,将母溞吸出,继续培养幼溞,如此反复,进而获得试验所需的同步性良好的幼溞(溞龄<24 h,体长为0.86 mm±0.08 mm)。
DEHP(分析纯,纯度大于99%)购自天津市科密欧化学试剂有限公司。以丙酮作为助溶剂,配制浓度为10 mg/L的DEHP母液,助溶剂浓度为0.1 mL/L,逐级稀释至试验所需浓度,现用现配。
1.2 方法
1.2.1 急性毒性试验 参照美国国家环境保护署(US EPA)的OECD标准方法进行急性毒性暴露试验[24],根据预试验结果确定大型溞急性毒性试验的浓度范围。DEHP浓度设置6组,即0.4、0.6、0.8、1.0、1.2、1.4 mg/L,同时设置1个空白对照组(CK)和1个丙酮溶剂对照组(CK-S)。对照组和处理组均设5个重复,试验在100 mL烧杯中进行,每个烧杯放入10只新生幼溞,培养于80 mL试验液中,期间不投喂、不更换培养液。静止暴露24、48 h后,分别计数每个烧杯中溞的死亡情况。以沉底停止游泳活动作为溞的死亡标准。用概率单位法计算24 h、48 h的LC50及其安全浓度。
1.2.2 慢性毒性试验 参照OECD 21 d慢性毒性试验方法[25],根据急性试验结果确定大型溞慢性毒性试验的浓度范围。DEHP浓度设置5组,即0.03、0.04、0.05、0.06、0.07 mg/L,同时,设置1个空白对照组(CK)和1个丙酮溶剂对照组(CK-S),每个浓度设置15个重复。试验在20 mL试管中进行,每个试管放入1只新生幼溞和20 mL培养液,试验用溞和培养条件同“1.2.1”节。试验期间饵料密度为3×105~4×105 ind./mL,每天更换1次培养液,并记录溞的存活数、产幼数、蜕皮数和母溞死亡数,挑出新生幼溞,试验至21 d结束。亲代(P)暴露于DEHP培养液中,而F1代和F3代放入无DEHP的正常培养液中继续培养,其他试验条件均相同。
1.2.3 指标的计算 安全浓度(SC)[26]和内禀增长率(rm)[27]计算公式分别为
其中: x为日龄;lx为x龄时的存活率;mx为x龄时的出生率。
1.3 数据处理
试验数据以平均值±标准差表示,采用SPSS 13.0统计软件进行单因素方差分析和多重比较,显著性水平为0.05,极显著性水平为0.01。
2 结果与分析
2.1 DEHP对大型溞的急性毒性
DEHP对大型溞死亡率的影响如表1所示,丙酮溶剂对照组(CK-S)与空白对照组(CK)中大型溞的死亡率无显著性差异(P>0.05),表明试验中0.1 mL/L的丙酮助溶剂对大型溞影响不明显。通过DEHP浓度对数(x)与死亡概率单位(y)建立线性回归方程(表2),结果表明,DEHP对大型溞24 h LC50和48 h LC50分别为0.820、0.569 mg/L,安全浓度为0.082 mg/L。
2.2 DEHP对大型溞的慢性毒性
在试验过程中,各组大型溞均存活21 d。DEHP对大型溞生殖参数的影响见图1。方差分析表明,DEHP对大型溞P代的生殖次数、平均生殖量、第一胎生殖量和产幼间隔有极显著性影响(P<0.01),对总蜕皮次数有显著性影响(P<0.05),而对总生殖量无显著性影响(P>0.05)。除生殖次数降低外,其余各参数均随DEHP浓度的增加呈升高或先升后降的趋势。DEHP浓度为0.04 mg/L时,生殖次数最低,仅为6.07次;DEHP浓度为0.06 mg/L时,平均生殖量为68.46个,第一胎生殖量为45.23个,产幼间隔为2.47 d,总蜕皮次数为15.54次,均显著高于对照组(P<0.05)。
表1 DEHP对大型溞死亡率的影响
Tab.1 Effects of DEHP on mortality of water fleas Daphnia magna %
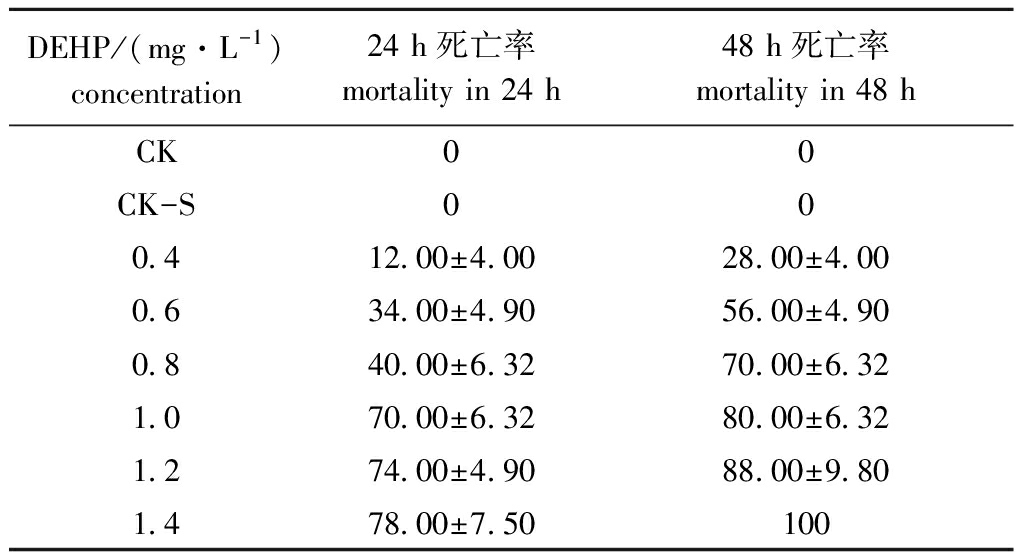
DEHP/(mg·L-1)concentration24 h死亡率mortality in 24 h48 h死亡率mortality in 48 hCK00CK-S000.412.00±4.0028.00±4.000.634.00±4.9056.00±4.900.840.00±6.3270.00±6.321.070.00±6.3280.00±6.321.274.00±4.9088.00±9.801.478.00±7.50100
DEHP对大型溞F1代各生殖参数均无显著性影响(P>0.05),而对大型溞F3代总蜕皮次数、总生殖量、平均生殖量和产幼间隔有显著性影响(P<0.05)。DEHP浓度为0.06 mg/L时,大型溞F3代总生殖量为357.71个,平均生殖量为59.62个,均显著低于对照组(P<0.05)。
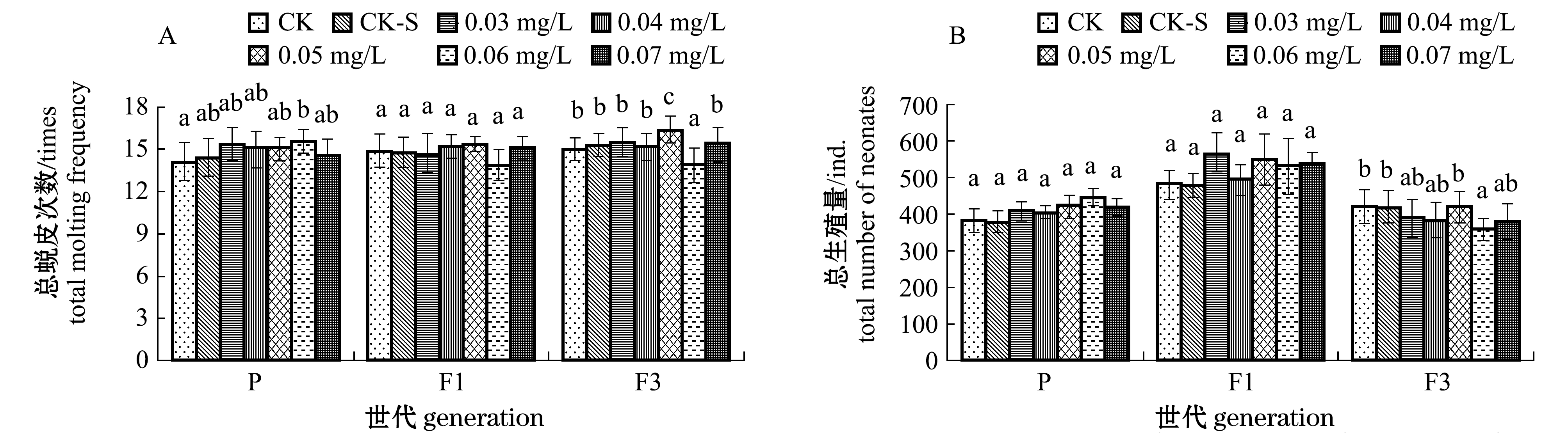
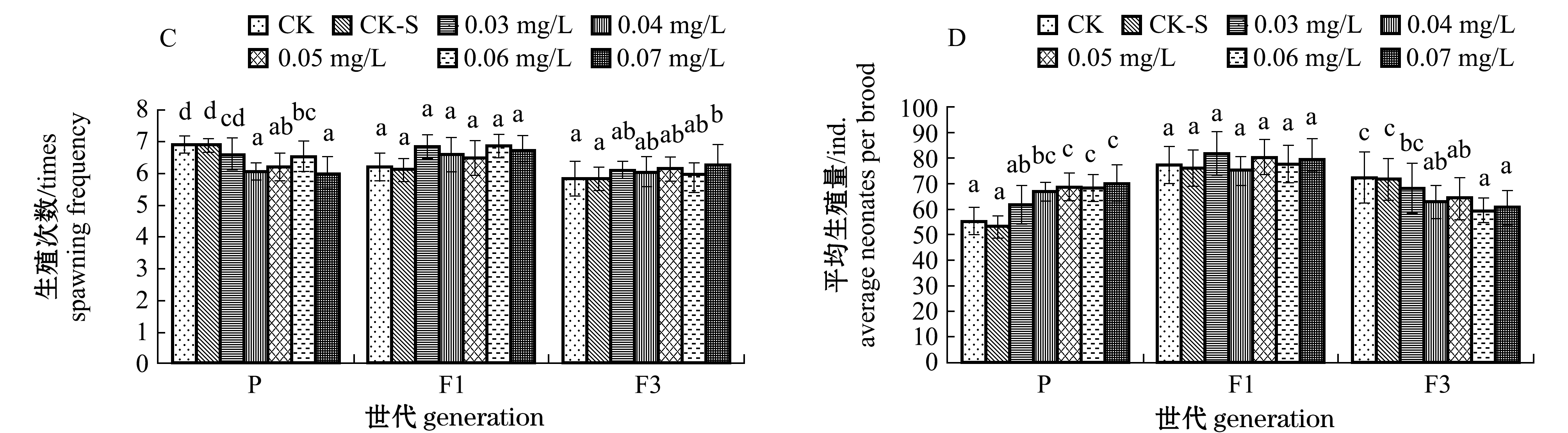
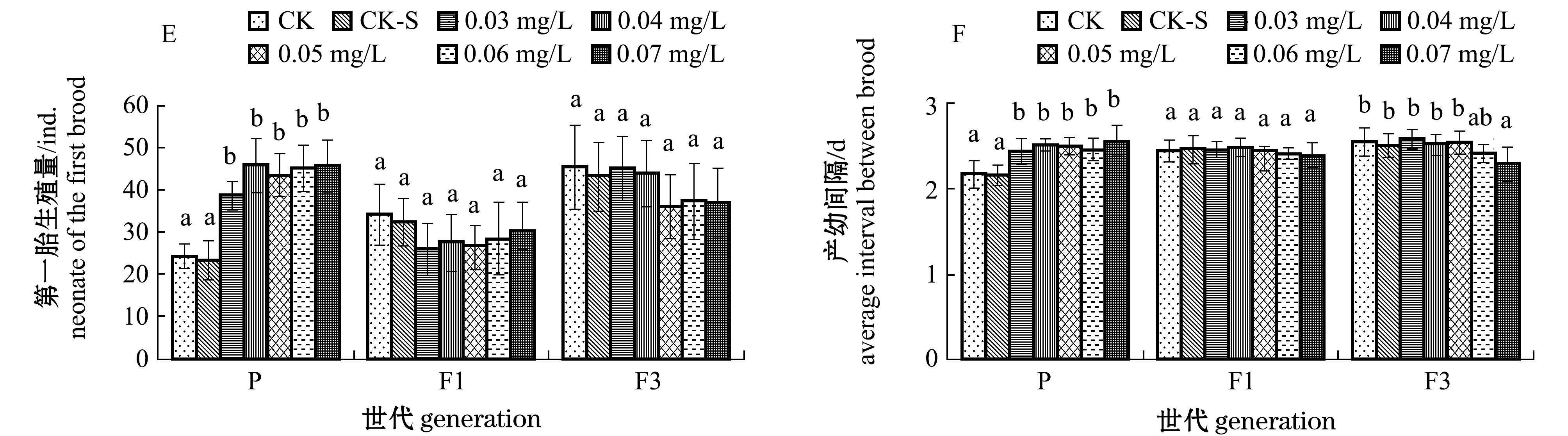
注:标有不同字母者表示同一世代不同浓度组间有显著性差异(P<0.05),标有相同字母者表示同一世代不同浓度组间无显著性差异(P>0.05),下同
Note: The means with different letters in the same generation are significant differences at various concentrations at the 0.05 probability level, and the means with the same letters in the same generation are not significant differences, et sequentia
图1 DEHP对大型溞生殖参数的影响
Fig.1 Effects of DEHP on fecundity parameters of water fleas Daphnia magna
表2 DEHP对大型溞的急性毒性试验结果
Tab.2 Acute toxicity of DEHP to water fleas Daphnia magna

时间/htime回归方程regression equation相关系数R2correlation coefficientLC50/(mg·L-1)95%置信区间confidence interval安全浓度/(mg·L-1)safe concentration24 y=3.681x+5.3180.9640.8200.641~1.04748 y=3.590x+5.8800.9960.5690.429~0.7530.082
DEHP对大型溞种群内禀增长率的影响如表3所示。从表3可见:DEHP对大型溞P代的内禀增长率有显著性影响(P<0.05),并随DEHP浓度的增加呈现先升后降的趋势,当DEHP浓度为0.06 mg/L时rm最高,达0.73/d;DEHP对大型溞F1代的内禀增长率无显著性影响(P>0.05),而对F3代有显著性影响(P<0.05),DEHP浓度为0.07 mg/L时,F3代的rm显著低于对照组(P<0.05)。
表3 DEHP对大型溞种群内禀增长率的影响
Tab.3 Effects of DEHP on the rm in water fleas Daphnia magna
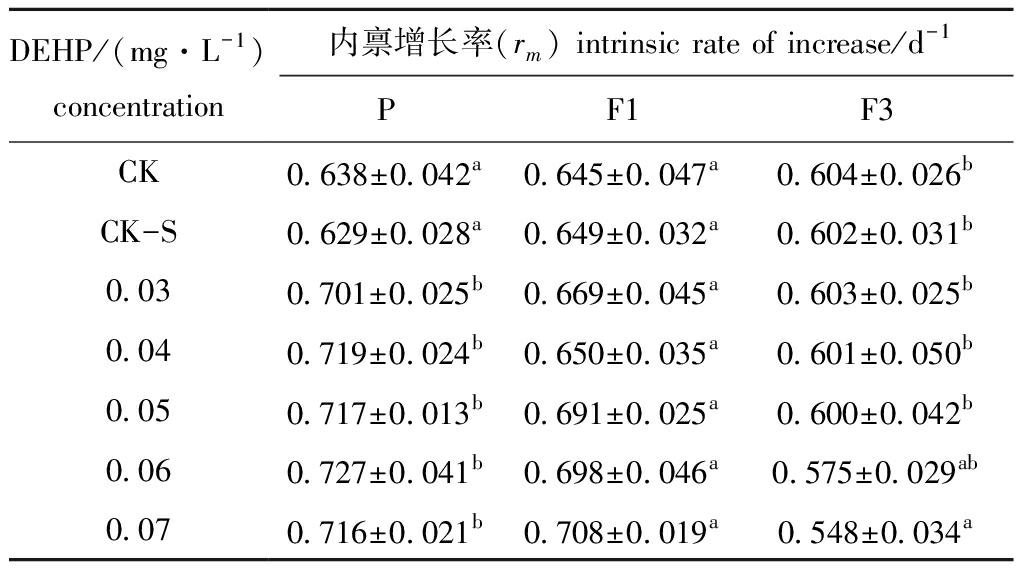
DEHP/(mg·L-1)concentration内禀增长率(rm) intrinsic rate of increase/d-1PF1F3CK0.638±0.042a0.645±0.047a0.604±0.026bCK-S0.629±0.028a0.649±0.032a0.602±0.031b0.030.701±0.025b0.669±0.045a0.603±0.025b0.040.719±0.024b0.650±0.035a0.601±0.050b0.050.717±0.013b0.691±0.025a0.600±0.042b0.060.727±0.041b0.698±0.046a0.575±0.029ab0.070.716±0.021b0.708±0.019a0.548±0.034a
注:同列中标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05)
Note:The means with different letters within the same column are significantly different in the groups(P<0.05), and the means with the same letters within the same column are not significant differences(P>0.05)
由此可见,浓度为0.03~0.07 mg/L的DEHP对大型溞的生殖和种群增长具有一定影响。其中,0.06~0.07 mg/L DEHP对大型溞P代的总生殖量、平均生殖量、第一胎生殖量、产幼间隔和种群增长有明显的促进作用,对大型溞F1代影响不明显,而对F3代的总生殖量、平均生殖量和种群增长具有一定抑制作用。
3 讨论
3.1 DEHP对大型溞的急性毒性影响
目前,DEHP已成为环境中普遍存在的持久性有机污染物之一,对水生生物的生长发育、生殖系统、内分泌系统等均有不同影响,并表现出不同程度的毒性效应。Cruciani等[28]发现,在持续暴露于2 mg/L的DEHP中达96 h后,浮游动物轮虫Brachionus calyciflorus的有性生殖与无性生殖均未受到显著影响;而Mankidy等[29]则发现,持续暴露在1 mg/L DEHP中达96 h后,黑头呆鱼Pimephales promelis的胚胎死亡率(30%)显著高于对照组(3%)。造成这种毒性差异的主要原因可能与试验使用的助溶剂、环境条件(如温度),以及受试生物的生殖系统和内分泌系统对DEHP的敏感性不同有关[10]。任何化学物质对生物的危害均存在着一个从量变到质变的过程,化学物质只有达到一定的浓度(或剂量)时才显示出它对生物的毒性。依据LC50和LD50的大小,可以将化学物质的急性毒性分为剧毒、高毒、中等毒、低毒和微毒5级[26]。据刘青等[30]报道,对溞类而言,当48 h LC50<0.1 mg/L时属于剧毒物质,以此类推,当48 h LC50为0.1~10 mg/L时应属于高毒物质。本试验中DEHP对大型溞48 h LC50为0.57 mg/L,按上述毒物分级标准,DEHP对大型溞应属高毒物质。黄国兰等[31]报道邻苯二甲酸酯类DBP对大型溞24 h LC50为10.35 mg/L,远高于本试验中DEHP对大型溞的24 h LC50(0.820 mg/L),可见DEHP对大型溞的急性毒性高于DBP。类似的结论在DEHP和DBP对黑头呆鱼的生物毒性影响研究中有过报道[29],然而对不同营养级水生生物是否具有普遍性有待进一步试验证实。目前,已经确定DEHP是一种过氧化物酶体增殖剂,很有可能通过激活生物体内过氧化物酶体增生物激活受体(PPARs),引起编码过氧化物酶体内各种酶基因的选择性转录,造成氧化酶与过氧化氢酶活性失衡,导致细胞内ROS水平升高而产生毒性效应[32]。
3.2 DEHP对大型溞生殖和种群增长的跨代效应
环境污染物对大型溞(亲代与子代)连续暴露的多代效应主要是研究该毒性物质在大型溞体内富集期间所诱发的多世代毒性效应[33-35],而跨代效应关注的通常是从亲代到子代毒性传递的敏感性、基于长期驯化适应的毒性物质耐受性,以及生长与繁殖恢复能力[21]。本研究聚焦于DEHP对大型溞的跨代效应,通过考察亲代DEHP直接暴露后的子代可能受到的种群生长及生殖的毒性影响,评价了无DEHP暴露条件下的子代健康状况。在试验设计上,笔者根据世代距离(或间隔)选择与亲代(P)世代距离最近的F1代和世代距离相对较远的F3代。研究表明,浓度为0.03~0.07 mg/L的DEHP对大型溞多个世代的生长及繁殖产生了不同影响,0.06~0.07 mg/L DEHP对大型溞P代的总生殖量、平均生殖量、第一胎生殖量、产幼间隔和种群增长有明显的促进作用;对大型溞F1代影响不明显,而对F3代的总生殖量、平均生殖量和种群增长具有一定抑制作用。总之,大型溞亲代长期暴露于DEHP下对F3代的不利影响更为明显,这表明子代对亲代暴露于DEHP诱导产生的毒物敏感性在距离较远的世代会有所增强,且大型溞的平均生殖量和内禀增长率较其他参数更为敏感。
此外,研究表明,环境污染物导致的跨代效应能通过表观遗传变异产生,即便去除诱发因子,这种效应仍能传递至后续世代[36-37]。目前,已在多种模式生物如斑马鱼[37]、线虫Caenorhabditis elegans[38]和枝角类大型溞[36]中成功地开展了污染物跨代效应的评价工作。其中,应用大型溞评价的有机污染物包括染料木黄酮[36]、醋氨酚和苯扎氯铵[21]等,这些污染物对大型溞子代的生长、繁殖和遗传特性均产生了不同程度地影响。本研究表明,环境激素类污染物DEHP对大型溞诱导的生殖毒性效应可以传递至F3代,与上述研究报道相符,本相关结果可为环境因子诱发的大型溞跨代效应提供了新的数据支持。
[1] Autian J.Toxicity and health threats of phthalate esters:review of the literature[J].Environmental Health Perspectives,1973,4:3-26.
[2] Lovekamp-Swan T,Davis B J.Mechanisms of phthalate ester toxicity in the female reproductive system[J].Environmental Health Perspectives,2003,111(2):139-145.
[3] Staples C A,Peterson D R,Parkerton T F,et al.The environmental fate of phthalate esters:a literature review[J].Chemosphere,1997,35(4):667-749.
[4] 刘庆,杨红军,史衍玺,等.环境中邻苯二甲酸酯类(PAEs)污染物研究进展[J].中国生态农业学报,2012,20(8):968-975.
[5] Graham P R.Phthalate ester plasticizers-why and how they are used[J].Environmental Health Perspectives,1973,3:3-12.
[6] Net S,Sempeéreé R,Delmont A,et al.Occurrence,fate,behavior and ecotoxicological state of phthalates in different environmental matrices[J].Environmental Science &Technology,2015,49(7):4019-4035.
[7] Wang Jun,Chen Gangcai,Christie P,et al.Occurrence and risk assessment of phthalate esters (PAEs) in vegetables and soils of suburban plastic film greenhouses[J].Science of the Total Environment,2015,523:129-137.
[8] Giam C S,Chan H S,Neff G S,et al.Phthalate ester plasticizers:a new class of marine pollutant[J].Science,1978,199(4327):419-421.
[9] Keresztes S,Tatár E,Czégény Z,et al.Study on the leaching of phthalates from polyethylene terephthalate bottles into mineral water[J].Science of the Total Environment,2013,458-460:451-458.
[10] 孙翠竹,李富云,涂海峰,等.邻苯二甲酸酯类对水生食物链的影响研究进展[J].生态毒理学报,2016,11(6):12-24.
[11] Li Rongli,Liang J,Gong Zhenbin,et al.Occurrence,spatial distribution,historical trend and ecological risk of phthalate esters in the Jiulong River,Southeast China[J].Science of the Total Environment,2017,580:388-397.
[12] Li Bin,Liu Ruixia,Gao Hongjie,et al.Spatial distribution and ecological risk assessment of phthalic acid esters and phenols in surface sediment from urban rivers in Northeast China[J].Environmental Pollution,2016,219:409-415.
[13] Li Xiaohui,Yin Pinghe,Zhao Ling.Phthalate esters in water and surface sediments of the Pearl River Estuary:distribution,ecological,and human health risks[J].Environmental Science and Pollution Research,2016,23(19):19341-19349.
[14] Liu Xiaowei,Shi Jianghong,Bo Ting,et al.Occurrence and risk assessment of selected phthalates in drinking water from waterworks in China[J].Environmental Science and Pollution Research,2015,22(14):10690-10698.
[15] Zhang Lulu,Liu Jingling,Liu Huayong,et al.The occurrence and ecological risk assessment of phthalate esters (PAEs) in urban aquatic environments of China[J].Ecotoxicology,2015,24(5):967-984.
[16] 张璐璐,刘静玲,何建宗,等.中国典型城市水环境中邻苯二甲酸酯类污染水平与生态风险评价[J].生态毒理学报,2016,11(2):421-435.
[17] 卢慧斌,陈光杰,蔡燕凤,等.近百年来枝角类群落响应洱海营养水平、外来鱼类引入以及水生植被变化的特征[J].湖泊科学,2016,28(1):132-140.
[18] 刘伟杰,段舜山.邻苯二甲酸二丁酯对多刺裸腹溞生长繁殖的影响[J].生态科学,2011,30(3):229-235.
[19] 唐思,刘伟杰,段舜山.壬基酚对多刺裸腹溞连续世代的毒性效应[J].生态毒理学报,2016,11(2):275-282.
[20] Brennan S J,Brougham C A,Roche J J,et al.Multi-generational effects of four selected environmental oestrogens on Daphnia magna[J].Chemosphere,2006,64(1):49-55.
[21] Castro B B,Freches A R,Rodrigues M,et al.Transgenerational effects of toxicants:an extension of the Daphnia 21-day chronic assay?[J].Archives of Environmental Contamination and Toxicology,2018,74(4):616-626.
[22] Smirnov N N.Physiology of the Cladocera[M].London:Academic Press,2014.
[23] Staples C A,Adams W J,Parkerton T F,et al.Aquatic toxicity of eighteen phthalate esters[J].Environmental Toxicology and Chemistry,1997,16(5):875-891.
[24] OECD.Guidelines for the testing of chemicals,Daphnia sp.,acute immobilisation test(No.202)[R].2004.https://www.oecd-ilibrary.org/docserver/9789264069947-en.pdf?expires=154658 1216&id=id&accname=guest&checksum=EEF565A1847DE3 F20D90602E9F2E5CCE
[25] OECD.Guidelines for the testing of chemicals,Daphnia magna reproduction test(No.211)[R],2012.http://www.oecd.org/chemicalsafety/risk-assessment/1948277.pdf
[26] 周永欣,章宗涉.水生生物毒性试验方法[M].北京:农业出版社,1989.
[27] Krebs C J.Ecology:the Experimental Analysis of Distribution and Abundance[M].4th ed.New York:Harper Collins College Publishers,1994.
[28] Cruciani V,Iovine C,Thomé J P,et al.Impact of three phthalate esters on the sexual reproduction of the monogonont rotifer, Brachionus calyciflorus[J].Ecotoxicology,2016,25(1):192-200.
[29] Mankidy R,Wiseman S,Ma Hong,et al.Biological impact of phthalates[J].Toxicology Letters,2013,217(1):50-58.
[30] 刘青,李扬,何芳,等.印楝素对大型溞生存、生长和繁殖的毒性效应[J].大连海洋大学学报,2013,28(2):121-126.
[31] 黄国兰,孙红文,高娟,等.邻苯二甲酸二丁酯对大型蚤(Daphnia magna)的毒性作用研究[J].环境化学,1998,17(5):428-433.
[32] Uren-Webster T M,Lewis C,Filby A L,et al.Mechanisms of toxicity of di(2-ethylhexyl) phthalate on the reproductive health of male zebrafish[J].Aquatic Toxicology,2010,99(3):360-369.
[33] Liu Yong,Qi Suzhen,Zhang Wen,et al.Acute and chronic toxicity of buprofezinon Daphnia magna and the recovery evaluation[J].Bulletin of Environmental Contamination and Toxicology,2012,89(5):966-969.
[34] Barata C,Campos B,Rivetti C,et al.Validation of a two-generational reproduction test in Daphnia magna:an interlaboratory exercise[J].Science of the Total Environment,2017,579:1073-1083.
[35] Massarin S,Alonzo F,Garcia-Sanchez L,et al.Effects of chronic uranium exposure on life history and physiology of Daphnia magna over three successive generations[J].Aquatic Toxicology,2010,99(3):309-319.
[36] Vandegehuchte M B,Lemière F,Vanhaecke L,et al.Direct and transgenerational impact on Daphnia magna of chemicals with a known effect on DNA methylation[J].Comparative Biochemistry and Physiology Part C:Toxicology & Pharmacology,2010,151(3):278-285.
[37] Baker T R,Peterson R E,Heideman W.Using zebrafish as a model system for studying the transgenerational effects of dioxin[J].Toxicological Sciences,2014,138(2):403-411.
[38] Yu Zhenyang,Chen Xiaoxue,Zhang Jing,et al.Transgenerational effects of heavy metals on L3 larva of Caenorhabditis elegans with greater behavior and growth inhibitions in the progeny[J].Ecotoxicology and Environmental Safety,2013,88:178-184.