年龄鉴定是渔业生物学研究的重要内容,通过鉴定水生生物的年龄,有助于掌握其生活史和估算其种群数量,为渔业资源管理提供基础信息[1]。对于大部分野生水生生物而言,一般可通过硬组织中的生长纹直接获得其年龄信息,如鱼类的耳石[2]、鳍条[3-4]和脊椎骨[3]等,头足类的耳石[5-6]、角质颚[7]和内壳[1, 8]等。但甲壳类动物是通过脱壳过程得以生长,其记录年龄信息的钙化结构周期性的消失,给直接鉴定其年龄带来一定困难。早期研究中,大部分学者使用饲养[9]、标记重捕[10-11]、体长频度[12-13]、脂褐素[14-15]和放射性同位素[16-17]分析等方法来鉴定甲壳类年龄,但这些方法均存在一些不足之处,饲养、标记重捕和放射性同位素分析法得出结果虽较为准确,但野生样本与养殖样本有所差异,故饲养法不适于实际野生环境,同时放射性同位素分析法成本花费较高,而脂褐素分析法得到的年龄结果需要使用生长环境进行校正,步骤较为烦琐。Kilada等[18]首次发现,眼柄能够作为甲壳类年龄鉴定的钙化组织,并认为眼柄中钙化组织信息与年龄存在一定关系,这才使得甲壳类年龄直接鉴定的难题得以解决。本研究中,综述了国内外学者对虾蟹类眼柄提取和制片的方法和步骤,以及眼柄在虾蟹类年龄鉴定中的应用,旨在为渔业生物学研究和渔业资源管理提供参考。
1 眼柄形态结构
虾蟹类头胸甲前缘正中有一对向前突出的复眼,复眼基部有一对可活动的柄,称为眼柄。眼柄内部包含视网膜神经和肌肉组织等,连接着复眼和头胸甲内其他器官。眼柄分为基部和远端(图1),基部中包含虾蟹类神经内分泌器官,远端连接着复眼,复眼中含视网膜细胞和色素细胞等[19]。
2 眼柄预处理与制片
2.1 眼柄的提取与保存
虾蟹类眼柄提取时,国内外多数学者使用解剖刀将眼柄与身体连接部分薄膜切断,再将整只眼柄取下,在切断眼柄与其他组织连接薄膜时应注意不要破坏眼柄,以保证取出眼柄的完整性。眼柄包埋前需要将其内部的有机组织去除,以减少之后在包埋及切片观察过程中对观察结果的影响。清理眼柄中有机物的方法一般分为直接处理[20-23] 、化学处理[24-25]和高温处理[26]3种方法:直接处理是将样本从保存溶液中取出,直接在解剖镜下使用解剖针将眼柄内部有机物剔除;化学处理一般将样本浸入二甲苯或碱性溶液中1 h以上,促使眼柄中有机物变性结块,之后在解剖镜下使用解剖针将内部有机物剔除;高温处理是将眼柄用水煮熟后再在解剖镜下使用解剖针剔除有机物。经过预处理后的眼柄样本可保存于70%以上的酒精或比例为6∶3∶1的酒精、甘油和水混合物中,样本保存时间不应太长,以免影响观察结果。
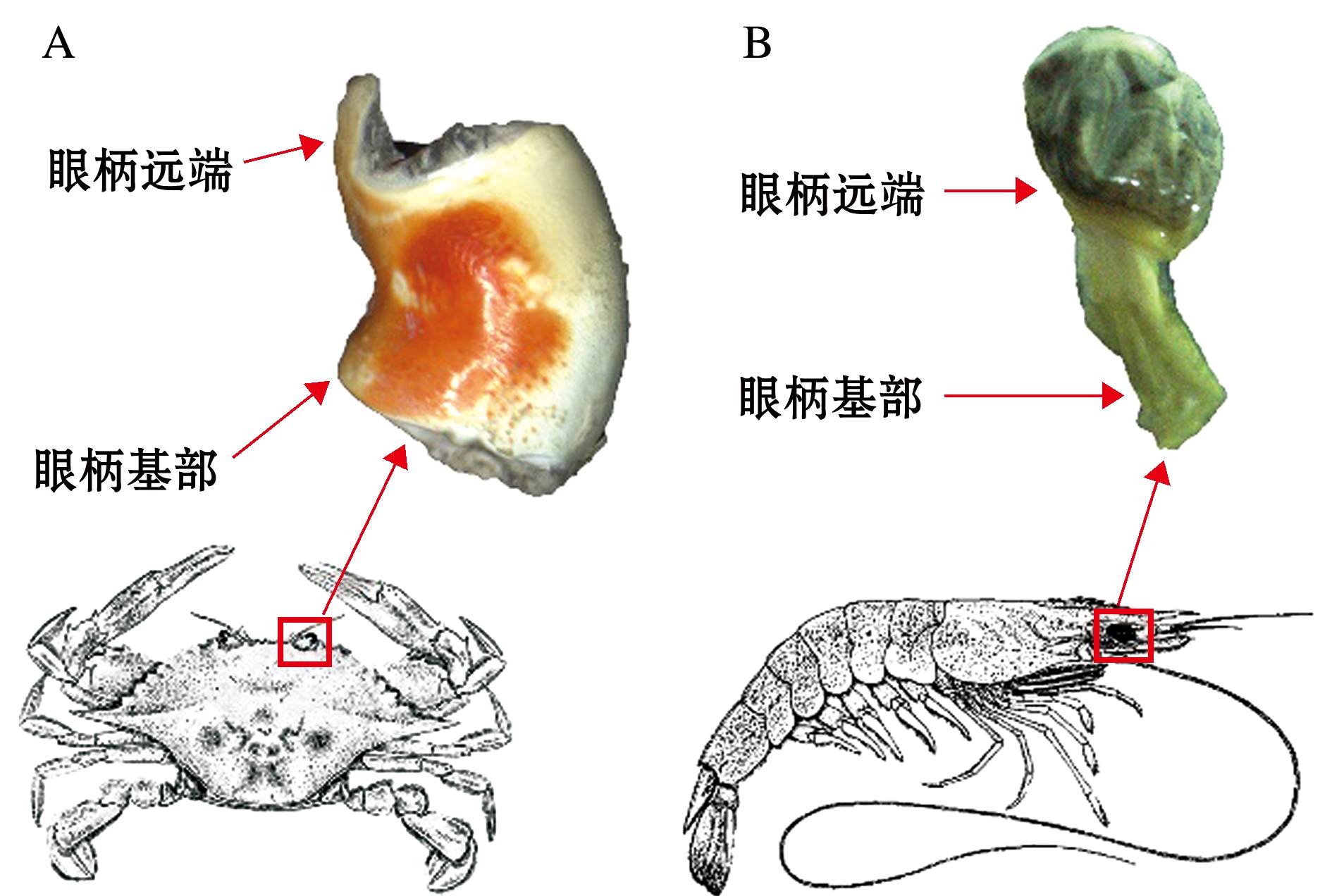
图1 三疣梭子蟹(A)和中国对虾(B)眼柄形态结构
Fig.1 Morphological structure of eyestalks in swimming crab Portunus trituberculatus (A) and Chinese shrimp Fenneropenaeus chinensis (B)
蒋瑞等[27]对比采用3种处理方法处理后的三疣梭子蟹 Portunus trituberculatus 眼柄样本后发现(图2):直接处理对眼柄钙化层结构影响最小,但眼柄中有机物与钙化结构有所黏结,在处理时直接使用解剖针剔除较为麻烦、耗时,且在显微镜下观察眼柄切片时发现在眼柄周围有黑色未处理干净的杂质(图2-A);高温处理后的眼柄虽能较快剔除眼柄中有机物和其他杂质,但高温处理后会导致眼柄钙化层较黑,微结构不清晰,不利于生长纹的观察(图2-B);相比较而言,对眼柄样本进行预处理时,使用化学处理是更为妥当的方法(图2-C)。

图2 直接处理(A)、高温处理(B)和化学处理(C)的三疣梭子蟹眼柄样本微结构观察对比[27]
Fig.2 Microstructure of eyestalks in swimming crab Portunus trituberculatus with direct treatment(A), boiled treatment (B) and chemical treatment (C)[27]
2.2 眼柄的制片
因为眼柄不能通过观察表面结构直接获取其年龄信息,故需要对眼柄做进一步切割和研磨处理。虾蟹类眼柄通常较小且为中空的圆柱体,需先进行包埋后再在机器上进行切割和打磨。归纳起来,眼柄的制片过程可为两类(表1):一是使用冷埋树脂包埋制片[18,21-23],该方法是将处理干净的眼柄样品从保存溶液中取出,包埋入冷埋树脂中,硬化后使用低速切割机切片或使用水磨砂纸打磨;二是使用石蜡包埋制片[21,24,28],该方法是将处理干净的眼柄样品从保存溶液中取出,在甲酸和柠檬酸钠混合溶液中脱钙后,包埋入熔融的石蜡中,待其冷却后使用石蜡切片机制片。两种方法相比,石蜡切片厚度(10 μm左右)要比树脂切片(50~200 μm)薄,因此,若试验需要对眼柄样本进行进一步操作时(如染色),通常会采用石蜡包埋制片。
蒋瑞等[29]在国外学者对虾蟹类眼柄使用冷埋树脂制片的基础之上,结合实验室条件对其方法进行改进。步骤如下:(1) 将样本从保存溶液中取出,用吸水纸将眼柄样本上残留的保存液擦拭干净,如将蟹类眼柄样本竖直在塑料模具底部(图3-A),虾类眼柄剪开后平铺在模具底部(图4-A); (2) 按1∶1的体积比将压克力粉和液体固化剂(黏度为60 mPas)配制成冷埋树脂溶液,倒入模具中,将注入冷埋树脂的模具放在阴凉通风处24 h以上,待其硬化;(3) 当模具完全硬化后,依次使用200、600、1200、2500目的水磨砂纸沿眼柄横截面打磨至样本中部,然后用氧化铝粉在水绒布上抛光(图3-C~E,图4-C~E),将抛光的一面使用热熔胶黏于载玻片上(图3-F,图4-F); (4) 模具另外一面依次使用200、600、1200、2500目的水磨砂纸沿眼柄横截面打磨(图3-G~H,图4-G~H);(5)在步骤(4)中,当模具厚度变薄时,打磨时需不断在显微镜下观察,直到轮纹结构在显微镜下清晰可见,最后使用氧化铝粉在水绒布上抛光(图3-I,图4-I)。
蒋瑞等[29]在对虾蟹类眼柄的研究基础上,改进了虾蟹类眼柄的预处理、包埋和制片技术。在虾蟹类眼柄预处理时,先将眼柄浸入二甲苯溶液中48 h,再使用解剖针等更容易剔除眼柄内有机物组织和其他杂质。在制作冷埋树脂包埋时将亚克力粉与固化剂体积比控制在1∶1时效果最好。比例过大会导致冷埋树脂整体泛白,在显微镜下不易观察,比例过小时则会使固化时间延长且在打磨时眼柄容易脱落。在显微镜下观察已处理好的眼柄样品切片时,无须使用盖玻片进行封片,只需在切片表面滴上甘油,有助于在显微镜下观察和计数。
3 眼柄微结构
3.1 眼柄微结构观察
2012年,Kilada等[18]首次在雪蟹Chionoecetes opilio、褐雕虾Sclerocrangon boreas和北部虾Pandalus borealis眼柄中观察到生长纹结构。随后Clore[24]和Krafft等[30]分别对淡水小龙虾和南极磷虾的眼柄切片进行了直接观察(表1)。国内蒋瑞等[27]对中华绒螯蟹、三疣梭子蟹和中国对虾的眼柄生长纹进行了观察(图5),经过制片后的样本在光学显微镜下可以观察到同样的生长纹。为了增加眼柄切片的清晰度,往往会对制备好的切面进行染色,例如Kilada等[31]使用马松三色染色法对点虾Pandalus platyceros的眼柄进行观察(表1)。马松三色染色法是在生物学上常用的一种染色方法,该方法根据各组织不同的渗透性能,选择分子大小不同的阴离子染料进行染色,便可把不同组织成分显示出来,经过染色后的眼柄样本要更容易观察。
3.2 眼柄微结构特征
2016年,Kilada等[31]在对点虾眼柄组织切片经马松三色染色后进行观察时发现,点虾眼柄中包含表层(Epicuticle)、色素层(Exocuticle)、钙化层(Endocuticle)和膜层(Membranous layer)4层结构。染色后点虾眼柄结构是双边结构,即点虾眼柄中表层和膜层其组成成分类似,色素层和钙化层的组成成分类似,这种循环结构表明在眼柄中的轮纹结构可能与其生活周期相关(图6)。
表1 眼柄的制片及观察方法
Tab.1 Slide preparation and observation methods of eyestalks
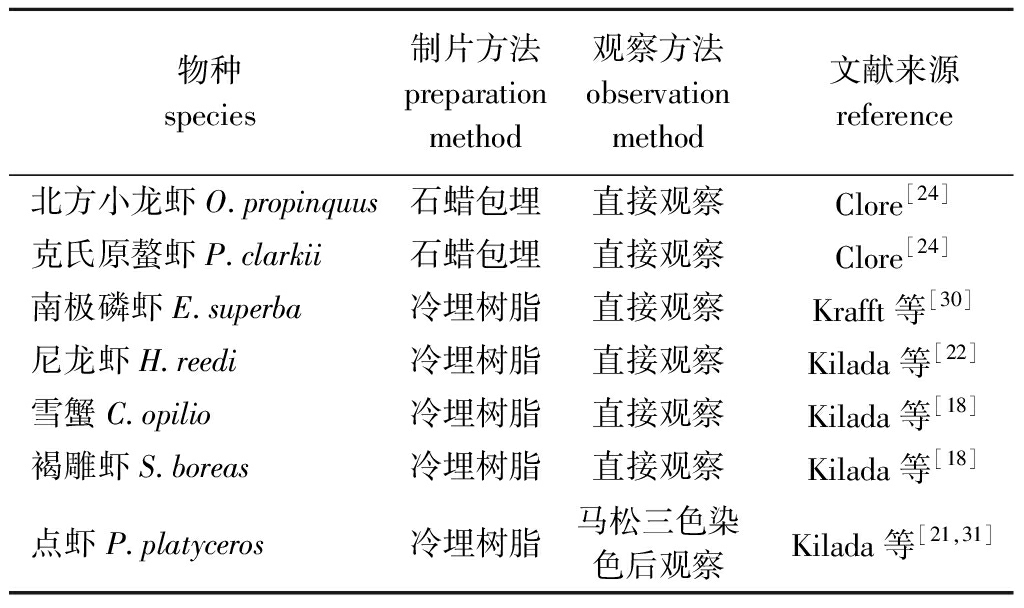
物种species制片方法preparation method观察方法observation method文献来源reference北方小龙虾O.propinquus石蜡包埋直接观察Clore[24]克氏原螯虾P.clarkii石蜡包埋直接观察Clore[24]南极磷虾E.superba冷埋树脂直接观察Krafft等[30]尼龙虾H.reedi冷埋树脂直接观察Kilada等[22]雪蟹C.opilio冷埋树脂直接观察Kilada等[18]褐雕虾S.boreas冷埋树脂直接观察Kilada等[18]点虾P.platyceros冷埋树脂马松三色染色后观察Kilada等[21,31]
2018年,蒋瑞等[27]在光学显微镜下对三疣梭子蟹和中国对虾眼柄切片直接观察发现,眼柄由表层、色素层、钙化层和膜层4层结构构成(图7)。其中表层处于眼柄的最外层,在眼柄中的4层结构占比最小,质地较为均匀;色素层在钙化层和表层之间,是几丁质层,当样本厚度较厚时,色素层透光性较差。样本切片较薄时,色素层透光性变强,层内有圆柱形结构;钙化层在眼柄结构中占比最大,在使用马松三色染色法时,钙化层颜色最深,这表明该层钙化程度高。钙化层中色素较少,透光性高,在光学显微镜下观察,有明显的周期性生长纹,平行于眼柄表层排列,同时存在垂直于眼柄表层的细纹。有学者认为,在虾蟹类眼柄的钙化层中,周期性的轮纹结构可能与虾蟹类的生长、年龄和脱壳次数有关[23-24,31]。膜层在眼柄最内部,是与视网膜神经和眼柄内其他有机物组织相连的部分。膜层在眼柄的4层结构中透明度最高,在光学显微镜下未观察到明显的轮纹结构。
4 眼柄在虾蟹类年龄和生长中的研究与应用
近年来,国内外学者发现,虾蟹类的眼柄通过清理、包埋和切片后能够在其钙化层中观察到明暗交替的生长纹。生长纹可分为宽带和细纹两种。最早Kilada等[18]首次探讨了美国龙虾、褐雕虾和雪蟹眼柄生长纹宽带数目与实际年龄的关系,结果发现,美国龙虾眼柄宽带与实际年龄相符,而褐雕虾和雪蟹的眼柄宽带与实际年龄不符。因此,对于眼柄中生长纹宽带与年龄或日龄的关系,Kilada等认为还需进一步地验证。为了验证用眼柄中生长纹数目研究虾蟹类年龄和生长的可行性,Kilada等[22,31]对4种北大西洋虾蟹类和3种阿拉斯加重要商业虾蟹类进行了探索试验,试验表明,眼柄中生长纹数目可以作为鉴定虾蟹类年龄信息的材料。
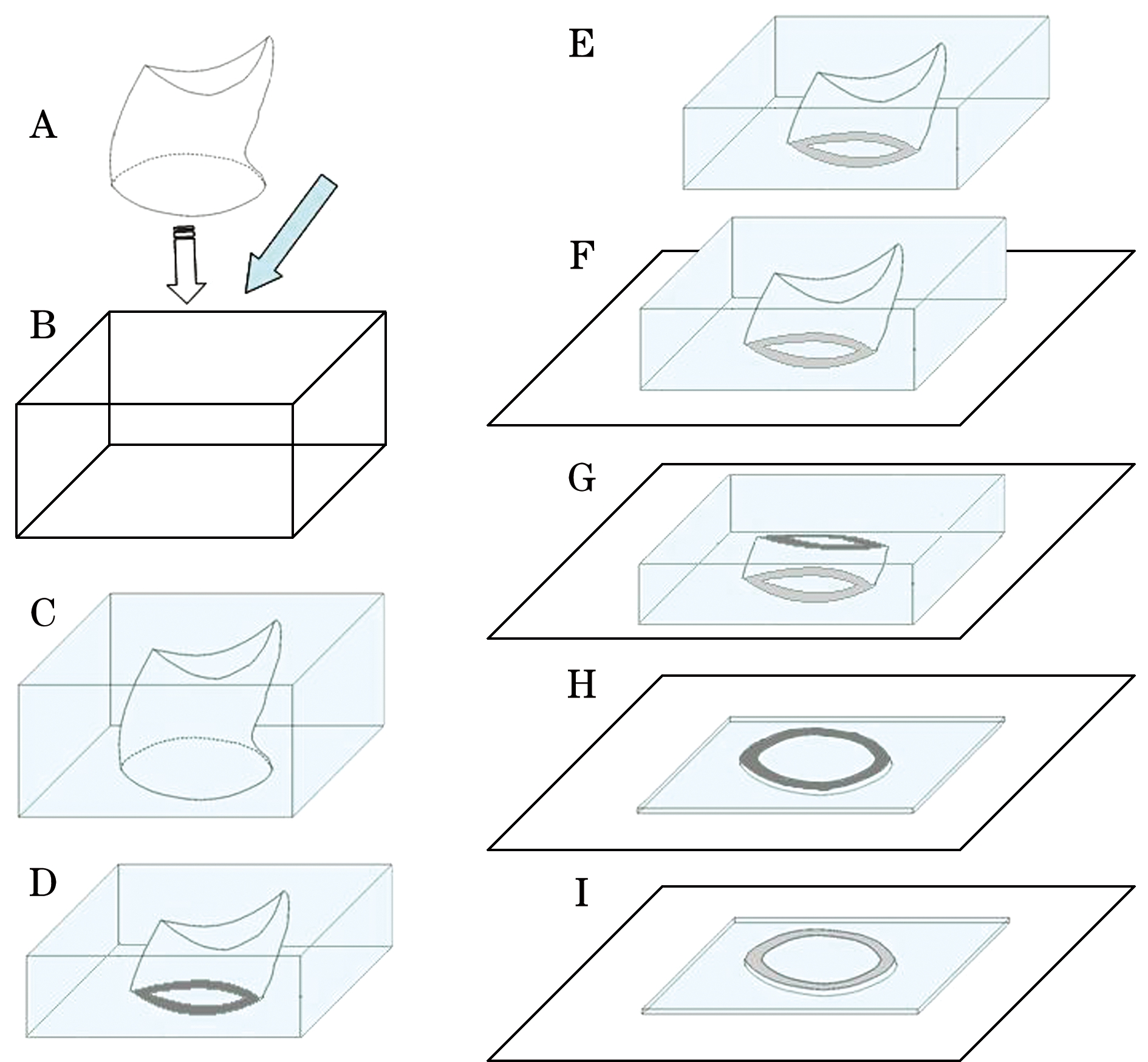
图3 蟹类眼柄切片制作示意图[29]
Fig.3 Schematic diagram of crab eyestalk section prepatation[29]

图4 虾类眼柄切片制作示意图[29]
Fig.4 Schematic diagram of shrimp eyestalk section prepatation[29]

图5 中国对虾(A)、中华绒螯蟹(B)和三疣梭子蟹(C)眼柄生长纹[27]
Fig.5 Growth bands in Chinese shrimp Fenneropenaeus chinensis (A),Chinese mitten handed crab Eriocheir sinensis H.Milne-Edwards(B)and swimming crab Portunus trituberculatus(C) eyestalks[27]

图6 点虾眼柄经马松三色染色后的组织切片
Fig.6 Histological sections stained with Masson’s trichrome of eyestalks Pandalus platyceros
国内以往的研究认为,虾蟹类年龄与体长有着一定的联系[32-34]。2015年,Kilada等[22]在对智利尼龙虾眼柄研究时发现,眼柄生长纹数目与体长的增长曲线和年龄与体长的增长曲线有着高度的相似,因此,对于眼柄中生长纹数目可以进一步和年龄建立关系。蒋瑞等[27]在对中国对虾眼柄的研究中认为,中国对虾眼柄生长纹细纹数目与体长、体质量的关系均适合用逻辑斯蒂生长方程曲线(Logistic curve)来描述。侯朝伟等[35]、徐炳庆等[36]研究表明,中国对虾生长规律符合逻辑斯蒂生长方程曲线,这与对眼柄生长纹细纹数目与体长、体质量关系的研究结果一致。

图7 三疣梭子蟹眼柄组织切片
Fig.7 Histological sections of eyestalk in swimming crab Portunus trituberculatus
2014年,Clore[24]对淡水小龙虾眼柄进行试验,在试验中使用广义线性模型(GLM)对小龙虾眼柄细纹数目和体长进行拟合,二者高度拟合(R2=0.941)。Kilada等[31]同样使用GLM模型对南极磷虾眼柄中宽带和个体体长进行分析,结果表明,宽带与个体体长间也存在线性关系。但是多数学者表示,若要获得每条生长纹所代表的确切意义,还需要大量已知年龄信息(天数和脱壳次数)的样本,并进行大量的周期性验证试验。2017年Kilada等[37]对两种不同来源已知年龄的南极磷虾眼柄进行研究,发现眼柄中每一条宽纹对应着一龄,这是首次采用已知年龄的南极磷虾对使用眼柄微结构研究其年龄进行的验证性试验。
5 分析与展望
在对眼柄生长纹计数中,现有的研究均采取人工计数,这往往会对后面的分析过程带来非系统性误差。在计数过程中对同一个眼柄制片的生长纹应至少3人分别独立计数,对其结果应当分析三者间的平均百分比误差(Index of average percent error, IAPE)和变异系数(Coefficient of variation, CV),这两个指数表明了3组计数的结果是否具有一致性[38]。当IAPE值大于5%或者CV值大于10%时,则表明该组数据差异较大,应重新计数。运用统计学方法能够帮助弥补在试验中的人为误差。
对虾蟹类眼柄中钙化结构的研究,主要是通过判读甲壳类动物在生长过程中钙化结构生成的生长纹来鉴定其年龄,这种方法是近年兴起的技术。相较早期鉴定甲壳类年龄的其他技术方法,使用虾蟹类眼柄中钙化结构鉴定其年龄组织提取方便,在试验中只需要提取眼柄即可,且预处理方法简单,不需要烦琐的提取过程。但虾蟹类眼柄不像其他鉴定年龄的材料(如耳石),在对生长纹计数时有一个已知的起点(核心面)以计算其数目或者宽度,对于眼柄而言,在计算其生长纹数目时没有一个固定的起点,这会给验证或检查计数的准确性带来难度。在未来的试验中,利用眼柄微结构研究虾蟹类的年龄和生长,应进一步建立眼柄中轮纹结构(宽带和细纹)与体长、体质量和年龄的关系,并且使用大量已知年龄的个体进行可靠的验证试验,以进一步建立眼柄中生长纹和年龄间的关系。
[1] 刘必林,陈新军,李建华.内壳在头足类年龄与生长研究中的应用进展[J].海洋渔业,2015,37(1):68-76.
[2] 邓维德,赵亚辉,康斌,等.耳石在鱼类年龄与生长研究中的应用[J].动物学杂志,2010,45(2):171-180.
[3] 李冬静.利用鳍棘和脊椎骨研究印度洋中西部大眼金枪鱼的年龄与生长[D].上海:上海海洋大学,2014.
[4] 魏朝军,申志新,贾银涛,等.花斑裸鲤年龄鉴定材料的比较与年龄判别[J].生态学杂志,2015,34(9):2537-2541.
[5] 江艳娥,陈作志,林昭进,等.南海中部海域鸢乌贼耳石形态特征分析[J].南方水产科学,2014,10(4):85-90.
[6] 马金,刘必林,陈新军,等.利用耳石鉴定头足类年龄与生长研究进展[J].海洋渔业,2009,31(3):316-324.
[7] 刘必林,陈新军,方舟,等.利用角质颚研究头足类的年龄与生长[J].上海海洋大学学报,2014,23(6):930-936.
[8] 陈新军,刘必林,钟俊生.头足类年龄与生长特性的研究方法进展[J].大连水产学院学报,2006,21(4):371-377.
[9] Hébert M,Benhalima K,Miron G,et al.Moulting and growth of male snow crab,Chionoecetes opilio (O.Fabricius,1788) (Decapoda,Majidae),in the Southern Gulf of St.Lawrence[J].Crustaceana,2002,75(5):671-702.
[10] Gherardi F,Barbaresi S,Salvi G.Spatial and temporal patterns in the movement of Procambarus clarkii,an invasive crayfish[J].Aquatic Sciences,2000,62(2):179-193.
[11] Schmalenbach I,Mehrtens F,Janke M,et al.A mark-recapture study of hatchery-reared juvenile European lobsters,Homarus gammarus,released at the Rocky Island of Helgoland (German Bight,North Sea) from 2000 to 2009[J].Fisheries Research,2011,108(1):22-30.
[12] Cházaro-Olvera S.Growth,mortality,and fecundity of Palaemonetes pugio from a lagoon system inlet in the southwestern Gulf of Mexico[J].Journal of Crustacean Biology,2009,29(2):201-207.
[13] Dhaouadi-Hassen S,Boumaiza M.Reproduction and population dynamics of Atyaephyra desmarestii (Decapoda,Caridea) from the Sidi Salem Dam Lake (Northern Tunisia)[J].Crustaceana,2009,82(2):129-139.
[14] Medina A,Vila Y,Megina C,et al.A histological study of the age-pigment,lipofuscin,in dendrobranchiate shrimp brains[J].Journal of Crustacean Biology,2000,20(3):423-430.
[15] Pereira C R,D’ Incao F,Fonseca D B.Bilateral comparison of insitu neurolipofuscin accumulation in Callinectes sapidus caught in the wild[J].Journal of the Marine Biological Association of the United Kingdom,2010,90(3):563-567.
[16] Gardner C,Jenkinson A,Heijnis H.Estimating Intermolt Duration in Giant Crabs (Pseudocarcinus gigas)[M]//Paul A J,Dawe E G,Elner R,et al.Crabs in Cold Water Regions:Biology,Management,and Economics.Fairbanks,Alaska:University of Alaska Sea Grant,2002.
[17] 朱江峰,王洁,戴小杰.东太平洋大青鲨脊椎骨的稳定同位素比值研究[J].南方水产科学,2015,11(4):40-45.
[18] Kilada R,Sainte-Marie B,Rochette R,et al.Direct determination of age in shrimps,crabs,and lobsters[J].Canadian Journal of Fisheries and Aquatic Sciences,2012,69(11):1728-1733.
[19] 范晓锐.甲壳动物眼柄神经内分泌系统研究概述[J].天津水产,2010(1):12-18.
[20] Kilada R,Acu a E.Direct age determination by growth band counts of three commercially important crustacean species in Chile[J].Fisheries Research,2015,170:134-143.
a E.Direct age determination by growth band counts of three commercially important crustacean species in Chile[J].Fisheries Research,2015,170:134-143.
[21] Kilada R,Ibrahim N K.Preliminary investigation of direct age determination using band counts in the gastric mill of the blue swimmer crab (Portunus pelagicus) in two salt-water lakes in the eastern Mediterranean[J].Journal of Crustacean Biology,2016,36(2):119-128.
[22] Kilada R,Agnalt A L,Arboe N H,et al.Feasibility of using growth band counts in age determination of four crustacean species in the Northern Atlantic[J].Journal of Crustacean Biology,2015,35(4):499-503.
[23] Leland J C,Bucher D J,Coughran J.Direct age determination of a subtropical freshwater crayfish (Red claw,Cherax quadricarinatus) using ossicular growth marks[J].PLoS One,2015,10(8):e0134966.
[24] Clore J L.Investigation of the definitive age of freshwater decapod crustaceans,Orconectes propinquus and Procambarus clarkii,via growth bands in the calcified regions of the eyestalk and gastric mill[D].State of Michigan:Grand Valley State University,2014.
[25] Sheridan M,O’ Connor I,Henderson A C.Investigating the effect of molting on gastric mill structure in Norway lobster (Nephrops norvegicus) and its potential as a direct ageing tool[J].Journal of Experimental Marine Biology and Ecology,2016,484:16-22.
[26] Sheridan M,O’ Connor I,Lordan C.Investigating the feasibility of using growth increments for age determination of Norway lobster (Nephrops norvegicus) and brown crab (Cancer pagurus)[J].Journal of Crustacean Biology,2015,35(4):495-498.
[27] 蒋瑞,刘必林,刘华雪,等.三种常见经济虾蟹类眼柄微结构分析[J].海洋与湖沼,2018,49(1):99-105.
[28] Vatcher H E,Roer R D,Dillaman R M.Structure,molting,and mineralization of the dorsal ossicle complex in the gastric mill of the blue crab,Callinectes sapidus[J].Journal of Morphology,2015,276(11):1358-1367.
[29] 蒋瑞,刘必林,张健,等.甲壳类年龄鉴定方法研究进展[J].海洋渔业,2017,39(4):471-480.
[30] Krafft B A,Kvalsund M,Søvik G,et al.Detection of growth zones in the eyestalk of the Antarctic krill Euphausia superba (Dana,1852) (Euphausiacea)[J].Journal of Crustacean Biology,2016,36(3):267-273.
[31] Kilada R,Webb J B,McNeel K W,et al.Preliminary assessment of a direct age determination method for 3 commercially important crustaceans from Alaska[J].Fishery Bulletin,2016,115:42-49.
[32] 高天龙,王燕飞,鲍雪宁,等.单体筐养三疣梭子蟹的蜕壳与生长规律研究[J].生物学杂志,2016,33(3):41-46.
[33] 李玉虎,宋芹芹,张志怀,等.凡纳滨对虾生长发育规律及生长曲线拟合研究[J].南方水产科学,2015,11(1):89-95.
[34] 刘海映,崔帆,闫红伟,等.皮口海域中国对虾生长特性的初步研究[J].大连海洋大学学报,2016,31(5):488-496.
[35] 侯朝伟,顾侨侨,潘广臣,等.山东半岛南部中国明对虾大、小规格增殖苗种生长特性对比分析[J].烟台大学学报:自然科学与工程版,2015,28(3):193-198.
[36] 徐炳庆,吕振波,李战军,等.莱州湾中国对虾生长特性及其空间分布[J].生态学报,2016,36(3):803-810.
[37] Kilada R,Reiss C S,Kawaguchi S,et al.Validation of band counts in eyestalks for the determination of age of Antarctic krill,Euphausia superba[J].PLoS One,2017,12(2):e0171773.
[38] Beamish R J,Fournier D A.A method for comparing the precision of a set of age determinations[J].Canadian Journal of Fisheries and Aquatic Sciences,1981,38:982-983.