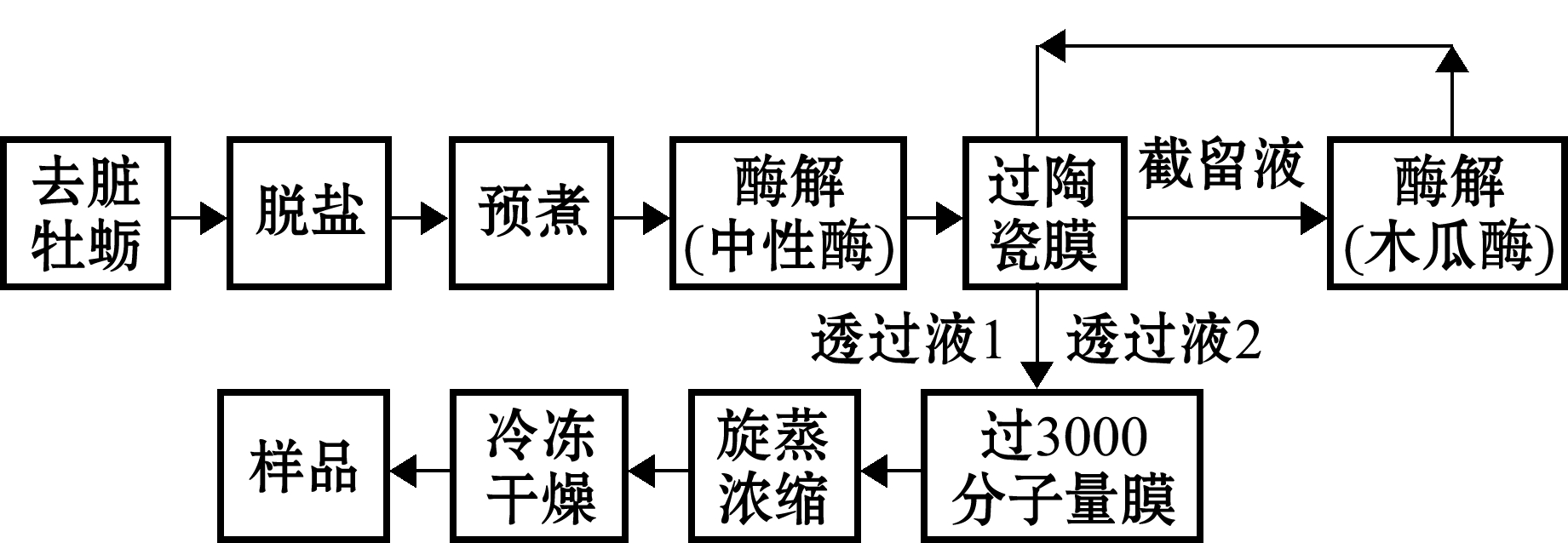
图1 牡蛎肽粉制备工艺
Fig.1 The process of oyster peptide powder preparation
太平洋牡蛎Crassostrea gigas隶属于软体动物门Mollusca、瓣鳃纲Lanellibranchia、异柱目Anisomyaria、牡蛎科Osteridae[1],是全球养殖规模最大的贝类,也是中国重要的经济养殖贝类之一[2],并首批进入药食同源名单[3-4]。生物活性肽(Bioactive peptide)是相对分子质量不高于6000,介于氨基酸和蛋白质之间的一类物质[5],由 3~20 个氨基酸残基构成,具有抗氧化、防治高血压、糖尿病等作用[6]。目前,海洋天然活性肽已经被很多人所探讨,如Lee 等[7]得到了源于大马哈鱼氨基酸序列为Gly-Leu-Pro-Leu-Asn-Leu-Pro的活性肽。Matsui等[8]研究发现,通过蛋白降解产生的二肽Ala-Pro 的结构与降血压药品卡托普利相似。研究表明,牡蛎肽有许多功能特性,如ACE抑制功能、抗菌功能及抵挡氧化作用。在有关研究中,Wang等[9]获得了IC50值为1.45 mg/mL的牡蛎蛋白ACE抑制肽。欧成坤等[10]获得了ACE抑制率为71.71%的牡蛎酶解液。但有关牡蛎ACE抑制肽的性质和体内降压活性分析研究比较少见。本研究中,以新鲜去脏牡蛎为原料,采用二次酶解工艺及超滤等技术制备牡蛎ACE抑制肽,研究牡蛎ACE抑制肽的性质并将其灌胃高血压大鼠,进行体内活性检测,旨在为生产安全、可靠的食源性降血压肽提供便捷、高效的生产工艺和技术参考,以推动牡蛎高价值的开发与利用。
试验用太平洋牡蛎肉购自辽宁省大连市黑石礁市场。试验用雄性原发性高血压大鼠(Spontaneously hypertensive rats,SHR),购自北京维通利华实验动物技术有限公司,共30只,每笼2只,体质量为(260±15)g,自由进食和饮水。在相对湿度为40%~70%、温度为(22±2)℃、光暗循环为12D∶12L的大连医科大学SPF动物实验中心动物饲养室暂养3 d。
试验试剂:血管紧张素转换酶(ACE)和马尿酰组胺酰-亮氨酸(HHL)购自Sigma公司;卡托普利购自生物工程(上海)股份有限公司;HPLC甲醇(色谱级)购自德国默克公司;中性蛋白酶、胃蛋白酶、胰蛋白酶(食品级)购自北京索莱宝公司;其他试剂均为分析纯。
试验仪器:MD3000无创血压仪(安徽正华生物仪器设备有限公司)、B-967匀浆机(上海标本模型厂)、Aglient 1260高效液相色谱仪(美国安捷伦公司)、BS224S型电子天平(北京赛多利斯仪器系统有限公司)、STARTER2100实验室pH计[奥豪斯仪器(上海)有限公司]和酶标仪(上海分析仪器厂)。
1.2.1 牡蛎脱盐优选试验 称取30 g去脏牡蛎(牡蛎外液盐度为19),分别加入30、60、90、120、180 mL的4 ℃蒸馏水浸渍4 h,每10 min搅动1次并记录牡蛎外液的盐度。试验期间换水3次,记录牡蛎外液盐度随时间的变化,选择最佳脱盐加水比例。
1.2.2 牡蛎肽粉制备工艺 试验设置脱盐组与未脱盐组。脱盐组首先按照牡蛎脱盐优选试验结果得到的最佳脱盐加水比例,对去脏牡蛎进行脱盐处理,然后按照制备工艺流程(图1)制备牡蛎肽粉。即按照料水比为1∶5(g∶mL)混合匀浆后煮沸10 min,采用中性蛋白酶在55 ℃、pH 7、加酶量2%的条件下酶解2 h得到牡蛎酶解液。将牡蛎酶解液进行陶瓷膜超滤,再将陶瓷膜的截留液加入0.5倍水后,用0.5%木瓜蛋白酶进行第二次酶解(反应温度为60 ℃,pH 7,反应时间1 h),之后继续过陶瓷膜超滤。最后将第一次和第二次酶解透过液再用3000分子量的膜超滤,得到相对分子质量小于3000的透过液。前期预试验结果显示,相对分子质量小于3000的牡蛎ACE抑制肽的ACE抑制率更高,因此,将相对分子质量小于3000的透过液浓缩并冻干成粉末,即为牡蛎肽粉,备用待测。

图1 牡蛎肽粉制备工艺
Fig.1 The process of oyster peptide powder preparation
未脱盐组未对去脏牡蛎进行脱盐处理,牡蛎肽粉的制备方法同脱盐组。
1.2.3 脱盐牡蛎与未脱盐牡蛎ACE抑制率的比较 各取10 mg用脱盐牡蛎制备的肽粉和用未脱盐牡蛎制备的肽粉,加入2 mL超纯水,配制成浓度为5 mg/mL的溶液,检测脱盐和未脱盐牡蛎肽粉的ACE抑制率[11]。
1.2.4 牡蛎ACE抑制肽的鉴定 采用GB 5009.5—2010凯氏定氮法和苯酚硫酸法[12]分别测定制备的牡蛎肽粉蛋白质含量和总糖含量;用全自动氨基酸分析仪分析水解后样品的氨基酸组成。由于用酸水解,未检测出色氨酸。
1.2.5 牡蛎ACE抑制肽的性质分析
(1)模拟体外消化。模拟胃液(SGF)和模拟肠液(SIF)的配制及体外模拟消化试验参考Calsamiglia等[13]、王金梅等[14]的方法。具体方法如下:称取5 g牡蛎肽粉,将其置于模拟胃液中,于37.0 ℃下水浴5 min,酶与底物按质量比为1∶50加入胃蛋白酶,消化1 h,调pH至7.5,终止反应;酶与底物按质量比为1∶50加入胰蛋白酶,继续消化4 h。
(2)乳化性和乳化稳定性。乳化性( Emulsifying activityindices, EAI)测定具体参考Taheri等[15]的方法,并稍做修改。即将牡蛎肽粉稀释50 倍,在500 nm波长下进行检测。乳化性EAI(cm2/g)计算公式为
EAI=2.3×2×A/(M×C)。
其中:A为吸光值;M为牡蛎肽粉的质量(g);C为油占乳状液的体积比(0.25)。
乳化稳定性(Emulsion stability indices, ESI)的测定,即将测定EAI后的乳状液样品在室温下静置10 min,再测定其乳化性(EAI′)。乳化稳定性ESI(min)计算公式为
ESI=EAI×Δt/(EAI-EAI′)。
其中:Δt为时间间隔(min)。
(3)吸水性和吸油性。计算吸水性(Water absorption capacity),参考Wani等[16]的方法,并做调整。称取0.1 g牡蛎ACE抑制肽粉,加入50 μL蒸馏水搅匀,再加入同体积蒸馏水,搅拌至不能析出,静置0.5 h后离心,除去上层未吸收的水分并称其质量。参考Benelhadj等[17]的方法计算吸油性(Oil absorption capacity)。
(4)溶解性。参考Ghribi等[18]的方法测定溶解性,并作微调。取一定量的牡蛎肽粉用蒸馏水配成1%的溶液,分别取60 μL溶液放在不同温度(20、50、60、70、80、90 ℃)的水浴锅中,水浴5 min。以9000 r/min离心10 min,取上清液50 μL,加入150 μL的双缩脲试剂,于37 ℃下水浴20 min, 在540 nm波长下进行检测。对不同pH(3~11)下的溶解性测定方法,与不同温度下的测定方法相同。
1.2.6 动物试验
(1)动物分组及给药。将SHR大鼠随机平均分成空白组、阳性对照组和牡蛎ACE抑制肽组,每组10只。适应饲养3 d,3 d后每日进行心脏收缩压(SBP)测定、体质量称量、给药灌胃等操作。牡蛎ACE抑制肽组灌胃牡蛎ACE抑制肽,剂量为150 mg/kg(体质量);阳性对照组灌胃卡托普利,剂量为20 mg/kg(体质量);空白组灌胃蒸馏水,剂量为0.5 mL/300 g(体质量)。早晚灌胃两次,共灌胃28 d,停止灌胃后继续观察6 d。
(2)心脏收缩压(SBP)的测定。每天测量心脏收缩压之前,将SHR放入(37±1)℃温热筒中,当SHR的尾动脉清晰时,记录SHR的心脏收缩压,每只SHR测定5次,取其平均值。整个饲养过程中记录其体质量。
实测数据均用平均值±标准差(mean±S.D.)表示,使用 SPSS 17.0软件进行单因素方差分析,用LSD法进行组间多重比较,显著性水平设为0.05,极显著水平设为0.01。
从图2可见:添加不同体积的蒸馏水后,随着时间的延长,牡蛎外液的盐度呈先上升后下降最后基本恒定的趋势;2 h后,加入90、120、180 mL水的牡蛎内液和牡蛎外液,盐度处于平衡状态,恒定在0.2。考虑到成本问题,故采用4倍体积水对牡蛎进行2 h的脱盐预处理。
如表1所示,用去脏牡蛎脱盐后制备的肽粉体外ACE抑制活性升高,抑制率为69.5%,表明脱盐过程有利于提高牡蛎的ACE抑制率。去脏牡蛎同全牡蛎相比比较细碎,浸泡除盐比较彻底。因此,后续试验中牡蛎肽粉的制备均选择用水浸法(加入4倍体积水)对牡蛎肉进行前处理。
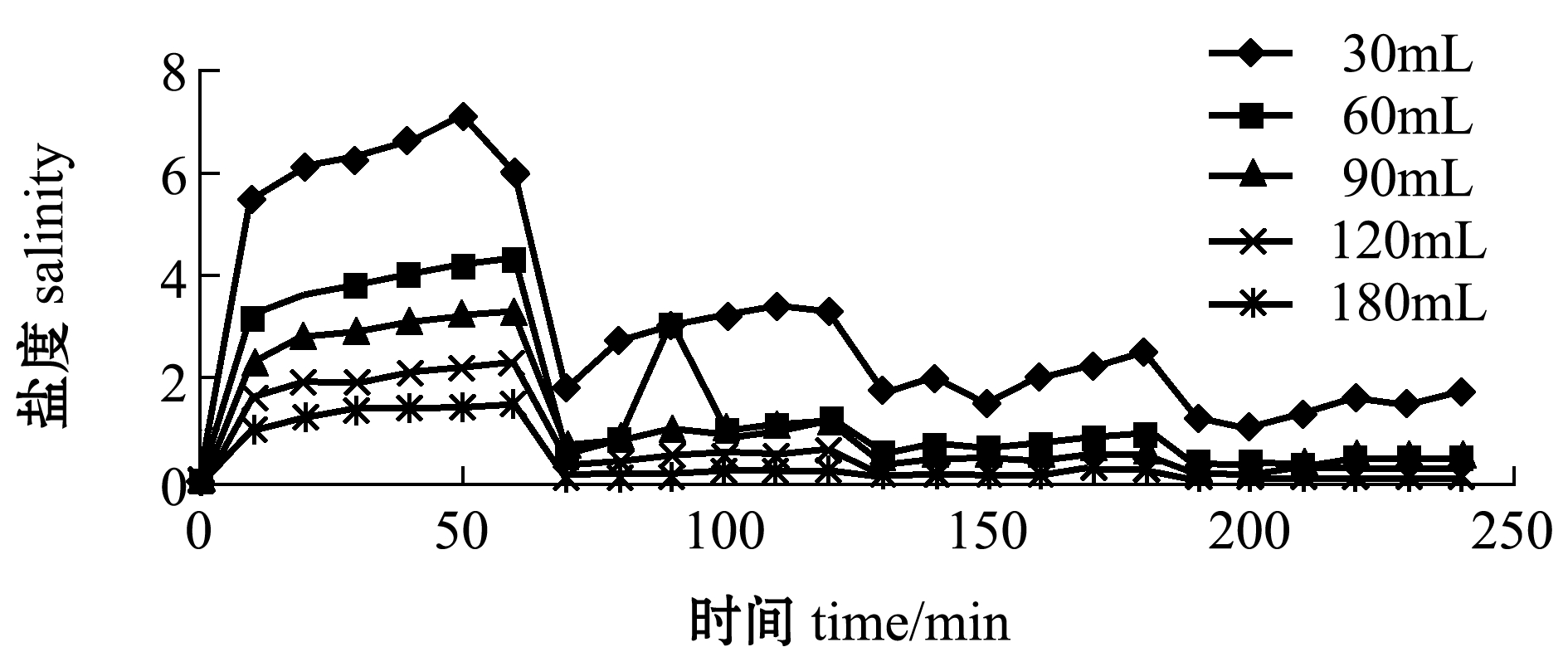
图2 脱盐时间对牡蛎外液盐度的影响
Fig.2 Effect of desalting time on salinity of oyster liquid
表1 脱盐牡蛎与未脱盐牡蛎结果比较(n=3)
Tab.1 Comparison of ACE inhibition between desalted oysters and non-desalted oysters(n=3)
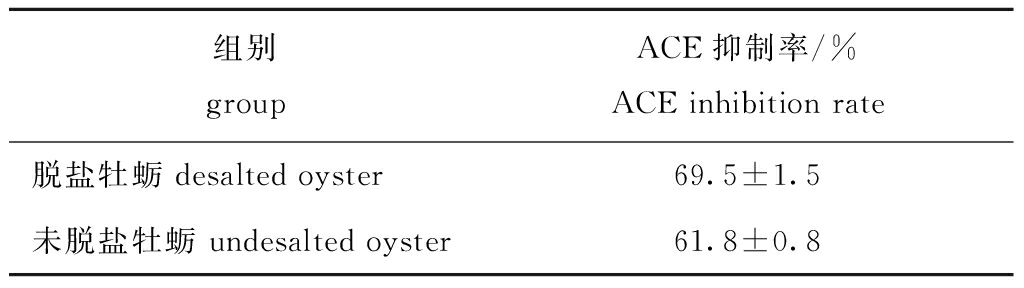
组别groupACE抑制率/%ACE inhibition rate脱盐牡蛎 desalted oyster69.5±1.5未脱盐牡蛎 undesalted oyster61.8±0.8
2.3.1 牡蛎ACE抑制肽的基本成分 经测定,所制备的牡蛎肽粉中多肽含量为66.7%,糖分为18.2%,灰分为6.31%。由此表明,制备的牡蛎ACE抑制肽纯度较高。牡蛎除去内脏后,牡蛎肉的杂质相对减少,故灰分含量较少。
2.3.2 牡蛎ACE抑制肽的氨基酸含量 从表2可见,牡蛎ACE抑制肽具有较好的氨基酸组成,谷氨酸含量最高(3.14%),与邱娟等[19]的研究结果一致。其次是亮氨酸和赖氨酸含量,胱氨酸含量最低。食品里营养素与必需氨基酸含量的多少密切相关[20],本研究中牡蛎ACE抑制肽的必需氨基酸含量较高,占氨基酸总量的44.28%。研究表明,ACE抑制率和氨基酸的疏水性有关[21],本研究中牡蛎ACE抑制肽的疏水性氨基酸含量占总氨基酸含量的46.14%。
2.4.1 胃肠模拟消化 从图3可知,牡蛎ACE抑制肽胃肠模拟消化后的抑制率虽低于未经过消化的,但未见显著性差异(P>0.05),表明该抑制肽能够抵抗消化酶的作用,属于真正抑制肽,其具有抗高血压的潜力。
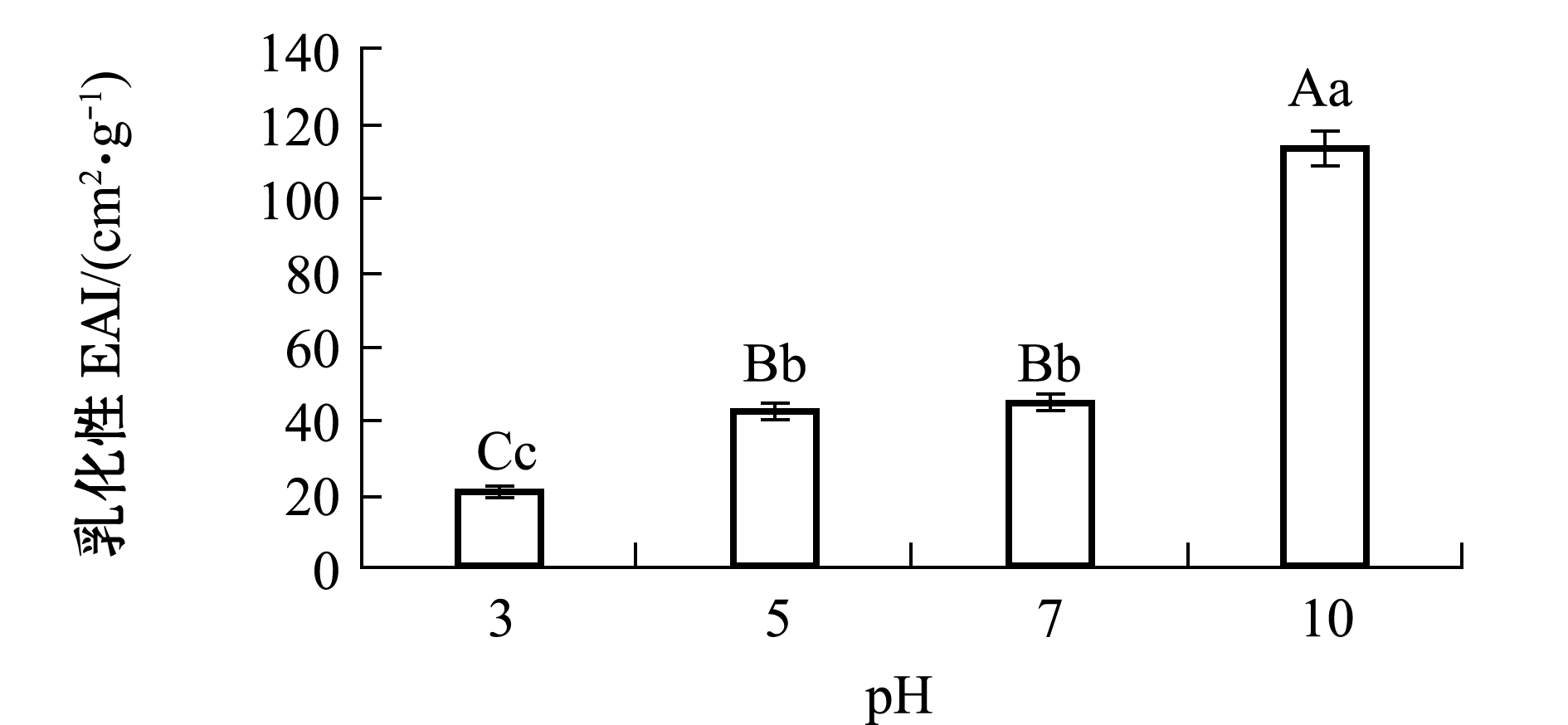
2.4.2 牡蛎ACE抑制肽的乳化性和乳化稳定性 乳化性是指与油和水的结合蛋白形成乳液的性能,乳化稳定性是指乳液保持稳定的能力。从图4可见:pH对牡蛎ACE抑制肽的乳化性有极显著性影响(P<0.01);随着pH值的增加,牡蛎ACE抑制肽的乳化性总体上呈上升趋势;pH为3时乳化性最低,pH为10时乳化性最高且显著高于其他pH值(P<0.05),pH为5和pH为7时的乳化性未见显著性差异(P>0.05)。
表2 牡蛎ACE抑制肽中氨基酸组成分析(n=3)
Tab.2 Amino acid composition of ACE inhibitory peptides from oyster(n=3)
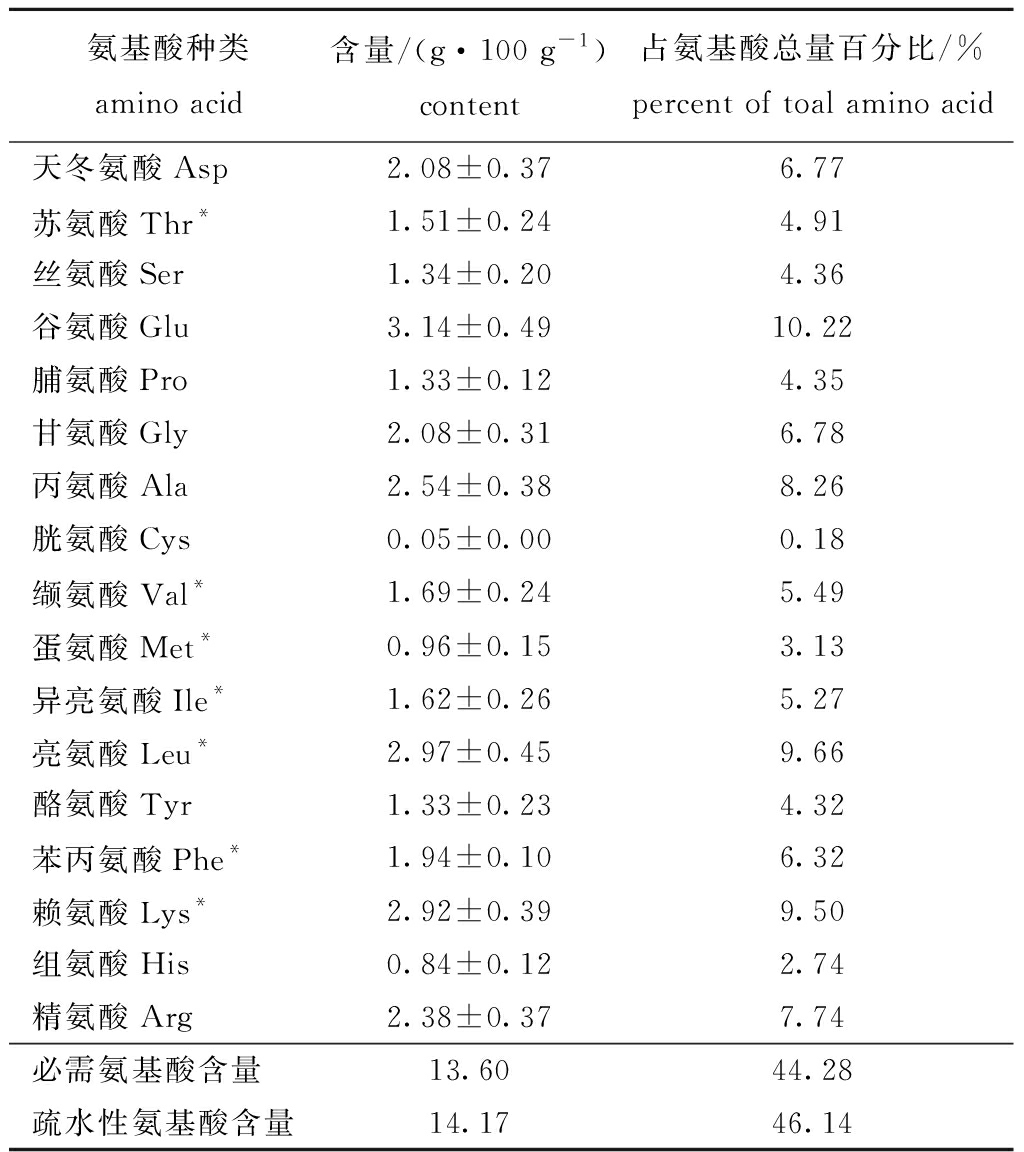
氨基酸种类amino acid含量/(g·100 g-1)content占氨基酸总量百分比/%percent of toal amino acid天冬氨酸Asp2.08±0.376.77苏氨酸Thr*1.51±0.244.91丝氨酸Ser1.34±0.204.36谷氨酸Glu3.14±0.4910.22脯氨酸Pro1.33±0.124.35甘氨酸Gly2.08±0.316.78丙氨酸Ala2.54±0.388.26胱氨酸Cys0.05±0.000.18缬氨酸Val*1.69±0.245.49蛋氨酸Met*0.96±0.153.13异亮氨酸Ile*1.62±0.265.27亮氨酸Leu*2.97±0.459.66酪氨酸Tyr1.33±0.234.32苯丙氨酸Phe*1.94±0.106.32赖氨酸Lys*2.92±0.399.50组氨酸His0.84±0.122.74精氨酸Arg2.38±0.377.74必需氨基酸含量13.6044.28疏水性氨基酸含量14.1746.14
注:*为必需氨基酸;Ala、Val、Leu、Ile、Phe、Pro、Met为疏水性氨基酸
Note: *,essential amino acids;Ala,Val,Leu,Ile,Phe,Pro,and Met,hydrophobic amino acids
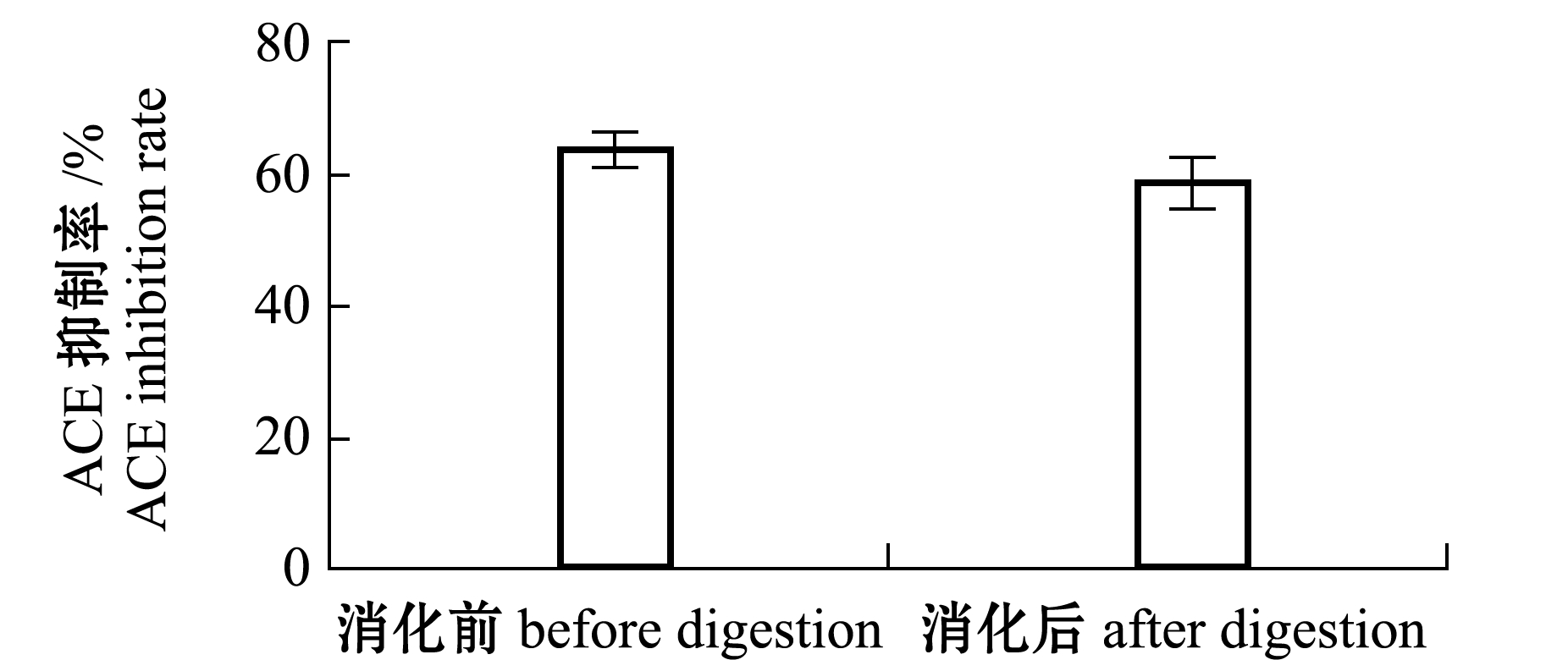
图3 消化前后ACE抑制率的变化
Fig.3 Changes in ACE inhibition rate before and after digestion
从图5可见,pH对牡蛎ACE抑制肽的乳化稳定性有极显著性影响(P<0.01);随着pH值的增加,牡蛎ACE抑制肽乳化稳定性呈波动变化的趋势;pH为3时乳化稳定性最低,pH为10时乳化稳定性最高且显著高于其他pH值(P<0.01)。
注: 标有不同大写字母者表示组间有极显著性差异(P<0.01),标有不同小写字母者表示组间有显著性差异(P<0.05),标有相同小写字母者表示组间无显著性差异(P>0.05),下同
Note: The means with different capital letters are very significantly different among the groups at the 0.01 probability level, the means with different letters being significantly different at the 0.05 probability level, and the means with the same letters are not significant differences,et sequentia
图4 pH对牡蛎ACE抑制肽乳化性的影响
Fig.4 Effects of pH on EAI of oyster peptides
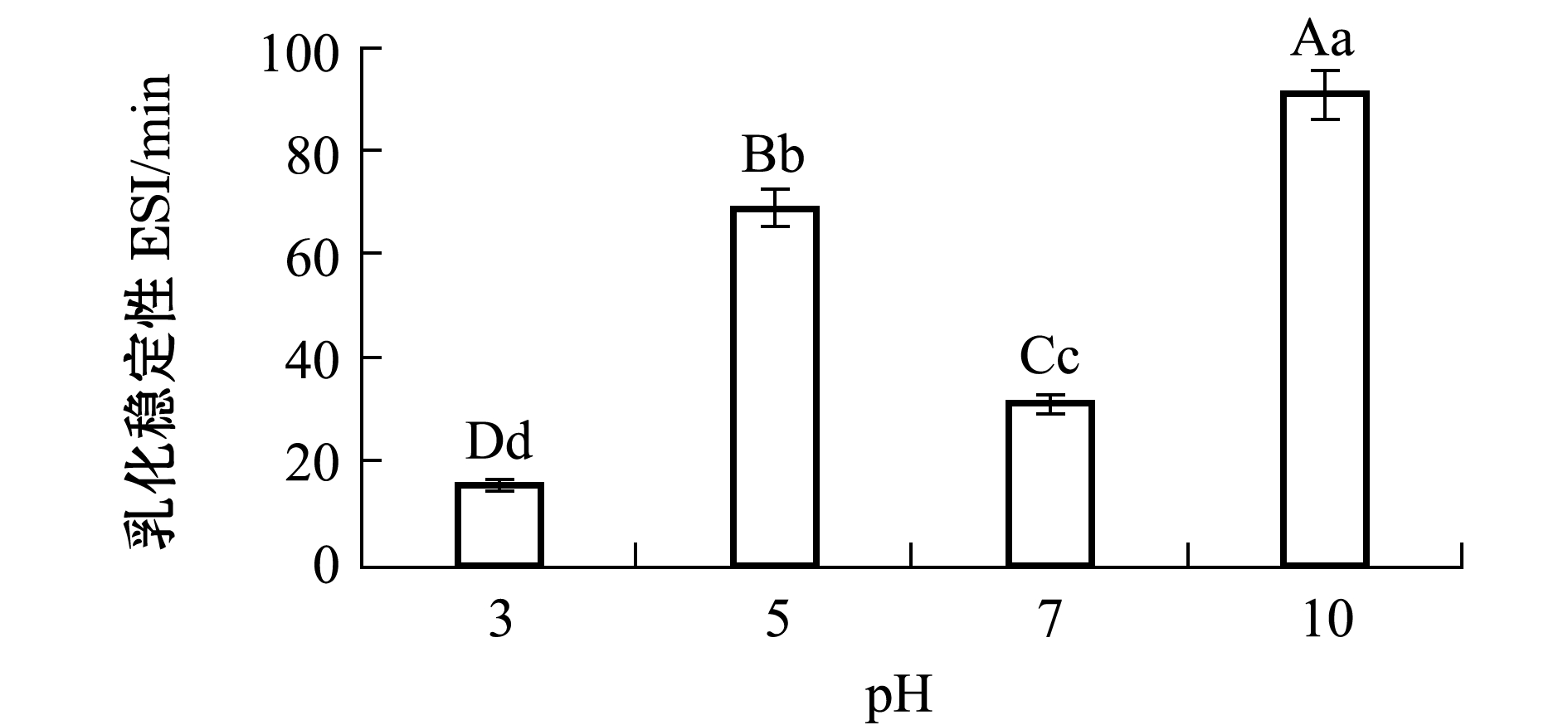
图5 pH对牡蛎ACE抑制肽乳化稳定性的影响
Fig.5 Effects of pH on ESI of oyster peptides
2.4.3 牡蛎ACE抑制肽的吸水性和吸油性 经测定,牡蛎ACE抑制肽的吸水性为(0.35±0.02)g/g,吸油性为(0.74±0.03)g/g。用该工艺制备的牡蛎肽有较好的吸油能力,牡蛎ACE抑制肽的吸水能力约为吸油能力的1/2。
2.4.4 牡蛎ACE抑制肽的溶解性 从图6可见:随着温度的升高,牡蛎ACE抑制肽的溶解性能呈先缓慢上升后下降的趋势;溶解性能在80 ℃时达到最高,且显著高于常温(20 ℃)组和其他温度组(P<0.05),其他温度组间均无显著性差异(P>0.05)。可以发现,升高温度可以加强牡蛎ACE抑制肽的溶解性能,但是过高温度也会使牡蛎ACE抑制肽的溶解性能下降。
从图7可见:pH对牡蛎ACE抑制肽的溶解度有极显著性影响(P<0.01);随着pH值的增加,牡蛎ACE抑制肽的溶解度整体上呈先升高后降低的变化趋势,pH为4时溶解度最低,pH为9时溶解度最高;pH为6~10时,牡蛎ACE抑制肽的溶解性未见显著性差异 (P>0.05)。
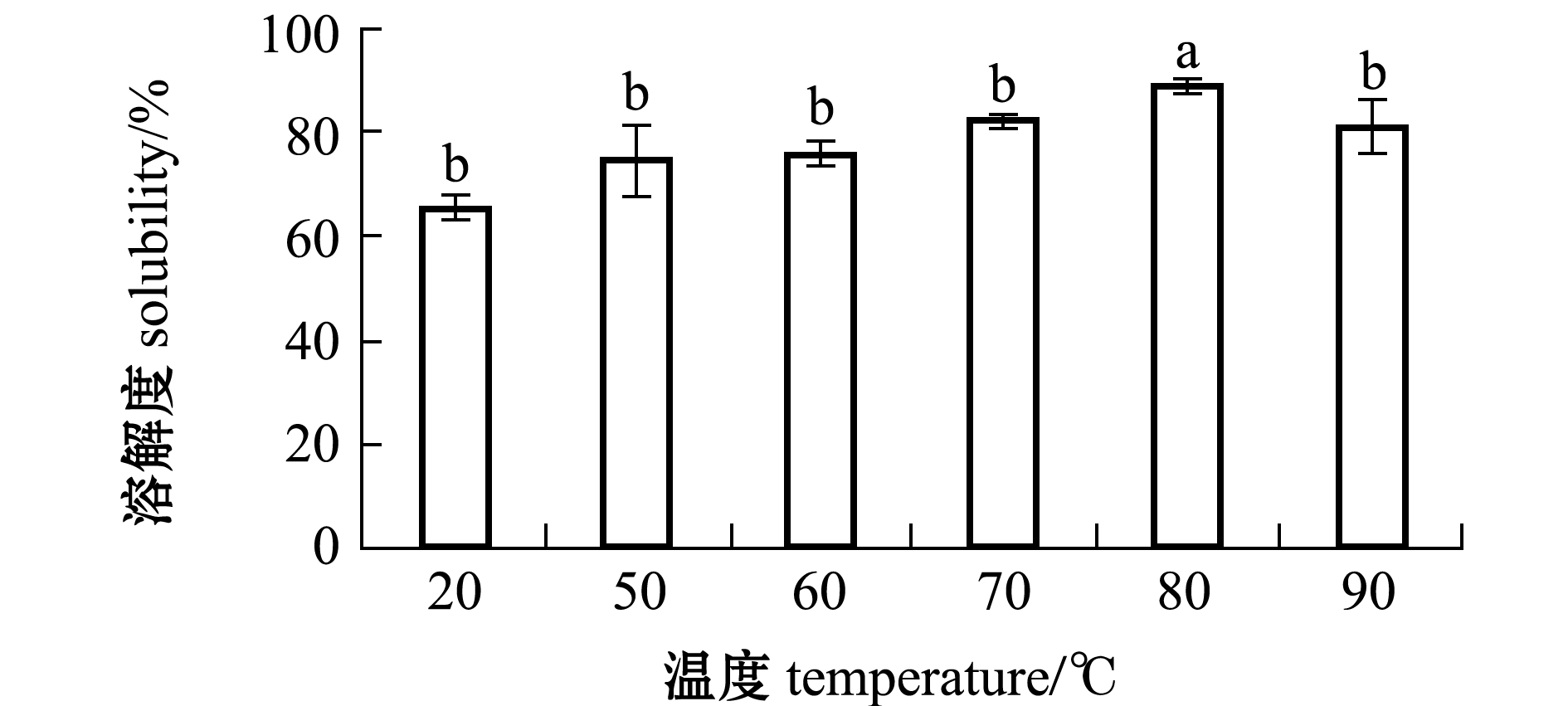
图6 温度对牡蛎ACE抑制肽溶解性的影响
Fig.6 Effect of temperature on solubility of ACE inhibitory peptide in oyster
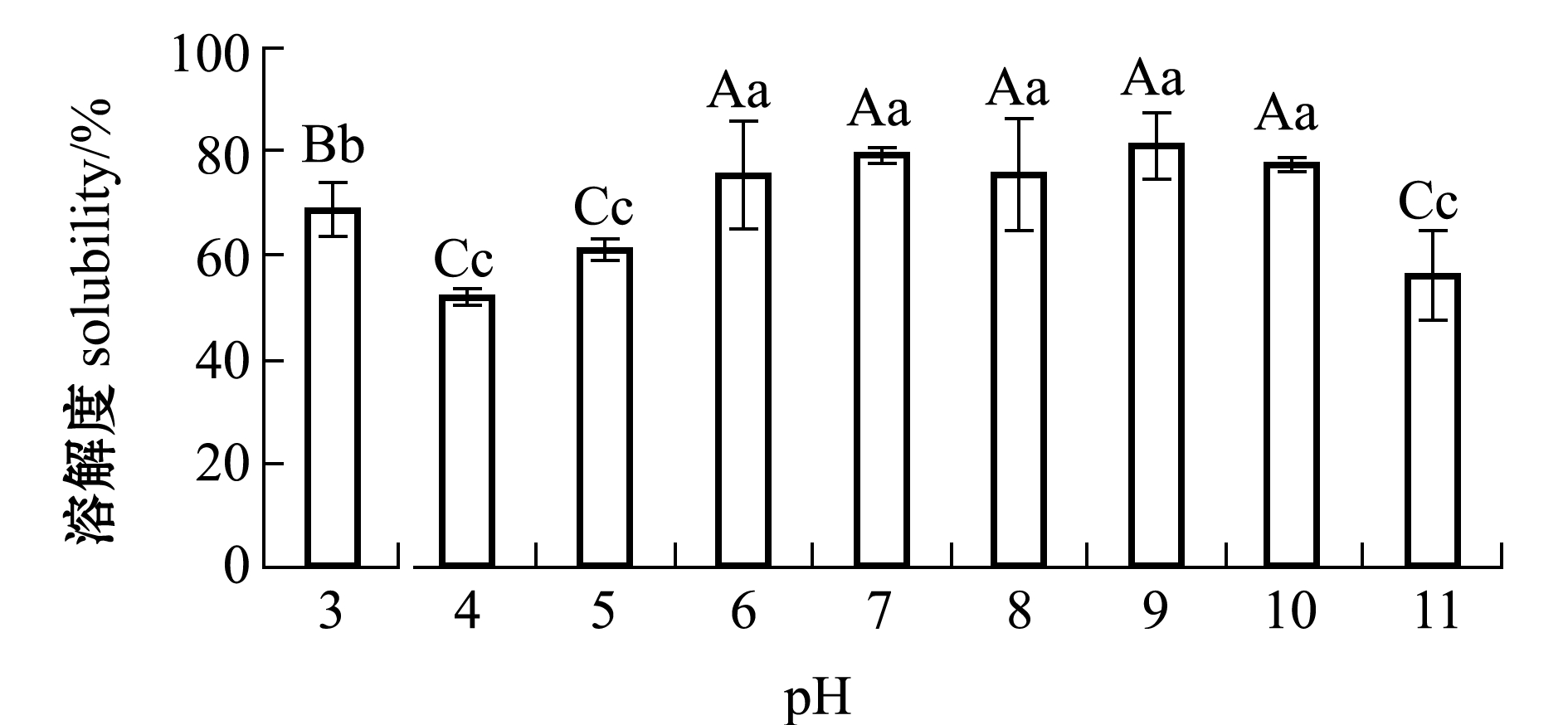
图7 pH对牡蛎ACE抑制肽溶解性的影响
Fig.7 Effect of pH on solubility of ACE inhibitory peptide in oyster
2.5.1 灌胃时间对SHR心脏收缩压的作用 从图8可见:随着灌胃时间的延长,空白组、阳性对照组和牡蛎ACE抑制肽组SHR的心脏收缩压均呈先下降后上升再下降的趋势;整个试验过程中,牡蛎ACE抑制肽组除第2天外SHR心脏收缩压均明显低于空白组,第21天时SHR心脏收缩压降到最低,为(161.56±16.63)mmHg,之后基本保持恒定且均极显著低于空白组(P<0.01);试验过程中,阳性对照组SHR心脏收缩压均极显著低于空白组(P<0.01),第18天时降到最低,为(137.1±8.9)mmHg,之后基本保持恒定且均极显著低于空白组(P<0.01);停止灌胃ACE抑制肽6 d内,ACE抑制肽组SHR的心脏收缩压与空白组相比仍表现出极显著性差异(P<0.01)。说明牡蛎ACE抑制肽对降低SHR的心脏收缩压有一定的效果且稳定性良好。
2.5.2 灌胃牡蛎ACE抑制肽对SHR体质量的影响 从图9可见:随着灌胃时间的延长,空白组、阳性对照组和牡蛎ACE抑制肽组SHR的体质量均呈上升趋势;各组SHR体质量均未见明显差异(P>0.05);灌胃一周后,牡蛎ACE抑制肽组和阳性对照组SHR的体质量略低于空白组,阳性对照组SHR与牡蛎ACE抑制肽组SHR体质量趋于一致;停止灌胃后(第29~34天),3组SHR的体质量均有一定程度先下降后平缓的趋势。
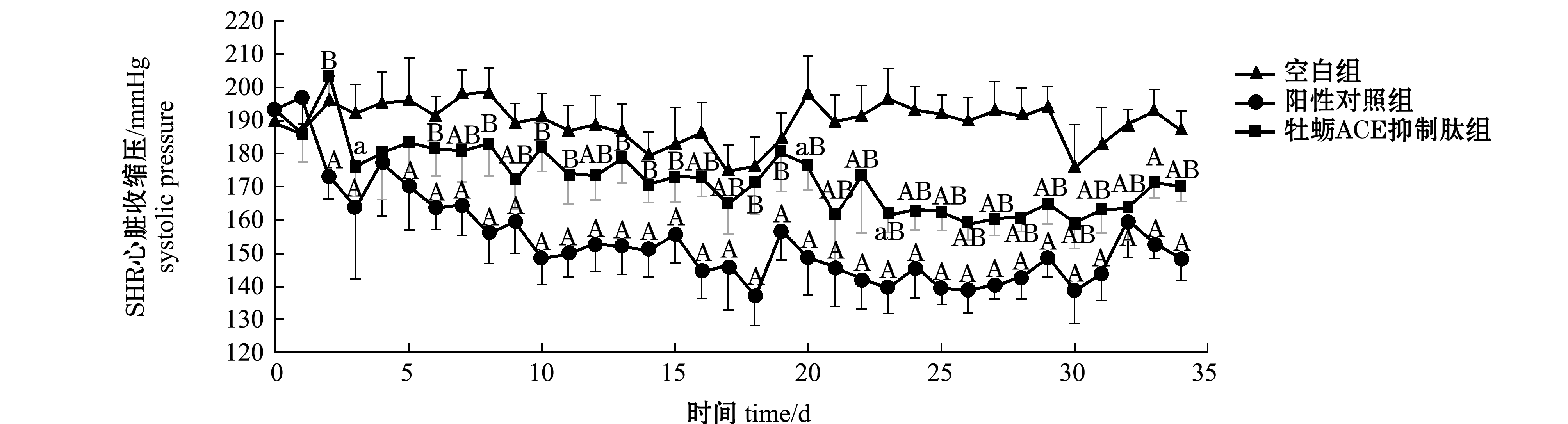
注:a表示与空白组相比有显著性差异(P<0.05),A表示与空白组相比有极显著性差异(P<0.01);B表示与阳性对照组相比有极显著性差异(P<0.01)
Note: a means significant difference compared with the blank(P<0.05);A means very significant difference compared with the blank(P<0.01);B means very significant difference compared with the control(P<0.01)
图8 灌胃牡蛎ACE抑制肽对SHR心脏收缩压的影响(n=10)
Fig.8 Effect of oyster ACE inhibitory peptide on SHR systolic blood pressure(n=10)
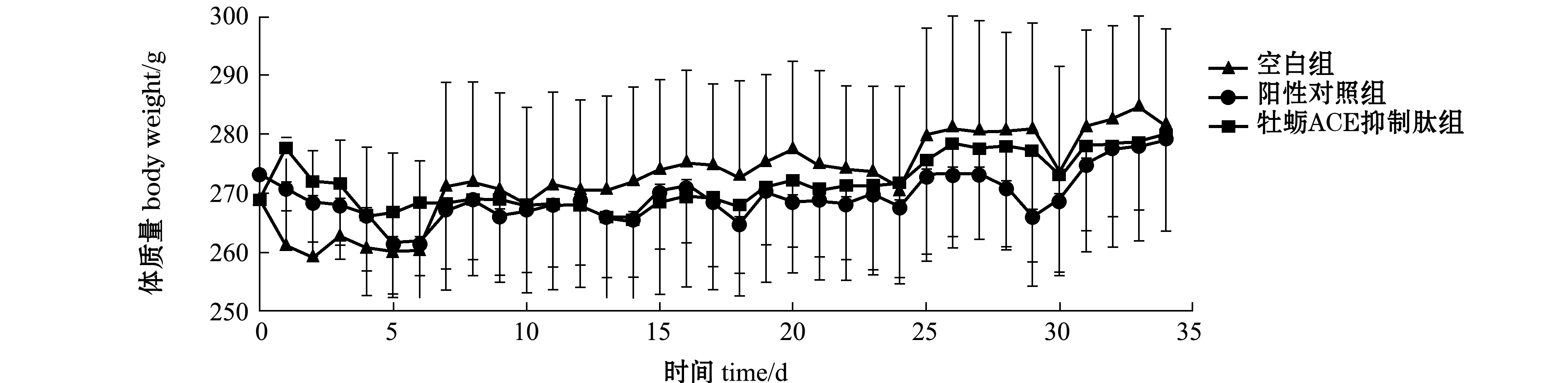
图9 灌胃牡蛎ACE抑制肽对SHR体质量的影响(n=10)
Fig.9 Effect of oyster ACE inhibitory peptide on SHR body weight(n=10)
本试验结果表明,用4倍体积的水浸泡牡蛎进行脱盐,效果较好,牡蛎外液盐度由19降为0.2,且体外ACE抑制活性提高了12.5%。邱娟[22]也采用水浸法对牡蛎进行脱盐处理,盐度可由 43 降至3 ,此方法简便且成本较低。汪秋宽等[23]和林海生等[24]均选用中性蛋白酶酶解牡蛎蛋白制备牡蛎活性肽,其中林海生等得到了相对分子质量小于3000的酶解物组分。本研究中采用中性蛋白酶和木瓜蛋白酶进行两次酶解工艺,同样获得相对分子质量小于3000的牡蛎ACE抑制肽。
Cian等[25]采用海藻ACE抑制活性肽模拟胃肠消化,ACE 抑制活性有所下降。本研究中制备的牡蛎ACE抑制肽经过模拟胃肠液消化后ACE 抑制活性略有降低,但无显著性差异,这与Cian等[25]的结果基本一致。邱娟[22]制备的牡蛎肽在不同pH 和温度下溶解性好,与本研究结果一致。本研究中制备的牡蛎ACE抑制肽在80 ℃时溶解度最高,在pH为4时溶解度最低,乳化性均在20 cm2/g以上,pH为10时乳化稳定性最佳。此外,其吸油能力比吸水能力高1倍。对牡蛎ACE抑制肽的性质研究可为人们开发食源性牡蛎产品提供技术参考。
ACE可以通过去除血管紧张素Ⅰ的C末端His-Leu,生成有血管收缩功能的血管紧张素Ⅱ,同时导致舒缓激肽失活,引起血压升高[26]。降血压肽通过抑制人体中ACE的活性而达到降血压作用。Wang等[9]用胃蛋白酶酶解的牡蛎蛋白水解产物灌胃SHR,表现出较高的降低血压功效。本试验中以两次酶解工艺得到的牡蛎ACE抑制肽为原料灌胃SHR,对其进行抗高血压效果的检测。结果表明,灌胃牡蛎ACE抑制肽对SHR心脏收缩压有较好的降压效果,与空白组相比,牡蛎ACE抑制肽组降压效果极显著,在灌胃第23天后SHR心脏收缩压一直维持在较低水平。停止灌胃牡蛎ACE抑制肽后,SHR的心脏收缩压并未出现明显上升趋势,且维持在稳定水平。通过观察SHR的体质量变化也能检测动物病情发展[27]。本试验结果显示,灌胃牡蛎ACE抑制肽和卡托普利对SHR体质量的增加有一定的抑制作用。与Oh等[28]得出的卡托普利可降低大鼠体质量增加的研究结果一致。
本研究中通过水浸法对牡蛎进行脱盐处理,再经过两次酶解工艺制备牡蛎ACE抑制肽。结果表明:用本研究工艺制备的牡蛎ACE抑制肽纯度高,17种氨基酸组成完善,且必需氨基酸含量占总氨基酸含量的比基本达到WHO/FAO标准模式,疏水性氨基酸含量丰富;牡蛎ACE抑制肽的消化稳定性良好,吸油特性高于吸水特性,不同pH 和温度下溶解性较好。动物试验结果表明,牡蛎ACE抑制肽不仅在体外具有较高ACE抑制活性,在体内仍具有明显降血压效果且保持稳定。本研究工艺制备的牡蛎ACE抑制肽,不仅能够实现牡蛎的高价值利用,还可为企业进行规模化、产业化生产食物源牡蛎ACE抑制肽提供技术参考。
[1] 徐凤山.中国海双壳类软体动物[M].北京:科学出版社,1997.
[2] 赵冠华,曲敏,胡斯杰,等.硫酸酯化牡蛎多糖对四氯化碳所致小鼠急性肝损伤的影响[J].大连海洋大学学报,2018,33(1):72-73.
[3] 汪何雅,杨瑞金,王璋.牡蛎的营养成分及蛋白质的酶法水解[J].水产学报,2003,27(2):163-168.
[4] 张凌晶,蔡秋凤,刘光明,等.太平洋牡蛎肌肉蛋白的模拟胃肠液消化研究[J].集美大学学报:自然科学版,2011,16(2):81-86.
[5] 牛丽丹,屠大伟,杨彦,等.功能性食品的发展概况及在食品营养标签中的新要求[J].食品与发酵科技,2015,51(2):9-11,17.
[6] 张开平,苏仕林,刘燕丽,等.生物活性肽功能及制备方法的研究进展[J].农产品加工,2015(12):61-64.
[7] Lee J K,Jeon,Byun H.Antihypertensive effect of novel angiotensin I converting enzyme inhibitory peptide from chum salmon(Oncorhynchus keta) skin in spontaneously hypertensive rats[J].Journal of Functional Foods,2014,7:318-389.
[8] Matsui T,Matsumoto K.Antihypertensive peptides from natural resources[J].Advances in Phytomedicine,2006,2:255-271.
[9] Wang J,Hu H,Cui J,et al.Purification and identification of a ACE inhibitory peptide from oyster proteins hydrolysate and the antihypertensive effect of hydrolysate in spontaneously hypertensive rats[J].Food Chemistry,2008,111(2):302-308.
[10] 欧成坤,杨瑞金.牡蛎酶解产物的ACE抑制活性和清除自由基活性研究[J].食品工业科技,2005,26(3):59-62.
[11] 任丹丹,汪秋宽,吴超,等.海带ACE酶抑制剂的浸提工艺研究[J].食品工业科技,2012,33(2):103-105.
[12] 张惟杰.复合多糖生化研究技术[M].上海:上海科学技术出版社,1987:6-7.
[13] Calsamiglia S,Stern M D,Firkins J L.Effects of protein source on nitrogen metabolism in continuous culture and intestinal digestion in vitro[J].Journal of Animal Science,1995,73(6):1819-1827.
[14] 王金梅,张占琴,王学军,等.菜籽蛋白的制备及其体外模拟消化[J].中国油脂,2008,33(9):10-15.
[15] Taheri A,Sabeena Farvin K H,Jacobsen C,et al.Antioxidant activities and functional properties of protein and peptide fractions isolated from salted herring brine[J].Food Chemistry,2014,142:318-326.
[16] Wani I A,Sogi D S,Shivhare U S,et al.Physico-chemical and functional properties of native and hydrolyzed kidney bean (Phaseolus vulgaris L.)protein isolates[J].Food Research International,2015,76:11-18.
[17] Benelhadj S,Gharsallaoui A,Degraeve P,et al.Effect of pH on the functional properties ofArthrospira (Spirulina)platensis protein isolate[J].Food Chemistry,2016,194:1056-1063.
[18] Ghribi A M,Gafsi I M,Sila A,et al.Effects of enzymatic hydrolysis on conformational and functional properties of chickpea protein isolate[J].Food Chemistry,2015,187:322-330.
[19] 邱娟,沈建东,翁凌,等.利用牡蛎制备ACE抑制肽的工艺优化[J].食品科学,2017,38(16):165-172.
[20] 曹善茂,王昊,陈炜,等.岩扇贝闭壳肌营养成分的分析及与中国3种扇贝的比较[J].大连海洋大学学报,2016,31(5):544-550.
[21] 蒋爽.ACE抑制肽的设计与抗酶解、抑制机理的研究[D].无锡:江南大学,2014.
[22] 邱娟.牡蛎生物活性肽的制备及其中试生产[D].厦门:集美大学,2016.
[23] 汪秋宽,宋琳琳,徐玲,等.牡蛎抗氧化活性肽的酶解工艺研究[J].大连水产学院学报,2009,24(2):95-99.
[24] 林海生,曹文红,章超桦,等.牡蛎蛋白酶解物的制备及其抗氧化活性研究[J].食品工业科技,2013,34(16):163-168.
[25] Cian R E,Garzón A G,Ancona D B,et al.Hydrolyzates fromPyropia columbina seaweed have antiplatelet aggregation,antioxidant and ACE I inhibitory peptides which maintain bioactivity after simulated gastrointestinal digestion[J].LWT-Food Science and Technology,2015,64(2):881-888.
[26] Soffer R L.Angiotensin-converting enzyme and the regulation of vasoactive peptides[J].Annual Review of Biochemistry,1976,45:73-94.
[27] 张辉.牡蛎活性肽降血糖和抑制ACE作用研究[D].南宁:广西医科大学,2009.
[28] Oh Y B,Kim J H,Park B M,et al.Captopril intake decreases body weight gain via angiotensin-(1-7)[J].Peptides,2012,37(1):79-85.