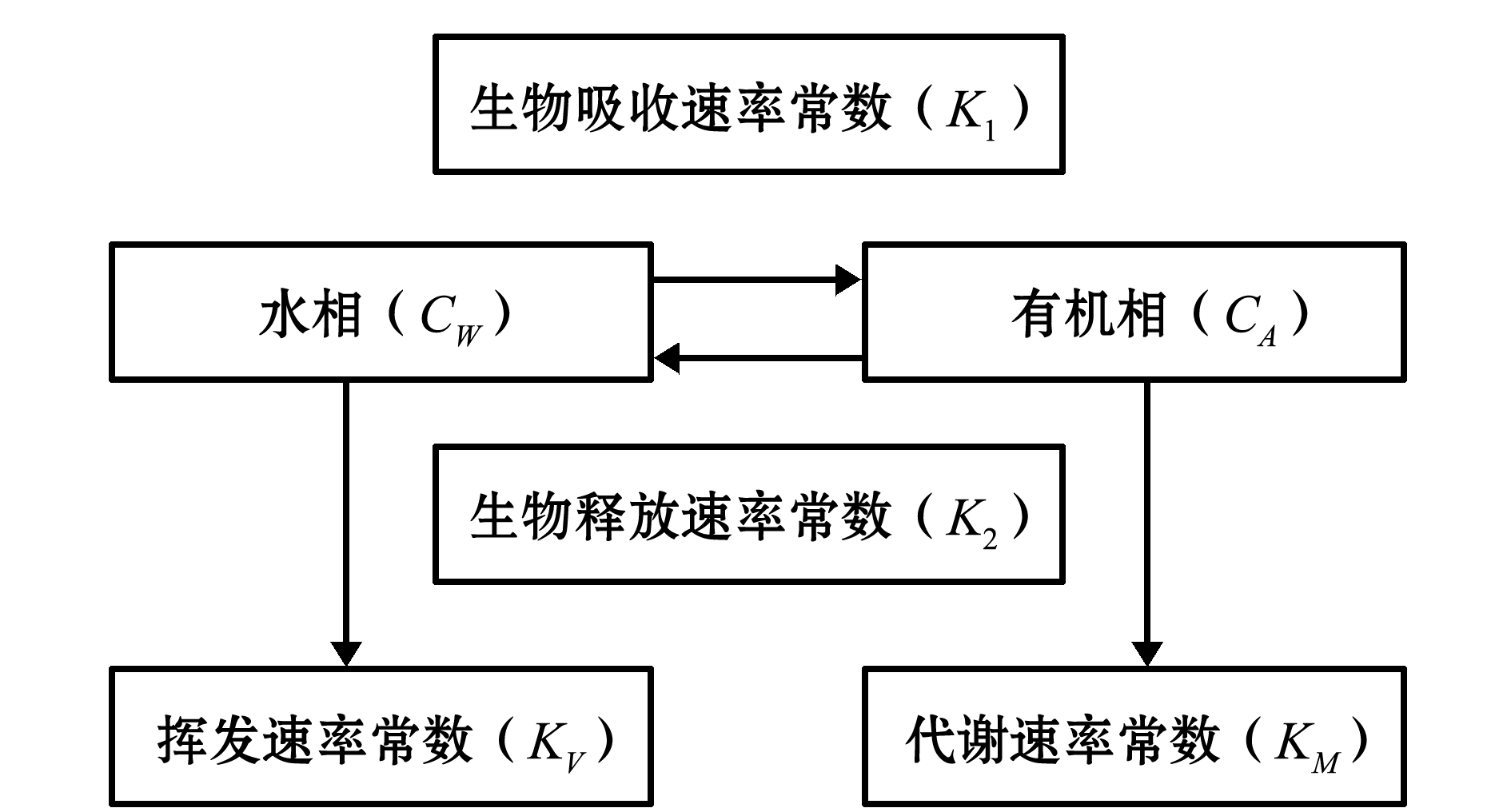
图1 生物富集双箱动力学模型
Fig.1 Two-compartment kinectic model of bioconcentration
多环芳烃(Polycyclic Armomatic Hydrocarbon,PAHs)作为持久性有机污染物质的一类,不仅具有较强的致癌、致畸和致突变性,还具有免疫毒性,会扰乱生物体抗氧防御系统的正常功能[1]。海洋中的PAHs多来自海洋溢油、大气沉降等,目前,随着经济的发展海洋中的多环芳烃含量及对海洋生物的潜在危害越来越引起学者的重视[2]。修蒙[3]研究了PAHs在栉孔扇贝Chlamys farreri体内蓄积特征与毒性效应;王静[4]研究了菲律宾蛤仔Ruditapes philippinarum在苯并[a]芘胁迫下的毒性效应;许高鹏等[5]利用双箱动力学模型研究了三疣梭子蟹Portunus trituberculatus体内苯并[a]芘的富集动力学。这些学者为研究水生生物对多芳环烃的富集提供了一定的基础。
虾夷马粪海胆Strongylocentrotus intermedius为中国北方地区具有极为重要经济价值和食用价值的经济动物[6],随着海洋环境污染加重,海胆对多环芳烃的生物富集成为影响海胆生长发育和威胁人体健康的重要因素。目前,国内外对于多芳环烃在虾夷马粪海胆体内富集过程的研究较少,由于3,4-苯并[a]芘(BaP)、9,10-二甲基蒽和3-甲基菲是中国海洋溢油优先监测的几种PAHs,且在所有水产养殖海域监测中均有发现,故本研究中选择此3种PAHs作为研究对象,通过虾夷马粪海胆在3种不同浓度PAHs溶液中的暴露,应用双箱模型对生物富集过程进行非线性拟合获得海胆对3种PAHs的生物富集动力学参数,旨在为研究PAHs在棘皮动物体内的富集机理及毒性风险评估提供参考依据。
试验用海水为取自大连市黑石礁海域,盐度为30~31,pH为7.8~8.1,经沙滤充分曝气后使用。试验用虾夷马粪海胆苗壳直径为(2.0±0.3)cm,购自大连太平洋海珍品有限公司,于实验室海水养殖循环系统中暂养一周后,选取健康的海胆用于试验。
试验仪器:气相色谱质谱联用仪(GC6890N/MSD5975B,Agilent Co.USA),加速溶剂提取仪(ASE350,Dionex Co.,USA),Heidolph旋转蒸发仪(Hei-VAP,德国)。
试验试剂:正己烷、二氯甲烷、丙酮等均为农残级,购自TEDIA公司;硅胶(0.100 mm)购自Merck公司;弗罗里硅土(Florsil,60-100目)购自美国Floridin公司;内标(替代内标Z-014J中含菲-d10和芘-d12,进样内标为三联苯-d14)购自Wellington公司;3,4-苯并[a]芘(BaP)、9,10-二甲基蒽和3-甲基菲购自Sigma公司(Sigma-Aldrich Corporation,USA),纯度分别大于99%、97%和98%,使用时用丙酮作为助溶剂将3种PAHs配制成一定浓度的母液。
1.2.1 生物蓄积试验 通过96 h急性毒性试验,3,4-苯并[a]芘(以下简写为苯并[a]芘)、9,10-二甲基蒽和3-甲基菲3种PAHs对虾夷马粪海胆的半致死浓度(LC50)分别为132.3、578.7、723.3 μg/L。以此为依据设置3种PAHs的生物蓄积试验所需的浓度。设置苯并[a]芘浓度分别为1、5、20 μg/L,9,10-二甲基蒽的浓度分别为5、10、50 μg/L,3-甲基菲浓度分别为5、10、100 μg/L。另外,设置1组海水对照组和1组丙酮对照组,丙酮浓度为所加入所有体系最大量的0.01%,每组设置3个重复,每个重复中放入海胆10只。试验期间持续充氧,使水中溶解氧浓度保持在6 mg/L以上,试验水温为18~20 ℃,每天定时投喂1次鲜海带,投喂量为体质量(以第一次称重为准)的1.5%。以此时为时间起始点,每天换1次新鲜海水,投加相应的污染物至所设置的浓度。试验进行到第3、7、14天时取样,每次从每个处理组取海胆3只,用锡箔纸包裹,放入冰箱(-80 ℃)中保存待测。
1.2.2 样品处理 全量称取冷冻干燥后的生物样品,加入无水硫酸钠和氘代回收率指示物 (Z-014J,10.0 μg/mL)用来控制样品前处理目标化合物的回收率,用100 mL正己烷和丙酮混合溶液(体积比为1∶1)进行加速溶剂萃取,萃取温度为100 ℃,加热时间为5 min,静止时间为10 min,循环3次,吹扫时间为60 s。样品提取液过无水硫酸钠小柱,加入盐酸处理过的铜粉进行除硫:生物样品提取液直接转入洁净的烧瓶中,加入一定量(视有机相的透明度而定)的酸性硅胶,磁力搅拌约0.5 h。去除脂肪等大分子杂质并将萃取液浓缩至2.0 mL左右,浓缩液过佛罗里土(5.0 g)与硅胶(8.0 g)复合柱净化,用50 mL正己烷预淋洗,用80 mL正己烷/二氯甲烷(体积比为1∶1)淋洗,接取淋洗液浓缩定容至200 μL,添加1 μL进样内标(三联苯-d14,10.0 μg/mL)。上机测定,加入内标的作用是为了消除系统误差及定量目标化合物。样品采用DB-5MS毛细管柱(30 m×0.25 mm×0.25 μm)进行气相分离,采用EI源电离方式进行质谱检测。色谱柱升温程序为:50 ℃开始,不停留;以4 ℃/min升温到220 ℃,停留3 min;以10 ℃/min升温到300 ℃,停留9 min。载气(氦气)流速为1.0 mL/min,恒流,进样口温度为280 ℃,无分流进样,进样量为1 μL;传输线温度为290 ℃,四极杆温度为150 ℃,离子源温度为230 ℃,离子扫描为SIM模式。
所有样品和空白中替代内标苯并[a]芘、9,10-二甲基蒽和3-甲基菲的回收率分别为79.7%~93.4%、65.5%~88.3%和71.2%~83.9%,相对标准偏差分别为8.9%、6.7%和7.3%,每个样品设3个平行测试。空白试验结果显示,所有目标物低于方法检测限,本研究中给出的数据均已经过回收率校准。
(1) 双箱动力学模型。双箱动力学模型是在近几年发展起来的一类数学模型,主要用于重金属、有机污染物的生物富集研究[7-8],能较好地描述污染物在水体与生物体间的作用过程,并能模拟出达到生物富集平衡情况下的动力学参数(图1)。

图1 生物富集双箱动力学模型
Fig.1 Two-compartment kinectic model of bioconcentration
双箱动力学模型生物富集公式为
(1)
其中:CA为生物体中PAHs浓度(ng/g);C0为试验开始前生物体内PAHs浓度(ng/g);K1为吸收速率常数;K2为释放速率常数;CW为水体中PAHs浓度(μg/L);t*为富集时间(d)。由方程(1)进行非线性拟合可得到K1、K2。
理论平衡状态下,富集系数(BCF)和生物半衰期(t1/2)计算公式为
(2)
(3)
当富集达到平衡时,生物体内最大PAHs含量(Cmax)计算公式为
Cmax=BCF×CW。
(4)
(2) 模型的拟合优度检验。应用MatLab2014A对数据进行非线性拟合,结合判定系数R2来评价该模型的拟合优度,并采用F检验对模型整体的显著性进行检验,以此验证双箱模型用于海胆对PAHs的生物富集研究的可行性。
PAHs在3 d、7 d和14 d时的生物富集动力学参数见表1。从图2和表1可见,对照组和丙酮对照组检测出少量的苯并[a]芘,由于对照组并未加入该污染物,故可以判定对照组中的苯并[a]芘来自环境本底值。随着苯并[a]芘浓度的升高,苯并[a]芘在海胆体内的蓄积量明显增加。随着暴露时间的延长,苯并[a]芘在海胆体内的蓄积量也有所增长,说明海胆体内只有少部分苯并[a]芘代谢出体外,随暴露时间的延长,海胆体内的蓄积量越来越多。在1 μg/L苯并[a]芘浓度条件下,虽然符合双箱动力学模型,但其K1值达到129.7,明显大于其他浓度的K1值,可能是由于此浓度过低,海胆蓄积毒物的时间到达第14天时,海水中苯并[a]芘含量较少,使海胆蓄积毒物受到浓度限制,因此,低浓度下K1值不太准确。而在5、20 μg/L浓度条件下,海胆的苯并[a]芘蓄积量明显增加,完全符合双箱动力学模型,K1分别为25.93和21.68,K2分别为0.083和0.291,R2分别为0.986和0.960(95%置信区间)。苯并[a]芘作为一种强致癌多环芳烃,具有较强的脂溶性,可以通过呼吸、体表渗透和食物链等多种途径进入海洋生物体内。被吸收的苯并[a]芘迅速溶入脂肪,由于其性质稳定,难以被生物分解代谢,因此,苯并[a]芘在生物体内富集系数较高。本研究中发现,水体中的苯并[a]芘在海胆体内富集量可以达到1.530 μg/g(浓度为20 μg/L,14 d),富集系数BCF最高为230.0(浓度为1 μg/L,14 d)。
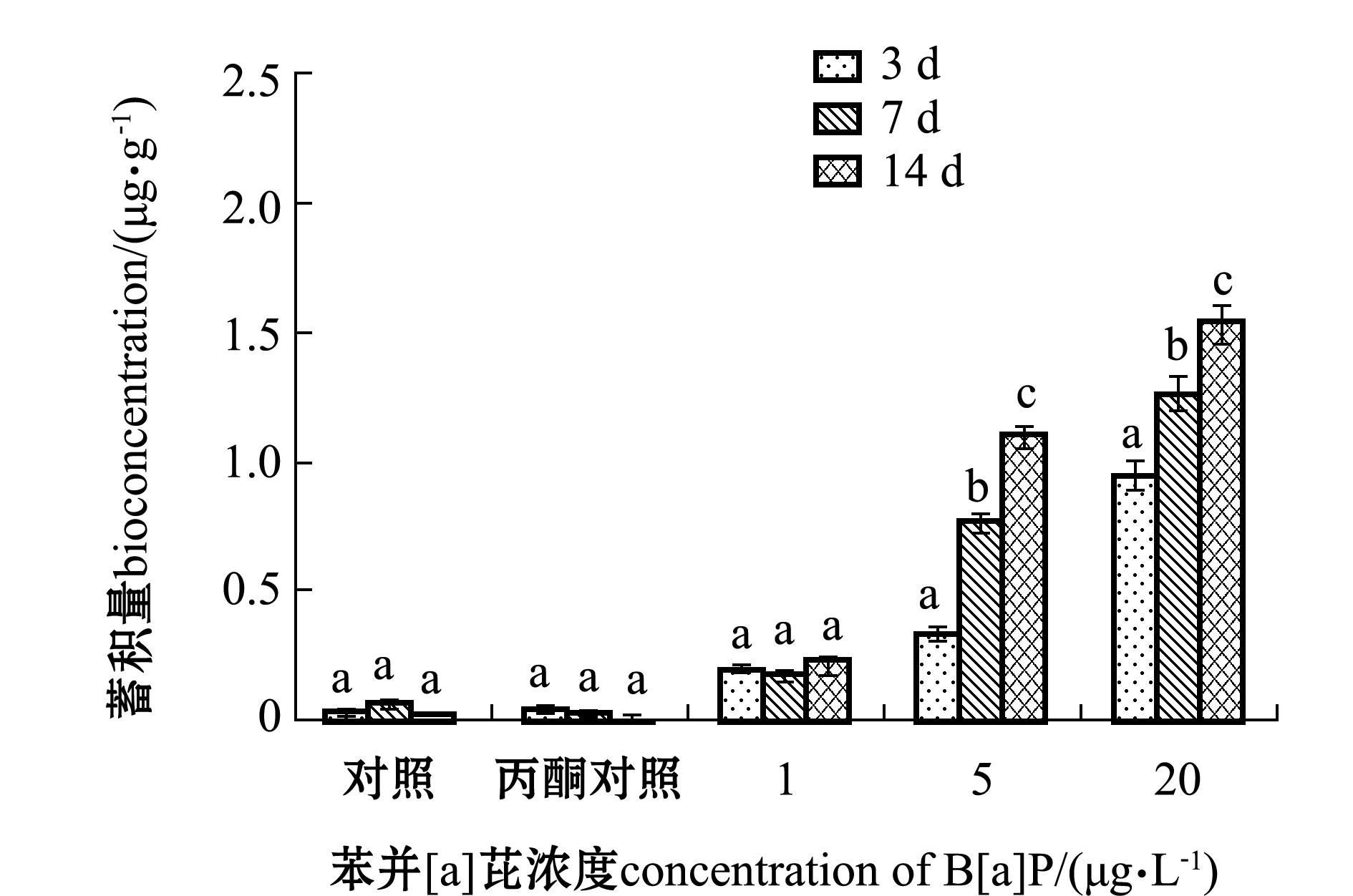
注:标有不同字母者表示同一浓度下不同时间组有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同
Note: The means with different letters in the same concentration are significant differences in different time group at the 0.05 probability level, and the means with the same letters are not significant differences, et sequentia
图2 海胆对不同浓度苯并[a]芘的生物蓄积
Fig.2 Bioaccumulation of different concentrations of benzo [a] pyrene in sea urchins
从图3和表1可见,在5 μg/L 9,10-二甲基蒽浓度下,海胆对9,10-二甲基蒽的富集量第7天与第14天间无显著性差异(P>0.05),说明海胆对9,10-二甲基蒽富集在第7天时达到了平衡。在5 μg/L 9,10-二甲基蒽浓度下,海胆符合双箱动力学模型,K1=9.93,K2=0.088,R2=0.907(95%置信区间)。在10 μg/L浓度下,随着9,10-二甲基蒽浓度的升高,9,10-二甲基蒽在海胆体内的蓄积量明显增加;第14 天时,9,10-二甲基蒽10 μg/L浓度组的富集系数明显高于其他两个浓度组;其双箱动力学模型参数分别为K1=14.05,K2=0.071,R2=0.913(95%置信区间)。在50 μg/L浓度下,海胆体内的9,10-二甲基蒽随着暴露时间的延长蓄积量也有所增长,此浓度下K1=12.88,K2=0.524,R2=0.892(95%置信区间)。
从图4和表1可见:在5 μg/L 3-甲基菲浓度下,双箱动力学模型参数K1=12.76,K2=0.063,R2=0.869(95%置信区间);在10 μg/L浓度下,3-甲基菲在海胆体内的蓄积量明显增加,但此条件下,K2=-0.033为负值,并不符合双箱动力学模型;在高浓度100 μg/L条件下,海胆体内的3-甲基菲随着暴露时间的延长蓄积量迅速增加,富集系数在第7天时已达到116.4,第14天时富集系数趋于稳定。综上得出,海胆在低浓度5 μg/L和高浓度100 μg/L时符合双箱动力学模型。
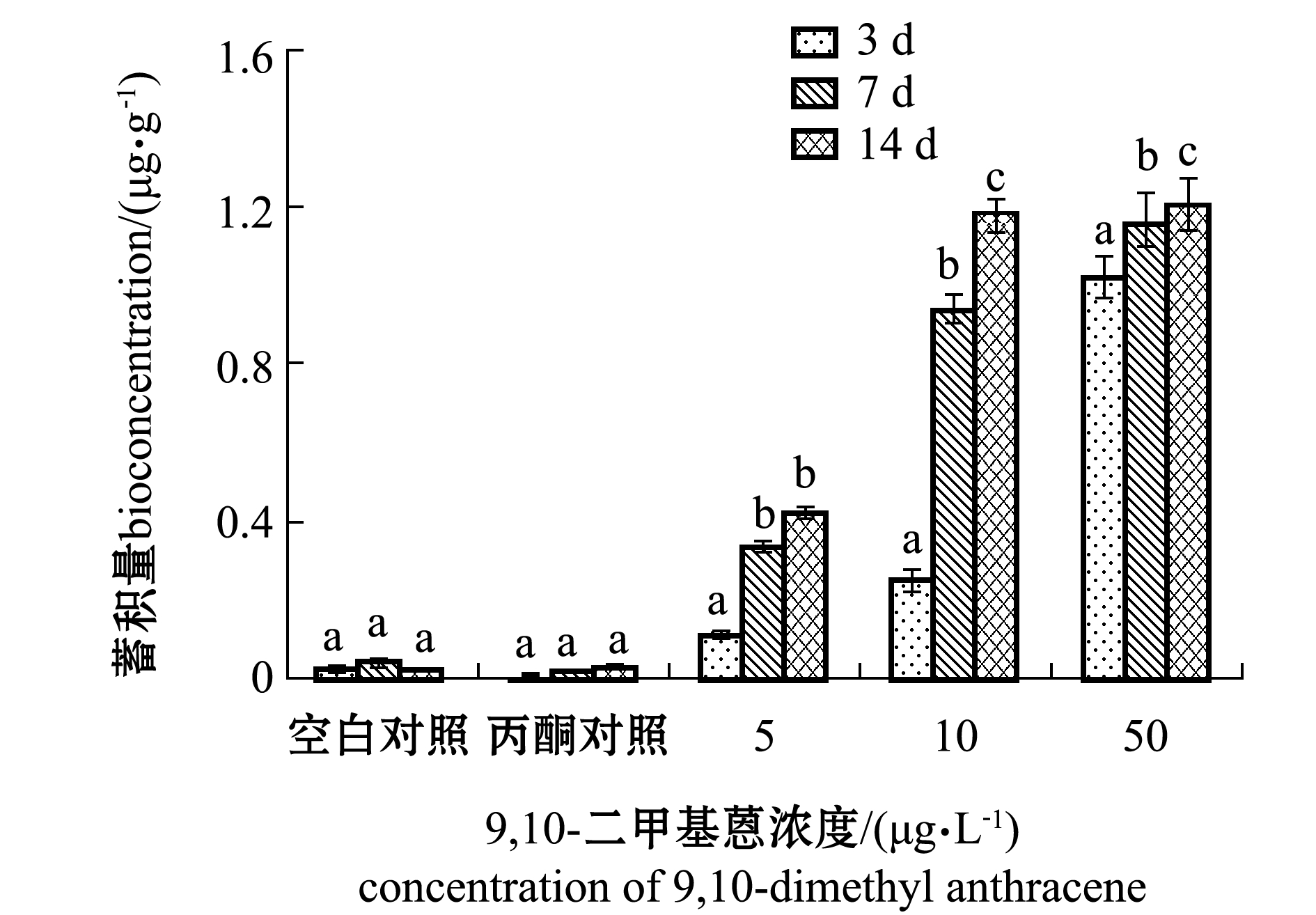
图3 海胆对不同浓度9,10-二甲基蒽的生物蓄积
Fig.3 Bioaccumulation of different concentrations of 9,10-dimethyl anthracene in sea urchin

图4 海胆对不同浓度3-甲基菲的生物蓄积
Fig.4 Bioaccumulation of different concentrations of 3-methyl phenanthrene in sea urchin
表1 3种PAHs在海胆体内3、7、14 d时的生物富集动力学参数及其富集系数
Tab.1 Bioaccumulation kinetic parameters and enrichment factors in sea urchin exposed to three PAHs in 3,7 d and 14 d
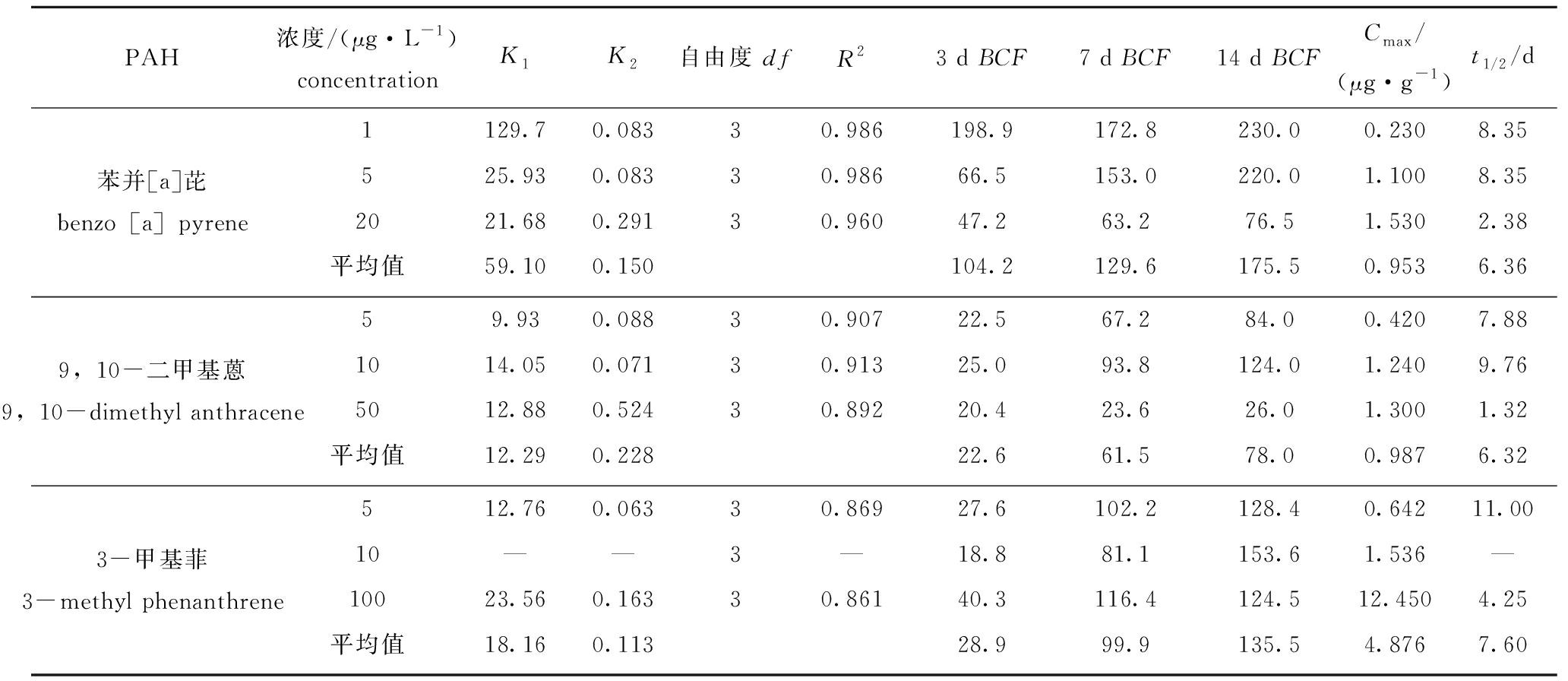
PAH浓度/(μg·L-1)concentrationK1K2自由度 dfR23 d BCF7 d BCF14 d BCFCmax/(μg·g-1)t1/2/d苯并[a]芘benzo[a]pyrene1129.70.08330.986198.9172.8230.00.2308.35525.930.08330.98666.5153.0220.01.1008.352021.680.29130.96047.263.276.51.5302.38平均值59.100.150104.2129.6175.50.9536.369,10-二甲基蒽9,10-dimethyl anthracene59.930.08830.90722.567.284.00.4207.881014.050.07130.91325.093.8124.01.2409.765012.880.52430.89220.423.626.01.3001.32平均值12.290.22822.661.578.00.9876.323-甲基菲3-methyl phenanthrene512.760.06330.86927.6102.2128.40.64211.0010——3—18.881.1153.61.536—10023.560.16330.86140.3116.4124.512.4504.25平均值18.160.11328.999.9135.54.8767.60
注:-表示无双箱模型拟合数据
Note:-means no data
海胆是大连地区拥有高经济价值和食用价值的海洋生物之一,而PAHs又是一种典型的持续性有机污染物,一旦PAHs通过各种途径进入水生生物体内,易积累于生物脂肪中,通过不断的累积形成生物富集,对生物体造成巨大的伤害[9]。苯并[a]芘、9,10-二甲基蒽、3-甲基菲是3种典型的多环芳烃,也是中国优先监测的多环芳烃。本研究结果表明,海胆能够从暴露溶液中快速吸收苯并[a]芘、9,10-二甲基蒽、3-甲基菲,第14 天时这3种PAHs最大浓度组蓄积量分别达到1.530、1.300、12.450 μg/g。同时,随着PAHs浓度的升高,海胆对3种PAHs生物富集量迅速增加,呈现指数增长趋势。低浓度(1、5、5 μg/L)条件下,海胆对3种PAHs富集需要在第14天时达到富集平衡,而在高浓度条件下(20、50、100 μg/L)需要在7天时达到吸收平衡。其原因有二:一是海胆刚暴露在3种多环芳烃水溶液中,环境水相中的PAHs迅速分配到脂质中,故初期富集量迅速增加,而后由于3种PAHs在环境水相-脂质相之间的分配逐渐达到平衡,因此,在低浓度条件下达到平衡需要时间较长(14 d),而在高浓度条件下达到平衡需要的时间较短(7 d);其次,PAHs有较高的正辛醇/水分配系数,水溶性差,具有良好的脂溶性,同时低分子量PAHs比高分子量PAHs脂溶性高,而本试验中使用了丙酮作为助溶剂,使得3种PAHs水溶性发生改变,提高了其生物可利用性。
本研究表明,海胆对3种PAHs的生物富集远比排除系数要高,因此,在14 d内主要表现为生物富集,如果进行生物排除试验研究可以进一步分析讨论对3种PAHs的代谢过程。这与其他学者的研究结果类似,如李天云[10]研究了河蚬Corbicula fluminea对太湖梅梁湾沉积物中PAHs的富集过程,发现河蚬对PAHs的生物-沉积物生物富集因子(BSAF)为0.09~0.44,其中含量最多的4种PAHs依次为芘、萘、菲和荧蒽。水生动物中,除贝类外,其他无脊椎动物(如甲壳类)虽然对PAHs有一定的代谢消除能力,但代谢速率较低,因此,其对PAHs具有很高的浓缩系数[11-16]。如李磊等[17]研究了苯并[a]芘、菲在缢蛏体内的生物富集与释放过程,发现苯并[a]芘、菲在缢蛏体内有较强的富集能力,富集过程符合双箱动力学模型。水生脊椎动物鱼类由于其代谢系统相对完善,其对PAHs的代谢消除能力较强,PAHs在鱼体内的残留量通常较无脊椎动物低,Baussant等[7,18]研究了比目鱼Scophthalmus maximus幼鱼和贻贝Mytilms edulis对PAHs的积累,结果显示,在原油中暴露一段时间后,贻贝体内PAHs与原油中更相近,而比目鱼幼鱼体内多芳环烃复杂,且放清水一段时间后,幼鱼体内多芳环烃含量明显减少。但也有报道显示,PAHs在鱼体内有较高的富集系数BCF,如朱必凤等[19]在其研究中,通过放射性同位素示踪的方法发现鲫Carassius auratus对PAHs的富集系数达到1600。本试验中由于使用了丙酮作为助溶剂大大提高了3种PAHs的水溶性,因此,生物富集能力可能得到了进一步加强。海胆与其他水生生物相比(表2),对PAHs的富集能力依次为三疣梭子蟹>棱鲻>圆海鰺≈虾夷马粪海胆>花鲈>河蚬。海胆对PAHs的富集系数为18.8~230.0,虽不属于对多芳环烃具有强富集能力的生物,但可预测海胆体内没有或者只有少量代谢途径,属于低富集能力、低代谢能力的生物,且海胆对于多芳环烃的富集系数随时间和浓度呈指数增长。由此推断,对于低浓度多芳环烃污染海域,海胆受其影响可能并不严重。但如果是高浓度多芳环烃污染海域,海胆富集能力增强,且难以代谢,会造成十分严重的后果。
表2 不同水产动物对PAHs的生物富集系数比较
Tab.2 Bioconcentration factor comparison of various aquatic animals for PAHs
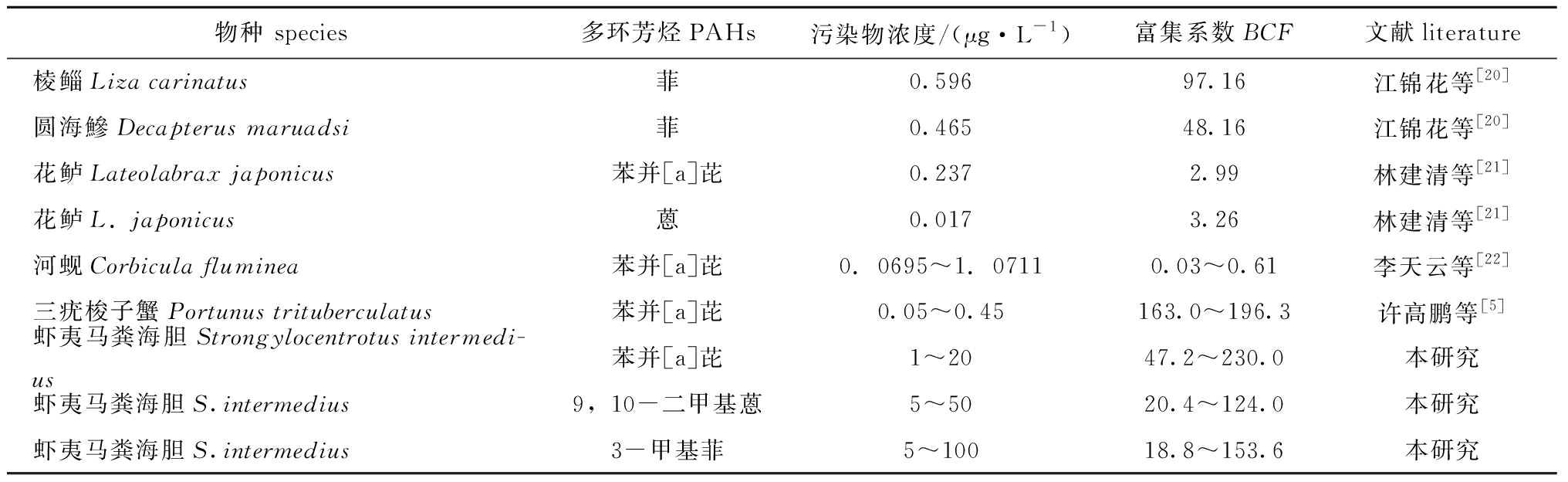
物种 species多环芳烃PAHs污染物浓度/(μg·L-1)富集系数BCF文献literature棱鲻Liza carinatus菲0.59697.16江锦花等[20]圆海鰺Decapterus maruadsi菲0.46548.16江锦花等[20]花鲈Lateolabrax japonicus苯并[a]芘0.2372.99林建清等[21]花鲈L. japonicus蒽0.0173.26林建清等[21]河蚬Corbicula fluminea苯并[a]芘0.0695~1.07110.03~0.61李天云等[22]三疣梭子蟹Portunus trituberculatus苯并[a]芘0.05~0.45163.0~196.3许高鹏等[5]虾夷马粪海胆Strongylocentrotus intermedi-us苯并[a]芘1~2047.2~230.0本研究虾夷马粪海胆S.intermedius9,10-二甲基蒽5~5020.4~124.0本研究虾夷马粪海胆S.intermedius3-甲基菲5~10018.8~153.6本研究
[1] 阎波,谭送琴,马晓芳,等.菲和镉单一及复合污染条件下在毛蚶体内的富集动力学研究[J].生态毒理学报,2017,12(3):572-578.
[2] 吕芳,詹冬梅,郭文,等.重金属镉对铜藻生长及其生物活性成分积累的影响[J].大连海洋大学学报,2017,32(6):664-670.
[3] 修蒙.多环芳烃(PAHs)在栉孔扇贝体内蓄积特征与毒性效应的研究[D].青岛:中国海洋大学,2014.
[4] 王静.栉孔扇贝对苯并芘(Benzo[a]pyrene)生物标志物筛选技术的初步研究[D].青岛:中国海洋大学,2008.
[5] 许高鹏,蒋玫,李磊,等.三疣梭子蟹体内苯并[a]芘的富集动力学[J].海洋渔业,2014,36(4):357-363.
[6] 韩奋杰,张伟杰,秦宇博,等.中间球海胆幼体及稚海胆生长性状的遗传参数估计[J].大连海洋大学,2017,32(1):145-149.
[7] Baussant T,Sanni S,Jonsson G,et al.Bioaccumulation of polycyclic aromatic compounds:1.bioconcentration in two marine species and in semipermeable membrane devices during chronic exposure to dispersed crude oil[J].Environmental Toxicology and Chemistry,2001,20(6):1175-1184.
[8] 蒋闰兰,肖佰财,禹娜,等.多环芳烃对水生动物毒性效应的研究进展[J].海洋渔业,2014,36(4):372-384.
[9] 王琳.镉-苯并[a]芘复合污染对菲律宾蛤仔毒性效应的研究[D].青岛:中国海洋大学,2010.
[10] 李天云.利用河蚬研究沉积物中有机氯农药和多环芳烃在生物体内的累积效应[D].重庆:西南大学,2008.
[11] Tse S.Uptake rates of selected polycyclic aromatic hydrocarbons (PAHs) and organochlorine pesticides by mussels and SPMDs under laboratory conditions[J].Dept of Biology & Chemistry, City University of Hong Kong,2000,26(9):504-505.
[12] Wang X H,Wang W X.Bioaccumulation and transfer of benzo(a)pyrene in a simplified marine food chain[J].Marine Ecology Progress,2006,312:101-111.
[13] 苗晶晶.苯并[a]芘对栉孔扇贝分子毒理学机制的研究[D].青岛:中国海洋大学,2010.
[14] 杨慧赞.苯并[a]芘在栉孔扇贝(Chlamys farreri)体内的毒代与毒效动力学研究[D].青岛:中国海洋大学,2008.
[15] Kahle J,Zauke G P.Bioaccumulation of trace metals in the copepodCalanoides acutus from the Weddell Sea (Antarctica):comparison of two-compartment and hyperbolic toxicokinetic models[J].Aquatic Toxicology,2002,59(1-2):115-135.
[16] Sun F H,Zhou Q X,Wang M E,et al.Joint stress of copper and petroleum hydrocarbons on the polychaetePerinereis aibuhitensis at biochemical levels[J].Ecotoxicology and Environmental Safety,2009,72(7):1887-1892.
[17] 李磊,沈新强,李超,等.苯并[a]芘、菲在缢蛏体内的生物富集与释放[J].水产学报,2015,39(7):998-1004.
[18] Baussant T,Sanni S,Skadsheim A,et al.Bioaccumulation of polycyclic aromatic compounds:2.modeling bioaccumulation in marine organisms chronically exposed to dispersed oil[J].Environmental Toxicology and Chemistry,2001,20(6):1185-1195.
[19] 朱必凤,邓少平,林志红.芳烃羟化酶与鲫鱼组织富集多环芳烃和代谢释放的关系[J].中国环境科学,1996,16(1):38-41.
[20] 江锦花,丁理法.台州湾五种海洋生物体内多环芳烃的浓度、富集特征及环境效应[J].环境污染与防治,2007,29(5):394-397.
[21] 林建清,王新红,洪华生.养殖水体中多环芳烃污染对水产品安全的影响[J].食品科学,2006,27(12):41-45.
[22] 李天云,黄圣彪,孙凡,等.河蚬对太湖梅梁湾沉积物多环芳烃的生物富集[J].环境科学学报,2008,28(11):2354-2360.