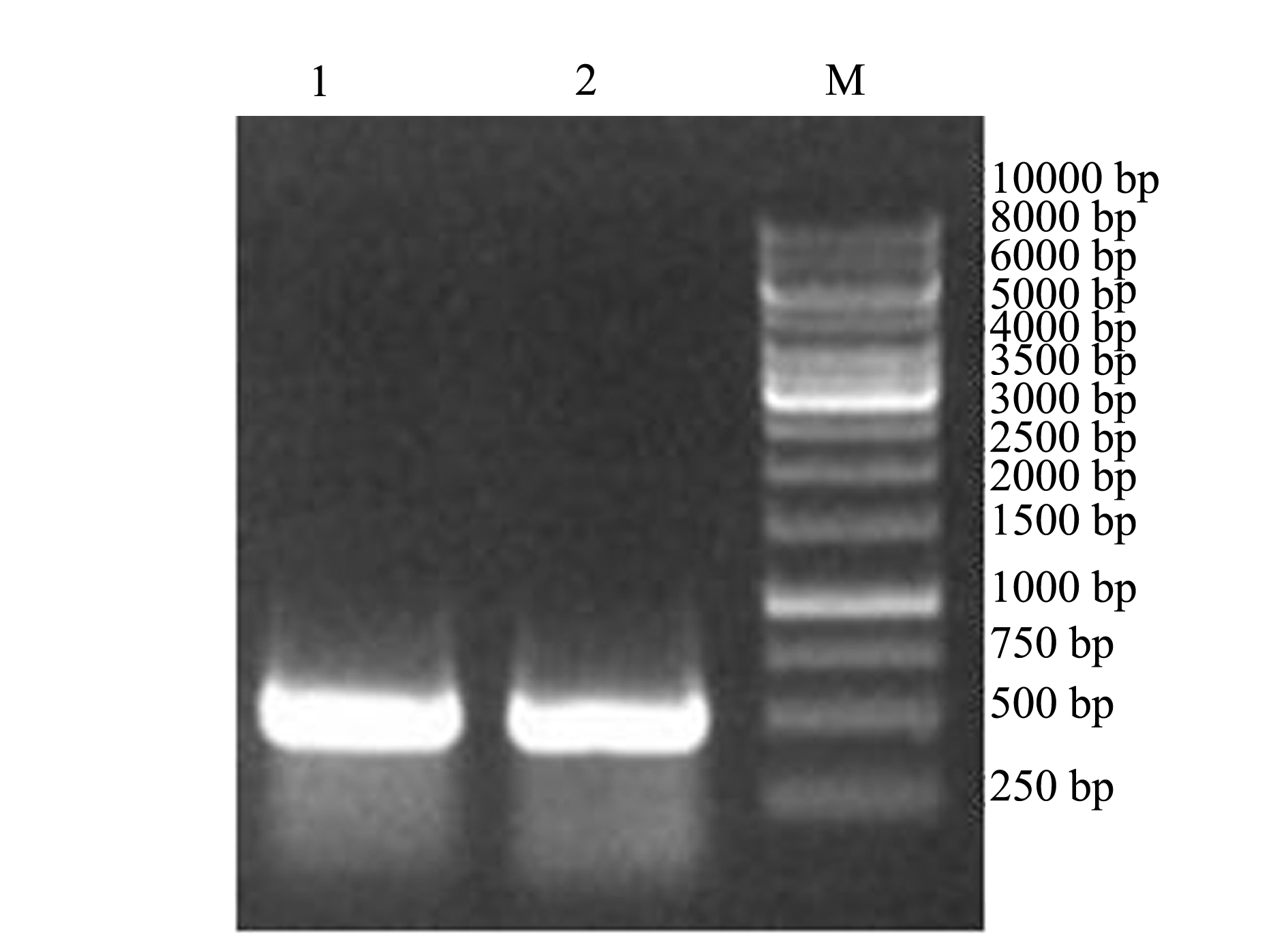
注:1、2分别为精巢组织cDNA样品;M为DL10000 Marker
Note:1 and 2,cDNA in testis;M,DL10000 Marker
图1gsdf 基因PCR 扩增产物结果
Fig.1 PCR product of zebrafishgsdf gene
性腺体衍生因子(Gonadal soma derived factor,GSDF)是TGF-β超家族中的一个特异成员,在鱼类性别决定和性别分化过程中均起着至关重要的作用。性腺体衍生因子基因gsdf最初从虹鳟Oncorhynchus mykiss性腺中分离出来,并发现该基因定位于性腺体细胞, 主要在雄性精原细胞周围的支持细胞、雌性卵原细胞和卵黄前体的卵母细胞周围的颗粒细胞表达,且在精巢的表达高于卵巢[1]。gsdf基因在硬骨鱼类中是保守存在的,其仅在性腺中表达,目前,在虹鳟[1]、日本青鳉Oryzias latipes[2]、三斑海猪鱼Halichoeres trimaculatus[3]、斑马鱼Danio rerio[4]、鲑鱼[5]等中均已克隆得到了gsdf基因。在青鳉中,gsdf基因作为Dmy下游基因对睾丸的早期分化起着至关重要的作用[2],纯合的gsdf-/-突变体青鳉能导致XY性腺往卵巢方向分化,表明gsdf基因在青鳉睾丸发育过程中起到内源性诱导作用[6-7]。同时也有研究表明,gsdf基因对减数分裂过程中生殖细胞的增殖和分化有重要的影响[8]。
斑马鱼具有繁殖力强、体外受精和发育、胚胎透明、性成熟周期短、个体小易养殖等诸多特点,特别是可以进行大规模的正向基因饱和突变与筛选。这些特点使其成为功能基因组时代生命科学研究中重要的模式脊椎动物之一。gsdf基因对于硬骨鱼睾丸分化是至关重要的,但对gsdf基因在斑马鱼早期睾丸分化过程中的研究尚缺乏相关报道。为进一步研究gsdf基因在斑马鱼早期精巢发育过程中的作用和分子调控机制,本研究中首次构建了以小鼠gamma-crystalin启动子启动的斑马鱼gsdf基因与增强型绿色荧光蛋白(Enhanced green flourence protein,EGFP)基因融合的表达质粒Crystal-pro-gsdf-2A-egfp,通过具有自我剪切功能的2A肽序列剪切成GSDF蛋白和绿色荧光蛋白(Green fluorescent protein,GFP),最终成功获得和建立了能稳定遗传和过表达gsdf基因的转基因斑马鱼模型,旨在为研究gsdf基因在斑马鱼雄性发育分子调控机制等方面的作用提供相关生物学数据资料。
野生型斑马鱼购自北京中国科学院遗传与发育生物学研究所,并置于教育部水产种质资源发掘与利用重点实验室的循环水养殖系统中饲养,水温为(28.0±0.5)℃,pH 为7.0~7.2,盐度为0.50~0.53,采用光控系统控制光照周期(黑暗10 h,光照14 h),投喂孵化的丰年虫Artemia salina,便于斑马鱼生长和繁殖产卵。
试验试剂:In-Fusion HD Cloning Kits(Clontech)、反转录试剂盒PrimeScriptTM RT reagent Kit with gDNA Eraser (Perfect Real Time)和PCR扩增试剂盒均购自TaKaRa公司,质粒测序工作由生工生物工程(上海)股份有限公司完成;凝胶回收试剂盒、各种限制性内切酶均购自TaKaRa公司;Crystal-pro-egfp表达质粒由教育部水产种质资源发掘与利用重点实验室保存;大肠杆菌Escherichia coli DH5α感受态细胞购自北京全式金公司;质粒小提试剂盒(Plasmid Mini Kit)和质粒去内毒素中量提取试剂盒(Endo-Free Plasmid Midi Kit)购自OMEGA生物公司。
试验仪器:凝胶成像系统为 Amersham Imager 600;电泳仪购自 Bio-Rad 公司;显微注射仪器为Eppendorf公司产品;倒置荧光生物显微镜购自日本Nikon公司。
1.2.1 生物信息学分析 通过 Ensemble(http://asia.ensembl.org/index.html)网站获得斑马鱼gsdf基因的核苷酸序列、氨基酸序列、cDNA,以及外显子和内含子位置信息,并通过NCBI(http://www.ncbi.nlm.nih.gov/)网站对斑马鱼gsdf基因信息进行补充和核实,通过 ZFIN(http://zfin.org/)网站对基因功能进一步了解,采用Vector NTI 软件对测序结果与目的基因片段进行比对。
1.2.2 引物设计及合成 首先在 NCBI 数据库中查找到斑马鱼的gsdf基因和2A基因,并运用该数据库中的Primer design功能对其编码序列进行引物设计。由于运用In-Fusion克隆技术,其基础是Clontech的In-Fusion专利酶,此酶通过识别DNA片段和线性化载体末端15 bp同源序列将DNA片段和线性化载体高效精确地融合在一起,根据此原理设计得到gsdf基因的上、下游引物:
gsdf-F:5′cttcccatcgattcggcatatgctgctgcgcctcgtcc 3′;
gsdf-R:5′ttgtggcacctgaccccggagggctcatggctg 3′。扩增其编码区片段长度为546 bp。
2A基因的上、下游引物:
2A-F:5′cagccatgagccctccggggtcaggtgccacaa 3′;
2A-R:5′cgcccttgctcaccatgggcccagggttttcttc 3′。
扩增片段长度为109 bp。引物均由生工生物工程(上海)股份有限公司合成。
1.2.3 斑马鱼gsdf 基因和2A基因的扩增 由于gsdf基因主要在斑马鱼精巢中表达,提取斑马鱼精巢总 RNA,逆转录合成cDNA,以该 cDNA 为模板,进行斑马鱼gsdf基因和2A基因的PCR 扩增。反应体系为:模板 cDNA 1 μL,上、下游引物(10 μmol/L)各1 μL,DNA 聚合酶 2 × Ex TaqMasterMix 12.5 μL,用ddH2O补足至总体系为 25 μL。PCR产物经10 g/L 琼脂糖凝胶电泳鉴定,并于4 ℃下保存。
1.2.4 Crystal-pro-gsdf-2A-egfp表达载体的构建 斑马鱼gsdf基因和2A基因的PCR产物和报告质粒载体Crystal-pro-egfp片段采用胶回收后并纯化,使用Clontech公司的In-Fusion HD Cloning Kits试剂盒,按照使用说明书,建立反应体系为5 μL,在50 ℃水浴锅中水浴15 min。连接产物转化至感受态大肠杆菌中,并涂布于固体 LB 培养基(含氨苄西林100 mg/L)中过夜。挑取单菌落于LB 液体培养基(含氨苄西林100 mg/L)中培养12~16 h,用质粒小量提取试剂盒(Plasmid Mini Kit,OMEGA)提取质粒后,采用PCR鉴定,取阳性克隆进行EcoR I、IsecI酶切验证,酶切产物送至生工生物工程(上海)股份有限公司测序。测序结果正确的质粒命名为Crystal-pro-gsdf-2A-egfp,采用质粒去内毒素中量提取试剂盒(Endo-Free Plasmid Midi Kit,OMEGA)提取质粒后用于显微注射。
1.2.5 斑马鱼胚胎的显微注射和维持 注射前1 d准备好显微注射用针,将进口毛细玻璃管(TW100F-4,WPI 公司)放置垂直拉针仪加热环中央,通过重力作用和加热原理,将玻璃管分成两个针头,将针头放置磨针仪中央,缓慢旋转螺母,直至看到针头倒影,缓慢下移与磨板接触并成45°角,50 s后可见针头磨成有一个斜面,即可使用。将性成熟的雌、雄亲鱼按1∶1比例放入产卵盒中交配,收集受精卵,用无菌水清洗后转移至15 g/L琼脂糖的表面皿中,将构建好的质粒浓度稀释为50 ng/μL,在受精后20 min开始显微注射,注射至斑马鱼受精胚胎1细胞期的动物极中。注射后的受精卵放入盛有无菌水的培养皿中,置于恒温箱(28.0 ℃±0.5 ℃)中培养,分别在1~3 dpf (days post fertilization)使用倒置荧光显微镜观察并筛选眼部晶状体有特异性绿色荧光表达的胚胎。
由于gsdf基因主要在斑马鱼精巢组织中表达,提取斑马鱼精巢总RNA,逆转录合成 cDNA,以其为模板,PCR 扩增得到gsdf基因的编码区,PCR产物经10 g/L琼脂糖凝胶电泳检测,结果表明,在 500 bp 附近有一特异性明亮条带,其大小与预期546 bp 相符(图1);2A基因PCR产物的琼脂糖凝胶电泳结果与预期109 bp相符(图2)。

注:1、2分别为精巢组织cDNA样品;M为DL10000 Marker
Note:1 and 2,cDNA in testis;M,DL10000 Marker
图1gsdf 基因PCR 扩增产物结果
Fig.1 PCR product of zebrafishgsdf gene
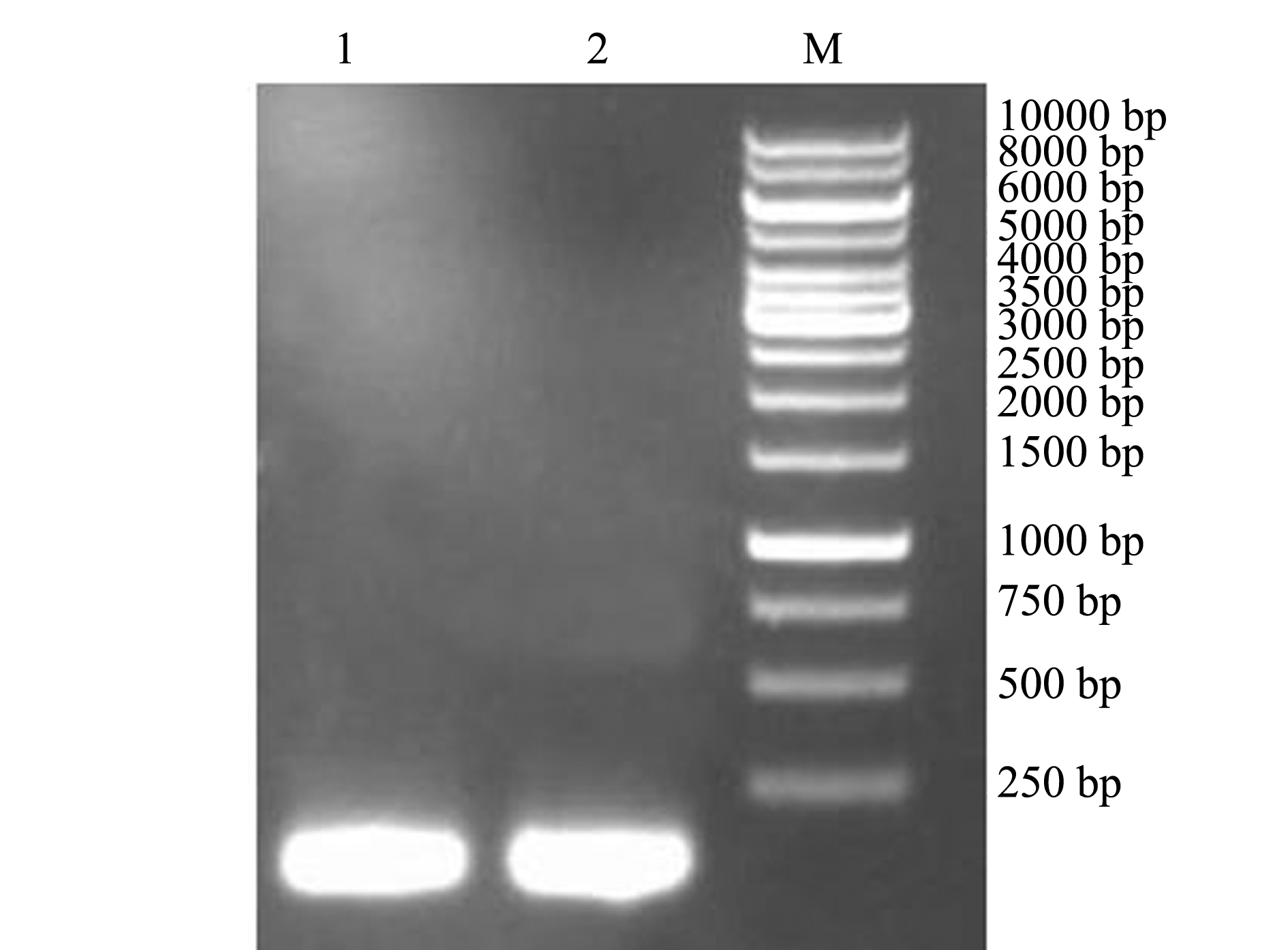
注:1、2分别为精巢组织cDNA样品;M为DL10000 Marker
Note:1 and 2,cDNA in testis;M,DL10000 Marker
图2 2A基因PCR 扩增产物结果
Fig.2 PCR product of zebrafish 2A gene
对P817-egfp载体和割胶回收的斑马鱼gsdf基因和2A肽基因的PCR产物采用Clontech的In-Fusion无缝连接产品进行连接,连接产物转化至E.coli DH5α 感受态细胞中,挑取阳性克隆进行菌落 PCR 验证(图3),菌株1~3号均扩增出与预期大小一致的目的基因条带。挑取其中菌株1和2保存菌种后提取质粒。
将重组质粒Crystal-pro-gsdf-2A-egfp分别进行EcoR I和IsecI酶切验证。挑选的阳性克隆质粒1和2的酶切结果中均有与目的基因大小一致的条带。同时,将这两个阳性克隆测序,通过vector NTI 软件对测序结果与目标基因片段进行比对,结果完全一致,本研究中将此重组表达质粒命名为Tg(Crystal-pro-gsdf-2A-egfp)。

注:1、2、3分别为3个重组质粒菌落样品,M为DL10000 Marker
Note:1,2 and 3,recombinant plasmid colony;M,DL10000 Marker
图3 重组质粒Crystal-pro-gsdf-2A-egfp的菌落 PCR电泳结果
Fig.3 PCR product of recombinant plasmid Crystal-pro-gsdf-2A-egfp inE.coli DH5α
将构建好的重组质粒Crystal-pro-gsdf-2A-egfp(图4)浓度稀释为50 ng/μL,通过显微注射技术注射至斑马鱼受精胚胎1细胞期的动物极中。
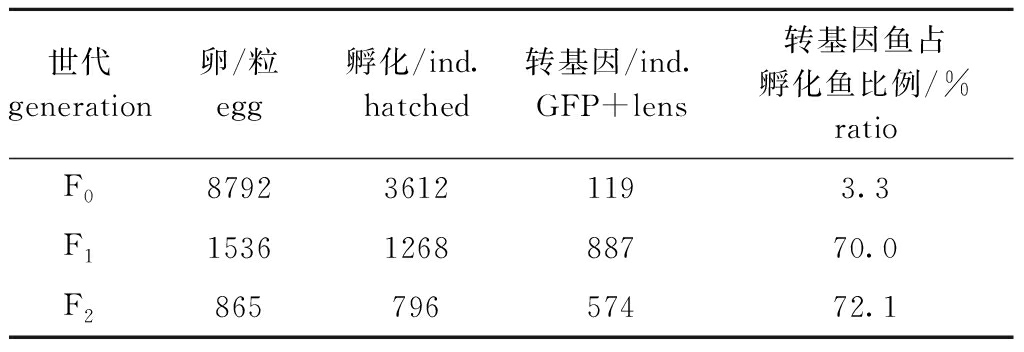
试验中注射了8792个胚胎,有绿色荧光蛋白(GFP)表达的性成熟的嵌合体转基因斑马鱼共119尾。其中,有17尾可将egfp基因遗传给下一代,即生殖系嵌合体转基因斑马鱼,嵌合子F0代,其与野生型(WT)斑马鱼杂交得到F1代,饲养至性成熟的F1代与野生型斑马鱼杂交得到F2代,转基因的效率统计结果如表1所示。
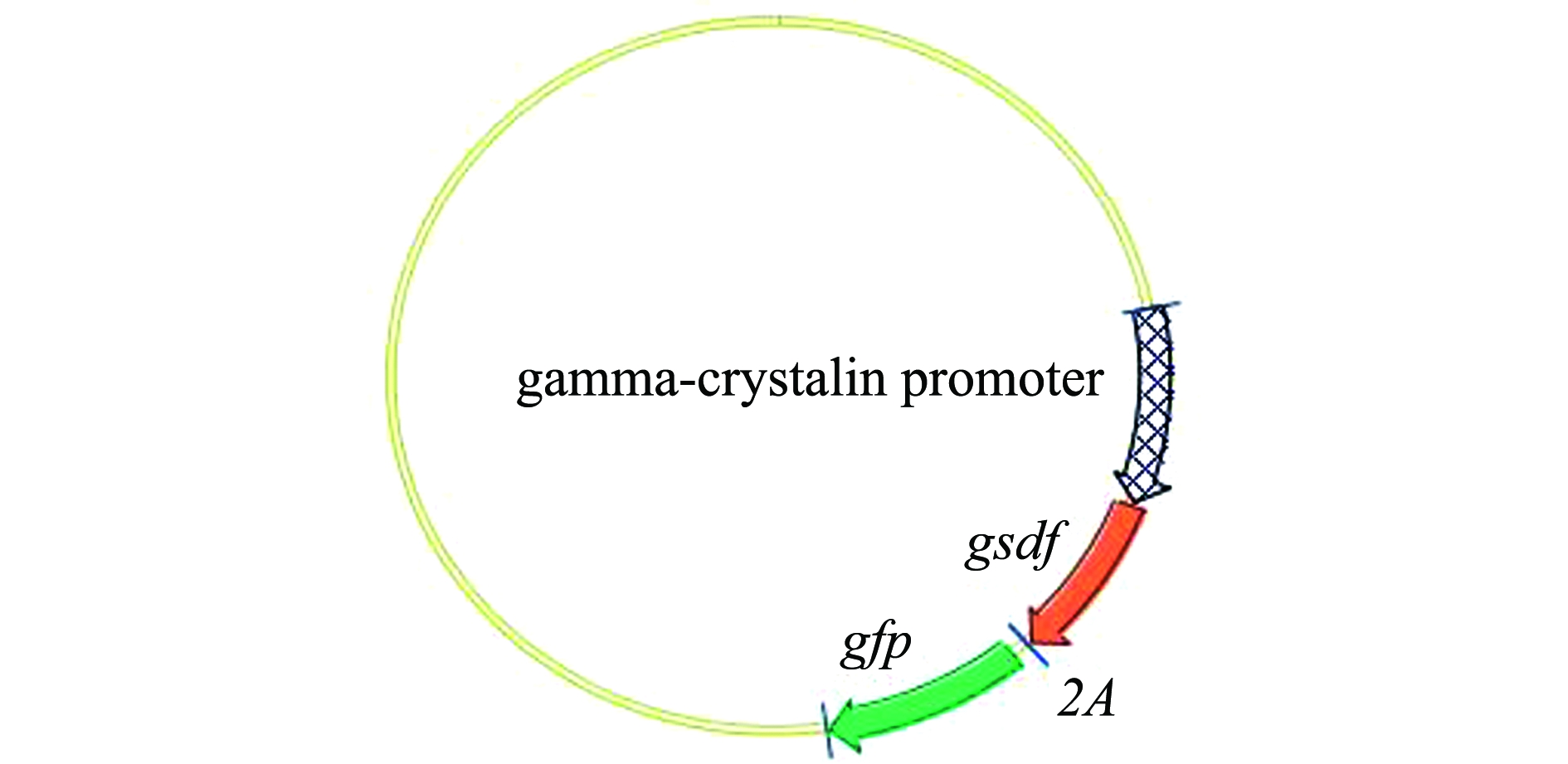
图4 重组质粒Crystal-pro-gsdf-2A-egfp图谱
Fig.4 Map of recombinant plasmid Crystal-pro-gsdf-2A-egfp
表1 gsdf斑马鱼转基因效率统计结果
Tab.1 Statistics of gsdf zebrafish transgene efficiency
世代generation卵/粒egg孵化/ind.hatched转基因/ind.GFP+lens转基因鱼占孵化鱼比例/%ratioF0879236121193.3F11536126888770.0F286579657472.1
由于重组质粒Tg(Crystal-pro-gsdf-2A-egfp)的启动子是一段小鼠的晶体蛋白基因,在眼部晶状体特异性表达,因此,通过倒置荧光显微镜观察,如斑马鱼眼部晶状体有特异性绿色荧光即为目的基因gsdf表达的转基因鱼。观察发现,F0代胚胎眼部晶状体有特异性绿色荧光,即嵌合体(图5)。
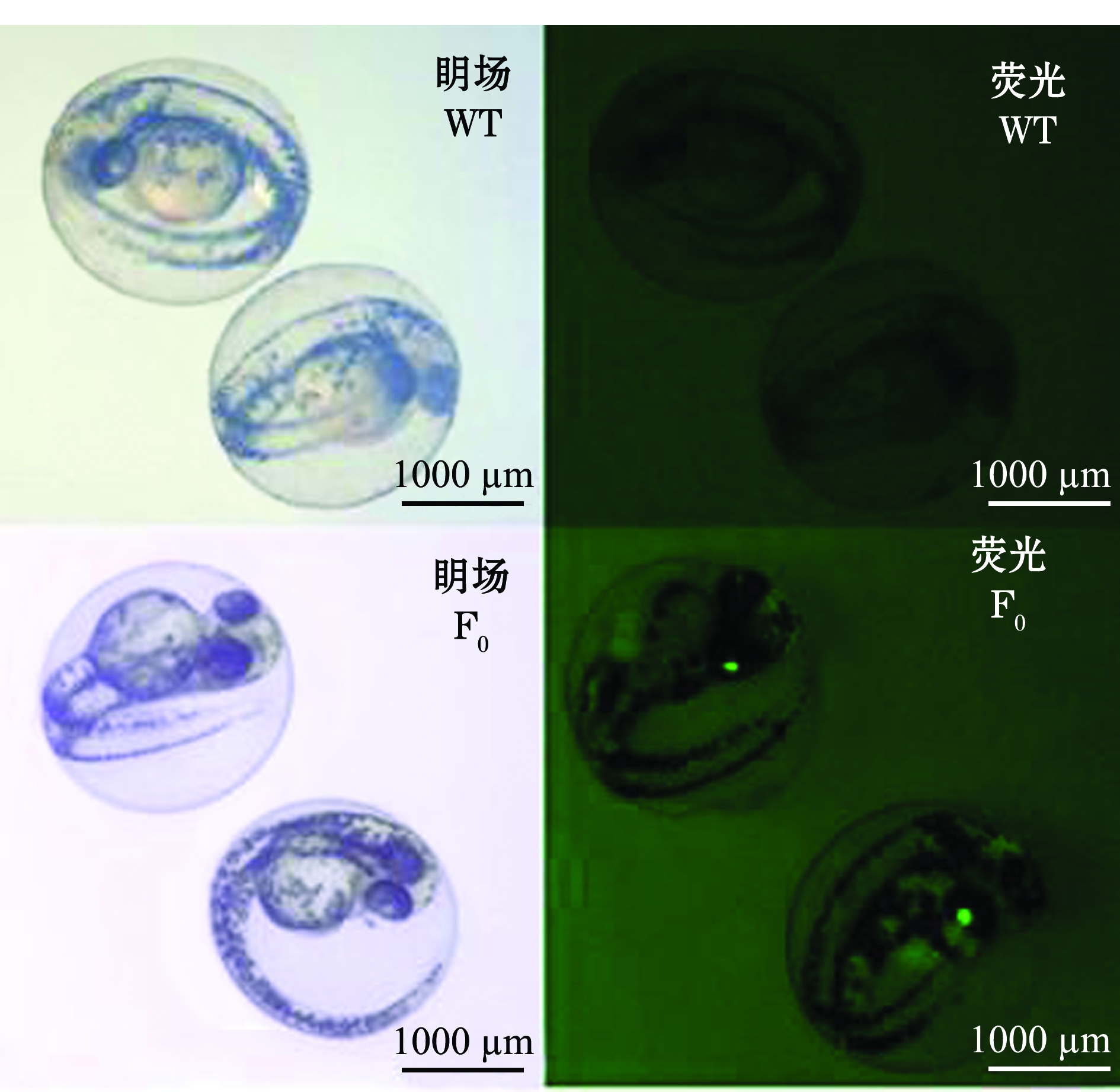
图5gsdf转基因F0代与野生型(WT)斑马鱼胚胎的眀场、绿色荧光显微图
Fig.5 Bright and fluorescence micrography of embryos ingsdf transgenic F0 generation and wild-type (WT) zebrafish
通过F0代嵌合体与野生型(WT)斑马鱼杂交,获得眼部晶状体有特异性绿色荧光的F1代,如图6所示。 F1代中眼部晶状体有特异性绿色荧光的个体与野生型斑马鱼(WT)杂交,获得眼部晶状体有特异性绿色荧光的F2代,如图7所示。
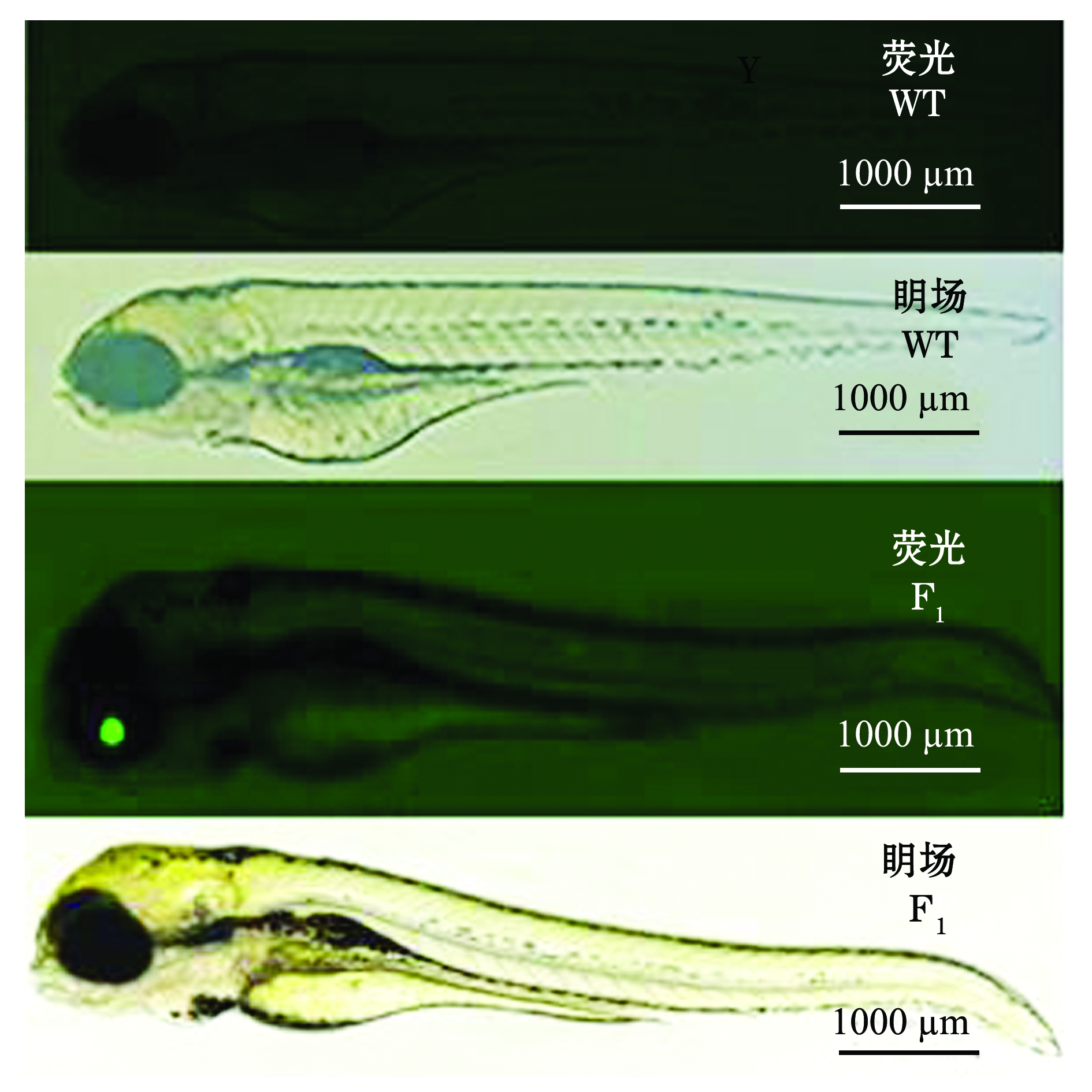
图6gsdf转基因F1代与野生型(WT)斑马鱼的眀场、绿色荧光显微图
Fig.6 Bright and fluorescence micrography of embryos ingsdf transgenic F1 generation and wild-type (WT) zebrafish
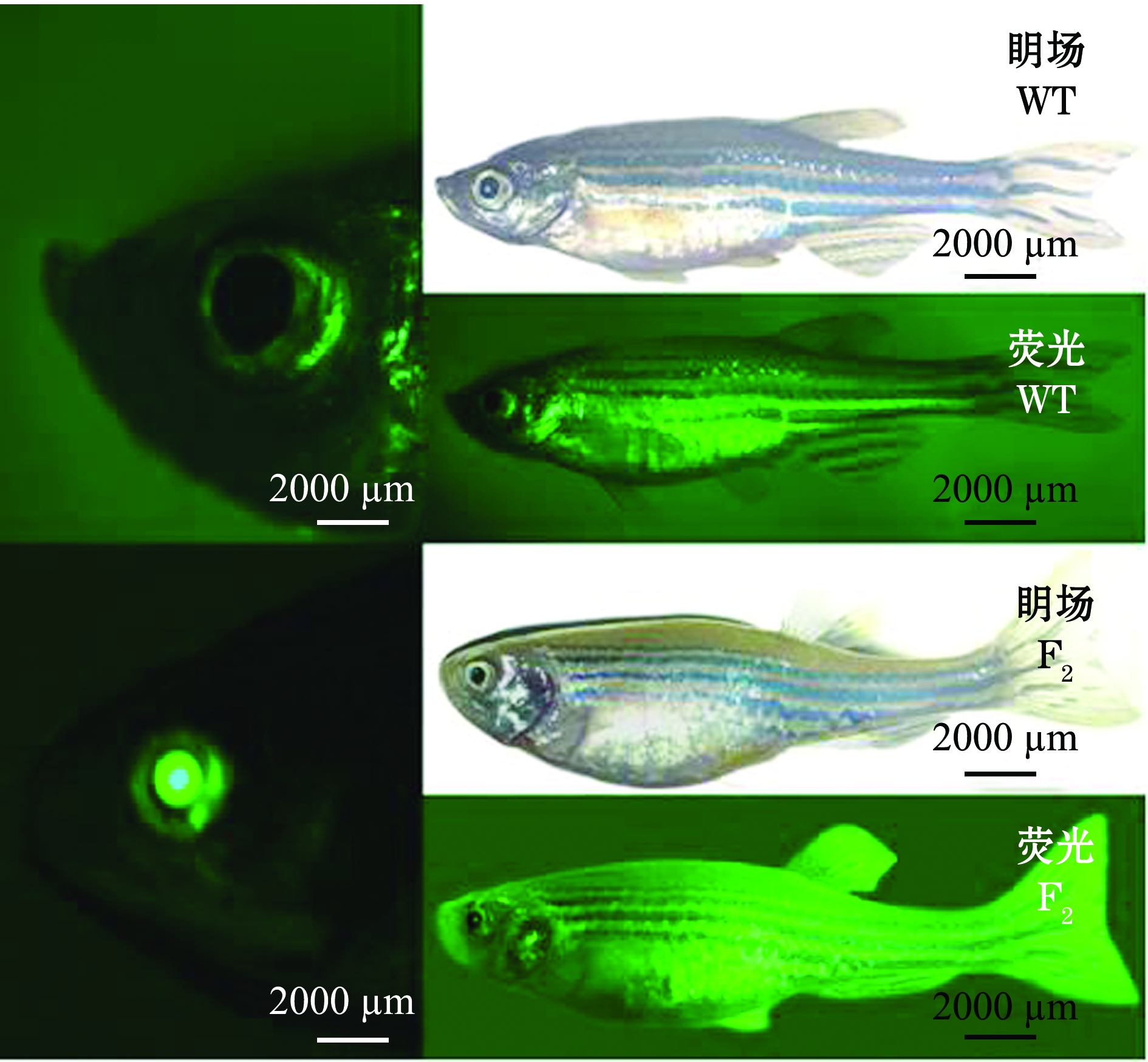
图7gsdf转基因F2代与野生型(WT)斑马鱼的眀场、绿色荧光显微图
Fig.7 Bright and fluorescence micrography of embryos ingsdf transgenic F2 generation and wild-type (WT) zebrafish
本试验结果表明,gsdf基因能在斑马鱼的眼部晶状体中特异表达并稳定遗传,这表明在斑马鱼上成功构建了gsdf基因转基因品系,从而为观察和研究gsdf基因在斑马鱼雄性发育中的具体分子机制提供了良好的试验模型,同时也为深入研究斑马鱼雄性性腺发育提供了重要的生物学资料。
2A自切割肽(2A)于1991年在口蹄疫病毒(FMDV)中发现,是一种寡肽,通常由19~22个氨基酸组成[9]。口蹄疫病毒的2A自切割肽通过自我切割产生成熟的病毒蛋白,切割位点位于其C端的最后一个甘氨酸和2B下游蛋白的第一个脯氨酸之间[10-11]。迄今为止,已经成功地从许多病毒mRNA分子中鉴定出2A样序列,包括猪瘟病毒-1 2A(P2A)、马鼻炎A病毒2A(E2A)、细胞质多角体病毒(BmCPV 2A)和软化病病毒(BmIFV 2A)等。2A肽具有许多优点: 2A分子量较小,较容易在切割多种蛋白质的同时尽量减少它们失去功能的可能性; 2A的切割活性仅依赖于核糖体,故与2A连接的蛋白质可以在所有的细胞类型中表达等。由于2A在真核生物中的结构高度保守[12],因此,基于2A序列的多基因表达系统(MGES)已被广泛应用在创建新的功能性或具有抗性的植物和动物研究中[13]。此外,研究人员已经使用2A序列来研究基因在小鼠[14]、斑马鱼[15]、猪[16]和绵羊[17]中的功能。
本研究中首次以小鼠gamma-crystalin为启动子,在斑马鱼上成功建立了Tg(Crystal-pro-gsdf-2A-egfp)转基因模型,发现斑马鱼的眼部晶状体有绿色荧光,表明小鼠gamma-crystalin能够驱动GSDF-2A-GFP融合蛋白在斑马鱼眼部晶状体表达,说明斑马鱼和哺乳动物小鼠间的晶状体存在高度的组织相似性,该研究目前国内外尚未有相关报道。利用GFP绿色荧光在斑马鱼眼部晶状体中的表达,便于直观和快捷地对gsdf转基因斑马鱼进行筛选,为后期对转基因斑马鱼的鉴定工作节省了时间。
自然界中,从低等生物到高等生物,雌雄的性别分化是一种较为普遍的现象,生物界实现性别差异的途径有许多种,其过程也相当复杂。在雌雄异体的硬骨鱼类中,表型性别可以通过遗传(基因型性别决定,GSD)或环境决定[18]。斑马鱼是一种主要的模式生物,但当前对于斑马鱼的性别决定机制还不是非常清楚。在驯化的斑马鱼中,性别决定似乎是受多基因和多种遗传因素影响的,并且还受到环境因素的影响。在目前的研究中,野生斑马鱼的基本性别决定似乎受到ZZ/ZW遗传系统的调控,但所涉及的基因尚未确定[19]。与此同时,一些研究表明,最常用的驯养斑马鱼品系不受任何主要的遗传性决定因素影响,而是依靠一种多基因遗传系统的调控[20-21],幼年时期的斑马鱼被归类为雌雄同体,在这个发育期间,性腺是双向的[22]。斑马鱼的性别在此阶段具有可塑性,Gautier等[23]研究表明,gsdf基因在斑马鱼双向性腺未分化之前就已经表达并仅限于在性腺中表达,这种表达是可检测的。在罗非鱼Oreochromis mossambicus中,gsdf基因是第一个在XY性腺分化的关键时期中表现出双向性腺形态的基因,在雄性决定和分化中起着重要的作用[6],但在斑马鱼中gsdf基因在双向性腺阶段发挥的具体作用尚不可知。在经历此阶段后,成为雄性个体的卵母细胞将通过凋亡过程而失去,而雌性的卵母细胞会继续成熟[24]。本研究中构建的Tg(Crystal-pro-gsdf-2A-egfp)模型可以用来研究gsdf基因在斑马鱼双性腺雌雄同体时期的作用。
gsdf基因的表达也受到外部环境的影响,据报道,高温能激活gsdf基因的表达与睾丸分化的启动[25]。本研究中建立的Tg(Crystal-pro-gsdf-2A-egfp)模型可以用来研究gsdf基因的过表达在不同温度条件下对雄性发育的影响,近期有研究表明,通过gsdf基因遗传功能丧失研究和启动子分析,gsdf基因为尼罗罗非鱼雄性通路中dmrt1的下游基因,是睾丸分化所必需的,并且似乎通过抑制雌激素产生而起作用[26],因此,本研究中构建的该转基因模型可以用来研究gsdf基因在斑马鱼的过表达与其他生殖相关基因的关系。随着研究内容的不断丰富,近期有研究人员发现,在斑马鱼中,gsdf基因能调节卵巢卵泡成熟和类固醇物质合成,同时,对肥胖、糖尿病和雌性生育力相关基因的表达也有调节作用,因此,其可以作为模拟人类多囊卵巢综合征(PCOS)的卵巢和卵巢外表型的模型,用来研究相关TGF-β信号分子与人类多囊卵巢综合征的病因关系[27]。
如今,转基因斑马鱼在生物医学研究、疾病模型构建、药物筛选等领域中发挥着越来越重要的作用[28]。本研究中首次在斑马鱼上构建了以小鼠gamma-crystalin启动子启动的Tg(Crystal-pro-gsdf-2A-egfp)荧光素酶报告质粒,通过倒置荧光显微镜观察斑马鱼眼部晶状体有特异性绿色荧光即可筛选出含有目的基因表达的斑马鱼个体,具有方便、快速和高效等优点,提高了建立转基因斑马鱼模型的效率。
综上所述,在斑马鱼上建立Tg(Crystal-pro-gsdf-2A-egfp)转基因品系,为研究和观察gsdf基因在斑马鱼精巢发育过程和分子调控机制方面的作用提供了新的方法。同时为研究外部环境对斑马鱼生殖的影响和研究与其生殖相关基因的功能提供了较好的模型。
[1] Sawatari E,Shikina S,Takeuchi T,et al.A novel transforming growth factor-β super family member expressed in gonadal somatic cells enhances primordial germ cell and spermatogonial proliferation in rainbow trout (Oncorhynchus mykiss)[J].Developmental Biology,2007,301(1):266-275.
[2] Shibata Y,Paul P B,Suzuki A,et al.Expression of gonadal soma derived factor (GSDF) is spatially and temporally correlated with early testicular differentiation in medaka[J].Gene Expression Patterns,2010,10(6):283-289.
[3] Horiguchi R,Nozu R,Hirai T,et al.Characterization of gonadal soma-derived factor expression during sex change in the protogynous wrasse,Halichoeres trimaculatus[J].Developmental Dynamics,2013,242(4):388-399.
[4] Gautier A,Sohm F,Joly J S,et al.The proximal promoter region of the zebrafishgsdf gene is sufficient to mimic the spatio-temporal expression pattern of the endogenous gene in sertoli and granulosa cells[J].Biology of Reproduction,2011,85(6):1240-1251.
[5] Luckenbach J A,Iliev D B,Goetz F W,et al.Identification of differentially expressed ovarian genes during primary and early secondary oocyte growth in coho salmon,Oncorhynchus kisutch[J].Reproductive Biology and Endocrinology,2008,6:2.
[6] Imai T,Saino K,Matsuda M.Mutation of gonadal soma-derived factor induces medaka XY gonads to undergo ovarian development[J].Biochemical and Biophysical Research Communications,2015,467(1):109-114.
[7] Zhang X,Guan G J,Li M Y,et al.Autosomalgsdf acts as a male sex initiator in the fish medaka[J].Scientific Reports,2016,6:19738.
[8] Kaneko H,Ijiri S,Kobayashi T,et al.Gonadal soma-derived factor (gsdf),a TGF-beta superfamily gene,induces testis differentiation in the teleost fishOreochromis niloticus[J].Molecular and Cellular Endocrinology,2015,415:87-99.
[9] Ryan M D,King A M Q,Thomas G P.Cleavage of foot-and-mouth disease virus polyprotein is mediated by residues located within a 19 amino acid sequence[J].Journal of General Virology,1991,72(11):2727-2732.
[10] Donnelly M L L,Luke G,Mehrotra A,et al.Analysis of the aphthovirus 2A/2B polyprotein ‘cleavage’ mechanism indicates not a proteolytic reaction,but a novel translational effect:a putative ribosomal ‘skip’[J].Journal of General Virology,2001,82(5):1013-1025.
[11] Atkins J F,Wills N M,Loughran G,et al.A case for ‘StopGo’:reprogramming translation to augment codon meaning of GGN by promoting unconventional termination (Stop) after addition of glycine and then allowing continued translation (Go)[J].RNA,2007,13(6):803-810.
[12] Minskaia E,Nicholson J,Ryan M D.Optimisation of the foot-and-mouth disease virus 2A co-expression system for biomedical applications[J].BMC Biotechnology,2013,13:67.
[13] Ha S H,Liang Y S,Jung H,et al.Application of two bicistronic systems involving 2A and IRES sequences to the biosynthesis of carotenoids in rice endosperm[J].Plant Biotechnology Journal,2010,8(8):928-938.
[14] Trichas G,Begbie J,Srinivas S.Use of the viral 2A peptide for bicistronic expression in transgenic mice[J].BMC Biology,2008,6(1):40.
[15] Dempsey W P,Fraser S E,Pantazis P,et al.PhOTO zebrafish:a transgenic resource forin vivo lineage tracing during development and regeneration[J].PLoS One,2012,7(3):e32888.
[16] Deng W,Yang D S,Zhao B T,et al.Use of the 2A peptide for generation of multi-transgenic pigs through a single round of nuclear transfer[J].PLoS One,2011,6(5):e19986.
[17] Tian Y Z,Li W R,Wang L Q,et al.Expression of 2A peptide mediated tri-fluorescent protein genes were regulated by epigenetics in transgenic sheep[J].Biochemical and Biophysical Research Communications,2013,434(3):681-687.
[18] Devlin R H,Nagahama Y.Sex determination and sex differentiation in fish:an overview of genetic,physiological,and environmental influences[J].Aquaculture,2002,208(3-4):191-364.
[19] Wilson C A,High S K,McCluskey B M,et al.Wild sex in zebrafish:loss of the natural sex determinant in domesticated strains[J].Genetics,2014,198(3):1291-1308.
[20] Liew W C,Orban L.Zebrafish sex:a complicated affair[J].Briefings in Functional Genomics,2014,13(2):172-187.
[21] Anderson J L,Rodriguez M A,Braasch I,et al.Multiple sex-associated regions and a putative sex chromosome in zebrafish revealed by RAD mapping and population genomics[J].PLoS One,2012,7(7):e40701.
[22] Rodriguez M A,Yan Y L,Bremiller R A,et al.Characterization and expression pattern of zebrafish Anti-Mullerian hormone (Amh) relative tosox9a,sox9b,andcyp19a1a,during gonad development[J].Gene Expression Patterns,2005,5(5):655-667.
[23] Gautier A,Le Gac F,Lareyre J J.Thegsdf gene locus harbors evolutionary conserved and clustered genes preferentially expressed in fish previtellogenic oocytes[J].Gene,2011,472(1-2):7-17.
[24] Uchida D,Yamashita M,Kitano T,et al.Oocyte apoptosis during the transition from ovary-like tissue to testes during sex differentiation of juvenile zebrafish[J].Journal of Experimental Biology,2002,205(6):711-718.
[25] Kitano T,Hayashi Y,Shiraishi E,et al.Estrogen rescues masculinization of genetically female medaka by exposure to cortisol or high temperature[J].Molecular Reproduction and Development,2012,79(10):719-726.
[26] Jiang D N,Yang H H,Li M H,et al.gsdf is a downstream gene ofdmrt1 that functions in the male sex determination pathway of the Nile tilapia[J].Molecular Reproduction and Development,2016,83(6):497-508.
[27] Yan Y L,Thomas D,Ruth B,et al.Gonadal soma controls ovarian follicle proliferation throughgsdf in zebrafish[J].Developmental Dynamics,2017,246(11):925-945.
[28] Schartl M.Beyond the zebrafish:diverse fish species for modeling human disease[J].Disease Models & Mechanisms,2014,7(2):181-192.