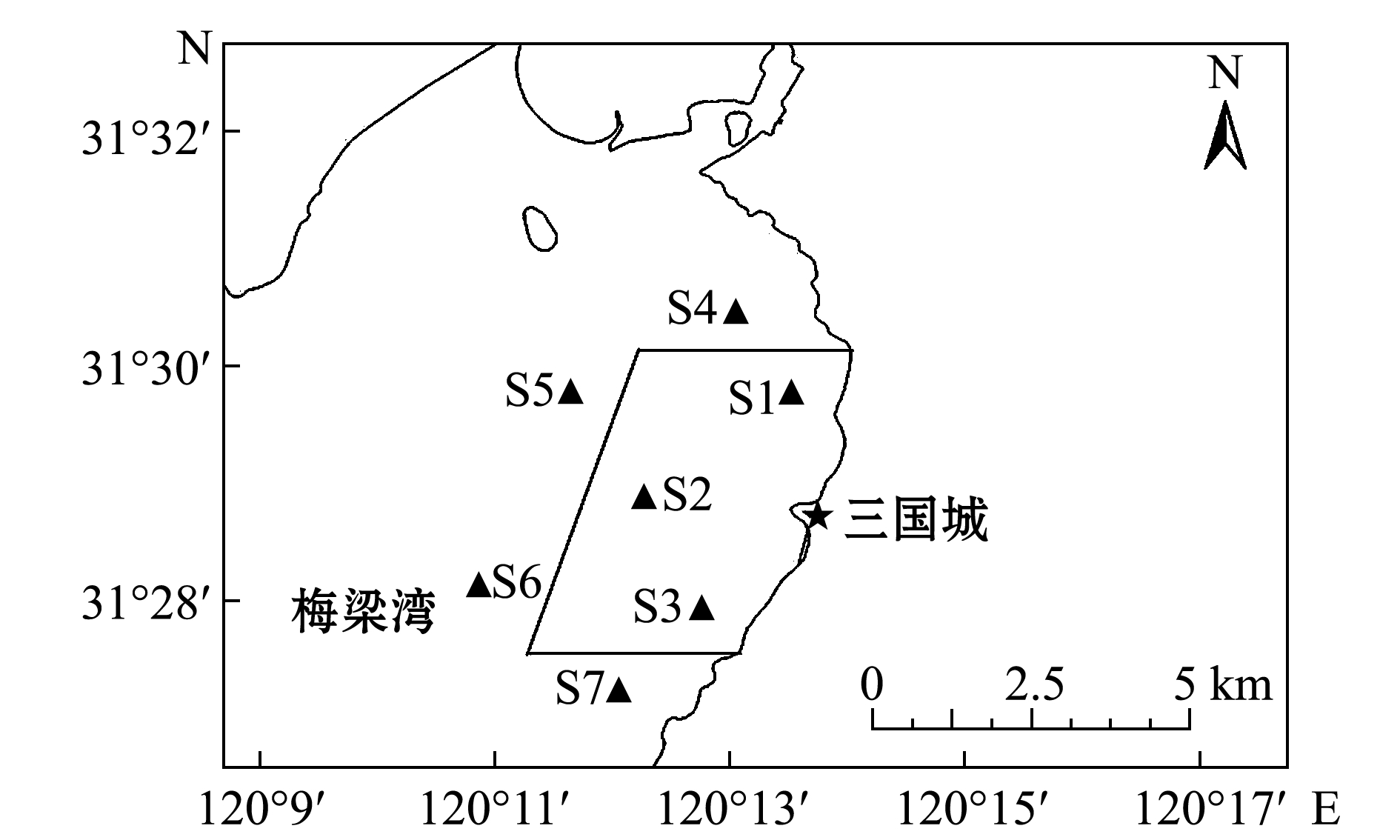
图1 三国城围栏及样点分布
Fig.1 Sketch of locations of fence disposed and sampling sites in Three Kingdoms City
冯超群1,徐东坡1、2,陈永进2,徐跑1、2,单峻峰3
(1.南京农业大学 渔业学院,江苏 无锡 214081;2.中国水产科学研究院淡水渔业研究中心,农业部长江下游渔业资源环境科学观测实验站,江苏 无锡 214081;3.江苏兴利生物技术工程有限公司,江苏 无锡 214092)
摘要:为研究鲢鳙放流对太湖三国城水域浮游植物群落的影响,于2016年8—11月逐月进行调查,通过对比抑藻放流围栏内外浮游植物群落结构差异,分析了鲢鳙放流对浮游植物的影响,并结合综合营养状态指数和生物多样性指数评价了三国城水质状况,同时还探讨了浮游植物与环境因子的关系。结果表明:本次调查共鉴定出浮游植物6门44属90种,优势种以蓝藻门Cyanobacteria种类为主;方差分析显示,围栏内外浮游植物种类组成及多样性无显著性差异(P>0.05);对浮游植物的密度和生物量分析显示,围栏内外均以微囊藻属Microcystis为主,围栏内显著低于围栏外(P<0.05);水质综合评价显示,太湖三国城属于中-重污染富营养化水体,围栏内水质较围栏外好;相关性分析表明,围栏内外浮游植物密度、生物量和蓝藻门密度均与水温呈极显著正相关(P<0.01),与溶解氧呈极显著负相关(P<0.01);RDA分析显示,围栏内浮游植物与水温、溶解氧、pH关系密切,而围栏外则受水温、溶解氧、pH、透明度的影响较大。研究表明,单纯放养鲢鳙适合控制蓝藻水华而非藻类总量,而以控藻为目的的鲢鳙放流模式有待进一步探索。
关键词:鲢鳙放流;浮游植物;相关性分析;RDA分析
富营养化引起的蓝藻水华已成为影响环境的重要问题之一,特别是2007年贡湖自来水危机事件[1],引起了国内外广泛关注。为改善太湖水质,维护生态平衡,研究人员尝试了大量的生态恢复措施[1-3],如机械打捞、化学沉降、生物修复等。其中,Shapiro等[4]提出的经典生物操纵理论(Bio-manipulation),主张利用浮游动物来控制藻类数量;谢平[5]提出的非经典生物操纵理论(Non-traditional bio-manipulation),则认为投放滤食性鱼类控藻效果更好。鲢Hypophthalmichthysmolitrix、鳙Aristichthysnobilis是典型的滤食性鱼类,主要以水体中浮游生物为食,故常常作为控藻生物引入各个水体[4-7]。然而,关于鲢鳙控藻仍存在较多争议[6]。有研究认为,放养鲢鳙能有效控制蓝藻水华[7];也有研究表明,鲢鳙非但无法控藻,反而会导致浮游生物小型化[8],且会降低浮游动物现存量,对控藻不利[9-10]。
浮游植物是水生生态系统中重要的生产者,也是物质循环和能量流动的重要环节[11]。浮游植物与水环境因子有着密切关系,其种类组成、生物量等群落特征在多种水环境因子的作用下,会出现一定的动态变化,而这种变化是水环境质量的重要标志,因此,浮游植物常被用来作为水质监测和评估的指示生物[12]。目前,通过围隔(阻碍水体自由交换)试验对水质及浮游生物群落变化做分析比较的研究较多[13-15],而对生物围栏(水体可自由交换)内外的调查研究鲜有报道,仅见柯志新等[16]在水体自由交换条件下对围栏内外浮游甲壳动物群落变化进行了研究。本研究中,在水体自由交换条件下对太湖三国城大型鲢鳙放流围栏内外浮游植物及环境因子的差异进行了对比,分析了造成这种差异的关键因子,以及鲢鳙放流对其的影响,以期为后续的控藻放流模式提供可靠的基础数据及参考依据。
三国城位于太湖北部港湾——梅梁湾内湾,是无锡著名的旅游景区及影视文化基地。随着无锡经济的飞速发展,人口不断增多,以及人类活动对三国城水域造成严重的破坏,导致近20年间蓝藻水华频频暴发,水质严重恶化。为改善这一状况,2016年7月,在太湖三国城水域设置大型生物围栏,面积约866.7 hm2,围栏用孔径1.5 cm的尼龙网与木桩连接而成,底部插入泥底,上部高出水面1~1.5 m。围栏内投放规格约2.7 g/尾的鲢鳙鱼苗种共2228.90万尾,鲢、鳙比例为1∶1,生物量约3.27 g /m3。截止2016年12月初,经测产,围栏内鲢鳙鱼生物量约82.85 g/m3,增长了20多倍。
1.2.1 采样点设置 根据鲢鳙放流围栏结构特点,共设置7个采样点(图1),其中S1、S2、S3位于围栏内,S4、S5、S6、S7位于围栏外,距围栏300 m左右。于2016年8—11月每月15日左右采样1次。

图1 三国城围栏及样点分布
Fig.1 Sketch of locations of fence disposed and sampling sites in Three Kingdoms City
1.2.2 样品的采集与处理 浮游植物样品采集与鉴定、密度与生物量的计算均参照《淡水浮游生物研究方法》[17]执行。分别用溶氧仪(YSI 550A USA)、pH仪(YSI pH60USA)、塞式黑白盘现场测定水体的水温(WT)、溶解氧(DO)、pH、透明度(SD)。用有机玻璃采水器采集表层水样(三国城水域平均水深仅1.8 m,不足2.0 m,故未进行分层采样),带回实验室后参照《水和废水监测分析方法 (第四版)》[18]测定总氮(TN)、总磷(TP)、化学需氧量(CODMn)、叶绿素a(Chl-a)。
1.2.3 水质评价 根据物种优势度指数(Y)、Shannon-Wiener多样性指数(H′)、Margalef物种丰富度指数(D)、Pielou均匀度指数(J)、Jaccard种类相似度指数(P)[19-21]对三国城抑藻放流围栏内外浮游植物群落结构特征进行分析,并结合综合营养状态指数TLI(∑)[22]对水质进行评价。Y、H′、D、J、P计算公式分别为
Y=Pi×fi,
(1)
(2)
D=(S-1)/lnN,
(3)
J=H′/lnS,
(4)
P=c/(a+b-c)。
(5)
其中:Pi=Ni/N,Ni为第i种的个体数;N为所有种类的总个体数;fi为各采样点第i种的出现频率;S为样点中出现的浮游植物总种数;a、b分别为两个地区浮游植物出现的总种数;c为两个地区浮游植物共有种数。其综合营养状态指数为
(6)
其中:TLI(∑)为综合营养状态指数;Wj为第j种因子的营养状态指数相关权重;TLI(j)为第j种因子的营养状态指数;m为评价因子个数。
采用SPSS 22.0软件对围栏内外差异性进行单因素方差分析(One-way ANOVA),用Pearson相关性分析环境因子与浮游植物的相关性。利用Canoco 4.5软件对浮游植物密度与环境因子的关系进行冗余分析(RDA)。
从表1可见:围栏内外水温(WT)变化基本一致,8—11月水温逐渐下降;透明度(SD)变化幅度较大,9月和11月透明度接近,8月最低,但围栏内外总体平均值十分接近;围栏内溶解氧(DO)、pH值略低于围栏外,最大值分别出现在10月和11月;围栏内总氮(TN)、总磷(TP)、化学需氧量(CODMn)平均值低于围栏外,但相差不大;围栏外叶绿素a除8月外均高于围栏内,10月相差最大,约为5倍。但方差分析表明,围栏内外环境因子均无显著性差异(P>0.05)。
表1围栏内外主要环境因子对比
Tab.1Comparisonofmainenvironmentalfactorswithinandoutsidethefence
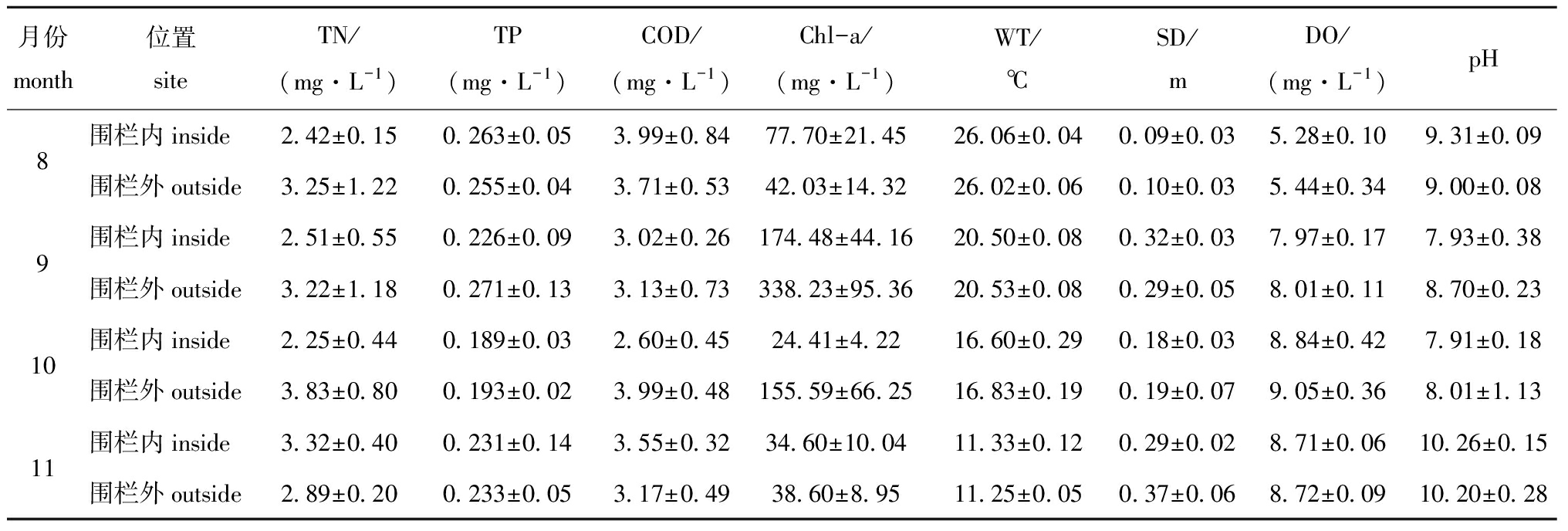
月份month位置siteTN/(mg·L-1)TP(mg·L-1)COD/(mg·L-1)Chl-a/(mg·L-1)WT/℃SD/mDO/(mg·L-1)pH8围栏内inside2.42±0.150.263±0.053.99±0.8477.70±21.4526.06±0.040.09±0.035.28±0.109.31±0.09围栏外outside3.25±1.220.255±0.043.71±0.5342.03±14.3226.02±0.060.10±0.035.44±0.349.00±0.089围栏内inside2.51±0.550.226±0.093.02±0.26174.48±44.1620.50±0.080.32±0.037.97±0.177.93±0.38围栏外outside3.22±1.180.271±0.133.13±0.73338.23±95.3620.53±0.080.29±0.058.01±0.118.70±0.2310围栏内inside2.25±0.440.189±0.032.60±0.4524.41±4.2216.60±0.290.18±0.038.84±0.427.91±0.18围栏外outside3.83±0.800.193±0.023.99±0.48155.59±66.2516.83±0.190.19±0.079.05±0.368.01±1.1311围栏内inside3.32±0.400.231±0.143.55±0.3234.60±10.0411.33±0.120.29±0.028.71±0.0610.26±0.15围栏外outside2.89±0.200.233±0.053.17±0.4938.60±8.9511.25±0.050.37±0.068.72±0.0910.20±0.28
2.2.1 种类组成及数量变化 本调查共鉴定出浮游植物6门44属90种(包括变种)。其中,绿藻门种类最多,占浮游植物总种数的63.30%;其次为蓝藻门(15.50%)和硅藻门(12.40%)。围栏内外浮游植物种类组成差别不大,根据Jaccard种类相似度指数计算,围栏内外浮游植物种类相似度指数为0.51,为中度相似。
围栏内浮游植物密度平均值为(54.83±24.77)×106cells/L,生物量平均值为(2.94±1.65)mg/L;围栏外密度平均值为(72.06±35.14)×106cells/L,生物量平均值为(3.61±1.76)mg/L。方差分析显示,围栏内外浮游植物密度和生物量均有显著性差异(P<0.05)。围栏内外蓝藻密度占比最大,约92%,而绿藻密度占比不到1%。浮游植物密度总体呈下降趋势。其中,8—10月围栏内浮游植物密度降低了65.70%,围栏外降低了61.71%,10—11月围栏内外均略有上升(图2)。生物量变化趋势和密度基本一致。
2.2.2 优势种 根据优势度计算(Y>0.02为优势种),围栏内外共发现优势种9种,其中蓝藻门最多(5种),分别是微囊藻属Microcystis、假鱼腥藻属Pseudoanabaena、卷曲鱼腥藻Anabaenacircinalis、细小平裂藻Merismopediaminima和旋折平裂藻Merismopediaconvoluta;硅藻门2种,分别是梅尼小环藻Cyclotellameneghiniana和谷皮菱形藻Nitzschiapalea;隐藻门2种,分别是啮蚀隐藻Cryptomonserosa和尖尾蓝隐藻Chroomonasacuta(表2)。微囊藻属是绝对优势种,8月微囊藻密度最大,随后不断减小;假鱼腥藻属、细小平裂藻为次优势种。围栏外假鱼腥藻属密度变化幅度较小,而围栏内的鱼腥藻密度则持续减少。细小平裂藻变化趋势与微囊藻属一致,8月围栏内密度较围栏外小,9月围栏内密度超过围栏外。梅尼小环藻、啮蚀隐藻和尖尾蓝隐藻密度与微囊藻属变化趋势则相反,11月密度最大,且围栏内密度较大(图3)。方差分析显示,围栏内外优势种密度无显著性差异(P>0.05)。

注:IB为围栏内生物量;ID为围栏内密度;OB为围栏外生物量;OD为围栏外密度。竖条表示标准差(围栏内N=3,围栏外N=4)
Note:IB, biomass inside the fence; ID, density inside the fence; OB, biomass outside the fence; OD, density outside the fence. Bars indicate standard deviation (Inside N=3; Ouside N=4)
图2 围栏内外浮游植物密度和生物量的变化
Fig.2 Changes in phytoplankton densityand biomass inside and outside fence
2.2.3 多样性指数 研究区围栏内与围栏外浮游植物Shannon-Wiener多样性指数H′、Pielou均匀度指数J与Margalef丰富度指数D的对比结果如表3所示。围栏内多样性指数H′最大值出现在11月,丰富度指数D最大值出现在8月,而均匀度指数J在整个调查期间均处于较低水平(<0.2)。方差分析表明,围栏内外浮游植物多样性均无显著性差异(P>0.05)。
表2围栏内外优势种优势度
Tab.2Dominanceofdominantspeciesinsideandoutsidethefence
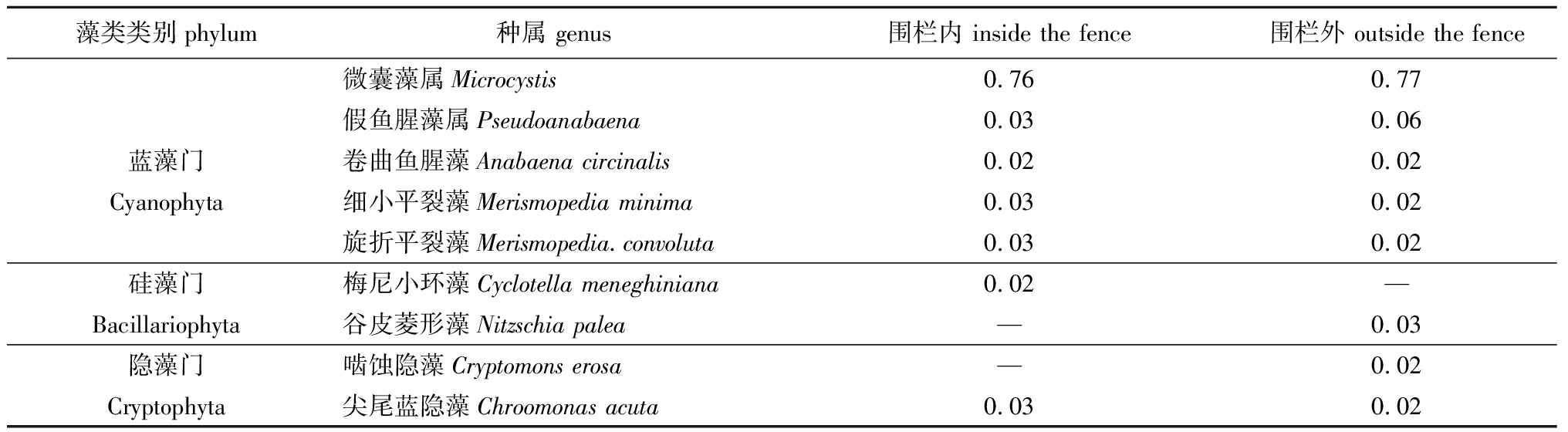
藻类类别phylum种属 genus围栏内 inside the fence围栏外 outside the fence微囊藻属Microcystis0.760.77假鱼腥藻属Pseudoanabaena0.030.06蓝藻门卷曲鱼腥藻Anabaena circinalis0.020.02Cyanophyta细小平裂藻Merismopedia minima0.030.02旋折平裂藻Merismopedia.convoluta0.030.02硅藻门梅尼小环藻Cyclotella meneghiniana0.02—Bacillariophyta谷皮菱形藻Nitzschia palea—0.03隐藻门啮蚀隐藻Cryptomons erosa—0.02Cryptophyta尖尾蓝隐藻Chroomonas acuta0.030.02
表3围栏内外浮游植物多样性指数
Tab.3Diversityindexofphytoplanktoninsideandoutsidethefence
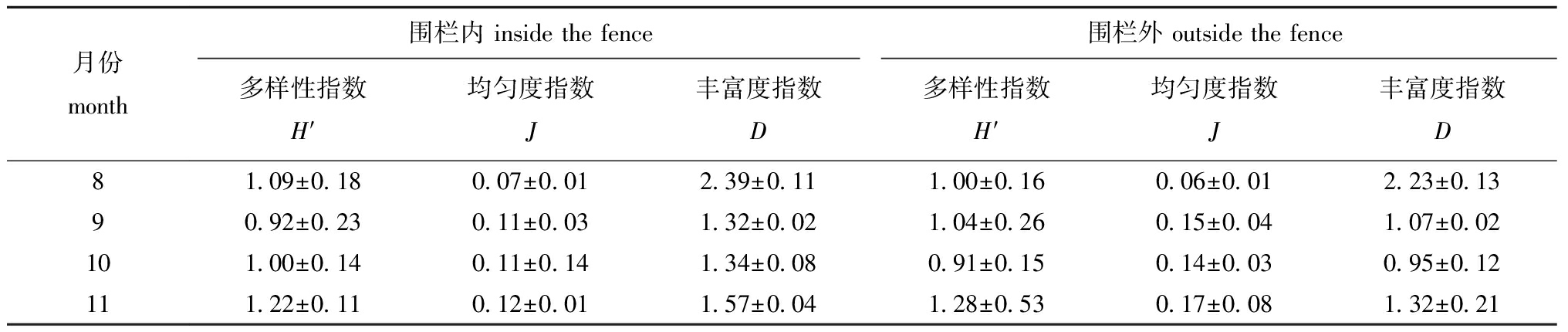
月份month围栏内 inside the fence 围栏外 outside the fence多样性指数H′均匀度指数 J丰富度指数 D多样性指数H′均匀度指数 J丰富度指数 D81.09±0.180.07±0.012.39±0.111.00±0.160.06±0.012.23±0.1390.92±0.230.11±0.031.32±0.021.04±0.260.15±0.041.07±0.02101.00±0.140.11±0.141.34±0.080.91±0.150.14±0.030.95±0.12111.22±0.110.12±0.011.57±0.041.28±0.530.17±0.081.32±0.21
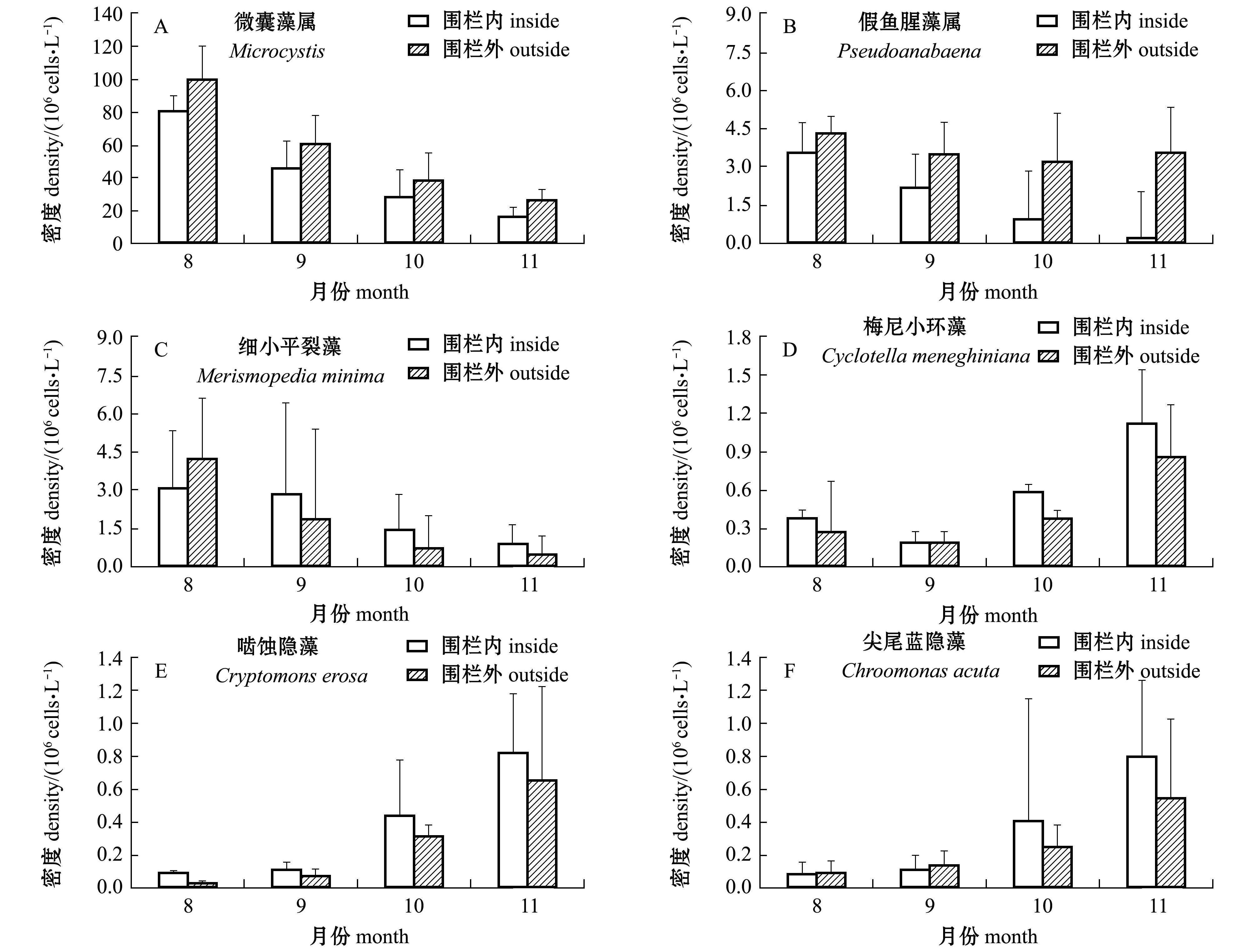
图3 围栏内外主要优势种密度的变化
Fig.3 Changes in the density of the main dominant species inside and outside the fence
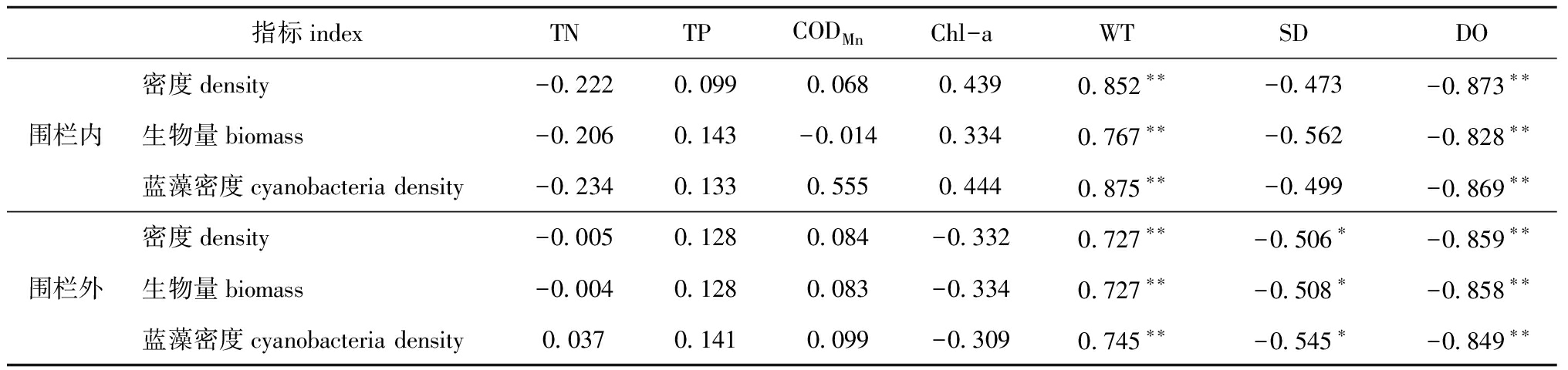
相关性分析显示(表4),三国城围栏内外浮游植物密度、生物量和蓝藻密度均与温度(WT)呈极显著正相关(P<0.01),与溶解氧(DO)呈极显著负相关(P<0.01);不同的是围栏内浮游植物密度、生物量和蓝藻密度与透明度(SD)无显著相关关系(P>0.05),而围栏外则表现为显著相关(P<0.05)。
根据浮游植物相对密度与相对频率,本研究中选择了15种浮游植物(表5)与7种环境因子作DCA分析,结果表明,围栏内外第一轴均小于3.0,适合作RDA(单峰模型)分析。DCA分析结果显示,围栏内轴Ⅰ与轴Ⅱ的特征值分别为0.326、0.096,围栏外分别为0.427、0.074,物种排序轴与环境因子排序轴的相关系数,围栏内分别为0.969、0.692,围栏外分别为0.941、0.814,且Monte Carlo检验显示差异性显著(P<0.05),说明这两个排序轴能很好地反映围栏内外浮游植物与环境因子的相关关系。
表4围栏内外浮游植物与环境因子的相关性
Fig.4Correlationbetweenphytoplanktonandenvironmentalfactorsinsideandoutsidethefence
指标indexTNTPCODMnChl-aWTSDDOpH围栏内密度density-0.2220.0990.0680.4390.852∗∗-0.473-0.873∗∗-0.243生物量biomass-0.2060.143-0.0140.3340.767∗∗-0.562-0.828∗∗-0.149蓝藻密度cyanobacteria density-0.2340.1330.5550.4440.875∗∗-0.499-0.869∗∗0.278围栏外密度density-0.0050.1280.084-0.3320.727∗∗-0.506∗-0.859∗∗-0.149生物量biomass-0.0040.1280.083-0.3340.727∗∗-0.508∗-0.858∗∗-0.151蓝藻密度cyanobacteria density0.0370.1410.099-0.3090.745∗∗-0.545∗-0.849∗∗-0.202
注: *表示显著相关(P<0.05), **表示极显著相关(P<0.01)
Note: * means significant correlations(P<0.05), **means very significant correlations(P<0.01)
表5RDA分析中浮游植物物种代码
Tab.5CodesofphytoplanktonspeciesinRDAanalysis

藻类类别 phylum代码code物种 speciesSP1微囊藻属MicrocystisSP2假鱼腥藻属Pseudoanabaena蓝藻门SP3卷曲鱼腥藻Anabaena circinalisCyanophytaSP4针晶蓝纤维藻Dactylococcopsis rhaphidioidesSP5微小平裂藻Merismopedia tenuissima LemmSP6细小平裂藻Merismopedia minimaSP7旋折平裂藻Merismopedia convoluta硅藻门SP8梅尼小环藻Cyclotella meneghinianaBacillariophytaSP9谷皮菱形藻Nitzschia palea隐藻门SP10啮蚀隐藻Cryptomons erosaCryptophytaSP11尖尾蓝隐藻Chroomonas acutaSP12双对栅藻Scenedesmus bijuba绿藻门SP13四尾栅藻Scenedesmus quadricandaChlorophytaSP14双棘栅藻Scenedesmus bicaudatusSP15四角藻属Tetraedron
如图4所示,影响围栏内外浮游植物的环境因子有所差别,围栏内主要受水温、溶解氧、pH值的影响,而围栏外受水温、溶解氧、pH值、透明度的影响较大。其中,围栏内微囊藻属、假鱼腥藻属、微小平裂藻、旋折平裂藻、谷皮菱形藻、双对栅藻、四尾栅藻、双棘栅藻与水温呈正相关,与pH值、溶解氧呈负相关;而卷曲鱼腥藻、细小平裂藻、梅尼小环藻、啮蚀隐藻、尖尾蓝隐藻与pH、溶解氧呈正相关,与水温呈负相关。围栏外蓝藻门与绿藻门所有种类均与水温呈正相关,与溶解氧、pH、透明度呈负相关,而硅藻门与隐藻门生物则与溶解氧、pH、透明度呈正相关,与水温呈负相关。
本研究表明,三国城水域围栏内外浮游植物种类组成差异不显著,Jaccard种类相似度指数也说明,围栏内外种类组成至少有51%的相似性。浮游植物优势种以蓝藻门居多,微囊藻属占绝对优势,这与历史资料[23]同期相比,结果基本一致。围栏内浮游植物密度和生物量均显著低于围栏外,说明鲢鳙摄食对浮游植物现存量具有一定的影响[24-25]。鲢鳙对食物的选择性,主要取决于食物的可得性和颗粒物大小[26],由于三国城水域夏秋季节主要以蓝藻门生物为主,因此,蓝藻是鲢鳙主要的食物来源[27],这是导致围栏内蓝藻平均密度比围栏外低30%的原因之一。随着鲢鳙的生长,蓝藻密度下降速率逐渐加快,其10—11月围栏内蓝藻密度下降速率约为围栏外的2倍。鲢鳙鳃耙结构限制了其摄食藻类的大小范围,只有那些大于鳃耙间隙的藻类才能被有效滤食[14-15]。统计结果显示,试验期间围栏内大型藻类如束丝藻、假鱼腥藻属等生物量显著下降,到试验结束时几乎消失,表明鲢鳙对浮游植物的控制主要体现在对大型藻类的摄食上[28]。随着鲢鳙的摄食,大型藻类数量下降,小型藻类生存压力减小,加上枝角类等能抑制小型藻类的浮游动物数量减少,刺激小型藻类大量繁殖[14]。小型藻类能迅速吸收营养盐并进行繁殖生长,在较高营养盐条件下可形成较高的相对丰度[29]。鲢鳙在控制蓝藻的同时,促进了硅藻和隐藻的生长(图4),这可能是11月围栏内浮游植物密度上升幅度大于围栏外的原因。此外,刘霞等[30]研究发现:冬春季太湖北部湾蓝藻生物量百分比均低于10%,而此时隐藻生物量百分比较高,为30%~70%;夏季蓝藻水华频发,其生物量百分比为60%~87%,此时隐藻生物量百分比均低于10%。三国城蓝藻和隐藻存在明显的群落演替,可能是隐藻在低温环境下具有较高的繁殖能力,生长周期短,当藻类群落摄食压力增大时,高繁殖率能弥补由于鱼类摄食带来的损失[14]。
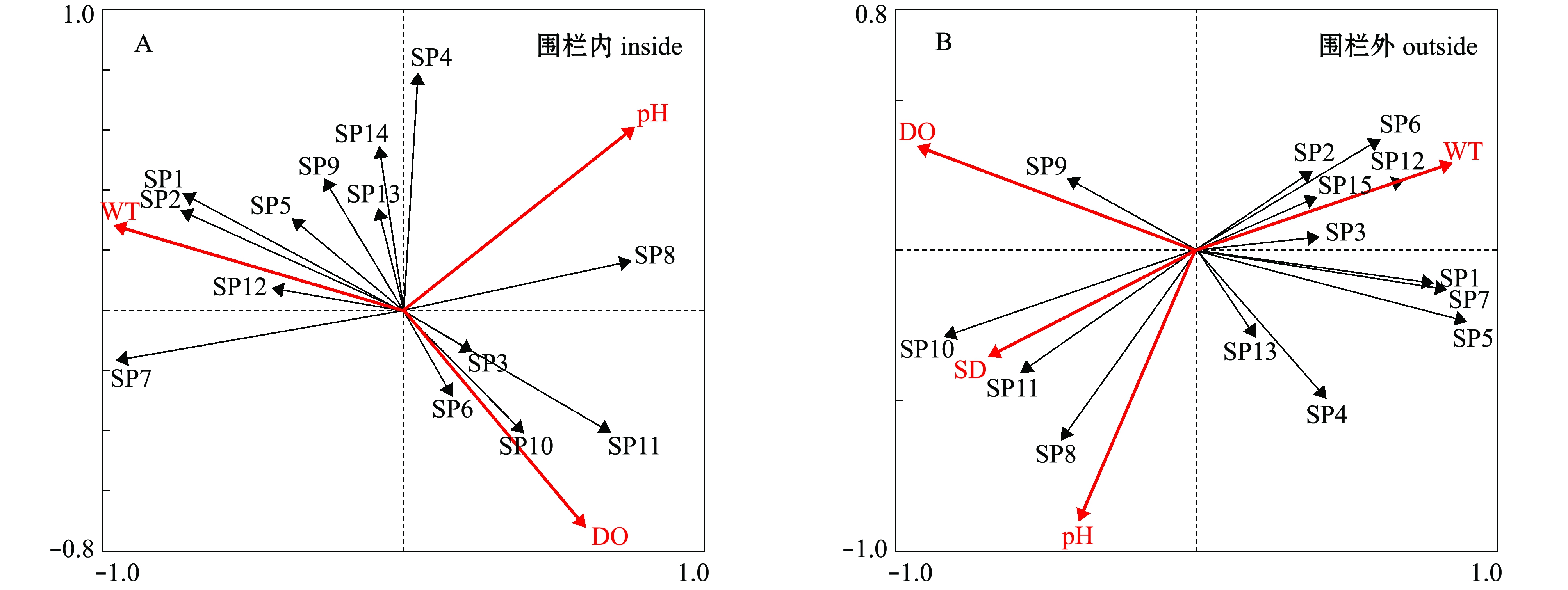
图4 围栏内外浮游植物—环境关系的RDA二维排序图
Fig.4 RDA biplot of relationship between phytoplankton species and environmental variables
鲢鳙放流增加了对浮游植物的摄食压力,间接改变了水体的理化因子。通过输出渔获物,可以减轻水体营养物含量,降低氮、磷负荷[15],从而抑制藻类生长。调查发现,三国城围栏外总氮较高,但与围栏内无显著性差异,总磷基本相同,说明鲢鳙放流对降低水体总氮、总磷的作用不明显,可能要长时间降低氮磷输入量和增加输出量,才能彻底减轻氮磷对水体的负荷[31]。另外,鲢鳙的扰动可以增加水体浑浊度,对浮游植物光合作用具有一定影响,也是造成试验中叶绿素a含量明显变化的原因之一,但围栏内外环境因子均无显著性差异,这可能是由于围栏是个开放系统,水体能自由交换,掩盖了鱼类对水质的影响[16]。
本次调查中,三国城浮游植物种类以绿藻门居多,但密度却以蓝藻门贡献最大。这种藻量丰富且以蓝藻为优势的群落特征,是水体严重富营养化的标志[32]。三国城水域还发现大量富营养型(β-α-ms型)水体指示种[33],如细小平裂藻、针晶蓝纤维藻、四角藻属等。原因可能是三国城处于梅梁湾内湾,水体交换缓慢,且进入梅梁湾的直湖港、武进港、梁溪河都是重污染河流,导致湾内污染物不断积累,以及营养盐含量不断升高[27,34]。根据浮游植物多样性指数对水质的评价标准[19-20]及综合营养状态指数分析[22],太湖三国城属于中-重污染富营养型水体。
浮游植物与水体中各种环境因子关系密切,特别是水温、pH、营养盐等环境因子[35-37]对浮游植物影响较大。水温变化对浮游植物密度和生物量有明显的影响,是驱动浮游植物季节性更替的关键因素[38]。本研究中,相关性分析发现,三国城水域围栏内外浮游植物密度、生物量和蓝藻密度与水温呈极显著正相关,这与国内外学者提出的水温是影响浮游植物最直接的因素这一结论一致[36-37]。RDA分析结果也表明,水温是影响三国城水域浮游植物的关键因子之一。pH对浮游植物群落有着重要影响,当pH>8.0时,蓝藻成为主要优势种[12]。同时,蓝藻可通过一系列的生理生化反应来调节水体pH,使其维持在适宜藻类生长的范围内[39]。RDA分析结果表明,pH是影响三国城水域藻类的重要因子之一。氮、磷元素能调节促进浮游植物生长,Redfield[40]提出,满足浮游植物对营养物质的生理需求的氮磷原子比为16∶1(质量比为7∶1)。在本次调查中,三国城抑藻区氮磷比约为12∶1,说明磷是浮游植物生长的限制因子之一。夏季蓝藻暴发,藻类大量死亡,水体中溶解氧降低[12]。之后随着藻类密度减少,溶解氧逐渐恢复。透明度能反映水体悬浮物的含量,一般来说,浮游植物密度越高,透明度越低。围栏外浮游植物密度与透明度负显著相关,围栏内则无显著相关性,可能是鲢鳙的存在,弱化了它们的关系。叶绿素a是浮游植物的一个重要组成部分,其在水体里的含量与分布一定程度反映了浮游植物密度的变化。本研究中,8月围栏内叶绿素a含量较高,但之后低于围栏外,说明随着鲢鳙的生长,对藻类的摄食不断增多,造成叶绿素a含量低于围栏外;但到了11月,围栏内外叶绿素a含量接近,可能是围栏内硅藻和隐藻大量繁殖引起叶绿素a含量上升。
三国城水域夏秋季节浮游植物绿藻门种类最多,蓝藻门密度最大,微囊藻属占绝对优势。随着鲢鳙的生长,围栏内蓝藻的大幅减少表明鲢鳙放流对控制蓝藻水华具有一定积极作用。鲢鳙的摄食降低了大型藻类和浮游动物的数量,刺激小型藻类的生长,导致试验后期浮游植物密度和生物量有所回升,说明单纯放养鲢鳙适合主要目的为控制蓝藻水华而非藻类总量。鲢鳙对浮游植物的种类组成,多样性的作用并不明显,因此,以控藻为目的的鲢鳙放流模式有待进一步探索。
参考文献:
[1] 秦伯强,王小冬,汤祥明,等.太湖富营养化与蓝藻水华引起的饮用水危机——原因与对策[J].地球科学进展,2007,22(9):896-906.
[2] 王宇庭,叶金云,郑荣泉.防止和修复湖泊水库富营养化渔业操纵的探讨[J].大连海洋大学学报,2017,32(4):451-456.
[3] 焉鸿启,赵文,郭凯,等.辽宁省6座水源水库富营养化状况的分析与评价[J].大连海洋大学学报,2016,31(2):180-184.
[4] Shapiro J,Lamarra V,Lynch M.Biomanipulation:an ecosystem approach to lake restoration[C]//A Symposium Water Quality Management Through Biological Control.Gainesville:Department of Environmental Engineering Sciences,University of Florida,1975.
[5] 谢平.鲢、鳙与藻类水华控制[M].北京:科学出版社,2003.
[6] 刘其根,张真.富营养化湖泊中的鲢、鳙控藻问题:争议与共识[J].湖泊科学,2016,28(3):463-475.
[7] 孔优佳,徐东炯,刘其根,等.滆湖湖滨带生态修复技术初步研究[J].水生态学杂志,2017,38(2):17-24.
[8] KOlar C S,Chapman D C,Courtenay W R,et al.Asian carps of the genusHypophthalmichthys(Pisces,Cyprinidae)-a biological synopsis and environmental risk assessment[J].Molecular Vision,2005,17(12):183.
[9] Hambright K D,Blumenshine S C,Shapiro J.Can filter-feeding fishes improve water quality in lakes?[J].Freshwater Biology,2002,47(6):1173-1182.
[10] 史为良,金文洪,王东强,等.放养鲢鳙对水体富营养化的影响[J].大连水产学院学报,1989,4(3):11-24.
[11] 王家利,王芳.盐湖微微型浮游植物多样性研究进展[J].生态学报,2014,34(2):282-293.
[12] 张云,马徐发,郭飞飞,等.湖北金沙河水库浮游植物群落结构及其与水环境因子的关系[J].湖泊科学,2015,27(5):902-910.
[13] 刘青,李鹏,关春江,等.鼠尾藻围隔生态系中浮游生物的变化[J].大连海洋大学学报,2009(S1):88-92.
[14] 卢子园.淀山湖鲢鳙放养对水质影响的围隔试验[D].上海:上海海洋大学,2010
[15] 张宁,季高华,王丽卿.滤食性鱼类鲢放养量对淀山湖水质影响的围隔试验[J].淡水渔业,2012,42(5):83-88.
[16] 柯志新,谢平,过龙根,等.太湖梅梁湾大型控藻围栏对浮游甲壳动物群落结构的影响[J].应用生态学报,2012,23(8):2270-2276.
[17] 章宗涉,黄祥飞.淡水浮游生物研究方法[D].北京:科学出版社,1991.
[18] 国家环境保护总局.水和废水监测分析方法[M].4版.北京:中国环境科学出版社,2002.
[19] 师吉华,李秀启,董贯仓,等.东平湖水环境质量综合评价[J].大连海洋大学学报,2015,30(4):391-397.
[20] 李沂軒,鞠哲,赵文,等.白石水库浮游植物的群落结构研究[J].大连海洋大学学报,2016,31(4):404-409.
[21] 李庆南,赵文,殷旭旺,等.辽河太子河水系的浮游植物种类多样性研究[J].大连海洋大学学报,2011,26(4):322-327.
[22] 王明翠,刘雪芹,张建辉.湖泊富营养化评价方法及分级标准[J].中国环境监测,2002,18(5):47-49.
[23] 孟顺龙,陈家长,胡庚东,等.2008年太湖梅梁湾浮游植物群落周年变化[J].湖泊科学,2010,22(4):577-584.
[24] Cooke S L,Hill W R,Meyer K P.Feeding at different plankton densities alters invasive bighead carp (Hypophthalmichthysnobilis) growth and zooplankton species composition[J].Hydrobiologia,2009,625(1):185-193.
[25] 李为星,徐玉萍,王丽卿,等.上海市城郊河道夏季浮游植物群落结构及水质评价[J].上海海洋大学学报,2013,22(3):357-363.
[26] 曾庆飞,谷孝鸿,毛志刚,等.鲢鳙控藻排泄物生态效应研究进展[J].生态学杂志,2010,29(9):1806-1811.
[27] 王媛,徐东坡,王小林,等.基于碳氮稳定同位素技术探究太湖北部湖区鲢、鳙食性差异[J].大连海洋大学学报,2017,32(5):597-602.
[28] 孙育平.营养盐加富、滤食性鱼类和浮游动物对水库浮游植物群落结构的影响[D].广州:暨南大学,2010.
[29] 李然然,章光新,张蕾.查干湖湿地浮游植物与环境因子关系的多元分析[J].生态学报,2014,34(10):2663-2673.
[30] 刘霞,陆晓华,陈宇炜.太湖北部隐藻生物量时空动态[J].湖泊科学,2012,24(1):142-148.
[31] 李林春.南湾水库鲢鳙放养比例对水质调控的研究[J].水生态学杂志,2010,3(4):70-74.
[32] 吴洁,虞左明.西湖浮游植物的演替及富营养化治理措施的生态效应[J].中国环境科学,2001,21(6):540-544.
[33] 冯天翼,宋超,陈家长.水生藻类的环境指示作用[J].中国农学通报,2011,27(32):257-265.
[34] 李娟,温周瑞,李庚辰,等.太湖梅梁湾和贡湖湾浮游甲壳动物群落结构及其与环境因子的相互关系[J].长江流域资源与环境,2014,23(S1):81-90.
[35] 李季东,肖利娟,韩博平.一座南亚热带中富营养水库夏季浮游植物群落的稳态平衡分析[J].应用与环境生物学报,2011,17(6):833-838.
[36] Sugiura N,Utsumi M,Wei B,et al.Assessment for the complicated occurrence of nuisance odours from phytoplankton and environmental factors in a eutrophic lake[J].Lakes & Reservoirs Research & Management,2010,9(3-4):195-201.
[37] Chang T,Pei H Y,Hu W R,et al.Phytoplankton variation and its relationship with the environmental factors in Nansi Lake,China[J].Environmental Monitoring and Assessment,2013,185(1):295-310.
[38] 田泽斌,刘德富,姚绪姣,等.水温分层对香溪河库湾浮游植物功能群季节演替的影响[J].长江流域资源与环境,2014,23(5):700-707.
[39] 许海,秦伯强,朱广伟.太湖不同湖区夏季蓝藻生长的营养盐限制研究[J].中国环境科学,2012,32(12):2230-2236.
[40] Redfield A C.The biological control of chemical factors in the environment[J].Sci Prog,1960,11(11):150-170.
FENG Chao-qun1, XU Dong-po1,2, CHEN Yong-jin2, XU Pao1,2, SHAN Jun-feng3
(1.Wuxi Fisheries College, Nanjing Agriculture University, Wuxi 214081, China; 2.Yangtze River Downstream Fisheries Resources and Environmental Science Observation Station, Ministry of Agriculture, Freshwater Fisheries Research Center, Chinese Academy of Fishery Sciences, Wuxi 214081, China; 3.Jiangsu Xinli Bioengineering Limited Company, Wuxi 214092, China)
Abstract:The impacts of stocked silver carpHypophthalmichthysmolitrixand bighead carpAristichthysnobilison phytoplankton community structure in the Three Kingdoms City, Taihu Lake by comparison of the differences of phytoplankton community structure between inside and outside fencing from August to November, 2016, and the water quality in the Three Kingdoms City was analyzed by comprehensive nutritional status index and biodiversity index to evaluate the relationship between environmental factors and phytoplankton community. A total of 90 species in 44 genera, 6 phyla was found,with dominant species cyanobacteria. Analysis of variance indicated that there was no significant difference in species composition and diversity within and outside fencing area (P>0.05). GenusMicrocystishad more density and biomass, significantly lower inside the fence than those outside the fence (P<0.05). Comprehensive evaluation revealed that the water quality in the Three Kingdoms City was within the middle and heavy pollution eutrophic water bodies, better inside the fence than outside. Correlation analysis indicated that phytoplankton density, biomass and cyanobacteria density were significantly positively correlated with water temperature (P<0.01), and negatively correlated with dissolved oxygen level (P<0.01). RDA analysis showed that phytoplankton within the fence was closely related to water temperature, dissolved oxygen, pH and CODMn, while the water temperature, dissolved oxygen, pH and transparency showed more effect outside the fence. The findings indicate that the stocking of silver carp and bighead carp is suitable for control algal blooms instead of algal aggregates, and that the releasing pattern of silver carp and bighead carp for control algae is needed further research.
Keywords:stocking of silver carp and bighead carp; phytoplankton; correlation analysis; RDA analysis
通信作者:徐跑(1963—), 男, 研究员, 博士生导师。 E-mail: xup@ffrc.cn
作者简介:冯超群(1991—), 男, 硕士研究生。E-mail:26637946@qq.com
基金项目:太湖治理专项省级统筹项目(苏财建[2015]162-2);梅梁湖净水渔业技术集成示范(Y2014-4)
收稿日期:2017-11-29
文章编号:2095-1388(2018)05-0666-08
DOI:10.16535/j.cnki.dlhyxb.2018.05.019
文献标志码:A
中图分类号:X826