李诗雅,韩青,苏亚文,祁艳霞,赵前程,李智博
(大连海洋大学 食品科学与工程学院,辽宁省水产品加工及综合利用重点实验室,辽宁 大连 116023)
摘要:为提取菲律宾蛤仔Ruditapesphilippinarum蒸煮液中的多糖组分,采用20%、40%、60%、80%不同浓度分级醇沉得到粗多糖组分RPCL1、RPCL2、RPCL3和RPCL4,并对每部分多糖进行纯度、回收率的计算、刚果红试验、红外光谱、差示量热扫描和单糖组成分析,以及抗氧化性测定。结果表明:60%(RPCL3)乙醇沉淀的多糖纯度最高,达73.46%,回收率也最高,可达48.31%,均显著高于其他组分(P<0.05);只有RPCL1存在三螺旋结构;4种多糖组分的红外光谱差别不大,但差示量热扫描结果相差很大,可见各组分多糖的糖链空间结构差别较大;岩藻糖(Fuc)和葡萄糖(Glc)在4种多糖组分中全部检测到,葡萄糖醛酸(GlcUA)在RPCL2和RPCL3多糖组分中检测到,半乳糖醛酸(GalUA)在RPCL2、RPCL3、RPCL4多糖组分中检测到,氨基半乳糖盐酸盐(GalN)和氨基葡萄糖(GlcN)在4种多糖组分中均未检测到;抗氧化性测定结果显示,随着糖浓度的不断增加,4种多糖组分对DPPH·自由基和羟自由基(·OH)的清除能力逐渐增强,且具有剂量依赖性。研究表明,4种多糖组分在纯度、单糖组成、糖链空间结构等方面存在较大差异,但都具有抗氧化活性。
关键词:菲律宾蛤仔;蒸煮液;多糖;分级醇沉;理化性质
菲律宾蛤仔Ruditapesphilippinarum隶属于软体动物门、双壳纲、帘蛤目、帘蛤科,南方俗称花蛤,辽宁俗称蚬子[1],在中国辽宁、河北、福建、广东等沿海地区均有分布。
贝类在加工成干制品或冷冻品时会产生蒸煮液。由于蒸煮液中含有较多的可溶性蛋白质、糖类等功能性成分和营养物质,未经利用直接排放,既污染环境又浪费资源[2]。蛤类多糖具有很好的生物活性,抗肿瘤、抗氧化、抗病毒、降低血脂和血糖、免疫调节和保护肝脏等活性都已被发现和证实[3]。当前针对水产品加工产生废弃液的研究主要集中在调味品开发[4]工作上,较少研究其功能性成分。对贝类蒸煮液中的多糖进行分离纯化,研究其功能活性,不仅有利于副产物的综合利用,而且能够提升贝类附加值,为进一步研究相关功能性食品和药物提供技术支持[5]。杨荣华等[6]从贻贝蒸煮液中提取的MJPs-1和MJPs-2多糖具有免疫调节作用和抑制Raji细胞增殖的活性,且贻贝蒸煮液多糖的低毒性使其在保健品的开发,以及结合其他强抗癌制剂以降低药物的细胞毒性方面具有极大的应用价值。李苹苹等[7]以紫贻贝废弃液为材料,对其浓缩液(DBM)进行营养功能成分测定,发现DBM营养及功能性成分丰富,其中总糖和蛋白质的平均含量分别为12.06%和5.36%,富含牛磺酸和矿物质,适于研制开发贻贝加工的系列产品。上述研究中关于营养成分的分析,为合理开发贝类蒸煮废弃液提供了参考依据。
用乙醇分级沉淀法进行分离纯化的依据是分子质量的大小,故多糖的得率和组成随着乙醇在醇沉时含量的不同而变化[8-9],多糖的分子质量与其生理活性密切相关[10]。史万忠等[11]通过不同的醇沉浓度,分级沉淀获得不同的沉淀物,通过比较不同醇沉浓度下河蚌多糖粗提物分级沉淀物的药效,确定河蚌多糖粗提物的有效部位。王德青等[12]采取一步醇沉和分级醇沉法提取4种山药多糖,探讨了山药多糖不同活性组分对淋巴细胞功能及体内免疫活性的影响。本试验中,以菲律宾蛤仔蒸煮液为原料,对其中的多糖组分采用分级醇沉法进行回收,计算得到粗多糖的回收率、提取率和纯度,并通过刚果红试验、红外光谱法、差示扫描量热法和PMP柱前衍生高效液相色谱法[13-15],对多糖组分进行结构表征和单糖组成分析,最后测定各多糖组分对两种自由基的清除作用,以期对菲律宾蛤仔蒸煮液多糖的开发利用提供参考依据。
试验用菲律宾蛤仔蒸煮液购自辽宁安德食品有限公司。
主要试剂:葡萄糖(Glc)、甘露糖(Man)、葡萄糖醛酸(GlcUA)、半乳糖(Fuc)、氨基葡萄糖(GlcN)、半乳糖醛酸(GalUA)为美国Sigma公司产品;乙腈(色谱级) 为德国Meker公司产品;KBr粉末(光谱纯)为美国PIKE公司产品;1,1-二苯基-2-苦肼基自由基(DPPH·)、1-苯基-3-甲基-5-吡唑啉酮(PMP)、FeSO4·7H2O、MgCl2·6H2O、苯酚、三氟乙酸、30%过氧化氢、氯仿、水杨酸等,均为国产分析纯。
仪器与设备:L-2000高效液相色谱仪(日本日立公司);SYNERGY HI酶标仪(美国伯腾仪器有限公司);Lambda 25紫外-可见分光光度计(美国PerkinElmer);Cary 660 FTIR傅里叶变换红外光谱仪(安捷伦科技有限公司); Q20差示量热扫描仪(美国TA公司)。
1.2.1 分级醇沉 准确量取菲律宾蛤仔蒸煮液500 mL,将其调整至固形物含量10%,加入体积分数为95%的乙醇,使乙醇终浓度(体积分数,下同)为20%,充分混匀,室温下放置24 h后离心分离(9000 r/min,20 min,4 ℃),收集沉淀物;将上清调节至乙醇终浓度为40%,24 h后离心分离沉淀物[15-18];以此类推,再将上清乙醇终浓度调节到60%和80%,收集沉淀物,将得到的沉淀物冻干,依次得到4种分级醇沉多糖RPCL1、RPCL2、RPCL3和RPCL4。
1.2.2 总糖、还原糖含量的测定 用苯酚-硫酸法[19]测定总糖含量;用3,5-二硝基水杨酸比色法[20]测定还原糖含量。
1.2.3 多糖含量[21]、纯度[22]、回收率[22]和提取率[21]的测定与计算
多糖含量=总糖含量-还原糖含量,
纯度![]()
回收率![]()
提取率![]()
1.2.4 刚果红试验 取干燥的不同组分的多糖各2.0 mg溶解于1.0 mL去离子水中,加入100 μmol/L刚果红试剂2.0 mL和不同浓度NaOH(0~0.4 mol/L),以不添加多糖的刚果红试剂为对照,用紫外光谱仪在190~700 nm波长下扫描,确定最大吸收波长[23]。
1.2.5 红外光谱测定(IR) 取干燥的不同组分的多糖样品各1 mg,与干燥KBr粉末按照质量比1∶100混合并压成透明薄片,用红外光谱仪扫描并记录吸收值(4000~400 cm-1)。
1.2.6 差示扫描量热法(DSC) 取不同组分的多糖样品各10 mg放入坩埚内,将样品压样后放入检测池,调节N2流速为40 mL/min,以10 ℃/min从50 ℃升温至400 ℃,根据其增长曲线,确定样品的吸热、放热温度范围及焓变值。
1.2.7 柱前衍生高效液相色谱法测定单糖组成 采用PMP 柱前衍生-HPLC 法测定,具体方法参考文献[24]并稍做修改。
色谱柱为 ZORBAX Eclipse XDB-C18 分离柱(4.6 mm×250 mm,5 μm),Agilent 1260高效液相色谱仪,紫外检测器波长为 254 nm,流速为 1.0 mL/min,柱温为 25 ℃,流动相A组成为15%乙腈+0.05 mol/L磷酸二氢钾-氢氧化钠缓冲溶液(pH 6.9),流动相B组成为40%乙腈+ 0.05 mol/L磷酸二氢钾-氢氧化钠缓冲溶液(pH 6.9),时间梯度为 0→10 min→40 min,流动相B浓度梯度为 0→8%→37%;进样体积为 10 μL。
1.2.8 抗氧化能力测定
(1)对羟自由基(·OH)清除能力测定。参照Beeley[25]的方法并略做改进:分别吸取浓度为2、4、6、8、10、12 mg/mL不同组分多糖溶液1 mL,依次加入3 mL 2 mmol/L FeSO4、3 mL 1 mmol/L H2O2摇匀后,再加入3 mL 6 mmol/L水杨酸,37 ℃下水浴60 min后取出,静置60 min,于510 nm波长处测定吸光度A1;用3 mL蒸馏水代替1 mmol/L H2O2作为本底,测定吸光度A2;空白对照用1 mL 95%乙醇代替样品液,并测定吸光度A0。测定时以95%乙醇作为参比,清除率计算公式:
·OH清除率=1-(A1-A2)/A0×100%。
其中:A0为空白对照吸光度值;A1为样液吸光度值;A2为本底吸光度值。
对·OH的半数清除(抑制)浓度(median elimination concentration,EC50)定义为清除50%自由基所需要的样品质量浓度,通过清除羟自由基线性回归方程进行计算[26]。
(2)对DPPH·自由基清除能力的测定。参照Singh等[27]的方法并略做改进:分别吸取浓度为2、4、6、8、10、12 mg/mL不同组分多糖溶液2 mL,加入2 mL DPPH·,25 ℃水浴中反应30 min后,于517 nm波长处测定其吸光度值Ai;取2 mL样液,加2 mL 95%乙醇,25 ℃水浴中反应30 min后测定吸光度Aj;取2 mL DPPH·溶液,加入2 mL蒸馏水,25 ℃水浴中反应30 min后测定吸光度A0。
DPPH·清除率=A0-(Ai-Aj)/A0×100%。
其中:A0为空白对照吸光度值;Ai为样液吸光度值;Aj为本底吸光度值。
对DPPH·的EC50计算方法与对·OH的EC50计算类似。
试验结果以平均值±标准差(mean±S.D.)表示,用SPSS 17.0软件进行单因素方差分析,用t检验法进行组间多重比较,显著性水平设为0.05。
用乙醇沉淀多糖时,沉淀出来的多糖种类随着乙醇浓度的升高而增多[28]。从表1可见:乙醇浓度越高,对多糖的提取越有利,当乙醇浓度由20%升到60%时,RPCL的回收率显著提高(P<0.05),多糖的纯度也显著提高(P<0.05),且当乙醇浓度在60%时,达到多糖回收率和纯度的最大值,初步推测这部分多糖的组成比较复杂,可能具有较高的生物活性;当乙醇浓度为80%时,RPCL4的纯度和回收率均显著降低(P<0.05),此时分级醇沉得到的蒸煮液多糖颜色较深,为明显的浅黄棕色,这可能是因部分色素与多糖一起被沉淀下来,所以导致纯度不高。
表1菲律宾蛤仔蒸煮液多糖分级醇沉结果
Tab.1PrecipitationofpolysacharidefromcookingliquorfromManilaclam(PRCL)bydifferentconcentrationsofethanol
%
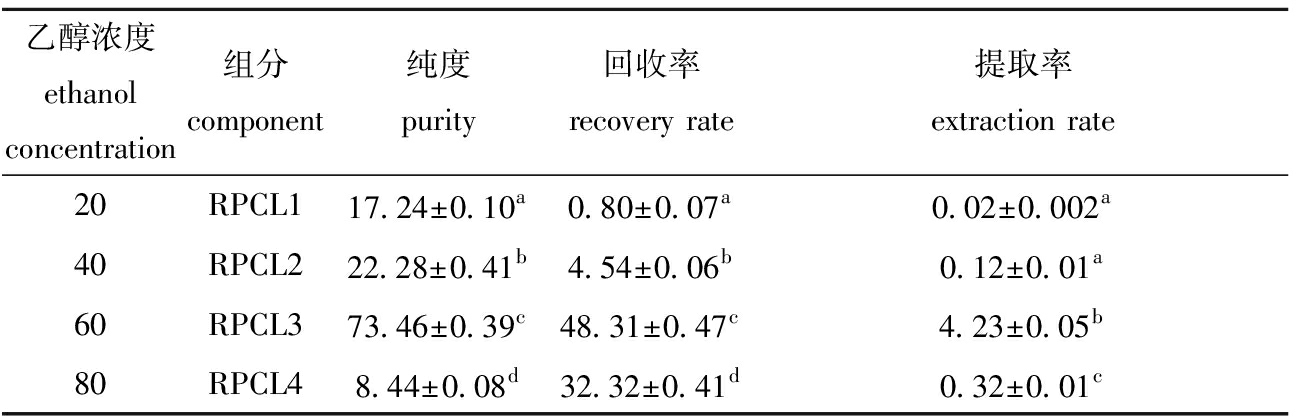
乙醇浓度ethanol concentration组分component纯度purity回收率recovery rate提取率extraction rate20RPCL117.24±0.10a0.80±0.07a0.02±0.002a40 RPCL222.28±0.41b4.54±0.06b0.12±0.01a 60RPCL373.46±0.39c48.31±0.47c4.23±0.05b 80RPCL48.44±0.08d32.32±0.41d0.32±0.01c
注:同列中标有不同小写字母者表示组间有显著性差异(P<0.05),标有相同小写字母者表示组间无显著性差异(P>0.05)
Note:The means with different letters within the same column are significantly different in the groups at the 0.05 probability level, and the means with the same letters within the same column are not significant differences
从图1可看出,RPCL1与刚果红结合所形成的络合物的最大吸收波长(λmax)随着 NaOH 浓度的增大红移明显发生。RPCL1在 NaOH 的浓度为 0.05~0.1 mol/L 范围内与刚果红溶液的最大吸收波长逐渐增大,出现了明显的亚稳区,说明 RPCL1 存在三螺旋结构,而 RPCL2、RPCL3、RPCL4却没有明显变化。
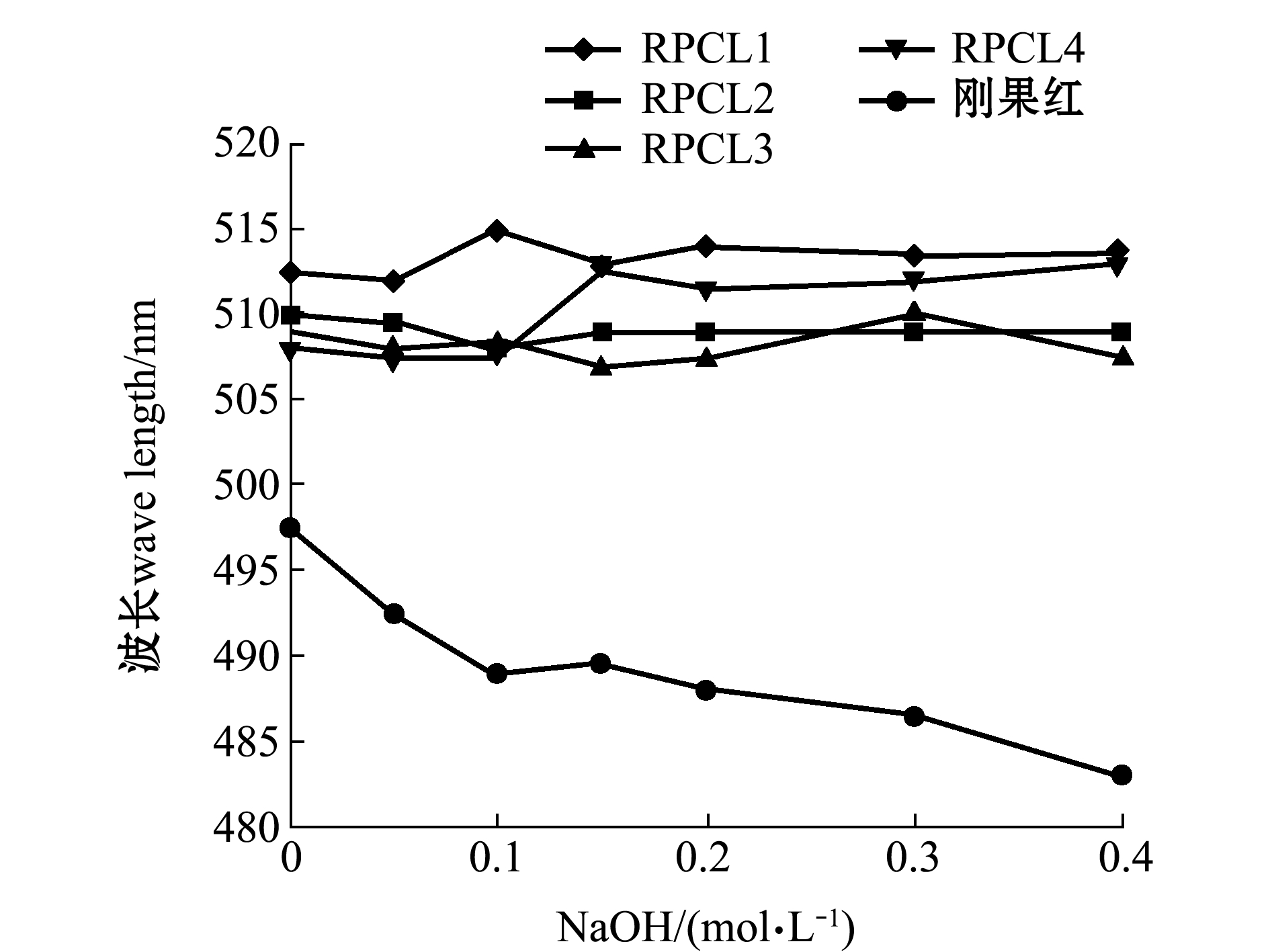
图1 RPCL 4种多糖-刚果红络合物在不同碱性环境中的最大吸收波长
Fig.1 Helix-coil transition analysis of RPCL according to the absorption maximum of the Congo red-polysaccharide complex at various concentrations of NaOH
多糖组分RPCL1、RPCL2、RPCL3和RPCL4的红外光谱如图2所示。首先,由于O-H伸缩振动和N-H伸缩振动,4种组分的多糖在3700~3200 cm-1处都有大吸收峰出现,羟基-OH和氨基-NH分别是糖类和糖胺聚糖所特有的基团。其次,在3000~2800 cm-1处都出现了一个吸收峰,且集中在2900 cm-1处附近,这是岩藻糖甲基-CH2-的C-H伸缩振动峰,说明这些多糖组分里都含有岩藻糖[29],并且发现RPCL3此处有强烈吸收,可知岩藻糖在该组分中的含量较多。最后,由于乙酰氨基-CONH2的C=O的伸缩振动,4种组分的多糖在1650 cm-1附近都有吸收峰的出现,为乙酰氨基的特征吸收峰[30],由此可知氨基糖存在于组分之中,结合1545 cm-1和1375~1450 cm-1附近的羧基-COOH吸收峰,可知糖醛酸存在于各个组分中。4种组分多糖在1200~950 cm-1波长范围的吸收峰差别较大,提示4种多糖的化学结构存在一定差异。
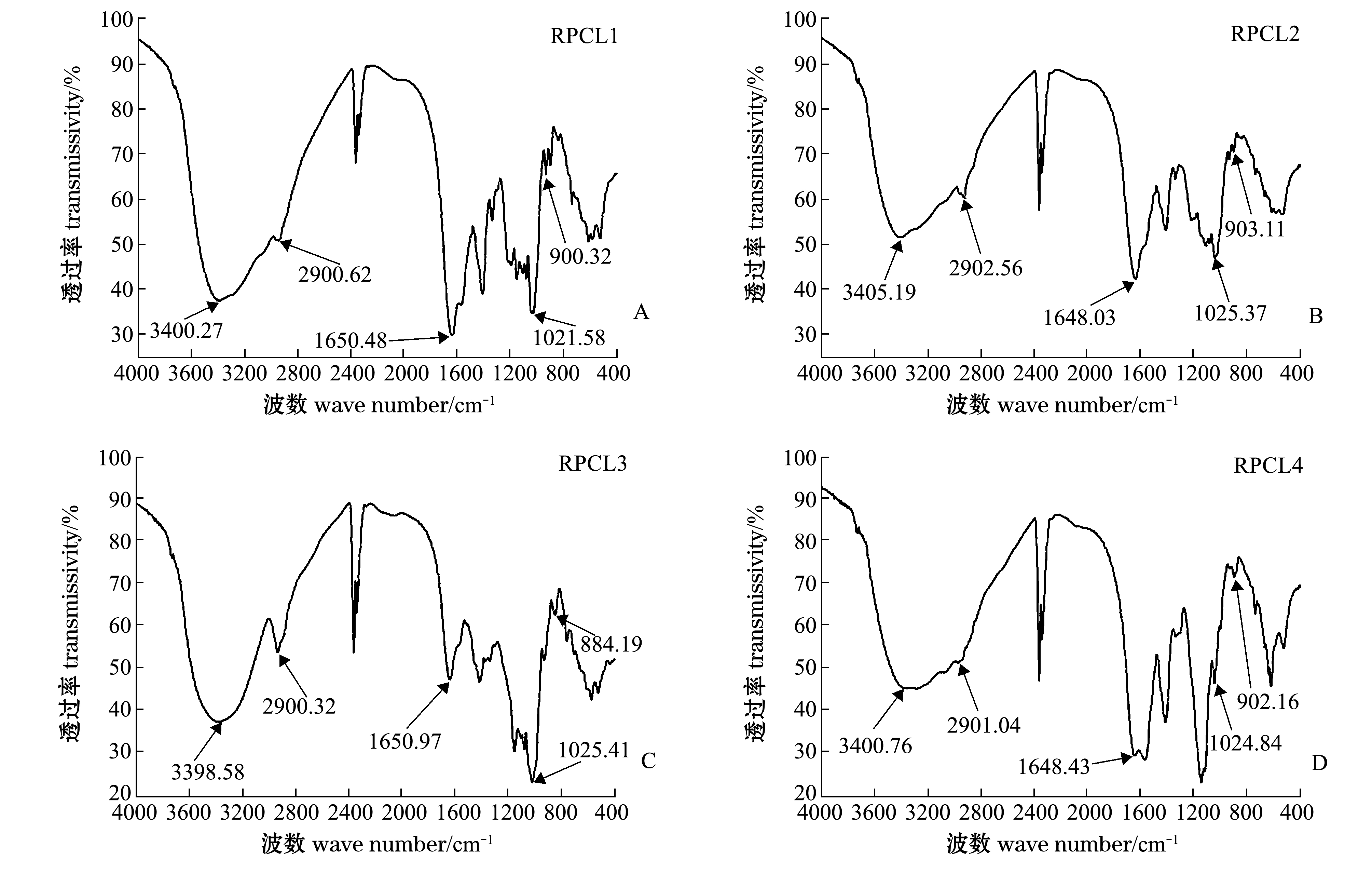
图2 菲律宾蛤仔蒸煮液多糖分级醇沉多糖各组分的红外光谱图
Fig.2 Infrared (IR) spectra of RPCL by different concentrations of alcohol precipitation
RPCL1、RPCL2、RPCL3和RPCL4的DSC图谱如图3所示。当加热温度从40 ℃升温到400 ℃时,RPCL1、RPCL2、RPCL3都是首先出现一个吸热峰随后出现一个放热峰。分析吸热峰的出现可能是由于多糖的吸水、熔化或者分解[31]。RPCL1在185.28 ℃时开始出现吸热峰,并于193.40 ℃时达到最高点,焓值为4.964 J/g,在199.89 ℃时放热峰开始出现,于202.67℃时达到最高点,焓值为173.7 J/g;RPCL2在137.03 ℃时开始出现放热峰,在159.74 ℃时为放热最高点,焓值为80.05 J/g,吸热峰在232.42 ℃左右出现,在252.66 ℃时为吸热最高点,焓值为36.27 J/g;RPCL3在186.37 ℃时开始出现放热峰,在191.78 ℃时为放热最高点,焓值为65.64 J/g,随后又分别出现了一个较弱的放热峰和吸热峰;RPCL4没有明显的吸热放热现象。
图4为多糖组分RPCL1、RPCL2、RPCL3和RPCL4经PMP衍生后的HPLC色谱图。由图4可知,岩藻糖(Fuc)和葡萄糖(Glc)存在于RPCL1中,在RPCL2和RPCL3中都检测到葡萄糖(Glc)、萄糖醛酸(GlcUA)和半乳糖醛酸(GalUA),RPCL4中含有半乳糖醛酸(GalUA)、岩藻糖(Fuc)、葡萄糖(Glc)成分。HPLC结果发现:4种RPCL中都检测到了葡萄糖(Glc)和岩藻糖(Fuc),与红外光谱结果分析基本一致,即各个组分中都含有岩藻糖(Fuc);RPCL2、RPCL3都检测到了葡萄糖醛酸(GlcUA),RPCL2、RPCL3、RPCL4中都检测到了半乳糖醛酸(GalUA),氨基葡萄糖(GlcN)和氨基半乳糖盐酸盐(GalN)在RPCL各组分中均未检测到。
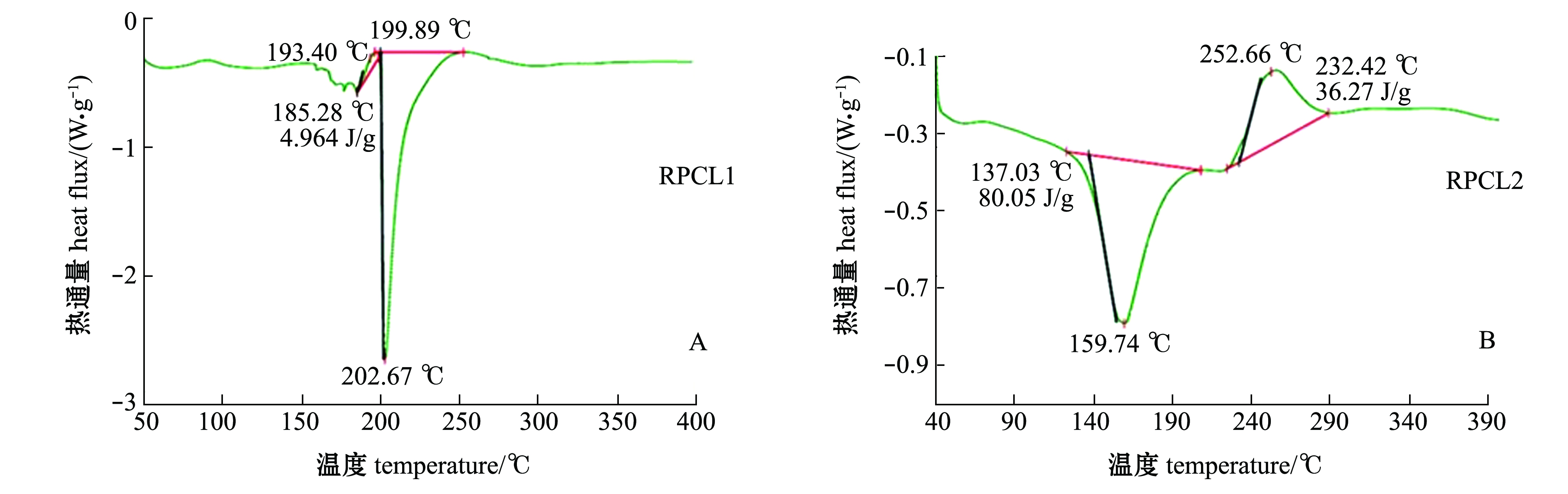
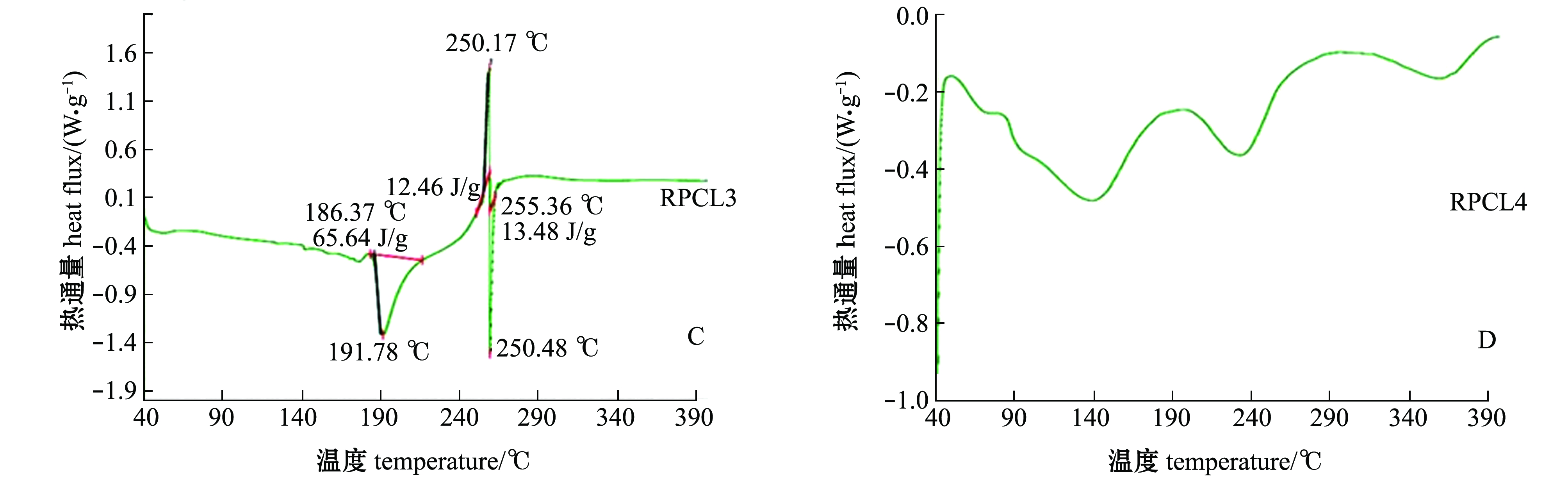
图3 菲律宾蛤仔多糖组分RPCL1、RPCL2、RPCL3和RPCL4的DSC图谱分析
Fig.3 DSC analysis of RPCL1, RPCL2, RPCL3,and RPCL4
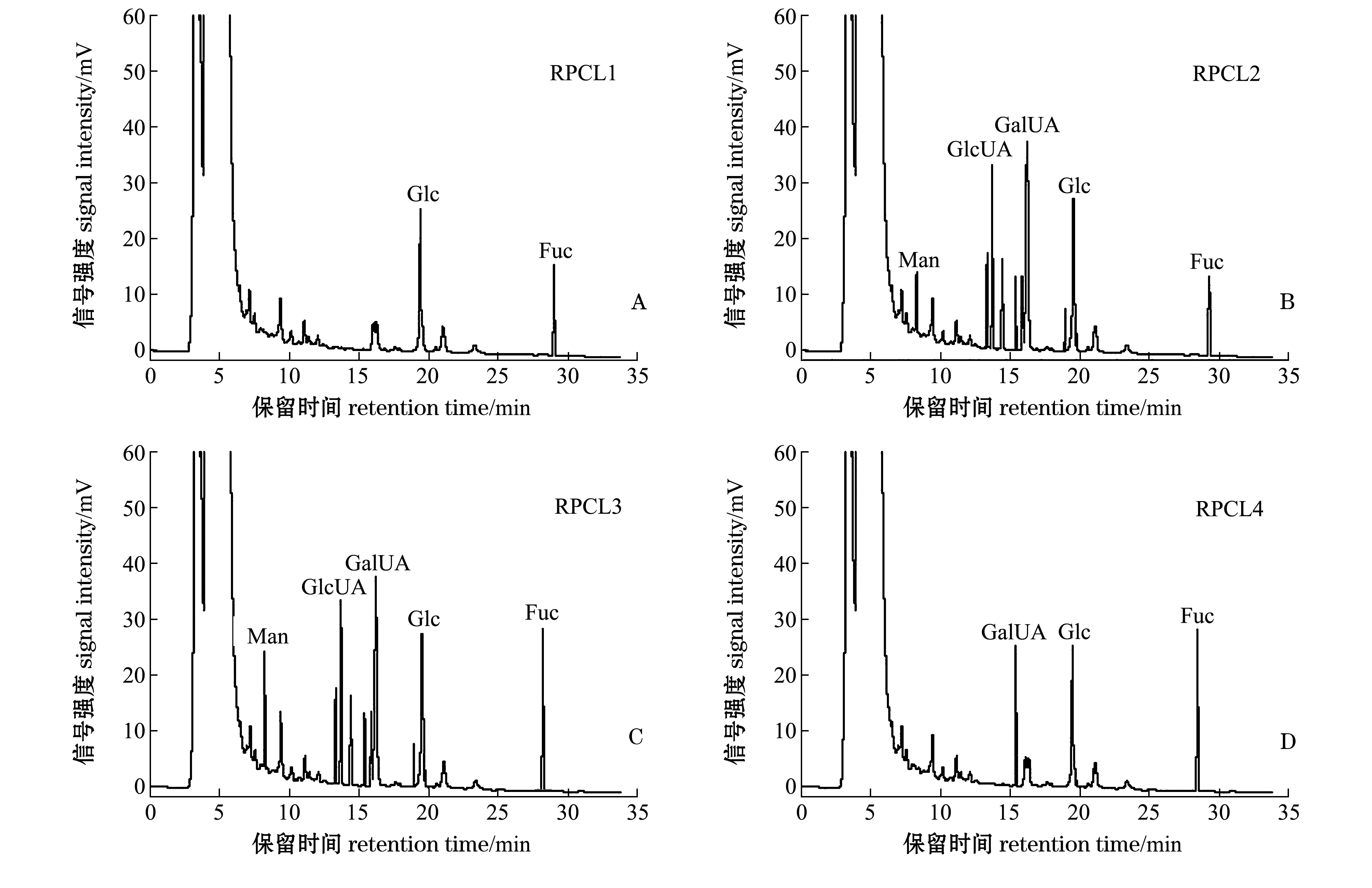
图4 RPCL1、RPCL2、RPCL3和RPCL4的柱前衍生物液相色谱图
Fig.4 HPLC chromatography of pre-column derivatives of RPCL1, RPCL2, RPCL3, and RPCL4
从表2可见:各组分中Glc含量RPCL1>RPCL2>RPCL4>RPCL3;GalUA含量RPCL2>RPCL3>RPCL4;GlcUA含量RPCL3>RPCL2;Man含量RPCL3>RPCL2;Fuc含量RPCL3>RPCL4>RPCL2>RPCL1。单糖含量通过将峰面积带入标准曲线中计算得出,RPCL1中,Glc含量>Fuc含量;RPCL2中,Glc含量>GlcUA含量>GalUA含量>Fuc含量>Man含量;RPCL3中,Fuc含量>GlcUA含量>Glc含量>GalUA含量>Man含量;RPCL4中,Fuc含量>Glc含量>GalUA含量。
表2RPCL各组分单糖含量
Tab.2ThemonosaccharidecontentsofRPCLμg/mL

单糖monosaccharide葡萄糖Glc半乳糖醛酸GalUA葡萄糖醛酸GlcUA甘露糖Man岩藻糖FucRPCL190.86———51.25RPCL278.2555.6978.2421.1153.31RPCL358.7940.3381.4439.0984.46RPCL459.7834.4——71.2
注:—表示未检出;
Note:—,undetected
由图5-A可知,随着糖浓度的增加,RPCL1、RPCL2、RPCL3和RPCL4对羟自由基(·OH)的清除能力逐渐增强,呈浓度依赖性;当糖浓度为12 mg/mL时,RPCL1、RPCL2、RPCL3和RPCL4的羟自由基(·OH)清除率分别为75.26%、79.31%、84.85%和87.24%;计算得到各组分多糖的EC50浓度依次为RPCL4(3.26 mg/mL)>RPCL3(4.41 mg/mL)>RPCL2(4.62 mg/mL)>RPCL1(5.34 mg/mL)。由图5-B可知:随着糖浓度的增加,RPCL1、RPCL2、RPCL3和RPCL4对DPPH·自由基清除能力均逐渐增强;当糖浓度为12 mg/mL时,RPCL1、RPCL2、RPCL3和RPCL4的DPPH·清除率分别为78.33%、82.13%、85.53%和96.31%;计算得到各组分多糖的EC50依次为RPCL4(4.97 mg/mL)>RPCL3(5.71 mg/mL)>RPCL2(6.84 mg/mL)>RPCL1(8.22 mg/mL)。4种多糖对羟自由基的清除能力均低于对DPPH·的清除能力。
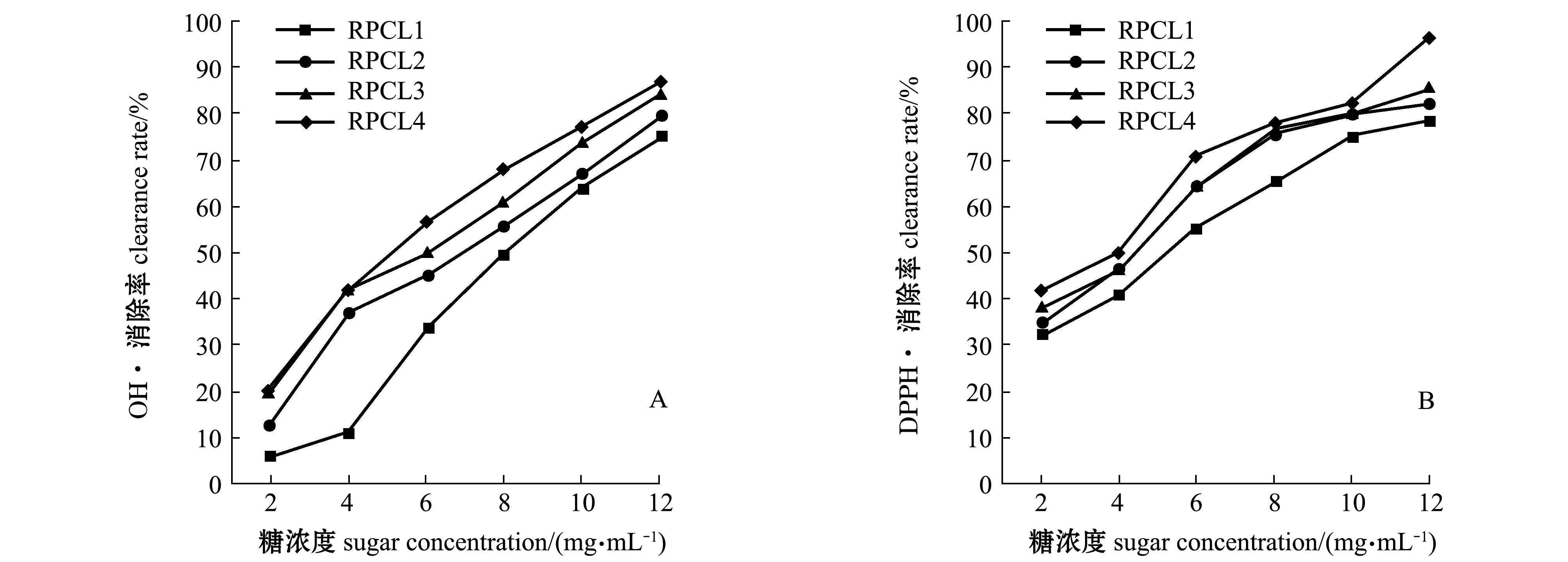
图5 菲律宾蛤仔多糖组分对羟自由基和DPPH·自由基的清除作用
Fig.5 Inhibition effect of RPCL fractions for hydroxyl radicals and DPPH·
传统醇沉方法所得多糖的成分比较复杂,而分级醇沉法能够对糖类按照分子量进行简单的分离,对于从贝类加工副产物中回收高效活性多糖组分具有重要的意义。具有规则三螺旋结构的多糖与刚果红溶液结合会产生络合物,该络合物在紫外光谱扫描下的最大吸收波长与空白的刚果红溶液相比会发生红移,且存在的三股螺旋结构越多位移就越大[32]。在刚果红试验中,RPCL2、RPCL3、RPCL4中没有出现最大吸收波长急剧下降的现象,可能是由于其中无三螺旋链的构象或其三螺旋链的构象特异,使得处于糖链之间的氢键相互作用较强而不易解旋,无法与刚果红生成络合物[23],这与王俊[33]报道的香菇多糖精制样品LST1的结果相似。RPCL多糖和其他动物、植物多糖一样,是一种生物大分子,分子量可达几万或几十万,溶于水时分子链逐渐伸展开;处于固态时,多糖链可能为半晶体状态或无定形状态[34]。本试验结果与淀粉的差示扫描量热法测定结果相对比,淀粉中有直链晶体,这种晶体有较大的晶体颗粒,结合的结实紧密不易被破坏;支链晶体也存在于淀粉中,尺寸较小且不坚固,容易被破坏[35]。因此,作者推测多糖组分RPCL1、RPCL2、RPCL3中可能具有直链晶体,而多糖组分RPCL4中无明显吸热放热现象,所以无法判断。RPCL1的柱前衍生液相色谱与红外光谱分析结果略有不同,即未检测到糖醛酸,分析可能是因为这个组分中糖醛酸的含量不高,未检测到。由于RPCL1和RPCL4两个组分多糖纯度不高,含有杂质和色素,导致检测到的单糖种类不多,样品未经过进一步的分离纯化,也可能检测不到一些含量低的单糖。
羟自由基被认为是毒性最强的活性氧自由基, 其反应性极强, 寿命极短, 对机体的破坏作用最大, 是造成生物有机体过氧化损伤的主要因素[36]。王莅莎等[37]研究的鲍鱼脏器多糖,在样品浓度为 0~2.0 mg/mL时对羟自由基的清除能力随样品浓度的增加而增大,与本试验中RPCL的结果一致,呈浓度依赖性。DPPH·常被用来评价抗氧化剂的自由基清除活性[38],贾彦明等[39]研究的海带多糖C1对DPPH·有良好的清除效果,也同RPCL的结果一致,随着糖浓度的增加对DPPH·自由基清除能力都逐渐增强。
本研究中,利用20%、40%、60%、80%浓度的乙醇对菲律宾蛤仔蒸煮液中的多糖进行回收,得到4种粗多糖组分RPCL1、RPCL2、RPCL3和RPCL4。进一步研究表明:RPCL3纯度最高,可达73.46%,回收率达到48.31%,提取率为 4.23%,显著高于其他3个组分;4种多糖组分中都检测到了葡萄糖(Glc)和岩藻糖(Fuc),与红外光谱结果分析基本一致;RPCL1存在三螺旋结构,而 RPCL2、RPCL3、RPCL4没有三螺旋链的构象或其三螺旋链的构象特异;4种多糖组分对DPPH·自由基和羟自由基(·OH)均具有清除作用,且有剂量依赖性,其清除能力依次为RPCL4 >RPCL3 >RPCL2 >RPCL1。
参考文献:
[1] 路海霞,吴靖娜,许旻,等.菲律宾蛤仔调味软罐头的工艺研究[J].食品安全质量检测学报,2017,8(4):1240-1247.
[2] 陈静波.贻贝蒸煮液水溶性多糖的分离纯化、结构分析和活性研究[D].杭州:浙江工商大学,2008.
[3] 汤梦瑶,王海波,祁艳霞,等.蛤类多糖的研究进展[J].大连海洋大学学报,2018,33(1):130-136.
[4] 陈超,魏玉西,刘慧慧,等.贝类加工废弃物复合海鲜调味料的制备工艺[J].食品科学,2010,31(18):433-436.
[5] Tsybul’ski A V,Isachkova L M,Ovodova R G,et al.Effect of mytilane,a bioglycan from the musselCrenomytilusgrayanus,on the course and outcome of experimental flu infection[J].Zhurnal Mikrobiologii,Epidemiologii,I Immunobiologii,1992(3):62-66.
[6] 杨荣华,陈静波,戴志远.贻贝蒸煮液多糖的提取及其生物活性研究[J].中国食品学报,2009,9(1):84-88.
[7] 李苹苹,丁霄霖.功能性天然贻贝调味汁的研制及营养成分分析[J].中国调味品,2006(2):17-19.
[8] 陈惠黎.糖复合物的结构和功能[M].上海:上海医科大学出版社,1997:241-245.
[9] 闫巧娟,韩鲁佳,江正强,等.黄芪多糖的分子量分布[J].食品科学,2004,25(8):27-30.
[10] 黄芳,蒙义文.活性多糖的研究进展[J].天然产物研究与开发,1999,11(5):90-98.
[11] 史万忠,刘瑾,倪嘉纳,等.河蚌多糖粗提物的分级醇沉及其活性研究[J].时珍国医国药,2012,23(9):2191-2192.
[12] 王德青,马霞,赵玉丛,等.山药多糖组分对小鼠免疫功能的影响[J].畜牧与兽医,2015,47(6):99-101.
[13] 张璐瑶,赵峡,陈欢欢.糖类化合物PMP衍生分析进展[J].分析测试学报,2016,35(3):367-372.
[14] 朱照武,庄洋,向春林,等.单糖柱前PMP衍生HPLC测定方法探讨[J].湖北民族学院学报:自然科学版,2015,33(3):337-341.
[15] 姜龙,宋悦凡,罗宣,等.树皮藻岩藻聚糖硫酸酯的纯化及其化学结构研究[J].大连海洋大学学报,2017,32(1):73-78.
[16] 秦建鲜,黄锁义.广西壮药鸡骨草总多糖和分级多糖相对分子质量的测定[J].化学世界,2016,57(10):617-622.
[17] 赵书凡,朱科学,朱红英,等.苦丁茶冬青多糖乙醇分级纯化及其理化性质研究[J].热带农业科学,2017,37(4):80-86.
[18] 孙丽平,李笑,苏雪娇.中华牛肝菌多糖的性质及抗氧化活性[J].食品工业科技,2016,37(24):173-175,185.
[19] Mourão P A S,Bastos I G.Highly acidic glycans from sea cucumbers:isolation and fractionation of fucose-rich sulfated polysaccharides from the body wall ofLudwigothureagrisea[J].European Journal of Biochemistry,1987,166(3):639-645.
[20] 赵凯,许鹏举,谷广烨.3,5-二硝基水杨酸比色法测定还原糖含量的研究[J].食品科学,2008,29(8):534-536.
[21] 孙晓朋.四角蛤蜊糖胺聚糖的提取、纯化及生理活性研究[D].天津:天津科技大学,2011.
[22] 田瑞红.大豆水酶法提油副产物中水溶性多糖的提取及应用[D].哈尔滨:东北农业大学,2011.
[23] 李红法,郭松波,满淑丽,等.乙醇分级沉淀提取黄芪多糖及其理化性质和抗氧化活性研究[J].中国中药杂志,2015,40(11):2112-2116.
[24] 尹利昂,陈士国,薛长湖.4种海参中含岩藻糖支链的硫酸软骨素化学组成差异的分析[J].中国海洋大学学报,2009,39(S1):63-68.
[25] Beeley J G.Glycoprotein and Proteoglycan Techniques:Laboratory Techniques in Biochemistry and Molecular Biology[M].New York:Elsevier,1985:232.
[26] 李晓英,薛梅,樊汶樵.蓝莓花、茎、叶酚类物质含量及抗氧化活性比较[J].食品科学,2017,38(3):142-147.
[27] Singh N,Rajini P S.Free radical scavenging activity of an aqueous extract of potato peel[J].Food Chemistry,2004,85(4):611-616.
[28] 田冰梅,谢晓梅,沈盼盼,等.分级醇沉宣木瓜多糖含量、分子量测定和活性初步研究[J].光谱学与光谱分析,2015,35(5):1331-1334.
[29] 张雪迪,宋悦凡,汪秋宽,等.苷苔岩藻聚糖硫酸酯分离纯化及结构研究[J].大连海洋大学学报,2017,32(6):740-746.
[30] Honda S,Akao E,Suzuki S,et al.High-performance liquid chromatography of reducing carbohydrates as strongly ultraviolet-absorbing and electrochemically sensitive 1-phenyl-3-methyl5-pyrazolone derivatives[J].Analytical Biochemistry,1989,180(2):351-357.
[31] 刘振海.分析化学手册:热分析[M].2版.北京:化学工业出版社,2000:1-20,64-98,196-249.
[32] 杨文雅.蛹虫草菌丝体多糖的分离、结构鉴定及免疫活性研究[D].镇江:江苏大学,2016.
[33] 王俊.香菇多糖的结构与抗肿瘤活性的关系研究[D].武汉:华中科技大学,2012.
[34] 周裔彬,汪东风,宛晓春,等.茶多糖的纯化及结构分析[J].化学通报,2008(9):691-695.
[35] Bilan M I,Grachev A A,Shashkov A S,et al.Structure of a fucoidan from the brown seaweedFucusserratusL.[J].Carbohydrate Research,2006,341(2):238-245.
[36] Wang Zhaojing,Luo Dianhui.Antioxidant activities of different fractions of polysaccharide purified fromGynostemmapentaphyllumMakino [J].Carbohydrate Polymers,2007,68(1):54-58.
[37] 王莅莎,朱蓓薇,周大勇,等.鲍鱼脏器多糖的抗氧化活性研究[J].食品与机械,2008,24(4):65-68,82.
[38] Jiménez-Escrig A,Jiménez-Jiménez I,Pulido R,et al.Antioxidant activity of fresh and processed edible seaweeds[J].Journal of the Science of Food and Agriculture,2001,81(5):530-534.
[39] 贾彦明,闵伟红.海带多糖的分离纯化及体外抗氧化作用的研究[J].农产品加工·学刊,2010(8):26-29,35.
LI Shi-ya, HAN Qing, SU Ya-wen, QI Yan-xia, ZHAO Qian-cheng, LI Zhi-bo
(Key Laboratory of Aquatic Product Processing and Utilization of Liaoning Province, College of Food Science and Engineering, Dalian Ocean University, Dalian 116023, China)
Abstract:Purification, recovery, and antioxidant activity were investigated in crude polysaccharide fractions RPCL1, RPCL2, RPCL3 and RPCL4 by fractional precipitation with 20%, 40%, 60% and 80% of ethanol, respectively, from cooking liquid of Manila clamRuditapesphilippinarum, by Congo red test, infrared spectroscopy, differential calorimetric scanning and monosaccharide composition analysis in order to extract the polysaccharide components from the clam. The results showed that there were purity of up to 73.46% and recovery rate of up to 48.31% in RPCL3 crude polysaccharide precipitated by 60% ethanol, significantly higher than other components. Only RPCL1 had a triple helix structure, without much difference in the infrared spectra of the four polysaccharides. The differential calorimetry scan indicated that there were great differences in sugar chain spatial structure of each component polysaccharide. Fucose (Fuc) and glucose (Glc) were detected in all polysaccharides, and glucuronic acid (GlcUA) component was detected in RPCL2 and RPCL3 polysaccharide fractions. In RPCL2, RPCL3,and RPCL4 polysaccharide groups, the galacturonic acid (GalUA) was detected in the fractions,without aminogalactose hydrochloride (GalN) and glucosamine (GlcN). The antioxidant property test revealed that the scavenging abilities of the four polysaccharides to DPPH· and hydroxyl radicals were gradually elevated with the increase in sugar concentration, with dose-dependent. The findings indicated that there were great differences in purity, monosaccharide composition and spatial structure of sugar chain in the components of the four polysaccharides with antioxidant activity.
Keywords:Ruditapesphilippinarum; cooking liquor; polysaccharide; fractional alcohol precipitation; physical and chemical property
通信作者:李智博(1979—),女, 博士, 副教授。E-mail:zhibo9800@163.com
作者简介:李诗雅(1994—),女,硕士研究生。E-mail:302558825@qq.com
基金项目:国家海洋公益性行业科研专项(201505030-6)
收稿日期:2018-07-09
文章编号:2095-1388(2018)05-0658-08
DOI:10.16535/j.cnki.dlhyxb.2018.05.018
文献标志码:A
中图分类号:TS254.9