周晏琳,郑尧,刘慧慧,张晴,宋扬, 田元勇, 刘俊荣
(大连海洋大学 食品科学与工程学院,辽宁 大连 116023)
摘要:为探究活品贝类在流通过程中的品质变化与胁迫代谢的关系,以虾夷扇贝Patinopectenyessoensis为研究对象,将采捕后的活品扇贝分为3组,进行冷却及室温干藏处理,其中冷却干藏温度为4 ℃,分充氧包装组(CDo)和充气包装组(CDa),常温环境温度20 ℃为充气包装组(ADa),对3个处理组进行跟踪观察,并每日采样直至扇贝死亡。探究其闭壳肌粗酶提取液中超氧化物歧化酶(SOD)的变化规律及其酶学性质。结果表明:缺氧和高温导致扇贝加速死亡,冷却充氧包装组(CDo)在第6天全部死亡,冷却充气包装组(CDa)在第4天全部死亡,而常温充气包装组(ADa)则在第2天就全部死亡;冷却干露贮藏期间,闭壳肌水溶性蛋白质含量出现轻微下降,SDS-PAGE电泳分析显示,卵清蛋白(相对分子质量44 000)条带附近的蛋白组分出现降解;扇贝闭壳肌中SOD活性与胁迫出现应答关联,常温组(ADa)SOD活性高于冷却组(CDo、CDa),充气组CDa又高于充氧组CDo,干露期间所有处理组的SOD活性整体呈现上升趋势;扇贝闭壳肌中SOD同样具有较高的耐热性,耐热温度为60 ℃,其pH稳定范围为中性,Cu2+、Zn2+、 Fe3+、十二烷基硫酸钠(SDS)、柠檬酸和H2O2等对SOD活性有抑制作用,低浓度Mn2+对SOD活性有促进作用,高浓度Mn2+则有抑制作用。初步研究表明,干露与活品虾夷扇贝中SOD活性有一定相关性,温度、缺氧等胁迫均引起虾夷扇贝闭壳肌中SOD活性应答,可以进行深入研究。
关键词:虾夷扇贝;活品干藏;闭壳肌;超氧化物歧化酶
据《中国渔业统计年鉴2017》统计显示,2016年,中国贝类产量为1447.36万t,其中扇贝为186.05万t[1]。虾夷扇贝作为中国重要的海洋经济养殖贝类,主要以活品形式流通,部分以闭壳肌为主的各类加工品形式流通。近年来,国内有关捕后虾夷扇贝的研究陆续有所报道,研究主要围绕捕后处置对活品虾夷扇贝生化代谢的影响及虾夷扇贝在活品流通过程中的品质及代谢变化等问题展开[2-4],此外还有对虾夷扇贝活品流通前后挥发性成分的对比研究[5]。
生物体正常生命代谢活动中会产生超氧阴离子自由基![]() 羟自由基(·OH)和过氧化氢(H2O2)等活性氧物质,生物体面临胁迫或疾病时,将产生过多的活性氧物质,为避免对机体产生损伤,生物体自身生成具有防御能力的抗氧化系统。抗氧化系统包括非酶类抗氧化剂和酶类抗氧化剂,非酶类抗氧化剂主要包括维生素E、维生素C、谷胱甘肽等,酶类抗氧化剂包括超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-PX)等[6]。其中,SOD是抗氧化系统的第一道防线,是一类广泛存在于生物体内的金属酶,能够催化超氧化物阴离子自由基发生歧化反应,生成氧气和过氧化氢,过氧化氢进一步被过氧化氢酶分解,从而消除超氧阴离子自由基。当机体产生过多的活性氧物质时,SOD会迅速产生应答,从而达到保护机体的目的。研究表明,SOD主要有3种:Cu/Zn-SOD、Mn-SOD、Fe-SOD,其中,Cu/Zn-SOD主要存在于真核细胞的细胞质中,Fe-SOD主要存在于原核细胞和真核细胞的基质中,Mn-SOD主要存在于原核细胞及少数植物细胞中[7]。
羟自由基(·OH)和过氧化氢(H2O2)等活性氧物质,生物体面临胁迫或疾病时,将产生过多的活性氧物质,为避免对机体产生损伤,生物体自身生成具有防御能力的抗氧化系统。抗氧化系统包括非酶类抗氧化剂和酶类抗氧化剂,非酶类抗氧化剂主要包括维生素E、维生素C、谷胱甘肽等,酶类抗氧化剂包括超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-PX)等[6]。其中,SOD是抗氧化系统的第一道防线,是一类广泛存在于生物体内的金属酶,能够催化超氧化物阴离子自由基发生歧化反应,生成氧气和过氧化氢,过氧化氢进一步被过氧化氢酶分解,从而消除超氧阴离子自由基。当机体产生过多的活性氧物质时,SOD会迅速产生应答,从而达到保护机体的目的。研究表明,SOD主要有3种:Cu/Zn-SOD、Mn-SOD、Fe-SOD,其中,Cu/Zn-SOD主要存在于真核细胞的细胞质中,Fe-SOD主要存在于原核细胞和真核细胞的基质中,Mn-SOD主要存在于原核细胞及少数植物细胞中[7]。
贝类属于无脊椎动物,其体内不具备特异性免疫系统,而为异于脊椎动物的独特非特异性免疫机制[8]。捕后流通过程中,温度、氧气、震荡等胁迫因素会对贝类的生理状态等方面有一定影响,目前,国内外在贝类养殖学以及病害学领域,已有大量缺氧和干露胁迫对贝类免疫系统影响及其机理的研究。参与贝类免疫防御的因子主要有水解酶、抗氧化酶、凝集素等[9]。虾夷扇贝在捕后流通过程中,面临多方面剧烈胁迫,其中干露处置的频繁出现会造成缺氧等胁迫。闭壳肌是虾夷扇贝的主要可食部位,最近,本研究团队郑尧等[10]从SOD、酸性磷酸酶(ACP)、溶菌酶(LSZ)及CAT 等因子出发,对缺氧胁迫下虾夷扇贝的非特异性免疫机制与扇贝活品品质的关联展开了初步探索。在此研究基础上,本研究中着重考察闭壳肌中的SOD,对捕后干露处置下活品虾夷扇贝的抗氧化机制进行初步探索,包括SOD的变化规律、稳定性和其他基本特性,以及粗酶水溶性蛋白的分布特性,以探究干露对活品虾夷扇贝闭壳肌SOD酶活及其性质的影响。
试验用活品虾夷扇贝购自獐子岛集团股份有限公司,为当日采捕的底播养殖扇贝。试验用仪器主要有:800s匀浆机(美国WARING公司);HG-200均质机(日本HSIANGTAI公司);高速离心机(德国HERMLE Labortechnik GmbH公司);UV-1800PC紫外分光光度计(上海美谱达仪器有限公司)。
试验用试剂主要有:聚丙烯酰胺凝胶电泳(SDS-PAGE)试剂购自美国Sigma公司;蛋白标准品购自美国BioLabs公司;Tris、盐酸、氯化钠、邻苯三酚、柠檬酸、过氧化氢、SDS等试剂皆为国产分析纯。
1.2.1 保活效果试验 将活品虾夷扇贝运至实验室后,立即取8个扇贝作为第1天的样品即初始点样本I,迅速开壳取闭壳肌,匀浆后装袋用干冰速冻,于-40 ℃下贮藏,用于后续SOD酶活测定及其性质研究。其余活品扇贝分3个处理组进行干露贮藏试验,每组8个扇贝,分别为4 ℃充氧包装组(记为CDo组)、4 ℃充气包装组(记为CDa组)及室温(20 ℃)充气包装组(记为ADa组)。干露贮藏期间,每日对各组进行采样直至扇贝死亡,对死亡当日的扇贝也进行采样,样品处理方式与第1天的样品相同。
1.2.2 粗酶提取液的制备及测定
(1)粗酶提取液的制备。取2.0 g闭壳肌匀浆,加入10 mL 0.1 mol/L NaCl和20 mmol/L Tris-HCl缓冲溶液(pH 7.5)。在10 000 r/min下均质3次(每次30 s,间隔30 s)后离心10 min(10 000g),取上清液即为粗酶,提取过程均在4 ℃下进行,用双缩脲法[11]测定粗酶蛋白含量。
(2)粗酶提取液分子量分布。采用SDS-PAGE方法[12]测定粗酶的分子量分布,其中浓缩胶的质量分数为5%,分离胶的质量分数为12.5%,采用考马斯亮蓝R-250染色法检验,用醋酸-甲醇溶液进行脱色。
(3)粗酶提取液SOD酶活测定。采用改进的邻苯三酚自氧化法[13]测定SOD酶活力。邻苯三酚在弱碱性条件下能发生自氧化,产生超氧阴离子自由基、半醌自由基、醌类等中间和最终产物[14],SOD能够催化超氧阴离子发生歧化反应,从而抑制中间产物的积累,在325 nm下通过动力学测定邻苯三酚吸光度值的变化进而测得SOD的酶活。
① 邻苯三酚自氧化速率测定。在25 ℃下,将4.5 mL 50 mmol/L Tris-HCl缓冲溶液(pH 8.2)预热20 min。加入邻苯三酚溶液后立即混合并注入比色皿中,于325 nm下测定吸光值,每30 s记录1次,直至210 s。计算每分钟吸光度值的增加(∆A),即为邻苯三酚自氧化速率A0。邻苯三酚自氧化速率控制在0.07 OD/min,邻苯三酚浓度为0.1 mmol/L。
② SOD酶活测定。按①所述步骤,加入0.5 mL粗酶液抑制邻苯三酚自氧化,于325 nm下测定吸光值,每30 s记录1次,直至210 s。计算每分钟吸光值的变化率即为SOD对邻苯三酚自氧化速率的抑制。酶活定义为:每分钟抑制邻苯三酚自氧化率50%的酶量为一个酶活力单位(U)。SOD比活力计算公式为
SOD比活力![]()
其中:A0为邻苯三酚自氧化速率(OD/min);As为加入样液后的氧化速率(OD/min);V为加样体积(mL);N为样品稀释倍数;n为粗酶液蛋白浓度(mg/mL)。
1.2.3 粗酶提取液SOD酶学性质
(1)热稳定性。取1.2 mL粗酶液于离心管中,分别在20、25、30、35、40、45、50、55、60、65、70、75 ℃下加热10 min后迅速置于冰水浴中冷却后测定酶活。
(2)pH稳定性。取粗酶稀释液0.5 mL于试管中,加入0.5 mol/L pH分别为3、4、5、6、7、8、9、10的缓冲溶液,使其浓度为20 mmol/L,并于4 ℃下处理1 h后再加入50 mmol/L Tris-HCl缓冲溶液(pH 8.2),测定其酶活,以未经处理的粗酶提取液的SOD酶活定义为100%。
1.2.4 金属离子和抑制剂对SOD活性的影响试验 (1)金属离子。用不同浓度(0、0.01、0.03、0.05、0.1、0.3、0.5、1.0 mmol/L)的Fe3+、Cu2+、Zn2+、Mn2+处理粗酶30 min后测定其SOD酶活。
(2)抑制剂。用十二烷基硫酸钠(SDS)、柠檬酸(浓度均为0、0.01、0.03、0.05、0.1、0.3、0.5、1.0 mmol/L)和过氧化氢(H2O2)(浓度为0、0.054、0.162、0.269、0.377、0.485 mmol/L)抑制剂处理粗酶30 min后测定其SOD酶活,以未经处理的粗酶提取液的SOD酶活定义为100%。
试验结果均以平均值±标准差表示,试验数据采用SPSS 18.0软件进行处理,用单因素分析法进行方差分析,用Duncan法进行组间多重比较,显著性水平设为0.05。
2.1.1 不同干露处理下活品虾夷扇贝的保活效果 初步观察的结果表明,干露贮藏条件对活品虾夷扇贝保活有影响。从表1可见,冷却充氧包装组(CDo)在第6天时全部死亡,冷却充气包装组(CDa)在第4天时全部死亡,而常温充气包装组(ADa)则在第2天就全部死亡。Rupp等[15]研究表明,高温组(23.5 ℃)扇贝的存活率显著降低(P<0.05)。缺氧分为环境型缺氧和功能型缺氧,干露条件下,扇贝的缺氧类型为环境型缺氧[16],导致活品虾夷扇贝的呼吸方式由有氧呼吸转变为无氧呼吸,从而影响扇贝正常的生理代谢。低温条件下,扇贝代谢活动较弱,而高温条件下,其生理代谢速率加快,进一步缩短了其保活期。由此可初步判断,冷却及供氧对于干露保活虾夷扇贝有较重要的影响。
表1不同干藏条件下活品虾夷扇贝的保活效果
Tab.1SurvialeffectsofyessoscallopPatinopectenyessoensisindrystorage
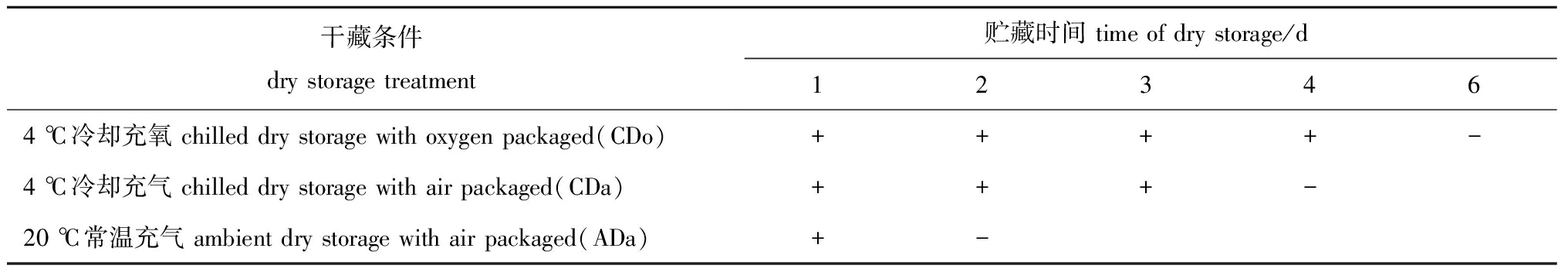
干藏条件dry storage treatment贮藏时间 time of dry storage/d123464 ℃冷却充氧 chilled dry storage with oxygen packaged(CDo)++++-4 ℃冷却充气 chilled dry storage with air packaged(CDa)+++-20 ℃常温充气 ambient dry storage with air packaged(ADa)+-
注:+表示活体;-表示死亡
Note:+,alive;-,dead
2.1.2 干露贮藏过程中闭壳肌水溶性蛋白的变化 从图1可见:冷却充氧包装组扇贝闭壳肌水溶性蛋白含量在第2天时略有升高,第2 天与第3天时无显著性差异(P>0.05),随后逐渐降低,第6天死亡当日扇贝闭壳肌水溶性蛋白含量显著降低(P<0.05);冷却充气包装组扇贝闭壳肌水溶性蛋白含量在第2天时也略有升高,随后逐渐降低;3个处理组第2天时的水溶性蛋白含量均无显著性差异(P>0.05)。说明在干藏过程中,虾夷扇贝闭壳肌水溶性蛋白出现逐渐降解趋势。刘金洋等[2]研究发现,捕后不同处置方式对虾夷扇贝闭壳肌水溶性蛋白组成未产生明显影响。出现这种现象的原因可能是干露后期,扇贝所受胁迫更为剧烈,致其体内产生大量的氧自由基,从而对自身蛋白质造成一定损伤[17]。
对不同干露处理组的水溶性蛋白即粗酶提取物进行SDS-PAGE分析,结果如图2所示。从图2可见:不同干露处理下,虾夷扇贝闭壳肌粗酶相对分子质量分布在44 000(卵清蛋白)附近的条带变化明显,4 ℃充氧包装组扇贝闭壳肌粗酶提取液第2、3天时及4 ℃充气包装组第2天时的条带相比于第1天时(初始样本)的条带颜色变深,随后变浅,进一步证明扇贝闭壳肌粗酶提取液中水溶性蛋白含量的变化。有研究报道,过饥饿状态下的鱼其肌肉水溶性蛋白组分会发生改变,如Yamashita等[18]发现,处于停止进食状态的繁殖洄游的大麻哈鱼Oncorhynchusketa,其普通肉的水溶性蛋白含量比进食状态下的低40%,这主要源于其肌肉组织蛋白酶的变化。相比之下,停止进食状态下的贝类水溶性蛋白的变化虽然不是十分剧烈,但由此可推测,缺氧和温度等胁迫对虾夷扇贝造成了一定影响,而贝类肌肉中有关酶的变化机制有待进一步探讨。
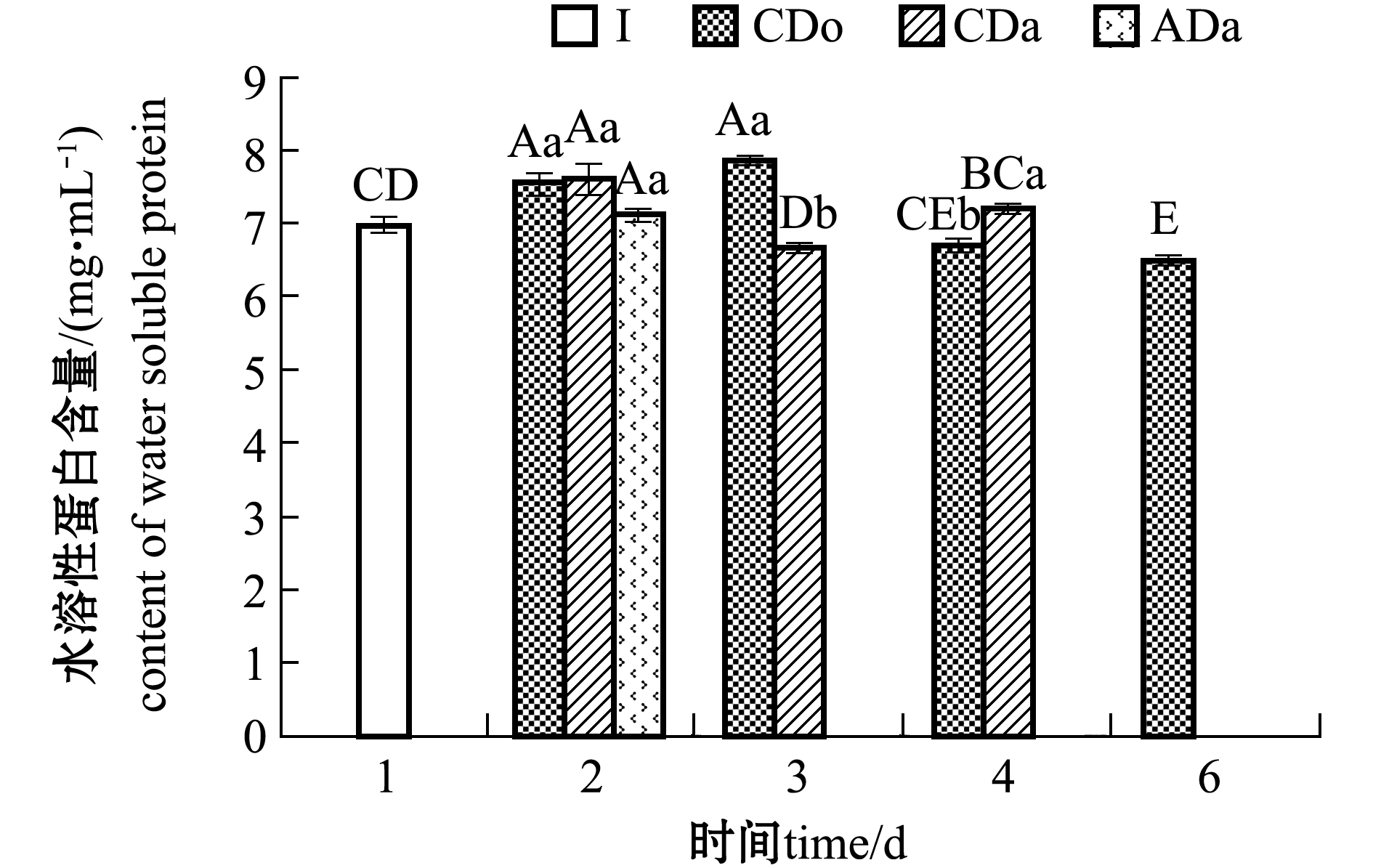
注:标有不同大写字母者表示同一贮藏条件不同时间下有显著性差异(P<0.05),标有不同小写字母者表示同一时间不同贮藏条件下有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05);I 为初始样本;CDo 为冷却充氧包装组;CDa为冷却充气包装组;ADa为常温充气包装组,下同
Note:The means with different capital letters in same condition are significantly different in different time at the 0.05 probability level, the means with different letters in the same time being significantly different in different conditions at the 0.05 probability level, and the means with the same letters are not significant differences, et sequentia; I, initial sample.CDo, chilled dry storage with oxygen packaged; CDa, chilled dry storage with air packaged; ADa, ambient dry storage with air packaged,et sequentia
图1 不同干藏条件下活品虾夷扇贝闭壳肌水溶性蛋白的变化
Fig.1 Changes of water-soluble protein of live yesso scallop Patinopecten yessoensis in dry storage
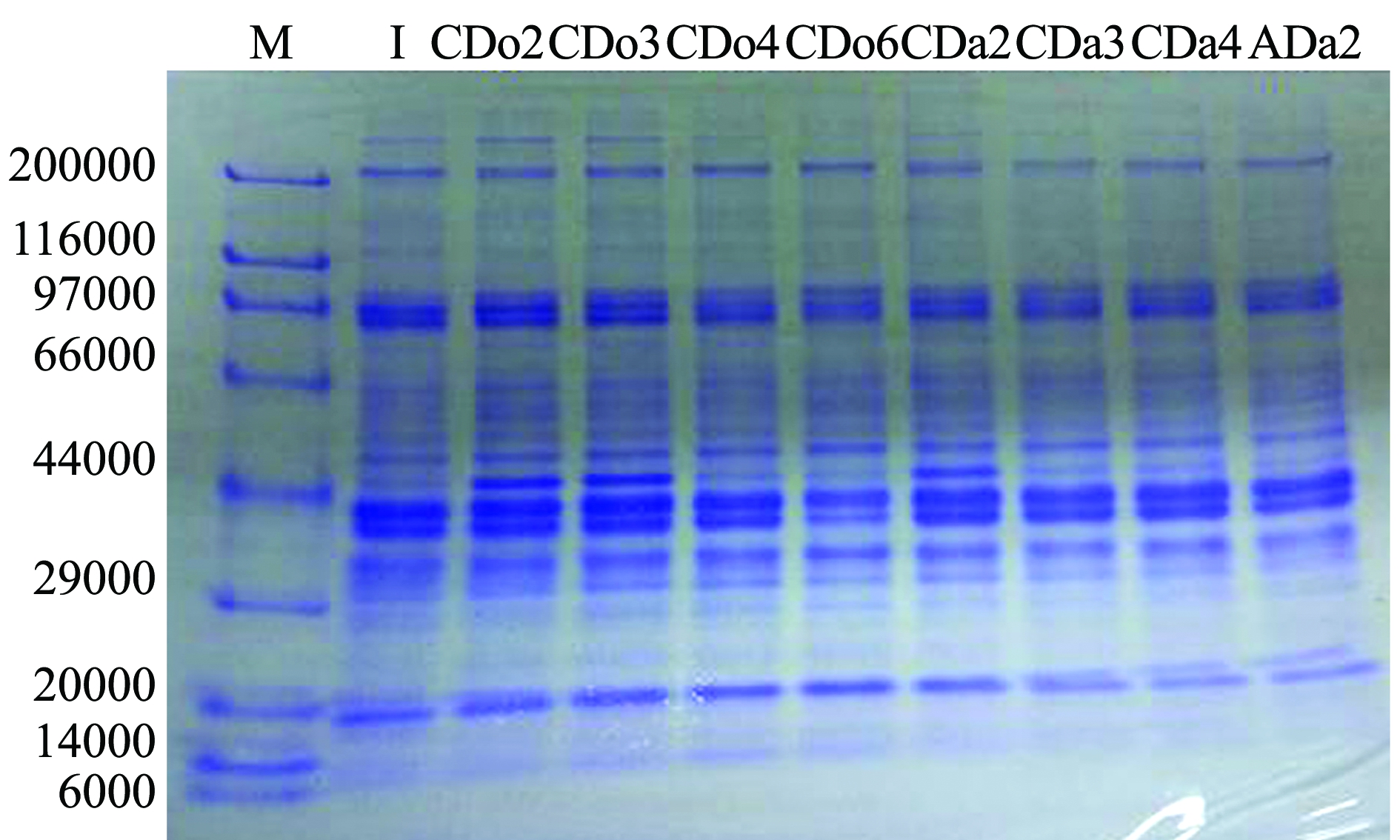
注:M为标准蛋白;I为初始样本;CDo2~CDo6为冷却充氧包装第2~6天的样品;CDa2~CDa4为冷却充气包装第2~4天的样品;ADa2为常温充气包装第2天的样品
Note:M,Marker;I,initial sample;CDo2-CDo6,sample in chilled dry storage with oxygen packaged from the second day to the sixth day;CDa2-CDa4,sample in chilled dry storage with air packaged from the second day to the fourth day;ADa2,sample in ambient dry storage with air packaged in the second day
图2 不同干露处理组活品虾夷扇贝闭壳肌水溶性蛋白组分分析
Fig.2 Molecular weight distributions of water-soluble protein in adductor of live dry storaged yesso scallop Patinopecten yessoensis
2.2.1 闭壳肌粗酶提取液的SOD热稳定性和pH稳定性 将粗酶提取液置于不同温度下,测定其SOD的残余酶活力,以观察闭壳肌SOD的热稳定性。从图3可见:活品虾夷扇贝闭壳肌中SOD的热稳定性随温度的升高呈逐渐降低趋势,低于60 ℃时,粗酶提取液的SOD能保持70%以上的活性;当温度高于60 ℃时,SOD酶活逐渐降低,温度达到75 ℃时,SOD残留酶活力仅为40%左右。由此可见,虾夷扇贝闭壳肌SOD同样具有较好的热稳定性[19]。
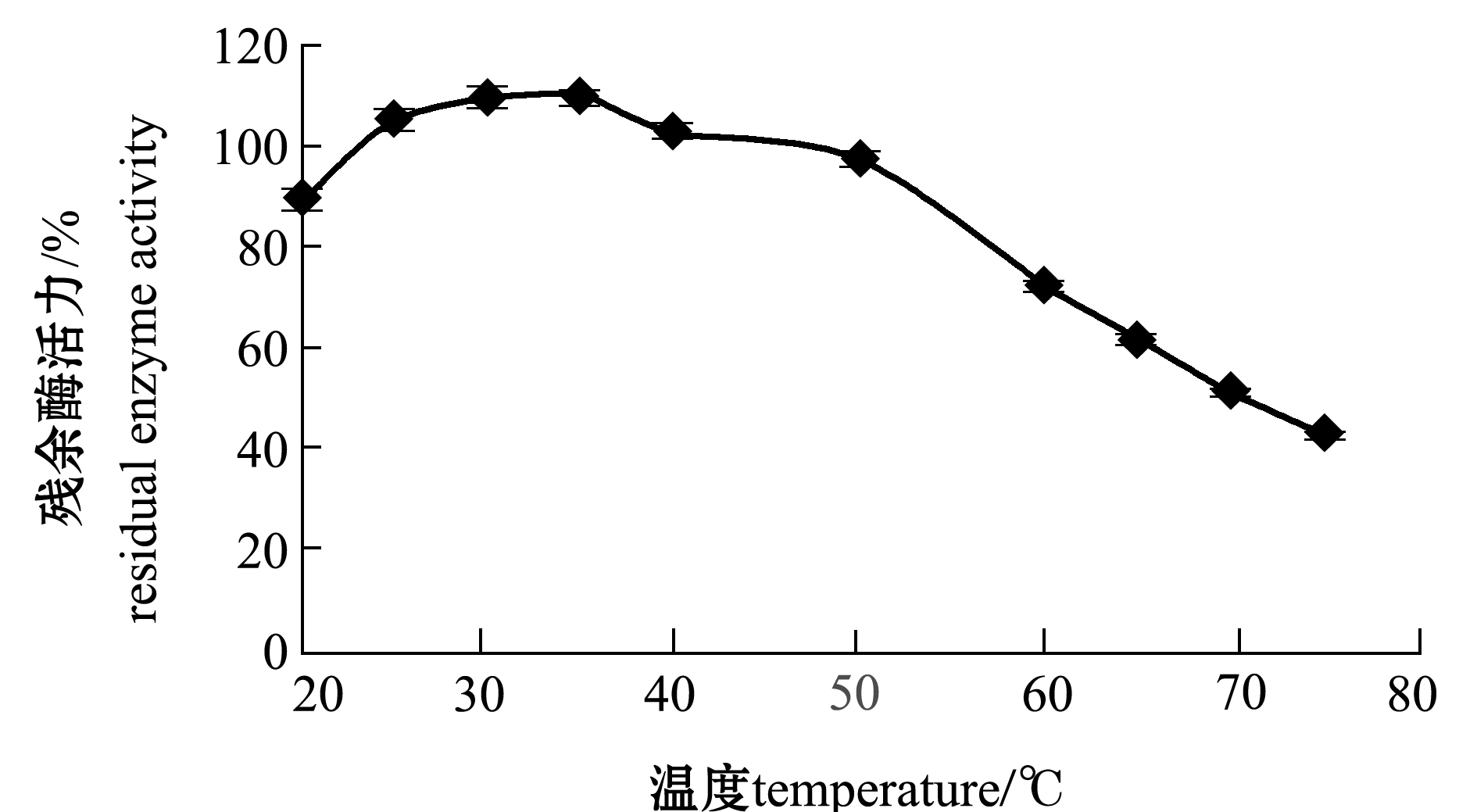
图3 活品虾夷扇贝闭壳肌SOD的热稳定性
Fig.3 Thermal stability of SOD in live Patinopecten yessoensis adductor muscle
本试验中进一步考察了粗酶提取液中SOD在不同pH下的稳定性。从图4可见,在pH为3~10范围内,粗酶提取液的SOD残余酶活随pH的升高呈先上升后下降的趋势,在中性范围最高;总体上,酸性条件下的残余酶活保持在80%以上,而碱性条件下的酶活呈现显著下降趋势,当pH达到10时,酶活仅为原来的50%左右。这是因为,在较低pH范围内,SOD的金属离子趋向于从结合位点解离下来,而在高pH下,SOD酶的构象会发生改变,从而导致酶失活[20]。
目前,关于贝类SOD的研究主要集中在贝类对金属离子等污染物及盐度等胁迫因素的应答[21-25]、贝类SOD的分离纯化[19, 26]等方面,研究部位以闭壳肌、体腔液、内脏等为主。此外,不乏对其他水产品如鱼、虾等的研究,其研究内容除与贝类相似的部分外,还包括对其理化性质的研究[27-28],研究部位集中在内脏、肌肉等。研究发现,SOD是一种热稳定酶,栉孔扇贝血清中的SOD经80 ℃加热依然可以保持较高活性[29]。
本研究是关于虾夷扇贝闭壳肌粗酶提取物中SOD的初步探讨,今后的研究中有待于对粗酶中SOD进一步分离纯化,可以利用SOD热稳定性高的特性,先经热处理除去杂蛋白,再进行后续分离纯化。
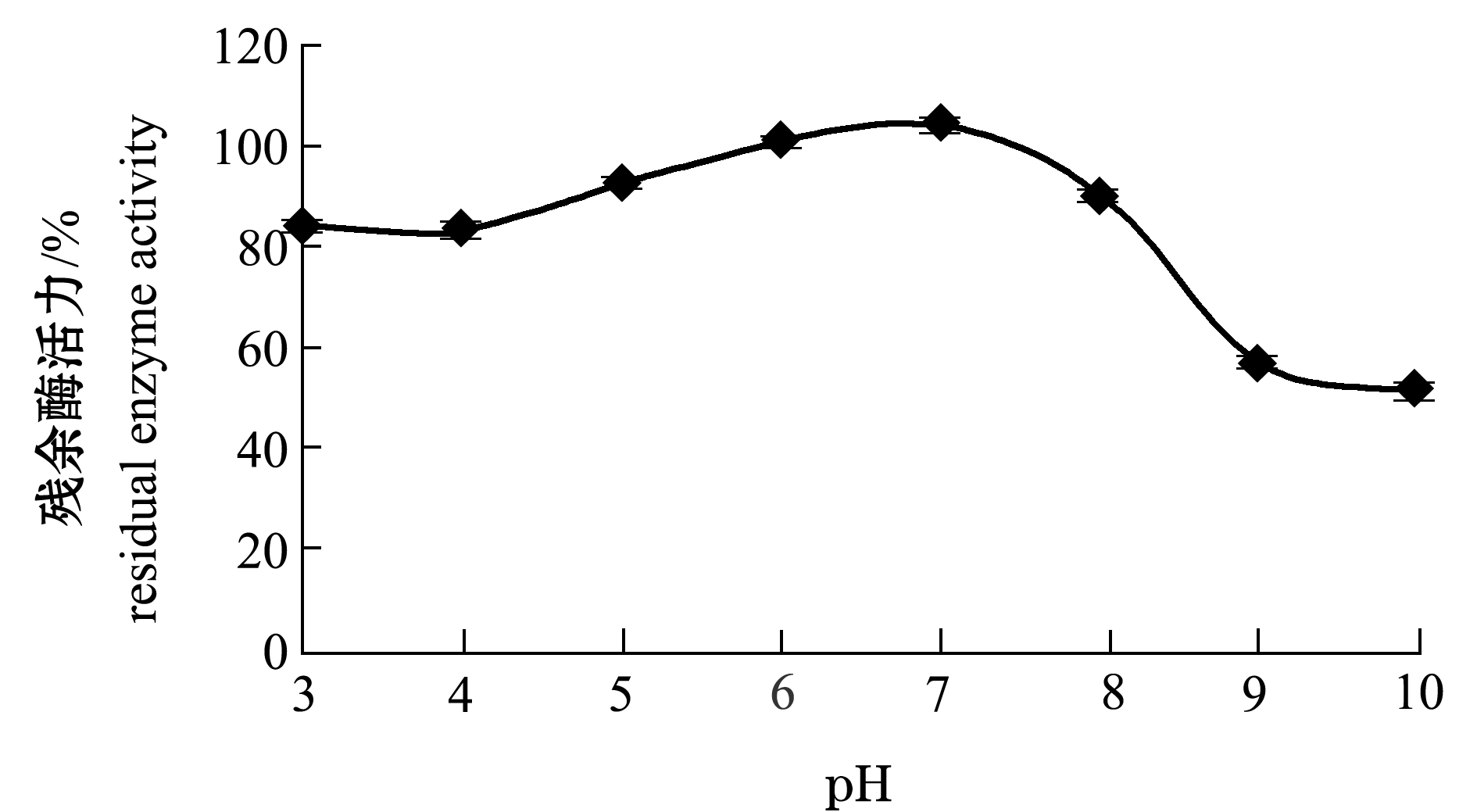
图4 活品虾夷扇贝闭壳肌SOD的pH稳定性
Fig.4 pH stability of SOD in adductor of live yesso scallop Patinopecten yessoensis
2.2.2 金属离子和抑制剂对SOD活性的影响 不同金属离子对粗酶提取液中SOD活性的影响结果如图5所示,从中可以看出,Cu2+、Zn2+、 Fe3+对SOD活性均有抑制作用,其中,Fe3+对SOD的抑制作用尤为明显,当Fe3+浓度达到0.3 mmol/L时,残余酶活力仅为25%左右,而Cu2+浓度达到1.0 mmol/L时,残余酶活力为65%左右;低浓度Mn2+对SOD的活性表现为诱导作用,而高浓度Mn2+则抑制其活性。
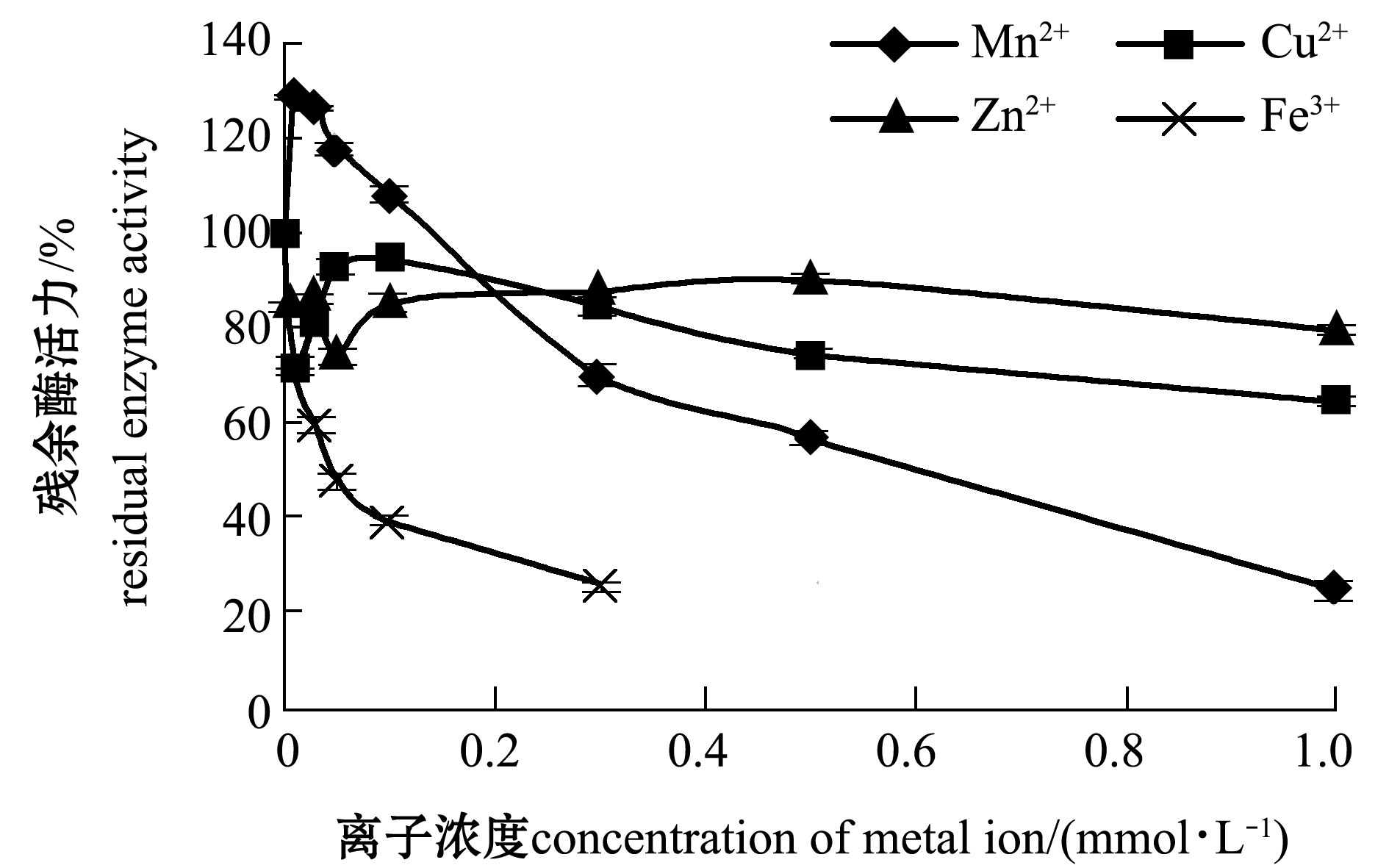
图5 金属离子对活品虾夷扇贝闭壳肌SOD的影响
Fig.5 Effects of metal ions on SOD activity in adductor of live yesso scallop Patinopecten yessoensis
Cu2+、Zn2+、Mn2+是SOD的组成元素,对维持其催化作用与稳定酶的空间构象具有重要作用[28]。目前,关于金属离子对贝类组织中SOD研究较少,但对其他水产品如鱼类的研究较多,沈洪国等[27]对黄鳝内脏中分离纯化的SOD进行性质研究时发现,0.3~0.9 mmol/L的Cu2+均使黄鳝肝脏中的SOD完全失活,王伟伟等[28]对3种虾中SOD部分理化性质研究时发现,低浓度Mn2+促进SOD酶活,高浓度Mn2+抑制其活性。
抑制剂对粗酶提取液中SOD的影响结果如图6所示,从中可以看出,H2O2和SDS对SOD有明显的抑制作用,当SDS的浓度达到1.0 mmol/L时,SOD残余酶活力仅剩40%左右;柠檬酸能够抑制SOD的活性,在浓度为0.01~0.05 mmol/L范围内,柠檬酸的抑制作用逐渐增强,随后逐渐减弱。
SDS是表面活性剂,能够破坏蛋白质的二级和三级结构,因此,SOD酶活逐渐降低;柠檬酸具有螯合作用,可螯合SOD中的金属离子,使其活性下降[30]。根据SOD 的敏感性:Cu/Zn-SOD对氰化钾(KCN)和H2O2敏感,Mn-SOD对KCN和H2O2均不敏感,Fe-SOD对KCN不敏感但对H2O2敏感[27]。本试验结果表明,H2O2能抑制虾夷扇贝闭壳肌中SOD的活性,因此,可初步判定其属于Cu/Zn-SOD或Fe-SOD,具体类型还需进一步探讨。

图6 抑制剂对活品虾夷扇贝闭壳肌中SOD的影响
Fig.6 Effects of inhibitors on SOD activity in adductor of live yesso scallop Patinopecten yessoensis
图7为3个干露处理组的SOD活性分析结果,从图中可见,在温度胁迫下,常温(20 ℃)条件下的SOD活性明显高于冷却时(4 ℃),这是因为常温组遭受胁迫更为严重,从而导致扇贝较快死亡(表1);在缺氧胁迫下,充气组的SOD活性相比于充氧组较高,说明缺氧胁迫造成SOD活性激活;随着干露时间的延长,3个处理组的SOD活性整体呈现上升趋势,第6天死亡当日充氧组扇贝闭壳肌SOD活性显著升高(P<0.05)。这表明,温度、缺氧等胁迫均引起虾夷扇贝闭壳肌中SOD活性应答(P<0.05)。
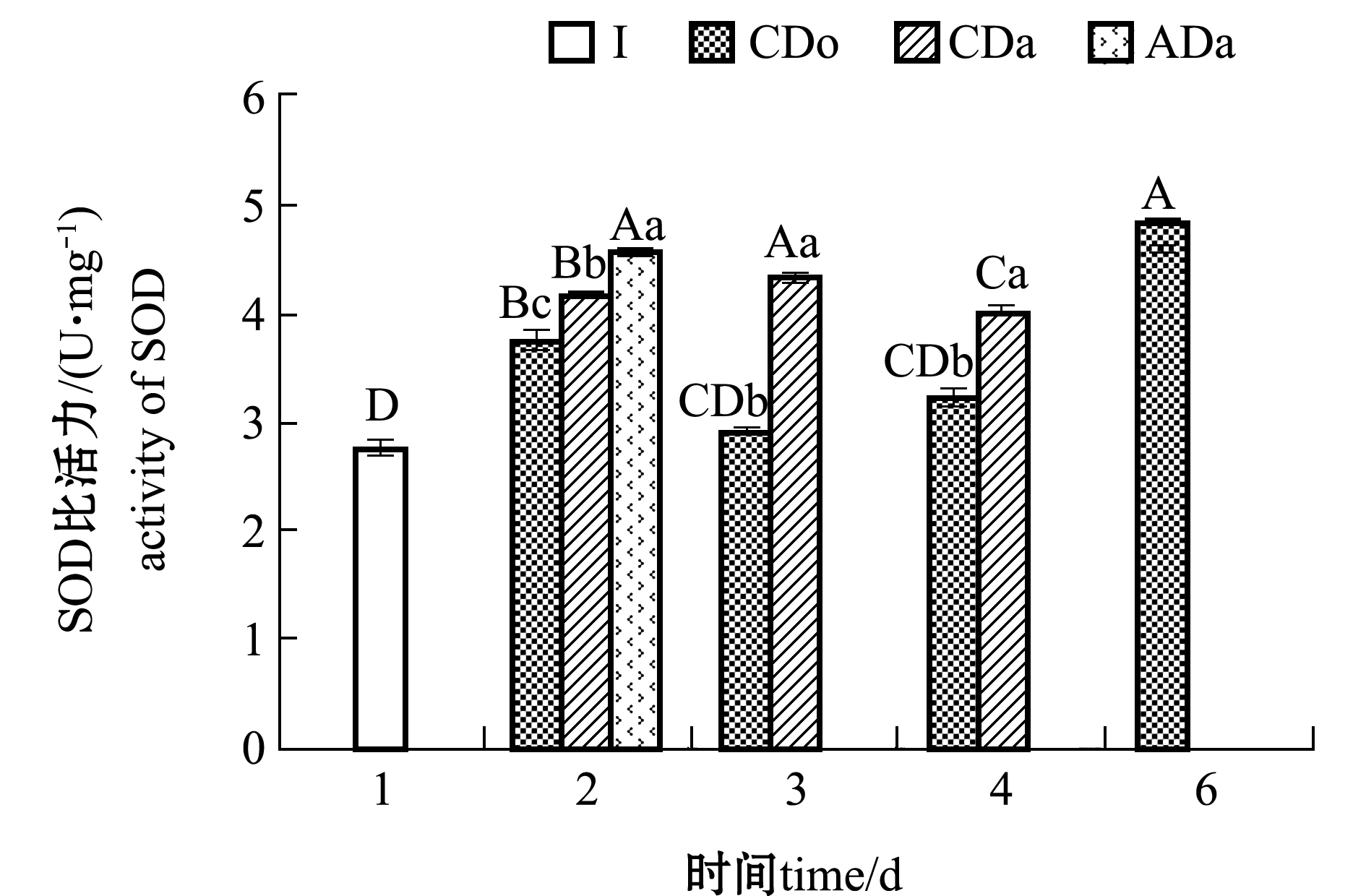
图7 不同干藏处理组活品虾夷扇贝闭壳肌的SOD活性
Fig.7 SOD activities in adductor of live yesso scallop Patinopecten yessoensis in dry storage
目前,针对扇贝中SOD的研究主要集中在扇贝的内脏[19, 22, 31]、血淋巴[32]等组织。郑尧等[10]通过跟踪研究捕后流通过程中活品虾夷扇贝闭壳肌的非特异性免疫因子时初步发现,超氧化物歧化酶活性变化与扇贝所受胁迫强度有一定的相关性。王凡等[31]对受到铜污染的扇贝内脏团的抗氧化酶研究时发现,SOD活性变化与环境中铜离子浓度有关;Pan等[33]通过研究苯并[α]芘对栉孔扇贝抗氧化酶活性的影响发现,当栉孔扇贝受到苯并[α]芘胁迫时,消化腺和鳃中的SOD均作出相应应答;Wang等[34]研究发现,24 h内29 ℃高温会导致扇贝体内SOD活性显著升高。当受到外界胁迫时,扇贝体内活性氧自由基增多,损害细胞膜,进一步破坏扇贝体内的活性氧代谢平衡,从而对扇贝造成损伤[35]。
(1)温度与供氧对虾夷扇贝的捕后干露保活有较大的影响。温度较高及供氧不足的情况下,活品遭受较剧烈的胁迫导致快速死亡,干露贮藏期间伴随闭壳肌水溶性蛋白含量及组分的变化;同时SOD对干露条件下的胁迫产生应答,温度较高时,扇贝所受胁迫增大,SOD活性升高;供氧不足时,扇贝所受胁迫增大,SOD活性同样升高;干露贮藏期间SOD活性总体呈上升趋势。
(2)虾夷扇贝闭壳肌SOD具有较高的耐热性,其耐热温度为60 ℃,其pH稳定范围为中性; Cu2+、Zn2+、 Fe3+、SDS、柠檬酸和H2O2等对SOD活性有抑制作用,低浓度Mn2+对SOD活性有促进作用,高浓度则有抑制作用。
初步研究表明,干露与活品虾夷扇贝中SOD活性有一定相关性,值得深入探讨。
参考文献:
[1] 农业部渔业渔政管理局.中国渔业统计年鉴2017[M].北京:中国农业出版社,2017.
[2] 刘金洋,刘俊荣,田元勇,等.捕后处置对活品底播虾夷扇贝生化代谢的影响[J].水产学报,2017,41(1):81-87.
[3] 刘金洋.虾夷扇贝在活品流通过程中的代谢变化[D].大连:大连海洋大学,2016.
[4] 杨婷婷,刘俊荣,俞微微,等.活品流通过程中虾夷扇贝风味品质的变化[J].水产学报,2015,39(1):136-146.
[5] 傅润泽,沈建,王锡昌.底播虾夷扇贝活品流通前后挥发性成分的对比分析[J].食品科学,2015,36(2):110-113.
[6] 张克烽,张子平,陈芸,等.动物抗氧化系统中主要抗氧化酶基因的研究进展[J].动物学杂志,2007,42(2):153-160.
[7] 林庆斌,廖升荣,熊亚红,等.超氧化物歧化酶(SOD)的研究和应用进展[J].化学世界,2006,47(6):378-381.
[8] 周作强,丁晴晴,刘其根,等.缺氧对贝类的胁迫效应及对其免疫系统的影响[J].生态毒理学报,2013,8(3):324-330.
[9] 孙虎山,李光友.双壳贝类参与免疫防御的体液因子[J].海洋科学,2001,25(4):34-36.
[10] 郑尧,刘俊荣,周晏琳,等.捕后虾夷扇贝闭壳肌免疫因子与活品品质评价初探[J].大连海洋大学学报,2017,32(2):217-223.
[11] 路苹,于同泉,王淑英,等.蛋白质测定方法评价[J].北京农学院学报,2006,21(2):65-69.
[12] 张龙,刘俊荣,田元勇,等.菲律宾蛤仔(Ruditapesphilippinarum)软体部位含氮物的组成及其分布[J].食品科学,2015,36(24):95-100.
[13] 桂兴芬,阎家麒,朱建梅.几种改进的邻苯三酚自氧化法测定超氧化物歧化酶活性的比较[J].中国兽医科学,1993,23(1):23-24.
[14] 高若梅,邹洪,袁倬斌.用电化学方法研究邻苯三酚的自氧化机理[J].分析化学,1997,25(3):297-300.
[15] Rupp G S,Parsons G J.Effects of salinity and temperature on the survival and byssal attachment of the lion’s paw scallopNodipectennodosusat its southern distribution limit[J].Journal of Experimental Marine Biology and Ecology,2004,309(2):173-198.
[16] Lee A C,Lee K T.The enzyme activities of opine and lactate dehydrogenases in the gills,mantle,foot,and adductor of the hard clamMeretrixlusoria[J].Journal of Marine Science and Technology,2011,19(4):361-367.
[17] De Almeida E A,Celso Dias Bainy A,De Melo Loureiro A P,et al.Oxidative stress inPernapernaand other bivalves as indicators of environmental stress in the Brazilian marine environment:antioxidants,lipid peroxidation and DNA damage[J].Comparative Biochemistry and Physiology Part A:Molecular & Integrative Physiology,2007,146(4):588-600.
[18] Yamashita M,Konagaya S.High activities of cathepsins B,D,H,and L in the white muscle of chum salmon in spawning migration[J].Comparative Biochemistry and Physiology Part B:Comparative Biochemistry,1990,95(1):149-152.
[19] 王跃军,孙谧,李民,等.扇贝超氧化物歧化酶的纯化及性质研究[J].海洋水产研究,1998,19(2):69-75.
[20] 吴燕燕,李来好,郝志明,等.罗非鱼肝脏中超氧化物歧化酶的提取、纯化与分析[J].水产学报,2007,31(4):518-524.
[21] 王晓宇.四角蛤蜊Mactraveneriformis对镉和汞污染胁迫的生理响应[D].北京:中国科学院研究生院(海洋研究所),2009.
[22] 赵艳芳,吴继法,翟毓秀,等.镉胁迫对不同镉富集能力海水养殖贝类抗氧化能力的影响——以扇贝和菲律宾蛤仔为例[J].生态毒理学报,2014,9(2):224-232.
[23] 毕研娇.白泥脱硫废水排海的生态风险评估[D].青岛:中国海洋大学,2012.
[24] 王清.几种重金属和有机污染物对文蛤Meretrximeretrix生态毒理效应的研究[D].北京:中国科学院研究生院(海洋研究所),2010.
[25] 吕昊泽.缢蛏、光滑河蓝蛤和河蚬对盐度的适应性及碳、氮收支研究[D].上海:上海海洋大学,2014.
[26] 肖湘,俞丽君,郑扬明,等.贻贝超氧化物歧化酶的分离纯化和部分性质[J].台湾海峡,1999,18(2):177-180.
[27] 沈洪国,唐云明,韩晨霞.黄鳝内脏铁型超氧化物歧化酶的纯化[J].水产科学,2005,24(2):15-17.
[28] 王伟伟,刘存歧,李道季,等.3种虾超氧化物歧化酶部分理化性质比较[J].水产科学,2009,28(4):200-204.
[29] 孙虎山,李光友.栉孔扇贝血淋巴中超氧化物歧化酶和过氧化氢酶活性及其性质的研究[J].海洋与湖沼,2000,31(3):259-265.
[30] 高梦祥,杨凤琴.冬瓜多酚氧化酶的特性及抑制剂研究[J].食品科技,2008,33(2):11-14.
[31] 王凡,赵元凤,吕景才,等.铜污染对扇贝内脏团抗氧化酶活性的影响[J].水产科学,2008,27(12):622-624.
[32] 石芳芳.栉孔扇贝和海湾扇贝免疫防御特性的比较研究[D].北京:中国科学院研究生院(海洋研究所),2006.
[33] Pan Luqing,Ren Jiayun,Zheng Debin.Effects of benzo(a)pyrene exposure on the antioxidant enzyme activity of scallopChlamysfarreri[J].Chinese Journal of Oceanology and Limnology,2009,27(1):43-53.
[34] Wang Xingqiang,Wang Lingling,Zhang Hua,et al.Immune response and energy metabolism ofChlamysfarreriunderVibrioanguillarumchallenge and high temperature exposure[J].Fish & Shellfish Immunology,2012,33(4):1016-1026.
[35] 高振锟,张继红,李敏,等.温度波动对不同规格虾夷扇贝(Patinopectenyessoensis)生理和免疫指标的影响[J].渔业科学进展,2017,38(3):148-154.
ZHOU Yan-lin, ZHENG Yao, LIU Hui-hui, ZHANG Qing, SONG Yang, TIAN Yuan-yong, LIU Jun-rong
(College of Food Science and Engineering, Dalian Ocean University, Dalian 116023, China)
Abstract:Activity and characteristics of superoxide dismutase (SOD) in an adductor were determined in yesso scallopPatinopectenyessoensisexposed to chilled dry storage with oxygen packaged(CDo) and air packaged(CDa) at 4 ℃, and ambient dry storage with air packaged (ADa) at 20 ℃ to explore the quality mechanism of post-harvest live scallop and metabolic suppression during live dry storage. High mortality due to hypoxia and higher temperature were observed in the scallop in group ADa, while prolonged survival period was found in the scallop exposed to chilling treatment in group CDo. During chilling exposure, the water-soluble protein content of the adductor was decreased slightly, and SDS-PAGE showed that the protein nearby the ovalbumin (44 000) was to some extent degraded. There was higher activity of SOD in the scallop adductor in group ADa than that in groups CDo and CDa, higher in group CDa than that in group CDo, though the SOD activity was shown to be increased in all groups during the dry storage. SOD activity was found to be heat stable in adductor of the scallop at heat-stable temperature of 60 ℃ and inhibited by Cu2+, Zn2+, Fe3+, SDS, citric acid and H2O2. However, the SOD activity was promoted at low concentration of Mn2+and inhibited at high concentration of Mn2+. The findings indicate that there is correlation between the anaerobic stress and the superoxide dismutase activity in live scallop adductor muscle, and that further investigation is required to clarify this mechanism.
Keywords:Patinopectenyessoensis; live dry storage; adductor; superoxide dismutase
通信作者:刘俊荣(1963—), 女, 博士, 教授。E-mail:ljunrong@dlou.edu.cn
作者简介:周晏琳(1993—), 女, 硕士研究生。E-mail: Zhouyl0821@163.com
基金项目:国家自然科学基金资助项目(31671790,31271980);辽宁省自然科学基金指导计划(201602105)
收稿日期:2017-12-19
文章编号:2095-1388(2018)05-0651-07
DOI:10.16535/j.cnki.dlhyxb.2018.05.017
文献标志码:A
中图分类号:TS254.4