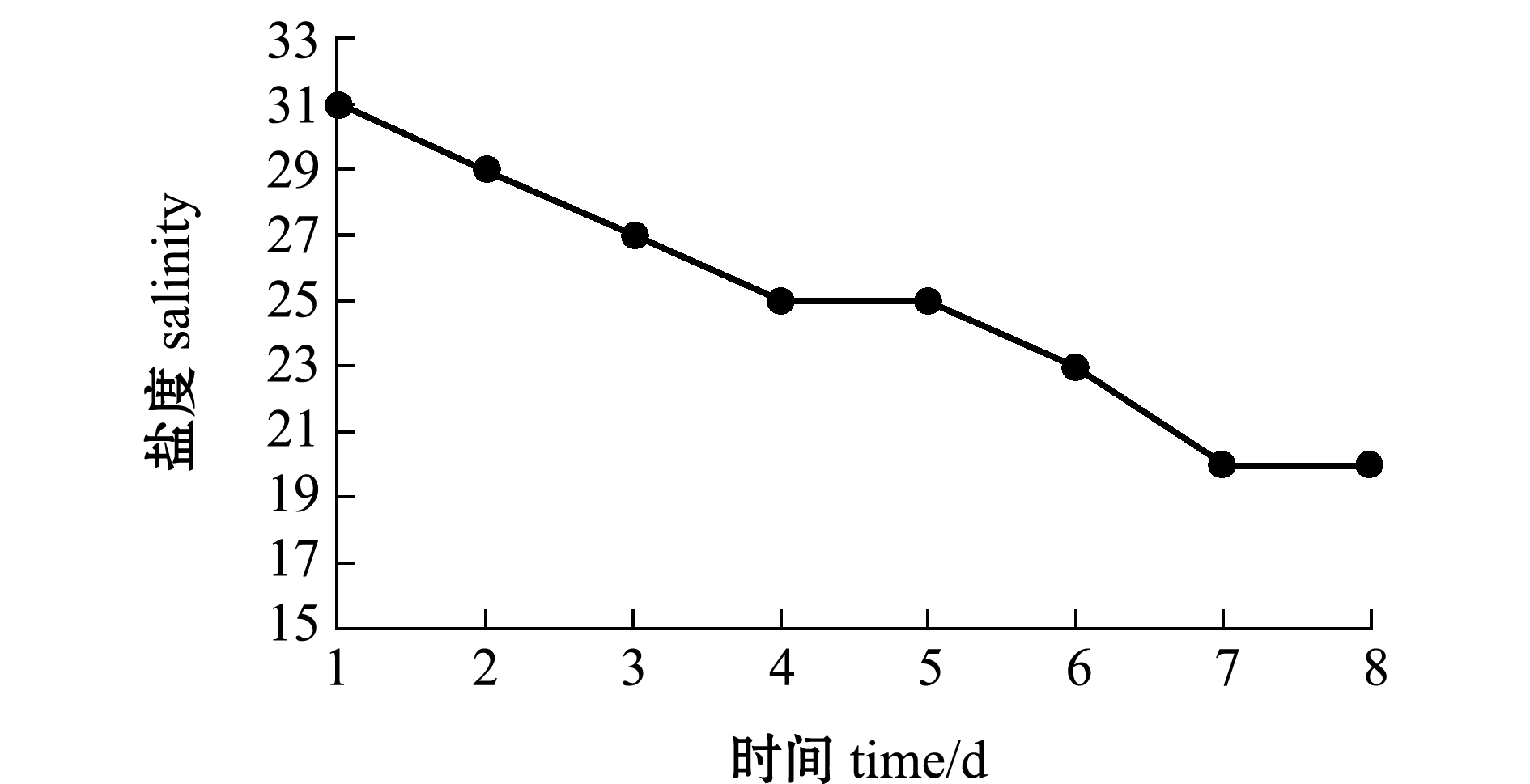
图1 盐度变化模式图
Fig.1 Diagram of the salinity change patterns
李晓雨1、2,田燚1、2,王伟1、2,李延涛3,刘钢1、4,郭然1,丛佳1
(1.大连海洋大学 水产与生命学院,辽宁 大连 116023;2.农业部北方海水增养殖重点实验室,辽宁 大连 116023;3.大连圣亚旅游控股股份有限公司,辽宁 大连 116023;4.大连海洋大学 水生生物学实验室,辽宁 大连 116023)
摘要:为研究低盐胁迫对白条双锯鱼Amphiprionfrenatus生理指标的影响,试验设置3个盐度组(盐度20、25、31),在水温(25.0±0.5)℃条件下,低盐胁迫后3、12、48 h时测定湿体质量为(5.42±1.29)g的成体白条双锯鱼的血细胞总数、鳃丝Na+-K+-ATP酶(NKA)活力、肝脏超氧化物歧化酶(SOD)和过氧化氢酶(CAT)活力的变化。结果表明:整个低盐胁迫过程中,各试验组白条双锯鱼个体活力正常,无死亡现象;盐度胁迫后48 h时,鱼体血细胞总数随盐度的降低而减少,且20盐度组在48 h时鱼体血细胞数量显著低于对照组(盐度31)和25盐度组(P<0.05);鳃丝Na+-K+-ATP酶(NKA)活力在盐度20、25胁迫下随时间的延长呈先升高后下降的趋势,NKA活力在盐度25整个胁迫期间均显著高于对照组和20盐度组(P<0.05),在盐度20胁迫下,仅在12 h时显著高于对照组(P<0.05);20、25盐度组肝脏SOD活性在各时间点均高于对照组,但无显著性差异(P>0.05);整个试验期间内,20盐度组CAT活力3 h时显著高于对照组(P<0.05),而12 h和48 h均显著低于对照组(P<0.05),25盐度组CAT活力与对照组无显著性差异(P>0.05)。研究表明,盐度20、25胁迫48 h内会显著影响白条双锯鱼的血细胞数、Na+-K+-ATP酶活力,盐度20会显著影响该鱼的CAT活力,但整个低盐胁迫过程并未影响鱼体的摄食和存活,相关生理指标的变化可为白条双锯鱼的淡化养殖提供参考依据。
关键词:白条双锯鱼;低盐胁迫;血细胞数;Na+-K+-ATP酶活性;SOD活力;CAT活力
白条双锯鱼Amphiprionfrenatus隶属于雀鲷科Pomacentridae、海葵鱼属Amphiprion,是最常见的小丑鱼品种之一,因其体色艳丽、易于饲养而深受人们青睐。近年来,海水观赏鱼产业蓬勃发展,其贸易额由1975年仅占世界观赏鱼贸易额的1%增长到2005年的10%[1]。中国的休闲渔业产值也由2011年的256亿元人民币增长到2017年的665亿元人民币[2]。因此,迫切需要对白条双锯鱼进行更深入地研究。
盐度是影响鱼类生存和繁衍的重要环境因子,它与鱼体的渗透压调节、离子浓度变化等各种生理生化反应都关系密切。白条双锯鱼自然分布的珊瑚礁海域环境十分稳定,以大洲岛珊瑚礁海域为例,其周年盐度基本稳定在33,变化范围在1之内[3]。然而,水族箱由于水体小加之温度较高,水分极易蒸发,盐度较容易出现波动,对小丑鱼生长发育会产生一定影响[4]。
由于海水资源的限制,北京海洋馆等许多内陆水族馆均采用人工海水,饲养小丑鱼也以人工海水为主。目前,市售的海盐品质参差不齐,优质海盐价格较为昂贵,如果可以低盐度饲养小丑鱼,则能够节省养殖成本,扩大养殖范围。同时,观赏鱼病害也是困扰养殖户的一大问题,由于部分海水病原微生物不喜低盐,所以单从病原体数量控制方面来说,低盐环境可以降低某些疾病的发生率。因此,低盐度饲养小丑鱼已成为许多水族商家和鱼友们的选择。对于水生生物来说,盐度作为一个重要的环境因子,对生物机体的各项生理生化指标的影响常制约着生物的生长发育,其对离子转运酶和抗氧化酶活性的影响多年来已成为学者研究的热点问题之一。隋延鸣[5]研究表明,盐度为8.7~43.7时,伴随盐度的升高,三疣梭子蟹Portunustrituberculatus体内的NKA活性呈先降低后升高趋势,盐度18.7为其等渗点。钱佳慧等[6]研究指出,盐度和温度对华贵栉孔扇贝Chlamysnobilis血淋巴中SOD和CAT活性所建立的回归模型影响极显著。对于大菱鲆Scophthalmusmaximus幼鱼来说,温度恒定状态下,盐度变化会使各组织中的抗氧化酶活性低于对照组[7]。克氏原螯虾Procambarusclarkii在同一盐度水平胁迫条件下,血清SOD活性会随胁迫时间的延长呈先升高后下降趋势[8]。目前,有关小丑鱼的研究主要集中在生长发育[9]、生活习性[10-11]、人工繁殖和胚胎发育等方面[4,12-13],低盐胁迫对其产生的生理影响方面的研究尚不多见。本研究中,分析了盐度变化对白条双锯鱼血细胞数量、离子转运酶活性和抗氧化酶活性的影响,以期为其低盐饲养的可行性方案提供依据。
试验用1龄健康白条双锯鱼购自辽宁省大连市水族花卉市场,原产于海南岛珊瑚礁海域,湿体质量为(5.42±1.29)g,暂养于辽宁省海洋生物资源恢复与生境修复重点实验室。
试验仪器主要有Olympus显微镜(CX21,Olympus Corporation),多通道酶标仪(SpectraMax i3x型,美谷分子仪器有限公司),高速冷冻离心机(CR22G,株式会社日立制作所)。
1.2.1 饲养管理 试验在容积为160 L的水族箱中进行。将试验鱼首先放入正常盐度为31的海水中暂养7 d,在其状态稳定、正常开口摄食且无任何病害发生后,开始进行后续试验。试验海水为经过沙滤的天然海水,通过添加曝气24 h以上的自来水调节至目标盐度。盐度胁迫期间水温为(25.0±0.5)℃,pH为7.92~8.29,持续充气,保持溶解氧含量为3.7 mg/L以上。每天投喂人工配合饲料1次至其不再摄食为止。整个试验过程中,每天吸底1次,清除残饵粪便。
1.2.2 试验设计 以原产地天然海水盐度31为对照组,盐度25、20为试验组,将暂养的白条双锯鱼随机分为3组,每组设置3个平行,每个平行组饲养10尾鱼,盐度由31每24 h降低2个盐度直至试验组预设值。在盐度达到预设值之后3、12、48 h 时分别从每组随机选取3尾鱼,并在每次取样时称量鱼体质量。用无菌针管抽取其血液于1.5 mL离心管内用于后续试验。存活试验持续至盐度达到预设值后的第15天。

图1 盐度变化模式图
Fig.1 Diagram of the salinity change patterns
1.2.3 指标的测定与计算
(1) 血液细胞数量。采用血球计数板,使用光学显微镜(10×10)对血液细胞数量进行直接计数。每个样本重复统计3次,取其平均值。计算公式为
体细胞数量=A/5×25×B×104。
其中:A为血球计数板中4个角加中间位置共5个方格中的细胞总数;B为稀释倍数。
(2) 鳃组织Na+-K+-ATP酶(NKA)活力的测定。准确称取样品鳃丝(冻存于-80 ℃)的质量,加入9倍体积生理盐水,冰浴条件下机械匀浆后,以2500 r/min离心10 min,取上清液,用10%匀浆上清液定磷法测定Na+-K+-ATP酶活性。样品中蛋白质含量采用考马斯亮蓝染色测试盒(W067,南京建成生物工程研究所)测定。以超微量Na+-K+-ATP酶测试盒(A070-2,南京建成生物工程研究所)检测每小时每毫克鳃组织蛋白组织中ATP分解成ADP产生1 μmoL无机磷的量为一个酶活力单位(U)。
(3) 肝脏超氧化物歧化酶(SOD)活力的测定。利用黄嘌呤氧化酶法,以总超氧化物歧化酶(T-SOD)测试盒(A001-1,南京建成生物工程研究所)检测每毫克组织蛋白在1 mL反应液中SOD抑制率达50%时所对应的SOD量为1个酶活力单位(U)。
(4) 肝脏过氧化氢酶(CAT)活力测定。以CAT测试盒(A007-1,南京建成生物工程研究所)检测每毫克组织蛋白每秒钟分解1 μmol的H2O2的量为一个酶活力单位(U)。
试验数据采用SPSS 22.0和Excel 2013软件进行处理,均用平均值±标准差表示(mean±S.D.),经验证数据符合正态分布后,对于不同盐度胁迫条件下各指标的差异采用单因素方差分析(One-Way ANOVA)进行检验,并使用Duncan多重比较法检验组间差异,显著性水平设为0.05。
存活试验结果表明,白条双锯鱼可在盐度20和25的水体中正常摄食和存活,15 d的试验期间内存活率达100%,无死亡现象。
从图2可见:低盐胁迫48时,白条双锯鱼血细胞数随盐度的降低而减少;盐度25时的血细胞数与对照组(盐度31)无显著性差异(P>0.05),当盐度降至20以后48 h时其血细胞数显著降低(P<0.05),与对照组和25盐度组有显著性差异(P<0.05)。
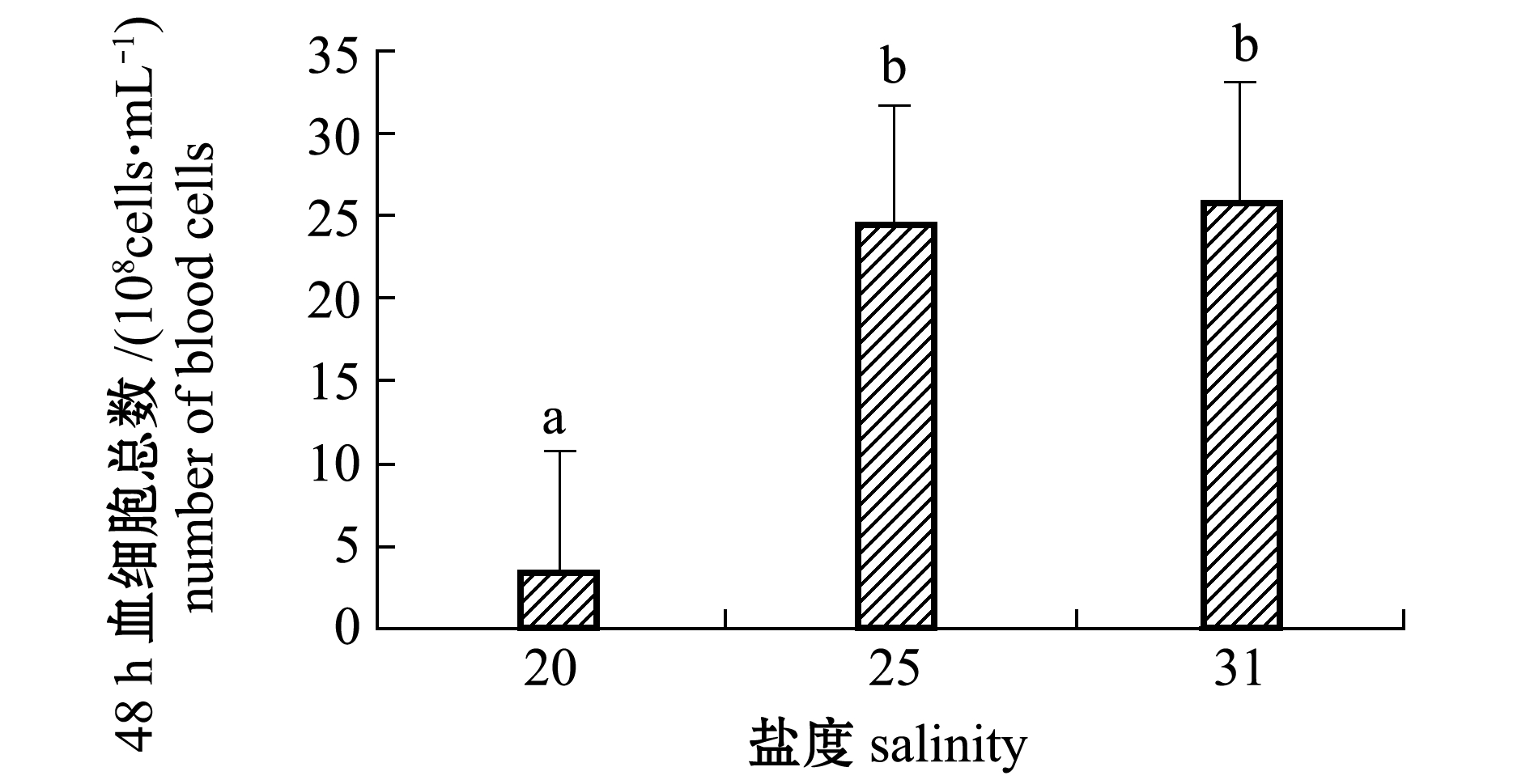
注:标有不同小写字母者表示组间有显著性差异(P<0.05),标有相同小写字母者表示组间无显著性差异(P>0.05)
Note: The means with different letters are significant differences among different groups at the 0.05 probability level, and the means with the same letters are not significant differences
图2 各盐度组48 h时白条双锯鱼血细胞总数
Fig.2 Total number of blood cells in tomato clownfish Amphiprion frenatus in each salinity group at 48 h
从图3可见:随胁迫时间的延长,20、25盐度组Na+-K+-ATP酶活力均呈先显著升高后显著下降的趋势;盐度胁迫3 h时,25盐度组鳃丝Na+-K+-ATP酶活力显著高于对照组和20盐度组(P<0.05),即20盐度组与对照组无显著性差异(P>0.05);盐度胁迫12 h时,25盐度组酶活力显著升高(P<0.05),达到(37.77±1.23)U/mg prot,处于整个试验阶段的最高值,20盐度组活力低于25盐度组但仍显著高于对照组(P<0.05);盐度胁迫48 h时,25盐度组酶活力仍显著高于对照组(P<0.05),20盐度组维持48 h时,Na+-K+-ATP酶活力为(7.94±0.43)U/mg prot,与对照组无显著性差异(P>0.05)。
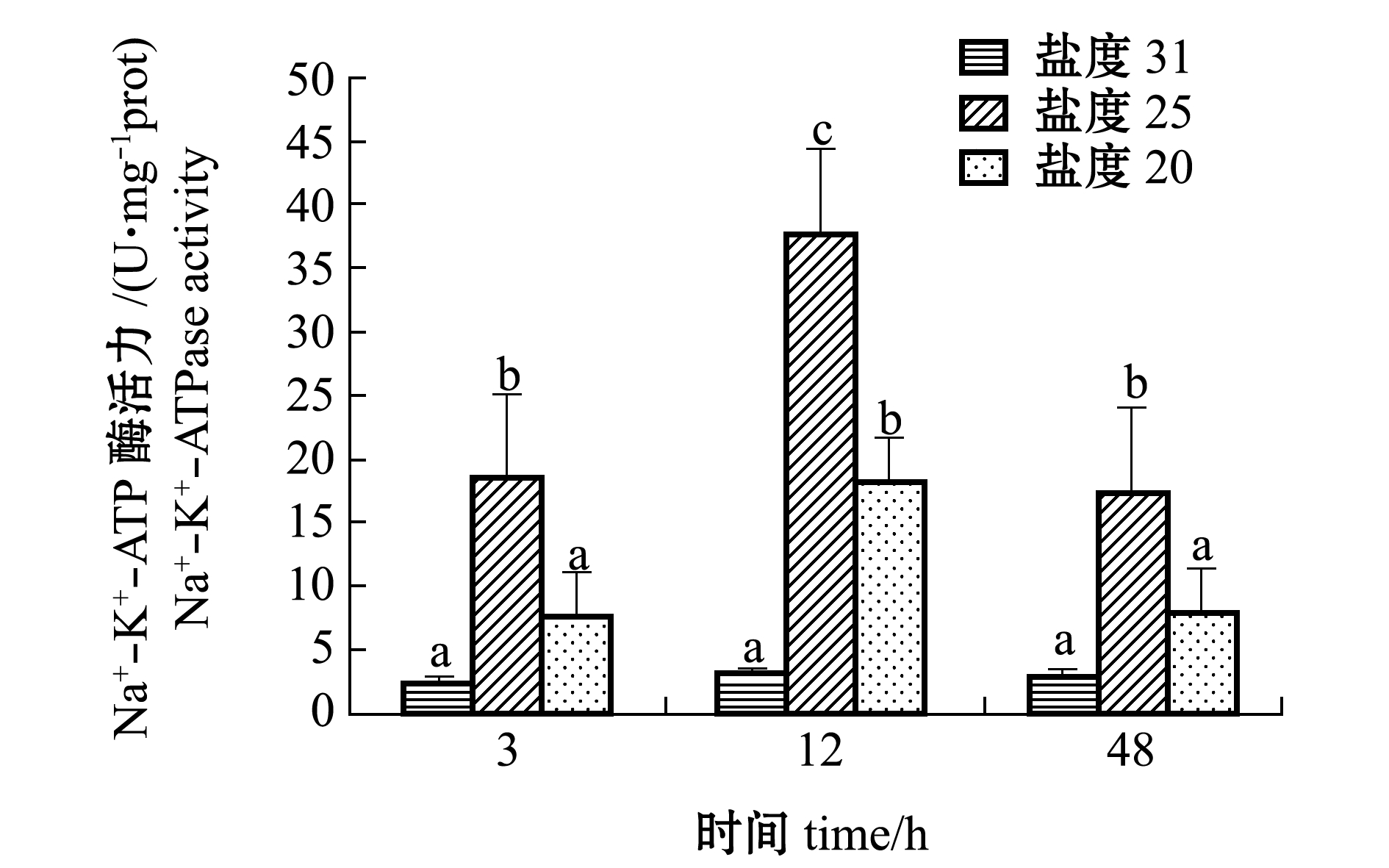
注:标有不同小写字母者表示同一时间下不同盐度组间有显著性差异(P<0.05),标有相同小写字母者表示组间无显著性差异(P>0.05),下同
Note: The means with different letters in the same time are significant differences in different salinity groups at the 0.05 probability level, and the means with the same letters are not significant differences, et sequentia
图3 低盐胁迫对白条双锯鱼鳃丝Na+-K+-ATP酶活力的影响
Fig.3 Effect of low salinity stress on the activities of Na+-K+-ATPase in gill of tomato clownfish Amphiprion frenatus
从图4可见:整个试验周期内,25盐度组肝脏SOD活力随胁迫时间的延长而逐渐升高,20盐度组SOD活力随胁迫时间的延长先升高后略有下降,但各盐度组SOD活力与对照组均无显著性差异(P>0.05)。
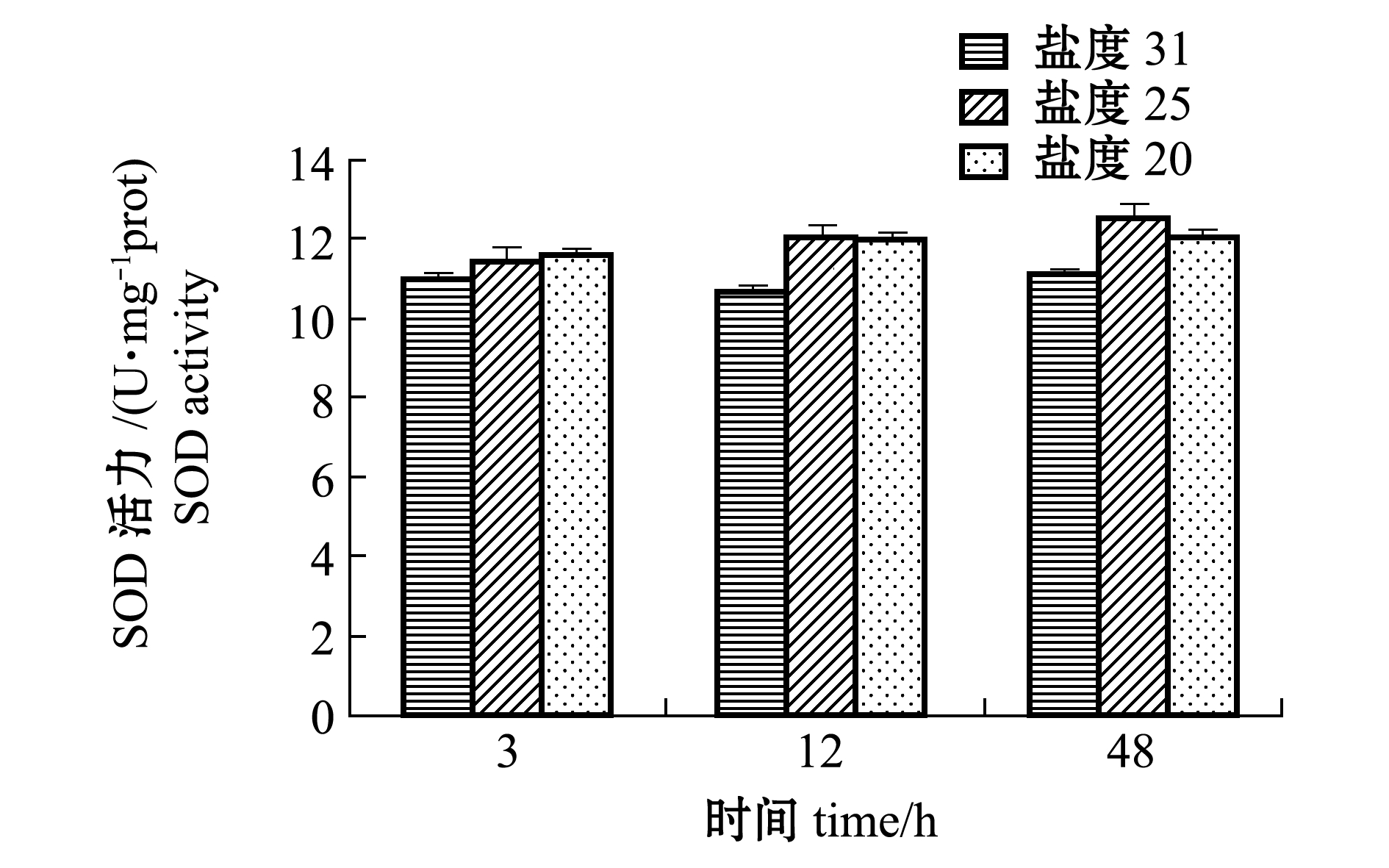
图4 低盐胁迫对白条双锯鱼肝脏SOD活力的影响
Fig.4 Effects of low salinity stress on SOD activity in liver of tomato clownfish Amphiprion frenatus
从图5可见:20盐度组在盐度胁迫初期(3 h)肝脏CAT活力显著高于对照组和25盐度组(P<0.05);随着胁迫时间延长至12 h时酶活力开始下降且显著低于其他两组(P<0.05);继续延长胁迫时间至48 h时,CAT活力持续降低并显著低于对照组(P<0.05),暂无回升趋势;25盐度组肝脏CAT活力随胁迫时间延长有先上升后下降的趋势,但均与对照组无显著性差异(P>0.05)。

图5 低盐胁迫对白条双锯鱼肝脏CAT活力的影响
Fig.5 Effects of low salinity stress on CAT activity in liver of tomato clownfish Amphiprion frenatus
环境胁迫将通过神经内分泌系统的调节使鱼体的血液成分发生变化,各项血液指标可作为判定鱼体营养状况、病理变化,以及对该生存环境的生理性适应等方面的重要依据[14]。研究表明,缺氧会刺激鱼类脾脏释放大量红细胞和血红蛋白以抵御低氧环境[15]。处于低渗环境下,将导致许氏平鮋的线粒体数量有所减少,胞质内微细小管系统变得松散,说明在低盐胁迫下,鱼体进行离子平衡代谢调节的微细小管系统的工作量降低,能量消耗也随之减少[16]。
本试验结果表明,盐度20胁迫48 h时,会使白条双锯鱼血细胞总数明显减少,推测这可能与其在低渗环境中血细胞的凋亡有关。张玉玉等[17]研究表明,随着低盐胁迫时间的延长,长蛸Octopusvariabilis血细胞中的颗粒细胞所占比率呈先升高后下降趋势,小颗粒细胞比率显著降低。王林等[18]研究表明,低盐胁迫会使三疣梭子蟹血细胞数量显著降低,在胁迫12 h后血细胞数量降至最低,后逐渐趋于稳定,该结果与本试验结果一致。血细胞数量及其组成成分与生物体的免疫密切相关,随着低盐度胁迫剧烈程度的增加,血细胞凋亡,同时也改变血液组分以提升机体免疫能力,这是水生生物对低盐胁迫的应激反应和应对策略。另外,此现象也可能与其渗透调节过程中有水分进入血液有关。
国内外许多研究表明,盐度变化对鱼类鳃丝Na+-K+-ATP酶的活性有影响[19-20]。Na+-K+-ATP酶分布于氯细胞基底膜的内褶上,是一种利用分解ATP产生能量进行主动转运,释放Na+、吸收K+的离子泵[14]。鱼类通过改变鳃部氯细胞的数量、类型及位于其上的Na+-K+-ATP酶活性和亚单位异构型以适应外界盐度的变化[21]。本试验中,25盐度组白条双锯鱼鳃丝的Na+-K+-ATP酶活力在整个试验周期内始终显著高于对照组,这是一种对外界环境变化的应激反应。随着盐度继续降低,20盐度组该酶活力在整个试验周期内显著低于25盐度组且与对照组无显著性差异,说明盐度降低至20会对白条双锯鱼的离子转运系统造成伤害。余德光等[22]研究表明,低盐胁迫会使斜带石斑鱼Epinepheluscoioides幼鱼鳃丝Na+-K+-ATP酶活力呈先升高后降低的趋势,与本次试验结果相一致。曾霖等[23]研究表明,大菱鲆幼鱼鳃组织中的Na+-K+-ATP酶活力会随着盐度的升高而升高,在盐度由12上升至36的过程中该酶活力一直呈上升趋势,与本次试验结果有差异,说明不同试验对象、不同试验条件,鱼体对盐度的变化会产生不一样的应答机制。
动物体的SOD和CAT主要存在于肝细胞和红细胞中,肝脏的抗氧化酶活性可代表鱼体的抗氧化能力[24]。细胞中的羟自由基等活性氧的存在会通过氧化应激损伤细胞大分子,对机体产生极为不利的影响,例如脂质的过氧化将干扰和破坏膜的生物功能,加速疾病及衰老现象的产生[25-26]。SOD可催化机体内的超氧化物经歧化反应转化为O2和H2O2,是判断鱼体抗应激能力的重要指标。研究表明,许氏平鮋体内SOD活性会随着水体盐度的降低而逐渐升高[27]。盐度胁迫会使花鲈Lateolabraxmaculatus体内SOD活性水平显著升高,随着时间的推移,由于鱼体对此盐度的适应性,SOD活性水平会逐渐降低至正常水平[28]。本试验中,白条双锯鱼肝脏SOD活力水平在选定时间点测得的值均无显著性差异。推测可能是因为白条双锯鱼对低盐胁迫的适应性较强,也可能是由其他酶来清除机体产生的活性氧,故并未发现肝脏SOD活力显著上升。
CAT可将超氧阴离子自由基歧化反应产生的H2O2催化分解为O2和H2O,使细胞免受H2O2毒害。本试验中,CAT活力在盐度25胁迫3 h和12 h时略有升高,之后又有所恢复,且整个胁迫期间内该酶活力变化并不显著,试验鱼体对盐度25的水环境有较好的适应性。盐度降到20之后3 h时机体开始出现应激反应,CAT活力显著升高,12 h时开始下降并持续下降,至48 h并无回升趋势,这表明白条双锯鱼并未适应盐度20的水环境。崔前进等[29]研究表明,钝吻黄盖鲽Pleuronectesyokohama幼鱼肝脏CAT活力,随低盐胁迫时间的延长呈先上升后下降的趋势。董燕[30]研究表明,盐度22胁迫96 h时会使施氏鲟AcipenserschrenckiBrandt幼鱼肝脏CAT活性呈先升高后降低的趋势,12 h时达到峰值,12 h之前该组与15盐度组无显著性差异,说明当环境盐度超过鱼类最适盐度时,机体会通过提高CAT活力来提升自身的抗氧化能力,每种鱼使CAT活性升高的条件有所不同。胡静等[31]研究指出,同为海葵鱼属的克氏双锯鱼Amphiprionclarkii在低盐胁迫过程中(盐度分别由35降至30、25、20、15),24 h内肝脏CAT活性均呈上升趋势,48 h后逐渐恢复至正常水平,其CAT活性变化明显大于本试验结果,分析原因可能是本试验中降低盐度的过程相对于胡静等的报道试验要缓慢一些,本试验是每天降低盐度2,2~3 d后降至预设盐度,而上述报道中采用的降盐方式是直接将鱼放入预设盐度的水体中。从CAT活性变化来看,显然在缓慢降低盐度这种更为温和的降盐过程中鱼体的应激反应更小,较有利于试验生物的健康。
综上所述,随着盐度的降低,胁迫时间的延长,白条双锯鱼会增强Na+-K+-ATP酶活力以应对环境的改变,机体相应产生应激反应,当鱼体适应低盐胁迫环境后,该酶活性会逐渐恢复正常水平;低盐胁迫对该种鱼体SOD活性无显著性影响,而最低盐度(盐度20)对CAT活性有显著影响。因此,可得出初步结论,白条双锯鱼可以适应盐度25的水环境,但本次试验并未做低盐胁迫对其发育及繁殖的影响。如果在仅要求鱼可以存活的前提下,可以尝试低盐饲养。而缓慢降低盐度,以更温和的方式使鱼体适应低盐环境对其健康养殖更加有利。需要关注的是,低盐胁迫会使白条双锯鱼血细胞数减少,而血液中的白细胞直接参与免疫应答相关过程,其数目减少是否会对鱼体的免疫调节产生较大危害有待今后进一步研究。
参考文献:
[1] 马本贺,马爱军,孙志宾,等.海水观赏鱼产业现状及其存在的问题[J].海洋科学,2016,40(10):151-159.
[2] 农业部渔业渔政管理局.2017中国渔业统计年鉴[M].北京:中国农业出版社,2017:8.
[3] 钱军,李洪武,王晓航,等.大洲岛珊瑚礁海域水质状况分析与评价[J].生态科学,2015,34(6):22-29.
[4] 鞠晨曦.公子小丑鱼(Amphiprionocellaris)胚胎发育的形态学观察及盐度对幼鱼生长的影响[D].上海:上海海洋大学,2013.
[5] 隋延鸣.盐度对三疣梭子蟹“黄选1号”生长及免疫、代谢相关酶的影响[D].上海:上海海洋大学,2012.
[6] 钱佳慧,栗志民,申玉春,等.温度和盐度对华贵栉孔扇贝抗氧化酶活性的联合效应研究[J].南方水产科学,2015,11(6):49-57.
[7] 郭黎,马爱军,王新安,等.盐度和温度对大菱鲆幼鱼抗氧化酶活性的影响[J].大连海洋大学学报,2012,27(5):422-428.
[8] 刘国兴.饥饿、盐度和密度胁迫对克氏原螯虾行为和生理功能的影响[D].扬州:扬州大学,2011.
[9] Ye Le,Yang Shengyun,Zhu Xiaoming,et al.Effects of temperature on survival,development,growth and feeding of larvae of yellowtail clownfishAmphiprionclarkia(Pisces:Perciformes)[J].Acta Ecologica Sinica,2011,31(5):241-245.
[10] 白海锋,李晓光,张霖,等.八种小丑鱼与五种海葵相容性的初步研究[J].水产养殖,2011(11):11-12.
[11] 杨剑辉.小丑鱼与海葵奇妙的共生关系[J].大自然,2008(3):42-45.
[12] Dhaneesh K V,Devi K N,Kumar T T A,et al.Breeding,embryonic development and salinity tolerance of skunk clownfishAmphiprionakallopisos[J].Journal of King Saud University-Science,2012,24(3):201-209.
[13] Ajith Kumar T T,Balasubramanian T.Broodstock development,spawning and larval rearing of the false clown fish,Amphiprionocellarisin captivity using estuarine water[J].Current Science,2009,97(10):1483-1486.
[14] 魏华,吴垠.鱼类生理学[M].2版.北京:中国农业出版社,2011:108.
[15] 沈晓民,童合一,华苒.团头鲂血液指标与水环境的关系[J].生态学报,1991,11(1):92-94.
[16] 王晓杰,张秀梅,姜明.盐度胁迫对许氏平鮋鳃、头肾、脾脏超微结构的影响[J].中国海洋大学学报,2006,36(S):85-90.
[17] 张玉玉,王春琳,李来国.长蛸的盐度耐受性及盐度胁迫对其血细胞和体内酶活力的影响[J].台湾海峡,2010,29(4):452-459.
[18] 王林.三疣梭子蟹(Portunustrituberculatus)在盐度胁迫下渗透调节和免疫响应机制的初步研究[D].青岛:中国海洋大学,2015.
[19] 董燕,陈立侨,庄平,等.盐度胁迫对施氏鲟的皮质醇、代谢反应及渗透调节的影响[J].水产学报,2007,31(S):38-44.
[20] SaoudI P,Kreydiyyeh S,Chalfoun A,et al.Influence of salinity on survival,growth,plasma osmolality and gill Na+-K+-ATPase activity in the rabbitfishSiganusrivulatus[J].Journal of Experimental Marine Biology and Ecology,2007,348(1-2):183-190.
[21] 徐力文,刘广锋,王瑞旋,等.盐度胁迫对军曹鱼稚鱼渗透压调节的影响[J].应用生态学报,2007,18(7):1596-1600.
[22] 余德光,杨宇晴,王海英,等.盐度变化对斜带石斑鱼生理生化因子的影响[J].水产学报,2011,35(5):719-728.
[23] 曾霖,雷霁霖,刘滨,等.盐度对大菱鲆幼鱼鳃Na+-K+-ATPase活力、血清离子浓度和激素水平的影响[J].动物学杂志,2014,49(3):407-414.
[24] Filho D W,Giulivi C,Boveris A.Antioxidant defences in marine fish:I.teleosts[J].Comparative Biochemistry and Physiology Part C:Pharmacology,Toxicology and Endocrinology,1993,106(2):409-413.
[25] 董亮,何永志,王远亮,等.超氧化物歧化酶(SOD)的应用研究进展[J].中国农业科技导报,2013,15(5):53-58.
[26] 王镜岩,朱圣庚,徐长法.生物化学(上册)[M].3版.北京:高等教育出版社,2002:96.
[27] 王晓杰,张秀梅,李文涛.盐度胁迫对许氏平鲉血液免疫酶活力的影响[J].海洋水产研究,2005,26(6):17-21.
[28] 王海亮,温海深,张晓燕.盐度胁迫对花鲈幼鱼肠道抗氧化和非特异性免疫能力的影响[J].现代农业科技,2016(4):261-263,269.
[29] 崔前进,陈冰,邱丽华,等.低盐胁迫对钝吻黄盖鲽幼鱼鳃Na+/K+-ATP酶、肝脏抗氧化酶和非特异免疫酶的影响[J].广东海洋大学学报,2017,37(6):26-32.
[30] 董燕.盐度、pH和捕捞胁迫对施氏鲟(Acipenserschrenckii)生理生化影响的初步研究[D].上海:华东师范大学,2007.
[31] 胡静,吴开畅,叶乐,等.盐度胁迫对克氏双锯鱼幼鱼过氧化氢酶的影响[J].南方水产科学,2015,11(6):73-78.
LI Xiao-yu1,2, TIAN Yi1,2,WANG Wei1,2, LI Yan-tao3, LIU Gang1,4, GUO Ran1, CONG Jia1
(1.College of Fisheries and Life Science, Dalian Ocean University, Dalian 116023, China; 2.Key Laboratory of Mariculture & Stock Enhancement in North China’s Sea, Dalian Ocean University, Dalian 116023, China; 3.Dalian Shengya Tourism Holding Company Limited, Dalian 116023, China; 4.Key Laboratory of Hydrobiology in Liaoning Province, Dalian Ocean University, Dalian 116023, China)
Abstract:The activities of liver superoxide dismutase (SOD) and catalase (CAT), total count of blood cells, and gill Na+-K+-ATPase activity were measured in adult tomato clownfishAmphiprionfrenatuswith body weight of (5.42±1.29)g exposed to a salinity of 31, 25 and 20 for 3 h, 12 h and 48 h to study the effect of low salinity stress on the physiological indices of the tomato clownfish. No dead tomato clownfish were observed in three experimental groups during the low salinity stress. However, the total number of blood cells was found to be decreased with decreasing salinity for 48 h salinity stress, significantly lower at salinity of 20 in 48 h exposure than that in the other two groups (P<0.05). The activity of Na+-K+-ATPase (NKA) was increased firstly and then decreased with the change in salinity under a salinity of 20 and 25, significantly higher a salinity of 25 than those in the control group and in the 20 salinity group during the whole stress period (P<0.05). In liver SOD activities were higher in the fish exposed to salinity of 20 and 25 than that in the control group. During the whole experiment, the CAT activity in salinity of 20 was significantly different from that in the control group (P<0.05); significantly lower in the salinity of 25 than that in the control group only in 48 h (P<0.05). The findings indicate that lower salinity (20 and 25) for 48 h will affect count of blood cells, and activities of Na+-K+-ATPase and CAT instead of survival and growth of tomato clownfish during the experiment stage, providing basis with the desalination culture of tomato clownfish.
Keywords:Amphiprionfrenatus; low salinity stress; blood cell count; Na+-K+-ATPase activity; SOD activity; CAT activity
通信作者:田燚(1979—), 女, 博士, 副教授。E-mail: tianyi@dlou.edu.cn
作者简介:李晓雨(1995—), 女, 硕士研究生。E-mail:2264598778@qq.com
基金项目:辽宁省百千万人才支持计划项目(2014921067);大连市科技之星计划项目(2015R081)
收稿日期:2018-01-08
文章编号:2095-1388(2018)05-0614-06
DOI:10.16535/j.cnki.dlhyxb.2018.05.011
文献标志码:A
中图分类号:S965.82