MS-222对东海带鱼幼鱼的麻醉效果研究
李伟业1,徐志进1,柳敏海1,殷小龙1,李凌刚1,章霞1,油九菊1,张川1,叶剑英2
(1.浙江省舟山市水产研究所,浙江 舟山 316000;2.浙江华兴水产科技有限公司,浙江 舟山 316000)
摘要:为研究MS-222麻醉剂对东海带鱼Trichiurushaumela幼鱼的麻醉效果,在水温(26.0±1.0)℃条件下,对体质量为(43.21±0.52)g的东海带鱼进行了不同MS-222浓度的麻醉试验,根据鱼体在最终麻醉状态和复苏过程中的行为特征,把麻醉程度分为6个时期,复苏过程分为4个时期,测定了麻醉和复苏各期试验鱼的呼吸频率,并利用不同质量浓度的麻醉剂,研究了其对东海带鱼幼鱼的麻醉程度和麻醉效果,以及对血清皮质醇和血糖水平的影响。结果表明:当MS-222麻醉剂浓度低于20 mg/L时,试验鱼的最终麻醉程度为0期;当麻醉剂浓度高于80 mg/L时,试验鱼的最终麻醉程度均能达到6期;试验鱼的入麻时间随着MS-222浓度的升高而减少,复苏时间随 MS-222 浓度的升高而增加;在本试验条件下,测得的MS-222有效质量浓度为 120~140 mg/L;在MS-222浓度为20、40 mg/L条件下,血清皮质醇含量随麻醉时间的延长呈先上升后下降的趋势,在MS-222浓度为60 mg/L条件下,血清皮质醇含量呈逐渐下降的趋势,各浓度组试验鱼在6 h时血清皮质醇含量最低,但无显著性差异(P>0.05);各试验组鱼血糖含量随麻醉时间的延长呈逐渐下降的趋势,均在6 h时降至最低,也无显著性差异(P>0.05)。研究表明,MS-222 麻醉剂对东海带鱼幼鱼的有效质量浓度为 120~140 mg/L,具有良好的麻醉效果。
关键词:东海带鱼;MS-222;麻醉
东海带鱼Trichiurushaumela隶属于辐鳍鱼纲、鲈形目、带鱼科、带鱼属,俗称裙带鱼、牙带、刀鱼等。体型侧扁如带,呈银灰色,背鳍及胸鳍为浅灰色,带有较细小的斑点,尾巴呈黑色,头尖口大,至尾部逐渐变细,身高为头长的2倍,广泛分布于中国、朝鲜半岛、日本、印度、菲律宾等海域。其肉质细嫩鲜美、肉厚刺少、营养丰富,且其烹食之法颇多,是老百姓最喜欢的海鲜之一,与大黄鱼、小黄鱼和墨鱼并称为中国“四大海产”[1]。
东海带鱼生性凶猛,受到刺激时反应激烈,离水后挣扎跳跃,极易损伤,进而死亡,给运输、分筛、注射等操作带来诸多困难。因此,需要科学合理地使用麻醉剂,以降低鱼体代谢速率,减缓鱼体的应激反应,便于生产和试验操作[2]。目前,鱼用麻醉剂种类繁多,有丁香酚、MS-222、喹哪啶、CO2等30余种。其中,MS-222因其使用便捷、入麻时间短、复苏快等优点,成为当前应用最广泛的水产麻醉剂,且通过了美国食品和药物管理局(FDA)认可[3]。
MS-222作为麻醉剂已用于多种鱼类的麻醉研究中,如美洲鲥Alosasapidissima[4]、施氏鲟Acipenserschrenckii[5]、半滑舌鳎CynoglossussemilaevisGunther[6]、真鲷Pagrusmajor[7]、孔雀鱼Poeciliareticulata[8]和斑马鱼Daniorerio等[9],但使用MS-222对带鱼麻醉目前尚未见报道。本研究中,使用MS-222对东海带鱼幼鱼进行了麻醉研究,以期为MS-222在带鱼麻醉上的应用提供参考依据。
1材料与方法
1.1材料
本试验于2017年7月在浙江省舟山市水产研究所朱家尖科研示范基地进行。试验鱼为该所驯养的东海带鱼幼鱼,体质量为(43.21±0.52)g,肛长为(14.50±0.13)cm,试验鱼饲养于车间水泥池中(4.0 m×4.0 m×1.6 m),试验开始前1 d将幼鱼移至试验桶中。试验用水为经沙滤、沉淀后的自然海水,试验水温为(26.0±1.0)℃,盐度为26,pH为8.4±0.1。试验期间连续充气,溶解氧保持在5 mg/L以上。试验桶为圆形塑料桶(容积900 L),试验水体为600 L,共计25个试验桶。
麻醉剂MS-222为上海布西化工有限公司生产,将其配制成浓度为0.1 g/mL的MS-222母液,试验时按各试验组浓度将母液稀释于各组海水中,麻醉剂药液配制后24 h用完。
1.2方法
1.2.1 麻醉程度和复苏过程的行为特征观察及分期 试验开始前先进行预试验,将MS-222设置10、20、40、60、80、100、120、140、160 mg/L 9个质量浓度组,每个浓度组放10尾鱼,观察试验鱼的麻醉情况。从预试验中得知,当MS-222浓度达到80 mg/L以上时,试验鱼可达到麻醉各期。因此,随机选取10尾试验鱼放入浓度为80 mg/L的MS-222麻醉液中,观察并记录鱼体在麻醉和复苏过程中各时期的行为特征和呼吸频率(以1 min鱼鳃盖张合次数为呼吸频率值)。麻醉和复苏分期参考刘长琳等[2]确定的标准,并结合东海带鱼幼鱼自身行为特征。
随机从各试验组分别取5尾鱼测定呼吸频率,以5尾鱼呼吸频率的平均值作为试验鱼在该麻醉期的呼吸频率。初始呼吸频率以试验鱼移入试验桶中稳定10 min后的呼吸频率为准,加入MS-222麻醉剂后再测定麻醉各期的呼吸频率。试验鱼进入5期后随机取5尾鱼,放入自然海水中进行复苏,测定呼吸频率,以5尾鱼呼吸频率的平均值作为试验鱼在该复苏期的呼吸频率。
1.2.2 不同浓度麻醉剂的麻醉程度 试验设置MS-222为10、 20、40、60、80、100、120 mg/L 7个质量浓度组,每个浓度组放10尾鱼,每组设3个平行,观察试验鱼的麻醉情况。测定试验鱼6 h内在各MS-222浓度下所达到的最终麻醉程度。
1.2.3 不同浓度麻醉剂的麻醉效果 试验设置MS-222为80、100、120、140、160 mg/L 5个质量浓度组,每个浓度组放10尾鱼,每组设3个平行。记录鱼体麻醉程度达到4期时的入麻时间,随后将鱼体立即从麻醉剂中移出,放入自然海水中复苏,记录复苏时间和成活率。其中,入麻时间是指鱼放入麻醉液,至达到4 期麻醉程度所需的时间;复苏时间是指麻醉至4期的鱼放入自然海水中完全恢复正常行为特征所需的时间。参照Marking等[9]的观点,有效质量浓度的标准为:鱼体在MS-222麻醉液中,3 min内麻醉,5 min内复苏,且在麻醉液中连续浸浴15 min 后成活率为100%。
1.2.4 不同浓度麻醉剂对血清皮质醇和血糖的影响 试验设置MS-222为20、40、60 mg/L 3个质量浓度组,每个浓度组放20尾鱼,每组设3个平行。将试验鱼放入各浓度组中,分别在第0、2、4、6 h时取样,每次从各试验组取样3尾。采用断尾取血法取试验鱼血液(断尾取血时先擦干鱼体表的黏液和水分,用毛细血管从尾部中间吸取血液,尽量避免组织液的流入),将血液置于1.5 mL离心管中,置于冰箱(4 ℃)中冷藏,静置4 h分层后,以5000 r/min离心20 min至完全分层,用移液器取上层血清放入离心管中。采用海水鱼皮质醇ELISA试剂盒(美国Rapidbio公司)测定皮质醇,采用血糖试剂盒(南京建成生物工程研究所)测定血糖,具体测定方法按照试剂盒说明书进行。
1.3数据处理
数据分析和处理采用SPSS 17.0统计软件,并用单因素方差分析法和Duncan法进行显著性分析和多重比较,试验结果以平均值±标准差(mean±S.D.)表示,显著性水平设为0.05。
2结果与分析
2.1麻醉程度和复苏过程各分期的行为特征及呼吸频率
根据不同麻醉状态下试验鱼的行为特征,将麻醉程度分为6期。从表1可见:不同麻醉程度下,试验鱼的呼吸频率会出现变化;在2期时,试验鱼的呼吸频率最高,为(179.80±3.49)次/ min;此后试验鱼的呼吸频率逐渐降低,当进入5期时,试验鱼的呼吸频率降至(110.40±2.07)次/min。
根据不同复苏状态下试验鱼的行为特征,将复苏过程分为4期。从表2可见:不同麻醉程度下,试验鱼的呼吸频率会出现变化;随着复苏程度的增加,试验鱼的呼吸频率逐渐升高,当进入4期时,试验鱼的呼吸频率为(152.60±3.05)次/min。
2.2不同质量浓度麻醉剂的麻醉程度
表1东海带鱼幼鱼麻醉过程分期、行为特征及呼吸频率
Tab.1Anaestheticstages,behaviorcharacteristicsandbreathfrequenciesofjuvenilelargeheadhairtailTrichiurushaumeladuringanaesthesiaprocess
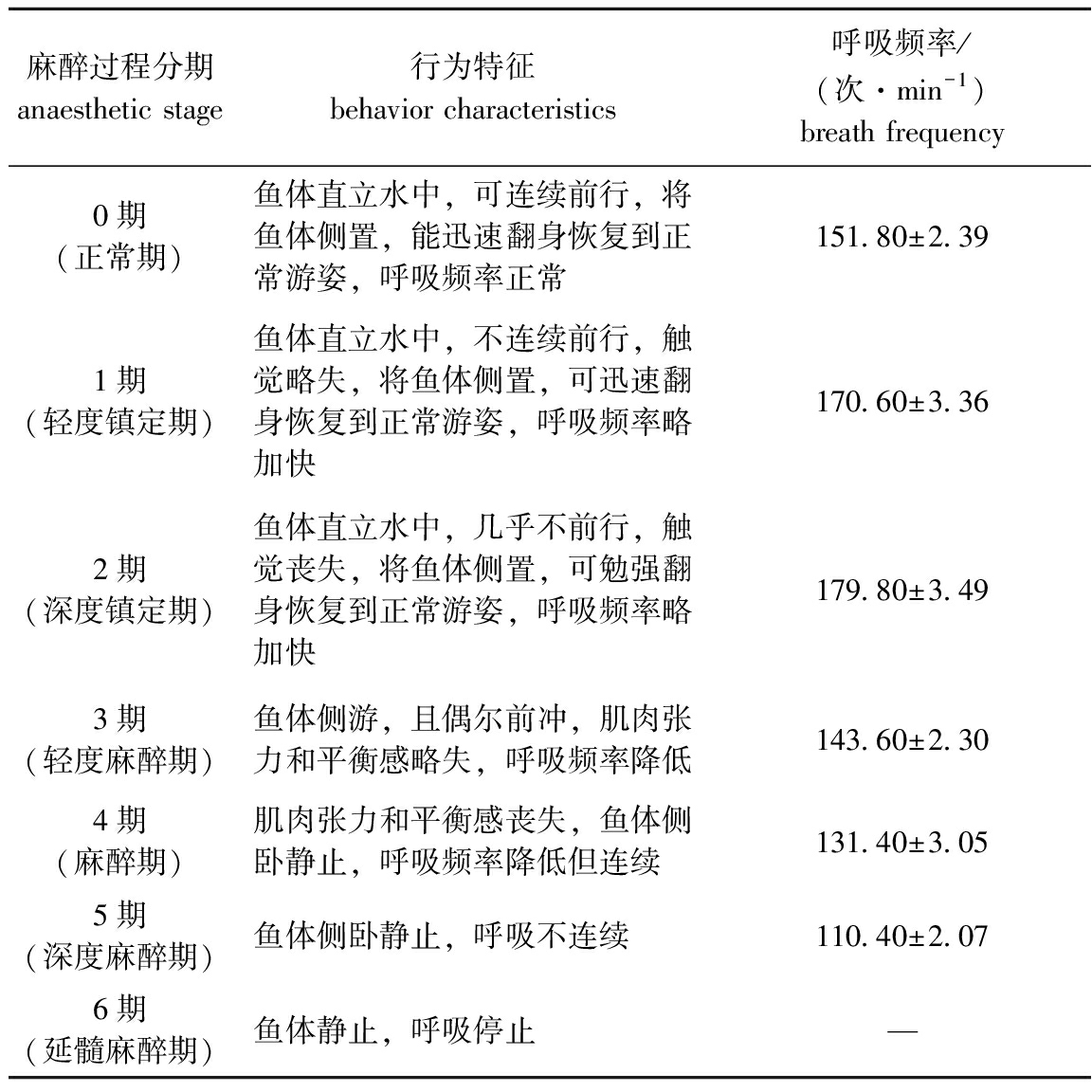
麻醉过程分期anaesthetic stage行为特征behavior characteristics呼吸频率/(次·min-1)breath frequency0期(正常期)鱼体直立水中,可连续前行,将鱼体侧置,能迅速翻身恢复到正常游姿,呼吸频率正常151.80±2.391期(轻度镇定期)鱼体直立水中,不连续前行,触觉略失,将鱼体侧置,可迅速翻身恢复到正常游姿,呼吸频率略加快170.60±3.362期(深度镇定期)鱼体直立水中,几乎不前行,触觉丧失,将鱼体侧置,可勉强翻身恢复到正常游姿,呼吸频率略加快179.80±3.493期(轻度麻醉期)鱼体侧游,且偶尔前冲,肌肉张力和平衡感略失,呼吸频率降低143.60±2.304期(麻醉期)肌肉张力和平衡感丧失,鱼体侧卧静止,呼吸频率降低但连续131.40±3.055期(深度麻醉期)鱼体侧卧静止,呼吸不连续110.40±2.076期(延髓麻醉期)鱼体静止,呼吸停止—
表2东海带鱼幼鱼复苏过程、行为特征及呼吸频率
Tab.2BehaviorcharacteristicsandbreathfrequenciesofjuvenilelargeheadhairtailTrichiurushaumeladuringrecoveryprocess
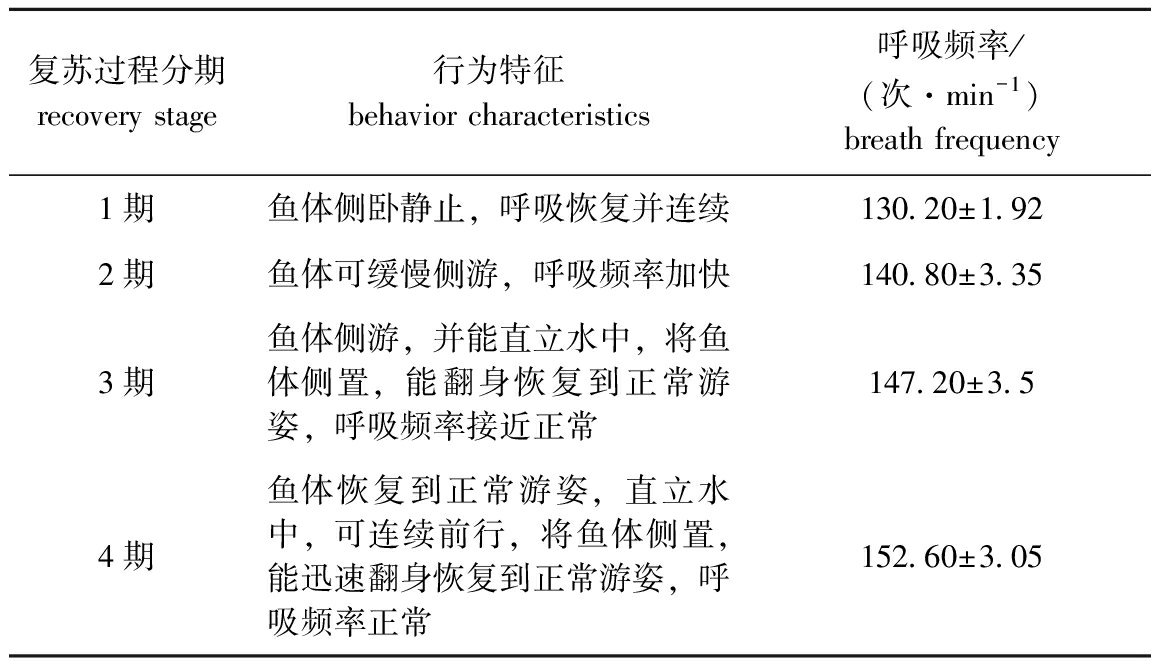
复苏过程分期recovery stage行为特征behavior characteristics呼吸频率/(次·min-1)breath frequency1期鱼体侧卧静止,呼吸恢复并连续130.20±1.922期鱼体可缓慢侧游,呼吸频率加快140.80±3.353期鱼体侧游,并能直立水中,将鱼体侧置,能翻身恢复到正常游姿,呼吸频率接近正常147.20±3.54期鱼体恢复到正常游姿,直立水中,可连续前行,将鱼体侧置,能迅速翻身恢复到正常游姿,呼吸频率正常152.60±3.05
从图1可知:随着MS-222浓度的增加,试验鱼最终麻醉程度逐渐增加。当MS-222 浓度低于20 mg/L时,试验鱼最终麻醉程度为0期;当MS-222浓度为40 mg/L时,大部分试验鱼麻醉程度为1期,而少部分试验鱼进入2期;当MS-222浓度为60 mg/L时,大部分试验鱼麻醉程度为3期,而少部分鱼进入4期;当MS-222浓度高于80 mg/L时,试验鱼最终麻醉程度均能达到6期。
2.3不同质量浓度麻醉剂的麻醉效果
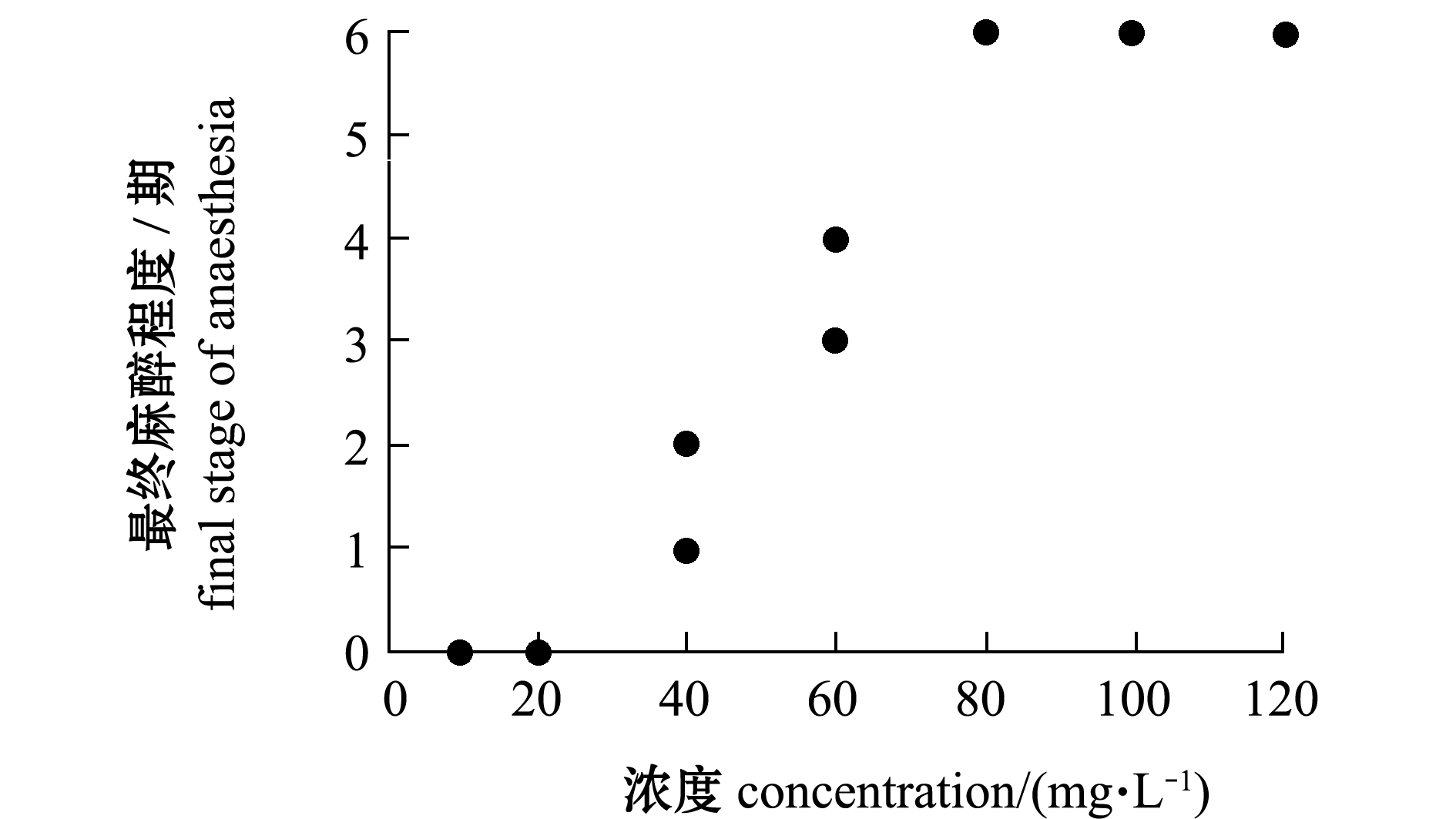
图1 东海带鱼幼鱼在不同MS-222质量浓度下的最终麻醉程度
Fig.1 Final anaesthesia stage of juvenile largehead hairtail Trichiurus haumela under different MS-222 concentrations
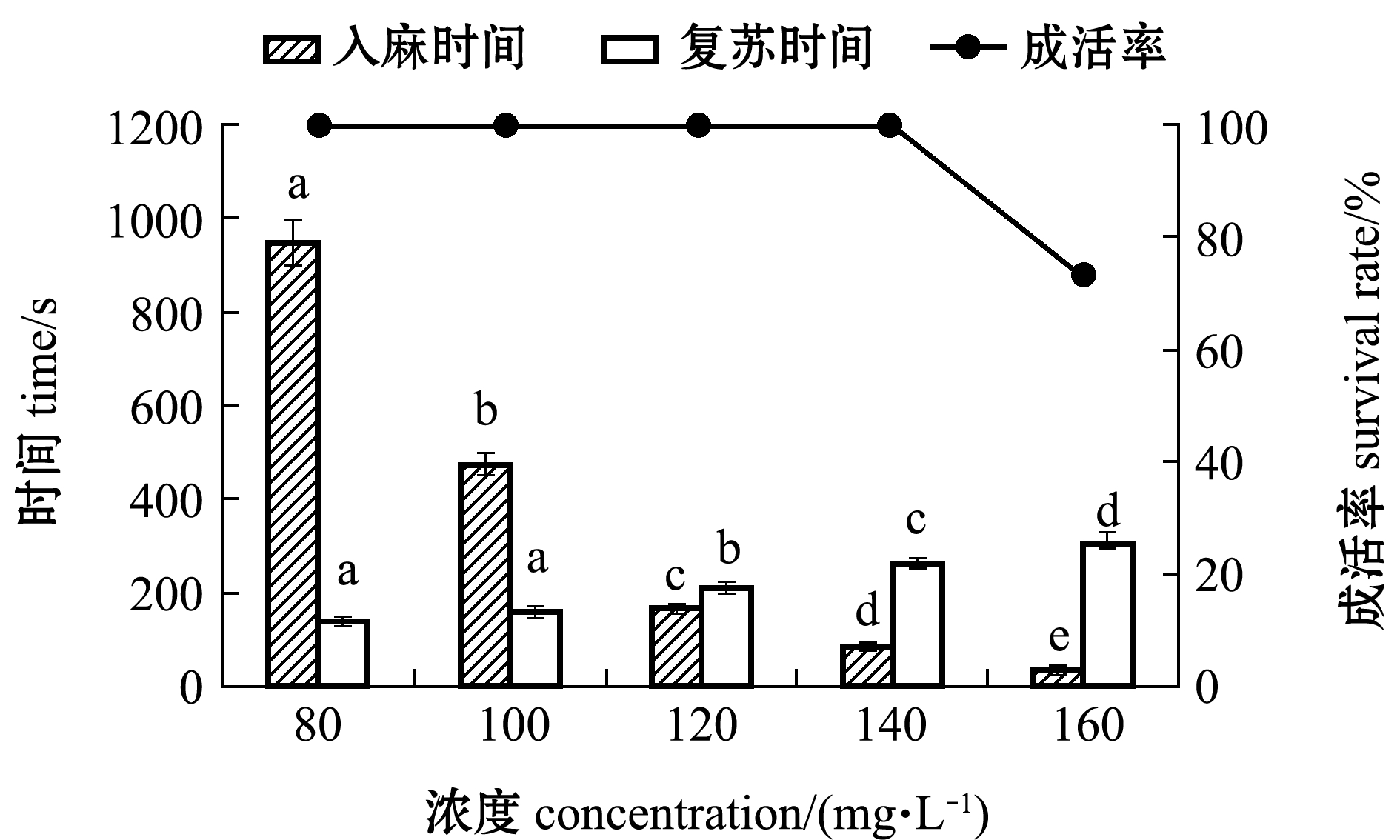
注:标有不同小写字母者表示同一指标下不同浓度间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05)
Note: The means with different letters in different concentrations in same index are very significantly different at the 0.05 probability level, and the means with the same letters are not significant differences
图2 不同MS-222质量浓度下东海带鱼幼鱼的入麻时间、复苏时间及其浸浴15 min后的成活率
Fig.2 Induction time,recovery time and survival rate of juvenile largehead hairtail Trichiurus haumela bathed in different MS-222 concentrations for 15 minutes
从图2可知,随着麻醉剂质量浓度的增加,试验鱼的入麻时间逐渐减少,复苏时间逐渐增加。当MS-222浓度为80 mg/L时,入麻时间为(953±33)s,显著高于其他浓度组(P<0.05);复苏时间为(142±11)s,与100 mg/L浓度组无显著性差异(P>0.05),但显著低于其他浓度组(P<0.05)。当MS-222浓度为160 mg/L时,入麻时间为(32±2)s,显著低于其他浓度组(P<0.05);复苏时间为(313±21)s,均显著高于其他浓度组(P<0.05)。当MS-222浓度高于120 mg/L时,试验鱼可在3 min内进入4期麻醉,当MS-222浓度低于140 mg/L时,试验鱼可在5 min内复苏,且复苏成活率为100%。参照Marking等[9]的有效质量浓度标准,东海带鱼幼鱼的有效MS-222浓度为120~140 mg/L。
2.4不同浓度麻醉剂对血液皮质醇和血糖的影响
从图3可见,在20、40 mg/L MS-222浓度下,试验鱼血清皮质醇含量随着麻醉时间的延长呈先上升后下降的趋势。MS-222浓度为20 mg/L时,试验鱼的血清皮质醇含量在4 h时最高,为(33.23±1.45)ng/mL,且显著高于其他浓度组(P<0.05);MS-222浓度为40 mg/L时,试验鱼的血清皮质醇含量在2 h时最高,为(31.16±1.95)ng/mL;MS-222浓度为60 mg/L时,试验鱼的血清皮质醇含量呈逐渐下降的趋势,在6 h时试验鱼的血清皮质醇含量最低,为(22.60±1.48)ng/mL;各浓度组试验鱼均在6 h时血清皮质醇含量最低,且各浓度组间无显著性差异(P>0.05)。
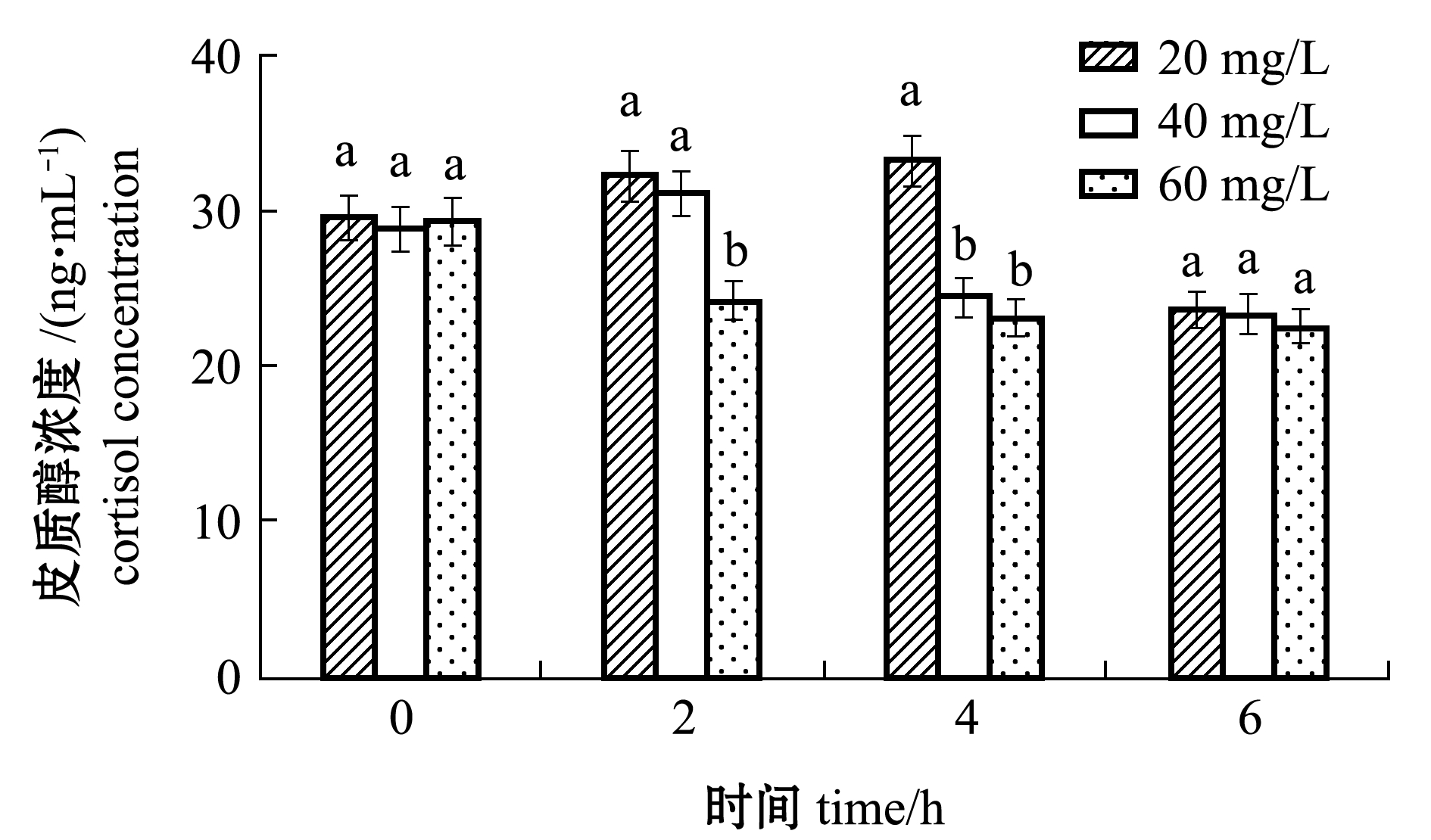
注:标有不同小写字母者表示同一时间下不同浓度组间有显著性差异(P<0.05),标有相同小写字母者表示组间无显著性差异(P>0.05),下同
Note:The means with different letters at the same time are significant differences in different groups at the 0.05 probability level, and the means with the same letters are not significant differences, et sequentia
图3 MS-222浓度对带鱼幼鱼血清皮质醇水平的影响
Fig.3 Effect of different MS-222 concentrations on serum cortisol concentration in juvenile largehead hairtail Trichiurus haumela
从图4可见:各浓度组鱼血糖含量随麻醉时间的延长呈逐渐下降的趋势,均在6 h时降至最低,分别为(1.13±0.12)、(1.14±0.15)、(1.12±0.11)mmol/L,且各浓度组间无显著性差异(P>0.05);而在2 h时,20 mg/L浓度组血糖含量显著高于40、60 mg/L浓度组(P<0.05)。
3讨论
3.1MS-222对带鱼的麻醉机制及带鱼麻醉程度分期
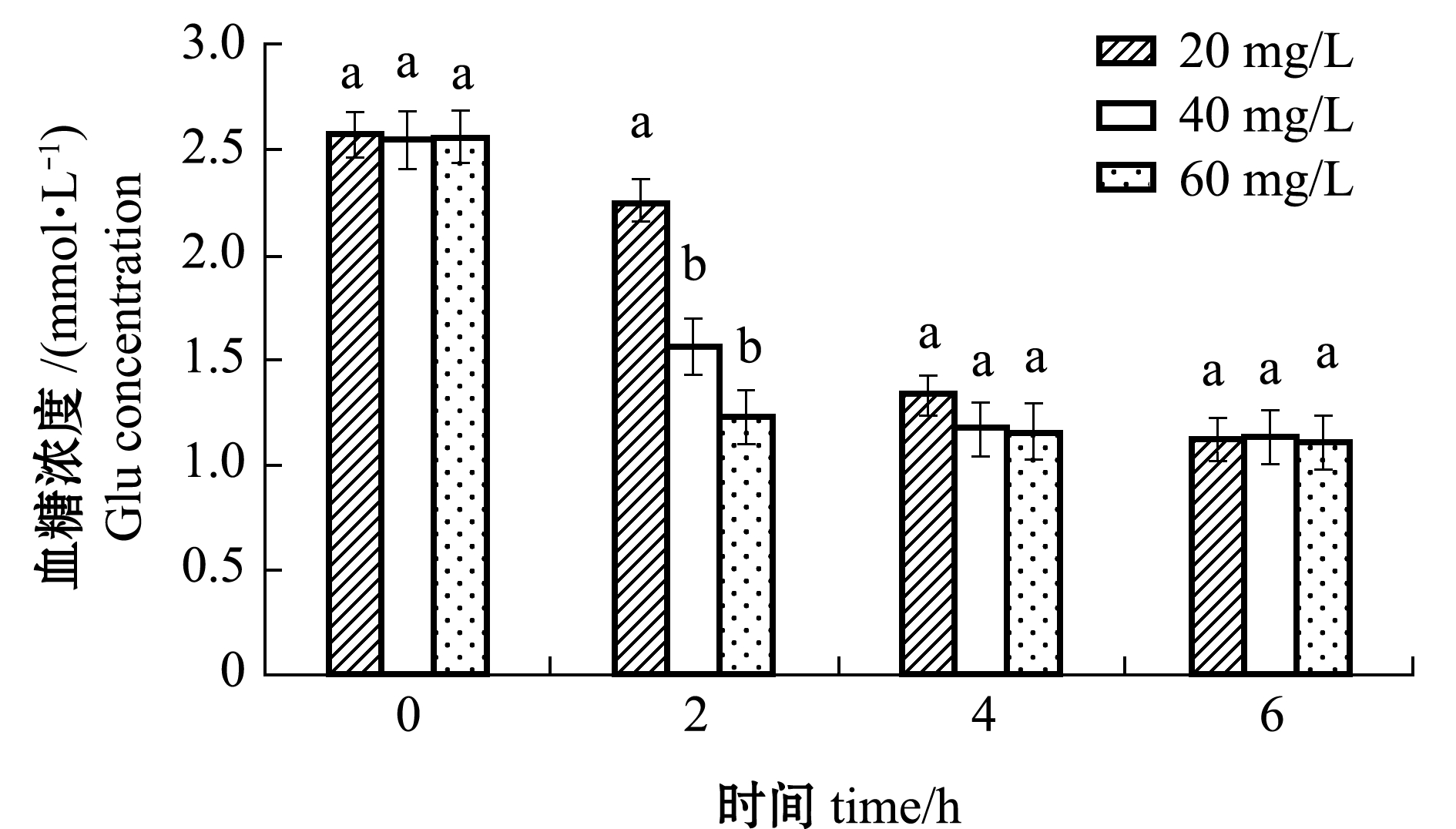
图4 MS-222浓度对东海带鱼幼鱼血糖水平的影响
Fig.4 Effect of different MS-222 concentrations on Glu concentration in juvenile largehead hairtail Trichiurus haumela
MS-222水溶液可以通过鱼鳃丝、鱼体表的吸收,迅速进入血液循环系统并传导至神经中枢使得活动能力和反射能力受抑制,然后在大脑中积累,麻醉鱼表现出呼吸频率降低、行动迟缓和排泄物减少,MS-222 进入鱼体后主要积聚在脾脏、肝脏中,而肌肉中含量甚微,在清水中极易从鱼体内转移到水中,故MS-222当前被广泛作为水产品生产及试验中的麻醉药物[10]。
研究人员通常根据麻醉原理和麻醉过程中鱼体的行为状态,将麻醉程度分为不同的阶段。由于不同鱼类在麻醉剂中的行为表现有差异,因此,研究人员对鱼类麻醉程度的分期标准也不尽相同,但均将平衡感、呼吸频率作为麻醉程度分期的重要指标[11-13]。
在不受外界刺激的情况下,带鱼的游动行为异于其他鱼类,大部分鱼体直立水中,通过背鳍的波浪式摆动前行。随着麻醉程度的深入,带鱼在直立状态下难以保持平衡,当进入轻度麻醉期(3期)时,鱼体开始侧游,并逐渐失去平衡感。进入麻醉期后,鱼体平衡感丧失,侧卧于水底,只能通过呼吸频率及鳃盖张合是否连续来判断鱼体麻醉程度。此外,通过人为将鱼体侧置,鱼体翻身的行为特征也可以作为判断麻醉程度的标准。随着麻醉程度的增加,被麻醉带鱼的翻身行为特征也出现显著的阶段性变化,分别为迅速翻身阶段、勉强翻身阶段、不能翻身阶段、静止和肌肉张力丧失阶段。复苏时,将带鱼侧置于自然海水中,在深度麻醉下,带鱼鳃盖首先出现张合,呼吸开始恢复并连续,头部和尾部上翘身体成弓形来回荡动,幅度逐渐增大后,实现翻身侧游,最后带鱼能直立于水中。
呼吸频率是衡量麻醉程度的重要指标。大部分研究认为,呼吸频率随麻醉程度的增加而降低,如用MS-222麻醉美洲鲥[4]、金鱼Cyprinuscarpio[14],用丁香酚麻醉黄腊鲹Tmchinotusovatus[15]、黑鲈Micropterussalmoides[16]等。但也有研究发现,在麻醉过程中,呼吸频率先上升后下降,例如用MS-222 麻醉半滑舌鳎[6]、鳜鱼Sinipercachuatsi[17]、圆斑星鲽Veraspervariegatus[18]等。本研究中发现,带鱼在麻醉程度达到2期(深度镇定期)前,呼吸频率逐渐上升,之后呼吸频率又下降,呈先升后降趋势。因此,麻醉对呼吸频率的影响与鱼的种类及麻醉剂的种类和浓度有较大相关性。
3.2麻醉剂的有效浓度
麻醉剂的剂量对动物的麻醉程度与麻醉时间有显著影响,相同条件下麻醉剂剂量越大,动物麻醉程度越深,入麻时间越短。彭宁东等[19]研究发现:当 MS-222浓度为40 mg/L时,赤眼鳟Spualiobarbuscurriculus幼鱼的最终麻醉程度为2 期;当 MS-222 浓度为 120 mg/L时,赤眼鳟幼鱼的麻醉程度为6期。赵明等[18]研究发现,MS-222浓度高于105 mg/L时,圆斑星鲽最终麻醉程度均能达到6期。王秀华等[20]研究发现,MS-222浓度从50 mg/L上升到200 mg/L时,牙鲆的麻醉时间由288 s缩短至50 s。本研究中发现,当 MS-222浓度高于80 mg/L时,东海带鱼幼鱼的最终麻醉程度均能达到6期,且随着麻醉剂浓度的增加,试验鱼的入麻时间逐渐减少,这也与上述研究相一致。
Marking等[9]认为,理想的麻醉浓度的标准为3 min之内麻醉,5 min之内苏醒。按照此标准,本研究中发现,用MS-222麻醉东海带鱼幼鱼的有效质量浓度为120~140 mg/L。MS-222有效质量浓度有种的特异性,游泳性鱼类的有效MS-222质量浓度一般低于底栖性鱼类,如大麻哈鱼、鲤等游泳性鱼类的有效MS-222质量浓度为80~100 mg/L,庸鲽、圆斑星鲽、半滑舌鳎等底栖性鱼类的有效MS-222质量浓度分别为250~480、150~230、120~210 mg/L[5,17]。本研究中,东海带鱼幼鱼的有效MS-222质量浓度低于上述底栖性鱼类而高于上述游泳性鱼类,这可能与东海带鱼的活动方式有关,具体原因需进一步研究。
3.3麻醉剂对血液皮质醇和血糖的影响
皮质醇是肾间组织分泌的一种激素,在鱼体中具有广泛的生理作用,被认为是鱼类应激的一个灵敏信号[21-22]。目前,国内外许多学者都将血液皮质醇水平作为鱼体应激的一项重要指标,也有学者将血液皮质醇水平用于鱼类的麻醉研究中。如梁政远等[23]研究了用丁香油麻醉罗非鱼Oreochromisspp.后其血液皮质醇水平的变化;朱挺兵等[24]研究了电麻醉和MS-222麻醉后圆口铜鱼Coreiusguichenoti血液皮质醇的变化情况。本研究中也研究了不同浓度MS-222麻醉东海带鱼幼鱼后不同时间段幼鱼血液皮质醇水平的变化,结果显示,麻醉后6 h时各浓度组血清皮质醇水平均低于0 h水平。这也与梁政远等[23]研究发现的用丁香油麻醉罗非鱼后血液皮质醇水平低于麻醉前的结论一致。这表明MS-222能降低带鱼幼鱼血液皮质醇水平。
血糖是鱼类机能活动所需能量的来源,易受环境因子的影响而变化,通常运动能力强的鱼类血糖值高于运动迟缓或底栖性鱼类[25]。本研究中,东海带鱼幼鱼经MS-222麻醉后,血糖浓度呈逐渐降低的趋势。这可能是麻醉胁迫下,鱼体活动量降低,代谢减慢,所需能量减少,致使血糖合成降低,这与用MS-222麻醉史氏鲟的结果[26]较相似。
综上所述,MS-222对东海带鱼幼鱼具有良好的麻醉效果,其对东海带鱼幼鱼的麻醉有效质量浓度为 120~140 mg/L。配制的MS-222溶液可直接投入水体中对带鱼进行麻醉,操作简单方便,麻醉对象入麻快、复苏快、安全边界宽,是一种理想的麻醉剂。
参考文献:
[1] 张晓敏.带鱼下脚料水解蛋白的制备及其利用研究[D].重庆:西南大学,2008.
[2] 刘长琳,何力,陈四清,等.鱼类麻醉研究综述[J].渔业现代化,2007,34(5):21-25.
[3] Mattson N S,Riple T H.Metomidate,a better anesthetic for cod(Gadusmorhua)in comparison with benzocaine,MS-222,chlorobutanol,and phenoxyethanol[J].Aquaculture,1989,83(1-2):89-94.
[4] 杜浩,危起伟,杨德国,等.MS-222、丁香油、苯唑卡因对养殖美洲鲥幼鱼的麻醉效果[J].大连水产学院学报,2007,22(1):20-26.
[5] 田家元,王京树,万建义,等.MS-222不同处理方式对史氏鲟和中华鲟麻醉效果的影响[J].水生态学杂志,2011,32(5):87-90.
[6] 刘长琳,陈四清,何力,等.MS-222对半滑舌鳎成鱼的麻醉效果研究[J].中国水产科学,2008,15(1):92-99.
[7] Oikawa S,Takeda T,Itazawa Y.Scale effects of MS-222 on a marine teleost,porgyPagrusmajor[J].Aquaculture,1994,121(4):369-379.
[8] Chambel J,Pinho R,Sousa R,et al.The efficacy of MS-222 as anaesthetic agent in four freshwater aquarium fish species[J].Aquaculture Research,2015,46(7):1582-1589.
[9] Marking L L,Meyer F P.Are better anesthetics needed in fisheries?[J].Fisheries,1985,10(6):2-5.
[10] 邬国民,何莉,何桂福.我国鱼类麻醉运输的现状及发展前景[J].中山大学学报论丛,1998(4):62-65.
[11] Schoettger R A,Walker C R,Marking L L,et al.MS-222 as an anesthetic for channel catfish:its toxicity,efficacy,and muscle residues[R].Washington,DC:U.S.Fish and Wildlife Service,1967,17:1-14.
[12] Summerfelt R C,Smith L S.Anaesthesia,surgery,and related techniques[M]//Schreck C B,Moyle P B.Methods for Fish Biology.Bethesda,MD:American Fisheries Society,1990:213-272.
[13] 胡发文,李莉,刘元文,等.丁香油和MS-222对大泷六线鱼幼鱼的麻醉效果[J].大连海洋大学学报,2017,32(6):671-675.
[14] 李春梅,黄永坚.MS-222麻醉金鱼的研究[J].黄冈职业技术学院学报,2002(4):67-70,63.
[15] 张朝晖,丛娇日,王波,等.麻醉剂丁香酚对黄腊鲹耗氧的影响[J].海洋科学,2003,27(6):11-14,34.
[16] Cooke S J,Suski C D,Ostrand K G,et al.Behavioral and physiological assessment of low concentrations of clove oil anaesthetic for handling and transporting largemouth bass (Micropterussalmoides)[J].Aquaculture,2004,239(1-4):509-529.
[17] 郭丰红,汪之和.MS-222对鳜鱼成鱼麻醉效果的研究[J].湖南农业科学,2009(7):150-153.
[18] 赵明,柳学周,徐永江,等.MS-222麻醉圆斑星鲽成鱼效果研究[J].海洋科学进展,2010,28(4):531-537.
[19] 彭宁东,汤文圣,郭栋,等.MS-222对赤眼鳟幼鱼麻醉效果的研究[J].华南师范大学学报:自然科学版,2016,48(6):37-43.
[20] 王秀华,张烨伟,杨春志.MS-222对牙鲆麻醉效果[J].渔业科学进展,2009,30(3):1-6.
[21] Barton B A,Peter R E,Paulencu C R.Plasma cortisol levels of fingerling rainbow trout (Salmogairdneri) at rest,and subjected to handling,confinement,transport,and stocking[J].Canadian Journal of Fisheries and Aquatic Sciences,1980,37(5):805-811.
[22] Strange R J,Schreck C B,Ewing R D.Cortisol concentrations in confined juvenile Chinook salmon (Oncorhynchustshawytscha)[J].Transactions of the American Fisheries Society,1987,107(6):812-819.
[23] 梁政远,安丽娜,董在杰,等.丁香油对罗非鱼的麻醉作用及其对血液指标和激素水平的影响[J].上海海洋大学学报,2009,18(5):629-635.
[24] 朱挺兵,李飞,吴兴兵,等.电麻醉对圆口铜鱼幼鱼行为及血液生化指标的影响[J].四川动物,2015,34(6):885-888.
[25] Donaldson E M.The pituitary-interrenal axis as an indicator of stress in fish[M]//Pickering A D.Stress and Fish.London:Academic Press,1981:11-48.
[26] 冯广朋,徐滨,庄平,等.化学麻醉与电麻醉对史氏鲟幼鱼血液指标的影响[J].安徽农业科学,2010,38(20):10731-10733,10754.
AnestheticeffectofMS-222onlargeheadhairtailjuvenileTrichiurushaumela
LI Wei-ye1, XU Zhi-jin1, LIU Min-hai1, YIN Xiao-long1, LI Ling-gang1, ZHANG Xia1, YOU Jiu-ju1, ZHANG Chuan1, YE Jian-ying2
(1.Zhoushan Fisheries Research Institute of Zhejiang Province, Zhoushan 316000, China; 2.Zhejiang Huaxing Aquatic Technology Company limited, Zhoushan 316000, China)
Abstract:The respiratory rate, anesthetic process, and concentrations of serum cortisol (COR) and glucose(GLU) were determined in largehead hairtail juvenileTrichiurushaumelawith body weight of (43.21±0.52)g anaesthetized by MS-222 at a dose of 10, 20, 40, 60, 80, 100,120, 140, and 160 mg/L in East China Sea at water temperature of (26.0±1.0)℃ to investigate the anesthetic effect of MS-222 on largehead hairtail juveniles. According to the fish behavior characteristics in the final stage of anesthetic and recovery process, the anesthetic process was divided into six periods and the recovery process into four stages. It was found that the final anesthetic degree of 0 was observed at MS-222 concentration of below 20 mg/L, and the final anesthetic degree of 6 at MS-222 concentration of over 80 mg/L in all experimental groups. The required time for narcotic state was found to be decreased and the recovery time increased as the concentration of MS-222 was elevated, with the efficient MS-222 mass concentration of 120-140 mg/L under the experimental conditions. The COR contents were increased and then decreased with the prolonged anesthetic period at MS-222 concentration of 20 mg/L and 40 mg/L, and again decrease at MS-222 concentration of 60 mg/L, with the minimal COR content in the fish anaesthetized by MS-222 at 6 hours, without significant difference (P>0.05). There was low serum GLU content with elapse of anesthetic process, with the minimal value at 6 hours post anesthetic, and without significant difference (P>0.05). In conclusion, it is suggested that the effective mass concentration for largehead hairtail juveniles be 120-140 mg/L of MS-222.
Keywords:Trichiurushaumela; MS-222; anesthetic
通信作者:徐志进(1979—), 男, 高级工程师。E-mail:17536260@qq.com
作者简介:李伟业(1986—), 男, 工程师。E-mail:liweiye1999@sina.com
基金项目:浙江省重大科技专项(2016C02055-7-3);2017年第二批现代渔业发展市级专项资金项目(舟财农[2017]53号);2017舟山市级公益类科技项目(2017C32086)
收稿日期:2018-01-12
文章编号:2095-1388(2018)05-0589-06
DOI:10.16535/j.cnki.dlhyxb.2018.05.007
文献标志码:A
中图分类号:S965.3





