巴西龟眼炎病原菌的分离鉴定及组织病理学研究
叶明皓1,胡秀彩1,吕爱军1,孙敬锋1,刘小雪1,宋亚娇2
(1.天津农学院 水产学院,天津市水产生态及养殖重点实验室,天津 300384;2.河南师范大学 水产学院,河南 新乡 453007)
摘要:为防治龟类细菌性眼炎病,从患眼炎巴西龟Trachemysscriptaelegans(体质量约150.0 g)眼内分泌液中分离获得1株革兰氏阴性细菌,编号为G0503菌株,通过细菌形态学观察、理化特性、16S rDNA克隆和测序,以及构建系统发育进化树分析等方法,对其进行了鉴定研究。结果表明:该分离菌与甘露糖、半乳糖、肌醇等反应为阳性,与赖氨酸、鸟氨酸脱羧酶等反应为阴性;进一步采用PCR方法扩增其16S rDNA序列,将其亚克隆至pMD18-T载体中测序,获得片段大小为1500 bp,与模式菌株ProvidenciarettgeriDSM 4542(AM040492.1)序列一致性为99.30%;构建系统发育树分析显示,该菌与Providenciarettgeri(JN644501.1)自然聚为一支,最终判定G0503菌株为雷氏普罗威登斯菌Providenciarettgeri;药敏试验结果显示,该菌株对头孢哌酮、头孢噻肟、诺氟沙星、左氟沙星、氟苯尼考等药物敏感,对阿莫西林、氨苄西林、磺胺异恶唑、复方新诺明等耐药;用该分离菌人工回归感染巴西龟死亡率达40%,主要呈现眼睛肿大、黏液增多,停止摄食等特征,并且与自然发病龟临床症状一致;组织病理学观察显示,病龟出现眼睑上皮细胞减少、淋巴细胞浸润等病理变化。本研究中首次报道巴西龟眼炎病原的分离鉴定,对该病防治可提供一定的参考依据。
关键词:巴西龟; 雷氏普罗威登斯菌; 16S rDNA; 药敏试验; 组织病理
雷氏普罗威登斯菌属于肠杆菌科Enterobacteriaceae、普罗威登斯菌属Providencia[1]。研究表明,人类感染雷氏普罗威登斯菌可引发腹泻、肺炎、尿道炎等多种疾病[2-3]。近年来,雷氏普罗威登斯菌可导致鱼、虾、鳖等多种水产动物发病死亡[4-6]。Faisal等[4]从濒死尼罗罗非鱼Oreochromisniloticus体内分离得到雷氏普罗威登斯菌。Bejarano等[5]从濒死鲢Hypophthalmichthysmolitrix心脏、肾脏等组织分离获得雷氏普罗威登斯菌。战文斌等[6]从患败血病对虾Fenneropenaeuschinensis体内分离出雷氏普罗威登斯菌。范红结等[7]从患病中华鳖Trionyxsinensis肝、脾和肺等实质器官均分离鉴定到雷氏普罗威登斯菌。李林俐等[8]对发病与死亡扬子鳄Alligatorsinensis进行病原学分离研究,鉴定病原菌为雷氏普罗威登斯菌。但是,关于雷氏普罗威登斯菌感染龟鳖类动物导致眼炎病例,目前尚未见文献报道。
近年来,由于养殖水环境污染加剧,龟类细菌性疾病频繁发生,往往造成巨大的经济损失[9-13]。杨瑞婷[13]报道,巴西龟眼炎主要表现为眼睑发炎充血,后逐渐变成灰白色且肿大,眼角膜和鼻黏膜糜烂,严重时双目失明,呼吸受阻等。最近,天津市某宠物龟养殖场的巴西龟发病,主要表现为眼睛发炎充血、肿大,精神沉郁、行动缓慢,摄食减少或停止摄食等临床症状,初步诊断为细菌性眼炎病例。本研究中,从发病龟眼内黏液中分离获得1株细菌,并对其进行细菌形态学观察、16S rDNA测序、生理生化特性、药敏试验、回归感染试验及病理学观察等系统研究,旨在为研究巴西龟眼炎的病原及其致病机理等提供数据资料,为该病的防治提供科学参考。
1材料与方法
1.1材料
健康巴西龟购自天津水产市场(体质量约8.0 g),在实验室饲养观察2周,确认健康无病后用于后续试验。发病巴西龟(体质量约150.0 g)为天津市某宠物龟养殖场的送检病龟。
细菌生化鉴定管和药敏纸片均购自杭州滨和微生物试剂有限公司,PCR Master Mix试剂购自北京天根生化科技有限公司,pMD18-T载体购自大连宝生物工程有限公司,胶回收DNA提取试剂盒(离心柱型)购自北京百泰克生物技术有限公司。
1.2方法
1.2.1 细菌分离与纯化 参照兰云等[9]的试验方法,将发病巴西龟体表病灶用无菌生理盐水冲洗,无菌操作取患病龟眼部组织及其分泌液划线接种于LB固体培养基上,28 ℃恒温下培养18 h。挑取优势单菌落接种纯化,经过3次纯化后得到纯菌种,置于冰箱(4 ℃)中保存备用。
1.2.2 细菌生理生化试验 将分离纯化后的菌株28 ℃下培养18 h,进行革兰氏染色镜检。将菌株无菌操作接种于细菌生化鉴定管中,进行硝酸盐还原、半固体动力、糖(醇、苷)类代谢等48种生理生化特性测定,具体方法参照文献[14-15]。
1.2.3 细菌基因组DNA提取及16S rDNA基因序列扩增 将分离菌株接种于LB液体培养基中,28 ℃、150 r/min摇床中培养过夜,取2 mL培养液于离心管中,4 ℃下以12 000 r/min离心2 min,弃去上清液;加500 μL超纯水,漩涡振荡30 s,置95 ℃下水浴5 min;再于4 ℃下以12 000 r/min离心2 min,取350 mL上清液为DNA模板,保存于-20 ℃中备用。
细菌的16S rDNA测序采用通用引物27F:5′AGAGTTTGATCCTGGCTCAG 3′,1492R:5′ GGTTACCTTGTTACGACTT 3′,引物来自生工生物工程(上海)股份有限公司。PCR扩增反应体系(25 μL):2×TaqPCR Master Mix 10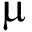 L,上、下游引物各1 μL,DNA模板2 μL,无菌双蒸水11 μL。PCR反应条件:95 ℃下预变性5 min;94 ℃下变性30 s,56 ℃下退火30 s,72 ℃下延伸1 min,共进行30个循环;最后在72 ℃下再延伸10 min。采用琼脂糖凝胶电泳检测目的基因,并将PCR产物送天津金唯智生物科技有限公司进行基因测序。用胶回收试剂盒回收纯化16S rDNA目的条带,与pMD18-T载体连接反应转化至大肠杆菌DH5α中,采用引物M13-47:5′CGCCAGGGTTTTCCCAGTCACGAC 3′,RV-M:5′ GAGCGGATAACAATTTC- ACACAGG 3′进行菌落PCR阳性克隆筛选,随机取阳性克隆送天津金唯智生物科技有限公司测序验证。
L,上、下游引物各1 μL,DNA模板2 μL,无菌双蒸水11 μL。PCR反应条件:95 ℃下预变性5 min;94 ℃下变性30 s,56 ℃下退火30 s,72 ℃下延伸1 min,共进行30个循环;最后在72 ℃下再延伸10 min。采用琼脂糖凝胶电泳检测目的基因,并将PCR产物送天津金唯智生物科技有限公司进行基因测序。用胶回收试剂盒回收纯化16S rDNA目的条带,与pMD18-T载体连接反应转化至大肠杆菌DH5α中,采用引物M13-47:5′CGCCAGGGTTTTCCCAGTCACGAC 3′,RV-M:5′ GAGCGGATAACAATTTC- ACACAGG 3′进行菌落PCR阳性克隆筛选,随机取阳性克隆送天津金唯智生物科技有限公司测序验证。
1.2.4 细菌16S rDNA基因序列及系统发育树分析 将16S rDNA序列通过NCBI的Blast检索系统进行序列同源性分析,同时在NCBI下载已公布的普罗威登斯菌属细菌16S rDNA基因序列进行相似性比较,采用MEGA 5.2软件用邻接法(neighbor-joining,NJ)构建系统发育树,并通过1000次的自举分析(bootstrap)进行置信度检测。
1.2.5 药敏试验 采用K-B纸片法对分离菌株进行29种常用抗生素药物的敏感性检测,将分离菌株均匀涂布于LB平板上,依次贴上药敏纸片,28 ℃下培养18 h后,测量抑菌圈直径,测量3次取其平均值,以抑菌圈直径大小作为判定细菌对药物敏感性的标准。
1.2.6 动物感染试验 随机选取20只健康巴西龟作为试验动物,感染组龟10只采取人工腹腔注射含菌量为1.88×108cfu/mL菌液,注射量为0.1 mL/只,对照组龟10只注射相同剂量的0.1 mL无菌生理盐水;饲养温度约为20 ℃,连续观察21 d,记录发病死亡情况。参照李玉平等[12]的方法对试验龟进行组织病理观察,无菌操作取正常和发病死亡巴西龟眼睑等组织放入波恩氏液中固定,用常规石蜡切片、H.E染色,观察并拍照记录。
2结果与分析
2.1巴西龟眼炎病原菌的分离及理化特性
巴西龟发病主要表现为眼睛发炎充血、肿大,行动迟缓,摄食减少等临床症状,初步诊断为细菌性眼炎,从发病龟眼内分泌液中分离获得1株革兰氏阴性细菌,编号为G0503菌株。该菌在LB培养基28 ℃下培养18 h,菌落形态呈圆形、边缘整齐、透明湿润,直径为1.0~1.5 mm,该分离菌经染色镜检显示为革兰氏染色阴性短杆状细菌。细菌生理生化试验结果表明,该菌株与半乳糖、甘露醇、肌醇、甘露糖等反应为阳性,与赖氨酸、鸟氨酸脱羧酶等反应为阴性,根据该菌株的形态学和理化特性,基本符合普罗威登斯菌属Providencia细菌的生理生化特征(表1)。
表1菌株G0503的生理生化特征
Tab.1PhysiologicalandbiochemicalcharacteristicsofthestrainG0503

生化项目 physiological and biochemical index菌株 strain G0503生化项目 physiological and biochemical index菌株 strain G0503M.R.试验M.R.test+七叶苷Aesculin+V.P.试验V.P.test-鼠李糖Rhamnose+氧化酶Oxidase-葡萄糖Glucose+半固体Semi-solid+葡萄糖(产气)Gas from glucose-赖氨酸脱羧酶Lysine decarboxylase-棉子糖Raffinose-鸟氨酸脱羧酶Ornithine decarboxylase-木糖Xylose-苯丙氨酸脱氨酶Phenylalanine deaminase+果糖Fructose+蛋白胨水Peptone water+麦芽糖Maltose-硝酸盐还原Nitrate reduction+乳糖Lactose-OFF松三糖Melezitose-水杨素Salicin+甘露糖Mannose+丙二酸盐Malonic acid-纤维二糖Cellobiose-苦杏仁苷Amygdalin-松二糖Turanose-枸橼酸盐Citrate-山梨糖Sorbose-尿素Urea+蕈糖Muscrose-葡萄糖酸盐Gluconate-蜜二糖Melibiose-氰化钾KCN-半乳糖Galactose+糊精Dextrin-山梨醇Sorbitol-胆汁七叶苷Bile aesculin+侧金盏花醇Adonitol+β-半乳糖苷ONPG-甘露醇Mannitol+酒石酸盐Tartrate-赤藓醇Erythritol+N-乙酰葡萄糖胺N-acetylglucosamine+卫矛醇Euonymol-葡萄糖胺Glucosamine-肌醇Inositol+DNA-木醇Methanol-
注:+ 表示阳性;-表示阴性;F表示发酵型
Note: +,positive; -,negative;F,fermentative type
2.2分离菌的16SrDNA序列及系统发育树分析
以分离菌 株G0503基因组DNA为模板,采用PCR方法扩增16S rDNA序列,通过琼脂糖凝胶电泳,检测出大小约为1500 bp的目的条带(图1泳道1、2),PCR产物测序获得16S rDNA片段大小为1386 bp;进一步将其亚克隆至pMD18-T载体,转化至大肠杆菌DH5α中后筛选阳性克隆(图1泳道3、4、5),测得16S rDNA长度为1500 bp (GenBank登录号:MG138153)。Blast比对结果表明,与模式菌株ProvidenciarettgeriDSM 4542(AM040492.1)的16S rDNA序列一致性均为99.30%,与Providenciarettgeri(JN644501.1)的16S rDNA序列一致性为99.60%。构建系统发育树分析显示,分离菌株G0503与Providenciarettgeri(JN644501.1)亲缘关系最近,自然聚为一支(图2),最终判定G0503菌株为雷氏普罗威登斯菌。
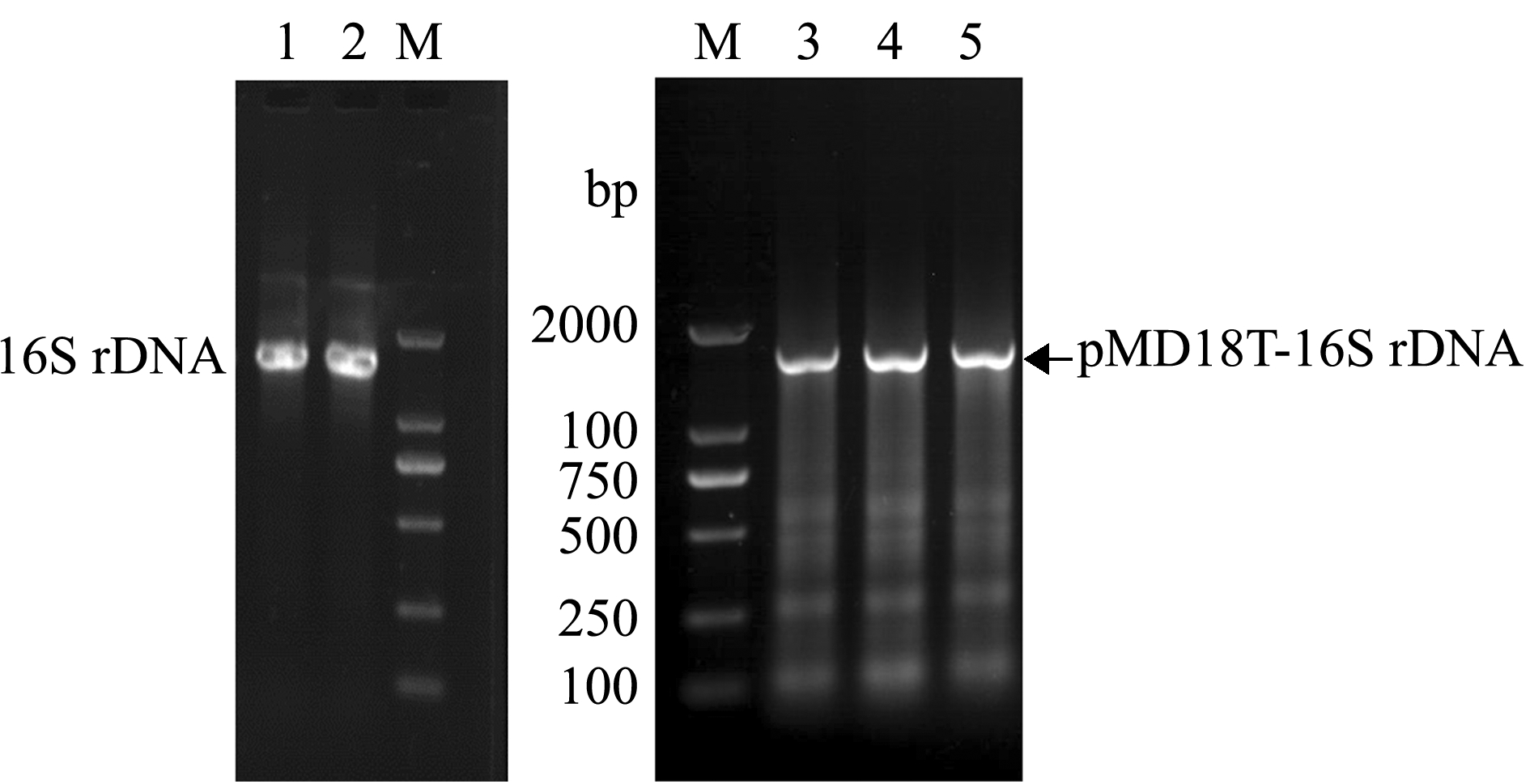
注:M为DNA标准DL 2000;1、2为16S rDNA,3、4、5为阳性克隆
Note: M,DNA standard DL 2000; 1 and 2, 16S rDNA, 3, 4 and 5, positive clones
图1 菌株G0503的16S rDNA基因PCR扩增及阳性克隆检测
Fig.1 PCR amplification and detection of 16S rDNA positive clone in the strain G0503

图2 基于16S rDNA基因序列构建的菌株G0503系统发育进化树
Fig.2 Phylogenetic tree of strain G0503 based on gene sequence of 16S rDNA
2.3分离菌G0503的药敏特性
药敏试验结果显示:G0503菌株对头孢噻肟、头孢哌酮、诺氟沙星、左氟沙星、氟苯尼考、阿米卡星、美罗培南、亚胺培南等抗生素高度敏感;对头孢克肟、链霉素、庆大霉素、新霉素等抗生素中度敏感;对阿莫西林、氨苄西林、头孢氨苄、卡那霉素、复方新诺明、磺胺异恶唑、甲氧嘧啶、萘啶酸、依诺沙星、恩诺沙星、四环素、阿奇霉素、万古霉素、克林霉素、利福平、呋喃唑酮、呋喃妥因等耐药。
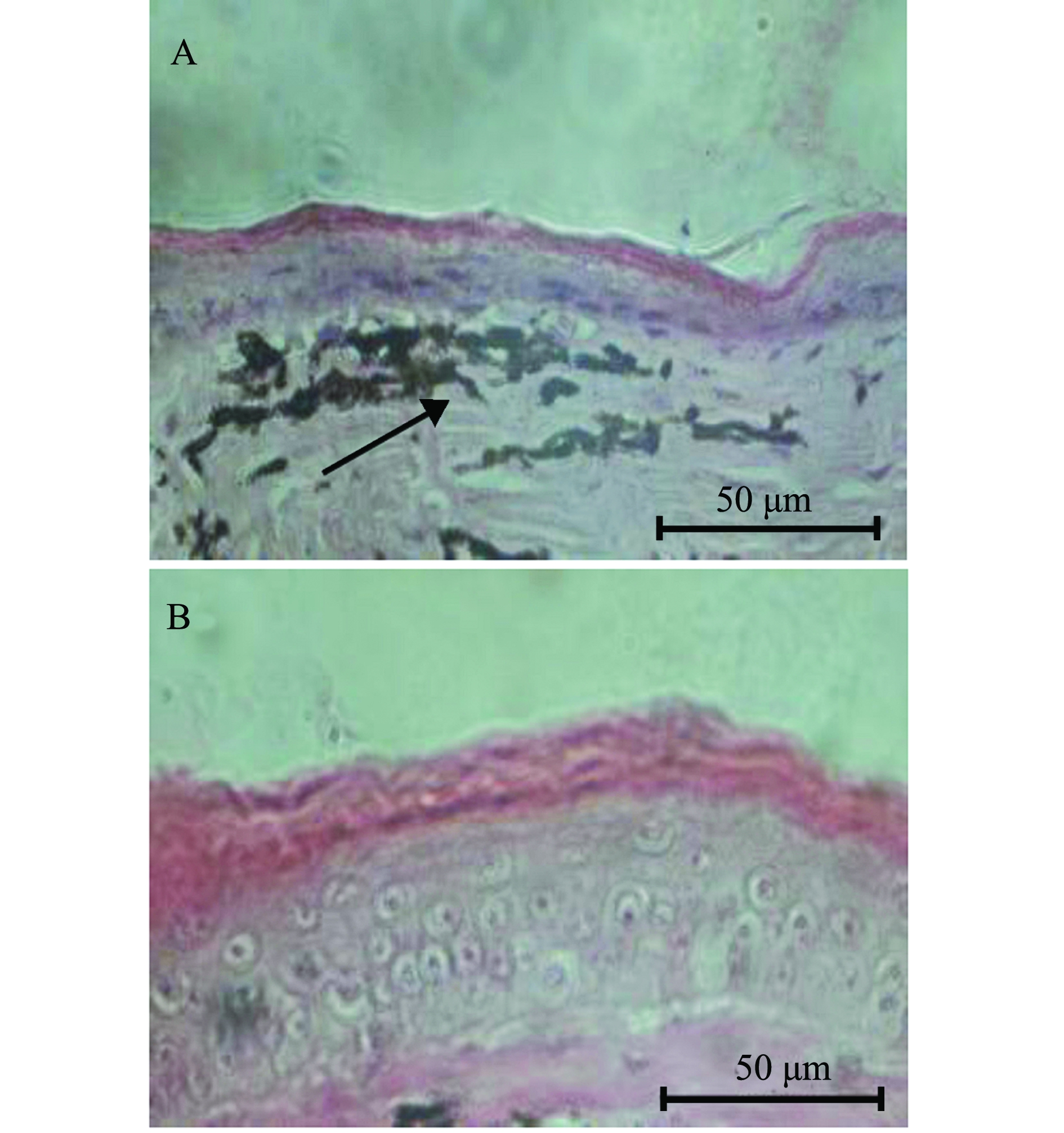
用G0503菌株人工腹腔注射健康巴西龟感染6 d后,试验龟出现发病、死亡现象,21 d累积死亡率达40%(4/10),感染龟主要临床症状为眼睛肿大、发炎充血、眼分泌液增多(图3),精神沉郁,行动迟缓,摄食减少或停止摄食,偶有前肢抓挠眼部等现象。人工感染发病死亡巴西龟与自然发病症状基本相同,并且从病死龟体内分离到与G0503菌株特征一致的细菌。注射生理盐水的对照组龟,观察21 d无发病死亡现象。进一步进行组织病理学观察发现,病龟眼睑组织上皮细胞中的多边形细胞消失,出现淋巴细胞浸润、色素细胞增多等病变(图4-A),而对照组正常巴西龟眼睑组织染色见图4-B。
3讨论
3.1雷氏普罗威登斯菌的致病性
普罗威登斯菌广泛分布于土壤、水体等自然环境中[16]。雷氏普罗威登斯菌不仅影响鱼、虾、龟鳖、鳄等水产动物健康养殖[6,8,17],而且对人类饮食构成潜在危害[3,17]。目前,有学者研究认为,雷氏普罗威登斯菌是条件致病菌,作为一种“人-兽-鱼”共患病病原菌,主要导致心包炎、腹泻、腹水等症状[18-19]。Zhang等[20]研究报道,雷氏普罗威登斯菌自然感染蚕导致败血症。最近,国内学者从猪内脏器官、粪便样品中分离得到雷氏普罗威登斯菌[3,15],并且证实对小鼠有较强致病性。也有报道雷氏普罗威登斯菌污染引起人食物中毒现象[21]。

注: A为眼睛肿大; B为黏液增多
Note: A,eyes are swollen; B, increased mucus
图3 发病巴西龟症状
Fig.3 Symptom of the turtle Trachemys scriptaelegans
注: A为患病巴西龟; B为健康巴西龟
Note:A,diseased turtle; B,healthy turtle
图4 巴西龟眼睑组织病理染色结果
Fig.4 Pathological observation of turtle Trachemys scriptaelegans with ophthalmia
近几年,关于雷氏普罗威登斯菌引发水产动物疾病等相关研究较受关注[3-8]。王建峰等[22]从国外船舶压舱水中分离出雷氏普罗威登菌。Faisal等[4]等报道罗非鱼发生大量死亡,病鱼鳃发白、肿胀,严重腹水,并在病死鱼的心、肾和脾中分离得到雷氏普罗威登斯菌。战文斌等[6]在发病的中国对虾淋巴液中分离出雷氏普罗威登斯菌,认为该菌是对虾细菌性败血症的病原。Bejarano等[5]研究表明,雷氏普罗威登斯菌是人工养殖鲢大量死亡的主要原因。陈永林等[23]从海洋馆病死白鳍鲨Triaenodonobesus腹腔脓液、心血中分离到一株致病性雷氏普罗威登斯菌。李林俐等[8]报道扬子鳄发病死亡,从其肝脏和血液中分离出雷氏普罗威登斯菌。范红结等[7]从患病中华鳖肝、脾和肺中分离出相同的病原菌,经鉴定为雷氏普罗威登斯菌,主要表现为鳖底板出血,肺、脾等内脏干酪样结节等临床症状。本试验中,从发病巴西龟眼部分泌液中分离到一株雷氏普罗威登斯菌G0503菌株,进行了细菌形态学、生理生化、16S rDNA测序及系统发育树分析,人工感染巴西龟主要呈现眼睛发炎肿大、反应呆滞、摄食减少或停止摄食等临床症状,组织染色观察发现,病龟出现眼睑组织上皮细胞中的多边形细胞消失,色素细胞增多等病理变化。
3.2雷氏普罗威登斯菌的药敏特性
由于抗生素药物在水产养殖和疾病防控中的广泛应用,且滥用药物现象时有发生,从而使鱼类疾病防治面临着新的挑战与难题[6,8]。夏淑等[24]研究报道,人类雷氏普罗威登斯菌对喹诺酮类、β内酰胺类及碳青霉烯类等抗生素耐药。战文斌等[6]研究表明,虾源雷氏普罗威登斯菌对羧苄青霉素、头孢唑啉、复方新诺明、链霉素等药物敏感,但对新生霉素和红霉素等耐药。陈永林等[23]对白鳍鲨雷氏普罗威登斯菌进行药敏试验,结果显示其对头孢曲松、头孢哌酮和诺氟沙星等抗生素敏感。李林俐等[8]对扬子鳄雷氏普罗威登斯菌进行药敏试验,结果显示其对头孢噻肟、头孢哌酮、诺氟沙星、氧氟沙星、磺胺异恶唑和复方新诺明等多种抗生素敏感。由此可见,人源雷氏普罗威登斯菌对喹诺酮类、碳青霉烯类等药敏特性与水产动物源雷氏普罗威登斯菌存在明显差异,这可能与菌株来源、地域分布和临床用药有关[8,24]。本研究中,对龟源雷氏普罗威登斯菌G0503菌株进行药敏试验,结果表明,该菌对头孢克肟、头孢哌酮、头孢噻肟、诺氟沙星、左氟沙星、氟苯尼考等药物敏感,对阿莫西林、氨苄西林、磺胺异恶唑、复方新诺明等耐药。研究表明,水产动物雷氏普罗威登斯菌对头孢菌素类、喹诺酮类及氟苯尼考等抗生素敏感[6,8],这与本试验中巴西龟雷氏普罗威登斯菌的药敏试验结果基本一致。以上研究报道了雷氏普罗威登斯菌药敏特性,可为水产动物疾病防治提供参考依据。
4结语
本研究中从患病巴西龟眼内分离到1株雷氏普罗威登斯菌,药敏试验结果显示,该菌对头孢克肟、头孢哌酮、头孢噻肟、诺氟沙星、左氟沙星、氟苯尼考等药物敏感;人工回归感染证实,该菌对巴西龟有致死性,并且导致眼睑等组织病理变化。本研究结果不仅为龟类细菌性疾病防治提供科学依据,而且对雷氏普罗威登斯菌感染龟鳖类水生动物的致病机理研究进行了有益的探索。
参考文献:
[1] 路娟,赵占春.普罗威登斯菌属属内分类和新种[J].哈尔滨医科大学学报,1989,23(5):375-377.
[2] Shima A,Hinenoya A,Asakura M,et al.Prevalence ofProvidenciastrains among children with diarrhea in Japan[J].Japanese Journal of Infectious Diseases,2012,65(6):545-547.
[3] 王建昌,姜彦芬,王金凤,等.猪源性blaNDM-1阴性雷氏普罗威登斯菌的分离鉴定[J].中国动物检疫,2015,32(4):22-25.
[4] Faisal M,Popp W,Refai M.High mortality of the Nile tilapiaOreochromisniloticuscaused byProvidenciarettgeri[J].Berliner Und Munchener Tierarztliche Wochenschrift,1987,100(7):238-240.
[5] Bejarano Y,Sarig S,Horne M T,et al.Mass mortalities in silver carpHypophthalmichthysmolitrix(Valenciennes) associated with bacterial infection following handling[J].Journal of Fish Diseases,2010,2(1):49-56.
[6] 战文斌,周丽,陈章群,等.一种新的对虾病原菌——雷氏普罗威登斯菌[J].中国水产科学,1997,4(1):38-44.
[7] 范红结,黄国庆,郭爱珍,等.雷氏普罗威登斯菌引致中华鳖脏器脓肿[J].南京农业大学学报,2001,24(4):71-74.
[8] 李林俐,胡智博,费荣梅,等.扬子鳄雷氏普罗威登斯菌与毗邻颗粒链菌混合感染病例的分析[J].中国兽医科学,2016,46(12):1505-1510.
[9] 兰云,胡秀彩,吕爱军,等.黄喉拟水龟摩氏摩根菌的分离鉴定及药敏试验[J].水生生物学报,2014,38(6):1173-1178.
[10] 王伟喆,潘连德.东锦龟摩尔摩根氏菌的分离鉴定和药敏试验[J].江苏农业科学,2013,41(10):205-208.
[11] 黄斌,陈世锋,陈勇.黄缘闭壳龟囊肿病的研究[J].淡水渔业,2002,32(5):44-46.
[12] 李玉平,赵凌恭,余春明,等.巴西龟肺炎眼炎综合征的病理学观察[J].中国兽医杂志,2011,47(2):56-57.
[13] 杨瑞婷.巴西龟白眼病病原的鉴别[J].养殖技术顾问,2014(9):81-81.
[14] Brenner D J,Krieg N R,Staley J T.Bergey’s Manual of Systematic Bacteriology[M].New York: Springer,2009:605-759.
[15] 陆梦莹,胡秀彩,吕爱军,等.鲶源维氏气单胞菌的分离鉴定及药敏特性[J].大连海洋大学学报,2017,32(5):563-567.
[16] 秦毅斌,何颖,卢冰霞,等.仔猪雷极氏普罗菲登斯菌的分离鉴定及系统进化分析[J].动物医学进展,2015,36(3):35-40.
[17] Camus A C,Hawke J P.Providenciarettgeri-associated septicemia and meningoencephalitis in juvenile farmed American alligatorsAlligatormississippiensis[J].Journal of Aquatic Animal Health,2002,14(2):149-153.
[18] 石磊,梁思思,岛绫香,等.食源性普罗威登斯菌的分离鉴定和耐药性研究[J].现代食品科技,2014,30(6):24-29.
[19] Wang X L,Wang J Q,Hao H F,et al.PathogenicProvidenciaalcalifaciensstrain that causes fatal hemorrhagic pneumonia in piglets[J].Current Microbiology,2014,68(3):278-284.
[20] Zhang J,Shen Z Y,Tang X D,et al.Isolation and identification of a pathogen,Providenciarettgeri,inBombyxmori[J].African Journal of Bacteriology Research,2013,5(2):22-28.
[21] 章根华.一起雷氏普罗威登斯菌引起的食物中毒调查[J].上海预防医学,2005,17(3):128.
[22] 王建峰,劳华均,孙萍,等.外来船舶压舱水中雷氏普罗威登菌的分离鉴定[J].畜牧与兽医,2012,44(10):110-111.
[23] 陈永林,张成林,闫鹤,等.白鳍鲨雷极氏普罗菲登斯菌的分离鉴定与药敏试验[J].中国兽药杂志,2010,44(6):48-50.
[24] 夏淑,肖书念,张琴,等.碳青霉烯类耐药雷氏普罗威登斯菌的出现及其耐药机制研究[J].第三军医大学学报,2013,35(23):2508-2512.
IsolationandidentificationofpathogenicbacteriaandhistopathologyinturtleTrachemysscriptaeleganswithophthalmia
YE Ming-hao1, HU Xiu-cai1, LÜ Ai-jun1, SUN Jing-feng1, LIU Xiao-xue1, SONG Ya-jiao2
(1.Tianjin Key Laboratory of Aqua-Ecology and Aquaculture, College of Fisheries, Tianjin Agricultural University, Tianjin 300384, China; 2.College of Fisheries, Henan Normal University, Xinxiang 453007, China)
Abstract:A bacterial strain named as strain G0503 was isolated from the mucus of ophthalmitis turtleTrachemysscriptaelegans(body weight of 150.0 g), and the morphological observation, physiological and biochemical characteristics, and sequencing of 16S rDNA and phylogenetic tree analysis were carried out in this study. Results showed that the G0503 strain was a rod-shaped, and gram-negative bacillus, and was characterized by production of acid from mannose, galactose and inositol, and negative reaction for lysine and ornithine decarboxylase. Furthermore, the 16S rDNA sequences was amplified by PCR method, and subcloned into pMD18-T vector, with a sequencing product of 1500 bp in length. The 16S rDNA sequence had a 99.30% similarity withProvidenciarettgeritype strain DSM 4542(AM040492.1), and clustered into one group withProvidenciarettgeri(JN644501.1), indicating that the G0503 strain was identified asP.rettgeri. The antibiotic susceptibility test showed that it was sensitive to cefoperazone, cefotaxime, levofloxacin, norfloxacin and florfenicol, and resistant to amoxicillin, ampicillin, sulfamethoxazole, sulfamethoxazole and trimethoprim. The challenge test revealed that the isolate resulted in mortality rate of 40% of the diseased turtle, with clinical signs including asthe swollen, increase in mucus of eye and feeding stop, which were consistent with the natural symptoms of the diseased turtles. Histopathological observation showed that reduction in the epithelium cell number and increase in chromatophores in the eyes. The findings firstly reported the isolation and identification ofP.rettgerifrom the turtle with ophthalmia, and will provide scientific reference for prevention and treatment in fish.
Keywords:Trachemysscriptaelegans;Providenciarettgeri; 16S rDNA; drug sensitivity test; histopathology
通信作者:吕爱军(1973—), 男, 教授。E-mail:lajand@126.com
作者简介:叶明皓(1995—), 男, 本科生。E-mail:1084395663@qq.com
基金项目:国家大学生创新训练计划项目(201810061036);国家自然科学基金资助项目(31272692);天津市自然科学基金资助项目(16JCZDJC33500,18JCYBJC299000);天津市水产产业技术体系创新团队(ITTFRS2017009);天津农学院综投平台项目(J01009030638);天津市高等学校“创新团队培养计划”现代水产生态健康养殖(TD13-5089);河南省高等学校重点科研项目(17A240001);河南省自然科学基金资助项目(182300410021)
收稿日期:2017-11-03
文章编号:2095-1388(2018)05-0564-06
DOI:10.16535/j.cnki.dlhyxb.2018.05.003
文献标志码:A
中图分类号:S947.9
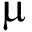 L,上、下游引物各1 μL,DNA模板2 μL,无菌双蒸水11 μL。PCR反应条件:95 ℃下预变性5 min;94 ℃下变性30 s,56 ℃下退火30 s,72 ℃下延伸1 min,共进行30个循环;最后在72 ℃下再延伸10 min。采用琼脂糖凝胶电泳检测目的基因,并将PCR产物送天津金唯智生物科技有限公司进行基因测序。用胶回收试剂盒回收纯化16S rDNA目的条带,与pMD18-T载体连接反应转化至大肠杆菌DH5α中,采用引物M13-47:5′CGCCAGGGTTTTCCCAGTCACGAC 3′,RV-M:5′ GAGCGGATAACAATTTC- ACACAGG 3′进行菌落PCR阳性克隆筛选,随机取阳性克隆送天津金唯智生物科技有限公司测序验证。
L,上、下游引物各1 μL,DNA模板2 μL,无菌双蒸水11 μL。PCR反应条件:95 ℃下预变性5 min;94 ℃下变性30 s,56 ℃下退火30 s,72 ℃下延伸1 min,共进行30个循环;最后在72 ℃下再延伸10 min。采用琼脂糖凝胶电泳检测目的基因,并将PCR产物送天津金唯智生物科技有限公司进行基因测序。用胶回收试剂盒回收纯化16S rDNA目的条带,与pMD18-T载体连接反应转化至大肠杆菌DH5α中,采用引物M13-47:5′CGCCAGGGTTTTCCCAGTCACGAC 3′,RV-M:5′ GAGCGGATAACAATTTC- ACACAGG 3′进行菌落PCR阳性克隆筛选,随机取阳性克隆送天津金唯智生物科技有限公司测序验证。



