菲律宾蛤仔橙蛤、斑马蛤和白蛤群体酚氧化酶活性的比较研究
丁鉴锋1、2,温嫱1,霍忠明1、2,聂鸿涛1、2,闫喜武1、2
(1.大连海洋大学 水产与生命学院, 辽宁 大连 116023; 2. 辽宁省贝类良种繁育工程技术研究中心, 辽宁 大连 116023)
摘要:为研究酚氧化酶(PO)在贝类体色形成和非特异性免疫过程中的重要作用,检测了壳长为(2.1±0.3)cm的3种壳色菲律宾蛤仔Ruditapesphilippinarum(橙蛤、斑马蛤和白蛤)血淋巴细胞和外套膜中的酚氧化酶活性,并对用脂多糖(LPS)和肽聚糖(PGN)刺激后其酶活性的变化进行了测定。结果表明:3种壳色蛤仔血淋巴细胞中酚氧化酶活性均显著高于外套膜中的酶活性(P<0.05);注射脂多糖后,橙蛤、斑马蛤和白蛤血淋巴细胞中酚氧化酶活性分别在3、12、12 h达到最大值,斑马蛤血淋巴细胞中酚氧化酶活性在12 h显著高于橙蛤(P<0.05),橙蛤、斑马蛤和白蛤外套膜中酚氧化酶活性分别在刺激后6、6、24 h时达到最大值;注射肽聚糖后,橙蛤血淋巴细胞中酚氧化酶活性在24 h达到最低值,斑马蛤和白蛤血淋巴细胞中的酚氧化酶活性分别在刺激后12 h和6 h达到最大值,白蛤血淋巴细胞中酚氧化酶活性在注射后6 h显著高于橙蛤和斑马蛤(P<0.05),斑马蛤血淋巴细胞中酚氧化酶活性在刺激后12 h显著高于橙蛤和白蛤(P<0.05),橙蛤外套膜组织中的酚氧化酶活性在注射肽聚糖后12 h达到最大值;不同壳色蛤仔体内酚氧化酶对细菌提取物刺激所表现出的不同反应模式,证实了蛤仔壳色形成过程与免疫能力可能具有重要的关联。本研究结果可为菲律宾蛤仔的壳色选育提供理论支持。
关键词:菲律宾蛤仔;壳色;血淋巴细胞;外套膜;酚氧化酶
贝壳是由贝类外套膜的边缘细胞所分泌的物质形成,其生长和色素形成受神经系统控制[1]。贝壳的多层结构由碳酸钙晶体及其中分布的蛋白成分和色素构成,色素是由外套膜细胞分泌并嵌入到生长边缘,随着壳的生长持续分泌到壳内[2]。贝类壳色形成的主要色素有黑色素、卟啉和类胡萝卜素等,其合成可能直接由少数几个基因控制[3]。对不同壳色贝类的比较研究发现,黑色素形成途径的相关基因差异表达是贝类壳色多态性形成的一个重要原因[3-5]。
在黑色素形成过程中,酚氧化酶(phenoloxidase, PO)参与L-多巴或多巴胺向黑色素的转化过程,是黑色素形成的一种关键酶[6]。同时,酚氧化酶在无脊椎动物的免疫、包裹、黑化和识别自身/非自身等过程中也发挥重要作用[7]。由于无脊椎动物体内的黑变(melanism)过程与先天性免疫过程存在共同的黑色素生成(也称为酚氧化酶级联反应)途径,无脊椎动物的体色与酚氧化酶介导的免疫能力间必然存在密切关系[8-9]。对一些节肢动物的研究发现,具有较强黑化作用或表皮中含有较多黑色素的个体表现出更高的免疫能力[10-12]。这种免疫差异能够被细菌提取物肽聚糖(peptidoglycans,PGN)、脂多糖(lipopolysaccharides,LPS),以及真菌中提取的β-1,3-葡聚糖等激活并表现出来[9]。贝类体内的酚氧化酶存在于多个组织中,外套膜合成和分泌的酚氧化酶可以转运到壳的棱柱层,参与黑色素的生物合成及色素形成过程[13-15]。有研究表明,贝类血淋巴细胞中的酚氧化酶也可能参与贝类的壳黑色素形成过程[16-17]。对太平洋牡蛎Crassostreagigas、栉孔扇贝Chlamysfarreri、菲律宾蛤仔Ruditapesphilippinarum、帘蛤Venerupisvariegata和文蛤Meretrixmeretrix的研究,证实了酚氧化酶在贝类抗菌感染中的重要作用[18-22];对虾夷扇贝Patinopectenyessoensis和蜗牛Cepaeahortensis、Thebapisana和Cornuaspersummaximum的研究也发现,不同壳色贝类体内酚氧化酶活性表现出差异[23-24]。因此,贝类壳色形成与免疫过程可能以酚氧化酶为媒介存在某种关联。
菲律宾蛤仔隶属于双壳纲、帘蛤科、缀锦亚科、蛤仔属,是一种中国沿海广泛养殖的滩涂贝类,其壳面颜色千差万别,是双壳贝类中壳色多态性最复杂的种类之一。研究发现,不同壳色蛤仔在耐受性、抗逆性和生长速率等方面表现出显著差异,并且能稳定遗传给下一代,但具体的作用机制尚不明确[24-28]。对不同壳色贝类的转录组研究发现,其差异表达基因分布在色素合成、生长、免疫和生物矿化等相关信号通路,色素形成信号通路主要集中在黑色素合成途径[4-5]。本研究中,以3种不同壳色且经转录组研究证实其外套膜组织酚氧化酶家族基因表达存在差异的菲律宾蛤仔为研究对象,检测在用细菌提取物肽聚糖和脂多糖刺激后其血淋巴和外套膜组织中酚氧化酶活性的变化情况,以期分析壳色与酚氧化酶活性的关联,为蛤仔的壳色形成和与抗逆性相关研究提供理论依据。
1材料与方法
1.1材料
试验用菲律宾蛤仔的斑马蛤、白蛤和橙色家系为辽宁省贝类良种繁育工程技术研究中心繁育的蛤仔家系,壳长为(2.1±0.3) cm,壳型完整且活力强,在50 L水体的养殖槽中暂养一周,养殖水温为(18.0±0.5)℃,盐度为32。暂养期间每天换水1次,并投喂螺旋藻粉,持续充氧。
1.2方法
1.2.1 试验设计 从3种壳色菲律宾蛤仔中各随机挑选72枚,每种壳色蛤仔分为3组,每组24枚。每种壳色的3组蛤仔按50 μL/枚的剂量分别注射免疫促进剂 LPS (100 μg/mL)和PGN (20 μg/mL),空白对照注射等量的PBS缓冲液,注射相同药品的蛤仔放入同一养殖槽中暂养,在注射后的0、3、6、12、24、48 h时从每种壳色蛤仔各注射组中随机选取4枚个体,采集样品组织用于后续分析。
1.2.2 样品采集 使用1 mL无菌注射器,从菲律宾蛤仔围心腔中分别抽取血淋巴400 μL,于4 ℃下以 4000 r/min 离心10 min,收集血淋巴细胞,液氮中冷冻后置于超低温冰箱(-80 ℃)中保存备用。分离采集血淋细胞后的蛤仔外套膜200 mg,用液氮速冻后研成粉末,置于-80 ℃下保存备用。
1.2.3 样品裂解 向血淋巴细胞和外套膜样品中加入裂解液500 μL,用匀浆机匀浆后,于4 ℃下 以1000 r/min 离心45 min,收集上清液用于酶活性和总蛋白含量的测定。
蛋白裂解液配制方法如下: 150 mmol/L NaCl、10 mmol/L Tris、1 mmol/L EDTA、1 mmol/L EGTA、1% TritonX-100和0.5% Igepal,按照1片/25 mL缓冲液的量加入不含EDTA的蛋白酶抑制剂(phosphatase inhibitor cocktail III 贝博生物)[29]。
1.2.4 酚氧化酶活性测定 采用Le Bris等[20]的方法测定酚氧化酶活性,以L-DOPA 为反应底物。具体操作如下:将50 μL裂解液(包括血淋巴细胞和外套膜组织裂解上清液)加入96孔酶标板孔中,再分别加入50 μL Tris-HCl缓冲液(0.10 mol/L,pH 8.0),25 ℃下孵育10 min;每孔分别加入100 μL 0.04 mol/L L-DOPA。混合均匀后置于酶标仪中, 在25 ℃条件下反应30 min,读取 492 nm处的吸光度值。L-DOPA的自发氧化采用相同方法同时测定,反应物用纯水替代裂解液,计算时将自发氧化的结果从测定值中剔除。
酚氧化酶的活性以每分钟吸光度值的增加量(ΔA/min)进行计算,公式为
PO活性(U /mg prot)=(ΔA/min×稀释倍数)/总蛋白浓度。
1.2.5 蛋白含量的测定 使用Bradford法蛋白检测试剂盒(南京建成生物有限公司) 测定总蛋白含量,用考马斯亮蓝G-250染色, 在酶标仪上读取595 nm波长下蛋白样品的光密度值。以蛋白标准(5 mg/mL BSA)稀释液作为蛋白质浓度标准, 计算血清总蛋白含量。
1.3数据处理
用 SPSS 20.0 软件对数据进行分析处理,采用单因素方差分析进行差异显著性检验,采用Duncan法进行组间多重比较,不同时间点比较以0 h测定值为对照,同一壳色不同组织之间的比较采用t检验法,显著性水平设为 0.05。
2结果与分析
2.13种壳色菲律宾蛤仔血淋巴细胞和外套膜中PO活性比较
从图1可见,3种壳色蛤仔血淋巴细胞中PO活性均显著高于外套膜中的酶活性(P<0.05),3种壳色蛤仔血淋巴细胞中PO活性依次为白蛤>橙蛤>斑马蛤,外套膜中PO活性相差不大。
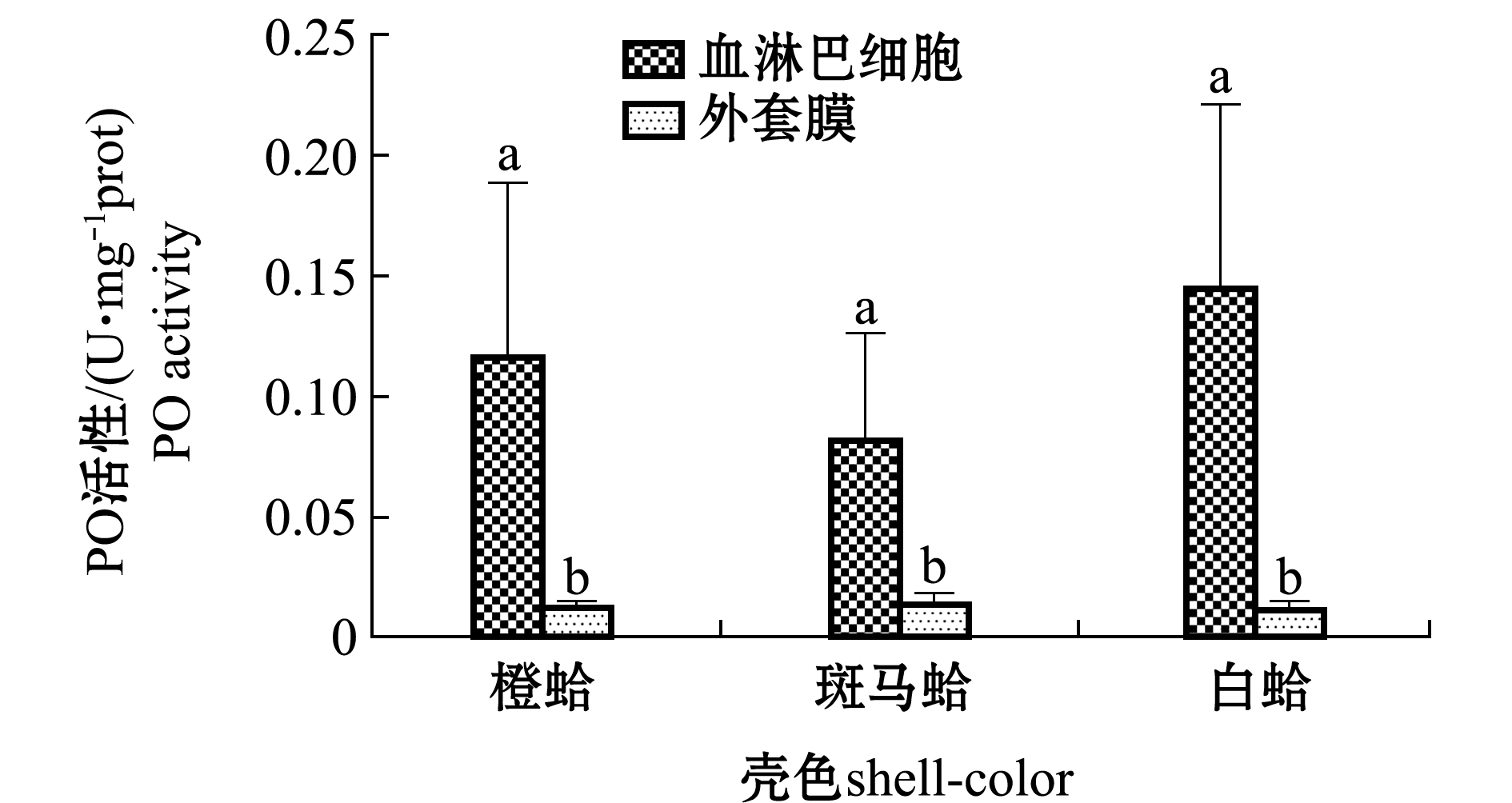
注:标有不同小写字母者表示同一壳色不同组织间有显著性差异(P<0.05)
Note:Different lowercase letters represent significant differences between tissues in the same shell-color group (P<0.05)
图1 3种壳色菲律宾蛤仔血淋巴细胞与外套膜组织中酚氧化活性的比较
Fig.1 Comparison of the phenoloxidase activity in hemocytes and mantle of the three shell-color clams
2.23种壳色菲律宾蛤仔注射LPS后血淋巴细胞和外套膜组织中PO活性比较
注射LPS后,3种壳色菲律宾蛤仔血淋巴细胞和外套膜中PO活性变化如图2所示。从图2可见,注射LPS后,随着时间的延长,3种壳色血淋巴细胞中的PO活性均表现出先升高后降低的趋势,橙蛤在被刺激后3 h、斑马蛤和白蛤在刺激后12 h时,PO活性均达到最大值且显著高于0 h(P<0.05);48 h时,3种蛤仔PO活性恢复至接近0 h水平,且斑马蛤血淋巴PO活性显著高于橙蛤(P<0.05)。
从图2还可见,注射LPS后,随着时间的延长,3种壳色外套膜中的PO活性均表现出先升高后降低的趋势,橙蛤和斑马蛤在被刺激后6 h时PO活性达到最大值且显著高于0 h(P<0.05),白蛤在被刺激后24 h时达到最大值且显著高于0 h(P<0.05);48 h时3种蛤仔PO活性均恢复至0 h水平。
2.33种壳色菲律宾蛤仔注射PGN后血淋巴细胞和外套膜组织PO活性比较
注射PGN后,3种壳色菲律宾蛤仔血淋巴细胞和外套膜中PO活性变化如图3所示。从图3可见,注射PGN后,随着时间的延长,橙蛤的PO活性表现出降低的趋势,在24 h时PO活性达到最低值,而斑马蛤和白蛤血淋巴细胞中PO活性均表现出先升高后降低的趋势,斑马蛤在被刺激后12 h、白蛤在刺激后6 h时,PO活性达均到最大值(P<0.05);在注射后6 h时,白蛤血淋巴细胞中PO活性显著高于橙蛤和斑马蛤(P<0.05),注射后12 h时,斑马蛤血淋巴细胞中PO活性显著高于橙蛤和白蛤(P<0.05)。
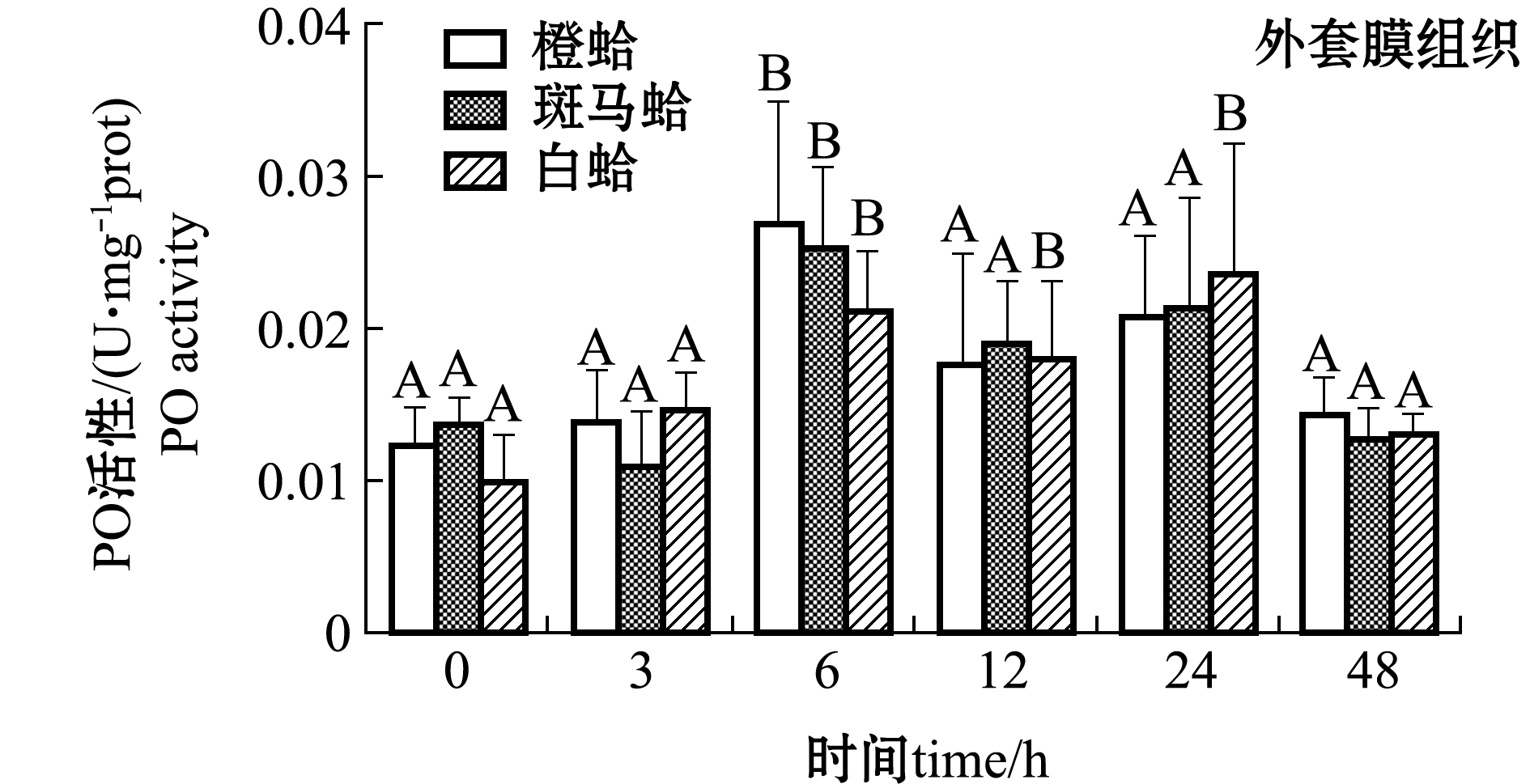
注:标有不同大写字母者表示不同时间点与0 h比较有显著性差异(P<0.05),标有不同小写字母者表示同一时间点不同组织间比较有显著性差异(P<0.05),下同
Note: Different capital letters indicate significant difference between 0 h and different time points(P<0.05); Different lowercase letters represent significant differences between tissues at the same time (P<0.05),et sequentia
图2 LPS刺激后3种壳色菲律宾蛤仔血淋巴细胞和外套膜组织中PO活性的变化
Fig.2 Changes in phenoloxidase activity in hemocytes and mantles of the three shell-color clams injected with LPS
从图3还可见,注射PGN后,随着时间的延长,3种壳色外套膜中的PO活性均表现出升高的趋势,橙蛤在注射后12 h时达到最大值且显著高于0 h(P<0.05),而其他两种壳色蛤仔外套膜中PO活性虽有升高但不显著(P>0.05)。
3讨论
3.1菲律宾蛤仔外套膜和血淋巴细胞中PO的分布
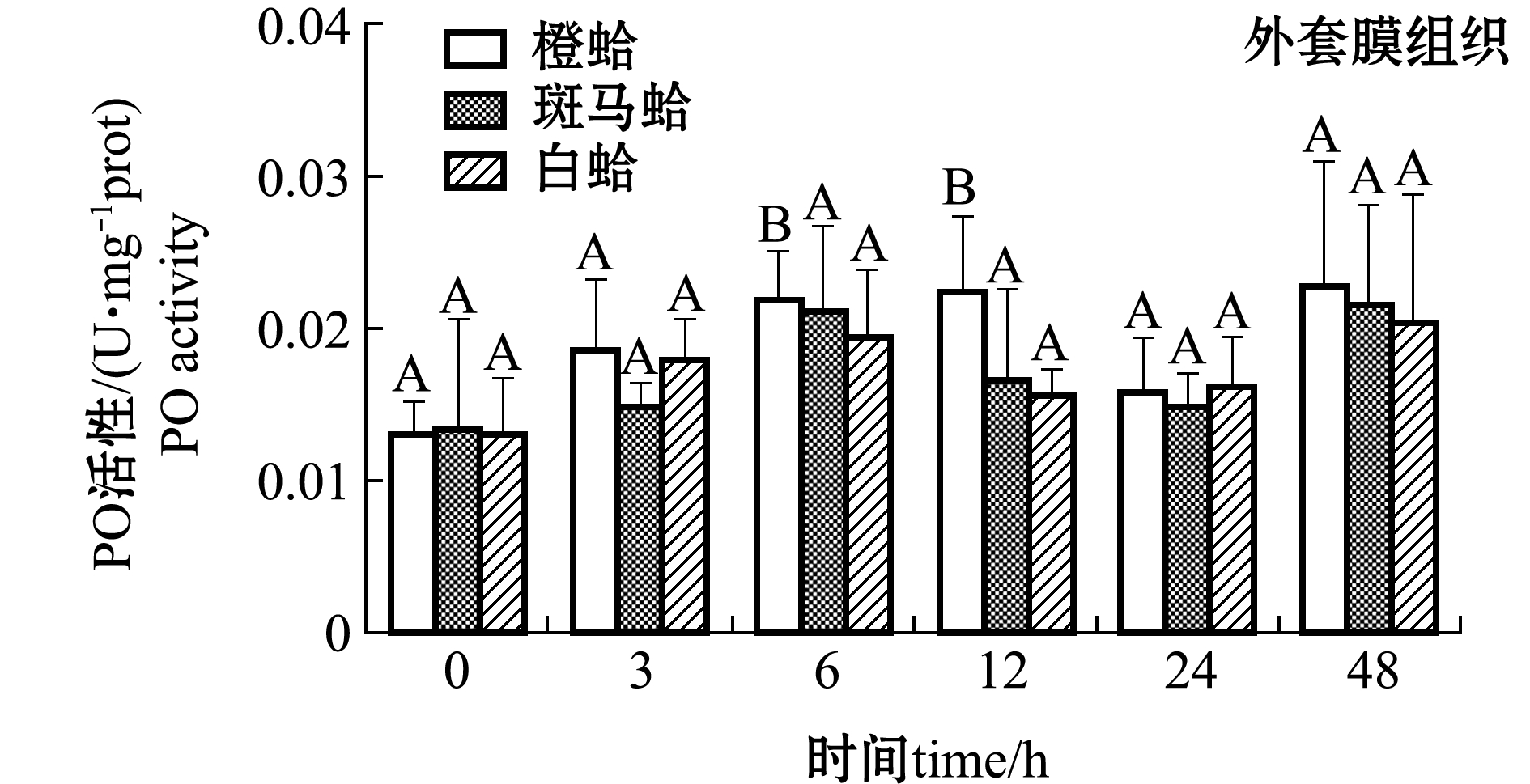
图3 PGN刺激后3种壳色菲律宾蛤仔血淋巴细胞和外套膜组织中PO活性的变化
Fig.3 Changes in phenoloxidase activity in hemocytes and mantles of the three shell-color clams injected with PGN
酚氧化酶又名酪氨酸酶,是一种含铜的酶,在哺乳动物体内通常称为酪氨酸酶,无脊椎动物一般称为PO,能够催化单酚羟化成二酚(如多巴),并把二酚氧化成醌。醌在非酶促条件下,形成最终的反应产物是黑色素[30]。PO在体内的不同组织中能够发挥不同的作用,如在血淋巴细胞中作为免疫效应因子,在血淋巴中作为化学递质,在鳃、足和外套膜中参与黏附蛋白的组成及贝壳的形成和修复等过程[16]。本研究中,在菲律宾蛤仔的鳃和外套膜组织中均检测到PO活性,且3种壳色蛤仔外套膜中的PO活性均显著低于其血淋巴中的酶活性。究其原因主要可能与蛤仔外套膜细胞中较高的Ca2+水平有关。对节肢动物的研究发现,高浓度的Ca2+能够抑制酚氧化酶原的激活导致PO活性较低[31-32],在一些血淋巴中含有较高Ca2+含量的蜗牛Cepaeahortensis、Thebapisana和Cornuaspersummaximum体内也发现了类似的结果[24]。因此,作为贝类参与壳矿化过程主要细胞分布的组织,蛤仔外套膜中高浓度的Ca2+是导致其PO活性远远低于血淋巴的一个重要原因[33]。
3.2菲律宾蛤仔外套膜和血淋巴细胞中PO的免疫应答作用
研究表明, PO 是大多数贝类先天免疫防御系统中的重要酶之一[16]。双壳贝类体内的PO能够被真菌β-1,3-葡聚糖及细菌的肽聚糖和脂多糖诱导,这一激活过程通常由病原模式识别受体(Pattern recognition receptors,PRRs)所触发[34]。栉孔扇贝C.farreri体内的PO被证实具有抗菌活性[19, 35]。Richard等[36]和Le Bris等[37]用弧菌V.tapetis刺激菲律宾蛤仔后其血淋巴PO活性也显著升高[36-37]。Aladaileh等[34]使用LPS刺激牡蛎Saccostreaglomerata后其血淋巴细胞中PO活性显著升高。此外,使用脂多糖刺激栉孔扇贝后其血淋巴中PO活性显著升高[19]。本研究中,在受到肽聚糖和脂多糖刺激后,3种壳色蛤仔血淋巴细胞和外套膜中的PO活性均表现出升高的过程。表明蛤仔体内的PO在受到病原微生物的感染时,能够被激活并参与到对病原的免疫反应过程[7]。此外,本研究中蛤仔外套膜中PO的升高程度要低于血淋巴中的PO,这可能与PO在不同组织中的作用差异有关[16]。
3.3菲律宾蛤仔体内PO在蛤仔壳黑色素形成和免疫防御中的作用
无脊椎动物体内的PO参与体内黑色素的形成过程,这一生化反应过程在机体的免疫和黑变(melanism)过程中具有关键作用,因此,无脊椎动物体内黑色素含量与免疫能力之间存在相关性[8-9]。对黄粉虫甲虫Tenebriomolitor的研究发现,黑色个体较黄褐色个体含有更多的黑色素,被脂多糖刺激后体内PO活性也显著高于黄褐色个体,能够更有效地抵御病原感染[10]。角质层黑色素含量较多的南方地蟋Allonemobiussocius也表现出更卓越的以黑色素为基础的免疫能力[38]。对虾夷扇贝的研究发现,黑色素含量较多的黑色个体PO活性显著高于含黑色素较少的白色个体[23]。Scheil等[24]对3种蜗牛Cepaeahortensis、Thebapisana和Cornuaspersummaximum的比较研究发现,深色蜗牛的血淋巴中PO活性远高于浅色个体。黑色素含量的差异也是贝类壳色多样性形成的重要原因之一[3]。Nagai等[13]在合浦珠母贝Pinctadafucata体内发现两种与壳黑色素形成相关的基因——Pfty1和Pfty2,其编码的蛋白具有PO的活性。对贻贝Meretrixmeretrix转录组的研究也发现,不同壳色贻贝的黑色素形成信号通路相关基因表达存在显著差异[5]。以上结果表明:不同壳色贝类基于黑色素合成途径的免疫能力也应存在差异。本研究中,3种壳色蛤仔血淋巴中PO活性受病原刺激后均出现升高的过程,但升高的幅度存在差异,其中,斑马蛤在被刺激12 h后血淋巴中PO活性显著高于其他两种壳色,白蛤被肽聚糖刺激6 h后血淋巴中PO活性显著高于其他两种壳色。前期研究发现,不同壳色菲律宾蛤仔群体抗逆性存在着显著的差异[27, 39]。因此,作为贝类壳中黑色素形成的关键酶——PO,在不同壳色蛤仔受病原刺激后其活性变化表现出的差异,可能是不同壳色蛤仔抗逆性不同的重要原因之一,该结果初步证实了蛤仔壳色形成与免疫过程间存在关联,可为菲律宾蛤仔的壳色选育提供理论支持。
参考文献:
[1] Boettiger A,Ermentrout B,Oster G,et al.The neural origins of shell structure and pattern in aquatic mollusks[J].Proceedings of the National Academy of Sciences of the United States of America,2009,106(16):6837-6842.
[2] Budd A,McDougall C,Green K,et al.Control of shell pigmentation by secretory tubules in the abalone mantle[J].Frontiers in Zoology,2014,11:62.
[3] Williams S T.Molluscan shell colour[J].Biological Reviews,2017,92(2):1039-1058.
[4] Ding Jun,Zhao Le,Chang Yaqing,et al.Transcriptome sequencing and characterization of Japanese scallopPatinopectenyessoensisfrom different shell color lines[J].PLoS One,2015,10(2):e0116406.
[5] Yue Xin,Nie Qing,Xiao Guoqiang,et al.Transcriptome analysis of shell color-related genes in the clamMeretrixmeretrix[J].Marine Biotechnology,2015,17(3):364-374.
[6] True J R.Insect melanism:the molecules matter[J].Trends in Ecology & Evolution,2003,18(12):640-647.
[7] Cerenius L,Lee B L,Söderhäll K.The proPO-system:pros and cons for its role in invertebrate immunity[J].Trends in Immunology,2008,29(6):263-271.
[8] Rolff J,Siva-Jothy M.Invertebrate ecological immunology[J].Science,2003,301(5632):472-475.
[9] Söderhäll K,Cerenius L.Role of the prophenoloxidase-activating system in invertebrate immunity[J].Current Opinion in Immunology,1998,10(1):23-28.
[10] Armitage S A O,Siva-Jothy M T.Immune function responds to selection for cuticular colour inTenebriomolitor[J].Heredity,2005,94(6):650-656.
[11] Barnes A I,Siva-Jothy M T.Density-dependent prophylaxis in the mealworm beetleTenebriomolitorL. (Coleoptera:Tenebrionidae):cuticular melanization is an indicator of investment in immunity[J].Proceedings of the Royal Society B:Biological Sciences,2000,267(1439):177-182.
[12] Cotter S C,Kruuk L E B,Wilson K.Costs of resistance:genetic correlations and potential trade-offs in an insect immune system[J].Journal of Evolutionary Biology,2004,17(2):421-429.
[13] Nagai K,Yano M,Morimoto K,et al.Tyrosinase localization in mollusc shells[J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,2007,146(2):207-214.
[14] Zhang Guofan,Fang Xiaodong,Guo Ximing,et al.The oyster genome reveals stress adaptation and complexity of shell formation[J].Nature,2012,490(7418):49-54.
[15] Bai Zhiyi,Zheng Hanfeng,Lin Jingyun,et al.Comparative analysis of the transcriptome in tissues secreting purple and white nacre in the pearl musselHyriopsiscumingii[J].PLoS One,2013,8(1):e53617.
[16] Luna-Acosta A,Breitwieser M,Renault T,et al.Recent findings on phenoloxidases in bivalves[J].Marine Pollution Bulletin,2017,122(1-2):5-16.
[17] Li Shiguo,Liu Yangjia,Liu Chuang,et al.Hemocytes participate in calcium carbonate crystal formation,transportation and shell regeneration in the pearl oysterPinctadafucata[J].Fish & Shellfish Immunology,2016,51:263-270.
[18] Luna-Acosta A,Bustamante P,Godefroy J,et al.Seasonal variation of pollution biomarkers to assess the impact on the health status of juvenile Pacific oystersCrassostreagigasexposed in situ[J].Environmental Science and Pollution Research,2010,17(4):999-1008.
[19] Zhou Zhi,Ni Duojiao,Wang Mengqiang,et al.The phenoloxidase activity and antibacterial function of a tyrosinase from scallopChlamysfarreri[J].Fish & Shellfish Immunology,2012,33(2):375-381.
[20] Le Bris C,Paillard C,Stiger-Pouvreau V,et al.Laccase-like activity in the hemolymph ofVenerupisphilippinarum:characterization and kinetic properties[J].Fish & Shellfish Immunology,2013,35(6):1804-1812.
[21] Buffet P E,Zalouk-Vergnoux A,Ch tel A,et al.A marine mesocosm study on the environmental fate of silver nanoparticles and toxicity effects on two endobenthic species:the ragwormHedistediversicolorand the bivalve molluscScrobiculariaplana[J].Science of the Total Environment,2014,470-471:1151-1159.
tel A,et al.A marine mesocosm study on the environmental fate of silver nanoparticles and toxicity effects on two endobenthic species:the ragwormHedistediversicolorand the bivalve molluscScrobiculariaplana[J].Science of the Total Environment,2014,470-471:1151-1159.
[22] Matozzo V,Bailo L.A first insight into haemocytes of the smooth venus clamCallistachione[J].Fish & Shellfish Immunology,2015,42(2):494-502.
[23] Sun Xiujun,Liu Zhihong,Zhou Liqing,et al.Integration of next generation sequencing and EPR analysis to uncover molecular mechanism underlying shell color variation in scallops[J].PLoS One,2016,11(8):e0161876.
[24] Scheil A E,Hilsmann S,Triebskorn R,et al.Shell colour polymorphism,injuries and immune defense in three helicid snail species,Cepaeahortensis,ThebapisanaandCornuaspersummaximum[J].Results in Immunology,2013,3:73-78.
[25] 闫喜武,张国范,杨凤,等.菲律宾蛤仔莆田群体两个壳色品系生长发育的比较[J].大连水产学院学报,2005,20(4):266-269.
[26] 丁鉴锋,王锐,闫喜武,等.菲律宾蛤仔3种壳色群体低盐耐受能力的比较研究[J].大连海洋大学学报,2013,28(3):264-268.
[27] 丁鉴锋,杨霏,闫喜武,等.不同壳色菲律宾蛤仔免疫机能的比较研究[J].大连海洋大学学报,2012,27(5):411-416.
[28] Cabaret J.Natural infection of land-snails by protostrongylids on a pasture grazed by sheep in the Rabat area of Morocco[J].Veterinary Parasitology,1988,26(3-4):297-304.
[29] Guévélou E,Huvet A,Galindo-Sánchez C E,et al.Sex-specific regulation of AMP-activated protein kinase (AMPK) in the Pacific oysterCrassostreagigas[J].Biology of Reproduction,2013,89(4):100.
[30] Sugumaran M.Roles of the insect cuticle in host defence reactions[M]//Soderhall K,Iwanaga S,Vasta G R.New Directions in Invertebrate Immunology.FairHaven,NJ:Sos Pubns,1996:355-374.
[31] Ashida M,Ishizaki Y,Iwahana H.Activation of pro-phenoloxidase by bacterial cell walls or β-1,3-glucans in plasma of the silkworm,Bombyxmori[J].Biochemical and Biophysical Research Communications,1983,113(2):562-568.
[32] Söderháll K.Fungal cell wall β-1,3-glucans induce clotting and phenoloxidase attachment to foreign surfaces of crayfish hemocyte lysate[J].Developmental & Comparative Immunology,1981,5(4):565-573.
[33] Addadi L,Joester D,Nudelman F,et al.Mollusk shell formation:a source of new concepts for understanding biomineralization processes[J].Chemistry-A European Journal,2006,12(4):980-987.
[34] Aladaileh S,Nair S V,Raftos D A.Induction of phenoloxidase and other immunological activities in Sydney rock oysters challenged with microbial pathogen-associate molecular patterns[J].Fish & Shellfish Immunology,2007,23(6):1196-1208.
[35] Xing Jing,Jiang Jingwei,Zhan Wenbin.Phenoloxidase in the scallopChlamysfarreri:purification and antibacterial activity of its reaction products generatedinvitro[J].Fish & Shellfish Immunology,2012,32(1):89-93.
[36] Richard G,Le Bris C,Guérard F,et al.Immune responses of phenoloxidase and superoxide dismutase in the Manila clamVenerupisphilippinarumchallenged withVibriotapetis-part II:combined effect of temperature and twoV.tapetisstrains[J].Fish & Shellfish Immunology,2015,44(1):79-87.
[37] Le Bris C,Richard G,Paillard C,et al.Immune responses of phenoloxidase and superoxide dismutase in the Manila clam Venerupisphilippinarumchallenged withVibriotapetis-part I:spatio-temporal evolution of enzymes’ activities post-infection[J].Fish & Shellfish Immunology,2015,42(1):16-24.
[38] Fedorka K M,Lee V,Winterhalter W E.Thermal environment shapes cuticle melanism and melanin-based immunity in the ground cricketAllonemobiussocius[J].Evolutionary Ecology,2013,27(3):521-531.
[39] 闫喜武,张跃环,霍忠明,等.不同壳色菲律宾蛤仔品系F2的表型性状[J].水产学报,2010,34(6):701-709.
Acomparisonofphenoloxidaseactivityintheorange-,zebra-andwhite-groupsofManilaclamRuditapesphilippinarum
DING Jian-feng1,2, WEN Qiang1, HUO Zhong-ming1,2, NIE Hong-tao1,2, YAN Xi-wu1,2
(1.College of Fisheries and Life Science, Dalian Ocean University, Dalian 116023, China; 2.Engineering Research Center of Shellfish Culture and Breeding in Liaoning Province, Dalian 116023, China)
Abstract:Phenoloxidase (PO) activity was determined in hemocytes and mantle tissues of Manila clamRuditapesphilippinarumwith three shell colors(orange, zebra and white)with shell length of (2.1±0.3)cm, and the hemolymph phenoloxidase activity were also measured in the Manila clam with injection of lipopolysaccharide (LPS) at a dose of 100 μg/mL and peptidoglycan (PGN) at a dose of 20 μg/mL 0, 3, 6, 12, 24, and 48 h after the administration. The results showed that there was significantly higher PO activity in hemocytes than that in mantle in all the three shell-color groups(P<0.05), the maximal level of PO activity in hemocytes of the clam injected with LPS at 3 h in orange, and 12 h in zebra and white clam groups, significant higher in zebra group than that in orange group at 12 h(P<0.05). In the mantle, however, the maximal level of PO activity was observed at 6 h in orange and zebra shell groups and 24 h in white shell color group. The PO activity in hemocytes was found to be declined in orange shell-color clam injected with PGN, the minimal value at 24 h, while the PO activity in hemocytes was clam enhanced in zebra and white color groups,with the maximal level at 12 h in zebra clam and 6 h in white color clam, and significant higher in mantle of zebra color group than that in orange and white color groups(P<0.05). The maximal PO activity in the mantle was detected in the orange color group clam at 12 h after PGN injection, indicating that the responds of PO activity to pathogens are varied with clams with different shell colors, which is involved in close correlation between shell pigmentation and immunity in Manila clam. These findings will provide theoretical support for shell color selection of Manila clam.
Keywords:Ruditapesphilippinarum; shell color; hemocyte; mantle; phenoloxidase
通信作者:闫喜武(1962—), 男, 博士, 教授。E-mail:yanxiwu@dlou.edu.cn
作者简介:丁鉴锋(1977—), 男, 博士, 副教授。E-mail:jfding@dlou.edu.cn
基金项目:辽宁省教育厅科研项目 (L2014276); 国家“863”计划项目(2012AA10A410-2)
收稿日期:2017-12-25
文章编号:2095-1388(2018)05-0558-06
DOI:10.16535/j.cnki.dlhyxb.2018.05.002
文献标志码:A
中图分类号:S968.31



 tel A,et al.A marine mesocosm study on the environmental fate of silver nanoparticles and toxicity effects on two endobenthic species:the ragworm
tel A,et al.A marine mesocosm study on the environmental fate of silver nanoparticles and toxicity effects on two endobenthic species:the ragworm