海岸带是海洋与陆地间的过渡地带,因其优良的自然资源和较高的生产力,已成为人类活动集中的地带。在海岸带的开发利用中,人类活动对海岸带的影响及海岸带环境变化对人类的反馈已成为研究的焦点[1-6]。Saeijs等[1]研究了人类交替活动对海岸带短期活动的直接影响和长期活动的间接影响,Dean等[2]详细地分析了人类活动对岸滩演变及水动力条件的变化,Sato等[3]通过对日本Isahaya湾的分析,指出填海使动物群的种类和丰度明显下降,也改变了湿地生物的群落结构,王国平等[4]、马军[5]、郭伟等[6]分别研究了人类活动对向海湿地水文与生态环境的影响。研究表明,人类活动加剧了近海地球化学过程[7],这为构建人海关系的生态过程及生态变化对人类的反馈提供了基础,海岸带独特的自然条件和人类用海活动的差异性导致相关研究的适用性不高,因此,对具有典型特征的海岸进行人海关系的研究具有重要意义。
莱州湾是典型的半封闭型内海,近年来,受围填海、养殖、盐田等人类活动影响,莱州湾海域环境质量逐渐恶化,特别是营养盐的输入给莱州湾生态环境和生物群落造成了严重的危害。莱州湾西部有广利河、小清河等入海河流,西北有黄河入海,沿岸人类活动频繁,区域特征明显,是莱州湾污染较严重的区域,也是研究人类活动对海岸带生态环境影响的良好素材。
浮游植物群落在生物地球化学循环中起着关键作用,可以迅速而灵敏地反映环境的变化[8],其群落结构特征能够反映海洋生态环境状况[9],是反映人类活动对海岸带生态系统演化影响的重要指标之一。为了客观反映莱州湾西部海域生态环境状况,了解浮游植物群落演变对海岸带生态环境变化的响应机制,笔者于2016年春、秋季对莱州湾西部浮游植物的群落生态学特征进行了研究,并结合有关理化指标分析其与环境因子的关系,以期为莱州湾海域生态环境保护提供科学的管理信息,同时为研究该海域人类活动与海岸带生态演化的交互作用提供基础数据资料。
1 材料与方法
1.1 调查站位
2016年春季(5月)、秋季(9月)进行了莱州湾西部海域调查工作,沿岸线方向设置5条断面共10个监测站位(图1),站位水深为1~8 m。
图1 莱州湾西部调查站位分布图
Fig.1 Sampling sites in the western Laizhou Bay
1.2 方法
1.2.1 样品的采集与分析 浮游植物取样用浅水Ⅲ型浮游生物网(孔径为0.076 mm,网口直径为37 cm,网长为1.5 m)于各站自水体底层至表层垂直拖取,采集的样品用5%福尔马林溶液固定保存,样品的处理方法按照《海洋调查规范 第6部分:海洋生物调查》(GB 12763. 6—2007)要求进行,样品鉴定依据《中国海藻志》和《中国近海赤潮生物图谱》。
对同步环境要素进行监测,监测内容包括温度、盐度、溶解氧、高锰酸盐指数(CODMn)、无机氮、活性磷酸盐,监测方法按照《海洋监测规范 第4部分:海水分析》(GB 17378.4—2007)的要求进行。
1.2.2 生物多样性分析 采用Shannon-Wiener多样性指数(H′)、Margalef物种丰度指数(D)和Pielou均匀度指数(J)分析浮游植物的群落结构,用优势度(Y)确定优势种,其计算公式为
D=(S-1)/log2N,
(1)
(2)
J=H′/log2S,
(3)
Y=(ni/N)×fi。
(4)
其中:ni为第i种的个体数量;Pi=ni/N,N为采集样品的所有种类总个体数;S为采集样品的种类总数;f为该种出现的频率,当优势度Y大于0.02的确定为优势种[10]。
1.3 数据处理
根据同步观测到的水温、盐度、DO、营养盐等数据,采用SPSS 17.0软件分析环境因子相关性,使用PRIMER 5.0 软件分析群落结构聚类,采用 CANOCO 5.0 软件分析样品主成分。
2 结果与分析
2.1 浮游植物种类组成
本次调查中,莱州湾西部海域共发现浮游植物64种,其中,硅藻28属57种,甲藻 6种,金藻1种。根据浮游植物对温度盐度适应性不同的生态和地理分布特点,调查海域已鉴定的浮游植物种类可归为4种生态类型[11-12]:(1) 广温广盐类群。这一类群可适应较大幅度的温度盐度变化,空间分布广泛,数量上占有较大优势。例如,斯氏根管藻Rhizosolenia stolterfothii在春季浮游植物总量中占较大比例,是春季浮游植物的第一优势种,优势度高达0.46。刚毛根管藻Rhizosolenia setigera在春秋两季均作为优势种出现。(2) 近岸和温带内湾类群。这是调查海区种类最多的生态类群,如布氏双尾藻Ditylum brightwellii、尖刺伪菱形藻Pseudo-nitzschia pungens、浮动弯角藻Eucampia zodiacus等,该类群很多种类均作为优势种出现。(3) 暖水类群。该类群在秋季浮游植物群落中占有一定的地位,代表种类有劳氏角毛藻Chaetoceros lorenzianus、掌状冠盖藻Stephanopyxis palmeriana和中华盒形藻Biddulphia sinensis等,优势种类出现不多。(4) 半咸水类群。如长斜纹藻Pleurosigma elongatum、洛伦菱形藻Nitzchia lorenziana、波罗地海布纹藻Gyrosigma balticum等,春季这一类群的部分种类作为优势种出现。秋季半咸水种数量有所提高,但优势地位下降,对浮游植物群落的贡献下降(表1)。
2.2 浮游植物数量分布
春季,浮游植物细胞数量的平均密度为79.96×104 ind./m3,各站位细胞数量的平均密度为(14.70~184.32)×104 ind./m3。硅藻细胞数量的平均密度为78.32×104 ind./m3,占浮游植物数量的97.9%;甲藻的平均密度为1.64×104 ind./m3。浮游植物细胞数量在黄河入海口南侧和小清河、弥河口附近各有一个密集区,最高值位于1号站,细胞数量的平均密度高达184.32×104 ind./m3,其余各站的细胞数量多为(10~50)×104 ind./m3(图2)。
秋季,浮游植物细胞数量的平均密度为574.54 ×104 ind./m3,硅藻数量的平均密度为565.87×104 ind./m3,占浮游植物数量的平均密度为98.5%,甲藻平均密度为7.79×104 ind./m3,金藻平均密度为0.88×104 ind./m3,仅在1号站发现,出现频率仅为10%,为偶见种。浮游植物细胞数量分布差异明显,密集区位于广利河、小清河口和老黄河口南侧附近,低值区位于老弥河口,高值为低值的170余倍(图2)。
春季,优势种数量占浮游植物总量的65.8%~98.4%,秋季占66.7%~87.4%,控制着浮游植物数量的分布情况,硅藻在浮游植物群落的优势地位十分突出。
表1 莱州湾西部不同季节浮游植物的优势种
Tab.1 Dominant species of phytoplankton in the western Laizhou Bay at different seasons
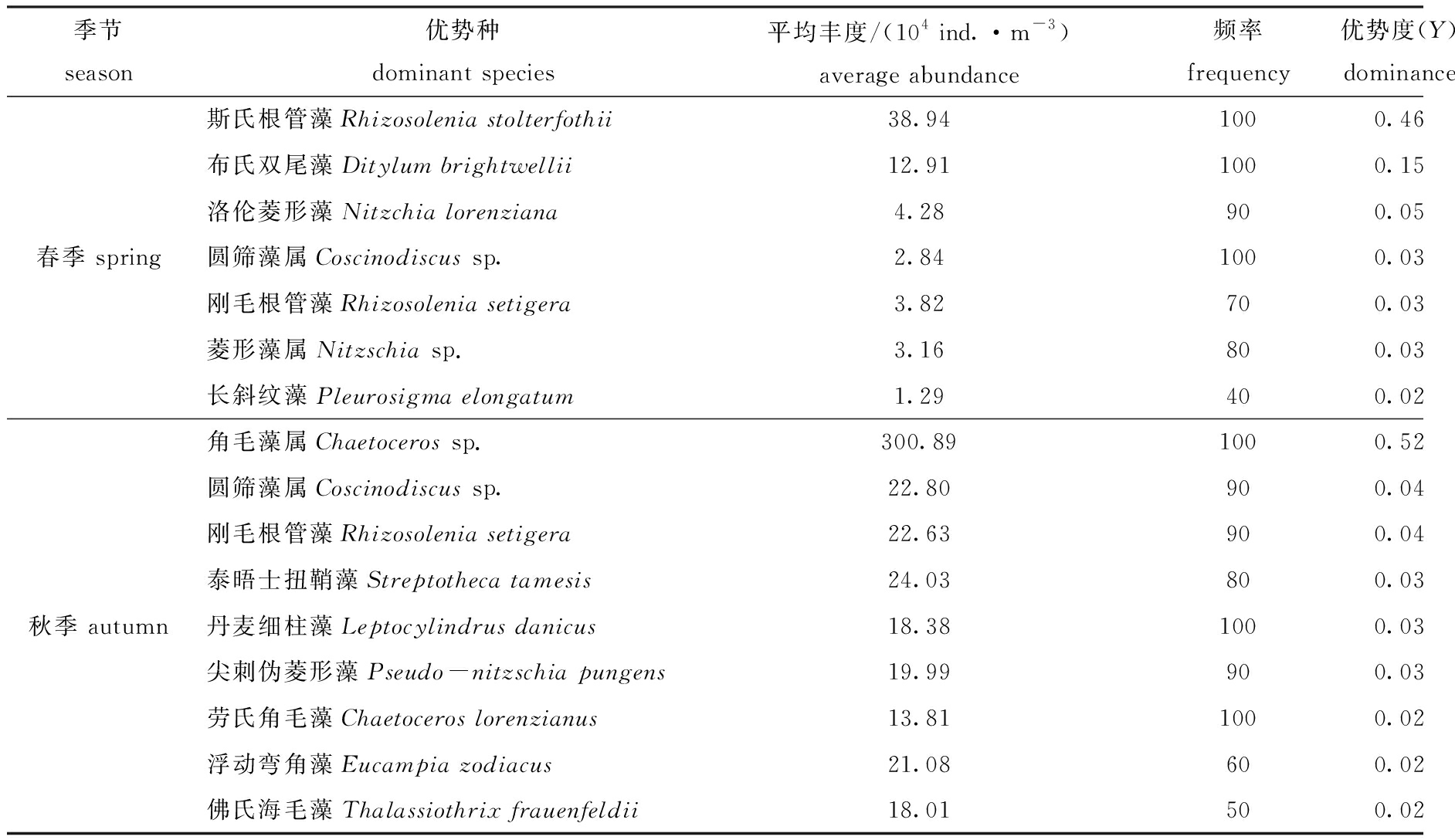
季节 season优势种 dominant species平均丰度/(104 ind.·m-3)average abundance频率 frequency优势度(Y)dominance斯氏根管藻Rhizosolenia stolterfothii38.941000.46布氏双尾藻Ditylum brightwellii12.911000.15洛伦菱形藻Nitzchia lorenziana4.28900.05春季 spring圆筛藻属Coscinodiscus sp.2.841000.03刚毛根管藻Rhizosolenia setigera3.82700.03菱形藻属Nitzschia sp.3.16800.03长斜纹藻Pleurosigma elongatum1.29400.02角毛藻属Chaetoceros sp.300.891000.52圆筛藻属Coscinodiscus sp.22.80900.04刚毛根管藻Rhizosolenia setigera22.63900.04泰晤士扭鞘藻Streptotheca tamesis24.03800.03秋季 autumn丹麦细柱藻Leptocylindrus danicus18.381000.03尖刺伪菱形藻Pseudo-nitzschia pungens19.99900.03劳氏角毛藻Chaetoceros lorenzianus13.811000.02浮动弯角藻Eucampia zodiacus21.08600.02佛氏海毛藻Thalassiothrix frauenfeldii18.01500.02
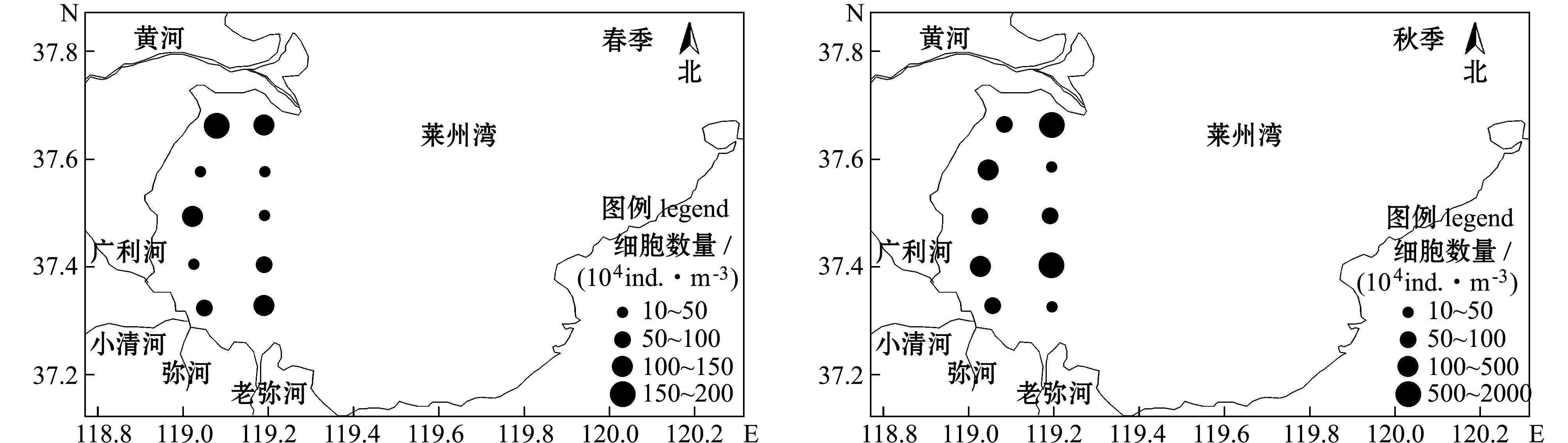
图2 莱州湾西部不同季节浮游植物细胞数量分布
Fig.2 Horizontal distribution of phytoplankton amount in the western Laizhou Bay at different seasons
2.3 浮游植物群落分析
Shannon-Wiener多样性指数和Pielou均匀度指数是反映生物群落种类组成和数量分配特点的指标。从表2可见:春季浮游植物种类较少,Shannon-Wiener多样性指数、Margalef丰富度指数和Pielou均匀度指数水平一般;秋季浮游植物种类增多,群落Shannon-Wiener多样性指数、Margalef丰富度指数和Pielou均匀度指数均有所提高。浮游植物细胞数量的密集区与多样性指数的低值区分布吻合,这与单一藻类优势过高有关。
2.4 浮游植物聚类分析结果
对浮游植物的聚类分析结果如图3所示。春季,浮游植物群落在60%的相似度上可分为3个组群:第一组群包括1~6号站、8号站,位于调查区北部和中部,SIMPER分析表明,该组群的特征种为斯氏根管藻、布氏双尾藻、洛伦菱形藻、刚毛根管藻,该组群种类组成以广温广盐性种为主,半咸水种类的细胞数量在这一组群中占有一定优势;第二组群包括小清河、老弥河口附近的9、10号站,特征种为斯氏根管藻,斯氏根管藻在这一组群中细胞数量占比90.22%,优势十分明显;第三组群为广利河口的7号站,该组群的特征种为斯氏根管藻、布氏双尾藻(图3)。聚类分析表明,莱州湾南岸河口附近的浮游植物群落明显有别于北部和中部区域,小清河、老弥河口与广利河口间也不相同。
表2 不同季节浮游植物群落指数
Tab.2 Community indices of phytoplankton at different seasons
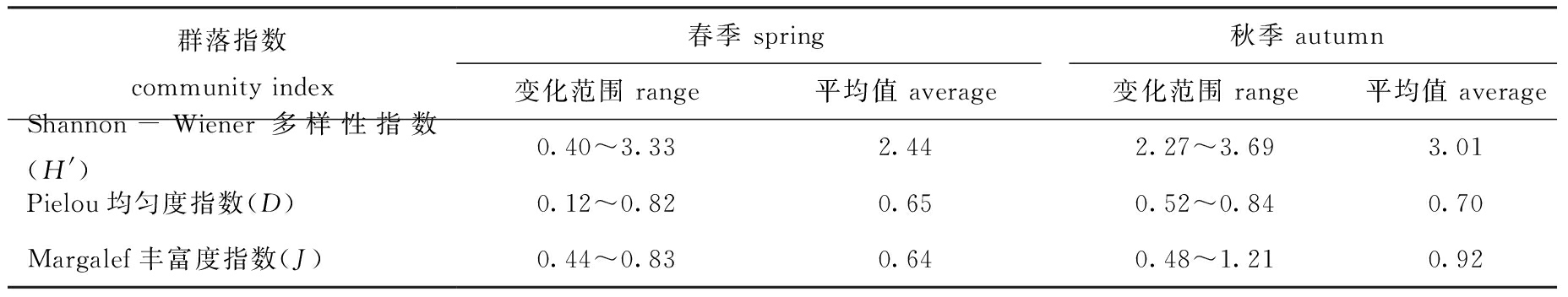
群落指数community index春季 spring秋季 autumn变化范围 range平均值 average变化范围 range平均值 averageShannon-Wiener多样性指数(H')0.40~3.332.442.27~3.693.01Pielou均匀度指数(D)0.12~0.820.650.52~0.840.70Margalef丰富度指数(J)0.44~0.830.640.48~1.210.92
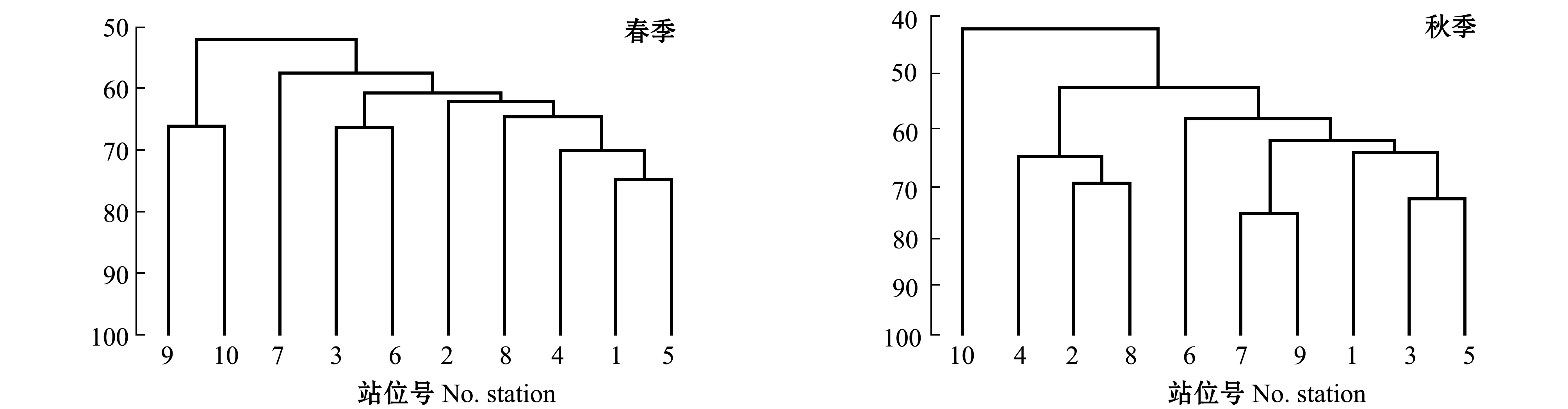
图3 不同站位浮游植物的聚类图
Fig.3 Cluster of phytoplankton abundance at different stations
秋季,浮游植物群落在60%的相似度上可分为4个组群:第一组群包括1、3、5、7、9号站,为莱州湾西部近岸水域,该组群特征种为角毛藻、浮动弯角藻、佛氏海毛藻和尖刺伪菱形藻等;第二组群位于调查区东侧的2、4、8号站,该组群特征种为角毛藻属、泰晤士扭鞘藻、刚毛根管藻、丹麦细柱藻和劳氏角毛藻;第三和第四组群分别为6号和10号站,该组群特征种为圆筛藻属、浮动弯角藻和角毛藻属;第四组群细胞数量少,群落结构单一,与其他组群有明显区别,特征种为角毛藻属(图3)。
2.5 浮游植物群落与环境因子的典范对应关系
对同步监测的资料(表3)进行典范对应分析(图4),结果表明:春季,前两个排序轴对物种变量的解释量达79.56%,解释物种与环境因子的关系。CODMn、活性磷酸盐、pH和N/P是影响浮游植物优势种分布的主要因素,斯氏根管藻数量分布与DO和N/P成正相关分布,与活性磷酸盐呈负相关关系。丰富的无机氮为斯氏根管藻的增殖提供了物质基础,该种数量分布控制着浮游植物的数量分布,受此影响,浮游植物细胞数量与N/P呈极显著正相关(r=0.721,P<0.01)。除斯氏根管藻和圆筛藻属外,洛伦菱形藻、刚毛根管藻等其余优势种与活性磷酸盐和pH的分布呈正相关。
秋季,前两个排序轴对物种变量的解释量达70.67%,N/P、温度、悬浮物和无机氮是影响浮游植物优势种分布的重要因素。浮游植物数量与环境因子相关性不显著,但部分优势种与环境因子的相关性显著,如泰晤士纽鞘藻与N/P呈极显著正相关(r=0.762,P<0.01),佛氏海毛藻、浮动弯角藻受温度的影响较明显,角毛藻属、丹麦细柱藻、圆筛藻属等与环境因子的相关不显著(P>0.05)。
表3 莱州湾西部水域环境参数
Tab.3 Environmental parameters in waters of the western Laizhou Bay
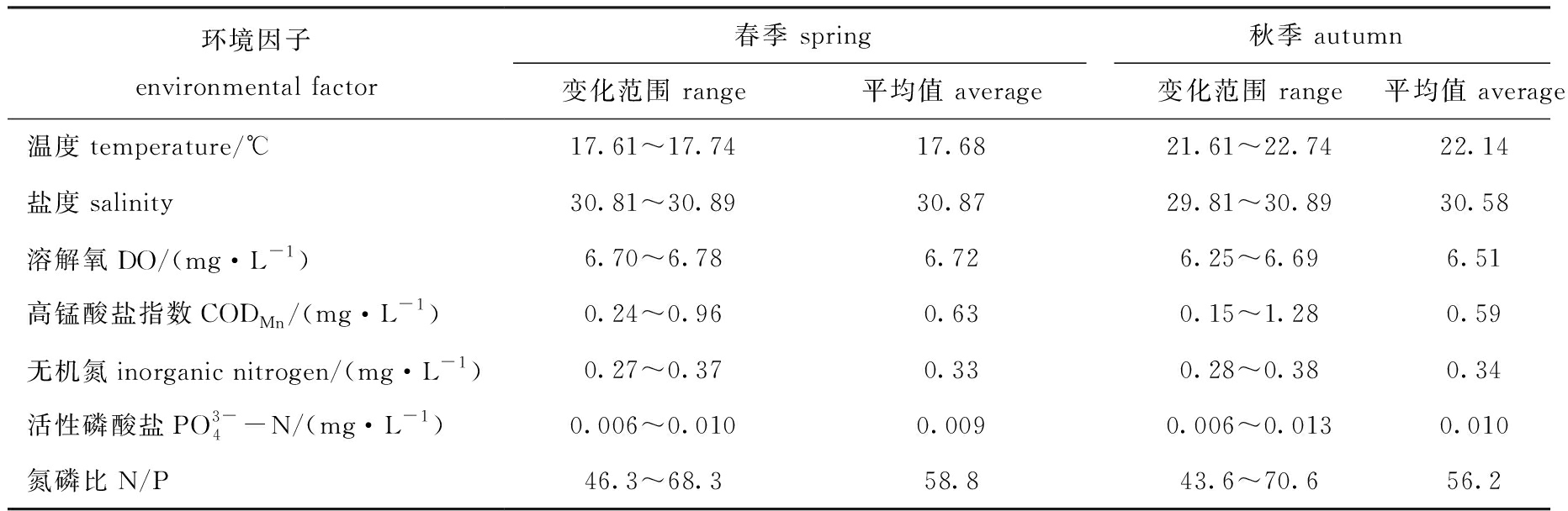
环境因子environmental factor春季 spring秋季 autumn变化范围 range平均值 average变化范围 range平均值 average温度temperature/℃17.61~17.7417.6821.61~22.7422.14盐度salinity30.81~30.8930.8729.81~30.8930.58溶解氧DO/(mg·L-1)6.70~6.786.726.25~6.696.51高锰酸盐指数CODMn/(mg·L-1)0.24~0.960.630.15~1.280.59无机氮inorganic nitrogen/(mg·L-1)0.27~0.370.330.28~0.380.34活性磷酸盐PO3-4-N/(mg·L-1)0.006~0.0100.0090.006~0.0130.010氮磷比N/P46.3~68.358.843.6~70.656.2
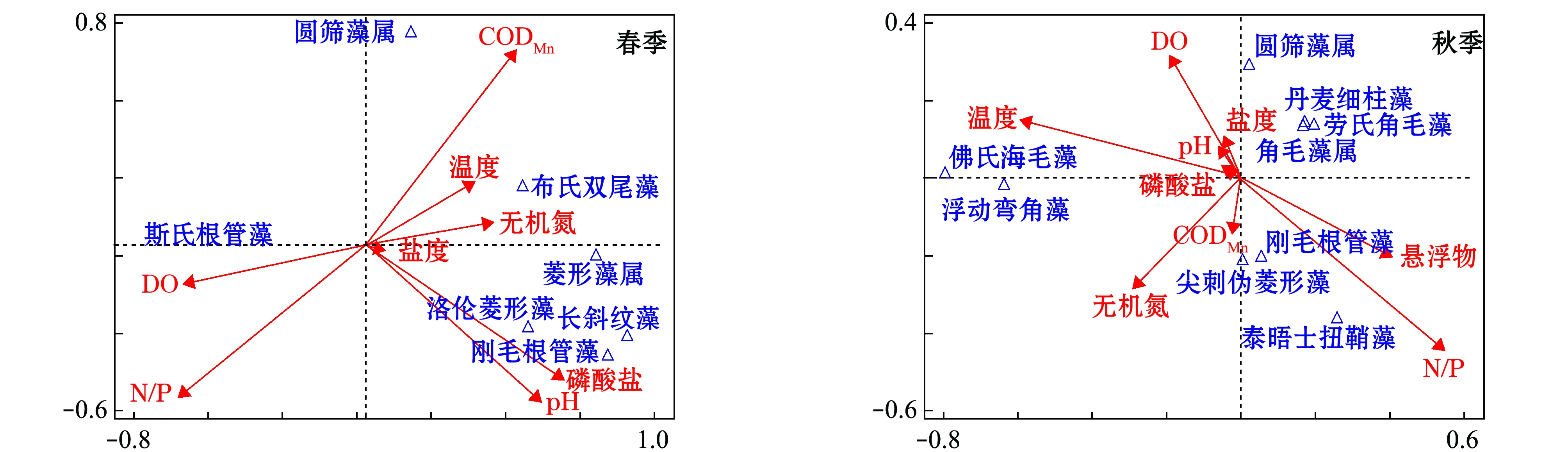
图4 浮游植物优势种数量与环境因子的典范对应分析
Fig.4 Canonical correspondence analysis of phytoplankton dominant species amount and environmental factors
3 讨论
3.1 浮游植物种群结构及变化
本调查与近几年对莱州湾海域的研究结果比较[11,13-14],莱州湾西部海域浮游植物的生态类型仍以广温广布性种和温带近岸种为主。春季斯氏根管藻属取代角毛藻属成为第一优势种,秋季角毛藻属优势地位未发生变化,圆筛藻属、刚毛根管藻等藻类优势地位上升,奇异菱形藻等优势地位下降,表明莱州湾西部水域浮游植物的群落结构与莱州湾其他水域存在差异,调查区域浮游植物群落的季节变化特征明显。莱州湾浮游植物的群落Shannon-Winener多样性指数、Pielou均匀度指数、Margalef丰富度指数均较历史同期资料高,浮游植物群落结构稳定。春季浮游植物数量与历年同期相比变化不大;秋季浮游植物细胞数量明显高于春季,与同期资料相比,符合莱州湾海域浮游植物数量分布规律。
3.2 影响浮游植物分布的环境因素
本次调查表明,莱州湾西部海域盐度略高于莱州湾海域盐度平均值,无机氮含量下降,小清河口附近站位的高锰酸盐指数、无机氮含量较高。环境因子季节差异较小,与历史同期资料相比变化不大[15-16]。根据小清河、广利河、弥河观测资料和黄河口同期环境监测资料[17-20],小清河、广利河和弥河监测断面无机氮超河流总氮劣五类标准,河流入海口主要污染物为无机氮和高锰酸盐指数,黄河入海口水质超河流总氮Ⅲ类标准,陆源污染物排放是河口污染的主要原因[21]。
浮游植物数量变化与水温、营养盐和光照等环境因子密切相关[22-23]。春季莱州湾水温低,黄河径流向南及东南方、湾底扩散[24-25],其所携营养盐成为影响浮游植物分布的主导因素,浮游植物群落的聚类分析也反映了这一情况。一些喜氮、磷的种类如斯氏根管藻和布氏双尾藻等大量繁殖,成为浮游植物群落的主要组成[26]。
秋季水温进一步升高,暖水种类数量增多,丰富的氮、磷为暖水种和广温性藻类的快速繁殖提供了物质基础,细胞数量达到了浮游植物的高值。在潮流和风的作用下,外海水以补偿形式进入莱州湾,在莱州湾西部形成顺时针环流[27]。调查水域外侧在海流作用下与莱州湾水体混合,受此影响,外侧各站位的浮游植物群落与莱州湾整体的浮游植物群落结构十分接近[13-14],而湾内西侧近岸水域水深较浅,水体呆滞[28],与莱州湾中东部主要水体交换不足导致近岸浮游植物群落的结构与莱州湾西部外侧各站有明显区别。
典范对应分析表明,N/P是影响莱州湾浮游植物数量的主要因素之一,N/P平均值高达50以上。Skjoldal[29]和Egge[30]的研究表明,高N/P下硅藻的生存竞争力下降,浮游植物硅藻群落加速向甲藻群落演替。国内学者也在对长江口[31]、珠江口[32]和南黄海海域[33]等的研究中发现,伴随着N/P的上升,甲藻赤潮频率升高和硅藻优势度出现降低。春季莱州湾内甲藻数量并不丰富,仅占浮游植物总数的2.1%,秋季下降至1.4%,未出现硅藻向甲藻更替的现象。根据林昱等[34]的围隔试验,在营养盐持续供给、水动力满足条件下,硅藻可以维持在较高的数量水平并阻碍甲藻形成优势。莱州湾氮、磷含量丰富,远高于浮游植物生长的阈值[35],磷或氮均未构成浮游植物生长繁殖的限制性因素,是硅藻数量占优势的原因之一。
莱州湾西部海域浮游植物群落结构反映出了调查时段莱州湾西部水域生态环境的变化特点,该海域N/P较高,具备甲藻赤潮爆发的物质基础,当海洋生态平衡打破时容易导致甲藻赤潮的发生。
4 结论
(1) 莱州湾西部海域共发现浮游植物64种,其中硅藻28属57种,甲藻 6种,金藻1种。生态类型以广温广盐类型和近岸、温带内湾类群为主。春季优势种为斯氏根管藻、布氏双尾藻等,秋季为角毛藻属和圆筛藻属等。春季浮游植物数量平均密度为79.96×104 ind./m3,秋季浮游植物数量为574.54 ×104 ind./m3。浮游植物均以硅藻为主要构成成分,优势种数量的分布控制着浮游植物数量的分布趋势。
(2) 春季浮游植物的多样性水平一般,秋季有所提高,浮游植物细胞数量的密集区也是多样性指数的低值区。
(3) 浮游植物群落的地域分布特征明显,春季浮游植物群落南北分化明显,河口附近的浮游植物群落有别于其他区域,N/P、pH、活性磷酸盐和高锰酸盐指数是影响浮游植物分布的主要环境因素。秋季受莱州湾环流的影响,浮游植物群落东西分化明显,N/P、温度、无机氮是影响浮游植物分布的主要环境因素。