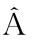南极磷虾Euphausia superba是一种似虾的无脊椎甲壳纲动物,通常是指南极大磷虾,其形体较小,体长一般为4~6 cm,生物储藏量巨大,据统计为3.4×108~5.4×108 t[1-2]。南极磷虾不仅蕴含丰富的蛋白质、矿质元素和多种不饱和脂肪酸,如EPA、DHA等,还含有多种活性成分,如酶类、甲壳素和虾青素等[3],这些物质有利于南极磷虾高附加值产品的开发,可极大地提高南极磷虾资源的综合利用率。南极磷虾中虾青素多为3R,3’R型,主要以酯化形式存在[4],由于中国存在大量的南极磷虾加工废弃物,故南极磷虾可作为提取虾青素的有效来源。虾青素是一种类胡萝卜素,易溶于丙酮、乙醇等有机溶剂,具有3种旋光异构体:3S,3’S、3R,3’R和3S,3’R,以及2种顺反异构体,即Z 型(顺式)异构体和 E 型(反式)异构体[5]。
虾青素具有多种生理学活性,包括抗氧化性、抗炎性、提高免疫力、预防心血管疾病和抗肿瘤等作用[6-10],因此,在食品饲料、医药、化妆品等行业具有重要作用。目前,从水产动物中提取虾青素的方法主要有有机溶剂法、超临界萃取法、酶解法,以及其他新技术辅助法,如超声波、超高压等[11-15]。酶解法可将与虾青素结合的蛋白质降解,易于虾青素的提取,相对于其他方法,具有反应条件温和、设备要求简便、用料少等优点。由于南极磷虾个体较小,且多数以“虾砖”的形式贮藏,因此,以南极磷虾为原料提取虾青素的关键是虾肉蛋白质的脱除技术。有文献报道,采用pH调节法对南极磷虾蛋白质分离时效率较低[16],目前,多采用酶解法(木瓜蛋白酶或Alcalase碱性蛋白酶)从水产动物中提取虾青素[17-18],主要是由于采用木瓜蛋白酶或Alcalase碱性蛋白酶酶解后,酶解产物中蛋白质和壳聚糖的回收率高[19-20],但采用2种酶复合酶解提取虾青素的试验还未见报道。本试验中,以冷冻南极磷虾为原料,经过复合酶解处理后用无水乙醇对南极磷虾中的虾青素进行提取,考察提取工艺参数对虾青素提取率的影响,并通过优化试验确定酶解的最优条件,旨在为南极磷虾的开发及利用加工提供基础。
1 材料与方法
1.1 材料
1.1.1 样品及药品 试验用冷冻南极磷虾由上海开创远洋渔业有限公司提供(2015年),-20 ℃下冷冻保存;木瓜蛋白酶(800 U/mg)、Alcalase碱性蛋白酶(Alcalase 2.4 L)、虾青素标准品(纯度≥98%),以及无水硫酸钠、氯化钠均购自广州市齐云生物技术有限公司(分析纯);无水乙醇、丙酮、石油醚均购自天津市富宇精细化工有限公司(分析纯)。
1.1.2 仪器与设备 JYL-C022E型料理机(山东九阳股份有限公司);GB204型电子天平(瑞士METTLER公司);SHZ-82A型水浴恒温振荡器(金坛市精达仪器制造有限公司);3K30型台式高速冷冻离心机(德国Sigma公司);MMV-1000W型振摇器(广州托普仪器有限公司);UV2550型紫外可见分光光度计(日本SHIMADZU公司)。
1.2 方法
1.2.1 南极磷虾基本成分及总类胡萝卜素含量测定 采用直接干燥法(GB/T 5009.3—2016)、高温煅烧法(GB/T 5009.4—2016)、微量凯氏定氮法(GB/T 5009.5—2010)和索氏抽提法(GB/T 5009.6—2010)分别测定水分、灰分、粗蛋白质和粗脂肪含量。
总类胡萝卜素含量的测定参照Niamnuy等[21]的方法略做修改。称取5 g左右冷冻南极磷虾样品,置于50 mL离心管中,加入20 mL丙酮均质后于4 ℃下以4000 r/min离心10 min,收集上清液,重复4次萃取至上清液基本无色,合并丙酮萃取液于分液漏斗中。向分液漏斗中加入等量的石油醚,充分摇动后加入100 mL浓度为1 g/L的氯化钠溶液,静置分层后弃去下相,加无水硫酸钠干燥后过滤,将滤液于40 ℃以下减压浓缩至干,即得南极磷虾类胡萝卜素提取物。将提取物复溶于50 mL无水乙醇中,采用紫外分光光度计法测定提取物中类胡萝卜素的含量。每个指标重复测定3次,取其平均值。
1.2.2 虾青素标准曲线的制作[15] 准确称取一定量的虾青素标准品,溶于乙醇配制成浓度为1~8 μg/mL的虾青素乙醇标准溶液,在400~600 nm波长范围内扫描最大吸收波长并测定各浓度吸光值并绘制标准曲线。
根据试验结果确定,虾青素在乙醇中的最大吸收波长为478 nm,标准曲线的一次回归方程为y=0.077x-0.0125,式中x为虾青素质量浓度(μg/mL),y为对应吸光值OD478 nm,线性回归相关系数R2=0.9991,说明虾青素质量浓度在1~8 μg/mL范围内具有线性关系。
1.2.3 南极磷虾虾青素复合酶法提取工艺 取冷冻南极磷虾用料理机搅碎后称取糊状湿虾样品5 g,按比例加入蒸馏水,升温至一定温度后,按比例加入Alcalase碱性蛋白酶和木瓜蛋白酶,恒温振荡水浴酶解后,冰水浴冷却,4 ℃下以10 000 r/min离心20 min,取离心沉淀物加入无水乙醇振荡提取后于4000 r/min离心5 min,收集上清液,重复操作2次,合并所得上清液,用无水乙醇定容后,再用紫外分光光度法测定虾青素含量。虾青素提取率计算公式为
虾青素提取率=ma/(c×mf)×100%。
其中:ma为测定条件下虾青素的提取量(μg);c为南极磷虾中总类胡萝卜素的含量(μg/g);mf为南极磷虾湿质量(g)。
1.2.4 复合酶法提取南极磷虾虾青素的单因素试验 由于虾青素在酸碱环境中均不稳定[22],因此,单因素试验均在自然pH条件(pH 7.1)下进行。以下单因素确定试验中,每组试验均设3个平行,除要考察的因素重新设定外,其他因素均设定一致,即酶底比为0.5%,水料比(mL∶g)为2∶1、酶解时间为2 h,酶解温度为55 ℃,无水乙醇料液比(g∶mL)为1∶5,振荡时间为5 min,Alcalase碱性蛋白酶与木瓜蛋白酶比例为3∶2。
(1) 复合酶比例的确定。在其他因素不变的条件下,分别考察Alcalase碱性蛋白酶与木瓜蛋白酶单一添加,以及二者的比例为4∶1、3∶2、1∶1、2∶3、1∶4时对虾青素提取率的影响。
(2) 酶底比的确定。在其他因素不变的条件下,考察酶底比为0.5%、1.0%、1.5%、2.0%、2.5%、3.0%时对虾青素提取率的影响。
(3) 水料比的确定。在其他因素不变的条件下,考察水料比(mL∶g)为2∶1、3∶1、4∶1、5∶1、6∶1、7∶1时对虾青素提取率的影响。
(4) 酶解时间的确定。在其他因素不变的条件下,考察酶解时间为1、2、3、4、5、6 h时对虾青素提取率的影响。
(5) 酶解温度的确定。在其他因素不变的条件下,考察酶解温度为35、40、45、50、55、60 ℃时对虾青素提取率的影响。
(6) 无水乙醇料液比的确定。在其他因素不变的条件下,考察无水乙醇料液比(g∶mL)为1∶2、1∶3、1∶4、1∶5、1∶6、1∶7时对虾青素提取率的影响。
(7) 振荡时间的确定。在其他因素不变的条件下,考察振荡时间为5、10、15、20、25、30 min时对虾青素提取率的影响。
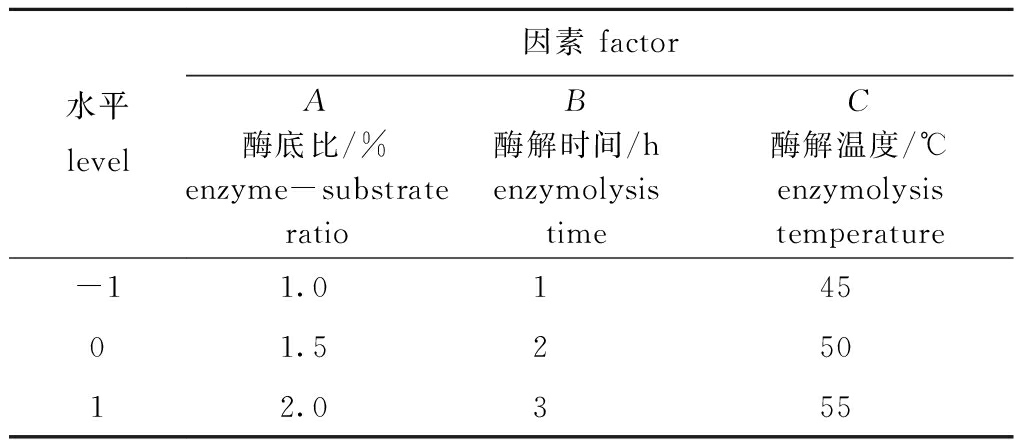
1.2.5 响应面优化试验设计 综合各单因素试验结果,根据Box-Behnken中心组合设计原理,选择对虾青素提取效果有显著影响的3个因素:酶底比(A)、酶解时间(B)、酶解温度(C)为自变量,以虾青素提取率(Y)为响应值,利用Design-Expert 8.0.6软件进行3因素3水平的响应面试验优化,试验因素和水平设置见表1。
表1 响应面试验因素水平
Tab.1 Factors and levels of response surface methodology in the experiment
水平level因素 factorA酶底比/%enzyme-substrate ratioB酶解时间/henzymolysis timeC酶解温度/℃enzymolysis temperature-11.014501.525012.0355
1.3 数据处理
采用Excel 2007软件处理试验数据,用SPSS 20.0、Design-Expert 8.0.6.1软件进行数据处理与分析,并采用Duncan新复极差法对虾青素提取率进行多重比较。
2 结果与分析
2.1 南极磷虾基本成分含量及总类胡萝卜素含量
经测定,南极磷虾基本营养成分(以湿质量计)分别为水分79.81%±0.08%、灰分3.06%±0.01%、粗蛋白质12.31%±0.13%、粗脂肪3.41%±0.13%,总类胡萝卜素含量为(69.59±3.72)μg/g湿质量。各成分含量与宋翔[23]报道的结果差别不大。其中粗脂肪含量略高,粗蛋白质含量略低,这是由于南极磷虾的生长容易受时间和地域的影响,不同季节南极磷虾体内脂肪和蛋白质含量往往不同,且两者呈显著负相关关系[24]。
2.2 复合酶法提取南极磷虾虾青素单因素试验结果
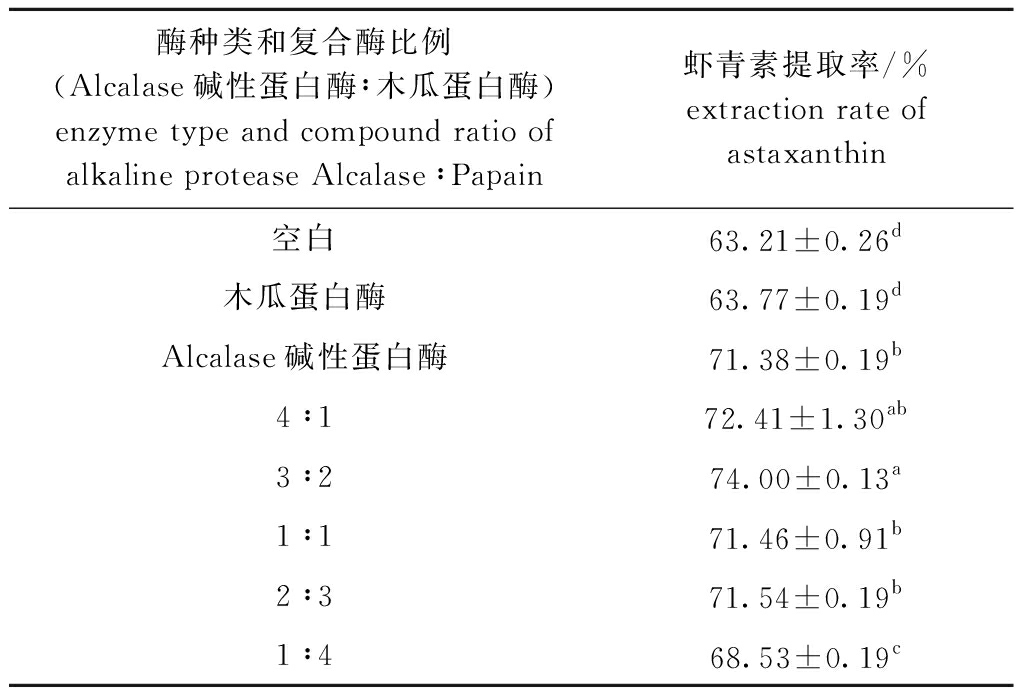
2.2.1 酶种类和复合酶比例对虾青素提取率的影响 从表2可见:与空白组相比,分别使用Alcalase碱性蛋白酶和木瓜蛋白酶对南极磷虾进行酶解处理后,均可提高虾青素的提取率,但用木瓜蛋白酶提取时对虾青素的提取率较对照组无显著性差异(P>0.05),而用Alcalase碱性蛋白酶提取时虾青素提取率显著高于对照组(P<0.05),说明Alcalase碱性蛋白酶的酶解效果优于木瓜蛋白酶;进一步进行复合酶酶解试验发现,加酶量一定时,虾青素提取率在Alcalase碱性蛋白酶与木瓜蛋白酶比例为3∶2时达到最大且显著高于该两种酶单独作用的结果(P<0.05),这可能是由于一定比例的两种酶复合具有协同酶解的作用,从而提高了酶解效果。因此,后续试验均以Alcalase碱性蛋白酶与木瓜蛋白酶比例为3∶2进行。
表2 不同酶种类和复合比例下虾青素提取率
Tab.2 Extraction rate of astaxanthi nunder different enzyme types and compound ratio
酶种类和复合酶比例(Alcalase碱性蛋白酶∶木瓜蛋白酶)enzyme type and compound ratio ofalkaline protease Alcalase∶Papain虾青素提取率/%extraction rate of astaxanthin空白63.21±0.26d木瓜蛋白酶63.77±0.19dAlcalase碱性蛋白酶71.38±0.19b4∶172.41±1.30ab3∶274.00±0.13a1∶171.46±0.91b2∶371.54±0.19b1∶468.53±0.19c
注:同列中标有不同小写字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05)
Note:The means with different letters within the same column are significant differences at the 0.05 probability level, and the means with the same letters within the same column are not significant differences
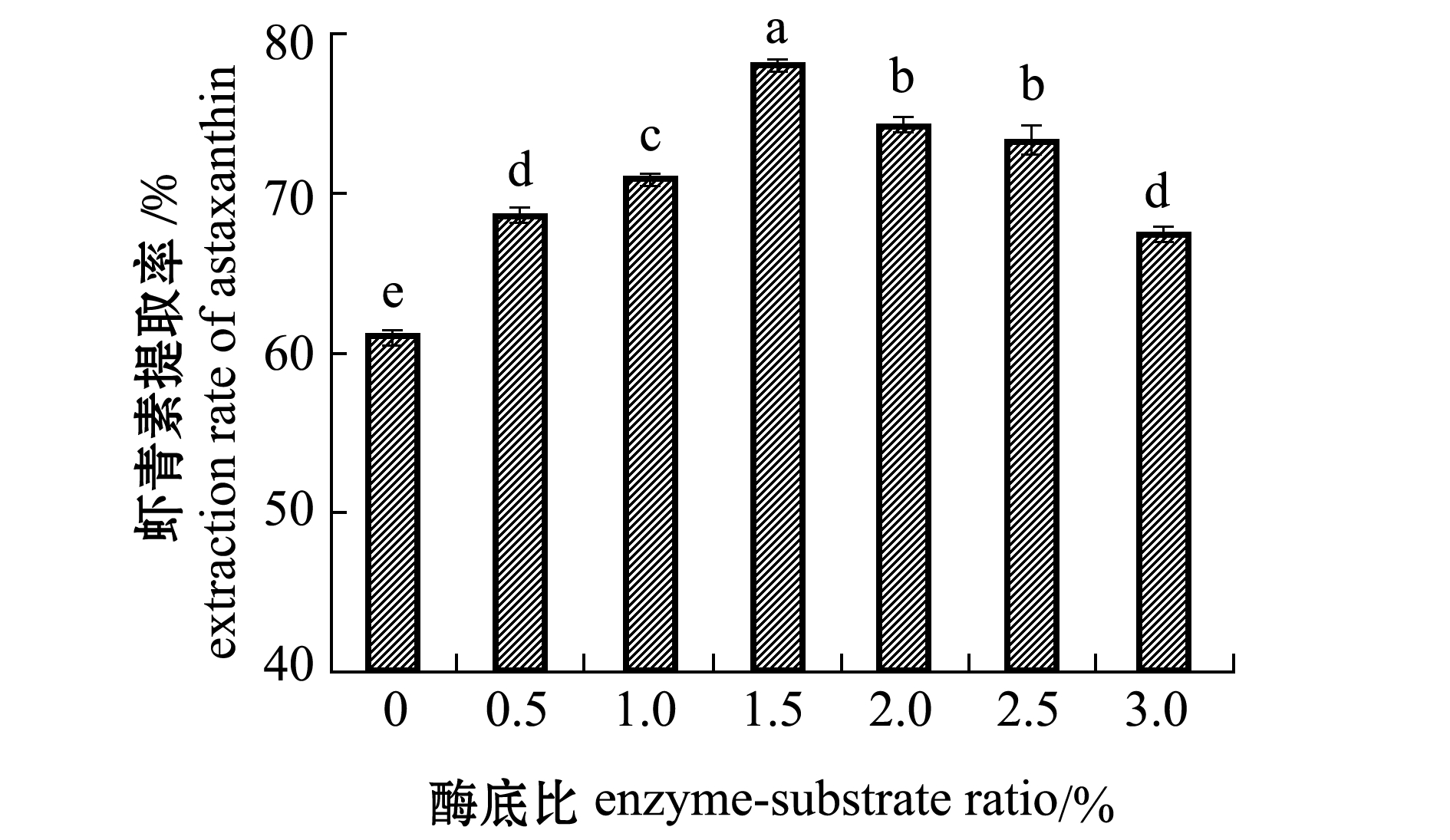
2.2.2 酶底比对虾青素提取率的影响 从图1可见:不同酶底比对虾青素提取率影响较大,南极磷虾虾青素提取率随酶底比的增大呈现先上升后缓慢下降的趋势;当酶底比为1.5%时,虾青素提取率达到最高且显著高于其他各组(P<0.05),继续增加酶底比时,虾青素提取率显著下降(P<0.05)。这可能是由于当底物浓度一定时,随着酶用量的增加,酶解反应速度加快,虾青素提取率呈明显上升趋势;而当酶用量超出了一定范围后,由于酶的竞争性抑制作用特点,加大酶底比反而会抑制酶解作用[25],从而导致虾青素提取率下降。因此,使用1.5%的酶底比为较适添加量。
注:标有不同小写字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同
Note:The means with different letters are significant differences at the 0.05 probability level, and the means with the same letters are not significant differences, et sequentia
图1 酶底比对虾青素提取率的影响
Fig.1 Effect of enzyme-substrate ratio on the extraction rate of astaxanthin
2.2.3 水料比对虾青素提取率的影响 从图2可见:南极磷虾虾青素提取率随水料比的增大呈现先上升后下降的趋势;当水料比(mL∶g)为4∶1时,虾青素提取率达到最高,当水料比(mL∶g)为4∶1、5∶1、6∶1时,虾青素提取率之间无显著性差异(P>0.05),但继续增大水料比,虾青素提取率显著降低(P<0.05)。这是因为当水料比太小时,样品流动性较差,酶解作用时复合酶与样品不能充分接触,从而使反应不易进行,但当水料比过大时,虽然样品流动性更好,但复合酶和底物的浓度都下降,从而使酶解效果减弱。因此,选择水料比(mL∶g)为4∶1时为较适工艺参数。
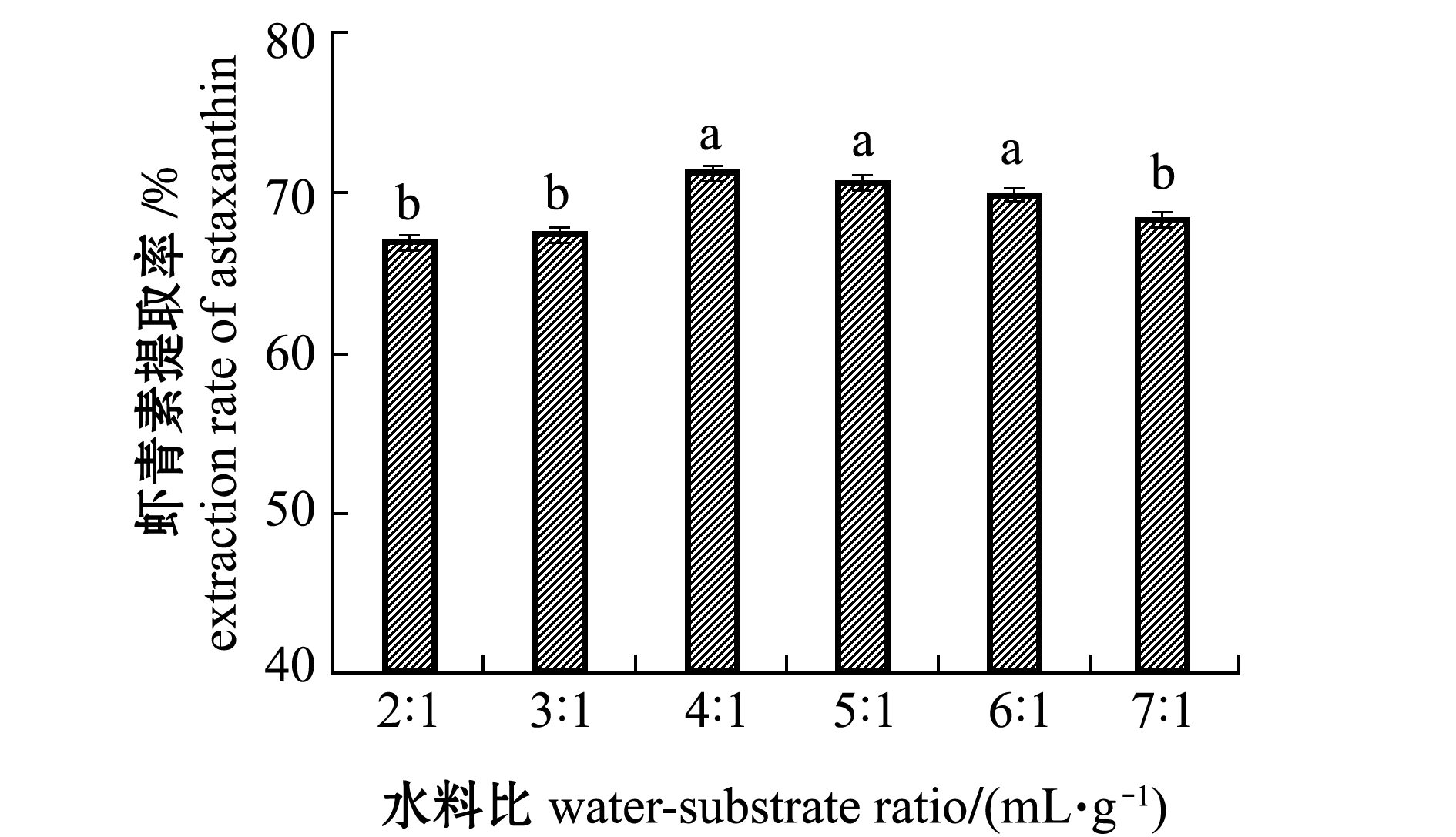
图2 水料比对虾青素提取率的影响
Fig.2 Effect of water-substrate ratio on the extraction rate of astaxanthin
2.2.4 酶解时间对虾青素提取率的影响 从图3可知见:虾青素提取率随酶解时间的延长呈现先上升后下降的趋势;当酶解时间为1、3、4、5 h时,虾青素提取率间无显著性差异(P>0.05),当酶解时间为2 h时,虾青素提取率显著提升至最高(P<0.05),当酶解时间为6 h时,虾青素提取率降低至最低(P<0.05)。这种变化趋势可能是由于在一定的时间范围内,酶解时间越长,酶解反应越完全;超出一定范围后,酶解时间的延长反而会抑制酶活力的发挥,加上虾青素在提取液中不稳定而引起分解,从而导致了虾青素提取率下降。因此,选择酶解时间为2 h较佳。
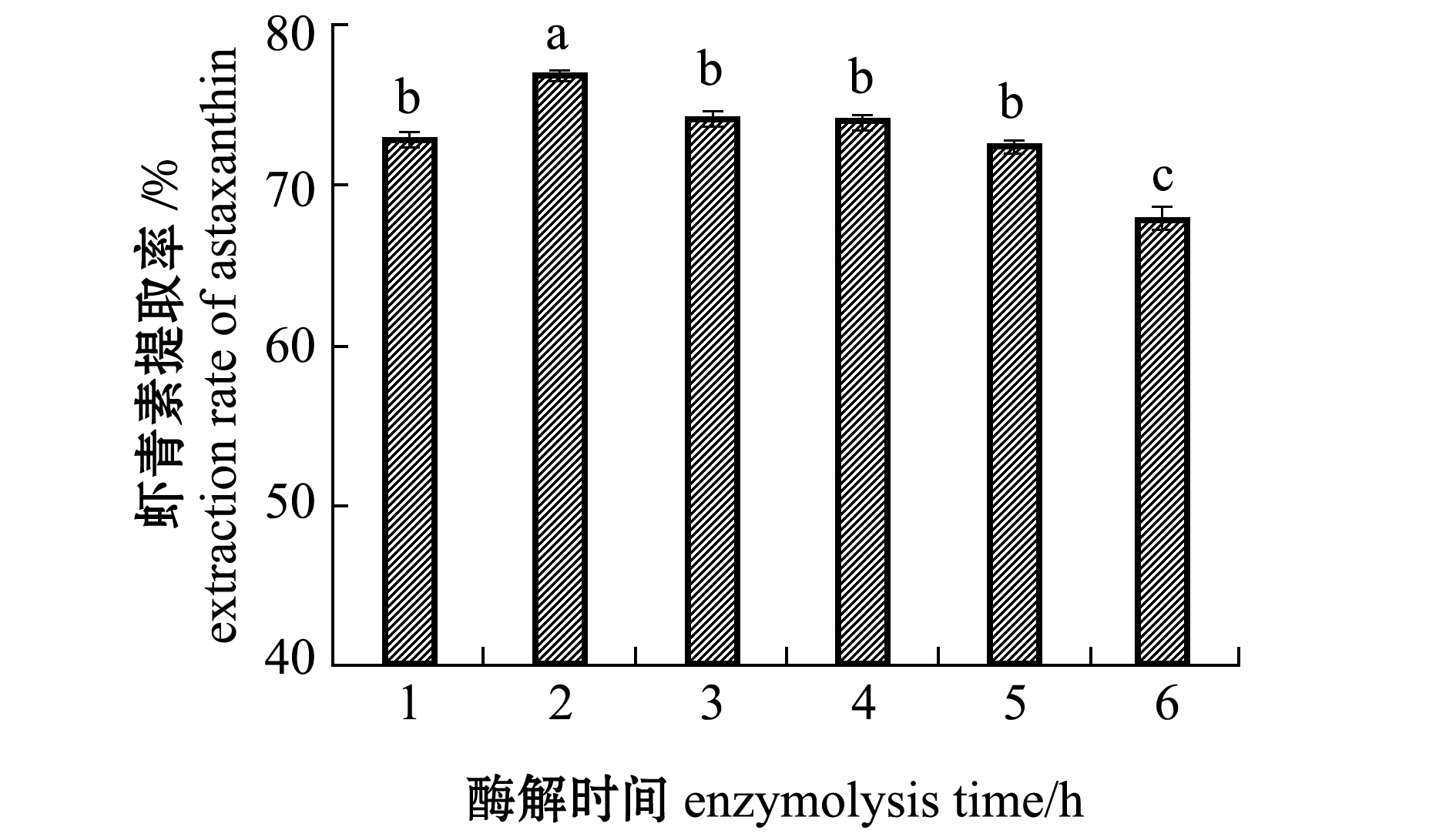
图3 酶解时间对虾青素提取率的影响
Fig.3 Effect of enzymolysis time on the extraction rate of astaxanthin
2.2.5 酶解温度对虾青素提取率的影响 不同酶解温度对虾青素提取率的影响较大,Vieira等[26]关于利用蛋白酶水解虾废物生产具有清除自由基活性的肽和回收总类胡萝卜素的研究中也表示,温度对不溶性部分中总类胡萝卜素的回收有显著影响。从图4可见,虾青素提取率随酶解温度的升高呈先升高后下降的趋势,并在50 ℃时达到最高。这是由于在一定温度范围内,随着温度的升高酶活性增强,酶解效果好,虾青素提取率也随之增高;但超过50 ℃后,高温会使酶变性失活,导致酶解作用减弱,因此,选择酶解温度为50 ℃左右较好。
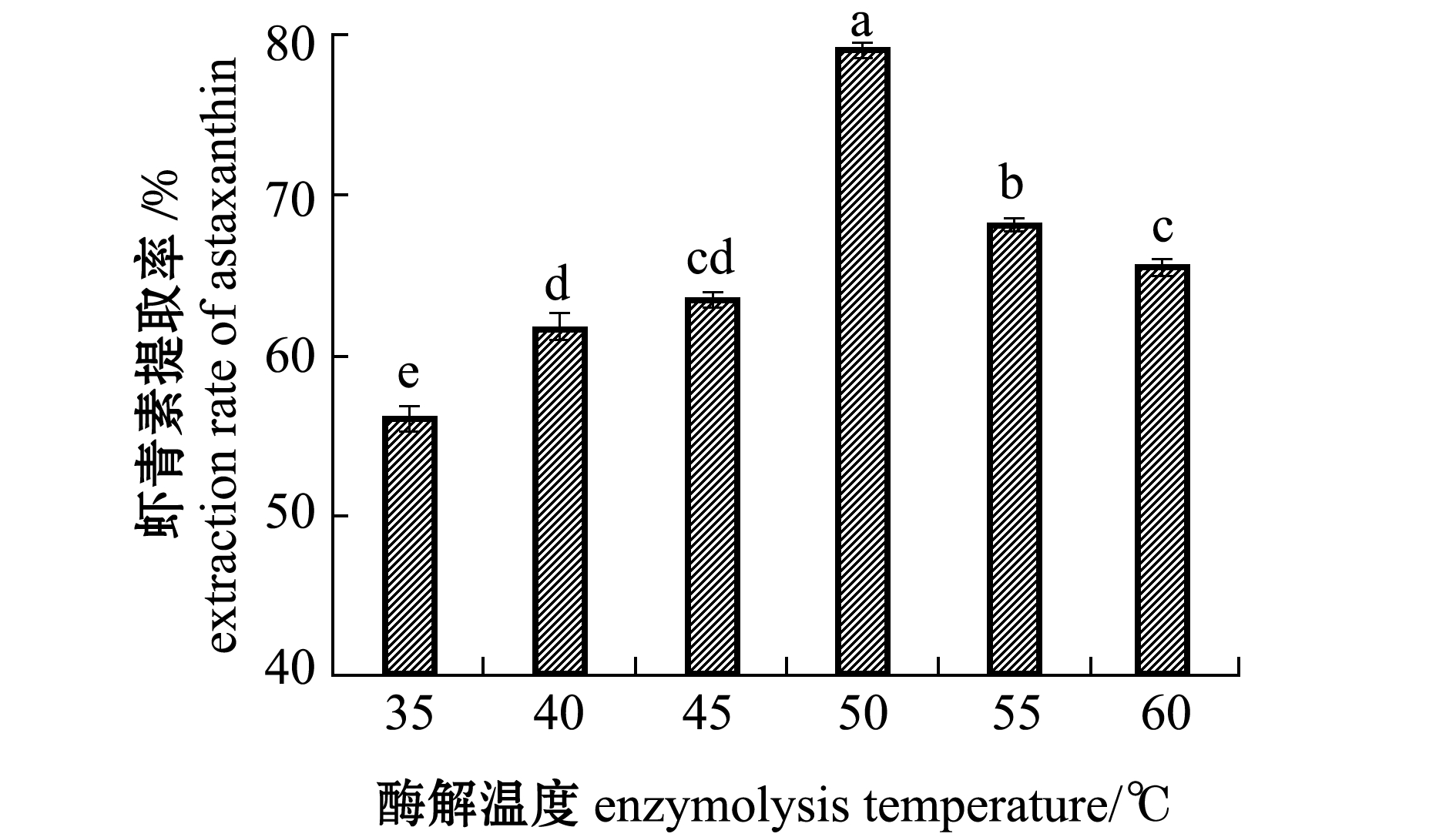
图4 酶解温度对虾青素提取率的影响
Fig.4 Effect of enzymolysis temperature on the extraction rate of astaxanthin
2.2.6 料液比对虾青素提取率的影响 从图5可见:虾青素提取率随提取剂用量的增加呈现先上升后趋于平缓的趋势,可能是由于在一定范围内随着提取剂的增加,虾青素溶解越来越充分;虾青素提取率在料液比(g∶mL)为1∶7时达到最高,为72.56%±1.17%,但与料液比(g∶mL)为1∶4、1∶5、1∶6时相比,虾青素提取率无显著性差异(P>0.05),此结果与宋素梅[27]分析料液比对虾青素提取效果的结果基本一致。据此,从经济实际出发,选择料液比(g∶mL)1∶4为适宜工艺参数。
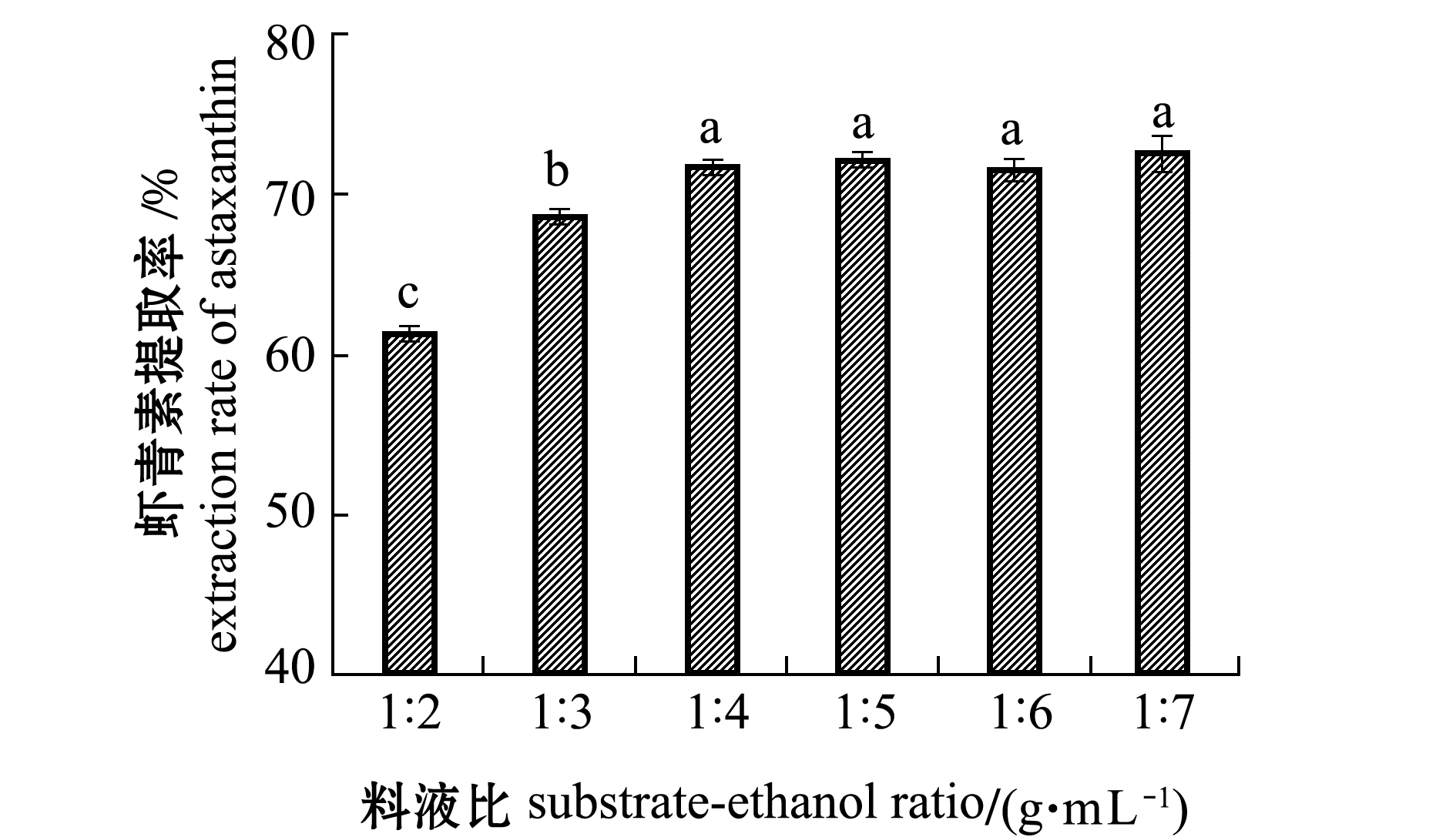
图5 料液比对虾青素提取率的影响
Fig.5 Effect of substrate-ethanol ratio on the extraction rate of astaxanthin
2.2.7 振荡时间对虾青素提取率的影响 采用机械震荡提取,可有效促进提取物质与提取剂的充分接触,大大缩短提取时间,且不需要进行加热[28]。从图6可见:虾青素提取率随振荡时间的延长呈现先上升后下降的趋势;当振荡时间为10、15、20、25 min时,虾青素提取率无显著性差异(P>0.05),当振荡时间延长至30 min时,虾青素提取率较10、20 min时显著降低(P<0.05)。可能是由于时间过短时,提取剂与样品接触不充分,虾青素不能充分溶解在提取剂中,但时间过长时,虾青素易降解导致提取效果降低。因此,选择振荡时间为10 min较佳。
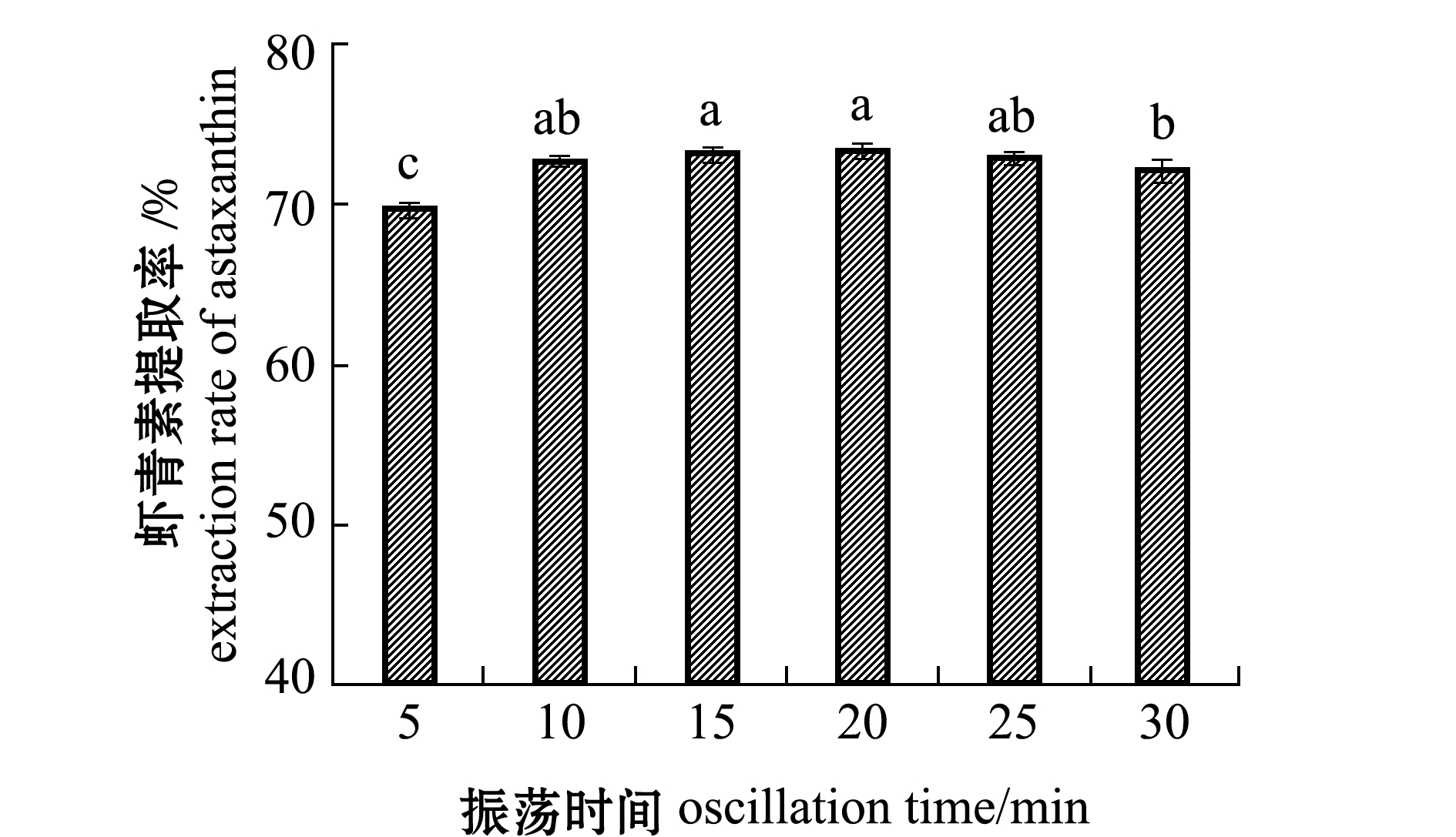
图6 振荡时间对虾青素提取率的影响
Fig.6 Effect of oscillation time on the extraction rate of astaxanthin
2.3 响应面优化试验结果
2.3.1 模型建立及方差分析 由单因素试验可知,不同因素对虾青素提取率影响程度不同,根据单因素试验结果,选择出影响较大的3个因素:酶底比(A)、酶解时间(B)、酶解温度(C),作为自变量,并固定水料比(mL∶g)为4∶1、料液比(g∶mL)为1∶4、振荡时间10 min,以虾青素提取率为响应值,自变量因素和水平设置如表1所示,根据Box-Behnken试验设计方案进行试验,各因素的试验组合及试验结果见表3。
表3 响应面设计方案与试验结果
Tab.3 Experimental design and results for response surface analysis
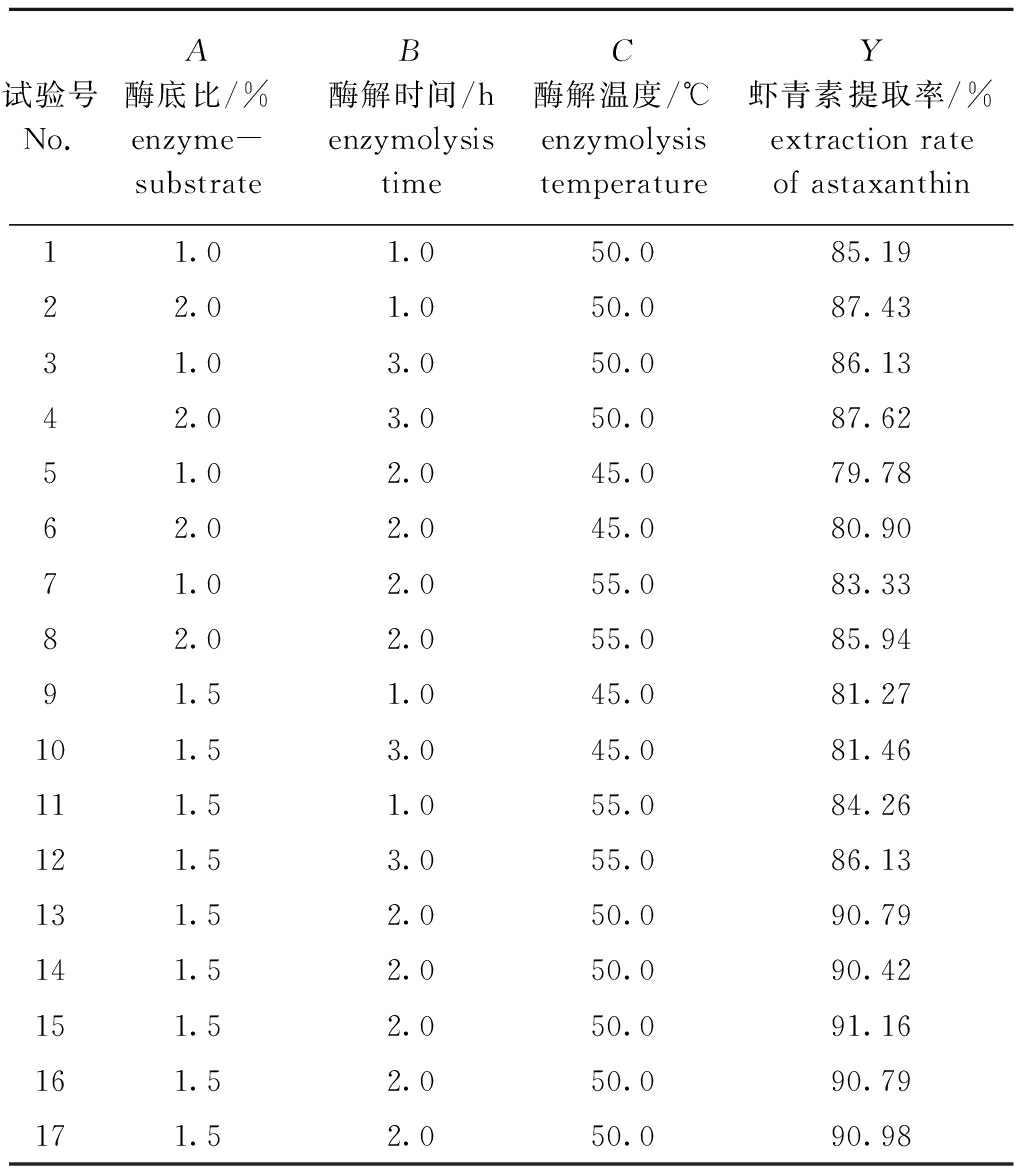
试验号No.A酶底比/%enzyme-substrateB酶解时间/henzymolysistimeC酶解温度/℃enzymolysistemperatureY虾青素提取率/%extraction rate of astaxanthin11.01.050.085.1922.01.050.087.4331.03.050.086.1342.03.050.087.6251.02.045.079.7862.02.045.080.9071.02.055.083.3382.02.055.085.9491.51.045.081.27101.53.045.081.46111.51.055.084.26121.53.055.086.13131.52.050.090.79141.52.050.090.42151.52.050.091.16161.52.050.090.79171.52.050.090.98
经多元回归拟合,得到虾青素提取率的二次多项回归方程为Y=90.83+0.93A+0.40B+2.03C-0.19AB+0.37AC+0.42BC-2.51A2-1.72B2-5.83C2。
对表3中所得试验结果进行方差分析,结果见表4。由表4方差分析可知,模型极显著(P<0.0001),失拟项不显著(P=0.4981>0.05),说明该模型与实际拟合程度好![]() 说明该模型拟合程度良好,试验误差小,能够反映响应值的变化,对优化虾青素的提取工艺有实际应用意义。同时可知,在此试验设计中, A、B、C、A2、B2、C2项均为极显著(P<0.01),且各因素对虾青素提取率的影响程度依次为:C>A>B,即酶解温度>酶底比>酶解时间;交互项AC、BC项显著(P<0.05),AB项不显著(P>0.05),表明酶底比与酶解温度、酶解时间与酶解温度对虾青素提取率有交互影响作用。
说明该模型拟合程度良好,试验误差小,能够反映响应值的变化,对优化虾青素的提取工艺有实际应用意义。同时可知,在此试验设计中, A、B、C、A2、B2、C2项均为极显著(P<0.01),且各因素对虾青素提取率的影响程度依次为:C>A>B,即酶解温度>酶底比>酶解时间;交互项AC、BC项显著(P<0.05),AB项不显著(P>0.05),表明酶底比与酶解温度、酶解时间与酶解温度对虾青素提取率有交互影响作用。
2.3.2 响应面交互作用分析与优化结果的确定 响应面是响应值对各试验因素所构成的三维空间曲面图,因素对响应值影响越大,曲面坡度越大。而等高线的形状则可以反映两两因素间交互作用的显著程度。椭圆形表示两因素交互作用显著,近似圆形则表明交互项的影响不显著[29]。各因素交互作用对虾青素提取率的影响如图7~图9所示,可以看出,酶解温度对虾青素提取率的影响最大,其次为酶底比和酶解时间;酶底比与酶解时间交互作用对虾青素提取率影响不显著(P>0.05),酶底比与酶解温度、酶解时间与酶解温度交互作用对虾青素提取率影响显著(P<0.05),且酶解时间与酶解温度的交互作用影响大于酶底比与酶解温度的交互作用,与方差分析结果一致。
通过响应面软件分析,得出复合酶解南极磷虾提取虾青素的最优工艺条件:A=1.60,B=2.13,C=50.93,即酶底比为1.60%、酶解时间为2.13 h、酶解温度为50.93 ℃、水料比(mL∶g)为4∶1、料液比(g∶mL)为1∶4、振荡时间为10 min,在此条件下,虾青素提取率的理论值为91.13%。
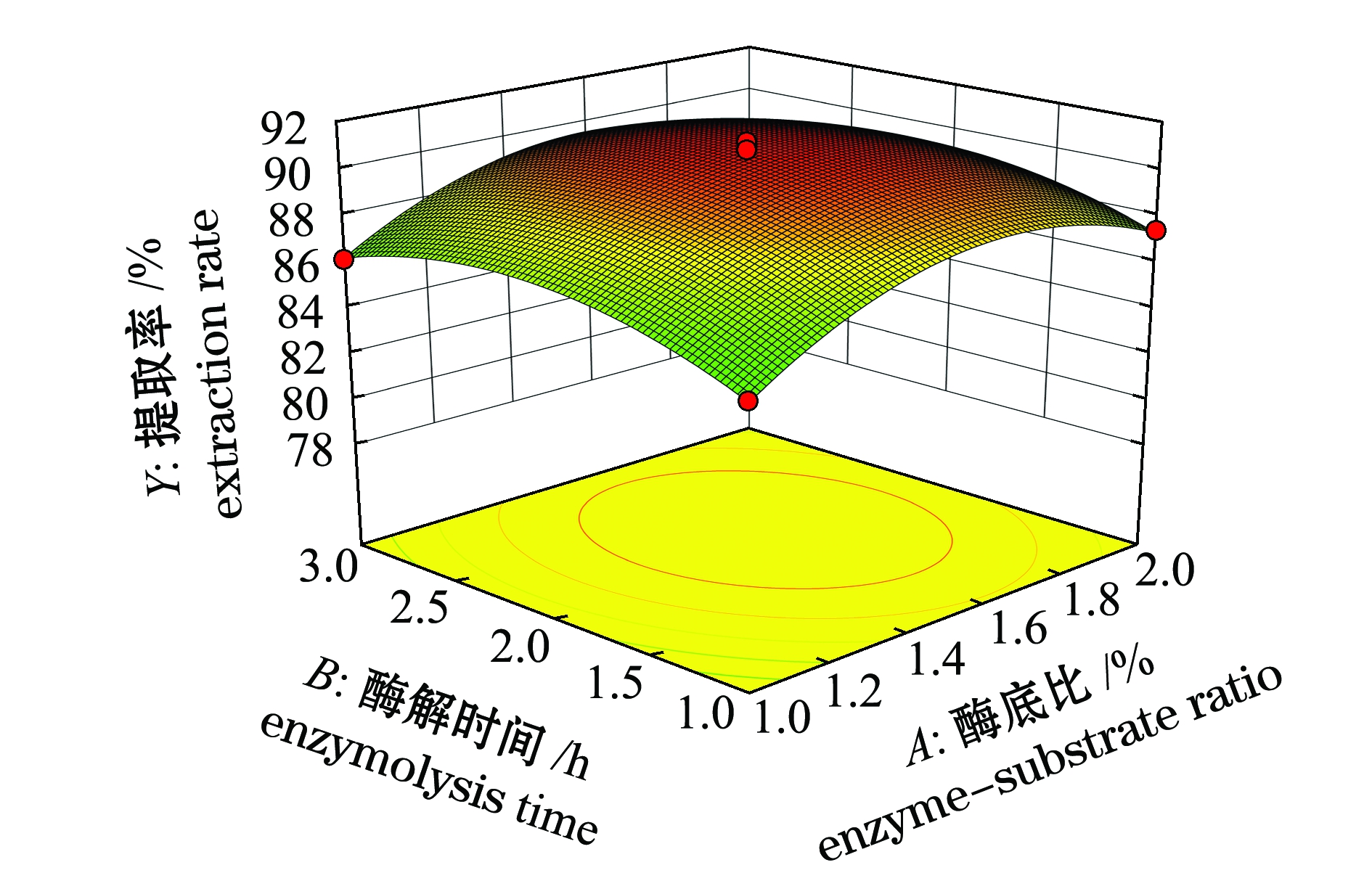
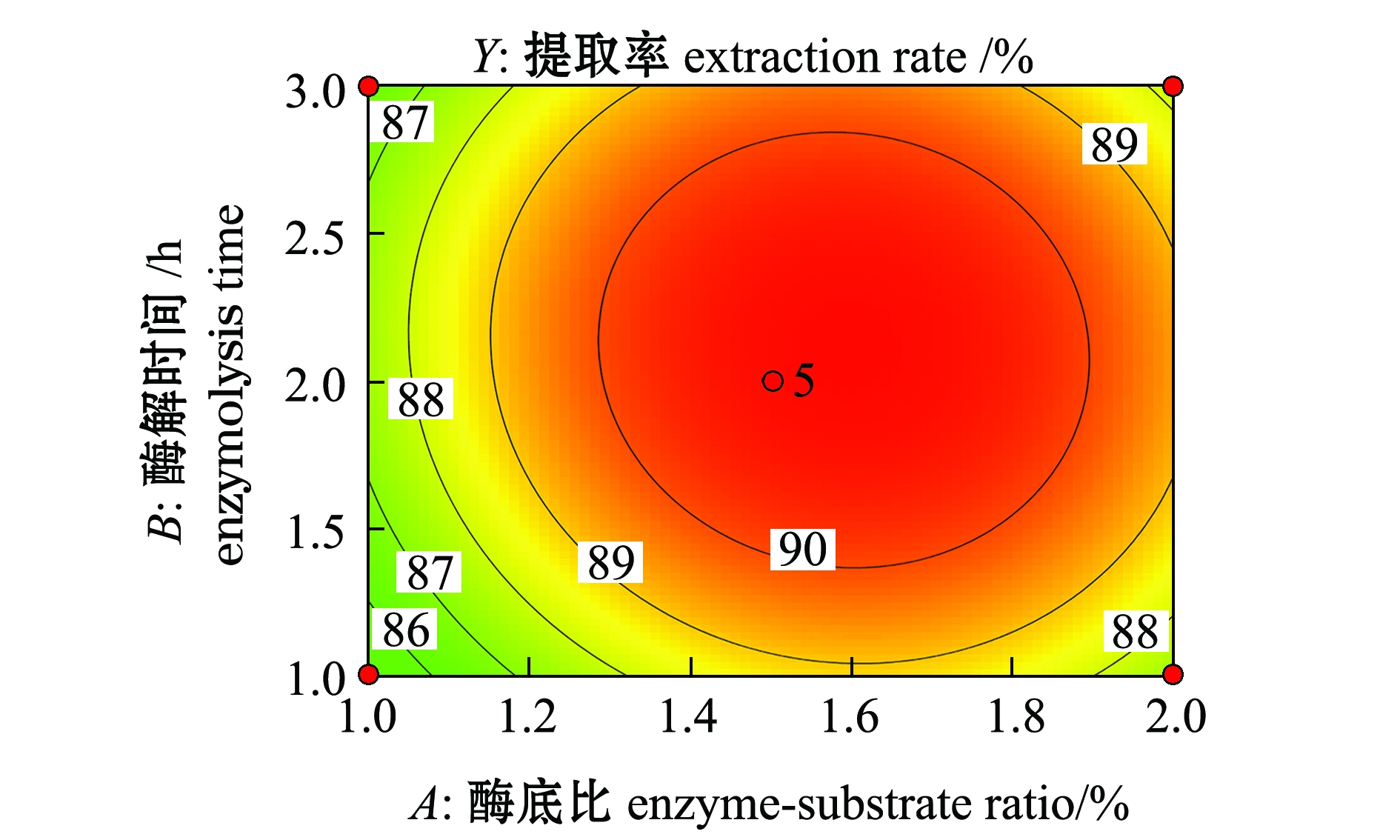
图7 酶底比与酶解时间交互作用对虾青素提取率影响的响应面与等高线图
Fig.7 Response surface and contour plots of the interactive effect of enzyme-substrate ratio and enzymolysis time on the extraction rate of astaxanthin
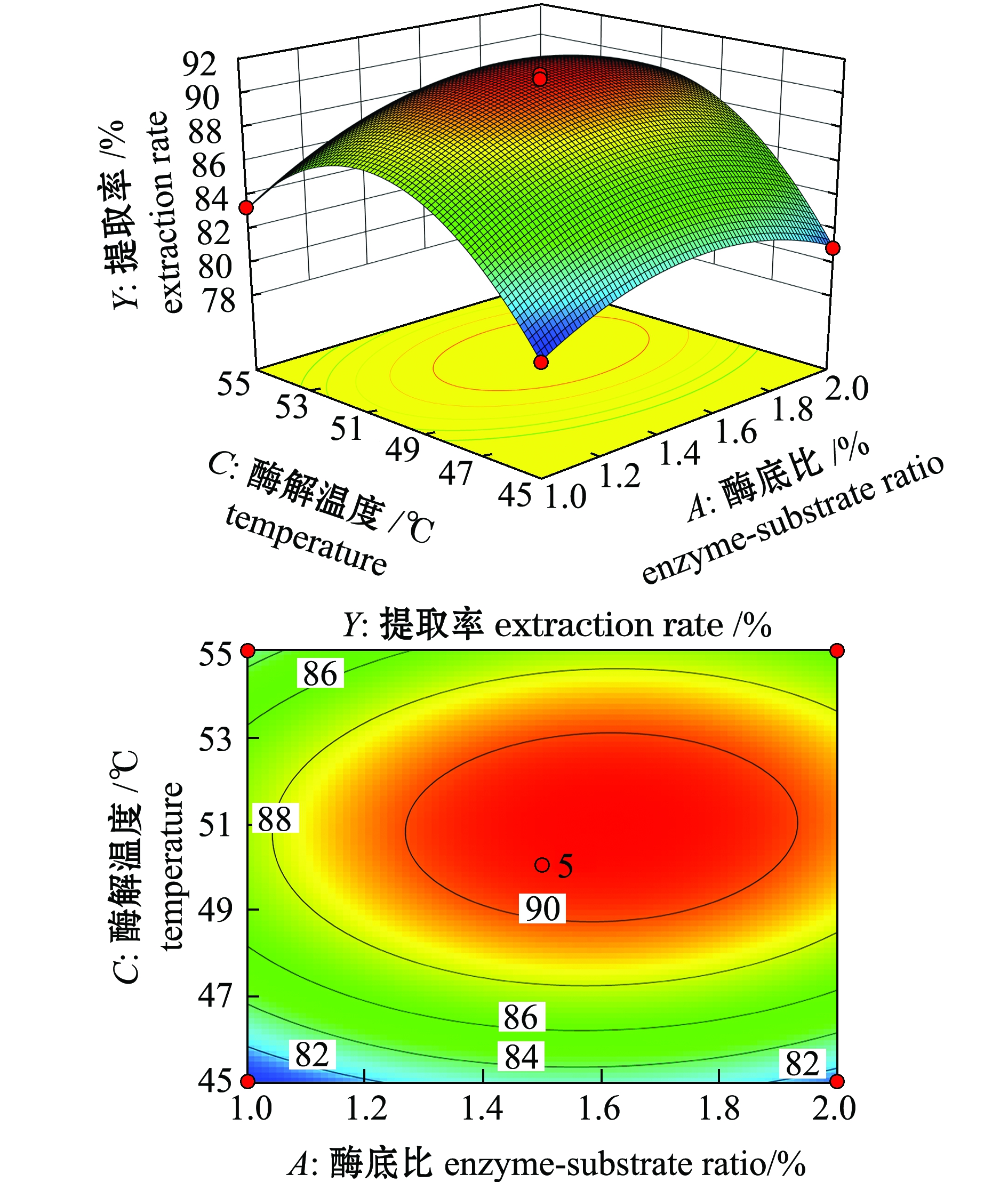
图8 酶底比与酶解温度交互作用对虾青素提取率影响的响应面与等高线图
Fig.8 Response surface and contour plots of the interactive effect of enzyme-substrate ratio and enzymolysis temperature on the extraction rate of astaxanthin
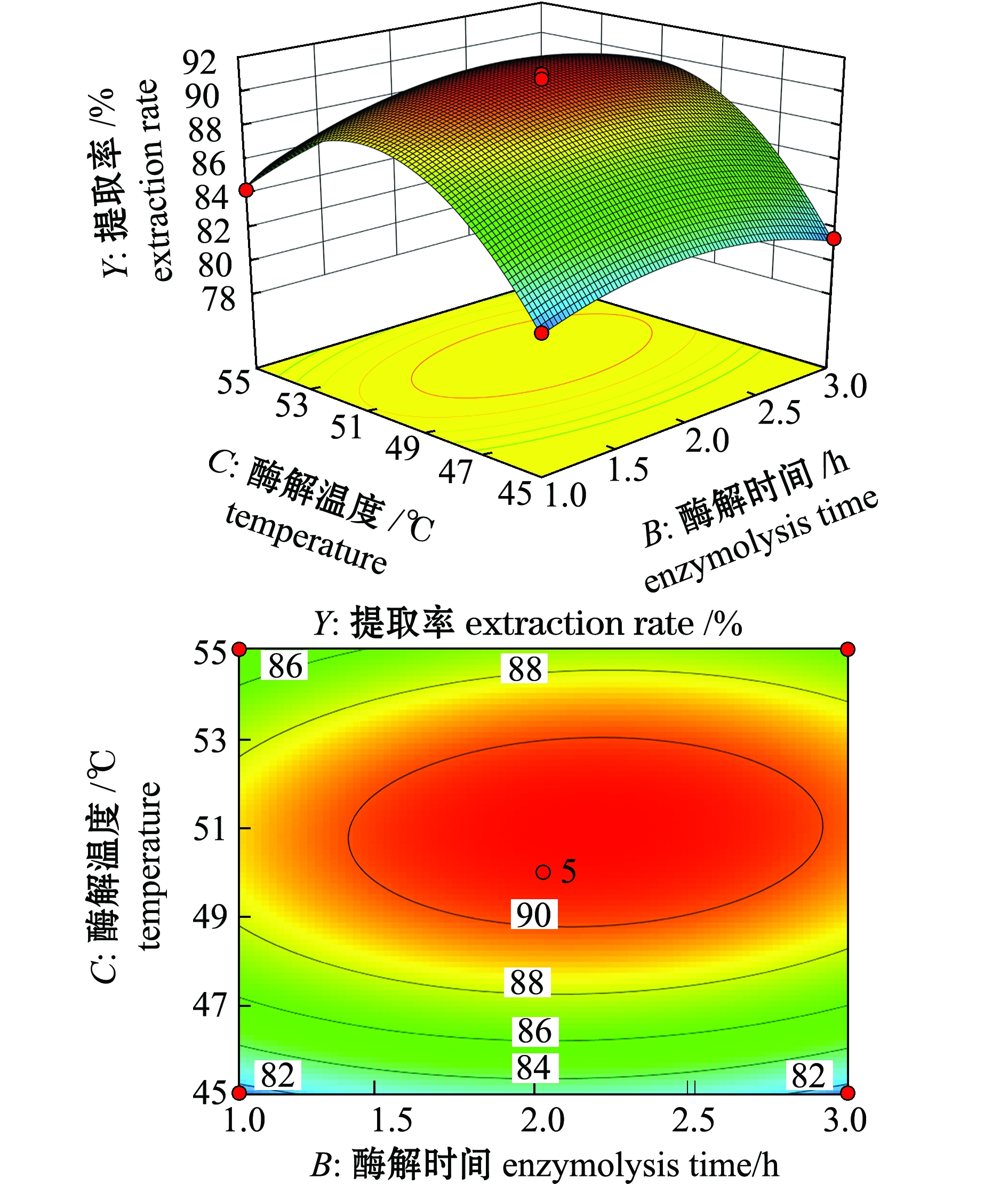
图9 酶解时间与酶解温度交互作用对虾青素提取率影响的响应面与等高线图
Fig.9 Response surface and contour plots of the interactive effect of enzymolysis time and temperature on the extraction rate of astaxanthin
表4 响应面二次模型方差分析
Tab.4 ANOVA for response surface quadratic model
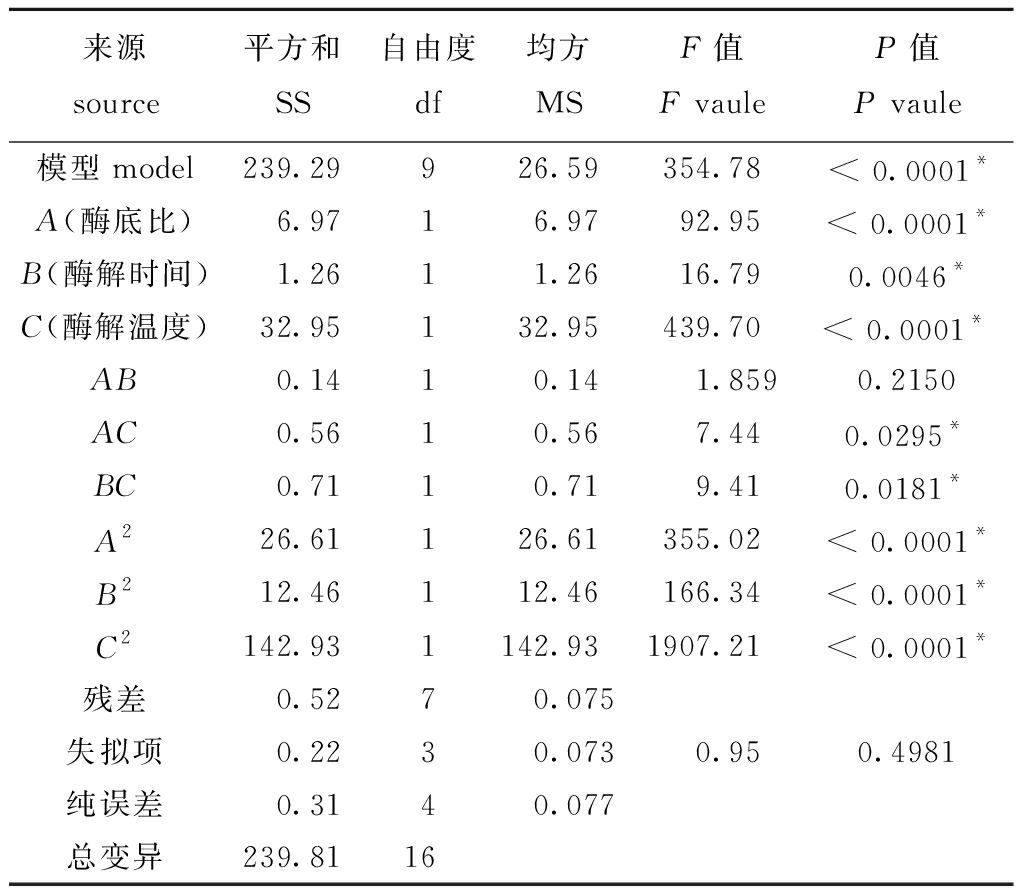
来源source平方和SS自由度df均方MSF值F vauleP值P vaule模型model239.29926.59354.78< 0.0001*A(酶底比)6.9716.9792.95< 0.0001*B(酶解时间)1.2611.2616.790.0046*C(酶解温度)32.95132.95439.70< 0.0001*AB0.1410.141.8590.2150AC0.5610.567.440.0295*BC0.7110.719.410.0181*A226.61126.61355.02< 0.0001*B212.46112.46166.34< 0.0001*C2142.931142.931907.21< 0.0001*残差0.5270.075失拟项0.2230.0730.950.4981纯误差0.3140.077总变异239.8116
注:*表示有显著性影响(P<0.05),**表示有极显著影响(P<0.01)
Note: *means significant effect(P<0.05),** means very significant effect(P<0.01)
2.3.3 验证性试验 为验证该模型对虾青素最大粗提取率的预测是否准确,结合实际操作情况,将最佳工艺条件修正为酶底比为1.6%、酶解时间为2.1 h、酶解温度为51 ℃、水料比(mL∶g)为4∶1、料液比(g∶mL)为1∶4、振荡时间为10 min,在此条件下进行3次重复试验,虾青素提取率平均为90.42%±0.39%,与理论值相对误差约为0.79%,说明模型是准确有效的。与宋素梅[27]对酶解后的虾壳残渣和沉淀分别提取虾青素的研究相比,本研究中虾青素提取率与宋素梅分别采用丙酮提取酶解后的虾壳残渣(15.6%)与乙醇提取酶解后的沉淀(73.7%)之和相当,但是大大简化了提取工艺,缩短了酶解时间和提取时间,一定程度上提高了提取效率,并且通过对Alcalase碱性蛋白酶、木瓜蛋白酶两者复配,酶解温度也得到了下降,有利于保证虾青素不被热降解并节约能源;与翁婷等[30]采用超临界CO2萃取法提取南极磷虾中虾青素的研究中虾青素提取率(84.4%)相比,本研究中最终提取率略高,但同时相比于超临界CO2萃取技术,酶解法提取产物的纯度可能会略低,因此,本研究中所得产物为虾青素粗提物,还需对其进行进一步的分离纯化研究。
3 结论
本研究中通过采用复合酶酶解的方法,将Alcalase碱性蛋白酶与木瓜蛋白酶进行复配,对南极磷虾进行酶解处理后,有效提高了南极磷虾虾青素的提取效率。以虾青素提取率为指标,通过单因素试验和Box-Behnken响应面优化试验确定复合酶法提取虾青素的最佳工艺条件为酶底比为1.6%、酶解时间为2.1 h、酶解温度为51 ℃、水料比(mL∶g)为4∶1、料液比(g∶mL)为1∶4、振荡时间为10 min,在此条件下虾青素提取率为90.42%±0.39%,与预测值接近,说明响应面法对复合酶酶解南极磷虾提取虾青素工艺条件的优化是可行的。