泥鳅Misgurnus anguillicaudatus在中国分布广泛,其肉质鲜美,营养丰富,是一种小型经济淡水鱼类。据报道,中国泥鳅存在二倍体(2n=50)、三倍体(3n=75)、四倍体(4n=100)和六倍体(6n=150)[1-2]。多倍体鱼类与二倍体鱼类相比,具有生长迅速、产量高、抗病力强等优势。在三倍体泥鳅的相关研究中,有通过冷休克、热休克和静水压等方法人工诱导成功的先例[3],而本实验室通过二倍体与四倍体泥鳅杂交的方法成功获得杂交三倍体泥鳅[4],并对杂交三倍体泥鳅的染色体组稳定性进行了一系列研究[5-8],结果表明,二倍体泥鳅(2n)与天然四倍体泥鳅(4n)正、反杂交后代均出现大量能存活的非整三倍体个体,并随养殖时间的延长,非整三倍体率呈下降趋势。关于杂交三倍体泥鳅与二倍体泥鳅杂交后代胚胎染色体组构成的研究国内外尚无报道,本研究中以杂交三倍体泥鳅(3n)与二倍体泥鳅(2n)为研究对象,配制不同杂交组合(3n♀×2n♂、2n♀×3n♂),对其后代的胚胎染色体进行银染(Ag-NORs)、CMA3/DA/DAPI三重荧光染色、荧光原位杂交(Fluorescence in situ hybridization,FISH)等研究,旨在为杂交三倍体泥鳅配子染色体组构成及杂交三倍体泥鳅的育性提供细胞遗传学证据,也为三倍体鱼类产业化探索高效、易行的新途径。
1 材料与方法
1.1 材料
试验用性腺发育良好的杂交三倍体(3n=75)泥鳅雌、雄各2尾,体长为10.90~14.20 cm,体质量为10.00~22.19 g;二倍体(2n=50)泥鳅雌、雄各2尾,体长为10.80~16.60 cm,体质量为8.54~15.50 g。
1.2 方法
1.2.1 人工催产及授精 采用杂交三倍体泥鳅
(2n♀×4n♂)2尾(雌、雄各1尾)与二倍体泥鳅2尾(雌、雄各1尾)进行1∶1杂交,人工进行催产,干法受精,配制2n♀×3n♂、3n♀×2n♂杂交组合。
1.2.2 染色体标本的制备 待受精卵发育至眼泡期后期时即可剥掉卵膜、去掉卵黄,用0.002 5%的秋水仙素处理45 min后,再用0.8%的柠檬酸钠低渗 20 min;将低渗液吸出,加入-20 ℃下预冷的卡诺固定液(甲醇∶冰醋酸=3∶1)3次,每次处理15 min,之后再换入新的卡诺固定液,冷冻过夜(>12 h);冷滴片,镜检。
1.2.3 银染(Ag-NORs) 采用Howell等[9]提出的银染法,在加热器(65 ℃)中预热染色体标本,将硝酸银溶液和明胶溶液以2∶1的比例混合后滴到染色体标本上,盖上盖玻片;在加热器(65 ℃)中处理2~3 min,当染色体标本呈金黄色时取出冲洗,风干封片,在显微镜下观测并拍照。
1.2.4 CMA3/DA/DAPI三重荧光染色 采用Schweizer等[10-11]报道的方法,用0.5 mg/mL Chromomycin A3(CMA3)染色60 min, 0.1 mg/mL Distamycin A(DA)和0.5 μg/mL 4, 6-diamidino-2-phenylindole(DAPI)分别染色 15 min。每次染色后均用MacIlvaine buffer(MI,pH=7.0)缓冲液漂洗2次,染色完成后用1∶1的甘油和MI缓冲液的混合溶液封片,镜检并拍照。
1.2.5 染色体荧光原位杂交(FISH) 以人的5.8S +28S rDNA为探针,采用生物素(Biotin-16-dUTP)进行标记。标记后的探针用100%酒精进行纯化,并加入杂交缓冲液中,80 ℃下处理10 min,迅速移到冰水中;将提前制备的并已经干燥3 h的染色体标本浸入到70 ℃的70%甲酰胺/2×SSC变性液中变性2 min,分别用-20 ℃预冷的70%酒精、100%酒精脱水,空气中干燥;将50 μL变性探针-杂交溶液混合液滴加在染色体标本上,盖好封口膜,置于2×SSC湿盒中于37 ℃下杂交18 h以上;将染色体标本在洗脱液中洗脱,进行杂交信号检测和放大,复染并封片,用Leica DM2000荧光显微镜观察并拍照。
1.2.6 染色体核型分析 染色体分类参照Levan等[12]提出的分类依据。用Adobe Photoshop 7.0 CS2软件分析上述试验中染色体均匀分散且形态清晰完整的中期分裂相照片。测量每条染色体长臂长、短臂长,并计算出臂比和相对长度。定义长臂长与短臂长的比值为臂比;某一条染色体全长占单倍染色体组的染色体总长度的百分比为该染色体的相对长度。按臂比将染色体分为4组:臂比为1.0~1.7时,为中部着丝粒染色体(m);臂比为1.7~3.0时,为亚中部着丝粒染色体(sm);臂比为3.0~7.0时,为亚端部着丝粒染色体(st);臂比大于7.0时,为端部着丝粒染色体(t)。
2 结果与分析
2.1 Ag-NORs
二倍体与三倍体泥鳅正反交后代染色体中期分裂相Ag-NORs均较明显,最高银染点数均为3个(图1-A、C)。通过核型分析可知,2n♀×3n♂及3n♀×2n♂杂交后代染色体中期分裂相Ag-NORs均位于中部着丝粒染色体(M1)的端部区域(图1-B、D)。
2.2 CMA3/DA/DAPI
二倍体与三倍体泥鳅正反交后代染色体中期分裂相都显示有明亮的 CMA3阳性部位,如图2-A、C白色箭头所示。经核型分析可知,两种杂交后代染色体中期分裂相CMA3阳性位点均位于中部着丝粒染色体(M1)的端部区域(图2-B、D),该区域即核仁组织区,与Ag-NORs结果一致,位置相同。
2.3 FISH
利用人的5.8S+28S rDNA为探针,对2n与3n泥鳅正反交后代染色体进行FISH定位。图3中黄绿色区域即为5.8S+28S rDNA杂交信号,二者染色体中期分裂相均出现3个杂交信号位点(图3-A、C)。根据核型分析,2n♀×3n♂、3n♀×2n♂后代染色体分裂相的杂交信号均位于第一对中部着丝粒染色体的端部(图3-B、D),与上述银染、CMA3结果一致,位置相同。
3 讨论
3.1 银染
NORs的分布、形态特征和数目可作为研究生物物种间染色体进化和亲缘关系的一个指标[13]。银染法是指核仁组织区(NORs)的酸性蛋白成分被硝酸银特异地染成黑色的方法。NORs表现出具有转录活性或潜在转录活性,其如果失活将染不上色。细胞中核仁数目与染色体倍性一致,含1个核仁为单倍体细胞,含2、3、4个核仁分别为二、三、四倍体细胞。与其他倍性检测方法相比,银染法快速准确、操作简单,无须特殊仪器设备,是一种值得推广的多倍体鱼类倍性鉴定方法。本研究结果表明,无论2n♀×3n♂还是3n♀×2n♂杂交后代中,染色体中期分裂相Ag-NORs均较为明显,最高银染点数均为3个。经核型分析可知,2n♀×3n♂及3n♀×2n♂后代染色体中期分裂相Ag-NORs均位于中部着丝粒染色体(M1)的端部区域。
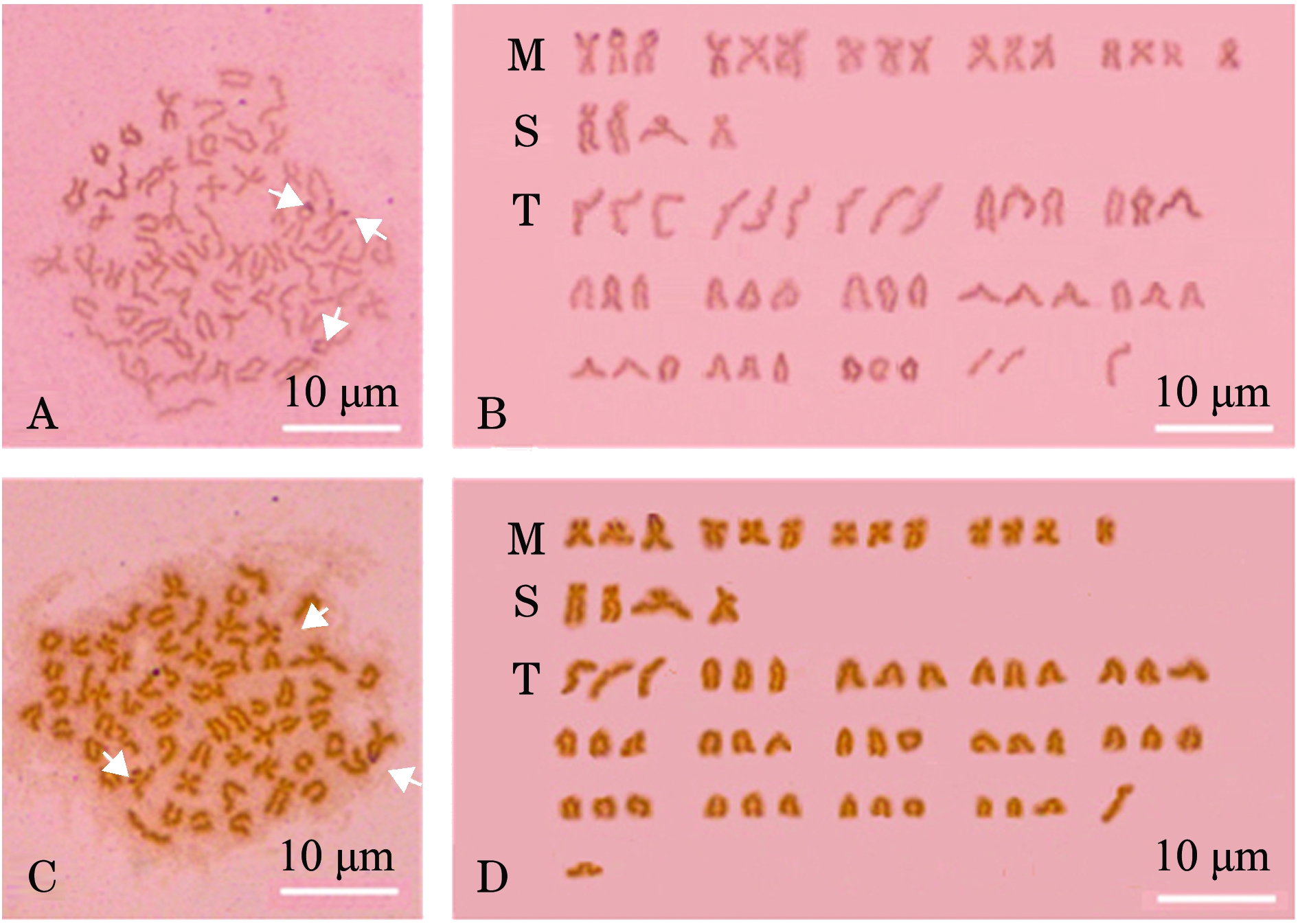
注:A、B为 2n♀×3n♂; C、D为3n♀×2n♂
Note: A,B,2n♀×3n♂; C,D, 3n♀×2n♂
图1 2n♀×3n♂及3n♀×2n♂后代胚胎染色体分裂相Ag-NORs及核型
Fig.1 Ag-NORs and karyotypes in chromosomes of embryos from 2n♀×3n♂ and 3n♀×2n♂ loach

注:A、B为 2n♀×3n♂;C、D为 3n♀×2n♂
Note: A,B, 2n♀×3n♂; C,D, 3n♀×2n♂
图2 2n♀×3n♂及3n♀×2n♂后代胚胎染色体分裂相的CMA3/DA/DAPI三重荧光染色及核型
Fig.2 CMA3/DA/DAPI staining and karyotypes in chromosomes of embryos from 2n♀×3n♂ and 3n♀×2n♂ loach
3.2 CMA3荧光显带
CMA3(Chromomycin A3)是只染GC 碱基的荧光染料,鱼类染色体的NORs被特异地显示。该方法与银染法不同,CMA3是染 NORs 处的rDNA,而不是酸性蛋白成分,因此,NORs 失活与否,CMA3均可染色,该方法可用于研究NORs 的多态性及活性,鉴定NORs数目。DAPI是双链DNA特异的染料,在重复顺序含量高的异染色质区域,也就是富含AT碱基对的区域,DAPI与DNA双链的小沟结合,表现出荧光;而在富有GC 碱基对的区域,DAPI则插入双链的碱基之间,产生的荧光较弱或不发荧光。本研究结果表明,无论2n♀×3n♂还是3n♀×2n♂杂交后代中,染色体中期分裂相均显示有明亮的 CMA3阳性部位。经核型分析可知,2n♀×3n♂及3n♀×2n♂后代染色体中期分裂相CMA3阳性位点位于第一对中部着丝粒染色体(M1)的端部区域,与Ag-NORs位置相同,为核仁组织区(NORs)。
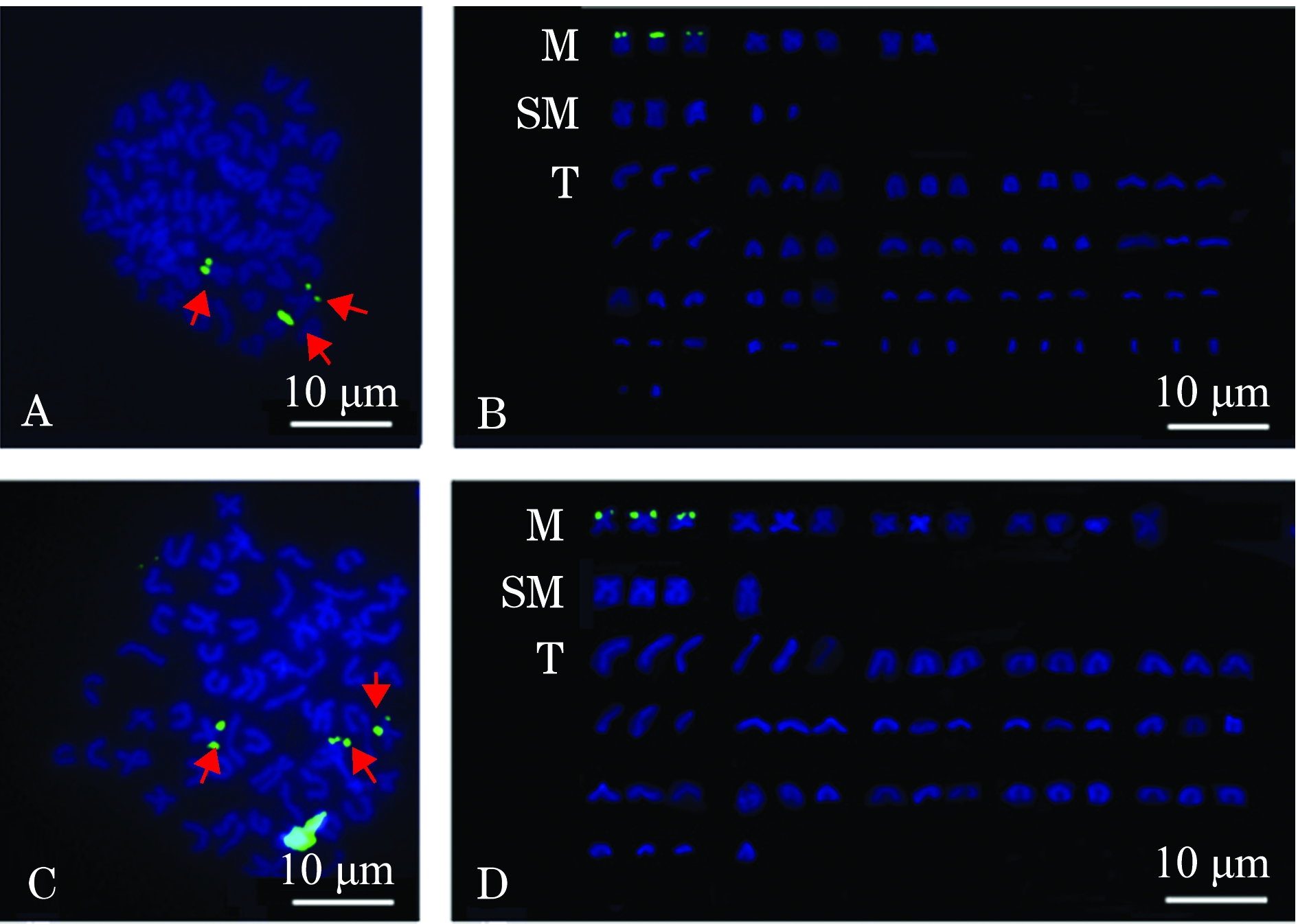
注:A、B为 2n♀×3n♂; C、D为3n♀×2n♂
Note: A,B, 2n♀×3n♂; C,D, 3n♀×2n♂
图3 5.8S+28S rDNA在2n♀×3n♂、3n♀×2n♂中期分裂相的荧光原位杂交结果
Fig.3 Results of fluorescence of 5.8S+28S rDNA in metaphase situ hybridization of 2n♀×3n♂and 3n♀×2n♂
3.3 核糖体rDNA序列的染色体定位(FISH)
FISH是指通过杂交和荧光显微镜进行特定DNA序列检测的技术。其原理是利用荧光标记的核酸片段为探针,与中期细胞的染色体或间期细胞核的DNA进行分子杂交,再用抗体与探针分子特异结合,经荧光显微镜对杂交信号即与探针同源的DNA片段在染色体上或核中定位等进行各种分析。可在染色体、细胞核组织切片标本上进行DNA杂交,用以检测细胞内特定序列DNA或RNA的存在。在鱼类基因定位中,FISH技术的应用主要集中在rDNA的定位上。例如,Li等 [14]利用FISH技术研究了二倍体和四倍体泥鳅的倍性,得到的结果与通过银染和CMA3染色得到的NORs 位点相吻合。本研究中利用FISH技术对2n♀×3n♂和3n♀×2n♂杂交后代染色体rDNA序列进行定位分析,结果显示,在2n♀×3n♂和3n♀×2n♂杂交后代胚胎染色体上同时发现3个主要的荧光信号,清晰定位于第一对中部着丝粒染色体(M1)的端部区域。
综上所述,通过银染、CMA3DA/DAPI三重荧光染色、FISH定位在2n♀×3n♂和3n♀×2n♂后代中得到的 NORs 位点相吻合,位点数目最多为 3个。该结果表明,杂交三倍体泥鳅无论雌雄与二倍体泥鳅杂交所产生的后代染色体组构成均为3套染色体组,进而可推测杂交三倍体泥鳅无论雌雄均可产生(1.5~2)n配子,本研究结果为杂交三倍体泥鳅配子染色体组成提供了细胞遗传学证据。